Furadantin 100mg Nitrofurantoin Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Furadantin 100 mg a jak se používá?
Furadantin (nitrofurantoinová perorální suspenze) je antibiotikum používané k léčbě infekcí močových cest. Furadantin je dostupný v generické formě.
Jaké jsou vedlejší účinky Furadantinu?
Mezi běžné vedlejší účinky přípravku Furadantin patří:
- nevolnost,
- zvracení,
- ztráta chuti k jídlu,
- žaludeční nevolnost,
- průjem,
- bolest hlavy,
- závrať,
- ospalost,
- rezavě zbarvená nebo nahnědlá moč, popř
- vaginální svědění nebo výtok.
Informujte svého lékaře, pokud máte vzácné, ale velmi závažné nežádoucí účinky přípravku Furadantin, včetně:
- bolest očí,
- změny vidění,
- mentální/náladové změny,
- trvalé nebo silné bolesti hlavy,
- nové známky infekce (např. horečka, přetrvávající bolest v krku), popř
- snadná tvorba modřin nebo krvácení.
POPIS
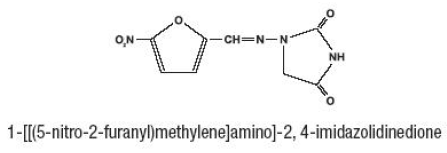
Furadantin (nitrofurantoin), syntetická chemikálie, je stabilní žlutá krystalická sloučenina. Furadantin je antibakteriální látka pro specifické infekce močových cest. Furadantin je dostupný v kapalné suspenzi 25 mg/5 ml pro perorální podání.
Neaktivní ingredience
Furadantin perorální suspenze obsahuje sodnou sůl karboxymethylcelulózy, kyselinu citrónovou, příchutě, glycerin, křemičitan hořečnato-hlinitý, methylparaben, propylparaben, čištěnou vodu, citrát sodný a sorbitol.
INDIKACE
Furadantin je specificky indikován k léčbě infekcí močových cest způsobených citlivými kmeny Escherichia coli, enterokoky, Staphylococcus aureus a určitými citlivými kmeny druhů Klebsiella a Enterobacter.
Nitrofurantoin není indikován k léčbě pyelonefritidy nebo perinefrických abscesů.
Nitrofurantoiny postrádají širší tkáňovou distribuci jiných terapeutických látek schválených pro infekce močových cest. V důsledku toho mnoho pacientů, kteří jsou léčeni Furadantin mají predispozici k přetrvávání nebo opětovnému výskytu bakteriurie. Vzorky moči pro kultivaci a testování citlivosti by měly být odebrány před a po dokončení terapie. Pokud dojde k přetrvávání nebo opětovnému objevení bakteriurie po léčbě s Furadantin měla by být vybrána jiná terapeutická činidla s širší distribucí v tkáních. Při zvažování použití Furadantin nižší míra eradikace by měla být vyvážena zvýšeným potenciálem pro systémovou toxicitu a pro rozvoj antimikrobiální rezistence, pokud se používají látky s širší distribucí v tkáních.
DÁVKOVÁNÍ A PODÁVÁNÍ
Furadantin by měl být podáván s jídlem, aby se zlepšila absorpce léku a u některých pacientů i tolerance.
Dospělí
50-100 mg čtyřikrát denně – nižší dávka se doporučuje pro nekomplikované infekce močových cest.
Pediatričtí pacienti
5-7 mg/kg tělesné hmotnosti za 24 hodin, podávaných ve čtyřech dílčích dávkách (kontraindikováno do jednoho měsíce věku).
Následující tabulka je založena na průměrné hmotnosti v každém rozmezí při příjmu 5 až 6 mg/kg tělesné hmotnosti za 24 hodin, podávaných ve čtyřech dílčích dávkách. Lze jej použít k výpočtu průměrné dávky Furadantin Perorální suspenze (25 mg/5 ml) pro pediatrické pacienty.
Léčba by měla pokračovat po dobu jednoho týdne nebo alespoň 3 dnů po dosažení sterility moči. Pokračující infekce naznačuje potřebu přehodnocení.
Pro dlouhodobou supresivní terapii u dospělých může být adekvátní snížení dávky na 50-100 mg před spaním. Pro dlouhodobou supresivní terapii u pediatrických pacientů mohou být adekvátní dávky již od 1 mg/kg za 24 hodin, podávané v jedné dávce nebo ve dvou dílčích dávkách. VIDĚT ČÁST VAROVÁNÍ TÝKAJÍCÍ SE RIZIK SPOJENÝCH S DLOUHODOBOU TERAPII .
JAK DODÁVÁNO
Furadantin Perorální suspenze je k dispozici v:
NDC 70199-006-32 PET jantarová láhev o objemu 230 ml
Vyvarujte se vystavení silnému světlu, které může lék ztmavit. Je stabilní při skladování mezi 20°-25°C (68°-77°F); povolené odchylky do 15°-30°C (59°-86°F) [Viz USP řízená pokojová teplota ]. Chraňte před mrazem. Důrazně protřepejte. Dávkujte v těsných, světlu odolných, plastových (PET) nebo skleněných nádobách.
Spotřebujte do 30 dnů.
Uchovávejte mimo dosah dětí.
Vyrobeno pro: Casper Pharma LLC, East Brunswick NJ 08816. Revize: prosinec 2020
VEDLEJŠÍ EFEKTY
Respirační
MŮŽE DOJÍT K CHRONICKÉ, SUBAKUTNÍ NEBO AKUTNÍ PLICNÍ REAKCI PŘECENITIVNOSTI.
CHRONICKÉ PLICNÍ REAKCE SE MOHOU OBECNĚ VYSKYTOVAT U PACIENTŮ, KTEŘÍ BYLI NEPŘETRŽITĚ LÉČENÍ PO ŠEST MĚSÍCŮ NEBO DÉLE. NEMOC, dušnost při námaze, KAŠEL A ZMĚNĚNÉ FUNKCE PLIC JSOU ČASTÉ PROJEVY, KTERÉ SE MOHOU PROJÍT ZÁKLADNĚ. RADIOLOGICKÉ A HISTOLOGICKÉ NÁLEZY DIFUZNÍ INTERSTICIÁLNÍ PNEUMONITIDY ČI FIBRÓZY, NEBO OBOU, JSOU TAKÉ BEŽNÝMI PROJEVY CHRONICKÉ PLICNÍ REAKCE. HOŘEČKA JE ZŘÍDKA VÝZNAMNÁ.
ZÁVAŽNOST CHRONICKÝCH PLICNÍCH REAKCÍ A STUPNĚ JEJICH ŘEŠENÍ SE ZDÁ SOUVISÍ S DÉLEM TERAPIE PO OBJEVU PRVNÍCH KLINICKÝCH PŘÍZNAKŮ. PLICNÍ FUNKCE MŮŽE BÝT TRVALO POŠKOZENA I PO UKONČENÍ TERAPIE. RIZIKO JE VĚTŠÍ, KDYŽ NEJSOU CHRONICKÉ PLICNÍ REAKCE ROZPOZNÁNY ČASNĚ.
U subakutních plicních reakcí se horečka a eozinofilie vyskytují méně často než u akutní formy. Po ukončení léčby může zotavení vyžadovat několik měsíců. Pokud nejsou příznaky rozpoznány jako související s drogou a léčba nitrofurantoinem není ukončena, příznaky se mohou zhoršit.
Akutní plicní reakce se běžně projevují horečkou, zimnicí, kašlem, bolestí na hrudi, dušností, plicní infiltrací s konsolidací pleurálního výpotku na rentgenovém snímku a eozinofilií.
Akutní reakce se obvykle objevují během prvního týdne léčby a jsou reverzibilní po ukončení léčby. Rozlišení je často dramatické. (vidět VAROVÁNÍ )
souvislosti s plicními reakcemi byly hlášeny změny na EKG (např. nespecifické změny ST/T vlny, blokáda raménka).
Cyanóza byla hlášena vzácně.
Jaterní
Jaterní reakce, včetně hepatitidy, cholestatické žloutenky, chronické aktivní hepatitidy a jaterní neurózy, se vyskytují vzácně. (vidět VAROVÁNÍ )
Neurologické
Vyskytla se periferní neuropatie, která se může stát závažnou nebo ireverzibilní. Byly hlášeny oběti na životech. Stavy, jako je poškození ledvin (clearance kreatininu pod 60 ml za minutu nebo klinicky významné zvýšení sérového kreatininu), anémie, diabetes mellitus, nerovnováha elektrolytů, nedostatek vitaminu B a vysilující onemocnění mohou zvýšit možnost periferní neuropatie (viz VAROVÁNÍ )
Při užívání nitrofurantoinu byly také hlášeny astenie, vertigo, nystagmus, závratě, bolesti hlavy a ospalost.
Vzácně byly hlášeny benigní intrakraniální hypertenze (pseudotumor cerebri), zmatenost, deprese, oční neuritida a psychotické reakce. Vzácně byly hlášeny vypouklé fontanely jako známka benigní intrakraniální hypertenze u kojenců.
Dermatologické
Exfoliativní dermatitida a erythema multiforme (včetně Stevens-Johnsonova syndromu) byly hlášeny vzácně. Byla hlášena také přechodná alopecie.
Alergický
Byl hlášen syndrom podobný lupusu spojený s plicními reakcemi na nitrofurantoin. Také angioedém; makulopapulární, erytematózní nebo ekzematózní erupce; pruritus; kopřivka; anafylaxe; artralgie; myalgie; drogová horečka; a vaskulitida (někdy spojená s plicními reakcemi). Reakce přecitlivělosti představují nejčastější spontánně hlášené nežádoucí účinky v celosvětovém postmarketingovém sledování s nitrofurantoinovými přípravky.
Gastrointestinální
Nejčastěji se objevuje nauzea, zvracení a anorexie. Bolest břicha a průjem jsou méně časté gastrointestinální reakce. Tyto reakce související s dávkou lze minimalizovat snížením dávky. Byla hlášena sialadenitida a pankreatitida. Sporadicky byly hlášeny případy pseudomembranózní kolitidy při užívání nitrofurantoinu. K nástupu symptomů pseudomembranózní kolitidy může dojít během nebo po antimikrobiální léčbě. (vidět VAROVÁNÍ )
Hematologické
Cyanóza sekundární k methemoglobinémii byla hlášena vzácně.
Smíšený
Stejně jako u jiných antimikrobiálních látek se mohou objevit superinfekce způsobené rezistentními organismy, např. druhy Pseudomonas nebo druhy Candida. Sporadicky jsou hlášeny superinfekce Clostridium difficile nebo pseudomembranózní kolitida při použití nitrofurantoinu.
Laboratorní nežádoucí příhody
Při použití nitrofurantoinu byly hlášeny následující laboratorní nežádoucí účinky; zvýšená AST (SGOT), zvýšená ALT (SGPT), snížený hemoglobin, zvýšený sérový fosfor, eozinofilie, anémie z nedostatku glukózo-6-fosfátdehydrogenázy (viz VAROVÁNÍ ), agranulocytóza, leukopenie, granulocytopenie, hemolytická anémie, trombocytopenie, megaloblastická anémie. Ve většině případů tyto hematologické abnormality vymizely po ukončení léčby. Aplastická anémie byla hlášena vzácně.
Chcete-li nahlásit PODEZŘENÍ NA NEŽÁDOUCÍ ÚČINKY, kontaktujte společnost Casper Pharma LLC. na 1-844- 5-CASPER (1-844-522-7737) nebo FDA na 1-800-FDA-1088 nebo www.fda.gov/medwatch.
DROGOVÉ INTERAKCE
Antacida obsahující trisilikát hořečnatý, pokud jsou podávána současně s nitrofurantoinem, snižují rychlost i rozsah absorpce. Mechanismem této interakce je pravděpodobně adsorpce nitrofurantoinu na povrch křemičitanu hořečnatého.
Uricosurické léky, jako je probenecid a sulfinpyrazon, mohou inhibovat renální tubulární sekreci nitrofurantoinu. Výsledné zvýšení hladin nitrofurantoinu v séru může zvýšit toxicitu a snížené hladiny v moči by mohly snížit jeho účinnost jako antibakteriálního prostředku na močové cesty.
Interakce drog/laboratorních testů
V důsledku přítomnosti nitrofurantoinu se může objevit falešně pozitivní reakce na glukózu v moči. To bylo pozorováno u roztoků Benedicta a Fehlinga, ale ne u glukózového enzymatického testu.
VAROVÁNÍ
Plicní reakce
U PACIENTŮ LÉČENÝCH NITROFURANTOINEM BYLY POZOROVANÉ AKUTNÍ, SUBAKUTNÍ NEBO CHRONICKÉ PLICNÍ REAKCE. V PŘÍPADĚ TĚCHTO REAKCÍ BY MĚLO BÝT FURADANTIN 100 mg UKONČENO A PŘIJAT VHODNÁ OPATŘENÍ. ZPRÁVY UVÁDÍ PLICNÍ REAKCE JAKO PŘISPĚVOU PŘÍČINU SMRTI.
CHRONICKÉ PLICNÍ REAKCE (DIFUZNÍ INTERSTICIÁLNÍ PNEUMONITIDA NEBO PLICNÍ FIBRÓZA, NEBO OBĚ) SE MOHOU ROZVOJIT ZÁKLUZNĚ. K TĚMTO REAKCÍM SE U PACIENTŮ, KTERÉ JSOU LÉČBA PO ŠEST MĚSÍCŮ NEBO DÉLE, VZNIKAJÍ ZŘÍDKA A OBECNĚ. BLÍZKÉ SLEDOVÁNÍ PLICNÍHO STAVU PACIENTŮ, KTERÉ PODÁVAJÍ DLOUHODOBOU LÉČBU, JE ZARUČENO A VYŽADUJE ZVÁŽENÍ PŘÍNOSŮ TERAPIE NAD POTENCIÁLNÍMI RIZIKAMI. (viz DÝCHACÍ REAKCE.)
Hepatotoxicita
Jaterní reakce, včetně hepatitidy, cholestatické žloutenky, chronické aktivní hepatitidy a jaterní nekrózy, se vyskytují vzácně. Byly hlášeny oběti na životech. Nástup chronické aktivní hepatitidy může být záludný a pacienti by měli být pravidelně sledováni kvůli změnám v biochemických testech, které by naznačovaly poškození jater. Pokud se objeví hepatitida, lék by měl být okamžitě vysazen a měla by být přijata vhodná opatření.
Neuropatie
Vyskytla se periferní neuropatie, která se může stát závažnou nebo ireverzibilní. Byly hlášeny oběti na životech. Stavy, jako je poškození ledvin (clearance kreatininu pod 60 ml za minutu nebo klinicky významné zvýšení sérového kreatininu), anémie, diabetes mellitus, nerovnováha elektrolytů, nedostatek vitaminu B a vysilující onemocnění mohou zvýšit výskyt periferní neuropatie. Pacienti, kteří dostávají dlouhodobou léčbu, by měli být pravidelně sledováni kvůli změnám funkce ledvin.
V postmarketingových zkušenostech s nitrofurantoinovými přípravky byla vzácně hlášena optická neuritida.
Hemolytická anémie
Případy hemolytické anémie typu citlivého na primachiny byly vyvolány nitrofurantoinem. Zdá se, že hemolýza souvisí s nedostatkem glukózo-6-fosfátdehydrogenázy v červených krvinkách postižených pacientů. Tento nedostatek se vyskytuje u 10 procent černochů a malého procenta etnických skupin středomořského a blízkovýchodního původu. Hemolýza je indikací k přerušení Furadantin hemolýza ustává po vysazení léku.
Průjem spojený s Clostridium Difficile
Průjem spojený s Clostridium difficile (CDAD) byl hlášen při použití téměř všech antibakteriálních látek, včetně Furadantin Perorální suspenze a může se pohybovat v rozsahu závažnosti od mírného průjmu až po fatální kolitidu. Léčba antibakteriálními látkami mění normální flóru tlustého střeva, což vede k přemnožení C. difficile.
C. difficile produkuje toxiny A a B, které přispívají k rozvoji CDAD. Kmeny C. difficile produkující hypertoxin způsobují zvýšenou morbiditu a mortalitu, protože tyto infekce mohou být odolné vůči antimikrobiální léčbě a mohou vyžadovat kolektomii. CDAD je třeba vzít v úvahu u všech pacientů, kteří mají průjem po užívání antibiotik. Je nutná pečlivá anamnéza, protože CDAD se objevilo více než dva měsíce po podání antibakteriálních látek.
Pokud je podezření na CDAD nebo je potvrzeno, může být nutné přerušit pokračující užívání antibiotik, která nejsou zaměřena proti C. difficile. Podle klinické indikace by měla být zahájena vhodná léčba tekutin a elektrolytů, suplementace proteinů, antibiotická léčba C. difficile a chirurgické vyšetření.
OPATŘENÍ
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Nitrofurantoin nebyl karcinogenní, když byl podáván samicím potkanů Holtzman po dobu 44,5 týdne nebo samicím potkanů Sprague-Dawley po dobu 75 týdnů. Dva chronické biologické testy na hlodavcích za použití samců a samic potkanů Sprague-Dawley a dva chronické biologické testy na myších Swiss a na myších BDF1 neodhalily žádné důkazy karcinogenity.
Nitrofurantoin představoval důkaz karcinogenní aktivity u samic myší B6C3F1, jak bylo prokázáno zvýšeným výskytem tubulárních adenomů, benigních smíšených nádorů a nádorů z granulózních buněk vaječníků. U samců potkanů F344/N byl zvýšený výskyt méně častých novotvarů tubulárních buněk ledvin, kostních osteosarkomů a novotvarů podkožní tkáně. V jedné studii zahrnující subkutánní podávání 75 mg/kg nitrofurantoinu březím samicím myší byly u generace F1 pozorovány plicní papilární adenomy neznámého významu.
Bylo prokázáno, že nitrofurantoin vyvolává bodové mutace u určitých kmenů Salmonella typhimurium a přímé mutace na buňkách myšího lymfomu L5178Y. Nitrofurantoin vyvolal zvýšený počet sesterských chromatidových výměn a chromozomálních aberací v buňkách vaječníků čínského křečka, ale ne v lidských buňkách v kultuře. Výsledky pohlavně vázaného recesivního letálního testu u Drosophila byly negativní po podání nitrofurantoinu krmením nebo injekcí. Nitrofurantoin neindukoval dědičnou mutaci ve zkoumaných modelech hlodavců.
Význam nálezů karcinogenity a mutagenity ve vztahu k terapeutickému použití nitrofurantoinu u lidí není znám.
Podávání vysokých dávek nitrofurantoinu potkanům způsobuje dočasné zastavení spermatogeneze; toto je reverzibilní po vysazení léku. Dávky 10 mg/kg/den nebo vyšší u zdravých mužů mohou v určitých nepředvídatelných případech způsobit mírnou až středně závažnou zástavu spermatogeneze se snížením počtu spermií.
Těhotenství
Teratogenní účinky
Bylo provedeno několik reprodukčních studií na králících a potkanech v dávkách až šestkrát vyšších, než je dávka pro člověka, a neodhalily žádné známky poškození plodnosti nebo poškození plodu v důsledku nitrofurantoinu. V jediné publikované studii provedené na myších v dávce 68násobku dávky pro člověka (na základě mg/kg podané samici) bylo pozorováno zpomalení růstu a nízký výskyt menších a běžných malformací. Při 25násobku lidské dávky však nebyly pozorovány malformace plodu; význam těchto zjištění pro člověka je nejistý. Neexistují však žádné adekvátní a dobře kontrolované studie u těhotných žen. Vzhledem k tomu, že reprodukční studie na zvířatech nejsou vždy prediktivní pro lidskou odpověď, měl by být tento lék používán během těhotenství pouze tehdy, je-li to nezbytně nutné.
Neteratogenní účinky
jedné publikované studii transplacentární karcinogenity bylo prokázáno, že nitrofurantoin indukuje plicní papilární adenomy u myší generace F1 v dávkách 19krát vyšších než je dávka pro člověka na základě mg/kg. Vztah tohoto zjištění k potenciální lidské karcinogenezi není v současnosti znám. Vzhledem k nejistotě ohledně důsledků těchto údajů na zvířatech pro člověka by měl být tento lék používán během těhotenství pouze tehdy, je-li to nezbytně nutné.
Práce a dodání
Vidět KONTRAINDIKACE .
Kojící matky
Nitrofurantoin byl detekován v lidském mateřském mléce ve stopových množstvích. Vzhledem k potenciálu závažných nežádoucích účinků nitrofurantoinu u kojených dětí mladších jednoho měsíce by mělo být rozhodnuto, zda přerušit kojení nebo přerušit léčbu, přičemž je třeba vzít v úvahu důležitost léku pro matku. (vidět KONTRAINDIKACE )
Pediatrické použití
Bezpečnost a účinnost Furadantin u novorozenců mladších jednoho měsíce nebyly stanoveny. (vidět KONTRAINDIKACE )
PŘEDÁVKOVAT
Občasné případy akutního předávkování Furadantin nevedly k žádným specifickým symptomům kromě zvracení. Doporučuje se indukce zvracení. Neexistuje žádné specifické antidotum, ale měl by být zachován vysoký příjem tekutin, aby se podpořilo vylučování léku močí. Je dialyzovatelný.
KONTRAINDIKACE
Anurie, oligurie nebo významné poškození funkce ledvin (clearance kreatininu pod 60 ml za minutu nebo klinicky významné zvýšení sérového kreatininu) jsou kontraindikacemi. Léčba tohoto typu pacientů s sebou nese zvýšené riziko toxicity kvůli zhoršenému vylučování léku.
Vzhledem k možnosti hemolytické anémie v důsledku nezralých enzymatických systémů erytrocytů (nestabilita glutathionu) je lék kontraindikován u těhotných pacientek v termínu (38.–42. týden těhotenství), během porodu a porodu nebo když se blíží nástup porodu. Ze stejného důvodu je lék kontraindikován u novorozenců mladších jednoho měsíce.
Furadantin je kontraindikován u pacientů s předchozí anamnézou cholestatické žloutenky/jaterní dysfunkce související s nitrofurantoinem. Furadantin je také kontraindikován u pacientů se známou přecitlivělostí na nitrofurantoin.
KLINICKÁ FARMAKOLOGIE
Orálně podávané Furadantin se snadno vstřebává a rychle vylučuje močí. Koncentrace v krvi při terapeutické dávce jsou obvykle nízké. Je vysoce rozpustný v moči, které může propůjčit hnědou barvu.
Po dávkovacím režimu 100 mg qid po dobu 7 dnů byla průměrná výtěžnost léku močí (0-24 hodin) v den 1 a den 7 42,7 % a 43,6 %.
Na rozdíl od mnoha léků může přítomnost potravy nebo látek zpomalujících vyprazdňování žaludku zvýšit biologickou dostupnost Furadantin pravděpodobně tím, že umožní lepší rozpouštění v žaludečních šťávách.
Mikrobiologie
Režim akce
Nitrofurantoin je redukován širokou škálou enzymů včetně bakteriálních flavoproteinů na reaktivní meziprodukty, které poškozují makromolekuly, jako je DNA a proteiny.
Křížový odpor
Přestože se může vyskytnout zkřížená rezistence s jinými antimikrobiálními látkami, zkřížená rezistence se sulfonamidy nebyla pozorována.
Interakce s jinými antimikrobiálními látkami
Antagonismus byl prokázán in vitro mezi nitrofurantoinem a chinolonovými antimikrobiálními látkami. Bylo prokázáno, že nitrofurantoin ve formě perorální suspenze nitrofurantoinu je účinný proti většině následujících bakterií jak in vitro, tak při klinických infekcích: (viz INDIKACE A POUŽITÍ ).
Gram-pozitivní aeroby
Staphylococcus aureus Druh Enterococcus
Gram-negativní aeroby
Escherichia coli
POZNÁMKA: Některé kmeny druhů Enterobacter a Klebsiella jsou odolné vůči nitrofurantoinu.
dispozici jsou následující údaje in vitro, ale jejich klinický význam není znám. Nitrofurantoin vykazuje in vitro aktivitu proti následujícím bakteriím; bezpečnost a účinnost nitrofurantoinu při léčbě klinických infekcí způsobených těmito bakteriemi však nebyla stanovena v adekvátních a dobře kontrolovaných klinických studiích.
Gram-pozitivní aeroby
Koaguláza-negativní stafylokoky (včetně Staphylococcus epidermidis a Staphylococcus saprophyticus) Streptococcus agalactiae Streptokoky skupiny Viridans
Gram-negativní aeroby
Citrobacter koseriCitrobacter freundiiKlebsiella oxytoca
Nitrofurantoin není účinný proti většině kmenů druhů Proteus nebo Serratia. Nemá žádnou aktivitu proti druhům Pseudomonas.
Testování citlivosti
Specifické informace týkající se interpretačních kritérií testu citlivosti a souvisejících testovacích metod a standardů kontroly kvality uznaných FDA pro tento lék naleznete na: http://www.fda.gov/STIC.
INFORMACE PRO PACIENTA
Pacienti by měli být poučeni, aby užívali Furadantin jídlem pro další zvýšení tolerance a zlepšení vstřebávání léčiva. Pacienti by měli být poučeni, aby dokončili celý léčebný cyklus; nicméně by jim mělo být doporučeno, aby kontaktovali svého lékaře, pokud se během léčby objeví nějaké neobvyklé příznaky.
Průjem je častým problémem způsobeným antibiotiky, který obvykle končí, když je antibiotikum vysazeno. Někdy po zahájení léčby antibiotiky se u pacientů může vyvinout vodnatá a krvavá stolice (s žaludečními křečemi a horečkou nebo bez nich) dokonce až dva nebo více měsíců po užití poslední dávky antibiotika. Pokud k tomu dojde, pacienti by měli co nejdříve kontaktovat svého lékaře.
Pacienty je třeba upozornit, aby během užívání neužívali antacida obsahující trikřemičitan hořečnatý Furadantin .
