Suprax 100mg, 200mg Cefixime Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Suprax 200 mg a jak se používá?
Suprax (cefixim) pro perorální suspenzi je cefalosporinové antibiotikum používané k léčbě mnoha různých typů infekcí způsobených bakteriemi.
Jaké jsou vedlejší účinky přípravku Suprax?
Mezi časté nežádoucí účinky přípravku Suprax 100 mg patří:
- žaludeční nevolnost/bolest,
- průjem,
- nevolnost,
- zácpa,
- ztráta chuti k jídlu,
- plyn,
- bolest hlavy,
- závrať,
- úzkost,
- ospalost,
- zvýšené noční močení,
- rýma,
- bolest krku,
- kašel, popř
- vaginální svědění nebo výtok.
Informujte svého lékaře, pokud zaznamenáte vzácné, ale velmi závažné nežádoucí účinky přípravku Suprax 200 mg, včetně:
- silná bolest žaludku nebo břicha,
- přetrvávající nevolnost nebo zvracení,
- žloutnutí očí nebo kůže,
- tmavá moč,
- neobvyklá únava,
- nové známky infekce (např. přetrvávající bolest v krku, horečka),
- snadná tvorba modřin nebo krvácení,
- změna množství moči, popř
- mentální změny/změny nálady (jako je zmatenost).
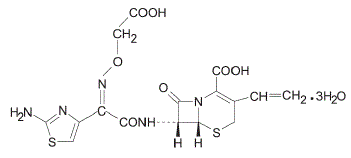
POPIS
Cefixim je semisyntetické cefalosporinové antibakteriální činidlo pro perorální podání. Chemicky se jedná o (6R,7R)-7-[2-(2-amino-4-thiazolyl)glyoxylamido]-8-oxo-3-vinyl-5-thia-1-azabicyklo[4.2.0]okt-2 trihydrát -en-2-karboxylové kyseliny, 72-(Z)-[0-(karboxymethyl)oxim].
Molekulová hmotnost = 507,50 jako trihydrát. Chemický vzorec je C16H15N5O7S2.3H2O
Strukturní vzorec pro cefixim je:
- Neaktivní složky obsažené v tabletách SUPRAX® (cefixim) 400 mg USP jsou: hydrogenfosforečnan vápenatý, hypromelóza, monohydrát laktózy, stearát hořečnatý, mikrokrystalická celulóza, polyethylenglykol, předbobtnalý škrob, oxid titaničitý a triacetin.
- Neaktivní složky obsažené v tobolkách SUPRAX® (cefixim) 400 mg jsou: koloidní oxid křemičitý, krospovidon, nízko substituovaná hydroxypropylcelulóza, stearát hořečnatý a mannitol. Obal tobolky obsahuje následující neaktivní složky: černý oxid železitý, červený oxid železitý, želatina, hydroxid draselný, propylenglykol, šelak, laurylsulfát sodný a oxid titaničitý.
- Neaktivní složky obsažené v SUPRAX® (cefixim) 100 mg nebo 150 mg nebo 200 mg žvýkacích tabletách jsou: aspartam, koloidní oxid křemičitý, krospovidon, FD&C Red # 40 Aluminium Lake, nízko substituovaná hydroxypropylcelulóza, stearát hořečnatý, mannitol, fantazijní permaseal a příchuť tutti frutti.
- Neaktivní složky obsažené v prášku SUPRAX® (cefixim) pro perorální suspenzi USP jsou: koloidní oxid křemičitý, benzoát sodný, jahodové aroma, sukralóza (pouze v síle 500 mg/5 ml), sacharóza a xanthanová guma.
INDIKACE
Nekomplikované infekce močových cest
SUPRAX je indikován k léčbě dospělých a dětských pacientů ve věku 6 měsíců nebo starších s nekomplikovanými infekcemi močových cest způsobenými citlivými izoláty Escherichia coli a Proteus mirabilis.
Zánět středního ucha
SUPRAX je indikován k léčbě dospělých a dětských pacientů ve věku 6 měsíců nebo starších se zánětem středního ucha způsobeným citlivými izoláty Haemophilus influenzae, Moraxella catarrhalis a Streptococcus pyogenes. (Účinnost Streptococcus pyogenes v tomto orgánovém systému byla studována u méně než 10 infekcí.)
Poznámka
U pacientů se zánětem středního ucha způsobeným Streptococcus pneumoniae byla celková odpověď přibližně o 10 % nižší u cefiximu než u komparátoru [viz Klinické studie ].
Faryngitida a tonzilitida
SUPRAX je indikován k léčbě dospělých a dětských pacientů ve věku 6 měsíců nebo staršíchs faryngitidou a tonzilitidou způsobenou citlivými izoláty Streptococcus pyogenes. (Poznámka: Penicilin je obvyklým lékem volby v léčbě infekcí Streptococcus pyogenes. SUPRAX je obecně účinný při eradikaci Streptococcus pyogenes z nosohltanu; údaje prokazující účinnost SUPRAX 100 mg v následné prevenci revmatické horečky však nejsou dostupný.)
Akutní exacerbace chronické bronchitidy
SUPRAX 200 mg je indikován k léčbě dospělých a dětských pacientů ve věku 6 měsíců nebo starších s akutní exacerbací chronické bronchitidy způsobené citlivými izoláty Streptococcus pneumoniae a Haemophilus influenzae.
Nekomplikovaná kapavka (cervikální/uretrální)
SUPRAX 100 mg je indikován k léčbě dospělých a pediatrických pacientů ve věku 6 měsíců nebo starších s nekomplikovanou kapavou (cervikální/uretrální) způsobenou citlivými izoláty Neisseria gonorrhoeae (izoláty neprodukující penicilinázu a izoláty neprodukující penicilinázu).
Používání
Aby se snížil vývoj bakterií rezistentních vůči lékům a zachovala se účinnost přípravku SUPRAX 100 mg a dalších antibakteriálních léků, měl by být přípravek SUPRAX 100 mg používán pouze k léčbě infekcí, u kterých je prokázáno nebo existuje silné podezření, že jsou způsobeny citlivými bakteriemi. Pokud jsou k dispozici informace o kultivaci a citlivosti, je třeba je vzít v úvahu při výběru nebo úpravě antimikrobiální terapie. Při absenci takových údajů mohou k empirickému výběru terapie přispět místní epidemiologie a vzorce citlivosti.
DÁVKOVÁNÍ A PODÁVÁNÍ
Dospělí
Doporučená dávka cefiximu je 400 mg denně. Může být podáván jako 400mg tableta nebo tobolka denně nebo 400mg tableta může být rozdělena a podávána jako jedna polovina tablety každých 12 hodin. Pro léčbu nekomplikovaných cervikálních/uretrálních gonokokových infekcí se doporučuje jednorázová perorální dávka 400 mg. Kapsle a tableta mohou být podávány bez ohledu na jídlo.
Při léčbě infekcí způsobených Streptococcus pyogenes by měla být terapeutická dávka cefiximu podávána po dobu nejméně 10 dnů.
Pediatričtí pacienti (6 měsíců nebo starší)
Doporučená dávka je 8 mg/kg/den suspenze. Může být podávána jako jedna denní dávka nebo může být podána ve dvou dílčích dávkách, jako 4 mg/kg každých 12 hodin.
Poznámka
Navrhovaná dávka byla stanovena pro každé dětské hmotnostní rozmezí. Viz Tabulka 1. Ujistěte se, že všechny objednávky, které specifikují dávku v mililitrech, zahrnují koncentraci, protože SUPRAX pro perorální suspenzi je k dispozici ve třech různých koncentracích (100 mg/5 ml, 200 mg/5 ml a 500 mg/5 ml).
Děti vážící více než 45 kg nebo starší 12 let by měly být léčeny doporučenou dávkou pro dospělé. Žvýkací tablety SUPRAX (cefixim) je nutné před spolknutím rozkousat nebo rozdrtit.
Zánět středního ucha by měl být léčen žvýkacími tabletami nebo suspenzí. Klinické zkoušky zánětu středního ucha byly provedeny se žvýkacími tabletami nebo suspenzí a žvýkací tablety nebo suspenze vedly k vyšším maximálním hladinám v krvi než tablety, když byly podávány ve stejné dávce.
Tableta nebo kapsle by proto neměla být nahrazena žvýkacími tabletami nebo suspenzí při léčbě zánětu středního ucha [viz KLINICKÁ FARMAKOLOGIE ].
Při léčbě infekcí způsobených Streptococcus pyogenes by měla být terapeutická dávka cefiximu podávána po dobu nejméně 10 dnů.
Renální poškození
SUPRAX 200 mg lze podávat v případě poruchy funkce ledvin. U pacientů s clearance kreatininu 60 ml/min nebo vyšší lze použít normální dávku a schéma. V tabulce 2 jsou uvedeny úpravy dávkování u dospělých s poruchou funkce ledvin. Ani hemodialýza, ani peritoneální dialýza neodstraňují z těla významné množství léčiva.
Pokyny pro rekonstituci pro perorální suspenzi
Po rekonstituci může být suspenze uchovávána po dobu 14 dnů buď při pokojové teplotě, nebo v chladničce, bez významné ztráty účinnosti. Uchovávejte těsně uzavřené. Před použitím dobře protřepejte. Nepoužitou část po 14 dnech zlikvidujte.
JAK DODÁVÁNO
Dávkové formy A Síly
SUPRAX je dostupný pro perorální podání v následujících lékových formách a silách:
- Potahované tablety poskytují 400 mg cefiximu jako trihydrát. Jsou to bílé až téměř bílé potahované tablety ve tvaru tobolky se zkosenými hranami a dělenou půlicí rýhou na každé straně. Na jedné straně tablety je vyraženo „SUPRAX“ a na druhé straně „LUPIN“.
- Kapsle poskytují 400 mg cefiximu jako trihydrát. Jedná se o tobolky velikosti „00EL“ s růžovým neprůhledným víčkem a růžovým neprůhledným tělem s „LU“ na víčku a „U43“ na těle černým inkoustem. Tobolky obsahují bílý až nažloutlý bílý granulovaný prášek.
- Žvýkací tablety poskytují buď 100 mg nebo 150 mg nebo 200 mg cefiximu jako trihydrát. 100 mg tableta je růžová kulatá tableta s vyraženým „SUPRAX 100“ na jedné straně a „LUPIN“ na druhé straně. 150mg tableta je růžová, kulatá tableta s vyraženým „SUPRAX 150“ na jedné straně a „LUPIN“ na druhé straně. 200 mg tableta je růžová kulatá tableta s vyraženým „SUPRAX 200“ na jedné straně a „LUPIN“ na druhé straně.
- Prášek pro přípravu perorální suspenze po rekonstituci poskytuje buď 100 mg/5 ml nebo 200 mg/5 ml nebo 500 mg/5 ml cefiximu jako trihydrát. Pro 100 mg/5 ml a 200 mg/5 ml má prášek šedobílou až světle žlutou barvu a má jahodovou příchuť. Pro 500 mg/5 ml má prášek špinavě bílou až krémovou barvu a má jahodovou příchuť.
Skladování A Manipulace
SUPRAX® je dostupný pro perorální podání v následujících lékových formách, silách a baleních uvedených v tabulce níže:
Výrobce: Lupin Limited Mandideep 462 046 Indie. Revize: březen 2018.
VEDLEJŠÍ EFEKTY
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Nejčastěji pozorovanými nežádoucími reakcemi v amerických studiích s tabletovou formulací byly gastrointestinální příhody, které byly hlášeny u 30 % dospělých pacientů v režimu 2x denně nebo 1x denně. Pět procent (5 %) pacientů v klinických studiích v USA přerušilo léčbu kvůli nežádoucím účinkům souvisejícím s lékem. Jednotlivé nežádoucí účinky zahrnovaly průjem 16 %, řídkou nebo častou stolici 6 %, bolesti břicha 3 %, nauzeu 7 %, dyspepsii 3 % a plynatost 4 %. Výskyt gastrointestinálních nežádoucích účinků, včetně průjmu a řídké stolice, u pediatrických pacientů užívajících suspenzi byl srovnatelný s výskytem pozorovaným u dospělých pacientů užívajících tablety.
Postmarketingové zkušenosti
Po použití cefiximu po schválení byly hlášeny následující nežádoucí účinky. Incidence byla menší než 1 z 50 (méně než 2 %).
Gastrointestinální
klinických studiích bylo identifikováno několik případů zdokumentované pseudomembranózní kolitidy. Během léčby nebo po ní se mohou objevit příznaky pseudomembranózní kolitidy.
Hypersenzitivní reakce
Anafylaktické/anafylaktoidní reakce (včetně šoku a úmrtí), kožní vyrážky, kopřivka, léková horečka, pruritus, angioedém a otok obličeje. Byly hlášeny erythema multiforme, Stevens-Johnsonův syndrom a reakce podobné sérové nemoci.
Jaterní
přechodné zvýšení SGPT, SGOT, alkalické fosfatázy, hepatitidy, žloutenky.
Renální
Přechodné zvýšení BUN nebo kreatininu, akutní selhání ledvin.
Centrální nervový systém
Bolesti hlavy, závratě, záchvaty.
Hemický A Lymfatický Systém
Přechodná trombocytopenie, leukopenie, neutropenie, prodloužení protrombinového času, zvýšená LDH, pancytopenie, agranulocytóza a eozinofilie.
Abnormální laboratorní testy
Hyperbilirubinémie.
Jiné nežádoucí účinky
Genitální pruritus, vaginitida, kandidóza, toxická epidermální nekrolýza.
Nežádoucí účinky hlášené u léků třídy cefalosporinů
Alergické reakce, superinfekce, renální dysfunkce, toxická nefropatie, jaterní dysfunkce včetně cholestázy, aplastická anémie, hemolytická anémie, krvácení a kolitida.
Několik cefalosporinů se podílí na spouštění záchvatů, zejména u pacientů s poruchou funkce ledvin, kdy dávka nebyla snížena (viz DÁVKOVÁNÍ A PODÁVÁNÍ vidět PŘEDÁVKOVAT ]. Pokud se objeví záchvaty spojené s lékovou terapií, lék by měl být vysazen. Pokud je to klinicky indikováno, lze podat antikonvulzivní léčbu.
DROGOVÉ INTERAKCE
karbamazepin
Po uvedení přípravku na trh byly při současném podávání cefiximu hlášeny zvýšené hladiny karbamazepinu. Monitorování léků může pomoci při detekci změn plazmatických koncentrací karbamazepinu.
Warfarin a antikoagulancia
Při současném podávání cefiximu byl hlášen zvýšený protrombinový čas, s klinickým krvácením nebo bez něj.
Interakce drog/laboratorních testů
Falešně pozitivní reakce na ketony v moči se může objevit u testů používajících nitroprusid, ale ne u testů používajících nitroferricyanid.
Podávání cefiximu může mít za následek falešně pozitivní reakci na glukózu v moči při použití Clinitest®, Benedictova roztoku nebo Fehlingova roztoku. Doporučuje se používat glukózové testy založené na enzymatických glukózooxidázových reakcích (jako je Clinistix® nebo TesTape®). Během léčby jinými cefalosporiny byl hlášen falešně pozitivní přímý Coombsův test; proto je třeba si uvědomit, že pozitivní Coombsův test může být způsoben drogou.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Hypersenzitivní reakce
Při užívání cefiximu byly hlášeny anafylaktické/anafylaktoidní reakce (včetně šoku a úmrtí).
Před zahájením léčby přípravkem SUPRAX je třeba pečlivě zjistit, zda pacient neměl v minulosti hypersenzitivní reakce na cefalosporiny, peniciliny nebo jiné léky. Pokud má být tento přípravek podáván pacientům citlivým na penicilin, je třeba postupovat opatrně, protože zkřížená přecitlivělost mezi beta-laktamovými antibakteriálními léky byla jasně zdokumentována a může se objevit až u 10 % pacientů s alergií na penicilin v anamnéze. Pokud se objeví alergická reakce na SUPRAX 100 mg, vysaďte lék.
Průjem spojený s Clostridium Difficile
Průjem spojený s Clostridium difficile (CDAD) byl hlášen při použití téměř všech antibakteriálních látek, včetně SUPRAX 200 mg, a může se pohybovat v rozsahu závažnosti od mírného průjmu až po fatální kolitidu. Léčba antibakteriálními látkami mění normální flóru tlustého střeva, což vede k přemnožení C. difficile.
C. difficile produkuje toxiny A a B, které přispívají k rozvoji CDAD. Izoláty C. difficile produkující hypertoxin způsobují zvýšenou morbiditu a mortalitu, protože tyto infekce mohou být odolné vůči antimikrobiální léčbě a mohou vyžadovat kolektomii. CDAD je třeba vzít v úvahu u všech pacientů, kteří mají průjem po užití antibakteriálních léků. Je nutná pečlivá anamnéza, protože CDAD se objevilo více než dva měsíce po podání antibakteriálních látek.
Pokud je podezření na CDAD nebo je potvrzeno, může být nutné přerušit pokračující užívání antibakteriálních léků, které nejsou zaměřeny proti C. difficile. Podle klinické indikace by měla být zahájena vhodná léčba tekutin a elektrolytů, suplementace proteinů, antibakteriální léčba C. difficile a chirurgické vyšetření.
Úprava dávky při poškození ledvin
Dávku přípravku SUPRAX 100 mg je třeba upravit u pacientů s poruchou funkce ledvin a také u pacientů podstupujících kontinuální ambulantní peritoneální dialýzu (CAPD) a hemodialýzu (HD). Pacienti na dialýze by měli být pečlivě sledováni [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Koagulační účinky
Cefalosporiny, včetně SUPRAX 200 mg, mohou být spojeny s poklesem aktivity protrombinu. Mezi ohrožené patří pacienti s renálním nebo jaterním poškozením nebo špatným nutričním stavem, stejně jako pacienti s protrahovanou antimikrobiální terapií a pacienti dříve stabilizovaní na antikoagulační léčbě. U rizikových pacientů je třeba sledovat protrombinový čas a exogenní vitamin K podávat podle indikace.
Vývoj bakterií odolných vůči léčivům
Je nepravděpodobné, že by předepsání přípravku SUPRAX (cefixim) při absenci prokázané nebo silně suspektní bakteriální infekce přineslo pacientovi prospěch a zvýšilo riziko rozvoje bakterií rezistentních na léky.
Riziko u pacientů s fenylketonurií
Fenylalanin může být škodlivý pro pacienty s fenylketonurií (PKU). SUPRAX 200 mg žvýkací tablety obsahují aspartam, zdroj fenylalaninu. Jedna síla 100 mg, 150 mg a 200 mg obsahuje 3,3 mg, 5 mg a 6,7 mg fenylalaninu. Než předepíšete SUPRAX žvýkací tablety pacientovi s PKU, zvažte kombinované denní množství fenylalaninu ze všech zdrojů, včetně SUPRAX 200 mg žvýkacích tablet.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Celoživotní studie na zvířatech ke zhodnocení karcinogenního potenciálu nebyly provedeny. Cefixim nezpůsobil bodové mutace v buňkách bakterií nebo savců, poškození DNA nebo poškození chromozomů in vitro a nevykazoval klastogenní potenciál in vivo v mikronukleárním testu na myších. U potkanů nebyla fertilita a reprodukční schopnost ovlivněna cefiximem v dávkách až 25násobku terapeutické dávky pro dospělé.
Použití u konkrétních populací
Těhotenství
Těhotenství kategorie B
Reprodukční studie byly provedeny na myších a potkanech v dávkách až 40krát vyšších, než je dávka pro člověka, a neodhalily žádné známky poškození plodu v důsledku cefiximu. Neexistují žádné adekvátní a dobře kontrolované studie u těhotných žen. Vzhledem k tomu, že reprodukční studie na zvířatech nejsou vždy prediktivní pro lidskou odpověď, měl by být tento lék používán během těhotenství pouze tehdy, je-li to nezbytně nutné.
Práce a dodání
Cefixim nebyl studován pro použití během porodu a porodu. Léčba by měla být podána pouze tehdy, je-li to nezbytně nutné.
Kojící matky
Není známo, zda se cefixim vylučuje do lidského mléka. Během léčby tímto lékem je třeba zvážit dočasné přerušení kojení.
Pediatrické použití
Bezpečnost a účinnost cefiximu u dětí mladších šesti měsíců nebyla stanovena. Výskyt gastrointestinálních nežádoucích reakcí, včetně průjmu a řídké stolice, u pediatrických pacientů užívajících suspenzi, byl srovnatelný s výskytem pozorovaným u dospělých pacientů užívajících tablety.
Geriatrické použití
Klinické studie nezahrnovaly dostatečný počet subjektů ve věku 65 let a starších, aby bylo možné určit, zda reagují odlišně než mladší subjekty. Jiné hlášené klinické zkušenosti nezjistily rozdíly v odpovědích mezi staršími a mladšími pacienty. Farmakokinetická studie u starších osob odhalila rozdíly ve farmakokinetických parametrech [viz KLINICKÁ FARMAKOLOGIE ]. Tyto rozdíly byly malé a nenaznačují potřebu úpravy dávkování léku u starších osob.
Renální poškození
Dávku cefiximu je třeba upravit u pacientů s poruchou funkce ledvin a také u pacientů podstupujících kontinuální ambulantní peritoneální dialýzu (CAPD) a hemodialýzu (HD). Pacienti na dialýze by měli být pečlivě sledováni [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
PŘEDÁVKOVAT
Může být indikován výplach žaludku; jinak neexistuje žádné specifické antidotum. Cefixim není odstraňován ve významných množstvích z oběhu hemodialýzou nebo peritoneální dialýzou. Nežádoucí účinky u malého počtu zdravých dospělých dobrovolníků užívajících jednotlivé dávky až 2 g cefiximu se nelišily od profilu pozorovaného u pacientů léčených doporučenými dávkami.
KONTRAINDIKACE
Suprax (cefixim) je kontraindikován u pacientů se známou alergií na cefixim nebo jiné cefalosporiny.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Cefixim je semisyntetické cefalosporinové antibakteriální léčivo [viz Mikrobiologie ].
Farmakokinetika
SUPRAX 200 mg žvýkací tablety jsou bioekvivalentní perorální suspenzi.
Tablety a suspenze SUPRAX 200 mg, podávané perorálně, se absorbují asi ze 40 % až 50 %, ať už jsou podávány s jídlem nebo bez jídla; doba do maximální absorpce se však prodlouží přibližně o 0,8 hodiny při podání s jídlem. Jedna 200mg tableta cefiximu produkuje průměrnou maximální sérovou koncentraci přibližně 2 mcg/ml (rozsah 1 až 4 mcg/ml); jedna 400mg tableta produkuje průměrnou maximální koncentraci přibližně 3,7 mcg/ml (rozmezí 1,3 až 7,7 mcg/ml). Perorální suspenze poskytuje průměrné maximální koncentrace přibližně o 25 % až 50 % vyšší než tablety při testování na normálních dospělých dobrovolnících. Dvě stě a 400 mg dávky perorální suspenze poskytují průměrné maximální koncentrace 3 mcg/ml (rozmezí 1 až 4,5 mcg/ml) a 4,6 mcg/ml (rozmezí 1,9 až 7,7 mcg/ml), při testování na normálních dospělých dobrovolnících . Při testování na normálních dospělých dobrovolnících je plocha pod křivkou závislosti času na koncentraci (AUC) větší přibližně o 10 % až 25 % u perorální suspenze než u tablety po dávkách 100 až 400 mg. Tuto zvýšenou absorpci je třeba vzít v úvahu, pokud má být tableta nahrazena perorální suspenzí. Kvůli nedostatku bioekvivalence by tablety neměly být nahrazeny perorální suspenzí při léčbě zánětu středního ucha [viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Zkřížené studie tablet versus suspenze nebyly u dětí provedeny.
400mg tobolka je bioekvivalentní 400mg tabletě za podmínek nalačno. Jídlo však snižuje absorpci po podání tobolky přibližně o 15 % na základě AUC a 25 % na základě Cmax.
Maximální sérové koncentrace se objevují mezi 2 a 6 hodinami po perorálním podání jedné 200 mg tablety, jedné 400 mg tablety nebo 400 mg suspenze cefiximu. Maximální sérové koncentrace se objevují mezi 2 a 5 hodinami po jednorázovém podání 200 mg suspenze. Maximální sérové koncentrace se objevují mezi 3 a 8 hodinami po perorálním podání jedné 400mg tobolky.
Rozdělení
Vazba na sérové proteiny je nezávislá na koncentraci s navázanou frakcí přibližně 65 %. Ve studii s více dávkami provedené s výzkumnou formulací, která je méně biologicky dostupná než tableta nebo suspenze, došlo po podávání po dobu 14 dnů k malé akumulaci léku v séru nebo moči. Adekvátní údaje o hladinách cefiximu v CSF nejsou k dispozici.
Metabolismus A Vylučování
Neexistují žádné důkazy o metabolismu cefiximu in vivo. Přibližně 50 % absorbované dávky se vyloučí v nezměněné podobě močí za 24 hodin. Ve studiích na zvířatech bylo zjištěno, že cefixim se také vylučuje žlučí v množství přesahujícím 10 % podané dávky. Sérový poločas cefiximu u zdravých jedinců je nezávislý na lékové formě a je v průměru 3 až 4 hodiny, ale u některých normálních dobrovolníků se může pohybovat až 9 hodin.
Zvláštní populace
Geriatrie
Průměrné AUC v rovnovážném stavu u starších pacientů jsou přibližně o 40 % vyšší než průměrné AUC u jiných zdravých dospělých. Rozdíly ve farmakokinetických parametrech mezi 12 mladými a 12 staršími subjekty, které dostávaly 400 mg cefiximu jednou denně po dobu 5 dnů, jsou shrnuty následovně:
Tato zvýšení však nebyla klinicky významná [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Renální poškození
U subjektů se středně závažnou poruchou funkce ledvin (clearance kreatininu 20 až 40 ml/min) je průměrný sérový poločas cefiximu prodloužen na 6,4 hodiny. Při těžké poruše ledvin (clearance kreatininu 5 až 20 ml/min) se poločas prodloužil na průměrně 11,5 hodiny. Lék není významně odstraňován z krve hemodialýzou nebo peritoneální dialýzou. Studie však ukázala, že při dávkách 400 mg mají pacienti podstupující hemodialýzu podobný krevní profil jako jedinci s clearance kreatininu 21 až 60 ml/min.
Mikrobiologie
Mechanismus působení
Stejně jako u jiných cefalosporinů je baktericidní účinek cefiximu výsledkem inhibice syntézy buněčné stěny. Cefixim je stabilní v přítomnosti určitých beta-laktamázových enzymů. V důsledku toho mohou být některé organismy rezistentní na peniciliny a některé cefalosporiny v důsledku přítomnosti betalaktamáz citlivé na cefixim.
Odpor
Rezistence na cefixim u izolátů Haemophilus influenzae a Neisseria gonorrhoeae je nejčastěji spojena se změnami v proteinech vázajícím penicilin (PBP). Cefixim může mít omezenou aktivitu proti Enterobacteriaceae produkujícím beta-laktamázy s rozšířeným spektrem (ESBL). Druhy Pseudomonas, druhy Enterococcus, kmeny streptokoků skupiny D, Listeria monocytogenes, většina kmenů stafylokoků (včetně kmenů rezistentních na meticilin), většina kmenů Enterobacter species, většina kmenů Bacteroides fragilis a většina kmenů druhu Clostridium jsou rezistentní vůči cefiximu.
Antimikrobiální aktivita
Bylo prokázáno, že cefixim je účinný proti většině izolátů následujících mikroorganismů, a to jak in vitro, tak při klinických infekcích [viz INDIKACE ].
Gram-pozitivní bakterie
Streptococcus pneumoniae Streptococcus pyogenes
Gram-negativní bakterie
Escherichia coli Haemophilus influenzae Moraxella catarrhalis Neisseria gonorrhoeae Proteus mirabilis
K dispozici jsou následující údaje in vitro, ale jejich klinický význam není znám. Nejméně 90 procent následujících bakterií vykazuje in vitro minimální inhibiční koncentraci (MIC) nižší nebo rovnou citlivému bodu zlomu pro cefixim proti izolátům podobného rodu nebo skupiny organismů. Účinnost cefiximu při léčbě klinických infekcí způsobených těmito bakteriemi však nebyla prokázána v adekvátních a dobře kontrolovaných klinických studiích.
Gram-pozitivní bakterie
Streptococcus agalactiae
Gram-negativní bakterie
Citrobacter amalonaticus Citrobacter diversus Haemophilus parainfluenzae Klebsiella oxytoca Klebsiella pneumoniae Pasteurella multocida Proteus vulgaris Providencia druh Salmonella druh Serratia marcescens Shigella
Testování citlivosti
Konkrétní informace týkající se interpretačních kritérií testu citlivosti a souvisejících testovacích metod a standardů kontroly kvality uznaných FDA pro tento lék naleznete na: https://www.fda.gov/STIC.
Klinické studie
Srovnávací klinické studie zánětu středního ucha byly provedeny u téměř 400 dětí ve věku od 6 měsíců do 10 let. Streptococcus pneumoniae byl izolován u 47 % pacientů, Haemophilus influenzae u 34 %, Moraxella catarrhalis u 15 % a S. pyogenes u 4 %.
Celková míra odezvy Streptococcus pneumoniae na cefixim byla přibližně o 10 % nižší a Haemophilus influenzae nebo Moraxella catarrhalis přibližně o 7 % vyšší (12 %, pokud jsou zahrnuty izoláty H. influenzae pozitivní na beta-laktamázu), než míra odezvy těchto organismů na léky aktivní kontroly.
těchto studiích byli pacienti randomizováni a léčeni buď cefiximem v dávkovacích režimech 4 mg/kg dvakrát denně nebo 8 mg/kg jednou denně, nebo komparátorem. U 69 až 70 % pacientů v každé skupině došlo k vymizení známek a symptomů zánětu středního ucha při hodnocení 2 až 4 týdny po léčbě, ale přetrvávající výpotek byl nalezen u 15 % pacientů. Při hodnocení na konci terapie bylo 17 % pacientů užívajících cefixim a 14 % pacientů užívajících účinné srovnávací léky (18 % včetně pacientů, kteří měli Haemophilus influenzae rezistentní na kontrolní lék a dostávali kontrolní antibakteriální lék) považováno za selhání léčby. Po 2 až 4 týdnech sledování mělo celkem 30 až 31 % pacientů známky selhání léčby nebo rekurentního onemocnění.
Bakteriologický výsledek zánětu středního ucha po dvou až čtyřech týdnech po terapii na základě opakování středního ucha
INFORMACE PRO PACIENTA
Informujte pacienty, že antibakteriální léky, včetně cefiximu, by se měly používat pouze k léčbě bakteriálních infekcí. Neléčí virové infekce (např. nachlazení). Pokud je cefixim předepsán k léčbě bakteriální infekce, pacienti by měli být informováni, že ačkoli je běžné, že se na začátku léčby cítí lépe, léky by měly být užívány přesně podle pokynů. Vynechání dávek nebo nedokončení celé terapie může: (1) snížit účinnost okamžité léčby a (2) zvýšit pravděpodobnost, že si bakterie vyvinou rezistenci a nebudou léčitelné cefiximem pro perorální suspenzi nebo cefiximovými žvýkacími tabletami nebo jinými antibakteriální léky v budoucnu.
Informujte pacienty s fenylketonurií, že SUPRAX 200mg žvýkací tablety obsahují aspartam, zdroj fenylalaninu, následovně: Každá SUPRAX žvýkací tableta obsahuje 3,3 mg, 5 mg a 6,7 mg fenylalaninu na 100 mg, 150 mg a 200 mg, v uvedeném pořadí.
Informujte pacienty, že průjem je častým problémem způsobeným antibakteriálními léky, který obvykle končí, když je antibakteriální lék vysazen. Někdy po zahájení léčby antibakteriálními léky se u pacientů může objevit vodnatá a krvavá stolice (s žaludečními křečemi a horečkou nebo bez nich) dokonce až dva nebo více měsíců po užití poslední dávky antibakteriálního léku. Pokud k tomu dojde, pacienti by měli co nejdříve kontaktovat svého lékaře.
