Xalatan 2.5ml Latanoprost Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
XALATAN® (latanoprost) oční roztok
POPIS
Latanoprost je analog prostaglandinu F2α. Jeho chemický název je isopropyl-(Z)-7[(lR,2R,3R,5S)3,5dihydroxy-2-[(3R)-3-hydroxy-5-fenylpentyl]cyklopentyl]-5-heptenoát. Jeho molekulový vzorec je C26H40O5 a jeho chemická struktura je:
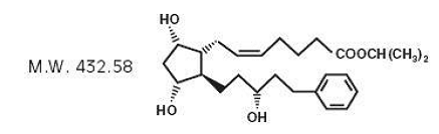
Latanoprost je bezbarvý až slabě žlutý olej, který je velmi rozpustný v acetonitrilu a volně rozpustný v acetonu, ethanolu, ethylacetátu, isopropanolu, methanolu a oktanolu. Je prakticky nerozpustný ve vodě.
XALATAN (latanoprost oční roztok) 0,005% se dodává jako sterilní, izotonický, pufrovaný vodný roztok latanoprostu s pH přibližně 6,7 a osmolalitou přibližně 267 mOsmol/kg. Každý ml přípravku XALATAN obsahuje 50 mcg latanoprostu. Jako konzervační prostředek se přidá 0,02% benzalkoniumchlorid. Neaktivními složkami jsou: chlorid sodný, monohydrát dihydrogenfosforečnanu sodného, bezvodý hydrogenfosforečnan sodný a voda na injekci. Jedna kapka obsahuje přibližně 1,5 mcg latanoprostu.
INDIKACE
XALATAN 2,5 ml je indikován ke snížení zvýšeného nitroočního tlaku u pacientů s glaukomem s otevřeným úhlem nebo oční hypertenzí.
DÁVKOVÁNÍ A PODÁVÁNÍ
Doporučená dávka je jedna kapka do postiženého oka (očí) jednou denně večer. Pokud dojde k vynechání jedné dávky, léčba by měla pokračovat další dávkou jako obvykle.
Dávkování přípravku XALATAN by nemělo překročit jednou denně; kombinované užívání dvou nebo více prostaglandinů nebo analogů prostaglandinu včetně XALATAN 2,5 ml se nedoporučuje. Ukázalo se, že podávání těchto prostaglandinových léčivých přípravků více než jednou denně může snížit účinek na snížení nitroočního tlaku (IOP) nebo způsobit paradoxní zvýšení IOP.
Snížení nitroočního tlaku začíná přibližně 3 až 4 hodiny po podání a maximálního účinku je dosaženo po 8 až 12 hodinách.
XALATAN může být užíván současně s jinými topickými oftalmickými léčivými přípravky ke snížení NOT. Pokud se používá více než jeden topický oční lék, měly by být léky podávány s odstupem alespoň pěti (5) minut. Kontaktní čočky je třeba před podáním přípravku XALATAN 2,5 ml vyjmout a lze je znovu nasadit 15 minut po podání
JAK DODÁVÁNO
Dávkové formy A Síly
Sterilní oční roztok obsahující 50 mcg/ml latanoprostu.
Skladování A Manipulace
XALATAN je čirý, izotonický, pufrovaný, konzervovaný bezbarvý roztok latanoprostu 0,005 % (50 mcg/ml). Dodává se jako 2,5 ml roztok v 5 ml čiré lahvičce z nízkohustotního polyethylenu s čirým polyetylenovým kapátkovým hrotem, tyrkysovým šroubovacím uzávěrem z vysokohustotního polyetylenu a průhledným polyetylenovým uzávěrem s nízkou hustotou, který je viditelný proti porušení.
2,5 ml náplň, 0,005 % (50 mcg/ml): Balení 1 lahvičky: NDC 0013-8303-04 2,5 ml náplň, 0,005 % (50 mcg/ml): Vícenásobné balení 3 lahviček: NDC 0013-8303-01
Úložný prostor
Chraňte před světlem. Neotevřenou lahvičku (láhve) skladujte v chladničce při teplotě 2° až 8°C (36° až 46°F). Během přepravy pacientovi může být lahvička udržována při teplotách do 40 °C (104 °F) po dobu nepřesahující 8 dní. Jakmile je lahvička otevřena pro použití, může být uchovávána při pokojové teplotě do 25 °C (77 °F) po dobu 6 týdnů.
Distribuuje: Pharmacia & Upjohn Co., divize společnosti Pfizer Inc., NY, NY 10017. Pfizer Manufacturing Belgium NV Puurs, Belgie. Přepracováno: n/a
VEDLEJŠÍ EFEKTY
Následující nežádoucí účinky byly hlášeny po uvedení přípravku na trh a jsou podrobněji popsány v jiných částech štítku:
- Změny pigmentace duhovky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Ztmavnutí kůže očních víček [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Změny řas (zvětšení délky, tloušťky, pigmentace a počtu řas) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Nitrooční zánět (iritida/uveitida) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Makulární edém, včetně cystoidního makulárního edému [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v klinické praxi.
XALATAN 2,5 ml byl studován ve třech multicentrických, randomizovaných, kontrolovaných klinických studiích. Pacienti dostávali 50 mcg/ml XALATAN jednou denně nebo 5 mg/ml aktivního komparátoru (timolol) dvakrát denně. Studovaná populace pacientů měla průměrný věk 65±10 let. Sedm procent pacientů odstoupilo před 6měsíčním koncovým bodem.
Méně než 1 % pacientů léčených přípravkem XALATAN 2,5 ml vyžadovalo přerušení léčby z důvodu intolerance spojivkové hyperémie.
Oční příhoda/příznaky a symptomy blefaritidy byly identifikovány jako „běžně pozorované“ prostřednictvím analýzy údajů z klinických studií.
Postmarketingové zkušenosti
Během postmarketingového používání přípravku XALATAN v klinické praxi byly zjištěny následující reakce. Protože jsou hlášeny dobrovolně z populace neznámé velikosti, není vždy možné spolehlivě odhadnout jejich četnost nebo stanovit příčinnou souvislost s expozicí drogám. Mezi reakce, které byly vybrány pro zařazení buď na základě jejich závažnosti, četnosti hlášení, možné kauzální souvislosti s přípravkem XALATAN 2,5 ml nebo kombinace těchto faktorů, patří:
Poruchy nervového systému: Závrať; bolest hlavy; toxická epidermální nekrolýza
Oční poruchy: Změny řas a vellusových chloupků očního víčka (zvětšení délky, tloušťky, pigmentace a počtu řas); keratitida; edém a eroze rohovky; nitrooční zánět (iritida/uveitida); makulární edém, včetně cystoidního makulárního edému; trichiáza; periorbitální změny a změny víček vedoucí k prohloubení rýhy víčka; cysta duhovky; ztmavnutí kůže očních víček; lokalizovaná kožní reakce na očních víčkách; zánět spojivek; pseudopemfigoid oční spojivky
Respirační, hrudní a mediastinální poruchy: Astma a exacerbace astmatu; dušnost
Poruchy kůže a podkožní tkáně: Pruritus
Infekce a nákazy: Herpes keratitida
Srdeční poruchy: angina pectoris; bušení srdce; angina nestabilní
Obecné poruchy a podmínky v místě podání: Bolest na hrudi
DROGOVÉ INTERAKCE
Studie in vitro ukázaly, že při smíchání očních kapek obsahujících thimerosal s XALATANem dochází k vysrážení. Pokud jsou takové léky použity, měly by být podávány s odstupem alespoň pěti (5) minut.
Kombinované užívání dvou nebo více prostaglandinů nebo analogů prostaglandinů včetně XALATAN 2,5 ml se nedoporučuje. Ukázalo se, že podávání těchto prostaglandinových léčivých přípravků více než jednou denně může snížit účinek na snížení NOT nebo způsobit paradoxní zvýšení NOT.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Pigmentace
Bylo hlášeno, že XALATAN způsobuje změny pigmentových tkání. Nejčastěji hlášenými změnami byla zvýšená pigmentace duhovky, periorbitální tkáně (očního víčka) a řas. Očekává se, že pigmentace se bude zvyšovat, dokud je latanoprost podáván.
Změna pigmentace je způsobena spíše zvýšeným obsahem melaninu v melanocytech než zvýšením počtu melanocytů. Po vysazení latanoprostu bude pigmentace duhovky pravděpodobně trvalá, zatímco pigmentace periorbitální tkáně a změny řas byly u některých pacientů reverzibilní. Pacienti, kteří jsou léčeni, by měli být informováni o možnosti zvýšené pigmentace. Po 5 letech nejsou účinky zvýšené pigmentace známy [viz Klinické studie ].
Změna barvy duhovky nemusí být patrná po několik měsíců až let. Typicky se hnědá pigmentace kolem zornice šíří soustředně směrem k periferii duhovky a celá duhovka nebo její části se zhnědnou. Zdá se, že léčba neovlivňuje névy ani pihy duhovky. Zatímco léčba přípravkem XALATAN 2,5 ml může pokračovat u pacientů, u kterých se rozvine znatelně zvýšená pigmentace duhovky, měli by být tito pacienti pravidelně vyšetřováni (viz INFORMACE PRO PACIENTA ].
Změny řas
XALATAN 2,5 ml může postupně měnit řasy a vellus v léčeném oku; tyto změny zahrnují zvýšenou délku, tloušťku, pigmentaci, počet řas nebo chloupků a nesprávně zaměřený růst řas. Změny řas jsou obvykle reverzibilní po přerušení léčby [viz INFORMACE PRO PACIENTA ].
Nitrooční zánět
XALATAN 2,5 ml by měl být používán s opatrností u pacientů s nitroočním zánětem v anamnéze (iritida/uveitida) a obecně by neměl být používán u pacientů s aktivním nitroočním zánětem, protože zánět může být exacerbován.
Makulární edém
Během léčby přípravkem XALATAN byl hlášen makulární edém, včetně cystoidního makulárního edému. XALATAN 2,5 ml by měl být používán s opatrností u afakických pacientů, u pseudofakických pacientů s natrženým zadním pouzdrem čočky nebo u pacientů se známými rizikovými faktory pro makulární edém.
Herpetická keratitida
Během léčby přípravkem XALATAN byla hlášena reaktivace keratitidy Herpes Simplex. XALATAN 2,5 ml by měl být používán s opatrností u pacientů s herpetickou keratitidou v anamnéze. XALATAN 2,5 ml je třeba se vyhnout v případech aktivní keratitidy herpes simplex, protože může dojít k exacerbaci zánětu.
Bakteriální keratitida
Byly hlášeny případy bakteriální keratitidy spojené s používáním vícedávkových obalů topických oftalmologických přípravků. Tyto nádoby byly neúmyslně kontaminovány pacienty, kteří ve většině případů měli souběžné onemocnění rohovky nebo narušení očního epiteliálního povrchu [viz INFORMACE PRO PACIENTA ].
Použití s kontaktními čočkami
Kontaktní čočky je třeba před podáním přípravku XALATAN vyjmout a lze je znovu nasadit 15 minut po podání.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Latanoprost nebyl karcinogenní ani u myší, ani u potkanů, když byl podáván perorální sondou v dávkách až 170 mcg/kg/den (přibližně 2800násobek doporučené maximální dávky pro člověka) po dobu až 20 a 24 měsíců.
Latanoprost nebyl mutagenní u bakterií, u myšího lymfomu ani u myších mikronukleárních testů. U lidských lymfocytů byly in vitro pozorovány chromozomové aberace. Další studie in vitro a in vivo týkající se neplánované syntézy DNA u potkanů byly negativní.
Ve studiích na zvířatech nebyl zjištěn žádný vliv latanoprostu na mužskou nebo ženskou fertilitu.
Použití u konkrétních populací
Těhotenství
Teratogenní účinky
Kategorie těhotenství C.
Reprodukční studie byly provedeny na potkanech a králících. U králíků se u 4 ze 16 samic nevyskytly žádné životaschopné plody při dávce, která byla přibližně 80krát vyšší než maximální dávka pro člověka, a nejvyšší neembryocidní dávka u králíků byla přibližně 15krát vyšší než maximální dávka pro člověka.
Neexistují žádné adekvátní a dobře kontrolované studie u těhotných žen. XALATAN 2,5 ml by měl být během těhotenství užíván pouze tehdy, pokud potenciální přínos ospravedlňuje potenciální riziko pro plod.
Kojící matky
Není známo, zda se tento lék nebo jeho metabolity vylučují do mateřského mléka. Vzhledem k tomu, že mnoho léků se vylučuje do mateřského mléka, je třeba opatrnosti při podávání přípravku XALATAN 2,5 ml kojící ženě.
Pediatrické použití
Bezpečnost a účinnost u pediatrických pacientů nebyla stanovena.
Geriatrické použití
Mezi staršími a mladšími pacienty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti.
PŘEDÁVKOVAT
Intravenózní infuze až 3 mcg/kg u zdravých dobrovolníků vyvolala průměrné plazmatické koncentrace 200krát vyšší než během klinické léčby a nebyly pozorovány žádné nežádoucí účinky. Intravenózní dávky 5,5 až 10 mcg/kg způsobily bolesti břicha, závratě, únavu, návaly horka, nevolnost a pocení. Pokud dojde k předávkování přípravkem XALATAN, léčba by měla být symptomatická.
KONTRAINDIKACE
Známá přecitlivělost na latanoprost, benzalkoniumchlorid nebo na kteroukoli další složku tohoto přípravku.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Latanoprost je prostanoidní selektivní agonista FP receptoru, o kterém se předpokládá, že snižuje nitrooční tlak (IOP) zvýšením odtoku komorové vody. Studie na zvířatech a lidech naznačují, že hlavním mechanismem účinku je zvýšený uveosklerální odtok. Zvýšený NOT představuje hlavní rizikový faktor ztráty pole glaukomu. Čím vyšší je hladina IOP, tím větší je pravděpodobnost poškození zrakového nervu a ztráty zorného pole.
Farmakodynamika
Snížení nitroočního tlaku u člověka začíná asi 3-4 hodiny po podání a maximálního účinku je dosaženo po 8-12 hodinách. Snížení NOT je přítomno minimálně 24 hodin.
Farmakokinetika
Vstřebávání
Latanoprost je absorbován rohovkou, kde je isopropylesterový prekurzor hydrolyzován na kyselou formu, aby se stal biologicky aktivní.
Rozdělení
Distribuční objem u lidí je 0,16 ± 0,02 l/kg. Kyselinu latanoprostu lze měřit v komorové vodě během prvních 4 hodin a v plazmě pouze během první hodiny po lokálním podání. Studie u člověka ukazují, že maximální koncentrace v komorové vodě je dosaženo asi dvě hodiny po topickém podání.
Metabolismus
Latanoprost, proléčivo isopropylesteru, je hydrolyzován esterázami v rohovce na biologicky aktivní kyselinu. Aktivní kyselina latanoprostu, která se dostává do systémové cirkulace, je primárně metabolizována v játrech na 1,2-dinor a 1,2,3,4-tetranor metabolity prostřednictvím β-oxidace mastných kyselin.
Vylučování
Eliminace kyseliny latanoprostu z lidské plazmy je rychlá (t½ = 17 min) po intravenózním i topickém podání. Systémová clearance je přibližně 7 ml/min/kg. Po β-oxidaci v játrech jsou metabolity eliminovány hlavně ledvinami. Přibližně 88 % a 98 % podané dávky se objeví v moči po místním a intravenózním podání.
Klinické studie
Zvýšená základní IOP
Pacienti s průměrnou výchozí hodnotou NOT 24 - 25 mmHg, kteří byli léčeni po dobu 6 měsíců v multicentrických, randomizovaných, kontrolovaných studiích, prokázali snížení NOT o 6 - 8 mmHg. Toto snížení NOT u přípravku XALATAN 0,005 % podávaného jednou denně bylo ekvivalentní účinku timololu 0,5 % podávaného dvakrát denně.
Progrese zvýšené pigmentace duhovky
Byla provedena 3letá otevřená, prospektivní studie bezpečnosti s 2letou prodlouženou fází, aby se vyhodnotila progrese zvýšené pigmentace duhovky při kontinuálním užívání přípravku XALATAN jednou denně jako doplňkové léčby u 519 pacientů s glaukomem s otevřeným úhlem. Analýza byla založena na populaci pozorovaných případů 380 pacientů, kteří pokračovali v prodloužené fázi.
Výsledky ukázaly, že nástup nápadné zvýšené pigmentace duhovky se objevil během prvního roku léčby u většiny pacientů, u kterých došlo k výraznému zvýšení pigmentace duhovky. Během pěti let studie pacienti nadále vykazovali známky zvyšující se pigmentace duhovky. Pozorování zvýšené pigmentace duhovky neovlivnilo výskyt, povahu nebo závažnost nežádoucích účinků (jiných než zvýšená pigmentace duhovky) zaznamenaných ve studii. Snížení NOT bylo podobné bez ohledu na vývoj zvýšené pigmentace duhovky během studie.
INFORMACE PRO PACIENTA
Potenciál pro pigmentaci
Informujte pacienty o možnosti zvýšené hnědé pigmentace duhovky, která může být trvalá. Informujte pacienty o možnosti ztmavnutí kůže očních víček, které může být reverzibilní po vysazení přípravku XALATAN (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Potenciál pro změny řas
Informujte pacienty o možnosti změn řas a vellusu v léčeném oku během léčby přípravkem XALATAN. Tyto změny mohou vést k rozdílům mezi očima v délce, tloušťce, pigmentaci, počtu řas nebo vellus chloupků a/nebo směru růstu řas. Změny řas jsou po přerušení léčby obvykle reverzibilní.
Manipulace s kontejnerem
Poučte pacienty, aby se špička dávkovacího zásobníku nedostala do kontaktu s okem nebo okolními strukturami, protože by to mohlo způsobit kontaminaci špičky běžnými bakteriemi, o kterých je známo, že způsobují oční infekce. Při použití kontaminovaných roztoků může dojít k vážnému poškození oka a následné ztrátě zraku [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Kdy vyhledat radu lékaře
Poučte pacienty, že pokud se u nich rozvine interkurentní oční stav (např. trauma nebo infekce) nebo podstoupí oční operaci nebo se u nich rozvinou jakékoli oční reakce, zejména zánět spojivek a reakce očních víček, měli by okamžitě vyhledat radu svého lékaře ohledně pokračování v užívání vícenásobné dávky kontejner.
Použití s kontaktními čočkami
Informujte pacienty, že XALATAN 2,5 ml obsahuje benzalkonium-chlorid, který může být absorbován kontaktními čočkami. Před podáním roztoku je třeba vyjmout kontaktní čočky. Čočky lze znovu nasadit 15 minut po podání přípravku XALATAN.
Použití s jinými očními léky
Pokud se používá více než jeden topický oční lék, měly by být léky podávány s odstupem alespoň pěti (5) minut.
