Asacol 400mg Mesalamine Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Asacol 400 mg a jak se používá?
Asacol je lék na předpis používaný k léčbě příznaků ulcerózní kolitidy. Asacol 400 mg lze užívat samostatně nebo s jinými léky.
Asacol patří do třídy léků nazývaných deriváty kyseliny 5-aminosalicylové.
Není známo, zda je přípravek Asacol 400 mg bezpečný a účinný u dětí mladších 5 let.
Jaké jsou možné vedlejší účinky přípravku Asacol 400 mg?
Asacol může způsobit závažné nežádoucí účinky, včetně:
- silná bolest žaludku,
- žaludeční křeče,
- krvavý průjem,
- horečka,
- bolest hlavy,
- vyrážka,
- krvavá nebo dehtovitá stolice,
- vykašlávání krve,
- zvratky, které vypadají jako kávová sedlina,
- malé nebo žádné močení,
- bolestivé nebo obtížné močení,
- otoky nohou nebo kotníků,
- cítit se unaveně,
- dušnost,
- ztráta chuti k jídlu,
- bolest v horní části žaludku,
- snadná tvorba modřin nebo krvácení,
- tmavá moč,
- stolice hliněné barvy, a
- zežloutnutí kůže nebo očí (žloutenka)
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Asacol patří:
- nevolnost,
- zvracení,
- bolest břicha,
- průjem,
- špatné trávení,
- plyn,
- bolest hlavy,
- vyrážka a
- abnormální jaterní testy
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Asacol. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
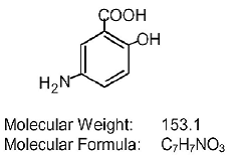
Každá tableta Asacol (mesalamin) s opožděným uvolňováním pro perorální podání obsahuje 400 mg mesalaminu, aminosalicylátu. Tablety Asacol (mesalamin) s opožděným uvolňováním obsahují pryskyřici na bázi akrylu, Eudragit S (kopolymer kyseliny metakrylové typu B, NF), který se rozpouští při pH 7 nebo vyšším a uvolňuje mesalamin v terminálním ileu a dále pro lokální protizánětlivý účinek v tlustém střevě . Mesalamin (také označovaný jako kyselina 5-aminosalicylová nebo 5-ASA) má chemický název kyselina 5-amino-2-hydroxybenzoová. Jeho strukturní vzorec je:
Neaktivní ingredience: Každá tableta obsahuje koloidní oxid křemičitý, dibutylftalát, jedlý černý inkoust, červený oxid železitý, žlutý oxid železitý, monohydrát laktózy, magnesium-stearát, kopolymer B kyseliny methakrylové (Eudragit S), polyethylenglykol, povidon, sodnou sůl glykolátu škrobu a mastek.
INDIKACE
Léčba mírné až středně aktivní ulcerózní kolitidy
Asacol® (mesalamin) tablety s opožděným uvolňováním jsou indikovány k léčbě mírně až středně aktivní ulcerózní kolitidy u pacientů ve věku 5 let a starších.
Udržení remise ulcerózní kolitidy u dospělých
Asacol (mesalamin) tablety s opožděným uvolňováním jsou indikovány k udržení remise ulcerózní kolitidy u dospělých. Bezpečnost a účinnost přípravku Asacol pro udržení remise ulcerózní kolitidy u pediatrických pacientů nebyla stanovena.
DÁVKOVÁNÍ A PODÁVÁNÍ
Dávkování pro léčbu mírné až středně aktivní ulcerózní kolitidy
Dospělí
Pro dospělé je doporučená dávka přípravku Asacol 400 mg dvě 400 mg tablety, které se užívají třikrát denně s jídlem nebo bez jídla (celková denní dávka 2,4 gramů), po dobu 6 týdnů [viz Klinické studie ].
Pediatrie
pediatrických pacientů je doporučená celková denní dávka přípravku Asacol založena na hmotnosti (až do maxima 2,4 gramů/den) (viz tabulka 1). Tablety Asacol 400 mg se užívají dvakrát denně s jídlem nebo bez jídla po dobu 6 týdnů (viz Klinické studie ].
Dávkování pro udržení remise ulcerózní kolitidy u dospělých
Pro dospělé je doporučená dávka Asacolu 1,6 gramu denně, v rozdělených dávkách, s jídlem nebo bez jídla [viz Klinické studie ].
Důležité pokyny pro administraci
Tablety Asacol spolkněte celé. Tablety neřežte, nelámejte ani nežvýkejte.
U dvou tablet Asacol 400 mg se neprokázalo, že jsou bioekvivalentní s jednou tabletou Asacol® HD (mesalamin) s opožděným uvolňováním 800 mg a neměly by být používány zaměnitelně.
Testování před podáním Asacol 400 mg
Před zahájením léčby přípravkem Asacol zhodnoťte funkci ledvin [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
JAK DODÁVÁNO
Dávkové formy A Síly
Asacol (mesalamin) tablety s opožděným uvolňováním: 400 mg (červenohnědé, ve tvaru tobolky s černým potiskem „0752 DR“).
Skladování A Manipulace
Asacol (mesalamin) tablety se zpožděným uvolňováním jsou dostupné jako červenohnědé tablety ve tvaru tobolky obsahující 400 mg mesalaminu s černým potiskem „0752 DR“.
NDC 0430-0752-27 Láhev 180 tablet
Uchovávejte při teplotě 20° až 25° C (68° až 77° F); povolené odchylky 15° až 30° C (59° až 86° F) [Viz USP řízená pokojová teplota ].
Výrobce: Warner Chilcott Deutschland GmbH D-64331 Weiterstadt Německo. Prodává: Warner Chilcott (US), LLC Rockaway, NJ 07866. Revize: říjen 2013
VEDLEJŠÍ EFEKTY
Nejzávažnější nežádoucí účinky pozorované v klinických studiích Asacol nebo s jinými přípravky, které obsahují mesalamin nebo jsou metabolizovány na mesalamin, jsou:
- Porucha funkce ledvin, včetně selhání ledvin [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Syndrom akutní intolerance [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hypersenzitivní reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Jaterní selhání [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Celkově byly tablety Asacol 400 mg hodnoceny u 2 690 pacientů s ulcerózní kolitidou v kontrolovaných a otevřených studiích. Nežádoucí účinky uvedené v následujících částech se mohou objevit bez ohledu na délku léčby a podobné reakce byly hlášeny v krátkodobých a dlouhodobých studiích a po uvedení přípravku na trh.
Klinické studie podporující použití přípravku Asacol 400 mg k léčbě mírně až středně aktivní ulcerózní kolitidy zahrnovaly dvě 6týdenní, placebem kontrolované, randomizované, dvojitě zaslepené studie u dospělých s mírně až středně aktivní ulcerózní kolitidou (studie 1 a 2) a jednu 6týdenní, randomizovaná, dvojitě zaslepená studie 2 dávek u dětí s mírnou až středně aktivní ulcerózní kolitidou. Klinické studie podporující použití přípravku Asacol 400 mg tablety k udržení remise ulcerózní kolitidy zahrnovaly 6měsíční, randomizovanou, dvojitě zaslepenou, placebem kontrolovanou, multicentrickou studii a čtyři aktivně kontrolované udržovací studie porovnávající přípravek Asacol 400 mg tablety se sulfasalazinem . Asacol 400 mg byl v těchto kontrolovaných studiích hodnocen u 427 dospělých a 82 dětí s ulcerózní kolitidou.
Léčba mírné až středně aktivní ulcerózní kolitidy u dospělých
Ve dvou 6týdenních placebem kontrolovaných klinických studiích (studie 1 a 2) zahrnujících 245 pacientů, z nichž 155 bylo randomizováno k léčbě Asacol [viz Klinické studie ], 3,2 procenta pacientů léčených Asacolem přerušilo léčbu kvůli nežádoucím reakcím ve srovnání s 2,2 procenty pacientů léčených placebem. Průměrný věk pacientů ve studii 1 byl 42 let a 48 procent pacientů byli muži. Průměrný věk pacientů ve studii 2 byl 42 let a 59 procent pacientů byli muži. Nežádoucí účinky vedoucí k vysazení přípravku Asacol zahrnovaly (každý u jednoho pacienta): průjem a vzplanutí kolitidy; závratě, nevolnost, bolesti kloubů a bolesti hlavy; vyrážka, letargie a zácpa; sucho v ústech, malátnost, nepohodlí v dolní části zad, mírná dezorientace, mírné zažívací potíže a křeče; bolest hlavy, nevolnost, bolest, zvracení, svalové křeče, ucpaná hlava, ucpané uši a horečka.
Nežádoucí účinky u pacientů léčených přípravkem Asacol vyskytující se s frekvencí nejméně 2 % as četností vyšší než u placeba v 6týdenních, dvojitě zaslepených, placebem kontrolovaných studiích (studie 1 a 2) jsou uvedeny v tabulce 2 níže.
Léčba mírně až středně aktivní ulcerózní kolitidy u dětských pacientů ve věku 5 až 17 let
Randomizovaná, dvojitě zaslepená, 6týdenní studie 2 dávek Asacolu (Studie 3) byla provedena u 82 pediatrických pacientů ve věku 5 až 17 let s mírnou až středně aktivní ulcerózní kolitidou. Všichni pacienti byli rozděleni podle kategorií tělesné hmotnosti (17 až méně než 33 kg, 33 až méně než 54 kg a 54 až 90 kg) a náhodně přiřazeni k podávání nízké dávky (1,2, 2,0 a 2,4 g/den pro příslušné kategorie tělesné hmotnosti) nebo vysokou dávkou (2,0, 3,6 a 4,8 g/den).
Vysoká dávka není schválenou dávkou, protože nebylo zjištěno, že by byla účinnější než schválená dávka [viz DÁVKOVÁNÍ A PODÁVÁNÍ a Klinické studie ].
Délka expozice mesalaminu u 82 pacientů ve studii se pohybovala od 12 do 50 dnů (průměrně 40 dnů v každé dávkové skupině). Většina (88 procent) pacientů v každé skupině byla léčena déle než 5 týdnů. Tabulka 3 uvádí souhrn specifických hlášených nežádoucích účinků (AR).
Dvanáct procent pacientů ve skupině s nízkou dávkou a 5 procent pacientů ve skupině s vysokou dávkou mělo závažné nežádoucí reakce (AR). Ulcerózní kolitida byla hlášena jako závažná AR u jednoho subjektu v každé skupině. Další závažné AR sestávaly ze sinusitidy, bolesti břicha, sníženého indexu tělesné hmotnosti, adenovirové infekce, krvavého průjmu, sklerotizující cholangitidy a pankreatitidy u jednoho jedince ve skupině s nízkou dávkou a anémie a synkopy u jednoho jedince ve skupině s vysokou dávkou.
Sedm pacientů bylo vyřazeno ze studie kvůli AR: 5 (12 procent) ve skupině s nízkou dávkou (ulcerózní kolitida, adenovirová infekce, sklerotizující cholangitida, pankreatitida) a 2 (5 procent) ve skupině s vysokou dávkou (zvýšená amyláza a zvýšená lipáza , bolest v horní části břicha).
Obecně byla povaha a závažnost reakcí u pediatrické populace podobná těm, které byly hlášeny u dospělých pacientů s ulcerózní kolitidou.
Udržování remise ulcerózní kolitidy u dospělých
V 6měsíční placebem kontrolované udržovací studii zahrnující 264 pacientů (studie 4) bylo 177 z nich randomizováno k léčbě Asacolem, šest (3,4 procenta) pacientů užívajících Asacol přerušilo léčbu kvůli nežádoucím reakcím, ve srovnání se čtyřmi (4,6 procenty). pacientů užívajících placebo [viz Klinické studie ]. Průměrný věk pacientů ve studii 4 byl 42 let a 55 procent pacientů byli muži. Nežádoucí účinky vedoucí k ukončení studie u pacientů užívajících Asacol (každý u jednoho pacienta): úzkost; bolest hlavy; pruritus; snížené libido; revmatoidní artritida; a stomatitida a astenie.
Kromě reakcí uvedených v tabulce 2 se u pacientů užívajících Asacol ve studii 4 objevily následující nežádoucí účinky s frekvencí 2 % nebo vyšší: zvětšení břicha, gastroenteritida, gastrointestinální krvácení, infekce, kloubní poruchy, migréna, nervozita, parestézie, rektální poruchy, rektální krvácení, abnormality stolice, tenesmus, frekvence močení, vazodilatace a poruchy vidění.
3342 pacientů v nekontrolovaných klinických studiích se následující nežádoucí účinky vyskytly s frekvencí 5 procent nebo vyšší a zdálo se, že se frekvence zvyšovala se zvyšující se dávkou: astenie, horečka, chřipkový syndrom, bolest, bolest břicha, bolest zad, plynatost, gastrointestinální krvácení artralgie a rýma.
Postmarketingové zkušenosti
Kromě výše uvedených nežádoucích účinků v klinických studiích zahrnujících přípravek Asacol byly během používání přípravku Asacol 400 mg a dalších přípravků obsahujících mesalamin zjištěny níže uvedené nežádoucí účinky. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Tělo jako celek: Bolest krku, otok obličeje, edém, lupus-like syndrom, horečka po drogách.
Kardiovaskulární: Perikarditida, myokarditida [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Gastrointestinální: Anorexie, pankreatitida, gastritida, zvýšená chuť k jídlu, cholecystitida, sucho v ústech, vředy v ústech, perforovaný peptický vřed krvavý průjem.
Hematologické: Agranulocytóza aplastická anémie, trombocytopenie, eozinofilie, leukopenie, anémie, lymfadenopatie.
Muskuloskeletální: Dna.
Nervový: Deprese, somnolence, emoční labilita, hyperestezie, vertigo, zmatenost, třes, periferní neuropatie, transverzální myelitida, Guillain-Barrého syndrom.
Renální: Selhání ledvin, intersticiální nefritida, nefropatie s minimálními změnami [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Respirační/Plicní: Eozinofilní pneumonie, intersticiální pneumonitida, exacerbace astmatu, pleuritida.
Kůže: Alopecie, psoriáza, pyoderma gangrenosus, suchá kůže, erythema nodosum, kopřivka.
Speciální smysly: Bolest očí, chuťová perverze, rozmazané vidění, tinitus.
Urogenitální: Dysurie, nutkání na močení, hematurie, epididymitida, menoragie, reverzibilní oligospermie.
Laboratorní abnormality: Zvýšená AST (SGOT) nebo ALT (SGPT), zvýšená alkalická fosfatáza, zvýšená GGT, zvýšená LDH, zvýšený bilirubin, zvýšený sérový kreatinin a BUN.

DROGOVÉ INTERAKCE
Nebyly provedeny žádné formální studie lékových interakcí s použitím přípravku Asacol 400 mg s jinými léky. Byly však hlášeny následující interakce mezi produkty obsahujícími mesalamin a jinými léky.
Nefrotoxické látky, včetně nesteroidních protizánětlivých léků
Současné užívání mesalaminu se známými nefrotoxickými látkami, včetně nesteroidních protizánětlivých léků (NSAID), může zvýšit riziko renálních reakcí (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Azathioprin nebo 6-merkaptopurin
Současné užívání mesalaminu s azathioprinem nebo 6-merkaptopurinem může zvýšit riziko onemocnění krve.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Renální poškození
Poškození ledvin, včetně nefropatie s minimálními změnami, akutní a chronické intersticiální nefritidy a selhání ledvin, bylo hlášeno u pacientů užívajících přípravky, jako je Asacol 400 mg, které obsahují mesalamin nebo jsou přeměněny na mesalamin.
Doporučuje se, aby pacienti před zahájením léčby přípravkem Asacol 400 mg a pravidelně během léčby podstoupili vyhodnocení funkce ledvin.
Předepisující lékaři by měli pečlivě zhodnotit rizika a přínosy při použití přípravku Asacol u pacientů se známou poruchou funkce ledvin nebo s anamnézou onemocnění ledvin (viz DROGOVÉ INTERAKCE a Neklinická toxikologie ].
Syndrom akutní intolerance vyvolaný mesalaminem
Mesalamin je spojován se syndromem akutní intolerance, který může být obtížné odlišit od exacerbace ulcerózní kolitidy. Přestože přesná frekvence výskytu nebyla stanovena, došlo k němu ve 3 procentech kontrolovaných klinických studií mesalaminu nebo sulfasalazinu. Příznaky zahrnují křeče, bolesti břicha, krvavý průjem a někdy horečku, bolest hlavy a vyrážku. Během léčby pacienty pečlivě sledujte, zda se tyto příznaky nezhorší. Při podezření na syndrom akutní intolerance okamžitě přerušte léčbu přípravkem Asacol.
Hypersenzitivní reakce
Někteří pacienti, u kterých se vyskytla reakce přecitlivělosti na sulfasalazin, mohou mít podobnou reakci na přípravek Asacol 400 mg nebo na jiné sloučeniny, které obsahují mesalamin nebo jsou na něj přeměněny.
přípravku Asacol a dalších mesalaminových léků byly hlášeny srdeční hypersenzitivní reakce vyvolané mesalaminem (myokarditida a perikarditida). Při předepisování tohoto léčivého přípravku pacientům s predispozicí k rozvoji myokarditidy nebo perikarditidy je třeba postupovat opatrně.
Jaterní selhání
U pacientů s již existujícím onemocněním jater, kterým byl podáván mesalamin, byly hlášeny případy selhání jater. Při podávání přípravku Asacol pacientům s onemocněním jater je třeba postupovat opatrně.
Prodloužená retence žaludku u pacientů s horní gastrointestinální obstrukcí
Organická nebo funkční obstrukce v horní části gastrointestinálního traktu může způsobit prodlouženou žaludeční retenci přípravku Asacol 400 mg, která by zpomalila uvolňování mesalaminu v tlustém střevě.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Mesalamin nebyl karcinogenní při dietních dávkách až 480 mg/kg/den u potkanů a 2000 mg/kg/den u myší, což je asi 2,9 a 6,1násobek maximální doporučené udržovací dávky přípravku Asacol 400 mg 1,6 g/den nebo 26,7 mg/kg/den, vztaženo na 60 kg tělesné hmotnosti, v daném pořadí, na základě tělesného povrchu.
Mutageneze
Mesalamin byl negativní v Amesově testu na mutagenezi, negativní na indukci sesterských chromatidových výměn (SCE) a chromozomálních aberací v buňkách vaječníků čínského křečka in vitro a negativní na indukci mikrojader (MN) v polychromatických erytrocytech kostní dřeně myší.
Zhoršení plodnosti
Bylo zjištěno, že mesalamin v perorálních dávkách až do 480 mg/kg/den (přibližně 1,9násobek doporučené léčebné dávky pro člověka na základě tělesného povrchu) nemá žádný vliv na fertilitu nebo reprodukční schopnost samců a samic potkanů.
Použití u konkrétních populací
Těhotenství
Kategorie těhotenství C
Shrnutí rizik
Neexistují žádné adekvátní a dobře kontrolované studie použití přípravku Asacol 400 mg u těhotných žen. Omezené publikované údaje o mesalaminu u lidí neukazují žádné zvýšení celkového počtu vrozených malformací. Některá data ukazují zvýšenou míru předčasných porodů, mrtvě narozených dětí a nízkou porodní hmotnost; tyto nepříznivé výsledky těhotenství jsou však také spojeny s aktivním zánětlivým onemocněním střev. Kromě toho všechna těhotenství, bez ohledu na expozici léku, mají základní míru 2 až 4 procenta velkých malformací a 15 až 20 procent ztráty těhotenství. V reprodukčních studiích na zvířatech s mesalaminem u potkanů a králíků nebyly pozorovány žádné známky poškození plodu při perorálních dávkách přibližně 1,9krát (potkan) a 3,9krát (králík) doporučené dávky pro člověka. Dibutylftalát (DBP) je však neaktivní složkou enterosolventního povlaku Asacol a ve studiích na zvířatech na potkanech v dávkách vyšších než 190krát vyšší než je dávka pro člověka na základě plochy povrchu těla, byl mateřský DBP spojen s vnějšími a kosterními malformacemi a nežádoucími účinky na mužského reprodukčního systému. Asacol 400 mg by se měl během těhotenství užívat pouze tehdy, pokud potenciální přínos ospravedlňuje potenciální riziko pro plod.
Lidská data
Mesalamin prochází placentou. V prospektivních a retrospektivních studiích s více než 600 ženami vystavenými mesalaminu během těhotenství nebyla pozorovaná četnost vrozených malformací zvýšena nad základní četnost v běžné populaci. Některé údaje ukazují zvýšenou míru předčasných porodů, mrtvě narozených dětí a nízkou porodní hmotnost, ale není jasné, zda to bylo způsobeno základním onemocněním matky, expozicí lékům nebo obojím, protože aktivní zánětlivé onemocnění střev je také spojeno s nepříznivými výsledky těhotenství.
Údaje o zvířatech
Reprodukční studie s mesalaminem byly provedeny během organogeneze u potkanů a králíků při perorálních dávkách až 480 mg/kg/den. Nebylo prokázáno poškození plodnosti nebo poškození plodu. Tyto dávky mesalaminu byly asi 1,9krát (potkan) a 3,9krát (králík) doporučené dávky pro člověka, na základě plochy povrchu těla.
Dibutylftalát (DBP) je neaktivní složka enterosolventního povlaku Asacol. Denní příjem DBP u člověka z maximální doporučené dávky tablet Asacol je asi 21 mg. Publikované zprávy u potkanů ukazují, že potomci samců potkanů vystavení in utero DBP (vyšší nebo rovno 100 mg/kg/den, přibližně 39násobek lidské dávky na základě plochy povrchu těla), vykazují aberace reprodukčního systému kompatibilní s narušením androgenní závislosti. rozvoj. Klinický význam tohoto nálezu u potkanů není znám. Při vyšších dávkách (vyšších nebo rovných 500 mg/kg/den, což je přibližně 194násobek lidské dávky na základě tělesného povrchu), další účinky, včetně kryptorchismu, hypospadie, atrofie nebo ageneze pohlavních přídatných orgánů, poranění varlat, snížené denně je zaznamenána produkce spermií, trvalá retence bradavek a zmenšená anogenitální vzdálenost. Ženské potomstvo není ovlivněno. Vysoké dávky DBP podávané březím potkanům byly spojeny se zvýšeným výskytem vývojových abnormalit, jako je rozštěp patra (vyšší nebo roven 630 mg/kg/den, přibližně 244krát vyšší než dávka pro člověka, na základě plochy povrchu těla) a kosterní abnormality (vyšší nebo rovné 750 mg/kg/den, asi 290násobek lidské dávky na základě tělesného povrchu) u potomků.
Kojící matky
Mesalamin a jeho N-acetyl metabolit jsou přítomny v mateřském mléce. V publikovaných laktačních studiích se dávky mesalaminu pro matku z různých perorálních a rektálních formulací a produktů pohybovaly od 500 mg do 3 g denně. Koncentrace mesalaminu v mléce se pohybovala od nedetekovatelné do 0,11 mg/l. Koncentrace metabolitu kyseliny N-acetyl-5-aminosalicylové se pohybovala od 5 do 18,1 mg/l. Na základě těchto koncentrací jsou odhadované kojenecké denní dávky pro výlučně kojené dítě 0 až 0,017 mg/kg/den mesalaminu a 0,75 až 2,72 mg/kg/den kyseliny N-acetyl-5-aminosalicylové.
Dibutylftalát (DBP), neaktivní složka enterosolventního potahu tablet Asacol 400 mg, a jeho primární metabolit mono-butylftalát (MBP) jsou vylučovány do lidského mléka. Klinický význam tohoto nebyl stanoven.
Je třeba zvážit vývojové a zdravotní přínosy kojení spolu s klinickou potřebou matky Asacol 400 mg a veškerými potenciálními nežádoucími účinky léku nebo základního stavu matky na kojené dítě. Při podávání přípravku Asacol 400 mg kojící ženě buďte opatrní.
Pediatrické použití
Bezpečnost a účinnost přípravku Asacol 400 mg u pediatrických pacientů ve věku 5 až 17 let pro léčbu mírné až středně aktivní ulcerózní kolitidy byla stanovena po dobu 6 týdnů. Použití přípravku Asacol v těchto věkových skupinách je podpořeno důkazy z adekvátních a dobře kontrolovaných studií přípravku Asacol 400 mg u dospělých a jedné studie u pediatrických pacientů (viz NEŽÁDOUCÍ REAKCE , KLINICKÁ FARMAKOLOGIE a Klinické studie ].
Asacol 400 mg byl studován v randomizované, dvojitě zaslepené, 6týdenní léčebné studii s paralelními skupinami se dvěma úrovněmi dávek přípravku Asacol 400 mg u 82 pediatrických pacientů ve věku 5 až 17 let s mírnou až středně aktivní ulcerózní kolitidou. Všichni pacienti byli rozděleni podle hmotnostní kategorie (17 až méně než 33 kg, 33 až méně než 54 kg a 54 až 90 kg) a náhodně přiřazeni k podávání nízké dávky (1,2, 2,0 a 2,4 g/den pro příslušnou hmotnost kategorie) nebo vysokou dávkou (2,0, 3,6 a 4,8 g/den). Základní a screeningové návštěvy byly následovány léčebným obdobím 6 týdnů [viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Vysoká dávka nebyla účinnější než nízká dávka a není schválenou dávkou [viz Klinické studie ].
Bezpečnost a účinnost přípravku Asacol u pediatrických pacientů mladších 5 let nebyla stanovena. Bezpečnost a účinnost přípravku Asacol při udržování remise ulcerózní kolitidy u pediatrických pacientů nebyla stanovena.
Geriatrické použití
Klinické studie přípravku Asacol nezahrnovaly dostatečný počet subjektů ve věku 65 a více let, aby bylo možné určit, zda reagují odlišně než mladší subjekty. Jiné hlášené klinické zkušenosti nezjistily rozdíly v odpovědi mezi staršími a mladšími pacienty. Obecně platí, že při předepisování přípravku Asacol je třeba vzít v úvahu vyšší frekvenci snížené funkce jater, ledvin nebo srdce a souběžného onemocnění nebo jiné lékové terapie u starších pacientů. Zprávy z nekontrolovaných klinických studií a postmarketingových systémů hlášení naznačují vyšší výskyt krevních dyskrazií, tj. agranulocytózy, neutropenie, pancytopenie, u subjektů užívajících přípravek Asacol ve věku 65 let nebo starších. Během léčby přípravkem Asacol je třeba pečlivě sledovat počet krvinek.
Renální poškození
Je známo, že mesalamin je v podstatě vylučován ledvinami a riziko toxických reakcí na tento lék může být větší u pacientů s poruchou funkce ledvin. Protože u starších pacientů je pravděpodobnější snížená funkce ledvin, je třeba při předepisování této lékové terapie postupovat opatrně. Doporučuje se, aby všichni pacienti měli před zahájením léčby přípravkem Asacol a pravidelně během léčby přípravkem Asacol vyhodnocení funkce ledvin (viz DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
PŘEDÁVKOVAT
Neexistuje žádné specifické antidotum pro předávkování mesalaminem a léčba při podezření na akutní závažnou toxicitu přípravkem Asacol by měla být symptomatická a podpůrná. To může zahrnovat prevenci další absorpce gastrointestinálního traktu, úpravu nerovnováhy elektrolytů v tekutinách a udržení adekvátní funkce ledvin. Asacol 400 mg je přípravek s opožděným uvolňováním závislý na pH a tento faktor je třeba vzít v úvahu při léčbě podezření na předávkování.
KONTRAINDIKACE
Asacol je kontraindikován u pacientů se známou přecitlivělostí na salicyláty nebo aminosalicyláty nebo na kteroukoli složku přípravku Asacol (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , NEŽÁDOUCÍ REAKCE , a POPIS ].
ASACOL (mesalamin) tablety s opožděným uvolňováním pro perorální podání
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Mechanismus účinku mesalaminu není znám, ale zdá se, že je spíše lokální než systémový. Slizniční produkce metabolitů kyseliny arachidonové, a to jak cestou cyklooxygenázy, tj. prostanoidů, tak cestou lipoxygenázy, tj. leukotrienů a hydroxyeikosatetraenových kyselin, je u pacientů s chronickou ulcerózní kolitidou zvýšená a je možné, že mesalamin zmírňuje zánět. blokuje cyklooxygenázu a inhibuje produkci prostaglandinů v tlustém střevě.
Farmakokinetika
Vstřebávání
Přibližně 28 procent mesalaminu v tabletách Asacol 400 mg se absorbuje po perorálním požití. Absorpce mesalaminu je podobná u jedinců nalačno a nakrmených. Hodnota T max mesalaminu a jeho metabolitu je obvykle opožděná, což odráží opožděné uvolňování, a pohybuje se od 4 do 16 hodin.
Metabolismus
Absorbovaný mesalamin je rychle acetylován ve stěně střevní sliznice a v játrech na kyselinu N-acetyl-5-aminosalicylovou.
Vylučování
Absorbovaný mesalamin je vylučován převážně ledvinami jako kyselina N-acetyl-5-aminosalicylová. Neabsorbovaný mesalamin se vylučuje stolicí.
Po intravenózním podání je poločas eliminace mesalaminu uváděn přibližně 40 minut. Po perorálním podání jsou konečné hodnoty t½ pro mesalamin a kyselinu N-acetyl-5-aminosalicylovou obvykle asi 12 hodin, ale jsou různé, v rozmezí od 2 do 15 hodin. Existuje velká interindividuální a intraindividuální variabilita v plazmatických koncentracích mesalaminu a kyseliny N-acetyl-5-aminosalicylové a v jejich eliminačních poločasech po podání Asacolu.
Specifické populace
Pediatričtí pacienti
Ve farmakokinetické studii s rozsahem dávek hodnotící dávky 30, 60 a 90 mg/kg/den přípravku Asacol 400 mg podávané dvakrát denně po dobu čtyř týdnů se průměrné hodnoty Cavg mesalaminu u pediatrických pacientů s ulcerózní kolitidou pohybovaly od přibližně 400 ng/ml do 2100 ng. /ml na základě údajů ze všech úrovní dávek.
Ve studii u pediatrických pacientů s ulcerózní kolitidou (studie 3) byly průměrné plazmatické koncentrace mesalaminu (na základě řídkého odběru vzorků) 820 až 988 ng/ml při nízké dávce (tj. 1,2, 2,0 nebo 2,4 g/den na základě vrstvy tělesné hmotnosti 17 až více než 33 kg, 33 až méně než 54 kg a 54 až méně než 90 kg, v tomto pořadí).
Toxikologie zvířat a/nebo farmakologie
Ve studiích na zvířatech (krysy, myši, psi) byly ledviny hlavním orgánem toxicity. (V následujícím je srovnání dávkování pro zvířata s doporučeným dávkováním pro člověka založeno na ploše povrchu těla a dávce 2,4 g/den pro osobu o hmotnosti 60 kg.)
Mesalamin způsobuje renální papilární nekrózu u potkanů v jednotlivých dávkách přibližně 750 mg/kg až 1000 mg/kg (přibližně 3 až 4násobek doporučené dávky pro člověka na základě tělesného povrchu). Dávky 170 a 360 mg/kg/den (asi 0,7 a 1,5násobek doporučené dávky pro člověka na základě tělesného povrchu) podávané krysám po dobu šesti měsíců vyvolaly papilární nekrózu, papilární edém, tubulární degeneraci, tubulární mineralizaci a uroteliální hyperplazii.
U myší způsobily orální dávky 4000 mg/kg/den mesalaminu (přibližně 8násobek doporučené dávky pro člověka na základě tělesného povrchu) po dobu tří měsíců tubulární nefrózu, multifokální/difuzní tubulo-intersticiální zánět a multifokální/difuzní papilární nekrózu.
psů vedly jednotlivé dávky 6000 mg (přibližně 8násobek doporučené dávky pro člověka na základě tělesného povrchu) mesalaminových tablet s opožděným uvolňováním k renální papilární nekróze, ale nebyly smrtelné. U psů, kterým byl chronicky podáván mesalamin v dávkách 80 mg/kg/den (1,1násobek doporučené dávky pro člověka na základě tělesného povrchu), došlo k renálním změnám.
Klinické studie
Léčba mírné až středně aktivní ulcerózní kolitidy
Dospělí
Dvě placebem kontrolované studie (studie 1 a 2) prokázaly účinnost tablet Asacol u pacientů s mírnou až středně aktivní ulcerózní kolitidou.
jedné randomizované, dvojitě zaslepené, multicentrické studii se 158 pacienty (studie 1) byly dávky přípravku Asacol 1,6 g/den a 2,4 g/den po dobu 6 týdnů srovnávány s placebem. Bodovací systém pro stanovení účinnosti léčby zahrnoval hodnocení frekvence stolice, krvácení z konečníku, sigmoidoskopické nálezy, funkční hodnocení pacienta a celkové hodnocení lékařem. Při dávce 2,4 g/den vykazovalo 21 ze 43 (49 procent) pacientů užívajících tablety Asacol zlepšení sigmoidoskopického vzhledu střeva ve srovnání s 12 ze 44 (27 procent) pacientů užívajících placebo (p = 0,048). Kromě toho významně více pacientů ve skupině s tabletami Asacol 2,4 g/den vykazovalo zlepšení rektálního krvácení a frekvence stolice. Dávka 1,6 g/den nepřinesla konzistentní důkaz účinnosti.
Ve druhé randomizované, dvojitě zaslepené, placebem kontrolované klinické studii v délce 6 týdnů u 87 pacientů (studie 2) vedly tablety Asacol v dávce 4,8 g/den po dobu 6 týdnů k sigmoidoskopickému zlepšení u 28 z 38 (74 procent) pacientů ve srovnání s 10 z 38 (26 procent) pacientů s placebem (p méně než 0,001). Také více pacientů ve skupině Asacol 400 mg tablety 4,8 g/den než ve skupině s placebem vykázalo zlepšení celkových příznaků.
Dávka 4,8 g/den není schválenou dávkou pro léčbu mírné až středně aktivní ulcerózní kolitidy.
Pediatrie
Bezpečnost a účinnost přípravku Asacol 400 mg u pediatrických pacientů ve věku 5 až 17 let pro léčbu mírné až středně aktivní ulcerózní kolitidy je podpořena důkazy z adekvátních a dobře kontrolovaných studií přípravku Asacol 400 mg u dospělých a jedné studie u pediatrických pacientů.
Randomizovaná, dvojitě zaslepená, 6týdenní studie 2 dávek Asacolu (Studie 3) byla provedena u 82 pediatrických pacientů ve věku 5 až 17 let s mírnou nebo středně aktivní ulcerózní kolitidou. Všichni pacienti byli rozděleni podle hmotnostní kategorie (17 až méně než 33 kg, 33 až méně než 54 kg a 54 až 90 kg) a náhodně přiřazeni k podávání nízké dávky (1,2, 2,0 a 2,4 g/den pro příslušnou hmotnost kategorie) nebo vysokou dávkou (2,0, 3,6 a 4,8 g/den). Dávky byly podávány každých 12 hodin.
Podíl pacientů, kteří dosáhli úspěchu na základě Truncated Mayo Score (TM-Mayo) (na základě frekvence stolice a subskóre rektálního krvácení podle Mayo skóre) a na základě indexu aktivity dětské ulcerózní kolitidy (PUCAI) (který zahrnoval hodnocení bolest břicha, rektální krvácení, konzistence a frekvence stolice, přítomnost nočního pohybu střev a úroveň aktivity) byla měřena po 6 týdnech léčby. Úspěch na základě TM-Mayo byl definován jako buď částečná odpověď (zlepšení od výchozí hodnoty ve frekvenci stolice nebo dílčí skóre krvácení z konečníku bez zhoršení u druhého), nebo jako úplná odpověď (podskóre frekvence stolice i dílčí skóre krvácení z konečníku se rovnají 0). Úspěch na základě PUCAI byl definován buď jako částečná odpověď (snížení PUCAI o více než nebo rovné 20 bodům od výchozího stavu do týdne 6 se skóre v týdnu 6 vyšším nebo rovným 10) nebo jako úplná odpověď (PUCAI méně než 10 v týdnu 6).
Ve skupině s nízkou dávkou bylo 41 pacientů a ve skupině s vysokou dávkou 41 pacientů, kteří dostali alespoň jednu dávku Asacolu; Studii dokončilo 36 pacientů v každé dávkové skupině. Pacienti byli považováni za neúspěšné v léčbě, pokud nedosáhli úspěchu nebo odpadli kvůli nežádoucí reakci nebo nedostatečné účinnosti.
V týdnu 6 dosáhlo úspěchu na základě TM-Mayo 73,2 procent pacientů ve skupině s nízkou dávkou a 70,0 procenta pacientů ve skupině s vysokou dávkou; Kompletní odpovědi dosáhlo 34,1 procent pacientů ve skupině s nízkou dávkou a 42,5 procenta pacientů ve skupině s vysokou dávkou. V týdnu 6 dosáhlo úspěchu na základě PUCAI 56,1 procent pacientů ve skupině s nízkou dávkou a 55,0 procenta pacientů ve skupině s vysokou dávkou; Kompletní odpověď dosáhlo 46,3 procent pacientů ve skupině s nízkou dávkou a 42,5 procenta pacientů ve skupině s vysokou dávkou.
Vysoká dávka nebyla účinnější než nízká dávka a není schválenou dávkou [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Udržení remise ulcerózní kolitidy u dospělých
Šestiměsíční, randomizovaná, dvojitě zaslepená, placebem kontrolovaná, multicentrická studie (studie 4) zahrnovala 264 pacientů léčených přípravkem Asacol 400 mg tablety 0,8 g/den (n = 90), 1,6 g/den (n = 87) nebo placebo (n = 87). V rameni s 0,8 g/den byla pacientům podávána dávka dvakrát denně; v rameni s 1,6 g/den byli pacienti podáváni čtyřikrát denně. Podíl pacientů léčených dávkou 0,8 g/den, kteří udrželi endoskopickou remisi, nebyl ve srovnání s placebem statisticky významný. Podíl pacientů užívajících tablety Asacol 1,6 g/den, kteří udrželi endoskopickou remisi ulcerózní kolitidy, byl u 61 z 87 (70,1 procenta) ve srovnání se 42 z 87 (48,3 procenta) pacientů s placebem (p = 0,005).
Souhrnná analýza účinnosti 4 udržovacích studií porovnávala tablety Asacol 400 mg v dávkách 0,8 g/den až 2,8 g/den v rozdělených dávkách v rozmezí od dvakrát denně do čtyřkrát denně se sulfasalazinem v dávkách 2 g/den až 4 g/den. Úspěch léčby byl pozorován u 59 z 98 (59 procent) pacientů užívajících tablety Asacol a 70 ze 102 (69 procent) pacientů užívajících sulfasalazin, což je nevýznamný rozdíl.
INFORMACE PRO PACIENTA
- Poučte pacienty, aby tablety přípravku Asacol polykali celé, přičemž dbejte na to, aby se tablety nerozlomily, nerozřezaly nebo nerozkousaly, protože potah je důležitou součástí přípravku s opožděným uvolňováním.
- Informujte pacienty, že pokud přecházejí z předchozí perorální léčby mesalaminem na přípravek Asacol, měli by přerušit předchozí perorální léčbu mesalaminem a řídit se pokyny pro dávkování přípravku Asacol. Informujte pacienty, že by neměli nahrazovat dvě tablety Asacol 400 mg jednou tabletou Asacol 400 mg HD 800 mg [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
- Informujte pacienty, že ve stolici byly hlášeny neporušené, částečně neporušené a/nebo obaly tablet. Poučte pacienty, aby kontaktovali svého lékaře, pokud k tomu dochází opakovaně.
- Poučte pacienty, aby přípravek Asacol 400 mg tablety chránili před vlhkostí. Poučte pacienty, aby nádobu těsně uzavřeli a nechali v láhvi spolu s tabletami všechny sáčky s vysoušedlem.
- Informujte ženy, které jsou těhotné, kojící nebo ve fertilním věku, že přípravek Asacol 400 mg obsahuje dibutylftalát, který byl ve studiích na zvířatech spojován s malformacemi a nežádoucími účinky na mužský reprodukční systém. Dibutylftalát se vylučuje do mateřského mléka.
