Ceftin 250mg, 500mg, 125mg Cefuroxime Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Ceftin 500 mg a jak se používá?
Ceftin 500 mg je lék na předpis používaný k léčbě příznaků bakteriálních infekcí. Ceftin lze užívat samostatně nebo s jinými léky.
Ceftin 250 mg je cefalosporinové antibiotikum.
Není známo, zda je Ceftin bezpečný a účinný u dětí mladších 3 měsíců.
Jaké jsou možné vedlejší účinky přípravku Ceftin?
Ceftin 250 mg může způsobit závažné nežádoucí účinky, včetně:
- silná bolest žaludku,
- průjem (s krví nebo bez krve),
- zežloutnutí kůže nebo očí,
- vyrážka,
- modřiny,
- silné brnění nebo necitlivost,
- záchvat (křeče),
- obtížné nebo bolestivé močení,
- otoky nohou, kotníků, obličeje nebo jazyka,
- únava,
- dušnost,
- horečka,
- bolest krku,
- pálení ve tvých očích,
- bolest kůže s červenou nebo fialovou vyrážkou,
- kožní puchýře a loupání
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Ceftin patří:
- průjem,
- nevolnost,
- zvracení,
- neobvyklá nebo nepříjemná chuť v ústech,
- plenková vyrážka u kojence,
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku Ceftin. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
CEFTIN 500 mg tablety a CEFTIN pro perorální suspenzi obsahují cefuroxim jako cefuroxim axetil. CEFTIN je semisyntetické cefalosporinové antibakteriální léčivo pro perorální podání.
Chemický název cefuroxim axetilu (1-(acetyloxy)ethylester cefuroximu) je (RS)-1-hydroxyethyl (6R,7R)-7-[2-(2-furyl)glyoxyl-amido]-3-(hydroxymethyl 72-(Z)-(0-methyloxim), 1-acetát-3-karbamát)-8-oxo-5-thia-l-azabicyklo[4.2.0]okt-2-en-2-karboxylát. Jeho molekulový vzorec je C20H22N4O10S a má molekulovou hmotnost 510,48.
Cefuroxim axetil je v amorfní formě a má následující strukturní vzorec:
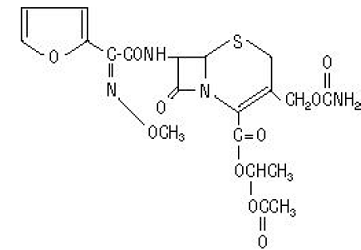
Tablety jsou potahované a obsahují ekvivalent 250 nebo 500 mg cefuroximu jako cefuroxim axetil. Tablety obsahují neaktivní složky koloidní oxid křemičitý, sodnou sůl kroskarmelózy, hydrogenovaný rostlinný olej, hypromelózu, methylparaben, mikrokrystalickou celulózu, propylenglykol, propylparaben, benzoát sodný, laurylsulfát sodný a oxid titaničitý.
Perorální suspenze po rekonstituci vodou poskytuje ekvivalent 125 mg nebo 250 mg cefuroximu (jako cefuroxim axetil) na 5 ml. Perorální suspenze obsahuje neaktivní složky acesulfam draselný, aspartam, povidon K30, kyselinu stearovou, sacharózu, tutti-frutti příchuť a xanthanovou gumu.
INDIKACE
Faryngitida/tonzilitida
CEFTIN 125 mg tablety je indikován k léčbě dospělých pacientů a dětských pacientů (13 let a starších) s mírnou až středně těžkou faryngitidou/tonzilitidou způsobenou citlivými kmeny Streptococcus pyogenes.
CEFTIN 500 mg ve formě perorální suspenze je indikován k léčbě pediatrických pacientů ve věku od 3 měsíců do 12 let s mírnou až středně těžkou faryngitidou/tonzilitidou způsobenou citlivými kmeny Streptococcus pyogenes.
Omezení použití
- Účinnost přípravku CEFTIN v prevenci revmatické horečky nebyla v klinických studiích prokázána.
- Účinnost přípravku CEFTIN 125 mg v léčbě kmenů Streptococcus pyogenes rezistentních na penicilin nebyla v klinických studiích prokázána.
Akutní bakteriální zánět středního ucha
CEFTIN 125 mg tablety je indikován k léčbě dětských pacientů (kteří mohou polykat tablety celé) s akutním bakteriálním zánětem středního ucha způsobeným citlivými kmeny Streptococcus pneumoniae, Haemophilus influenzae (včetně kmenů produkujících β-laktamázu), Moraxella catarrhalis (včetně β-laktamázy -produkující kmeny) nebo Streptococcus pyogenes.
CEFTIN pro perorální suspenzi je indikován k léčbě dětských pacientů ve věku od 3 měsíců do 12 let s akutním bakteriálním zánětem středního ucha způsobeným citlivými kmeny Streptococcus pneumoniae, Haemophilus influenzae (včetně kmenů produkujících β-laktamázu), Moraxella catarrhalis (včetně β-laktamázy -produkující kmeny) nebo Streptococcus pyogenes.
Akutní bakteriální maxilární sinusitida
Tablety CEFTIN jsou indikovány k léčbě dospělých a dětských pacientů (13 let a starších) s mírnou až středně těžkou akutní bakteriální maxilární sinusitidou způsobenou citlivými kmeny Streptococcus pneumoniae nebo Haemophilus influenzae (pouze kmeny neprodukující β-laktamázu).
CEFTIN 250 mg ve formě perorální suspenze je indikován k léčbě dětských pacientů ve věku od 3 měsíců do 12 let s mírnou až středně těžkou akutní bakteriální maxilární sinusitidou způsobenou citlivými kmeny Streptococcus pneumoniae nebo Haemophilus influenzae (pouze kmeny neprodukující β-laktamázu). .
Omezení použití
Účinnost přípravku CEFTIN na sinusové infekce způsobené Haemophilus influenzae nebo Moraxella catarrhalis produkujícími β-laktamázu u pacientů s akutní bakteriální maxilární sinusitidou nebyla stanovena kvůli nedostatečnému počtu těchto izolátů v klinických studiích [viz Klinické studie ].
Akutní bakteriální exacerbace chronické bronchitidy
Tablety CEFTIN jsou indikovány k léčbě dospělých pacientů a dětských pacientů (ve věku 13 let a starších) s mírnými až středně těžkými akutními bakteriálními exacerbacemi chronické bronchitidy způsobenými citlivými kmeny Streptococcus pneumoniae, Haemophilus influenzae (kmeny negativní na β-laktamázu), nebo Haemophilus para influenzae (p-laktamáza-negativní kmeny).
Nekomplikované infekce kůže a kožní struktury
Tablety CEFTIN 250 mg jsou indikovány k léčbě dospělých pacientů a dětských pacientů (ve věku 13 let a starších) s nekomplikovanými infekcemi kůže a kožní struktury způsobenými citlivými kmeny Staphylococcus aureus (včetně kmenů produkujících β-laktamázu) nebo Streptococcus pyogenes.
Nekomplikované infekce močových cest
CEFTIN 500 mg tablety je indikován k léčbě dospělých pacientů a dětských pacientů (ve věku 13 let a starších) s nekomplikovanými infekcemi močových cest způsobenými citlivými kmeny Escherichia coli nebo Klebsiella pneumoniae.
Nekomplikovaná kapavka
Tablety CEFTIN jsou indikovány k léčbě dospělých pacientů a dětských pacientů (ve věku 13 let a starších) s nekomplikovanou kapavkou, uretrální a endocervikální, způsobenou kmeny Neisseria gonorrhoeae produkujícími a neprodukujícími penicilinázu citlivými na penicilinázu a nekomplikovanou kapavkou, rektální, u žen , způsobeného kmeny Neisseria gonorrhoeae, které neprodukují penicilinázu.
Časná lymská borelióza (erythema migrans)
Tablety CEFTIN jsou indikovány k léčbě dospělých pacientů a dětských pacientů (ve věku 13 let a starších) s časnou lymskou boreliózou (erythema migrans) způsobenou citlivými kmeny Borrelia burgdorferi.
Impetigo
CEFTIN 250 mg ve formě perorální suspenze je indikován k léčbě pediatrických pacientů ve věku od 3 měsíců do 12 let s impetigo způsobeným citlivými kmeny Staphylococcus aureus (včetně kmenů produkujících plaztamázu) nebo Streptococcus pyogenes.
Používání
Ke snížení rozvoje bakterií rezistentních vůči lékům a zachování účinnosti přípravku CEFTIN a dalších antibakteriálních léků by měl být přípravek CEFTIN 500 mg používán pouze k léčbě nebo prevenci infekcí, u kterých je prokázáno nebo existuje silné podezření, že jsou způsobeny citlivými bakteriemi. Pokud jsou k dispozici informace o kultivaci a citlivosti, je třeba je vzít v úvahu při výběru nebo úpravě antibakteriální terapie. Při absenci takových údajů mohou k empirickému výběru terapie přispět místní epidemiologie a vzorce citlivosti.
DÁVKOVÁNÍ A PODÁVÁNÍ
Důležité pokyny pro administraci
- Tablety CEFTIN a CEFTIN pro perorální suspenzi nejsou bioekvivalentní, a proto je nelze nahradit na základě miligramů na miligram [viz KLINICKÁ FARMAKOLOGIE ].
- Podávejte CEFTIN tablety nebo perorální suspenzi, jak je popsáno v příslušných pokynech pro dávkování [viz Dávkování pro CEFTIN 500 mg tablety, Dávkování pro CEFTIN 250 mg pro perorální suspenzi a Příprava a podávání přípravku CEFTIN 125 mg pro perorální suspenzi ].
- Tablety CEFTIN 500 mg podávejte s jídlem nebo bez jídla.
- CEFTIN 500 mg pro perorální suspenzi podávejte s jídlem.
- Pediatričtí pacienti (ve věku 13 let a starší), kteří nemohou spolknout tablety CEFTIN 125 mg celé, by měli dostat CEFTIN pro perorální suspenzi, protože tableta má po rozdrcení silnou, přetrvávající hořkou chuť [viz Dávkování pro tablety CEFTIN ].
Dávkování pro tablety CEFTIN 500 mg
Podávejte tablety CEFTIN 250 mg, jak je popsáno v níže uvedené tabulce s pokyny pro dávkování, s jídlem nebo bez jídla.
Dávkování pro CEFTIN Pro perorální suspenzi
Podávejte CEFTIN pro perorální suspenzi, jak je popsáno v tabulce pokynů pro dávkování níže, s jídlem.
Příprava a podávání CEFTINU pro perorální suspenzi
Připravte suspenzi v době dávkování následovně:
- Před každým použitím perorální suspenzi dobře protřepejte.
- Po každém otevření uzávěr bezpečně nasaďte zpět.
- Rekonstituovanou suspenzi uchovávejte v chladu mezi 2° a 8°C (36° a 46°F).
- Po 10 dnech rekonstituovanou suspenzi zlikvidujte.
Dávkování u pacientů s poruchou funkce ledvin
Úprava dávkovacího intervalu je nutná u pacientů, jejichž clearance kreatininu je nižší než 30 ml/min, jak je uvedeno v tabulce 4 níže, protože cefuroxim se vylučuje primárně ledvinami [viz KLINICKÁ FARMAKOLOGIE ].
JAK DODÁVÁNO
Dávkové formy A Síly
Tablety CEFTIN jsou bílé potahované tablety ve tvaru tobolky dostupné v následujících silách:
- 250 mg cefuroximu (jako cefuroxim axetil) s vyrytým „GX ES7“ na jedné straně a prázdným na druhé straně.
- 500 mg cefuroximu (jako cefuroxim axetil) s vyrytým „GX EG2“ na jedné straně a prázdným na druhé straně.
CEFTIN pro perorální suspenzi se dodává jako suchý, bílý až téměř bílý prášek s příchutí tutti-frutti. Po rekonstituci podle pokynů poskytuje suspenze ekvivalent 125 mg nebo 250 mg cefuroximu (jako cefuroxim axetil) na 5 ml.
Skladování A Manipulace
Tablety CEFTIN, 250 mg cefuroximu (jako cefuroxim axetil), jsou bílé potahované tablety ve tvaru tobolky s vyrytým „GX ES7“ na jedné straně a prázdné na druhé straně takto: 20 tablet/lahvička NDC 0173-0387-00
Tablety CEFTIN, 500 mg cefuroximu (jako cefuroxim axetil), jsou bílé, tobolkovité, potahované tablety s vyrytým „GX EG2“ na jedné straně a prázdné na druhé straně takto: 20 tablet/lahvička NDC 0173-0394-00
Tablety uchovávejte při teplotě mezi 15° a 30°C (59° a 86°F). Po každém otevření uzávěr bezpečně nasaďte zpět.
CEFTIN 500 mg pro perorální suspenzi je dodáván jako suchý, bílý až téměř bílý prášek s příchutí tutti-frutti. Po rekonstituci podle pokynů poskytuje suspenze ekvivalent 125 mg nebo 250 mg cefuroximu (jako cefuroxim axetil) na 5 ml. Dodává se v lahvích z jantarového skla takto:
125 mg/5 ml
100 ml suspenze NDC 0173-0740-00
250 mg/5 ml
50 ml suspenze NDC 0173-0741-10 100 ml suspenze NDC 0173-0741-00
Před rekonstitucí skladujte suchý prášek při teplotě mezi 2° a 30°C (36° a 86°F).
Po rekonstituci ihned uchovávejte suspenzi v chladu při teplotě mezi 2° a 8°C (36° a 46°F). VYŘAĎTE PO 10 DNECH.
GlaxoSmithKline, Research Triangle Park, NC 27709. Revize: říjen 2017
VEDLEJŠÍ EFEKTY
Následující závažné a jinak důležité nežádoucí účinky jsou podrobněji popsány v části Upozornění a opatření na štítku:
Anafylaktické reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Tablety
Vícedávkové dávkovací režimy s trváním 7 až 10 dnů
klinických studiích s opakovanými dávkami bylo 912 subjektů léčeno přípravkem CEFTIN (125 až 500 mg dvakrát denně). Je třeba poznamenat, že 125 mg dvakrát denně není schválená dávka. Dvacet (2,2 %) subjektů přerušilo medikaci kvůli nežádoucím účinkům. Sedmnáct (85 %) z 20 subjektů, které přerušily léčbu, tak učinilo kvůli gastrointestinálním poruchám, včetně průjmu, nevolnosti, zvracení a bolesti břicha. Procento subjektů léčených přípravkem CEFTIN, kteří vysadili studovaný lék kvůli nežádoucím účinkům, bylo podobné při denních dávkách 1 000, 500 a 250 mg (2,3 %, 2,1 % a 2,2 %). Výskyt gastrointestinálních nežádoucích účinků se však s vyššími doporučenými dávkami zvyšoval.
Nežádoucí účinky v tabulce 5 se týkají subjektů (n = 912) léčených přípravkem CEFTIN 250 mg v klinických studiích s více dávkami.
Následující nežádoucí účinky se objevily u méně než 1 %, ale více než 0,1 % subjektů (n = 912) léčených CEFTINem v klinických studiích s opakovanými dávkami.
Poruchy imunitního systému Kopřivka, oteklý jazyk.
Poruchy metabolismu a výživy : Anorexie.
Poruchy nervového systému : Bolest hlavy.
Srdeční poruchy : Bolest na hrudi.
Poruchy dýchání : Dušnost.
Gastrointestinální poruchy : Bolesti břicha, křeče v břiše, plynatost, špatné trávení, vředy v ústech.
Poruchy kůže a podkožní tkáně : Vyrážka, svědění.
Poruchy ledvin a močových cest : Dysurie.
Poruchy reprodukčního systému a prsu : Vaginitida, svědění vulvy.
Obecné poruchy a podmínky v místě podání : Zimnice, ospalost, žízeň.
Vyšetřování : Pozitivní Coombsův test.
Časná lymská borelióza s 20denním režimem
Dvě multicentrické studie hodnotily CEFTIN 500 mg dvakrát denně po dobu 20 dnů. Nejčastějšími nežádoucími účinky souvisejícími s lékem byly průjem (10,6 %), Jarischova-Herxheimerova reakce (5,6 %) a vaginitida (5,4 %). Další nežádoucí účinky se vyskytly s četností srovnatelnou s četnostmi hlášenými při podávání 7 až 10 dnů.
Jednodávkový režim pro nekomplikovanou kapavku
V klinických studiích s použitím jedné dávky 1 000 mg přípravku CEFTIN 250 mg bylo 1 061 subjektů léčeno pro nekomplikovanou kapavku. Nežádoucí reakce v tabulce 6 byly pro subjekty léčené jednou dávkou 1 000 mg CEFTINu v klinických studiích v USA.
Následující nežádoucí účinky se vyskytly u méně než 1 %, ale více než u 0,1 % subjektů (n = 1 061) léčených jednou dávkou CEFTINU 1 000 mg pro nekomplikovanou kapavku v klinických studiích v USA.
Infekce a infestace : Vaginální kandidóza.
Poruchy nervového systému : Bolest hlavy, závratě, somnolence.
Srdeční poruchy : Tlak/bolest na hrudi, tachykardie.
Gastrointestinální poruchy : Bolesti břicha, dyspepsie.
Poruchy kůže a podkožní tkáně : Erytém, vyrážka, pruritus.
Poruchy svalové a kosterní soustavy a pojivové tkáně : Svalové křeče, svalová ztuhlost, svalové křeče krku, reakce typu lockjaw.
Poruchy ledvin a močových cest : Krvácení/bolest v močové trubici, bolest ledvin.
Poruchy reprodukčního systému a prsu : Vaginální svědění, vaginální výtok.
Orální suspenze
V klinických studiích s opakovanými dávkami CEFTINU 250 mg byli dětští pacienti (96,7 % mladších než 12 let) léčeni CEFTINem (20 až 30 mg/kg/den rozdělených dvakrát denně až do maximální dávky 500 nebo 1 000 mg/den, respektive). Jedenáct (1,2 %) subjektů v USA přerušilo léčbu kvůli nežádoucím účinkům. Vysazení byla primárně pro gastrointestinální poruchy, obvykle průjem nebo zvracení. Třináct (1,4 %) pediatrických subjektů v USA přerušilo terapii kvůli chuti a/nebo problémům s podáváním léku.
Nežádoucí účinky v tabulce 7 se týkají subjektů v USA (n = 931) léčených CEFTINem v klinických studiích s opakovanými dávkami.
Následující nežádoucí účinky se objevily u méně než 1 %, ale více než 0,1 % pacientů v USA (n = 931) léčených přípravkem CEFTIN pro perorální suspenzi v klinických studiích s více dávkami.
Infekce a infestace : Gastrointestinální infekce, kandidóza, virové onemocnění, infekce horních cest dýchacích, sinusitida, infekce močových cest.
Poruchy krve a lymfatického systému : Eozinofilie.
Psychiatrické poruchy : Hyperaktivita, podrážděné chování.
Gastrointestinální poruchy : Bolesti břicha, plynatost, ptyalismus.
Poruchy kůže a podkožní tkáně : Vyrážka.
Poruchy svalové a kosterní soustavy a pojivové tkáně : Otoky kloubů, artralgie.
Poruchy reprodukčního systému a prsu : Vaginální podráždění.
Obecné poruchy a podmínky v místě podání : Kašel, horečka.
Vyšetřování : Zvýšené jaterní enzymy, pozitivní Coombsův test.
Postmarketingové zkušenosti
Během používání přípravku CEFTIN po schválení byly zjištěny následující nežádoucí účinky. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Poruchy krve a lymfatického systému
Hemolytická anémie, leukopenie, pancytopenie, trombocytopenie.
Gastrointestinální poruchy
Pseudomembranózní kolitida [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Hepatobiliární poruchy
Porucha funkce jater včetně hepatitidy a cholestázy, žloutenka.
Poruchy imunitního systému
Anafylaxe, reakce podobná sérové nemoci.
Vyšetřování
Zvýšený protrombinový čas.
Poruchy nervového systému
Záchvaty, encefalopatie.
Poruchy ledvin a močových cest
Renální dysfunkce.
Poruchy kůže a podkožní tkáně
Angioedém, multiformní erytém, Stevens-Johnsonův syndrom, toxická epidermální nekrolýza, kopřivka.
DROGOVÉ INTERAKCE
Orální antikoncepce
Cefuroxim axetil může ovlivnit střevní flóru, což vede k nižší reabsorpci estrogenu a snížené účinnosti kombinovaných perorálních estrogen/progesteronových kontraceptiv. Poraďte pacientkám, aby zvážily alternativní doplňková (nehormonální) antikoncepční opatření během léčby.
Léky, které snižují kyselost žaludku
Léky, které snižují kyselost žaludku, mohou mít za následek nižší biologickou dostupnost CEFTINu ve srovnání s podáváním nalačno. Podávání léků, které snižují žaludeční kyselost, může negovat potravinový efekt zvýšené absorpce přípravku CEFTIN 250 mg při podání v postprandiálním stavu. Podávejte CEFTIN alespoň 1 hodinu před nebo 2 hodiny po podání krátkodobě působících antacid. Je třeba se vyhnout antagonistům histaminu-2 (H2) a inhibitorům protonové pumpy.
Probenecid
Současné podávání probenecidu s tabletami cefuroxim axetilu zvyšuje sérové koncentrace cefuroximu (viz KLINICKÁ FARMAKOLOGIE ]. Současné podávání probenecidu s cefuroxim axetilem se nedoporučuje.
Interakce drog/laboratorních testů
Falešně pozitivní reakce na glukózu v moči se může objevit u testů na redukci mědi (např. Benediktův nebo Fehlingův roztok), ale ne u testů na glykosurii na bázi enzymů. Protože se při ferrikyanidovém testu může vyskytnout falešně negativní výsledek, doporučuje se u pacientů užívajících cefuroxim axetil použít ke stanovení hladin glukózy v krvi/plazmě buď glukózooxidázovou nebo hexokinázovou metodu. Přítomnost cefuroximu neinterferuje se stanovením kreatininu v séru a moči metodou alkalického pikrátu.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Anafylaktické reakce
pacientů užívajících β-laktamová antibiotika byly hlášeny závažné a příležitostně fatální hypersenzitivní (anafylaktické) reakce. Tyto reakce se pravděpodobněji vyskytují u jedinců s anamnézou přecitlivělosti na β-laktam a/nebo anamnézou citlivosti na více alergenů. Existují zprávy o jedincích s anamnézou přecitlivělosti na penicilin, u kterých se vyskytly závažné reakce při léčbě cefalosporiny. CEFTIN 500 mg je kontraindikován u pacientů se známou přecitlivělostí na CEFTIN nebo jiná β-laktamová antibakteriální léčiva [viz KONTRAINDIKACE ]. Před zahájením léčby přípravkem CEFTIN se informujte o předchozích reakcích přecitlivělosti na peniciliny, cefalosporiny nebo jiné alergeny. Pokud se objeví alergická reakce, přerušte léčbu přípravkem CEFTIN a zahajte vhodnou léčbu.
Průjem spojený s Clostridium Difficile
Průjem související s Clostridium difficile (CDAD) byl hlášen při použití téměř všech antibakteriálních látek, včetně CEFTINu, a může se pohybovat v rozsahu od mírného průjmu až po fatální kolitidu. Léčba antibakteriálními látkami mění normální flóru tlustého střeva, což vede k přemnožení C. difficile.
C. difficile produkuje toxiny A a B, které přispívají k rozvoji CDAD. Kmeny C. difficile produkující hypertoxin způsobují zvýšenou morbiditu a mortalitu, protože tyto infekce mohou být odolné vůči antimikrobiální léčbě a mohou vyžadovat kolektomii. CDAD je třeba vzít v úvahu u všech pacientů, kteří mají průjem po užívání antibiotik. Je nutná pečlivá anamnéza, protože CDAD se objevilo více než 2 měsíce po podání antibakteriálních látek.
Pokud je podezření na CDAD nebo je potvrzeno, může být nutné přerušit pokračující užívání antibiotik, která nejsou zaměřena proti C. difficile. Podle klinické indikace by měla být zahájena vhodná léčba tekutin a elektrolytů, suplementace proteinů, antibiotická léčba C. difficile a chirurgické vyšetření.
Potenciál pro přemnožení mikrobů
Během léčby je třeba vzít v úvahu možnost superinfekcí houbovými nebo bakteriálními patogeny.
Vývoj bakterií odolných vůči léčivům
Je nepravděpodobné, že by předepsání přípravku CEFTIN při absenci prokázané nebo silně suspektní bakteriální infekce nebo v profylaktické indikaci přineslo pacientovi prospěch a zvýšilo riziko rozvoje bakterií rezistentních na léky.
Fenylketonurie
CEFTIN 125 mg pro perorální suspenzi 125 mg/5 ml obsahuje fenylalanin 11,8 mg na 5 ml (1 čajová lžička) rekonstituované suspenze. CEFTIN 250 mg pro perorální suspenzi 250 mg/5 ml obsahuje fenylalanin 25,2 mg na 5 ml (1 čajová lžička) rekonstituované suspenze.
Interference s glukózovými testy
Falešně pozitivní výsledek na glukózu v moči se může objevit při testech na redukci mědi a falešně negativní výsledek na glukózu v krvi/plazmě se může objevit při testech ferrikyanidů u subjektů užívajících CEFTIN [viz DROGOVÉ INTERAKCE ].
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Ačkoli nebyly provedeny celoživotní studie na zvířatech k vyhodnocení karcinogenního potenciálu, nebyla u cefuroxim axetilu v sérii testů bakteriálních mutací zjištěna žádná mutagenní aktivita. Pozitivní výsledky byly získány v in vitro testu chromozomové aberace; negativní výsledky však byly zjištěny v mikronukleárním testu in vivo v dávkách do 1,5 g/kg. Reprodukční studie na potkanech v dávkách až 1 000 mg/kg/den (9násobek doporučené maximální dávky pro člověka na základě tělesného povrchu) neodhalily žádné poškození fertility.
Použití u konkrétních populací
Těhotenství
Těhotenství kategorie B. Neexistují žádné adekvátní a dobře kontrolované studie u těhotných žen. Vzhledem k tomu, že reprodukční studie na zvířatech nejsou vždy prediktivní pro lidskou odpověď, měl by být CEFTIN během těhotenství používán pouze tehdy, je-li to nezbytně nutné.
Reprodukční studie byly provedeny na myších v dávkách až 3 200 mg/kg/den (14násobek doporučené maximální dávky pro člověka na základě tělesného povrchu) a na potkanech při dávkách až 1 000 mg/kg/den (9násobek doporučené maximální dávky dávka pro člověka na základě tělesného povrchu) a neodhalily žádné známky poškození plodnosti nebo poškození plodu v důsledku cefuroxim axetilu.
Kojící matky
Vzhledem k tomu, že se cefuroxim vylučuje do mateřského mléka, je třeba opatrnosti při podávání přípravku CEFTIN 500 mg kojící ženě.
Pediatrické použití
Bezpečnost a účinnost přípravku CEFTIN 250 mg byla stanovena pro pediatrické pacienty ve věku od 3 měsíců do 12 let pro akutní bakteriální maxilární sinusitidu na základě jeho schválení u dospělých. Použití přípravku CEFTIN u pediatrických pacientů je podpořeno farmakokinetickými a bezpečnostními údaji u dospělých a pediatrických pacientů a klinickými a mikrobiologickými údaji z adekvátních a dobře kontrolovaných studií léčby akutní bakteriální maxilární sinusitidy u dospělých a akutního zánětu středního ucha s výpotkem v dětských pacientů. Je také podporován postmarketingovým sledováním nežádoucích účinků. [Vidět INDIKACE A POUŽITÍ , DÁVKOVÁNÍ A PODÁVÁNÍ , NEŽÁDOUCÍ REAKCE , KLINICKÁ FARMAKOLOGIE ]
Geriatrické použití
celkového počtu subjektů, které dostaly CEFTIN 250 mg ve 20 klinických studiích, bylo 375 ve věku 65 let a více, zatímco 151 bylo ve věku 75 let a více. Mezi těmito subjekty a mladšími dospělými subjekty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti. Hlášená klinická zkušenost nezjistila rozdíly v odpovědích mezi staršími a mladšími dospělými pacienty, ale nelze vyloučit větší citlivost některých starších jedinců.
Cefuroxim je v podstatě vylučován ledvinami a riziko nežádoucích účinků může být vyšší u pacientů s poruchou funkce ledvin. Vzhledem k tomu, že u starších pacientů je pravděpodobnější snížená funkce ledvin, je třeba věnovat pozornost výběru dávky a může být užitečné sledovat funkci ledvin.
Renální poškození
Snížení dávky přípravku CEFTIN 125 mg se doporučuje u dospělých pacientů s těžkou poruchou funkce ledvin (clearance kreatininu DÁVKOVÁNÍ A PODÁVÁNÍ , KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
Předávkování cefalosporiny může způsobit podráždění mozku vedoucí ke křečím nebo encefalopatii. Sérové hladiny cefuroximu lze snížit hemodialýzou a peritoneální dialýzou.
KONTRAINDIKACE
CEFTIN je kontraindikován u pacientů se známou přecitlivělostí (např. anafylaxí) na CEFTIN nebo na jiná β-laktamová antibakteriální léčiva (např. peniciliny a cefalosporiny).
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
CEFTIN 250 mg je antibakteriální léčivo [viz Mikrobiologie ].
Farmakokinetika
Vstřebávání
Po perorálním podání je cefuroxim axetil absorbován z gastrointestinálního traktu a rychle hydrolyzován nespecifickými esterázami ve střevní sliznici a krvi na cefuroxim. Sérové farmakokinetické parametry cefuroximu po podání přípravku CEFTIN 250 mg tablety dospělým jsou uvedeny v tabulce 8.
Food Effect
Absorpce tablety je vyšší, když se užije po jídle (absolutní biologická dostupnost se zvyšuje z 37 % na 52 %). Navzdory tomuto rozdílu v absorpci byly klinické a bakteriologické odpovědi subjektů nezávislé na příjmu potravy v době podávání tablet ve 2 studiích, kde to bylo hodnoceno.
Všechny studie farmakokinetiky a klinické účinnosti a bezpečnosti u pediatrických subjektů používajících suspenzní formulaci byly provedeny ve stavu po jídle. Nejsou dostupné žádné údaje o kinetice absorpce suspenzní formulace při podávání pediatrickým subjektům nalačno.
Nedostatek bioekvivalence
Perorální suspenze nebyla při testování u zdravých dospělých bioekvivalentní tabletám. Formulace ve formě tablet a perorální suspenze NENÍ nahraditelné na bázi miligram-permiligram. Plocha pod křivkou pro suspenzi činila v průměru 91 % plochy pro tabletu a vrcholová plazmatická koncentrace pro suspenzi činila v průměru 71 % vrcholové plazmatické koncentrace tablet. Proto byla bezpečnost a účinnost jak tablet, tak perorálních suspenzních přípravků stanovena v samostatných klinických studiích.
Rozdělení
Cefuroxim je distribuován do extracelulárních tekutin. Přibližně 50 % sérového cefuroximu se váže na bílkoviny.
Metabolismus
Axetilová část je metabolizována na acetaldehyd a kyselinu octovou.
Vylučování
Cefuroxim se vylučuje v nezměněné podobě močí; u dospělých se přibližně 50 % podané dávky objeví v moči během 12 hodin. Farmakokinetika cefuroximu u pediatrických pacientů nebyla studována. Dokud nebudou k dispozici další údaje, renální eliminace cefuroxim axetilu stanovená u dospělých by neměla být extrapolována na pediatrické subjekty.
Specifické populace
Renální poškození
Ve studii s 28 dospělými s normální funkcí ledvin nebo těžkou poruchou funkce ledvin (clearance kreatininu DÁVKOVÁNÍ A PODÁVÁNÍ ].
Pediatričtí pacienti
Sérové farmakokinetické parametry cefuroximu u pediatrických pacientů, kterým byl podáván CEFTIN pro perorální suspenzi, jsou uvedeny v tabulce 9.
Geriatričtí pacienti
Ve studii s 20 staršími subjekty (průměrný věk = 83,9 let) s průměrnou clearance kreatininu 34,9 ml/min byl průměrný sérový eliminační poločas prodloužen na 3,5 hodiny; i přes nižší eliminaci cefuroximu u geriatrických pacientů však není nutná úprava dávkování podle věku (viz Použití u konkrétních populací ].
Lékové interakce
Současné podávání probenecidu s tabletami cefuroxim axetilu zvyšuje plochu cefuroximu pod křivkou sérové koncentrace proti času a maximální sérovou koncentraci o 50 % a 21 %.
Mikrobiologie
Mechanismus působení
Cefuroxim axetil je baktericidní činidlo, které působí inhibicí syntézy bakteriální buněčné stěny. Cefuroxim axetil má aktivitu v přítomnosti některých β-laktamáz, jak penicilináz, tak cefalosporináz, gramnegativních a grampozitivních bakterií.
Mechanismus Odporu
Rezistence na cefuroxim axetil je primárně způsobena hydrolýzou β-laktamázou, změnou proteinů vázajících penicilin (PBP), sníženou permeabilitou a přítomností bakteriálních efluxních pump.
Citlivost na cefuroxim axetil se bude lišit v závislosti na zeměpisné poloze a čase; je třeba konzultovat místní údaje o citlivosti, jsou-li k dispozici. Na beta-laktamázu negativní, ampicilin-rezistentní (BLNAR) izoláty H. influenzae by měly být považovány za rezistentní vůči cefuroxim axetilu.
Bylo prokázáno, že cefuroxim axetil je účinný proti většině izolátů následujících bakterií, a to jak in vitro, tak u klinických infekcí (viz INDIKACE A POUŽITÍ ]:
Gram-pozitivní bakterie
Staphylococcus aureus (pouze izoláty citlivé na meticilin) Streptococcus pneumoniae Streptococcus pyogenes
Gram-negativní bakterie
Escherichia colia Klebsiella pneumoniaea Haemophilus influenzae Haemophilus parainfluenzae Moraxella catarrhalis Neisseria gonorrhoeae a izoláty produkující β-laktamázu (ESBL) a karbapenemázu s nejširším spektrem jsou rezistentní vůči cetilfuroxim a. Spirochety Borrelia Burgdorferi
K dispozici jsou následující údaje in vitro, ale jejich klinický význam není znám. Nejméně 90 procent následujících mikroorganismů vykazuje in vitro minimální inhibiční koncentraci (MIC) nižší nebo rovnou prahu citlivosti pro cefuroxim axetil 1 mcg/ml. Účinnost cefuroxim axetilu při léčbě klinických infekcí způsobených těmito mikroorganismy však nebyla v adekvátních a dobře kontrolovaných klinických studiích stanovena.
Gram-pozitivní bakterie
Staphylococcus epidermidis (pouze izoláty citlivé na meticilin) Staphylococcus saprophyticus (pouze izoláty citlivé na meticilin) Streptococcus agalactiae
Gram-negativní bakterie
Morganella morganii Proteus inconstans Proteus mirabilis Providencia rettgeri Anaerobní bakterie Peptococcus niger
Metody testování citlivosti
Jsou-li k dispozici, měla by klinická mikrobiologická laboratoř poskytovat výsledky testů citlivosti in vitro pro antimikrobiální léčivé přípravky používané v místních nemocnicích a ordinacích lékaři jako pravidelné zprávy, které popisují profil citlivosti nozokomiálních a komunitně získaných patogenů. Tyto zprávy by měly pomoci lékaři při výběru antibakteriálního léku pro léčbu.
Techniky ředění
Pro stanovení antimikrobiálních MIC se používají kvantitativní metody. Tyto MIC poskytují reprodukovatelné odhady citlivosti bakterií na antimikrobiální sloučeniny. MIC by měly být stanoveny pomocí standardizované testovací metody (bujón nebo agar).1,2 Hodnoty MIC by měly být interpretovány podle kritérií uvedených v tabulce 10.2,3
Difúzní techniky
Kvantitativní metody, které vyžadují měření průměrů zón, také poskytují reprodukovatelné odhady citlivosti bakterií na antimikrobiální sloučeniny. Velikost zóny poskytuje odhad citlivosti bakterií na antimikrobiální sloučeniny. Velikost zóny by měla být stanovena pomocí standardizované testovací metody.4 Tento postup používá papírové disky impregnované 30 mcg cefuroxim axetilu k testování citlivosti mikroorganismů na cefuroxim axetil. Kritéria interpretace diskové difúze jsou uvedena v tabulce 10.3
Citlivost stafylokoků na cefuroxim lze odvodit z testování pouze penicilinu a buď cefoxitinu nebo oxacilinu.
Citlivost Streptococcus pyogenes lze odvodit z testování penicilinu.3
Zpráva „Vnímavý“ naznačuje, že antimikrobiální léčivo pravděpodobně inhibuje růst patogenu, pokud antimikrobiální léčivo dosáhne koncentrace obvykle dosažitelné v místě infekce. Zpráva „Střední“ znamená, že výsledek by měl být považován za nejednoznačný, a pokud mikroorganismus není plně citlivý na alternativní, klinicky proveditelné léky, test by se měl opakovat. Tato kategorie implikuje možnou klinickou použitelnost v místech těla, kde je léčivo fyziologicky koncentrované, nebo v situacích, kdy lze použít vysokou dávku léčiva. Tato kategorie také poskytuje nárazníkovou zónu, která zabraňuje malým nekontrolovaným technickým faktorům způsobit velké nesrovnalosti ve výkladu. Zpráva „Rezistentní“ naznačuje, že antimikrobiální léčivo pravděpodobně nebude inhibovat růst patogenu, pokud antimikrobiální léčivo dosáhne koncentrací obvykle dosažitelných v místě infekce; měla by být zvolena jiná terapie.
Kontrola kvality
Standardizované postupy testování citlivosti vyžadují použití laboratorních kontrol k monitorování a zajištění přesnosti a přesnosti zásob a činidel používaných v testu a technik jednotlivce provádějícího test.1,2,4 Rozsahy kontroly kvality pro MIC a diskovou difúzi testování pomocí 30-mcg disku jsou uvedeny v tabulce 11.3
Klinické studie
Akutní bakteriální maxilární sinusitida
Jedna adekvátní a dobře kontrolovaná studie byla provedena u subjektů s akutní bakteriální maxilární sinusitidou. V této studii byl každému subjektu odebrán maxilární sinusový aspirát před zahájením léčby předpokládané akutní bakteriální sinusitidy. Všichni jedinci měli radiografický a klinický důkaz akutní maxilární sinusitidy. Ve studii byla klinická účinnost CEFTINu při léčbě akutní maxilární sinusitidy srovnatelná s perorálním antimikrobiálním přípravkem obsahujícím specifický inhibitor β-laktamázy. Mikrobiologické údaje však prokázaly, že CEFTIN je účinný při léčbě akutní bakteriální maxilární sinusitidy způsobené pouze Streptococcus pneumoniae nebo Haemophilus influenzae neprodukující β-laktamázu. V této studii nebyl získán dostatečný počet izolátů Haemophilus influenzae a Moraxella catarrhalis produkujících β-laktamázu, aby bylo možné adekvátně vyhodnotit účinnost CEFTINu při léčbě akutní bakteriální maxilární sinusitidy způsobené těmito 2 organismy.
Tato studie randomizovala 317 dospělých subjektů, 132 subjektů v USA a 185 subjektů v Jižní Americe. Tabulka 12 ukazuje výsledky analýzy záměrné léčby.
V této studii a v podpůrné studii maxilární punkce mělo 15 hodnotitelných subjektů jako identifikovaný patogen Haemophilus influenzae neprodukující β-laktamázu. Z toho u 67 % (10/15) byl tento patogen vymýcen. Osmnáct (18) hodnotitelných subjektů mělo jako identifikovaný patogen Streptococcus pneumoniae. Z toho u 83 % (15/18) byl tento patogen vymýcen.
Časná lymská borelióza
U subjektů s časnou lymskou boreliózou byly provedeny dvě adekvátní a dobře kontrolované studie. U všech subjektů se objevil erythema migrans zdokumentovaný lékařem, se systémovými projevy infekce nebo bez nich. Subjekty byly hodnoceny 1 měsíc po léčbě z hlediska úspěchu v léčbě časné lymské boreliózy (část I) a 1 rok po léčbě z hlediska úspěchu v prevenci progrese k následkům pozdní lymské boreliózy (část II).
Ve 2 studiích bylo randomizováno celkem 355 dospělých subjektů (181 léčených cefuroxim axetilem a 174 léčených doxycyklinem), přičemž diagnóza časné lymské boreliózy byla potvrzena u 79 % (281/355). Klinická diagnóza časné lymské boreliózy u těchto subjektů byla potvrzena 1) zaslepeným odborným čtením fotografií, pokud byly k dispozici, kožních lézí erythema migrans před léčbou, a 2) sérologickým potvrzením (pomocí enzymatického imunosorbentního testu [ELISA] a imunoblotového testu [“Western” blot]) přítomnosti protilátek specifických pro Borrelia burgdorferi, etiologického agens lymské boreliózy. Údaje o účinnosti v tabulce 13 jsou specifické pro tuto „validovanou“ podskupinu pacientů, zatímco údaje o bezpečnosti níže odrážejí celou populaci pacientů ve 2 studiích. Klinické údaje pro hodnotitelné subjekty v podskupině „validovaných“ pacientů jsou uvedeny v tabulce 13.
CEFTIN a doxycyklin byly účinné v prevenci rozvoje následků pozdní lymské boreliózy.
Zatímco výskyt gastrointestinálních nežádoucích účinků souvisejících s lékem byl podobný ve 2 léčebných skupinách (cefuroxim axetil – 13 %; doxycyklin – 11 %), výskyt průjmu souvisejícího s lékem byl vyšší v rameni s cefuroxim axetilem oproti rameni s doxycyklinem (11 % oproti 3 %, v tomto pořadí).
REFERENCE
1. Institut klinických a laboratorních standardů (CLSI). Metody ředění Testy antimikrobiální citlivosti pro bakterie, které rostou aerobně; Schválený standard – desáté vydání. 2015. CLSI dokument M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
2. Institut klinických a laboratorních standardů (CLSI). Metody pro antimikrobiální ředění a testování diskové citlivosti na zřídka izolované nebo náročné bakterie: Schválené směrnice - druhé vydání. 2010. CLSI dokument M45-A2, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
3. Institut klinických a laboratorních standardů (CLSI). Výkonové standardy pro testování antimikrobiální citlivosti; Dvacátý pátý informační doplněk. 2015. CLSI dokument M100- S25, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
4. Institut klinických a laboratorních standardů (CLSI). Výkonové standardy pro antimikrobiální diskové difúzní testy citlivosti; Schválený standard – dvanácté vydání. 2015. CLSI dokument M02-A12, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
INFORMACE PRO PACIENTA
Alergické reakce
Informujte pacienty, že CEFTIN je cefalosporin, který může u některých jedinců způsobit alergické reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Průjem spojený s Clostridium Difficile
Informujte pacienty, že průjem je častým problémem způsobeným antibakteriálními látkami a obvykle končí, když se antibiotikum vysadí. Někdy po zahájení léčby antibakteriálními látkami se u pacientů může vyvinout vodnatá a krvavá stolice (s žaludečními křečemi a horečkou nebo bez nich) dokonce až 2 nebo více měsíců po užití poslední dávky antibakteriálního přípravku. Pokud k tomu dojde, doporučte pacientům, aby co nejdříve kontaktovali svého lékaře.
Fenylketonurie
Informujte pacienty a pečovatele, že CEFTIN 125 mg pro perorální suspenzi obsahuje fenylalanin (složka aspartamu) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Drtící tablety
Poučte pacienty, aby tabletu spolkli celou, aniž by ji rozdrtili. Pacienti, kteří nemohou polykat celou tabletu, by měli dostat perorální suspenzi.
Orální suspenze
Poučte pacienty, aby před každým použitím dobře protřepali perorální suspenzi, uchovávali v chladničce a po 10 dnech zlikvidovali. Perorální suspenze se má užívat s jídlem.
Odolnost vůči lékům
Informujte pacienty, že antibakteriální léky, včetně přípravku CEFTIN, by se měly používat pouze k léčbě bakteriálních infekcí. Neléčí virové infekce (např. nachlazení). Je-li CEFTIN 250 mg předepsán k léčbě bakteriální infekce, informujte pacienty, že ačkoli je běžné, že se na začátku léčby cítí lépe, lék by měl být užíván přesně podle pokynů. Vynechání dávek nebo nedokončení celé terapie může: (1) snížit účinnost okamžité léčby a (2) zvýšit pravděpodobnost, že si bakterie vyvinou rezistenci a nebudou v budoucnu léčitelné přípravkem CEFTIN 500 mg nebo jinými antibakteriálními léky. .
