Péče o vlasy: Avodart 0.5mg Dutasteride Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Avodart 0,5 mg a jak se používá?
Avodart 0,5 mg je lék na předpis používaný k léčbě příznaků zvětšené prostaty (benigní hyperplazie prostaty). Avodart lze užívat samostatně nebo s jinými léky.
Avodart 0,5 mg patří do třídy léků nazývaných inhibitory 5-alfa-reduktázy.
Není známo, zda je přípravek Avodart 0,5 mg bezpečný a účinný u dětí.
Jaké jsou vedlejší účinky Avodartu?
Mezi vedlejší účinky přípravku Avodart 0,5 mg patří:
- kopřivka,
- potíže s dýcháním,
- otok v obličeji nebo krku,
- horečka,
- bolest krku,
- pálení očí,
- bolest kůže a
- červená nebo fialová kožní vyrážka s puchýři a olupováním
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Avodart 0,5 mg patří:
- snížené libido (sexuální touha),
- snížené množství semene uvolněného během sexu,
- impotence (potíže s dosažením nebo udržením erekce) a
- citlivost nebo zvětšení prsou
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Avodart. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
AVODART 0,5 mg je syntetická 4-azasteroidní sloučenina, která je selektivním inhibitorem izoforem typu 1 i typu 2 steroid 5 alfa-reduktázy, intracelulárního enzymu, který přeměňuje testosteron na DHT.
Dutasterid je chemicky označen jako (5a,17p)-N-{2,5bis(trifluormethyl)fenyl}-3-oxo-4-azaandrost-1-en-17-karboxamid. Empirický vzorec dutasteridu je C27H30F6N2O2, který představuje molekulovou hmotnost 528,5 s následujícím strukturním vzorcem:
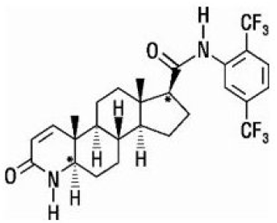
Dutasterid je bílý až světle žlutý prášek s bodem tání 242 °C až 250 °C. Je rozpustný v ethanolu (44 mg/ml), methanolu (64 mg/ml) a polyethylenglykolu 400 (3 mg/ml), ale je nerozpustný ve vodě.
Každá tobolka AVODART 0,5 mg z měkké želatiny, podávaná perorálně, obsahuje 0,5 mg dutasteridu rozpuštěného ve směsi mono-diglyceridů kyseliny kaprylové/kaprinové a butylovaného hydroxytoluenu. Neaktivní pomocné látky v plášti tobolky jsou oxid železitý (žlutý), želatina (z certifikovaných bovinních zdrojů bez BSE), glycerin a oxid titaničitý. Měkké želatinové tobolky jsou potištěny jedlým červeným inkoustem.
INDIKACE
Monoterapie
AVODART (dutasterid) měkké želatinové tobolky jsou indikovány k léčbě symptomatické benigní hyperplazie prostaty (BPH) u mužů se zvětšenou prostatou k:
- zlepšit příznaky,
- snížit riziko akutní retence moči (AUR) a
- snížit riziko nutnosti operace související s BPH.
Kombinace s alfa-adrenergním antagonistou
AVODART v kombinaci s alfa-adrenergním antagonistou tamsulosinem je indikován k léčbě symptomatické BPH u mužů se zvětšenou prostatou.
Omezení použití
AVODART 0,5 mg není schválen pro prevenci rakoviny prostaty.
DÁVKOVÁNÍ A PODÁVÁNÍ
Tobolky by se měly polykat celé a neměly by se žvýkat ani otevírat, protože kontakt s obsahem tobolky může způsobit podráždění orofaryngeální sliznice. AVODART lze podávat s jídlem nebo bez jídla.
Monoterapie
Doporučená dávka přípravku AVODART je 1 tobolka (0,5 mg) užívaná jednou denně.
Kombinace s alfa-adrenergním antagonistou
Doporučená dávka přípravku AVODART 0,5 mg je 1 tobolka (0,5 mg) jednou denně a tamsulosin 0,4 mg jednou denně.
JAK DODÁVÁNO
Dávkové formy A Síly
0,5 mg, neprůhledné, matně žluté, želatinové tobolky s potiskem „GX CE2“ červeným inkoustem na jedné straně.
Skladování A Manipulace
AVODART měkké želatinové tobolky 0,5 mg jsou podlouhlé, neprůhledné, matně žluté, želatinové tobolky s potiskem „GX CE2“ s červeným jedlým inkoustem na jedné straně, balené v lahvičkách po 30 ( NDC 0173-0712-15) a 90 ( NDC 0173-0712-04) s dětskými bezpečnostními uzávěry.
Skladujte při teplotě 25 °C (77 °F); povoleny výchylky do 15° až 30°C (59° až 86°F) [viz USP řízená pokojová teplota ].
Dutasterid se vstřebává kůží. S AVODART 0,5 mg tobolkami by neměly manipulovat ženy, které jsou těhotné nebo které by mohly otěhotnět, kvůli možné absorpci dutasteridu a následnému potenciálnímu riziku pro vyvíjející se plod mužského pohlaví (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Vyrobeno pro: GlaxoSmithKline Research Triangle Park. Revize: leden 2020
VEDLEJŠÍ EFEKTY
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie probíhají za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinické studii jiného léku a nemusí odrážet míry pozorované v praxi.
Z klinických studií s AVODART 0,5 mg v monoterapii nebo v kombinaci s tamsulosinem:
- Nejčastějšími nežádoucími účinky hlášenými u subjektů užívajících AVODART 0,5 mg byly impotence, snížené libido, poruchy prsů (včetně zvětšení a citlivosti prsů) a poruchy ejakulace. Nejčastějšími nežádoucími účinky hlášenými u subjektů užívajících kombinovanou léčbu (AVODART 0,5 mg plus tamsulosin) byly impotence, snížené libido, poruchy prsů (včetně zvětšení a citlivosti prsů), poruchy ejakulace a závratě. Poruchy ejakulace se vyskytly významně častěji u subjektů užívajících kombinovanou terapii (11 %) ve srovnání s těmi, kteří dostávali AVODART (2 %) nebo tamsulosin (4 %) jako monoterapii.
- V placebem kontrolovaných studiích s AVODARTem došlo k ukončení studie z důvodu nežádoucích účinků u 4 % subjektů užívajících AVODART 0,5 mg a 3 % subjektů užívajících placebo. Nejčastější nežádoucí reakcí vedoucí k ukončení studie byla impotence (1 %).
- klinické studii hodnotící kombinovanou terapii došlo k ukončení studie z důvodu nežádoucích účinků u 6 % subjektů užívajících kombinovanou léčbu (AVODART plus tamsulosin) a 4 % subjektů užívajících AVODART 0,5 mg nebo tamsulosin jako monoterapii. Nejčastější nežádoucí reakcí ve všech léčebných ramenech, která vedla k ukončení studie, byla erektilní dysfunkce (1 % až 1,5 %).
Monoterapie
Více než 4 300 mužů s BPH bylo náhodně rozděleno do skupin dostávajících placebo nebo 0,5 mg denní dávky AVODARTu ve 3 identických 2letých, placebem kontrolovaných, dvojitě zaslepených, léčebných studiích fáze 3, po každé následovala 2letá otevřená studie rozšíření. Během dvojitě zaslepeného léčebného období bylo 2 167 mužů vystaveno AVODARTu 0,5 mg, včetně 1 772 exponovaných po dobu 1 roku a 1 510 vystavených po dobu 2 let. Při zahrnutí otevřených prodloužení bylo 1 009 mužů vystaveno AVODARTu 0,5 mg po dobu 3 let a 812 bylo vystaveno po dobu 4 let. Populace byla ve věku 47 až 94 let (průměrný věk: 66 let) a více než 90 % byli běloši. Tabulka 1 shrnuje klinické nežádoucí účinky hlášené u nejméně 1 % subjektů užívajících AVODART a s vyšší incidencí než u subjektů užívajících placebo.
Dlouhodobá léčba (až 4 roky)
Vysoce kvalitní rakovina prostaty
Studie REDUCE byla randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie, do které bylo zařazeno 8 231 mužů ve věku 50 až 75 let se sérovým PSA 2,5 ng/ml až 10 ng/ml a negativní biopsií prostaty během předchozích 6 měsíců. Subjekty byly randomizovány tak, aby dostávaly placebo (n = 4 126) nebo 0,5 mg denní dávky přípravku AVODART (n = 4 105) po dobu až 4 let. Průměrný věk byl 63 let a 91 % byli běloši. Subjekty podstoupily protokolem nařízené plánované biopsie prostaty po 2 a 4 letech léčby nebo měli „biopsie z důvodu“ v neplánovaných časech, pokud je to klinicky indikováno. U mužů užívajících AVODART (1,0 %) byla ve srovnání s muži užívajícími placebo (0,5 %) vyšší incidence rakoviny prostaty Gleason skóre 8-10 (viz INDIKACE A POUŽITÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. V 7leté placebem kontrolované klinické studii s jiným inhibitorem 5-alfa-reduktázy (finasterid 5 mg, PROSCAR) byly pozorovány podobné výsledky pro Gleasonovo skóre 8-10 karcinomu prostaty (finasterid 1,8 % oproti placebu 1,1 %).
pacientů s karcinomem prostaty léčených přípravkem AVODART nebyl prokázán žádný klinický přínos.
Poruchy reprodukce a prsu
Ve 3 stěžejních placebem kontrolovaných studiích BPH s AVODARTem 0,5 mg, trvajících každé 4 roky, nebyly žádné důkazy o zvýšených sexuálních nežádoucích reakcích (impotence, snížené libido a porucha ejakulace) nebo poruchách prsu při delším trvání léčby. Mezi těmito 3 studiemi byl 1 případ rakoviny prsu ve skupině s dutasteridem a 1 případ ve skupině s placebem. Ve 4leté studii CombAT nebo 4leté studii REDUCE nebyly hlášeny žádné případy rakoviny prsu v žádné léčebné skupině.
Vztah mezi dlouhodobým užíváním dutasteridu a mužskou neoplazií prsu není v současnosti znám.
Kombinace s terapií alfa-blokátory (CombAT)
Více než 4 800 mužů s BPH bylo náhodně rozděleno do 4leté dvojitě zaslepené studie, kterým byl podáván 0,5 mg AVODART 0,5 mg, 0,4 mg tamsulosin nebo kombinovaná léčba (0,5 mg AVODART plus 0,4 mg tamsulosinu) podávaná jednou denně. Celkem 1 623 subjektů dostalo monoterapii přípravkem AVODART; 1 611 subjektů dostávalo monoterapii tamsulosinem; a 1 610 subjektů dostalo kombinovanou terapii. Populace byla ve věku 49 až 88 let (průměrný věk: 66 let) a 88 % byli běloši. Tabulka 2 shrnuje nežádoucí účinky hlášené u nejméně 1 % subjektů ve skupině s kombinací a s vyšší incidencí než u subjektů léčených monoterapií přípravkem AVODART 0,5 mg nebo tamsulosinem.
Srdeční selhání
CombAT po 4 letech léčby byla incidence složeného termínu srdeční selhání ve skupině s kombinovanou terapií (12/1 610; 0,7 %) vyšší než v obou skupinách s monoterapií: AVODART 0,5 mg, 2/1 623 (0,1 %) a tamsulosin, 9/1 611 (0,6 %). Kompozitní srdeční selhání bylo také zkoumáno v samostatné 4leté placebem kontrolované studii hodnotící AVODART u mužů s rizikem rozvoje rakoviny prostaty. Incidence srdečního selhání u subjektů užívajících AVODART 0,5 mg byla 0,6 % (26/4 105) ve srovnání s 0,4 % (15/4 126) u subjektů užívajících placebo. Většina subjektů se srdečním selháním v obou studiích měla komorbidity spojené se zvýšeným rizikem srdečního selhání. Klinický význam numerické nerovnováhy u srdečního selhání proto není znám. Nebyla prokázána žádná příčinná souvislost mezi AVODART samotným nebo v kombinaci s tamsulosinem a srdečním selháním. V žádné studii nebyla pozorována nerovnováha ve výskytu celkových kardiovaskulárních nežádoucích příhod.
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během používání přípravku AVODART po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku. Tyto reakce byly vybrány pro zařazení kvůli kombinaci jejich závažnosti, četnosti hlášení nebo potenciální kauzální souvislosti s AVODARTem.
Poruchy imunitního systému
Hypersenzitivní reakce, včetně vyrážky, svědění, kopřivky, lokalizovaného edému, závažných kožních reakcí a angioedému.
Novotvary
Mužská rakovina prsu.
Psychiatrické poruchy
Depresivní nálada.
Poruchy reprodukčního systému a prsu
Bolest varlat a otok varlat.
DROGOVÉ INTERAKCE
Inhibitory cytochromu P450 3A
Dutasterid je u lidí rozsáhle metabolizován izoenzymy cytochromu P450 (CYP)3A4 a CYP3A5. Účinek silných inhibitorů CYP3A4 na dutasterid nebyl studován. Vzhledem k možnosti lékových interakcí buďte opatrní při předepisování přípravku AVODART pacientům užívajícím silné, chronické inhibitory enzymu CYP3A4 (např. ritonavir) [viz KLINICKÁ FARMAKOLOGIE ].
Alfa-adrenergní antagonisté
Podávání přípravku AVODART v kombinaci s tamsulosinem nebo terazosinem nemá žádný vliv na farmakokinetiku v ustáleném stavu žádného z alfa-adrenergních antagonistů. Vliv podávání tamsulosinu nebo terazosinu na farmakokinetické parametry dutasteridu nebyl hodnocen.
Antagonisté vápníkového kanálu
Současné podávání verapamilu nebo diltiazemu snižuje clearance dutasteridu a vede ke zvýšené expozici dutasteridu. Změna expozice dutasteridu se nepovažuje za klinicky významnou. Nedoporučuje se žádná úprava dávky [viz KLINICKÁ FARMAKOLOGIE ].
Cholestyramin
Podání jedné 5mg dávky přípravku AVODART 0,5 mg následované 1 hodinou později 12 g cholestyraminu neovlivňuje relativní biologickou dostupnost dutasteridu (viz KLINICKÁ FARMAKOLOGIE ].
Digoxin
AVODART 0,5 mg nemění farmakokinetiku digoxinu v ustáleném stavu, pokud je podáván současně v dávce 0,5 mg/den po dobu 3 týdnů (viz KLINICKÁ FARMAKOLOGIE ].
Warfarin
Současné podávání přípravku AVODART 0,5 mg/den po dobu 3 týdnů s warfarinem nemění farmakokinetiku izomerů S- nebo R-warfarinu v ustáleném stavu ani nemění účinek warfarinu na protrombinový čas (viz KLINICKÁ FARMAKOLOGIE ].
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Účinky na prostatický specifický antigen (PSA) a použití PSA při detekci rakoviny prostaty
klinických studiích snížil AVODART 0,5 mg sérovou koncentraci PSA přibližně o 50 % během 3 až 6 měsíců léčby. Tento pokles byl předvídatelný v celém rozsahu hodnot PSA u subjektů se symptomatickou BPH, i když se může u jednotlivců lišit. AVODART 0,5 mg může také způsobit snížení PSA v séru v přítomnosti rakoviny prostaty. Pro interpretaci sériových PSA u mužů užívajících AVODART 0,5 mg by měla být stanovena nová výchozí hodnota PSA alespoň 3 měsíce po zahájení léčby a poté by PSA měla být pravidelně monitorována. Jakékoli potvrzené zvýšení z nejnižší hodnoty PSA během léčby AVODARTem může signalizovat přítomnost rakoviny prostaty a mělo by být vyhodnoceno, i když jsou hladiny PSA stále v normálním rozmezí pro muže, kteří neužívají inhibitor 5-alfareduktázy. Nesoulad s AVODART může také ovlivnit výsledky testu PSA.
Pro interpretaci izolované hodnoty PSA u muže léčeného přípravkem AVODART 0,5 mg po dobu 3 měsíců nebo déle by měla být hodnota PSA zdvojnásobena pro srovnání s normálními hodnotami u neléčených mužů. Poměr volného a celkového PSA (procento volného PSA) zůstává konstantní i pod vlivem AVODARTu. Pokud se lékaři rozhodnou použít procento volného PSA jako pomůcku při detekci rakoviny prostaty u mužů užívajících AVODART, nezdá se, že by bylo nutné upravovat jeho hodnotu.
Současné podávání dutasteridu a tamsulosinu vedlo k podobným změnám PSA v séru jako monoterapie dutasteridem.
Zvýšené riziko rakoviny prostaty vysokého stupně
U mužů ve věku 50 až 75 let s předchozí negativní biopsií na karcinom prostaty a výchozí hodnotou PSA mezi 2,5 ng/ml a 10,0 ng/ml, kteří užívali AVODART ve 4leté studii Reduction by Dutasteride of Prostate Cancer Events (REDUCE), došlo zvýšený výskyt rakoviny prostaty Gleason skóre 810 ve srovnání s muži užívajícími placebo (AVODART 1,0 % versus placebo 0,5 %) [viz INDIKACE A POUŽITÍ , NEŽÁDOUCÍ REAKCE ]. V 7leté placebem kontrolované klinické studii s jiným inhibitorem 5-alfa-reduktázy (finasterid 5 mg, PROSCAR) byly pozorovány podobné výsledky pro Gleasonovo skóre 8-10 karcinomu prostaty (finasterid 1,8 % oproti placebu 1,1 %).
Inhibitory 5-alfa-reduktázy mohou zvýšit riziko rozvoje rakoviny prostaty vysokého stupně. Nebylo stanoveno, zda účinek inhibitorů 5-alfa-reduktázy na snížení objemu prostaty nebo faktory související se studiem ovlivnily výsledky těchto studií.
Hodnocení pro jiná urologická onemocnění
Před zahájením léčby přípravkem AVODART 0,5 mg je třeba zvážit další urologická onemocnění, která mohou způsobit podobné příznaky. Kromě toho mohou koexistovat BPH a rakovina prostaty.
Transdermální expozice AVODARTU 0,5 mg u těhotných žen – riziko pro mužský plod
S tobolkami AVODART by neměly manipulovat ženy, které jsou těhotné nebo mohou být těhotné. Dutasterid může být absorbován kůží a mohl by vést k nezamýšlené expozici plodu a potenciálnímu riziku pro mužský plod. Pokud se těhotná žena dostane do kontaktu s prosakujícími tobolkami dutasteridu, kontaktní oblast by měla být okamžitě omyta mýdlem a vodou [viz Použití u konkrétních populací ]. Dutasterid může být absorbován kůží na základě studií na zvířatech [viz Neklinická toxikologie ].
Darování krve
Muži léčení přípravkem AVODART by neměli darovat krev, dokud neuplyne alespoň 6 měsíců od poslední dávky. Účelem tohoto odloženého období je zabránit podávání dutasteridu těhotné příjemkyni transfuze.
Vliv na vlastnosti spermatu
Účinky dutasteridu 0,5 mg/den na charakteristiky spermatu byly hodnoceny u zdravých mužů během 52 týdnů léčby a 24 týdnů následného sledování po léčbě. V 52. týdnu vedla léčba dutasteridem ve srovnání s placebem k průměrnému snížení celkového počtu spermií, objemu spermatu a motility spermií; účinky na celkový počet spermií nebyly po 24 týdnech sledování reverzibilní. Koncentrace spermií a morfologie spermií nebyly ovlivněny a průměrné hodnoty pro všechny parametry spermatu zůstaly ve všech časových bodech v normálním rozmezí. Klinický význam účinku dutasteridu na charakteristiky spermatu pro fertilitu jednotlivých pacientů není znám [viz Použití u konkrétních populací ].
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( INFORMACE PRO PACIENTA ).
Monitorování PSA
Informujte pacienty, že AVODART snižuje hladiny PSA v séru přibližně o 50 % během 3 až 6 měsíců léčby, i když se může u každého jedince lišit. U pacientů podstupujících screening PSA může zvýšení hladin PSA během léčby přípravkem AVODART signalizovat přítomnost rakoviny prostaty a mělo by být vyhodnoceno poskytovatelem zdravotní péče [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Zvýšené riziko rakoviny prostaty vysokého stupně
Informujte pacienty, že došlo ke zvýšení rakoviny prostaty vysokého stupně u mužů léčených 5 inhibitory alfa-reduktázy (které jsou indikovány k léčbě BPH), včetně přípravku AVODART 0,5 mg, ve srovnání s těmi, kteří byli léčeni placebem ve studiích zaměřených na použití těchto léky na snížení rizika rakoviny prostaty [viz INDIKACE A POUŽITÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , NEŽÁDOUCÍ REAKCE ].
Transdermální expozice AVODARTu u těhotných nebo potenciálně těhotných žen – riziko pro mužský plod
Informujte pacienty, že s tobolkami AVODART 0,5 mg by neměly manipulovat ženy, které jsou těhotné nebo mohou být potenciálně těhotné, kvůli možné absorpci dutasteridu a následnému potenciálnímu riziku pro vyvíjející se plod mužského pohlaví. Dutasterid může být absorbován kůží a může vést k nechtěné expozici plodu. Pokud se těhotná nebo potenciálně těhotná žena dostane do kontaktu s prosakujícími tobolkami AVODART 0,5 mg, kontaktní oblast by měla být okamžitě omyta mýdlem a vodou [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , Použití u konkrétních populací ].
Účinky na parametry spermatu
Upozorněte muže, že AVODART 0,5 mg může ovlivnit vlastnosti spermií, ale účinek na fertilitu není znám (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , Použití u konkrétních populací ].
Darování krve
Informujte muže léčené přípravkem AVODART 0,5 mg, že nemají darovat krev dříve než 6 měsíců po poslední dávce, aby se zabránilo těhotným ženám dostávat dutasterid prostřednictvím krevní transfuze (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Hladiny dutasteridu v séru jsou detekovatelné po dobu 4 až 6 měsíců po ukončení léčby [viz KLINICKÁ FARMAKOLOGIE ].
AVODART je ochranná známka vlastněná nebo licencovaná skupinou společností GSK.
Ostatní uvedené značky jsou ochranné známky vlastněné nebo licencované jejich příslušnými vlastníky a nejsou vlastněny ani licencovány skupinou společností GSK. Tvůrci těchto značek nejsou přidruženi a nepodporují skupinu společností GSK ani její produkty.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Dvouletá studie karcinogenity byla provedena na myších B6C3F1 v dávkách 3, 35, 250 a 500 mg/kg/den pro samce a 3, 35 a 250 mg/kg/den pro samice; zvýšený výskyt benigních hepatocelulárních adenomů byl zaznamenán pouze u samic myší při dávce 250 mg/kg/den (290násobek MRHD 0,5 mg denní dávky). Dva ze 3 hlavních lidských metabolitů byly detekovány u myší. Expozice těmto metabolitům u myší je buď nižší než u lidí, nebo není známa.
Ve dvouleté studii karcinogenity u potkanů Han Wistar při dávkách 1,5, 7,5 a 53 mg/kg/den u samců a 0,8, 6,3 a 15 mg/kg/den u samic došlo ke zvýšení Leydigových buněk adenomy ve varlatech při 135násobku MRHD (53 mg/kg/den a více). Zvýšený výskyt hyperplazie Leydigových buněk byl přítomen při 52násobku MRHD (dávky samců potkanů 7,5 mg/kg/den a vyšší). Pozitivní korelace mezi proliferativními změnami v Leydigových buňkách a zvýšením hladiny cirkulujícího luteinizačního hormonu byla prokázána u inhibitorů 5-alfa-reduktázy a je v souladu s účinkem na osu hypotalamus-hypofýza-varlata po inhibici 5-alfa-reduktázy. Při tumorogenních dávkách byly hladiny luteinizačního hormonu u potkanů zvýšeny o 167 %. V této studii byly hlavní lidské metabolity testovány na karcinogenitu při přibližně 1 až 3násobku očekávané klinické expozice.
Mutageneze
Dutasterid byl testován na genotoxicitu v testu bakteriální mutageneze (Amesův test), testu chromozomálních aberací v buňkách vaječníků čínského křečka a mikronukleárním testu u potkanů. Výsledky neukázaly žádný genotoxický potenciál mateřského léčiva. Dva hlavní lidské metabolity byly také negativní buď v Amesově testu, nebo ve zkráceném Amesově testu.
Zhoršení Plodnosti
Léčba pohlavně dospělých samců potkanů dutasteridem v 0,1násobku MRHD (dávky pro zvířata 0,05 mg/kg/den nebo vyšší po dobu až 31 týdnů) na základě průměrné sérové koncentrace vedla k poklesu plodnosti závislému na dávce a času při všech dávkách ; snížený (absolutní) počet spermií v kaudě nadvarlete, ale ne koncentrace spermií (při 50 a 500 mg/kg/den); snížená hmotnost nadvarlete, prostaty a semenných váčků; a mikroskopické změny (cytoplazmatická vakuolizace tubulárního epitelu v nadvarletích a/nebo snížený cytoplazmatický obsah epitelu, konzistentní se sníženou sekreční aktivitou v prostatě a semenných váčcích) v reprodukčních orgánech při všech dávkách bez přítomnosti otcovské toxicity. Účinky na plodnost byly zvráceny 6. týdnem zotavení při všech dávkách a počet spermií byl na konci 14týdenního období zotavení normální. Mikroskopické změny již nebyly přítomny ve 14. týdnu zotavení při 0,1násobku MRHD a byly částečně obnoveny ve zbývajících léčebných skupinách. Nízké hladiny dutasteridu (0,6 až 17 ng/ml) byly detekovány v séru neléčených potkaních samic spářených s léčenými samci (10 až 500 mg/kg/den po dobu 29 až 30 týdnů), což je 16 až 110krát vyšší než MRHD na základě střední koncentrace v séru. U samců neléčených samic potkanů spárovaných s léčenými potkaními samci nedošlo k žádné feminizaci, i když u samic potkanů byly pozorovány detekovatelné hladiny dutasteridu v krvi.
Ve studii fertility u samic potkanů s dávkováním 4 týdny před pářením až do časné březosti vedlo perorální podávání dutasteridu v dávkách 0,05, 2,5, 12,5 a 30 mg/kg/den ke snížení velikosti vrhu v důsledku zvýšené resorpce a feminizace plodů mužského pohlaví (snížená anogenitální vzdálenost) na 2 až 10násobku MRHD (dávky pro zvířata 2,5 mg/kg/den nebo vyšší) na základě průměrné sérové koncentrace, za přítomnosti mateřské toxicity (snížený přírůstek tělesné hmotnosti). Tělesná hmotnost plodu byla také snížena na přibližně 0,02násobek MRHD (dávka potkana 0,05 mg/kg/den nebo vyšší) na základě průměrné sérové koncentrace, bez hladiny bez účinku, při absenci mateřské toxicity.
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
AVODART 0,5 mg je kontraindikován pro použití v těhotenství, protože může způsobit poškození plodu mužského pohlaví (viz KONTRAINDIKACE ]. AVODART není indikován k použití u žen.
AVODART 0,5 mg je inhibitor 5-alfa-reduktázy, který zabraňuje přeměně testosteronu na dihydrotestosteron (DHT), hormon nezbytný pro normální vývoj mužských genitálií. Abnormality v genitáliích mužských plodů jsou očekávaným fyziologickým důsledkem inhibice této konverze. Tyto výsledky jsou podobné pozorování u kojenců mužského pohlaví s genetickým deficitem 5-alfa-reduktázy.
V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 % až 4 % a 15 % až 20 %.
reprodukčních studiích na zvířatech dutasterid inhiboval normální vývoj zevních genitálií u samčích potomků, když byl podáván potkanům nebo králíkům během organogeneze v dávce nižší, než je maximální doporučená dávka pro člověka (MRHD) 0,5 mg denně, bez mateřské toxicity. Při 15násobku MRHD byly u potkanů pozorovány prodloužené březosti, snížená hmotnost reprodukčních orgánů a opožděná puberta u samčích potomků, přičemž hladiny bez účinku byly nižší než MRHD 0,5 mg denně. Byla také pozorována zvýšená hmotnost placenty u králíků, přičemž hladiny bez účinku nižší než MRHD 0,5 mg denně (viz Data ).
Přestože je dutasterid vylučován do lidského spermatu, koncentrace léčiva u partnerky je přibližně 100krát nižší než koncentrace vyvolávající abnormality mužských genitálií ve studiích na zvířatech (viz Data ). U opic, kterým byly během organogeneze podávány koncentrace v krvi srovnatelné s hladinami, kterým je podle odhadu vystavena lidská partnerka, nebo nad nimi, nebyly vnější genitálie samčích potomků nepříznivě ovlivněny. U samčích potomků neléčených potkaních samic, které byly pářeny s léčenými potkaními samci, nedošlo k žádné feminizaci, i když byly u potkaních samic pozorovány detekovatelné hladiny dutasteridu v krvi [viz Neklinická toxikologie ].
Data
Lidská data
Nejvyšší naměřená koncentrace dutasteridu v spermatu u léčených mužů byla 14 ng/ml. Ačkoli je dutasterid detekován ve spermatu, za předpokladu expozice 50kg ženy 5 ml spermatu a 100% absorpci by byla očekávaná koncentrace dutasteridu v krvi ženy prostřednictvím spermatu asi 0,0175 ng/ml. Tato koncentrace je přibližně 100krát nižší než koncentrace v krvi vyvolávající abnormality mužských genitálií ve studiích na zvířatech. Dutasterid se ve vysoké míře váže na proteiny v lidském spermatu (více než 96 %), což může snížit množství dutasteridu dostupného pro vaginální absorpci.
Údaje o zvířatech
Ve studii embryo-fetálního vývoje u potkanů vedlo perorální podávání dutasteridu v dávce 10krát nižší než MRHD 0,5 mg denně (na základě průměrných hladin v krvi u mužů) k feminizaci mužských genitálií u plodu (snížení anogenitální vzdálenosti při dávce 0,05 mg /kg/den, s nedostatkem hladiny bez účinku) při absenci mateřské toxicity. Kromě toho se u plodů samic léčených v dávkách 2,5 mg/kg/den nebo vyšších (přibližně 15násobek MRHD) objevil vývoj bradavek, hypospadie a rozšířené předkožkové žlázy. Snížená tělesná hmotnost plodu a související opožděná osifikace v přítomnosti mateřské toxicity (snížený přírůstek tělesné hmotnosti) byly pozorovány při expozici matky přibližně 15násobku MRHD (dávka 2,5 mg/kg/den nebo vyšší). Zvýšení počtu mrtvě narozených mláďat bylo pozorováno u samic léčených dávkou 30 mg/kg/den (přibližně 111násobek MRHD), s hladinou bez účinku 12,5 mg/kg/den.
Ve studii embryo-fetálního vývoje králíků byly dávky 28násobku MRHD (dávky 30 mg/kg/den nebo vyšší), založené na průměrných krevních hladinách u mužů, podávány perorálně ve dnech gestace 7 až 29 (během organogeneze a později období vývoje vnějších genitálií). Histologické hodnocení genitální papily plodů odhalilo známky feminizace mužského plodu, stejně jako srostlé lebeční kosti a zvýšenou hmotnost placenty při všech dávkách bez mateřské toxicity. Druhá studie embryo-fetálního vývoje u králíků, kterým byla podávána dávka během březosti (organogeneze a pozdější období vývoje vnějších genitálií [6. až 29. den gestace]) při 0,3násobku MRHD (dávky 0,05 mg/kg/den nebo vyšší, bez žádných úroveň účinku), také prokázaly feminizaci genitálií u plodů mužského pohlaví a zvýšenou hmotnost placenty při všech dávkách bez mateřské toxicity.
Ve studii embryo-fetálního vývoje byly březí opice makak rhesus během organogeneze (20. až 100. den gestace) intravenózně vystaveny hladině dutasteridu v krvi srovnatelné nebo vyšší než odhadovaná expozice dutasteridu u partnerky. Dutasterid byl podáván ve dnech gestace 20 až 100 (během organogeneze) v dávkách 400, 780, 1 325 nebo 2 010 ng/den (12 opic/skupina). Nebyla pozorována žádná feminizace samčích vnějších genitálií opičích potomků. Při nejvyšší testované dávce bylo pozorováno snížení hmotnosti fetálních nadledvin, snížení hmotnosti fetální prostaty a zvýšení hmotnosti fetálních vaječníků a varlat. Na základě nejvyšší naměřené koncentrace dutasteridu v spermatu u léčených mužů (14 ng/ml) představují tyto dávky u opic až 16násobek potenciální maximální expozice 50kg lidské ženy 5 ml spermatu denně z dutasteridu- léčeného muže, za předpokladu 100% absorpce. Úrovně dávek (na základě ng/kg) podávané opicím v této studii jsou 32 až 186násobek nominální dávky (ng/kg), které by mohla být samice potenciálně vystavena prostřednictvím spermatu. Není známo, zda králíci nebo opice rhesus produkují některý z hlavních lidských metabolitů.
Ve studii orálního pre- a postnatálního vývoje u potkanů byla pozorována feminizace samčích genitálií. Snížená anogenitální vzdálenost byla pozorována při 0,05násobku MRHD a více (0,05 mg/kg/den a více), s nepřítomností hladiny bez účinku, na základě průměrných krevních hladin u mužů jako odhad AUC. Hypospadie a rozvoj bradavek byly pozorovány při dávce 2,5 mg/kg/den nebo vyšší (14násobek MRHD nebo vyšší, s hladinou bez účinku při dávce 0,05 mg/kg/den). Dávky 2,5 mg/kg/den a vyšší také vedly k prodloužené březosti u rodičovských samic, prodloužení doby do balano-prepuciální separace u samčích potomků, zkrácení doby do vaginální průchodnosti u samičích potomků a snížení prostaty a hmotnosti semenných váčků u mužských potomků. Při dávce 30 mg/kg/den (102násobek MRHD za přítomnosti mateřské toxicity [snížená tělesná hmotnost]) byl zaznamenán zvýšený počet mrtvě narozených dětí a snížená neonatální životaschopnost u potomků.
Laktace
Shrnutí rizik
AVODART není indikován k použití u žen. Nejsou dostupné žádné informace o přítomnosti dutasteridu v mateřském mléce, o účincích na kojené dítě nebo o účincích na produkci mléka.
Ženy a muži reprodukčního potenciálu
Neplodnost
Muži
Účinky dutasteridu 0,5 mg/den na charakteristiky spermatu byly hodnoceny u normálních dobrovolníků ve věku 18 až 52 let (n = 27 dutasterid, n = 23 placebo) po dobu 52 týdnů léčby a 24 týdnů následného sledování po léčbě. V 52. týdnu bylo průměrné procento snížení celkového počtu spermií, objemu spermatu a motility spermií 23 %, 26 % a 18 %, v daném pořadí, ve skupině s dutasteridem, když se upravilo na změny oproti výchozí hodnotě ve skupině s placebem. Koncentrace spermií a morfologie spermií nebyly ovlivněny. Po 24 týdnech sledování zůstala průměrná procentuální změna celkového počtu spermií ve skupině s dutasteridem o 23 % nižší než výchozí hodnota. Zatímco průměrné hodnoty všech parametrů spermatu ve všech časových bodech zůstaly v normálních rozmezích a nesplňovaly předem definovaná kritéria pro klinicky významnou změnu (30 %), 2 subjekty ve skupině s dutasteridem měly pokles počtu spermií o více než 90 % oproti výchozí hodnotě. 52 týdnů, s částečným zotavením při 24týdenním sledování. Klinický význam účinku dutasteridu na charakteristiky spermatu pro fertilitu jednotlivých pacientů není znám [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Pediatrické použití
AVODART 0,5 mg není indikován k použití u pediatrických pacientů. Bezpečnost a účinnost u pediatrických pacientů nebyla stanovena.
Geriatrické použití
Z 2 167 mužů léčených přípravkem AVODART 0,5 mg ve 3 klinických studiích bylo 60 % ve věku 65 let a více a 15 % bylo ve věku 75 let a více. Mezi těmito subjekty a mladšími subjekty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti. Jiné hlášené klinické zkušenosti nezjistily rozdíly v odpovědích mezi staršími a mladšími pacienty, ale nelze vyloučit větší citlivost některých starších jedinců [viz KLINICKÁ FARMAKOLOGIE ].
Renální poškození
U pacientů s poruchou funkce ledvin není nutná úprava dávky pro AVODART 0,5 mg (viz KLINICKÁ FARMAKOLOGIE ].
Poškození jater
Vliv poruchy funkce jater na farmakokinetiku dutasteridu nebyl studován. Protože je dutasterid extenzivně metabolizován, expozice by mohla být vyšší u pacientů s poruchou funkce jater. Nicméně v klinické studii, kde 60 subjektů dostávalo 5 mg (10násobek terapeutické dávky) denně po dobu 24 týdnů, nebyly pozorovány žádné další nežádoucí účinky ve srovnání s těmi, které byly pozorovány při terapeutické dávce 0,5 mg [viz KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
Ve studiích s dobrovolníky byly podávány jednotlivé dávky dutasteridu až do 40 mg (80násobek terapeutické dávky) po dobu 7 dnů bez významných obav o bezpečnost. V klinické studii byly denní dávky 5 mg (10násobek terapeutické dávky) podávány 60 subjektům po dobu 6 měsíců bez dalších nežádoucích účinků, které byly pozorovány u terapeutických dávek 0,5 mg.
Pro dutasterid neexistuje žádné specifické antidotum. V případech podezření na předávkování by proto měla být poskytnuta vhodná symptomatická a podpůrná léčba, přičemž je třeba vzít v úvahu dlouhý poločas dutasteridu.
KONTRAINDIKACE
AVODART 0,5 mg je kontraindikován pro použití u:

- Těhotenství. Použití dutasteridu je kontraindikováno u těhotných žen. Ve studiích reprodukční toxicity a vývojové toxicity na zvířatech dutasterid inhiboval vývoj zevních genitálií mužského plodu. Proto může AVODART 0,5 mg způsobit poškození plodu při podání těhotné ženě [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , Použití u konkrétních populací ].
- Pacienti s dříve prokázanou klinicky významnou hypersenzitivitou (např. závažné kožní reakce, angioedém) na AVODART nebo jiné inhibitory 5-alfa-reduktázy (viz NEŽÁDOUCÍ REAKCE ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Dutasterid inhibuje přeměnu testosteronu na DHT. DHT je androgen primárně zodpovědný za počáteční vývoj a následné zvětšení prostaty. Testosteron je přeměněn na DHT enzymem 5-alfa-reduktázou, která existuje jako 2 izoformy, typ 1 a typ 2. Isoenzym typu 2 je primárně aktivní v reprodukčních tkáních, zatímco izoenzym typu 1 je také zodpovědný za konverzi testosteronu v kůže a játra.
Dutasterid je kompetitivní a specifický inhibitor izoenzymů 5-alfa-reduktázy typu 1 i typu 2, se kterými tvoří stabilní enzymový komplex. Disociace z tohoto komplexu byla hodnocena za podmínek in vitro a in vivo a je extrémně pomalá. Dutasterid se neváže na lidský androgenní receptor.
Farmakodynamika
Vliv na 5 alfa-dihydrotestosteron a testosteron
Maximální účinek denních dávek dutasteridu na snížení DHT je závislý na dávce a je pozorován během 1 až 2 týdnů. Po 1 a 2 týdnech denního podávání dutasteridu 0,5 mg byly střední koncentrace DHT v séru sníženy o 85 % a 90 %. U pacientů s BPH léčených dutasteridem 0,5 mg/den po dobu 4 let byl střední pokles sérového DHT 94 % po 1 roce, 93 % po 2 letech a 95 % po 3 i 4 letech. Medián zvýšení sérového testosteronu byl 19 % po 1 a 2 letech, 26 % po 3 letech a 22 % po 4 letech, ale průměr a medián hladin zůstaly ve fyziologickém rozmezí.
pacientů s BPH léčených dutasteridem v dávce 5 mg/den nebo placebem po dobu až 12 týdnů před transuretrální resekcí prostaty byly průměrné koncentrace DHT v prostatické tkáni významně nižší ve skupině s dutasteridem ve srovnání s placebem (784 a 5 793 pg/g respektive P
Dospělí muži s geneticky zděděným nedostatkem alfa-reduktázy typu 2 5 mají také snížené hladiny DHT. Tito muži s deficitem 5 alfa-reduktázy mají po celý život malou prostatu a nevyvine se u nich BPH. Kromě souvisejících urogenitálních defektů přítomných při narození nebyly u těchto jedinců pozorovány žádné další klinické abnormality související s deficitem 5-alfa-reduktázy.
Účinky na jiné hormony
zdravých dobrovolníků nevedlo 52 týdnů léčby dutasteridem 0,5 mg/den (n = 26) k žádné klinicky významné změně ve srovnání s placebem (n = 23) u globulinu vázajícího pohlavní hormony, estradiolu, luteinizačního hormonu, folikuly stimulujícího hormonu, tyroxin (volný T4) a dehydroepiandrosteron. Statisticky signifikantní, na výchozí hodnotu upravená průměrná zvýšení ve srovnání s placebem byla pozorována u celkového testosteronu v 8. týdnu (97,1 ng/dl, P
Další efekty
Plazmatický lipidový panel a kostní minerální hustota byly hodnoceny po 52 týdnech podávání dutasteridu 0,5 mg jednou denně u zdravých dobrovolníků. Ve srovnání s placebem nebo výchozí hodnotou nedošlo k žádné změně v hustotě kostního minerálu, jak bylo měřeno pomocí rentgenové absorptiometrie s duální energií. Kromě toho nebyl dutasteridem ovlivněn profil plazmatických lipidů (tj. celkový cholesterol, lipoproteiny s nízkou hustotou, lipoproteiny s vysokou hustotou, triglyceridy). V podskupině populace (n = 13) v jednoleté studii se zdravými dobrovolníky nebyly pozorovány žádné klinicky významné změny v odpovědích hormonů nadledvin na stimulaci adrenokortikotropním hormonem (ACTH).
Farmakokinetika
Vstřebávání
Po podání jedné 0,5mg dávky měkké želatinové tobolky nastává čas k dosažení maximálních sérových koncentrací (Tmax) dutasteridu během 2 až 3 hodin. Absolutní biologická dostupnost u 5 zdravých subjektů je přibližně 60 % (rozmezí: 40 % až 94 %). Při podávání léku s jídlem byly maximální sérové koncentrace sníženy o 10 % až 15 %. Toto snížení nemá žádný klinický význam.
Rozdělení
Farmakokinetické údaje po jednotlivých a opakovaných perorálních dávkách ukazují, že dutasterid má velký distribuční objem (300 až 500 l). Dutasterid se silně váže na plazmatický albumin (99,0 %) a kyselý alfa-1 glykoprotein (96,6 %).
Ve studii se zdravými jedinci (n = 26), kteří dostávali dutasterid 0,5 mg/den po dobu 12 měsíců, byly koncentrace dutasteridu ve spermatu v průměru 3,4 ng/ml (rozmezí: 0,4 až 14 ng/ml) po 12 měsících a podobně jako v séru byly dosaženy stabilní hodnoty -uvádějte koncentrace po 6 měsících. V průměru se po 12 měsících 11,5 % sérových koncentrací dutasteridu rozdělilo do spermatu.
Metabolismus A Eliminace
Dutasterid je u lidí extenzivně metabolizován. Studie in vitro ukázaly, že dutasterid je metabolizován izoenzymy CYP3A4 a CYP3A5. Oba tyto izoenzymy produkovaly metabolity 4'-hydroxydutasterid, 6-hydroxydutasterid a 6,4'-dihydroxydutasterid. Kromě toho byl metabolit 15-hydroxydutasteridu tvořen CYP3A4. Dutasterid není in vitro metabolizován izoenzymy lidského cytochromu P450 CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 a CYP2E1. V lidském séru po podání do ustáleného stavu zůstal nezměněný dutasterid, 3 hlavní metabolity (4'-hydroxydutasterid, 1,2-dihydrodutasterid a 6-hydroxydutasterid) a 2 vedlejší metabolity (6,4'-dihydroxydutasterid a 15 -hydroxydutasterid), jak bylo stanoveno hmotnostní spektrometrickou odezvou. Absolutní stereochemie hydroxylových adic v polohách 6 a 15 není známa. In vitro jsou metabolity 4'-hydroxydutasteridu a 1,2-dihydrodutasteridu mnohem méně účinné než dutasterid proti oběma izoformám lidské 5-alfa-reduktázy. Aktivita 6β-hydroxydutasteridu je srovnatelná s aktivitou dutasteridu.
Dutasterid a jeho metabolity byly vylučovány převážně stolicí. Jako procento dávky bylo přibližně 5 % nezměněného dutasteridu (~1 % až ~15 %) a 40 % ve formě metabolitů souvisejících s dutasteridem (~2 % až ~90 %). V moči byla nalezena pouze stopová množství nezměněného dutasteridu (
Terminální eliminační poločas dutasteridu je přibližně 5 týdnů v ustáleném stavu. Průměrná sérová koncentrace dutasteridu v ustáleném stavu byla 40 ng/ml po 0,5 mg/den po dobu 1 roku. Po denním dávkování dosahují sérové koncentrace dutasteridu 65 % koncentrace v ustáleném stavu po 1 měsíci a přibližně 90 % po 3 měsících. Vzhledem k dlouhému poločasu dutasteridu zůstávají sérové koncentrace detekovatelné (vyšší než 0,1 ng/ml) po dobu až 4 až 6 měsíců po ukončení léčby.
Specifické populace
Pediatričtí pacienti
Farmakokinetika dutasteridu nebyla zkoumána u subjektů mladších 18 let.
Geriatričtí pacienti
starších pacientů není nutná žádná úprava dávkování. Farmakokinetika a farmakodynamika dutasteridu byla hodnocena u 36 zdravých mužů ve věku 24 až 87 let po podání jedné 5mg dávky dutasteridu. V této studii s jednorázovou dávkou se poločas dutasteridu prodlužoval s věkem (přibližně 170 hodin u mužů ve věku 20 až 49 let, přibližně 260 hodin u mužů ve věku 50 až 69 let a přibližně 300 hodin u mužů starších 70 let). Z 2 167 mužů léčených dutasteridem ve 3 klíčových studiích bylo 60 % ve věku 65 a více let a 15 % ve věku 75 a více let. Mezi těmito pacienty a mladšími pacienty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti.
Mužské A ženské pacienty
AVODART je kontraindikován v těhotenství a není indikován k použití u žen [viz KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Farmakokinetika dutasteridu u žen nebyla studována.
Rasové A Etnické Skupiny
Vliv rasy na farmakokinetiku dutasteridu nebyl studován.
Pacienti s poruchou ledvin
Vliv poruchy funkce ledvin na farmakokinetiku dutasteridu nebyl studován. Méně než 0,1 % dávky dutasteridu v rovnovážném stavu 0,5 mg se však objeví v lidské moči, takže u pacientů s poruchou funkce ledvin se nepředpokládá žádná úprava dávkování.
Pacienti s poruchou funkce jater
Vliv poruchy funkce jater na farmakokinetiku dutasteridu nebyl studován. Protože je dutasterid extenzivně metabolizován, expozice by mohla být vyšší u pacientů s poruchou funkce jater.
Studie lékových interakcí
Inhibitory cytochromu P450
Nebyly provedeny žádné klinické studie lékových interakcí ke zhodnocení vlivu inhibitorů enzymu CYP3A na farmakokinetiku dutasteridu. Na základě údajů in vitro se však koncentrace dutasteridu v krvi mohou zvýšit v přítomnosti inhibitorů CYP3A4/5, jako je ritonavir, ketokonazol, verapamil, diltiazem, cimetidin, troleandomycin a ciprofloxacin.
Dutasterid neinhibuje in vitro metabolismus modelových substrátů pro hlavní izoenzymy lidského cytochromu P450 (CYP1A2, CYP2C9, CYP2C19, CYP2D6 a CYP3A4) v koncentraci 1 000 ng/ml, což je 25krát více než koncentrace v séru v ustáleném stavu u lidí .
Alfa-adrenergní antagonisté
V jednosekvenční zkřížené studii u zdravých dobrovolníků nemělo podávání tamsulosinu nebo terazosinu v kombinaci s AVODARTem žádný vliv na farmakokinetiku v ustáleném stavu ani jednoho z alfa-adrenergních antagonistů. Ačkoli nebyl hodnocen účinek podávání tamsulosinu nebo terazosinu na farmakokinetické parametry dutasteridu, procentuální změna koncentrací DHT byla podobná u samotného AVODARTU 0,5 mg ve srovnání s kombinovanou léčbou.
Antagonisté vápníkového kanálu
populační farmakokinetické analýze bylo zaznamenáno snížení clearance dutasteridu při současném podávání s inhibitory CYP3A4 verapamilem (-37 %, n = 6) a diltiazemem (-44 %, n = 5). Naproti tomu nebylo pozorováno žádné snížení clearance, když byl amlodipin, další antagonista kalciového kanálu, který není inhibitorem CYP3A4, podáván současně s dutasteridem (+7 %, n = 4).
Snížení clearance a následné zvýšení expozice dutasteridu v přítomnosti verapamilu a diltiazemu se nepovažuje za klinicky významné. Nedoporučuje se žádná úprava dávkování.
Cholestyramin
Podání jedné 5mg dávky přípravku AVODART 0,5 mg následované o 1 hodinu později 12 g cholestyraminu neovlivnilo relativní biologickou dostupnost dutasteridu u 12 normálních dobrovolníků.
Digoxin
Ve studii s 20 zdravými dobrovolníky AVODART 0,5 mg nezměnil farmakokinetiku digoxinu v ustáleném stavu, pokud byl podáván současně v dávce 0,5 mg/den po dobu 3 týdnů.
Warfarin
Ve studii s 23 zdravými dobrovolníky nezměnila 3týdenní léčba přípravkem AVODART 0,5 mg/den farmakokinetiku izomerů S- nebo R-warfarinu v ustáleném stavu ani účinek warfarinu na protrombinový čas při podávání s warfarinem.
Jiná souběžná terapie
Ačkoli nebyly provedeny specifické studie interakcí s jinými sloučeninami, přibližně 90 % subjektů ve 3 randomizovaných, dvojitě zaslepených, placebem kontrolovaných studiích bezpečnosti a účinnosti užívajících AVODART užívalo současně jiné léky. Kombinaci AVODARTu a souběžné léčbě nebylo možné přičíst žádné klinicky významné nežádoucí interakce, pokud byl AVODART podáván současně s antihyperlipidemiky, inhibitory angiotenzin-konvertujícího enzymu (ACE), beta-adrenergními blokátory, blokátory kalciových kanálů, kortikosteroidy, diuretiky, nesteroidními antirevmatiky. - léky proti zánětům (NSAID), inhibitory fosfodiesterázy typu V a chinolonová antibiotika.
Toxikologie zvířat a/nebo farmakologie
Toxikologické studie centrálního nervového systému
potkanů a psů vedlo opakované perorální podávání dutasteridu k tomu, že některá zvířata vykazovala známky nespecifické, reverzibilní, centrálně zprostředkované toxicity bez souvisejících histopatologických změn při expozicích 425- a 315-násobku očekávané klinické expozice (mateřského léčiva), v tomto pořadí .
Králičí dermální absorpce
Ve studii dermální farmakokinetiky králíků vedla dermální absorpce dutasteridu v CAPMUL (glyceryl oleát) u králíků k sérovým koncentracím 2,7 až 40,5 mcg/h/ml pro dávky 1 až 20 mg/ml, respektive 56 % až 100 % aplikovaného dutasteridu, aby se vstřebal v uzavřených a prodloužených podmínkách. Měkké želatinové tobolky AVODART podávané perorálně obsahují 0,5 mg dutasteridu rozpuštěného ve směsi mono-diglyceridů kyseliny kaprylové/kaprinové a butylovaného hydroxytoluenu. Dutasterid ve vodě byl u králíků absorbován minimálně (2 000 mg/kg).
Klinické studie
Monoterapie
AVODART 0,5 mg/den (n = 2 167) nebo placebo (n = 2 158) byly hodnoceny u mužů s BPH ve třech 2letých multicentrických, placebem kontrolovaných, dvojitě zaslepených studiích, každá s 2letým otevřeným prodloužením ( n = 2 340). Více než 90 % pokusné populace byli běloši. Subjekty byly ve věku alespoň 50 let se sérovým PSA ≥ 1,5 ng/ml a
Vliv na skóre příznaků
Symptomy byly kvantifikovány pomocí AUA-SI, dotazníku, který hodnotí močové symptomy (neúplné vyprázdnění, frekvence, intermitentnost, urgence, slabý proud, napětí a nykturie) hodnocením na stupnici 0 až 5 pro celkové možné skóre 35, přičemž vyšší číselné skóre celkového symptomu představující větší závažnost symptomů. Výchozí AUA-SI skóre ve 3 studiích bylo přibližně 17 jednotek v obou léčebných skupinách.
Subjekty užívající dutasterid dosáhly statisticky významného zlepšení symptomů oproti placebu do 3. měsíce v 1 studii a do 12. měsíce v dalších 2 klíčových studiích. Ve 12. měsíci bylo průměrné snížení celkových skóre symptomů AUA-SI od výchozí hodnoty ve 3 shromážděných studiích -3,3 jednotek pro dutasterid a -2,0 jednotek pro placebo s průměrným rozdílem mezi 2 léčebnými skupinami -1,3 (rozmezí: -1,1 do -1,5 jednotky v každé ze 3 studií, P
Tyto studie byly prospektivně navrženy tak, aby vyhodnotily účinky na symptomy založené na velikosti prostaty na počátku. U mužů s objemem prostaty ≥ 40 ccm byl průměrný pokles -3,8 jednotek pro dutasterid a -1,6 jednotek pro placebo, s průměrným rozdílem mezi 2 léčebnými skupinami -2,2 v měsíci 24. U mužů s objemem prostaty
Obrázek 1: Změna skóre AUA-SI od základní hodnoty (náhodné, dvojitě zaslepené, placebem kontrolované studie sdružené)
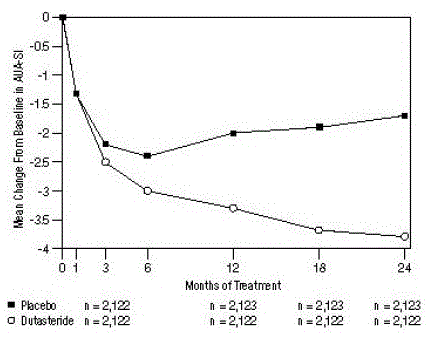
skóre AUA-SI se pohybuje od 0 do 35.
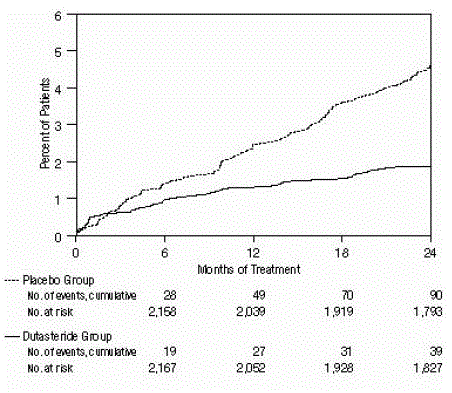
Vliv na akutní zadržování moči a potřebu operace související s BPH
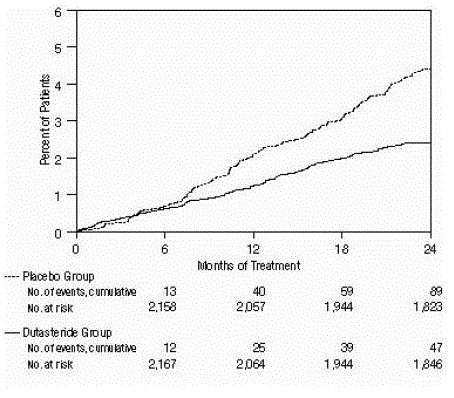
Účinnost byla také hodnocena po 2 letech léčby podle výskytu AUR vyžadující katetrizaci a urologickou chirurgickou intervenci související s BPH. Ve srovnání s placebem byl AVODART spojen se statisticky významně nižší incidencí AUR (1,8 % pro AVODART oproti 4,2 % pro placebo, P
Obrázek 2: Procento subjektů, u kterých se vyvinula akutní retence moči během 24měsíčního období (sdružené randomizované, dvojitě zaslepené, placebem kontrolované studie)
Obrázek 3: Procento pacientů, kteří podstoupili operaci pro benigní hyperplazii prostaty během 24měsíčního období (sdružené randomizované, dvojitě zaslepené, placebem kontrolované studie)
Vliv na objem prostaty
Pro vstup do studie byl vyžadován objem prostaty alespoň 30 cm3 měřený transrektálním ultrazvukem. Průměrný objem prostaty při vstupu do studie byl přibližně 54 cm3.
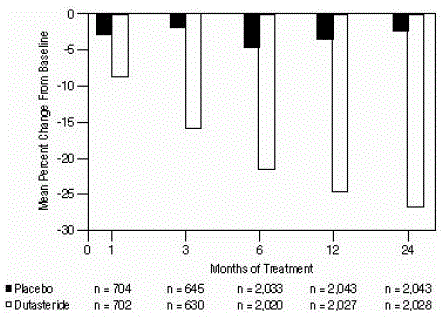
Statisticky významné rozdíly (AVODART 0,5 mg oproti placebu) byly zaznamenány při prvním měření objemu prostaty po léčbě v každé studii (1. měsíc, 3. měsíc nebo 6. měsíc) a pokračovaly až do 24. měsíce. Ve 12. měsíci byla průměrná procentní změna v objem prostaty ve 3 spojených studiích byl -24,7 % pro dutasterid a -3,4 % pro placebo; průměrný rozdíl (dutasterid mínus placebo) byl -21,3 % (rozmezí: -21,0 % až -21,6 % v každé ze 3 studií, P
Obrázek 4: Procentuální změna objemu prostaty oproti výchozí hodnotě (randomizované, dvojitě zaslepené, placebem kontrolované studie sdružené)
Vliv na maximální rychlost průtoku moči
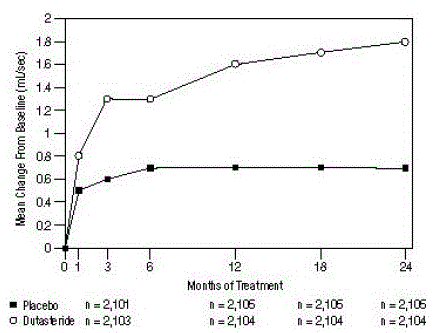
Pro vstup do studie byl vyžadován průměrný maximální průtok moči (Qmax) ≤15 ml/s. Qmax byl přibližně 10 ml/s na začátku ve 3 klíčových studiích.
Rozdíly mezi těmito 2 skupinami byly statisticky významné od výchozí hodnoty ve 3. měsíci ve všech 3 studiích a udržely se až do 12. měsíce. Ve 12. měsíci bylo průměrné zvýšení Qmax ve 3 souhrnných studiích 1,6 ml/s pro AVODART 0,5 mg a 0,7 ml /s pro placebo; průměrný rozdíl (dutasterid mínus placebo) byl 0,8 ml/s (rozmezí: 0,7 až 1,0 ml/s v každé ze 3 studií, P
Obrázek 5: Změna Qmax od základní hodnoty (náhodné, dvojitě zaslepené, placebem kontrolované studie sdružené)
Souhrn klinických studií
Údaje ze 3 velkých, dobře kontrolovaných studií účinnosti ukazují, že léčba přípravkem AVODART (0,5 mg jednou denně) snižuje riziko AUR a chirurgické intervence související s BPH ve srovnání s placebem, zlepšuje symptomy související s BPH, snižuje objem prostaty a zvyšuje maximální průtoky moči. Tyto údaje naznačují, že AVODART 0,5 mg zastavuje proces onemocnění BPH u mužů se zvětšenou prostatou.
Kombinace s terapií alfa-blokátory (CombAT)
Účinnost kombinované léčby (AVODART 0,5 mg/den plus tamsulosin 0,4 mg/den, n = 1 610) byla srovnávána se samotným AVODART 0,5 mg (n = 1 623) nebo samotným tamsulosinem (n = 1 611) ve 4letém multicentru, randomizované , dvojitě zaslepený pokus. Kritéria pro vstup do studie byla podobná dvojitě zaslepeným, placebem kontrolovaným studiím účinnosti monoterapie popsaným v části 14.1. Osmdesát osm procent (88 %) populace zařazené do studie byli běloši. Přibližně 52 % subjektů bylo v minulosti vystaveno léčbě 5-alfa-reduktázovým inhibitorem nebo alfa-adrenergním antagonistou. Ze 4 844 subjektů náhodně přiřazených k léčbě dokončilo 4 roky dvojitě zaslepené léčby 69 % subjektů ve skupině s kombinovanou léčbou, 67 % ve skupině dostávající AVODART 0,5 mg a 61 % ve skupině s tamsulosinem.
Vliv na skóre příznaků
Symptomy byly kvantifikovány pomocí prvních 7 otázek mezinárodního skóre symptomů prostaty (IPSS) (identické s AUA-SI). Výchozí skóre bylo přibližně 16,4 jednotek pro každou léčebnou skupinu. Kombinovaná terapie byla statisticky lepší než každá z monoterapeutických terapií ve snížení skóre symptomů ve 24. měsíci, což je primární časový bod pro tento cílový bod. Ve 24. měsíci byly průměrné změny oproti výchozí hodnotě (±SD) v celkovém skóre symptomů IPSS -6,2 (±7,14) pro kombinaci, -4,9 (±6,81) pro AVODART a -4,3 (±7,01) pro tamsulosin s průměrným rozdílem mezi kombinací a AVODART 0,5 mg -1,3 jednotek (P
Obrázek 6: Změna mezinárodního skóre symptomů prostaty oproti výchozí hodnotě za 48měsíční období (náhodná, dvojitě zaslepená, paralelní skupinová studie [CombAT Trial])
![International Prostate Symptom Score Change from Baseline over a 48Month Period (Randomized, Double-blind, Parallel-Group Trial [CombAT Trial]) - Illustration](/pics/fff88d9516bc28f8f2460590a9b59564.jpg)
Vliv na akutní zadržování moči nebo potřebu chirurgického zákroku souvisejícího s BPH
Po 4 letech léčby nepřinesla kombinovaná léčba přípravkem AVODART 0,5 mg a tamsulosinem přínos oproti monoterapii přípravkem AVODART ve snížení incidence AUR nebo operací souvisejících s BPH.
Vliv na maximální rychlost průtoku moči
Výchozí hodnota Qmax byla přibližně 10,7 ml/s pro každou léčebnou skupinu. Kombinovaná terapie byla statisticky lepší než každá z monoterapeutických terapií ve zvýšení Qmax ve 24. měsíci, což je primární časový bod pro tento cílový bod. Ve 24. měsíci byla průměrná zvýšení od výchozí hodnoty (±SD) v Qmax 2,4 (±5,26) ml/s pro kombinaci, 1,9 (±5,10) ml/s pro AVODART 0,5 mg a 0,9 (±4,57) ml/s pro tamsulosin, s průměrným rozdílem mezi kombinací a AVODARTem 0,5 ml/s (P = 0,003; [95% CI: 0,17, 0,84]) a mezi kombinací a tamsulosinem 1,5 ml/s (P
Další zlepšení Qmax kombinované terapie oproti monoterapii přípravkem AVODART 0,5 mg již nebylo ve 48. měsíci statisticky významné.
Obrázek 7: Změna Qmax od výchozího stavu za 24měsíční období (náhodný, dvojitě zaslepený, paralelní skupinový pokus [CombAT Trial])
![Qmax Change from Baseline over a 24-Month Period (Randomized, Double-blind, Parallel-Group Trial [CombAT Trial]) - Illustration](/pics/59ccd041fbf81cf7d0b39edfa5d89c32.jpg)
Vliv na objem prostaty
Průměrný objem prostaty při vstupu do studie byl přibližně 55 ml. Ve 24. měsíci, primárním časovém bodu pro tento cílový bod, byly průměrné procentuální změny objemu prostaty oproti výchozí hodnotě (±SD) -26,9 % (±22,57) pro kombinovanou léčbu, -28,0 % (±24,88) pro AVODART 0,5 mg a 0 % (±31,14) pro tamsulosin, s průměrným rozdílem mezi kombinací a AVODART 0,5 mg 1,1 % (P = NS; [95% CI: -0,6, 2,8]) a mezi kombinací a tamsulosinem -26,9 % (P
INFORMACE PRO PACIENTA
AVODART (av o dart) (dutasterid) tobolky
AVODART 0,5 mg je určen pouze pro muže.
Přečtěte si tyto informace pro pacienta dříve, než začnete užívat AVODART 0,5 mg a pokaždé, když dostanete náhradní náplň. Mohou se objevit nové informace. Tyto informace nenahrazují rozhovor s vaším poskytovatelem zdravotní péče o vašem zdravotním stavu nebo vaší léčbě.
Co je AVODART 0,5 mg?
AVODART 0,5 mg je lék na předpis, který obsahuje dutasterid. AVODART 0,5 mg se používá k léčbě příznaků benigní hyperplazie prostaty (BPH) u mužů se zvětšenou prostatou k:
- zlepšit příznaky,
- snížit riziko akutní retence moči (úplné zablokování toku moči),
- snížit riziko nutnosti operace související s BPH.
Kdo by NEMĚL užívat AVODART?
Neužívejte AVODART, pokud:
- těhotná nebo by mohla otěhotnět. AVODART 0,5 mg může poškodit vaše nenarozené dítě. Těhotné ženy by se neměly dotýkat tobolek AVODART. Pokud žena, která je těhotná s dítětem mužského pohlaví, dostane do těla dostatečné množství přípravku AVODART 0,5 mg spolknutím nebo dotykem přípravku AVODART, může se dítě mužského pohlaví narodit s pohlavními orgány, které nejsou normální. Pokud se těhotná žena nebo žena ve fertilním věku dostane do kontaktu s prosakujícími tobolkami AVODART 0,5 mg, kontaktní oblast by měla být okamžitě omyta mýdlem a vodou.
- dítě nebo teenager.
- alergický na dutasterid nebo na kteroukoli složku přípravku AVODART. Úplný seznam složek přípravku AVODART naleznete na konci této příbalové informace.
- alergický na jiné inhibitory 5-alfa-reduktázy, například tablety PROSCAR (finasterid)®.
Co mám sdělit svému poskytovateli zdravotní péče před užitím přípravku AVODART 0,5 mg?
Než začnete užívat AVODART 0,5 mg, informujte svého poskytovatele zdravotní péče, pokud:
- mít problémy s játry
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis a bez předpisu, vitamínů a bylinných doplňků. AVODART a jiné léky se mohou navzájem ovlivňovat a způsobovat nežádoucí účinky. AVODART 0,5 mg může ovlivnit účinek jiných léků a jiné léky mohou ovlivnit účinek přípravku AVODART 0,5 mg.
Znát léky, které užíváte. Uchovávejte si jejich seznam, abyste je mohli ukázat svému poskytovateli zdravotní péče a lékárníkovi, když dostanete nový lék.
Jak mám užívat AVODART?
- Užívejte 1 kapsli AVODART jednou denně.
- Tobolky AVODART 0,5 mg polykejte celé. Tobolky AVODART 0,5 mg nedrťte, nežvýkejte ani neotevírejte, protože obsah tobolky může dráždit vaše rty, ústa nebo hrdlo.
- AVODART 0,5 mg můžete užívat s jídlem nebo bez jídla.
- Pokud vynecháte dávku, můžete si ji vzít později ten den. Nenahrazujte vynechanou dávku užíváním 2 dávek následující den.
Čemu se mám vyhnout při užívání přípravku AVODART 0,5 mg?
- Během užívání přípravku AVODART nebo po dobu 6 měsíců po ukončení užívání přípravku AVODART byste neměli darovat krev. To je důležité, aby se zabránilo těhotným ženám dostávat AVODART prostřednictvím krevních transfuzí.
Jaké jsou možné vedlejší účinky přípravku AVODART?
AVODART může způsobit závažné nežádoucí účinky, včetně:
- Vzácné a závažné alergické reakce, včetně:
- otok obličeje, jazyka nebo hrdla
- závažné kožní reakce, jako je olupování kůže
Pokud máte tyto závažné alergické reakce, okamžitě vyhledejte lékařskou pomoc.
- Vyšší šance na závažnější formu rakoviny prostaty.
Mezi nejčastější vedlejší účinky přípravku AVODART patří:
- potíže s dosažením nebo udržením erekce (impotence)*
- snížení libida (libida)*
- problémy s ejakulací*
- zvětšená nebo bolestivá prsa. Pokud zaznamenáte hrudky v prsou nebo výtok z bradavek, měli byste si promluvit se svým poskytovatelem zdravotní péče.
*Některé z těchto příhod mohou pokračovat i poté, co přestanete AVODART užívat.
U pacientů užívajících AVODART byla hlášena depresivní nálada.
Bylo prokázáno, že AVODART 0,5 mg snižuje počet spermií, objem spermatu a pohyb spermií. Účinek přípravku AVODART 0,5 mg na mužskou fertilitu však není znám.
Test na prostatický specifický antigen (PSA): Váš poskytovatel zdravotní péče vás může zkontrolovat, zda nemáte jiné problémy s prostatou, včetně rakoviny prostaty, než začnete a během užívání přípravku AVODART. Krevní test nazývaný PSA (prostatický specifický antigen) se někdy používá ke zjištění, zda byste mohli mít rakovinu prostaty. AVODART sníží množství PSA naměřeného ve vaší krvi. Váš poskytovatel zdravotní péče si je tohoto účinku vědom a může stále používat PSA, aby zjistil, zda byste mohli mít rakovinu prostaty. Zvýšení hladin PSA během léčby přípravkem AVODART (i když jsou hladiny PSA v normálním rozmezí) by měl vyhodnotit váš poskytovatel zdravotní péče.
Informujte svého poskytovatele zdravotní péče, pokud máte jakýkoli vedlejší účinek, který vás obtěžuje nebo který nezmizí.
To nejsou všechny možné vedlejší účinky přípravku AVODART. Další informace získáte od svého poskytovatele zdravotní péče nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800- FDA-1088.
Jak mám uchovávat AVODART 0,5 mg?
- Uchovávejte AVODART 0,5 mg tobolky při pokojové teplotě (59 °F až 86 °F nebo 15 °C až 30 °C).
- Tobolky AVODART 0,5 mg se mohou zdeformovat a/nebo změnit barvu, pokud jsou uchovávány při vysokých teplotách.
- Nepoužívejte AVODART 0,5 mg, pokud jsou vaše tobolky zdeformované, změnily barvu nebo prosakují.
- Léky, které již nepotřebujete, bezpečně vyhoďte.
Uchovávejte AVODART 0,5 mg a všechny léky mimo dosah dětí.
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v příbalové informaci pro pacienty. Nepoužívejte AVODART 0,5 mg pro stav, pro který nebyl předepsán. Nepodávejte AVODART jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Tato příbalová informace pro pacienty shrnuje nejdůležitější informace o přípravku AVODART. Pokud chcete další informace, promluvte si se svým poskytovatelem zdravotní péče. Můžete požádat svého lékárníka nebo poskytovatele zdravotní péče o informace o přípravku AVODART 0,5 mg, který je určen pro zdravotníky.
Pro více informací navštivte www.AVODART.com nebo volejte 1-888-825-5249.
Jaké jsou složky přípravku AVODART 0,5 mg?
Aktivní složka: dutasterid.
Neaktivní složky: butylovaný hydroxytoluen, oxid železitý (žlutý), želatina (z certifikovaných hovězích zdrojů bez BSE), glycerin, mono-diglyceridy kyseliny kaprylové/kaprinové, oxid titaničitý a červený jedlý inkoust.
Jak AVODART působí?
Růst prostaty je způsoben hormonem v krvi zvaným dihydrotestosteron (DHT). AVODART snižuje produkci DHT v těle, což u většiny mužů vede ke zmenšení zvětšené prostaty. Zatímco někteří muži mají po 3 měsících léčby přípravkem AVODART méně problémů a příznaků, obvykle je nutná doba léčby alespoň 6 měsíců, aby se zjistilo, zda u vás AVODART 0,5 mg bude fungovat.
Tyto informace pro pacienty byly schváleny americkým Úřadem pro kontrolu potravin a léčiv.
