Propecia 1mg, 5mg Finasteride Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Propecia 1 mg a jak se používá?
Propecia je lék na předpis používaný k léčbě příznaků benigní hyperplazie prostaty (BPH), vypadávání vlasů u mužů (androgenní alopecie). Propecia může být použita samostatně nebo s jinými léky.
Propecia 1 mg patří do třídy léků nazývaných inhibitory 5-alfa-reduktázy.
Není známo, zda je přípravek Propecia 1 mg bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Propecia 5 mg?
Propecia 1 mg může způsobit závažné nežádoucí účinky, včetně:
- bulky v prsou,
- bolest nebo citlivost prsou,
- výtok z bradavek a
- jakékoli jiné změny prsou
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Propecia 5 mg patří:
- ztráta zájmu o sex,
- impotence,
- potíže s orgasmem a
- abnormální ejakulace
Informujte svého lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Propecia. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
Tablety PROPECIA (finasterid) obsahují jako účinnou látku finasterid. Finasterid, syntetická 4-azasteroidní sloučenina, je specifický inhibitor steroidního typu II 5a-reduktázy, intracelulárního enzymu, který přeměňuje androgenní testosteron na 5a-dihydrotestosteron (DHT).
Chemický název finasteridu je N-terc-butyl-3-oxo-4-aza-5α-androst-1-en-17β-karboxamid. Empirický vzorec finasteridu je C23H36N2O2 a jeho molekulová hmotnost je 372,55. Jeho strukturní vzorec je:
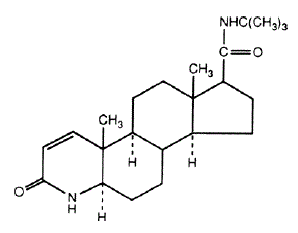
Finasterid je bílý krystalický prášek s bodem tání blízko 250 °C. Je volně rozpustný v chloroformu a v rozpouštědlech s nižším alkoholem, ale je prakticky nerozpustný ve vodě.
Tablety PROPECIA (finasterid) jsou potahované tablety pro perorální podání. Jedna tableta obsahuje 1 mg finasteridu a následující neúčinné složky: monohydrát laktózy, mikrokrystalická celulóza, předbobtnalý škrob, sodná sůl glykolátu škrobu, hydroxypropylmethylcelulóza, hydroxypropylcelulóza, oxid titaničitý, magnesium-stearát, mastek, dokusát sodný, žlutý oxid železitý a červený železitý kysličník.
INDIKACE
PROPECIA® je indikována k léčbě mužského typu vypadávání vlasů (androgenní alopecie) POUZE U MUŽE.
Účinnost v bittemporální recesi nebyla stanovena.
PROPECIA není indikována k použití u žen.
DÁVKOVÁNÍ A PODÁVÁNÍ
PROPECIA může být podávána s jídlem nebo bez jídla.
Doporučená dávka přípravku PROPECIA je jedna tableta (1 mg) užívaná jednou denně.
Obecně je nutné každodenní užívání po dobu tří měsíců nebo déle, než je pozorován přínos. Pro udržení přínosu se doporučuje pokračovat v užívání, které by mělo být pravidelně přehodnocováno. Vysazení léčby vede ke zvrácení účinku do 12 měsíců.
JAK DODÁVÁNO
Dávkové formy A Síly
PROPECIA 5 mg tablety (1 mg) jsou hnědé, osmihranné, potahované konvexní tablety s logem „stylizovaného P“ na jedné straně a PROPECIA 5 mg na druhé straně.
PROPECIA tablety, 1 mg, jsou hnědé, osmihranné, potahované konvexní tablety s logem „stylizovaného P“ na jedné straně a PROPECIA na straně druhé. Dodávají se následovně:
NDC 78206-152-01 lahve po 30 (s vysoušedlem) NDC 78206-152-02 Láhve PROPAK 90 ® (s vysoušedlem).
Skladování A Manipulace
Skladujte při pokojové teplotě, 15-30°C (59-86°F). Uchovávejte obal uzavřený a chraňte před vlhkostí.
Ženy by neměly manipulovat s rozdrcenými nebo rozlomenými tabletami přípravku PROPECIA, když jsou těhotné nebo mohou být potenciálně těhotné kvůli možnosti vstřebání finasteridu a následnému potenciálnímu riziku pro plod mužského pohlaví. PROPECIA 5 mg tablety jsou potažené a zabrání kontaktu s léčivou látkou při běžné manipulaci za předpokladu, že tablety nejsou rozlomeny nebo rozdrceny [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , Použití u konkrétních populací a Informace pro pacienty ].
Dist. od: Organon LLC, dceřiná společnost ORGANON & Co., Jersey City, NJ 07302, USA. Upraveno: červen 2021
VEDLEJŠÍ EFEKTY
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v klinické praxi.
Klinické studie přípravku PROPECIA (finasterid 1 mg) při léčbě vypadávání vlasů u mužského typu
Ve třech kontrolovaných klinických studiích s přípravkem PROPECIA 5 mg trvajících 12 měsíců bylo 1,4 % pacientů užívajících přípravek PROPECIA (n=945) vysazeno z důvodu nežádoucích účinků, které byly považovány za možná, pravděpodobně nebo určitě související s lékem (1,6 % u placeba; n=934).
Klinické nežádoucí účinky, které byly hlášeny jako možná, pravděpodobně nebo určitě související s lékem u ≥ 1 % pacientů léčených přípravkem PROPECIA nebo placebem, jsou uvedeny v tabulce 1.
TABULKA 1: Nežádoucí zkušenosti související s léčivem PROPECIA (finasterid 1 mg) v roce 1 (%) PÁDÁNÍ VLASŮ U MUŽŮ
Integrovaná analýza klinických nežádoucích účinků ukázala, že během léčby přípravkem PROPECIA 1 mg hlásilo 36 (3,8 %) z 945 mužů jeden nebo více těchto nežádoucích účinků ve srovnání s 20 (2,1 %) z 934 mužů léčených placebem (p=0,04). . U mužů, kteří přerušili léčbu přípravkem PROPECIA kvůli těmto nežádoucím účinkům, au většiny těch, kteří v léčbě pokračovali, došlo k ústupu. Výskyt každého z výše uvedených nežádoucích účinků se do pátého roku léčby přípravkem PROPECIA snížil na ≤ 0,3 %.
Ve studii finasteridu 1 mg denně u zdravých mužů byl po 48 týdnech léčby pozorován střední pokles objemu ejakulátu o 0,3 ml (-11 %) ve srovnání s 0,2 ml (-8 %) u placeba. Dvě další studie prokázaly, že finasterid v 5násobku dávky přípravku PROPECIA (5 mg denně) způsobil významné snížení mediánu objemu ejakulátu přibližně o 0,5 ml (-25 %) ve srovnání s placebem, ale to bylo reverzibilní po přerušení léčby.
V klinických studiích s přípravkem PROPECIA se výskyt citlivosti a zvětšení prsou, reakcí přecitlivělosti a bolesti varlat u pacientů léčených finasteridem nelišil od výskytu u pacientů léčených placebem.
Kontrolované klinické studie a dlouhodobé otevřené rozšiřující studie pro PROSCAR® (finasterid 5 mg) a AVODART (dutasterid) v léčbě benigní hyperplazie prostaty
Ve čtyřleté kontrolované klinické studii PROSCAR Long-Term Efficacy and Safety Study (PLESS), čtyřleté kontrolované klinické studii, byla po dobu 4 let hodnocena bezpečnost 3040 pacientů ve věku 45 až 78 let se symptomatickou BPH a zvětšenou prostatou (1524 na PROSCAR 5 mg/den a 1516 na placebu). 3,7 % (57 pacientů) léčených přípravkem PROSCAR 5 mg a 2,1 % (32 pacientů) léčených placebem přerušilo léčbu v důsledku nežádoucích účinků souvisejících se sexuální funkcí, což jsou nejčastěji hlášené nežádoucí účinky.
Tabulka 2 uvádí jediné klinické nežádoucí účinky, které zkoušející považoval za možná, pravděpodobně nebo určitě související s lékem, u nichž byla incidence u přípravku PROSCAR ≥ 1 % a vyšší než u placeba během 4 let studie. V letech 2-4 studie nebyl mezi léčebnými skupinami významný rozdíl v incidenci impotence, sníženého libida a poruchy ejakulace.
TABULKA 2: Nežádoucí zkušenosti související s léčivem pro PROSCAR (finasterid 5 mg) BENIGNÍ PROSTATICKÁ HYPERPLASIE
Profily nežádoucích účinků v jednoletých, placebem kontrolovaných studiích fáze III BPH a 5letých otevřených prodlouženích s PROSCAR 5 mg a PLESS byly podobné.
Neexistují žádné důkazy o zvýšených sexuálních nežádoucích zkušenostech při delším trvání léčby přípravkem PROSCAR 5 mg. Nové zprávy o sexuálních nežádoucích účincích souvisejících s drogami se s délkou léčby snižovaly.
Během 4- až 6leté placebem a komparátorem kontrolované studie Medical Therapy of Prostatic Symptoms (MTOPS), do které bylo zařazeno 3047 mužů, se vyskytly 4 případy rakoviny prsu u mužů léčených přípravkem PROSCAR, ale žádné případy u mužů neléčených přípravkem PROSCAR. Během 4leté placebem kontrolované studie PLESS, do které bylo zařazeno 3040 mužů, se vyskytly 2 případy rakoviny prsu u mužů léčených placebem, ale u mužů léčených přípravkem PROSCAR nebyly hlášeny žádné případy.
Během 7leté placebem kontrolované studie prevence rakoviny prostaty (PCPT), do které bylo zařazeno 18 882 mužů, se vyskytl 1 případ rakoviny prsu u mužů léčených přípravkem PROSCAR a 1 případ rakoviny prsu u mužů léčených placebem. Vztah mezi dlouhodobým užíváním finasteridu a mužskou neoplazií prsu není v současnosti znám.
Studie PCPT byla 7letá randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie, do které bylo zařazeno 18 882 zdravých mužů ve věku ≥ 55 let s normálním digitálním rektálním vyšetřením a PSA ≤ 3,0 ng/ml. Muži dostávali denně buď PROSCAR (finasterid 5 mg) nebo placebo. Pacienti byli každoročně hodnoceni pomocí PSA a digitálních rektálních vyšetření. Biopsie byly provedeny pro zvýšené PSA, abnormální digitální rektální vyšetření nebo na konci studie. Výskyt rakoviny prostaty Gleason skóre 8-10 byl vyšší u mužů léčených finasteridem (1,8 %) než u mužů léčených placebem (1,1 %). Ve 4leté placebem kontrolované klinické studii s jiným inhibitorem 5α-reduktázy [AVODART (dutasterid)] byly pozorovány podobné výsledky pro karcinom prostaty Gleasonovo skóre 8-10 (1 % dutasterid vs 0,5 % placebo). Klinický význam těchto zjištění s ohledem na použití přípravku PROPECIA u mužů není znám.
pacientů s karcinomem prostaty léčených přípravkem PROSCAR nebyl prokázán žádný klinický přínos. PROSCAR není schválen ke snížení rizika vzniku rakoviny prostaty.
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během používání přípravku PROPECIA po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku:
Hypersenzitivní reakce: hypersenzitivní reakce, jako je vyrážka, pruritus, kopřivka a angioedém (včetně otoku rtů, jazyka, hrdla a obličeje);
Rozmnožovací systém: sexuální dysfunkce, která pokračovala po přerušení léčby, včetně erektilní dysfunkce, poruch libida, poruch ejakulace a poruch orgasmu; mužská neplodnost a/nebo špatná kvalita semenů (po vysazení finasteridu byla hlášena normalizace nebo zlepšení kvality semenů); bolest varlat; hematospermie.
Novotvary: rakovina prsu u mužů;
Poruchy prsou: citlivost a zvětšení prsou;
Nervový systém/psychiatrický: Deprese
DROGOVÉ INTERAKCE
Cytochrome P450-Linked Drug Metabolizing Enzyme System
Nebyly zjištěny žádné klinicky významné lékové interakce. Nezdá se, že by finasterid ovlivňoval enzymový systém navázaný na cytochrom P450, který metabolizuje léčivo. Mezi sloučeniny, které byly testovány u člověka, patří antipyrin, digoxin, propranolol, theofylin a warfarin a nebyly nalezeny žádné klinicky významné interakce.
Jiná souběžná terapie
Ačkoli nebyly provedeny specifické interakční studie, byly v klinických studiích současně s acetaminofenem, kyselinou acetylsalicylovou, α-blokátory, analgetiky, inhibitory angiotenzin-konvertujícího enzymu (ACE), antikonvulziva, benzodiazepiny, betablokátory, vápníkem použity dávky finasteridu 1 mg nebo vyšší -blokátory srdečních kanálů, srdeční nitráty, diuretika, H2 antagonisté, inhibitory HMG-CoA reduktázy, inhibitory prostaglandinsyntetázy (také označované jako NSAID) a chinolonová antiinfektiva bez známek klinicky významných nežádoucích interakcí.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Vystavení žen - Riziko Pro Mužský Plod
PROPECIA není indikována k použití u žen. Ženy by neměly manipulovat s rozdrcenými nebo rozlomenými tabletami přípravku PROPECIA, když jsou těhotné nebo mohou být potenciálně těhotné kvůli možnosti vstřebání finasteridu a následnému potenciálnímu riziku pro plod mužského pohlaví. Tablety PROPECIA jsou potažené a zabrání kontaktu s léčivou látkou při běžné manipulaci za předpokladu, že tablety nebyly rozlomeny nebo rozdrceny. [Vidět INDIKACE A POUŽITÍ , KONTRAINDIKACE , Použití u konkrétních populací , JAK DODÁVÁNO / Skladování A Manipulace a Informace pro pacienty ]
Účinky na prostatický specifický antigen (PSA)
klinických studiích s PROPECIA (finasterid, 1 mg) u mužů ve věku 18-41 let se průměrná hodnota sérového prostatického specifického antigenu (PSA) snížila z 0,7 ng/ml na začátku na 0,5 ng/ml ve 12. měsíci. v klinických studiích s PROSCARem (finasterid, 5 mg) při použití u starších mužů s benigní hyperplazií prostaty (BPH) jsou hladiny PSA sníženy přibližně o 50 %. Jiné studie s přípravkem PROSCAR ukázaly, že může také způsobit snížení sérového PSA v přítomnosti rakoviny prostaty. Tato zjištění je třeba vzít v úvahu pro správnou interpretaci sérového PSA při hodnocení mužů léčených finasteridem. Jakékoli potvrzené zvýšení z nejnižší hodnoty PSA během léčby přípravkem PROPECIA může signalizovat přítomnost rakoviny prostaty a mělo by být vyhodnoceno, i když jsou hladiny PSA stále v normálním rozmezí pro muže, kteří neužívají inhibitor 5α-reduktázy. Nedodržení léčby přípravkem PROPECIA 5 mg může také ovlivnit výsledky testu PSA.
Zvýšené riziko rakoviny prostaty vysokého stupně s inhibitory 5α-reduktázy
Muži ve věku 55 a více let s normálním digitálním rektálním vyšetřením a PSA ≤ 3,0 ng/ml na začátku užívající finasterid 5 mg/den (5násobek dávky PROPECIA) v 7leté studii prevence rakoviny prostaty (PCPT) měli zvýšené riziko rakoviny prostaty Gleason skóre 8-10 (finasterid 1,8 % vs. placebo 1,1 %). [Vidět NEŽÁDOUCÍ REAKCE ] Podobné výsledky byly pozorovány ve 4leté placebem kontrolované klinické studii s jiným inhibitorem 5α-reduktázy (dutasterid, AVODART) (1 % dutasterid vs 0,5 % placebo). Inhibitory 5α-reduktázy mohou zvýšit riziko rozvoje rakoviny prostaty vysokého stupně. Nebylo stanoveno, zda účinek inhibitorů 5α-reduktázy na snížení objemu prostaty nebo faktory související se studií ovlivnily výsledky těchto studií.
Pediatričtí pacienti
PROPECIA není indikována k použití u pediatrických pacientů [viz Použití u konkrétních populací ].
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( INFORMACE PRO PACIENTA ).
Vystavení žen - Riziko Pro Mužský Plod
Lékaři by měli pacienty informovat, že ženy, které jsou těhotné nebo mohou být potenciálně těhotné, by neměly manipulovat s rozdrcenými nebo rozbitými tabletami přípravku PROPECIA kvůli možnosti vstřebání finasteridu a následnému potenciálnímu riziku pro plod mužského pohlaví. PROPECIA 5 mg tablety jsou potažené a zabrání kontaktu s léčivou látkou při běžné manipulaci za předpokladu, že tablety nebyly rozlomeny nebo rozdrceny. Pokud žena, která je těhotná nebo může být potenciálně těhotná, přijde do kontaktu s rozdrcenými nebo rozbitými tabletami PROPECIA 1 mg, kontaktní oblast by měla být okamžitě omyta mýdlem a vodou [viz KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , Použití u konkrétních populací a JAK DODÁVÁNO / Skladování A Manipulace ].
Zvýšené riziko rakoviny prostaty vysokého stupně
Pacienti by měli být informováni, že došlo ke zvýšení rakoviny prostaty vysokého stupně u mužů léčených inhibitory 5α-reduktázy indikovanými k léčbě BPH ve srovnání s těmi, kteří byli léčeni placebem ve studiích zaměřených na použití těchto léků k prevenci rakoviny prostaty [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a NEŽÁDOUCÍ REAKCE ].
Další pokyny
Lékaři by měli pacienty poučit, aby neprodleně hlásili jakékoli změny na prsou, jako jsou bulky, bolest nebo výtok z bradavek. Byly hlášeny změny prsů včetně zvětšení prsou, citlivosti a novotvaru [viz NEŽÁDOUCÍ REAKCE ].
Lékaři by měli své pacienty poučit, aby si před zahájením léčby přípravkem PROPECIA přečetli příbalovou informaci pro pacienty a aby si ji znovu přečetli při každém obnovení předpisu, aby byli informováni o aktuálních informacích pro pacienty týkající se přípravku PROPECIA.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Ve 24měsíční studii na potkanech Sprague-Dawley, kterým byly podávány dávky finasteridu až 160 mg/kg/den u samců a 320 mg/kg/den u samic, nebyly pozorovány žádné známky tumorigenního účinku. Tyto dávky vyvolaly příslušnou systémovou expozici u potkanů 888krát a 2192krát vyšší než u člověka, kterému byla podávána doporučená dávka pro člověka 1 mg/den. Všechny výpočty expozice byly založeny na vypočtené AUC(0-24h) pro zvířata a průměrné AUC(0-24h) pro člověka (0,05 μg•hod/ml).
19měsíční studii karcinogenity na myších CD-1 bylo pozorováno statisticky významné (p≤0,05) zvýšení incidence testikulárních adenomů z Leydigových buněk při 1824násobku expozice u člověka (250 mg/kg/den). U myší při 184násobku expozice u člověka, odhadované (25 mg/kg/den) au potkanů při 312násobku expozice u člověka (≥40 mg/kg/den) bylo pozorováno zvýšení výskytu hyperplazie Leydigových buněk. U obou druhů hlodavců léčených vysokými dávkami finasteridu byla prokázána pozitivní korelace mezi proliferativními změnami v Leydigových buňkách a zvýšením sérových hladin LH (2- až 3krát nad kontrolou). Žádné změny Leydigových buněk související s lékem nebyly pozorovány ani u potkanů, ani u psů léčených finasteridem po dobu 1 roku v dávce 240 a 2800krát (20 mg/kg/den a 45 mg/kg/den), ani u myší léčených po dobu 19 měsíců při 18,4násobku expozice u člověka, odhadované (2,5 mg/kg/den).
testu bakteriální mutageneze in vitro, testu mutageneze na savčích buňkách nebo v testu alkalické eluce in vitro nebyly pozorovány žádné známky mutagenity. V in vitro testu chromozomových aberací za použití ovariálních buněk čínského křečka došlo k mírnému zvýšení chromozomových aberací. V in vivo testu chromozomových aberací u myší nebylo pozorováno žádné zvýšení chromozomových aberací související s léčbou u finasteridu v maximální tolerované dávce 250 mg/kg/den (1824násobek expozice u člověka), jak bylo stanoveno ve studiích karcinogenity.
pohlavně dospělých samců králíků léčených finasteridem v dávce 4344krát vyšší, než je expozice u člověka (80 mg/kg/den) po dobu až 12 týdnů, nebyl pozorován žádný vliv na fertilitu, počet spermií nebo objem ejakulátu. U pohlavně dospělých samců potkanů léčených 488násobkem expozice u člověka (80 mg/kg/den) nebyly po 6 nebo 12 týdnech léčby pozorovány žádné významné účinky na plodnost; když však léčba pokračovala po dobu až 24 nebo 30 týdnů, došlo ke zjevnému snížení plodnosti, plodnosti a souvisejícímu významnému snížení hmotnosti semenných váčků a prostaty. Všechny tyto účinky byly reverzibilní do 6 týdnů po ukončení léčby. U potkanů nebo králíků nebyl pozorován žádný účinek na varlata nebo páření související s léčivem. Toto snížení plodnosti u potkanů léčených finasteridem je sekundární vzhledem k jeho účinku na pomocné pohlavní orgány (prostata a semenné váčky), což má za následek selhání tvorby semenné zátky. Semenná zátka je nezbytná pro normální plodnost u potkanů, ale není relevantní u člověka.
Použití u konkrétních populací
Těhotenství
Kategorie těhotenství X [viz KONTRAINDIKACE ]. PROPECIA 5 mg je kontraindikována u žen, které jsou nebo mohou otěhotnět. PROPECIA 5 mg je inhibitor 5α-reduktázy typu II, který zabraňuje přeměně testosteronu na 5α-dihydrotestosteron (DHT), hormon nezbytný pro normální vývoj mužských genitálií. Ve studiích na zvířatech způsobil finasterid abnormální vývoj vnějších genitálií u plodů mužského pohlaví. Pokud je tento lék užíván během těhotenství nebo pokud pacientka otěhotní během užívání tohoto léku, pacientka by měla být informována o potenciálním riziku pro mužský plod.
Abnormální vývoj mužských genitálií je očekávaným důsledkem, když je přeměna testosteronu na 5α-dihydrotestosteron (DHT) inhibována inhibitory 5α-reduktázy. Tyto výsledky jsou podobné jako u kojenců mužského pohlaví s genetickým deficitem 5α-reduktázy. Ženy mohou být vystaveny finasteridu při kontaktu s rozdrcenými nebo rozbitými tabletami přípravku PROPECIA 5 mg nebo spermatem od mužského partnera užívajícího přípravek PROPECIA. Pokud jde o expozici finasteridu přes kůži, tablety PROPECIA jsou potaženy a zabrání kontaktu pokožky s finasteridem při běžné manipulaci, pokud tablety nebyly rozdrceny nebo rozbité. Ženy, které jsou těhotné nebo mohou otěhotnět, by neměly manipulovat s rozdrcenými nebo rozlomenými tabletami přípravku PROPECIA 5 mg kvůli možné expozici plodu mužského pohlaví. Pokud se těhotná žena dostane do kontaktu s rozdrcenými nebo rozbitými tabletami přípravku PROPECIA 1 mg, kontaktní oblast by měla být okamžitě omyta mýdlem a vodou. Pokud jde o potenciální expozici finasteridu prostřednictvím spermatu, byla provedena studie u mužů užívajících přípravek PROPECIA 1 mg/den, která měřila koncentrace finasteridu v spermatu [viz KLINICKÁ FARMAKOLOGIE ].
Ve studii embryo-fetálního vývoje dostávaly březí krysy finasterid během období hlavní organogeneze (6. až 17. den březosti). Při dávkách perorálního finasteridu přibližně 1 až 684násobku doporučené dávky pro člověka (RHD) 1 mg/den (na základě AUC při dávkách pro zvířata 0,1 až 100 mg/kg/den) došlo k na dávce závislému zvýšení hypospadie, která se objevila 3,6 až 100 % mužských potomků. Násobky expozice byly odhadnuty s použitím údajů od nebřezích krys. 16. až 17. den březosti je kritickým obdobím u samců plodu potkanů pro diferenciaci vnějších genitálií. Při perorálních dávkách pro matku přibližně 0,2násobku RHD (na základě AUC při dávce pro zvířata 0,03 mg/kg/den) měli samčí potomci sníženou hmotnost prostaty a semenných váčků, opožděnou separaci předkožky a přechodný vývoj bradavek. U samců březích potkaních samců, kteří dostávali přibližně 0,02násobek RHD (na základě AUC při zvířecí dávce 0,003 mg/kg/den), došlo ke snížení anogenitální vzdálenosti. U potomků samic vystavených jakékoli dávce finasteridu in utero nebyly pozorovány žádné abnormality.
potomků neléčených samic spárovaných s potkaními samci léčenými finasteridem, kteří dostávali přibližně 488násobek RHD (na základě AUC při dávce pro zvířata 80 mg/kg/den), nebyly pozorovány žádné vývojové abnormality. Mírně snížená plodnost byla pozorována u samčích potomků po podání přibližně 20násobku RHD (na základě AUC při zvířecí dávce 3 mg/kg/den) samicím potkanů během pozdní březosti a laktace. Za těchto podmínek nebyly u samic pozorovány žádné účinky na fertilitu.
Nebyly pozorovány žádné známky malformací samčích zevních genitálií nebo jiných abnormalit u plodů králíků vystavených finasteridu během období hlavní organogeneze (6.–18. den gestace) v dávkách matek až 100 mg/kg/den (hladiny expozice finasteridu nebyly měřeny v králíci). Tato studie však možná nezahrnovala kritické období pro účinky finasteridu na vývoj samčích vnějších genitálií u králíka.
Účinky expozice matce finasteridu na plod během období embryonálního a fetálního vývoje byly hodnoceny u opice rhesus (20.–100. den březosti), u druhu a období vývoje, které více predikují specifické účinky u lidí než studie na potkanech a králících. Intravenózní podávání finasteridu březím opicím v dávkách až 800 ng/den (odhadovaná maximální koncentrace v krvi 1,86 ng/ml nebo asi 930násobek nejvyšší odhadované expozice těhotných žen finasteridu ze spermatu mužů užívajících 1 mg/den) bez abnormalit u plodů mužského pohlaví. Potvrzením relevance modelu makaka pro vývoj lidského plodu je perorální podání dávky finasteridu (2 mg/kg/den nebo přibližně 120 000násobek nejvyšší odhadované hladiny finasteridu v krvi ze spermatu mužů užívajících 1 mg/den) březích opic vedly k abnormalitám vnějších genitálií u samčích plodů. U plodů mužského pohlaví nebyly pozorovány žádné jiné abnormality a žádné abnormality související s finasteridem nebyly pozorovány u plodů ženského pohlaví v jakékoli dávce.
Kojící matky
PROPECIA není indikována k použití u žen.
Není známo, zda se finasterid vylučuje do lidského mateřského mléka.
Pediatrické použití
PROPECIA 1 mg není indikována k použití u pediatrických pacientů.
Bezpečnost a účinnost u pediatrických pacientů nebyla stanovena.
Geriatrické použití
Klinické studie účinnosti přípravku PROPECIA nezahrnovaly subjekty ve věku 65 let a více. Na základě farmakokinetiky finasteridu 5 mg není u starších pacientů nutná žádná úprava dávkování přípravku PROPECIA (viz KLINICKÁ FARMAKOLOGIE ]. Nicméně účinnost přípravku PROPECIA 1 mg u starších pacientů nebyla stanovena.
Poškození jater
Opatrnosti je třeba při podávání přípravku PROPECIA 5 mg u pacientů s abnormalitami jaterních funkcí, protože finasterid je extenzivně metabolizován v játrech (viz KLINICKÁ FARMAKOLOGIE ].
Renální poškození
U pacientů s poruchou funkce ledvin není nutná žádná úprava dávkování (viz KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
V klinických studiích nevedly jednotlivé dávky finasteridu do 400 mg a opakované dávky finasteridu do 80 mg/den po dobu tří měsíců k nežádoucím účinkům. Dokud nebudou získány další zkušenosti, nelze doporučit žádnou specifickou léčbu předávkování finasteridem.
Významná letalita byla pozorována u myších samců a samic při jednorázových perorálních dávkách 1500 mg/m² (500 mg/kg) a u samic a samců potkanů při jednorázových perorálních dávkách 2360 mg/m² (400 mg/kg) a 5900 mg/m (1000 mg/kg).
KONTRAINDIKACE
PROPECIA 5 mg je kontraindikována v následujících případech:
- Těhotenství. Užívání finasteridu je kontraindikováno u žen, které jsou nebo mohou být těhotné. Vzhledem ke schopnosti inhibitorů 5α-reduktázy typu II inhibovat přeměnu testosteronu na 5α-dihydrotestosteron (DHT), může finasterid způsobit abnormality vnějších genitálií mužského plodu těhotné ženy, která dostává finasterid. Pokud je tento lék užíván během těhotenství nebo pokud během užívání tohoto léku dojde k otěhotnění, těhotná žena by měla být informována o potenciálním riziku pro mužský plod. [Vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , Použití u konkrétních populací , JAK DODÁVÁNO / Skladování A Manipulace a Informace pro pacienty ] U samic potkanů vyvolaly nízké dávky finasteridu podávané během březosti abnormality vnějších genitálií u samčích potomků.
- Přecitlivělost na kteroukoli složku tohoto léku.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Finasterid je kompetitivní a specifický inhibitor 5α-reduktázy typu II, intracelulárního enzymu, který přeměňuje androgenní testosteron na DHT. U myší, krys, opic a lidí se nacházejí dva odlišné isozymy: typ I a II. Každý z těchto izoenzymů je v tkáních a vývojových stádiích exprimován odlišně. U lidí je 5α-reduktáza typu I převládající v mazových žlázách většiny oblastí kůže, včetně pokožky hlavy a jater. 5α-reduktáza typu I je zodpovědná za přibližně jednu třetinu cirkulujícího DHT. Isozym 5α-reduktázy typu II se primárně nachází v prostatě, semenných váčcích, nadvarletích a vlasových folikulech a také v játrech a je zodpovědný za dvě třetiny cirkulujícího DHT.
lidí je mechanismus účinku finasteridu založen na jeho preferenční inhibici izozymu typu II. S použitím nativních tkání (pokožka hlavy a prostata) in vitro vazebné studie zkoumající potenciál finasteridu inhibovat kterýkoli isozym odhalily 100násobnou selektivitu pro lidskou 5α-reduktázu typu II oproti izozymu typu I (IC50 = 500 a 4,2 nM pro typ I a II). U obou isozymů je inhibice finasteridem doprovázena redukcí inhibitoru na dihydrofinasterid a tvorbou aduktu s NADP+. Obrat enzymového komplexu je pomalý (t½ přibližně 30 dní pro enzymový komplex typu II a 14 dní pro komplex typu I). Inhibice 5a-reduktázy typu II blokuje periferní přeměnu testosteronu na DHT, což má za následek významné snížení koncentrací DHT v séru a v tkáni.
mužů s mužskou typickou ztrátou vlasů (androgenetickou alopecií) obsahuje plešatící pokožka hlavy miniaturizované vlasové folikuly a zvýšené množství DHT ve srovnání s chlupatou pokožkou hlavy. Podávání finasteridu u těchto mužů snižuje koncentraci DHT v pokožce hlavy a v séru. Relativní příspěvky těchto snížení k léčebnému účinku finasteridu nebyly definovány. Zdá se, že tímto mechanismem finasterid přerušuje klíčový faktor ve vývoji androgenní alopecie u pacientů s genetickou predispozicí.
Farmakodynamika
Finasterid způsobuje rychlé snížení koncentrace DHT v séru a dosahuje 65% suprese během 24 hodin po perorálním podání s 1 mg tabletou. Průměrné cirkulující hladiny testosteronu a estradiolu byly zvýšeny přibližně o 15 % ve srovnání s výchozí hodnotou, ale zůstaly ve fyziologickém rozmezí.
Finasterid nemá žádnou afinitu k androgennímu receptoru a nemá žádné androgenní, antiandrogenní, estrogenní, antiestrogenní nebo progestační účinky. Ve studiích s finasteridem nebyly zjištěny žádné klinicky významné změny luteinizačního hormonu (LH), folikuly stimulujícího hormonu (FSH) nebo prolaktinu. U zdravých dobrovolníků léčba finasteridem nezměnila odpověď LH a FSH na hormon uvolňující gonadotropin, což naznačuje, že osa hypotalamus-hypofýza-varlata nebyla ovlivněna.
Finasterid neměl žádný vliv na cirkulující hladiny kortizolu, hormonu stimulujícího štítnou žlázu nebo tyroxinu, ani neovlivnil profil plazmatických lipidů (např. celkový cholesterol, lipoproteiny s nízkou hustotou, lipoproteiny s vysokou hustotou a triglyceridy) nebo minerální hustotu kostí.
Farmakokinetika
Vstřebávání
Ve studii s 15 zdravými mladými mužskými subjekty byla průměrná biologická dostupnost 1 mg tablet finasteridu 65 % (rozmezí 26–170 %) na základě poměru plochy pod křivkou (AUC) vzhledem k intravenózní (IV) referenční dávce dávka. V ustáleném stavu po dávkování 1 mg/den (n=12) dosahovala maximální plazmatická koncentrace finasteridu v průměru 9,2 ng/ml (rozmezí 4,9-13,7 ng/ml) a bylo jí dosaženo 1 až 2 hodiny po podání; AUC byla 53 ng•hod/ml (rozmezí 20-154 ng•hod/ml). Biologická dostupnost finasteridu nebyla potravou ovlivněna.
Rozdělení
Průměrný distribuční objem v ustáleném stavu byl 76 litrů (rozmezí 44-96 litrů; n=15). Přibližně 90 % cirkulujícího finasteridu se váže na plazmatické proteiny. Po opakovaných dávkách nastává fáze pomalé akumulace finasteridu.
Bylo zjištěno, že finasterid prochází hematoencefalickou bariérou.
Hladiny spermatu byly měřeny u 35 mužů užívajících finasterid 1 mg/den po dobu 6 týdnů. U 60 % (21 z 35) vzorků byly hladiny finasteridu nedetekovatelné ( Použití u konkrétních populací ]
Metabolismus
Finasterid je rozsáhle metabolizován v játrech, primárně prostřednictvím podrodiny enzymů cytochromu P450 3A4. Byly identifikovány dva metabolity, monohydroxylovaný t-butylový postranní řetězec a metabolity monokarboxylové kyseliny, které nevykazují více než 20 % inhibiční aktivity finasteridu na 5α-reduktázu.
Vylučování
Po intravenózní infuzi u zdravých mladých subjektů (n=15) byla průměrná plazmatická clearance finasteridu 165 ml/min (rozmezí 70-279 ml/min). Průměrný terminální poločas v plazmě byl 4,5 hodiny (rozmezí 3,3-13,4 hodin; n=12). Po perorální dávce 14C-finasteridu u člověka (n=6) bylo průměrně 39 % (rozmezí 32-46 %) dávky vyloučeno močí ve formě metabolitů; 57 % (rozmezí 51-64 %) bylo vyloučeno stolicí.
Průměrný terminální poločas je přibližně 5-6 hodin u mužů ve věku 18-60 let a 8 hodin u mužů starších než 70 let.
TABULKA 3: Průměrné (SD) farmakokinetické parametry u zdravých mužů (věk 18-26)
TABULKA 4: Průměrné (SD) nekompartmentální farmakokinetické parametry po více dávkách 1 mg/den u zdravých mužů (věk 19-42)
Renální poškození
pacientů s poruchou funkce ledvin není nutná žádná úprava dávkování. U pacientů s chronickou poruchou funkce ledvin s clearance kreatininu v rozmezí od 9,0 do 55 ml/min byly AUC, maximální plazmatická koncentrace, poločas a vazba na proteiny po jedné dávce 14C-finasteridu podobné těm, které byly získány u zdravých dobrovolníků. U pacientů s poruchou funkce ledvin bylo sníženo vylučování metabolitů močí. Tento pokles byl spojen se zvýšením exkrece metabolitů stolicí. Plazmatické koncentrace metabolitů byly významně vyšší u pacientů s poruchou funkce ledvin (na základě 60% zvýšení AUC celkové radioaktivity). Nicméně finasterid byl tolerován u mužů s normální funkcí ledvin, kteří dostávali až 80 mg/den po dobu 12 týdnů, kde by expozice těchto pacientů metabolitům byla pravděpodobně mnohem vyšší.
Poškození jater
Vliv poruchy funkce jater na farmakokinetiku finasteridu nebyl studován. Při podávání přípravku PROPECIA 1 mg pacientům s abnormalitami jaterních funkcí je třeba postupovat opatrně, protože finasterid je extenzivně metabolizován v játrech.
Klinické studie
Studie u mužů
Účinnost přípravku PROPECIA 1 mg byla prokázána u mužů (88 % bělochů) s mírnou až středně těžkou androgenetickou alopecií (mužské vypadávání vlasů) ve věku 18 až 41 let. Aby se předešlo seboroické dermatitidě, která by mohla zkreslit hodnocení růstu vlasů v těchto studiích, byli všichni muži, ať už léčeni finasteridem nebo placebem, instruováni, aby používali během první 2 roky studia.
Byly provedeny tři dvojitě zaslepené, randomizované, placebem kontrolované studie trvající 12 měsíců. Dva primární cílové parametry byly počet vlasů a sebehodnocení pacientem; dva sekundární koncové body byly hodnocení zkoušejícím a hodnocení fotografií. Kromě toho byly shromážděny informace týkající se sexuálních funkcí (na základě dotazníku, který si sami zadali) a růstu ochlupení mimo pokožku hlavy. Tyto tři studie byly provedeny u 1879 mužů s mírnou až středně těžkou, ale ne úplnou ztrátou vlasů. Dvě ze studií zahrnovaly muže s převážně mírnou až středně závažnou ztrátou vlasů na hlavě (n=1553). Třetí zařazení muži s mírnou až středně závažnou ztrátou vlasů v oblasti přední části hlavy s plešatěním nebo bez něj (n=326).
Studie U mužů s vertexovou plešatostí
mužů, kteří dokončili prvních 12 měsíců dvou studií vertexové plešatosti, se 1215 rozhodlo pokračovat ve dvojitě zaslepených, placebem kontrolovaných, 12měsíčních prodloužených studiích. 547 mužů užívalo přípravek PROPECIA 5 mg jak v počáteční studii, tak v prvním prodloužení (až 2 roky léčby) a 60 mužů dostávalo placebo po stejné období. Rozšířené studie pokračovaly další 3 roky, přičemž 323 mužů na PROPECIA 5 mg a 23 na placebu vstoupilo do pátého roku studie.
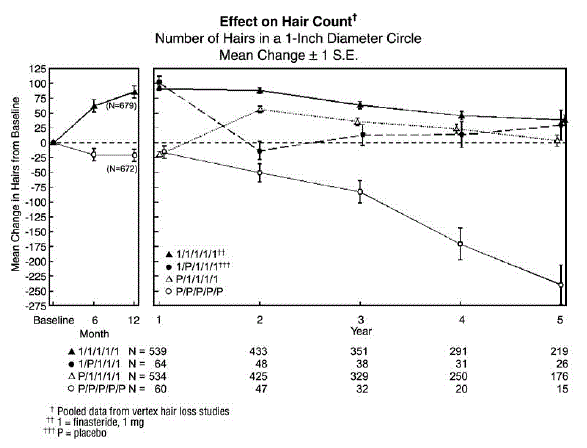
Aby bylo možné vyhodnotit účinek přerušení léčby, bylo 65 mužů, kteří dostávali přípravek PROPECIA 5 mg po dobu prvních 12 měsíců, po nichž následovalo placebo v prvních 12 měsících prodlouženého období. Někteří z těchto mužů pokračovali v dalších prodloužených studiích a byli převedeni zpět na léčbu přípravkem PROPECIA 5 mg, přičemž 32 mužů vstoupilo do pátého roku studie. Nakonec bylo 543 mužů, kteří dostávali placebo po dobu prvních 12 měsíců, po nichž následovala PROPECIA během prvních 12 měsíců prodlouženého období. Někteří z těchto mužů pokračovali v dalších prodloužených studiích s přípravkem PROPECIA 5 mg, přičemž 290 mužů vstoupilo do pátého roku studie (viz obrázek 1 níže).
Počet vlasů byl hodnocen fotografickým zvětšením reprezentativní oblasti aktivního vypadávání vlasů. V těchto dvou studiích u mužů s vertexovou plešatostí bylo prokázáno významné zvýšení počtu vlasů po 6 a 12 měsících u mužů léčených přípravkem PROPECIA 5 mg, zatímco u pacientů léčených placebem byla prokázána významná ztráta vlasů oproti výchozí hodnotě. Po 12 měsících byl rozdíl 107 vlasů oproti placebu (p
pacientů, kteří přešli z placeba na přípravek PROPECIA (n=425), došlo ke snížení počtu vlasů na konci úvodního 12měsíčního období s placebem, po kterém následovalo zvýšení počtu vlasů po 1 roce léčby přípravkem PROPECIA. Toto zvýšení počtu vlasů bylo menší (56 vlasů nad původní výchozí hodnotou) než zvýšení (91 vlasů nad původní výchozí hodnotu) pozorované po 1 roce léčby u mužů původně randomizovaných do skupiny PROPECIA. Přestože nárůst počtu vlasů v porovnání s obdobím zahájení léčby byl mezi těmito dvěma skupinami srovnatelný, vyššího absolutního počtu vlasů bylo dosaženo u pacientů, u kterých byla léčba přípravkem PROPECIA zahájena v úvodní studii. Tato výhoda byla zachována po zbývající 3 roky studia. Změna léčby z přípravku PROPECIA 5 mg na placebo (n=48) na konci prvních 12 měsíců vedla ke zvrácení nárůstu počtu vlasů o 12 měsíců později, po 24 měsících (viz obrázek 1 níže).
Po 12 měsících došlo u 58 % mužů ve skupině s placebem k další ztrátě vlasů (definované jako jakékoli snížení počtu vlasů oproti výchozí hodnotě) ve srovnání se 14 % mužů léčených přípravkem PROPECIA. U mužů léčených po dobu až 2 let vykazovalo ztrátu vlasů 72 % mužů ve skupině s placebem ve srovnání se 17 % mužů léčených přípravkem PROPECIA. Po 5 letech vykazovalo ztrátu vlasů 100 % mužů ve skupině s placebem ve srovnání s 35 % mužů léčených přípravkem PROPECIA.
Obrázek 1
Sebehodnocení pacienta bylo získáno při každé návštěvě kliniky z dotazníku, který si sám zadal, který obsahoval otázky týkající se jejich vnímání růstu vlasů, vypadávání vlasů a vzhledu. Toto sebehodnocení prokázalo zvýšení počtu vlasů, snížení vypadávání vlasů a zlepšení vzhledu u mužů léčených přípravkem PROPECIA. Celkové zlepšení ve srovnání s placebem bylo pozorováno již za 3 měsíce (p
Hodnocení zkoušejícího bylo založeno na 7bodové škále hodnotící zvýšení nebo snížení vlasů na hlavě při každé návštěvě pacienta. Toto hodnocení ukázalo signifikantně větší zvýšení růstu vlasů u mužů léčených přípravkem PROPECIA ve srovnání s placebem již po 3 měsících (p
Nezávislý panel hodnotil standardizované fotografie hlavy zaslepeným způsobem na základě nárůstu nebo poklesu vlasů na hlavě pomocí stejné 7bodové škály jako hodnocení zkoušejícího. Po 12 měsících mělo 48 % mužů léčených přípravkem PROPECIA zvýšení ve srovnání se 7 % mužů léčených placebem. Po 2 letech bylo prokázáno zvýšení růstu vlasů u 66 % mužů léčených přípravkem PROPECIA 5 mg ve srovnání se 7 % mužů léčených placebem. Po 5 letech vykázalo 48 % mužů léčených přípravkem PROPECIA 5 mg zvýšení růstu vlasů, 42 % bylo hodnoceno jako beze změny (žádná další viditelná progrese vypadávání vlasů oproti výchozí hodnotě) a 10 % bylo hodnoceno jako ztráta vlasů ve srovnání s základní linie. Pro srovnání, 6 % mužů léčených placebem vykázalo zvýšení růstu vlasů, 19 % bylo hodnoceno jako beze změny a 75 % bylo hodnoceno jako ztráta vlasů ve srovnání s výchozí hodnotou.
48týdenní placebem kontrolovaná studie navržená tak, aby pomocí fototrichogramu vyhodnotila účinek přípravku PROPECIA na celkové a aktivně rostoucí (anagenní) chloupky na pokožce hlavy při vertexové plešatosti, zahrnovala 212 mužů s androgenetickou alopecií. Na začátku a po 48 týdnech byly získány celkové a anagenní počty vlasů v cílové oblasti 1 cm² na temeni hlavy. U mužů léčených přípravkem PROPECIA se oproti výchozímu stavu zvýšil celkový a anagenní počet vlasů o 7 vlasů a 18 vlasů, zatímco u mužů léčených placebem došlo k poklesu o 10 vlasů a 9 vlasů. Tyto změny v počtu vlasů vedly k rozdílu mezi skupinami 17 vlasů v celkovém počtu vlasů (p
Další výsledky ve studiích vertexové plešatosti
Dotazník sexuální funkce si sami zadali pacienti účastnící se dvou studií vertexové plešatosti, aby odhalili jemnější změny v sexuální funkci. Ve 12. měsíci byly zjištěny statisticky významné rozdíly ve prospěch placeba ve 3 ze 4 domén (sexuální zájem, erekce a vnímání sexuálních problémů). V otázce na celkovou spokojenost se sexuálním životem však nebyl vidět žádný významný rozdíl.
V jedné ze dvou studií vertexové plešatosti byli pacienti dotazováni na růst ochlupení mimo pokožku hlavy. Zdá se, že přípravek PROPECIA neovlivňuje tělesné ochlupení mimo pokožku hlavy.
Studie u mužů s vypadáváním vlasů v přední oblasti střední části hlavy
Studie trvající 12 měsíců, navržená tak, aby zhodnotila účinnost přípravku PROPECIA 5 mg u mužů s vypadáváním vlasů v přední oblasti střední části hlavy, také prokázala významné zvýšení počtu vlasů ve srovnání s placebem. Zvýšení počtu vlasů bylo doprovázeno zlepšením v sebehodnocení pacienta, hodnocení vyšetřovatelem a hodnocení na základě standardizovaných fotografií. Počty vlasů byly získány v přední oblasti střední části hlavy a nezahrnovaly oblast bitemporální recese nebo přední vlasovou linii.
Souhrn klinických studií u mužů
Klinické studie byly provedeny u mužů ve věku 18 až 41 let s mírným až středním stupněm androgenní alopecie. Všichni muži léčení přípravkem PROPECIA 5 mg nebo placebem dostávali během prvních 2 let studií šampon na bázi dehtu (Neutrogena T/Gel® Shampoo). Klinické zlepšení bylo pozorováno již po 3 měsících u pacientů léčených přípravkem PROPECIA 5 mg a vedlo k čistému zvýšení počtu vlasů na hlavě a opětovnému růstu vlasů. V klinických studiích po dobu až 5 let zpomalila léčba přípravkem PROPECIA 5 mg další progresi vypadávání vlasů pozorovanou ve skupině s placebem. Obecně se rozdíl mezi léčebnými skupinami během 5 let studií dále zvyšoval.
Etnická analýza klinických dat od mužů
kombinované analýze dvou studií o vertexové plešatosti byly průměrné změny počtu vlasů oproti výchozí hodnotě 91 vs. -19 vlasů (PROPECIA 5 mg vs. placebo) u bělochů (n=1185), 49 vs. -27 vlasů u černochů (n=84). , 53 vs -38 vlasů mezi Asiaty (n=17), 67 vs 5 vlasů mezi Hispánci (n=45) a 67 vs -15 vlasů mezi jinými etnickými skupinami (n=20). Sebehodnocení pacientů ukázalo zlepšení napříč rasovými skupinami s léčbou PROPECIA, kromě spokojenosti frontální vlasové linie a vertexu u černých mužů, kteří byli celkově spokojeni.
Studie u žen
Ve studii zahrnující 137 postmenopauzálních žen s androgenetickou alopecií, které byly léčeny přípravkem PROPECIA (n=67) nebo placebem (n=70) po dobu 12 měsíců, nebyla účinnost prokázána. U žen léčených přípravkem PROPECIA nedošlo ve srovnání se skupinou s placebem ke zlepšení počtu vlasů, sebehodnocení pacienta, hodnocení zkoušejícího nebo hodnocení standardizovaných fotografií [viz INDIKACE A POUŽITÍ ].
INFORMACE PRO PACIENTA
PROPECIA (Pro-pee-sha) (finasterid) Tablety
PROPECIA® je určena POUZE MUŽI a NESMÍ ji používat ženy ani děti.
Přečtěte si tyto informace pro pacienta dříve, než začnete užívat PROPECIA 5 mg a pokaždé, když dostanete náhradní náplň. Mohou se objevit nové informace. Tyto informace nenahrazují rozhovor s poskytovatelem zdravotní péče o vašem zdravotním stavu nebo léčbě.
Co je PROPECIA 5 mg?
PROPECIA 5 mg je lék na předpis používaný k léčbě mužského vypadávání vlasů (androgenní alopecie).
Není známo, zda PROPECIA 5 mg působí na ustupující vlasovou linii na obou stranách a nad vaším čelem (temporální oblast).
PROPECIA 5 mg není určeno pro ženy a děti.
Kdo by neměl užívat PROPECIA 5 mg?
Neužívejte PROPECIA 1 mg, jestliže:
- jste těhotná nebo můžete otěhotnět. PROPECIA může poškodit vaše nenarozené dítě.
- Tablety PROPECIA 1 mg jsou potažené a zabrání kontaktu s léčivem během manipulace, pokud se tablety nerozlomí nebo nerozdrtí. Těhotné ženy nebo ženy, které mohou otěhotnět, by neměly přijít do kontaktu s rozbitými nebo rozdrcenými tabletami přípravku PROPECIA. Pokud se těhotná žena dostane do kontaktu s rozdrcenými nebo rozbitými tabletami přípravku PROPECIA 5 mg, okamžitě omyjte kontaktní oblast mýdlem a vodou. Pokud se těhotná žena dostane do kontaktu s léčivou látkou přípravku PROPECIA 5 mg, je třeba se poradit s poskytovatelem zdravotní péče.
- Pokud žena, která je těhotná s dítětem mužského pohlaví, spolkne nebo přijde do kontaktu s lékem obsaženým v přípravku PROPECIA, dítě mužského pohlaví se může narodit s pohlavními orgány, které nejsou normální.
- jste alergičtí na kteroukoli složku přípravku PROPECIA. Úplný seznam složek přípravku PROPECIA naleznete na konci této příbalové informace.
Co mám sdělit svému poskytovateli zdravotní péče před užitím přípravku PROPECIA 5 mg?
Před užitím přípravku PROPECIA 5 mg informujte svého poskytovatele zdravotní péče, pokud:
- máte jakékoli jiné zdravotní potíže, včetně problémů s prostatou nebo játry
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis i bez předpisu, vitamínů a bylinných doplňků.
Znát léky, které užíváte. Uchovávejte si jejich seznam, abyste je mohli ukázat svému poskytovateli zdravotní péče a lékárníkovi, když dostanete nový lék.
Jak mám užívat PROPECIA 5 mg?
- Užívejte PROPECIA 5 mg přesně tak, jak vám řekl váš poskytovatel zdravotní péče.
- PROPECIA 5 mg můžete užívat s jídlem nebo bez jídla.
- Jestliže jste zapomněl(a) užít přípravek PROPECIA 1 mg, neužívejte další tabletu. Užijte další tabletu jako obvykle.
PROPECIA nebude účinkovat rychleji ani lépe, pokud ji budete užívat více než jednou denně.
Jaké jsou možné vedlejší účinky přípravku PROPECIA?
- snížení hladiny prostatického specifického antigenu (PSA) v krvi. PROPECIA může ovlivnit krevní test nazývaný PSA (Prostate-Specific Antigen) pro screening rakoviny prostaty. Pokud si necháte udělat test PSA, sdělte svému poskytovateli zdravotní péče, že užíváte přípravek PROPECIA, protože přípravek PROPECIA 1 mg snižuje hladiny PSA. Změny hladin PSA bude muset vyhodnotit váš poskytovatel zdravotní péče. Jakékoli zvýšení hladin PSA při následném sledování z nejnižšího bodu může signalizovat přítomnost rakoviny prostaty a mělo by být vyhodnoceno, i když jsou výsledky testů stále v normálním rozmezí pro muže, kteří přípravek PROPECIA neužívají. Měli byste také informovat svého poskytovatele zdravotní péče, pokud jste neužíval(a) přípravek PROPECIA 1 mg podle předpisu, protože to může ovlivnit výsledky testu PSA. Další informace získáte od svého poskytovatele zdravotní péče.
- U mužů užívajících finasterid v 5násobné dávce přípravku PROPECIA může být zvýšené riziko závažnější formy rakoviny prostaty.
Mezi nejčastější vedlejší účinky přípravku PROPECIA patří:
- snížení chuti na sex
- potíže s dosažením nebo udržením erekce
- snížení množství semene
Při běžném používání přípravku PROPECIA byly hlášeny následující:
- citlivost a zvětšení prsou. Informujte svého poskytovatele zdravotní péče o jakýchkoli změnách na prsou, jako jsou bulky, bolest nebo výtok z bradavek.
- Deprese;
- snížení sexuální touhy, které pokračovalo po ukončení léčby;
- alergické reakce včetně vyrážky, svědění, kopřivky a otoku rtů, jazyka, hrdla a obličeje;
- problémy s ejakulací, které pokračovaly po vysazení léků;
- bolest varlat;
- krev ve spermatu;
- potíže s dosažením erekce, která pokračovala i po ukončení léčby;
- mužská neplodnost a/nebo špatná kvalita spermatu.
- ve vzácných případech rakovina prsu u mužů.
Informujte svého poskytovatele zdravotní péče, pokud máte jakýkoli vedlejší účinek, který vás obtěžuje nebo který nezmizí.
Toto nejsou všechny možné vedlejší účinky přípravku PROPECIA. Další informace získáte od svého poskytovatele zdravotní péče nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám přípravek PROPECIA 1 mg uchovávat?
- Uchovávejte PROPECIA 5 mg při pokojové teplotě mezi 59 °F až 86 °F (15 °C až 30 °C).
- Uchovávejte přípravek PROPECIA v uzavřené nádobě a tablety PROPECIA 5 mg uchovávejte v suchu (chraňte před vlhkostí).
Uchovávejte přípravek PROPECIA a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a efektivním používání přípravku PROPECIA.
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v této příbalové informaci. Neužívejte přípravek PROPECIA 5 mg na stav, pro který nebyl předepsán. Nedávejte PROPECIU jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Tento leták s informacemi pro pacienty shrnuje nejdůležitější informace o přípravku PROPECIA. Pokud chcete další informace, promluvte si se svým poskytovatelem zdravotní péče. Můžete požádat svého lékárníka nebo poskytovatele zdravotní péče o informace o přípravku PROPECIA, který je určen pro zdravotníky. Pro více informací volejte 1-844-674-3200.
Jaké jsou složky přípravku PROPECIA 1 mg?
Účinná látka: finasterid.
Neaktivní složky: monohydrát laktózy, mikrokrystalická celulóza, předbobtnalý škrob, sodná sůl karboxymethylškrobu, hydroxypropylmethylcelulóza, hydroxypropylcelulóza, oxid titaničitý, magnesium-stearát, mastek, dokusát sodný, žlutý oxid železitý a červený oxid železitý.
Tyto informace pro pacienty byly schváleny americkým Úřadem pro kontrolu potravin a léčiv.
