Proscar 5mg Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Proscar 5 mg a jak se používá?
Proscar je lék na předpis používaný k léčbě příznaků benigní hyperplazie prostaty a androgenní alopecie. Tento lék je určen pouze k použití u mužů. Proscar 5 mg lze užívat samostatně nebo s jinými léky.
Proscar patří do třídy léků nazývaných inhibitory 5-alfa-reduktázy.
Není známo, zda je Proscar 5 mg bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Proscar 5 mg?
Proscar může způsobit závažné nežádoucí účinky, včetně:
- těžká nebo přetrvávající nevolnost,
- potíže s dýcháním,
- otok obličeje, rtů, jazyka nebo hrdla,
- bulky v prsou,
- bolest nebo citlivost prsou,
- výtok z bradavek a
- jiné změny prsou
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Proscar patří:
- ztráta zájmu o sex,
- impotence,
- potíže s orgasmem a
- abnormální ejakulace
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Proscar. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
PROSCAR (finasterid), syntetická 4-azasteroidní sloučenina, je specifický inhibitor steroidního typu II 5α-reduktázy, intracelulárního enzymu, který přeměňuje androgenní testosteron na 5α-dihydrotestosteron (DHT).
Finasterid je 4-azaandrost-1-en-17-karboxamid, N-(1,1-dimethylethyl)-3-oxo-,(5a,17ß)-. Empirický vzorec finasteridu je C23H36N2O2 a jeho molekulová hmotnost je 372,55. Jeho strukturní vzorec je:
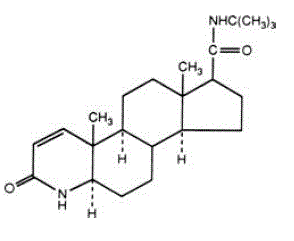
Finasterid je bílý krystalický prášek s bodem tání blízko 250 °C. Je volně rozpustný v chloroformu a v rozpouštědlech s nižším alkoholem, ale je prakticky nerozpustný ve vodě.
Tablety PROSCAR (finasterid) pro perorální podání jsou potahované tablety, které obsahují 5 mg finasteridu a následující neaktivní složky: hydratovaná laktóza, mikrokrystalická celulóza, předbobtnalý škrob, sodná sůl glykolátu škrobu, hydroxypropylcelulóza LF, hydroxypropylmethylcelulóza, oxid titaničitý, stearát hořečnatý , mastek, docusát sodný, hliníkový lak FD&C Blue 2 a žlutý oxid železitý.
INDIKACE
Monoterapie
PROSCAR® je indikován k léčbě symptomatické benigní hyperplazie prostaty (BPH) u mužů se zvětšenou prostatou k:
- Zlepšit příznaky
- Snižte riziko akutní retence moči
- Snížení rizika nutnosti chirurgického zákroku včetně transuretrální resekce prostaty (TURP) a prostatektomie.
Kombinace s alfa-blokátorem
PROSCAR 5 mg podávaný v kombinaci s alfa-blokátorem doxazosinem je indikován ke snížení rizika symptomatické progrese BPH (potvrzené ≥4 bodové zvýšení skóre příznaků Americké urologické asociace (AUA).
Omezení použití
PROSCAR není schválen pro prevenci rakoviny prostaty.
DÁVKOVÁNÍ A PODÁVÁNÍ
PROSCAR lze podávat s jídlem nebo bez jídla.
Monoterapie
Doporučená dávka přípravku PROSCAR je jedna tableta (5 mg) užívaná jednou denně [viz Klinické studie ].
Kombinace s alfa-blokátorem
Doporučená dávka přípravku PROSCAR je jedna tableta (5 mg) užívaná jednou denně v kombinaci s alfa-blokátorem doxazosinem [viz. Klinické studie ].
JAK DODÁVÁNO
Dávkové formy A Síly
5mg modré potahované tablety upraveného tvaru jablka, s kódem MSD 72 na jedné straně a PROSCAR 5 mg na druhé straně.
Skladování A Manipulace
č. 3094 - PROSCAR tablety 5 mg jsou modré, upravené, potahované tablety ve tvaru jablka, s kódem MSD 72 na jedné straně a PROSCAR na druhé straně. Dodávají se následovně:
NDC 0006-0072-31 jednotka použití láhve po 30 NDC 0006-0072-58 jednotka použití láhve po 100.
Skladování A Manipulace
Skladujte při pokojové teplotě pod 30°C (86°F). Chraňte před světlem a udržujte nádobu těsně uzavřenou.
Ženy by neměly manipulovat s rozdrcenými nebo rozbitými tabletami PROSCAR 5 mg, když jsou těhotné nebo mohou být potenciálně těhotné kvůli možnosti absorpce finasteridu a následnému potenciálnímu riziku pro mužský plod [viz. VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Distribuuje: Merck Sharp & Dohme Corp., dceřiná společnost MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Upraveno: červen 2021
VEDLEJŠÍ EFEKTY
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v klinické praxi.
4letá placebem kontrolovaná studie (PLESS)
Ve studii PLESS byla po dobu 4 let hodnocena bezpečnost u 1524 pacientů léčených přípravkem PROSCAR a 1516 pacientů léčených placebem. Nejčastěji hlášené nežádoucí účinky souvisely se sexuální funkcí. 3,7 % (57 pacientů) léčených přípravkem PROSCAR 5 mg a 2,1 % (32 pacientů) léčených placebem přerušilo léčbu v důsledku nežádoucích účinků souvisejících se sexuální funkcí, což jsou nejčastěji hlášené nežádoucí účinky.
Tabulka 1 uvádí jediné klinické nežádoucí účinky, které zkoušející považoval za možná, pravděpodobně nebo určitě související s lékem, u nichž byla incidence u přípravku PROSCAR 5 mg ≥1 % a vyšší než u placeba během 4 let studie. V letech 2-4 studie nebyl mezi léčebnými skupinami významný rozdíl v incidenci impotence, sníženého libida a poruchy ejakulace.
Studie fáze III a 5letá otevřená prodloužení
Profil nežádoucích účinků v 1leté, placebem kontrolované studii fáze III, 5letých otevřených prodlouženích a PLESS byl podobný.
Studie lékařské terapie prostatických příznaků (MTOPS).
Ve studii MTOPS bylo randomizováno 3047 mužů se symptomatickou BPH, kteří dostávali PROSCAR 5 mg/den (n=768), doxazosin 4 nebo 8 mg/den (n=756), kombinaci PROSCAR 5 mg/den a doxazosin 4 resp. 8 mg/den (n=786) nebo placebo (n=737) po dobu 4 až 6 let. [Vidět Klinické studie .]
Míry výskytu nežádoucích účinků souvisejících s lékem hlášených u ≥ 2 % pacientů v jakékoli léčebné skupině ve studii MTOPS jsou uvedeny v tabulce 2.
Jednotlivé nežádoucí účinky, které se vyskytovaly častěji ve skupině s kombinovanou léčbou ve srovnání s každým lékem samostatně, byly: astenie, posturální hypotenze, periferní edém, závratě, snížené libido, rýma, abnormální ejakulace, impotence a abnormální sexuální funkce (viz tabulka 2). Z nich byl výskyt abnormální ejakulace u pacientů léčených kombinovanou terapií srovnatelný se součtem výskytu těchto nežádoucích účinků hlášených u dvou monoterapií.
Kombinovaná léčba finasteridem a doxazosinem nebyla spojena s žádnými novými klinickými nežádoucími zkušenostmi.
Čtyři pacienti v MTOPS uvedli nežádoucí zkušenost s rakovinou prsu. Tři z těchto pacientů užívali pouze finasterid a jeden byl na kombinované terapii. [Vidět Dlouhodobá data .]
Studie MTOPS nebyla specificky navržena k provádění statistických srovnání mezi skupinami pro hlášené nežádoucí účinky. Navíc přímá srovnání údajů o bezpečnosti mezi studií MTOPS a předchozími studiemi jednotlivých látek nemusí být vhodná na základě rozdílů v populaci pacientů, dávkování nebo dávkovacím režimu a dalších procedurálních a designových prvcích studie.
Dlouhodobá data
Vysoce kvalitní rakovina prostaty
Studie PCPT byla 7letá randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie, do které bylo zařazeno 18 882 mužů ve věku ≥ 55 let s normálním digitálním rektálním vyšetřením a PSA ≤ 3,0 ng/ml. Muži dostávali denně buď PROSCAR (finasterid 5 mg) nebo placebo. Pacienti byli každoročně hodnoceni pomocí PSA a digitálních rektálních vyšetření. Biopsie byly provedeny pro zvýšené PSA, abnormální digitální rektální vyšetření nebo na konci studie. Výskyt rakoviny prostaty Gleason skóre 8-10 byl vyšší u mužů léčených finasteridem (1,8 %) než u mužů léčených placebem (1,1 %) [viz. INDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Ve 4leté placebem kontrolované klinické studii s jiným inhibitorem 5α-reduktázy (dutasterid, AVODART) byly pozorovány podobné výsledky pro karcinom prostaty Gleasonovo skóre 8-10 (1 % dutasterid vs 0,5 % placebo).
U pacientů s karcinomem prostaty léčených přípravkem PROSCAR nebyl prokázán žádný klinický přínos.
Rakovina prsu
Během 4 až 6leté studie MTOPS kontrolované placebem a komparátorem, do které bylo zařazeno 3047 mužů, se vyskytly 4 případy rakoviny prsu u mužů léčených finasteridem, ale žádné případy u mužů neléčených finasteridem. Během 4leté, placebem kontrolované studie PLESS, do které bylo zařazeno 3040 mužů, se vyskytly 2 případy rakoviny prsu u mužů léčených placebem, ale žádné případy u mužů léčených finasteridem. Během 7leté placebem kontrolované studie prevence rakoviny prostaty (PCPT), do které bylo zařazeno 18 882 mužů, se vyskytl 1 případ rakoviny prsu u mužů léčených finasteridem a 1 případ rakoviny prsu u mužů léčených placebem. Vztah mezi dlouhodobým užíváním finasteridu a mužskou neoplazií prsu není v současnosti znám.
Sexuální funkce
Neexistují žádné důkazy o zvýšených sexuálních nežádoucích zkušenostech při delším trvání léčby přípravkem PROSCAR. Nové zprávy o sexuálních nežádoucích účincích souvisejících s drogami se s délkou léčby snižovaly.
Postmarketingové zkušenosti
Následující další nežádoucí účinky byly hlášeny po uvedení přípravku PROSCAR na trh. Protože jsou tyto příhody hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí drogám:
- hypersenzitivní reakce, jako je svědění, kopřivka a angioedém (včetně otoku rtů, jazyka, hrdla a obličeje)
- bolest varlat
- hematospermie
- sexuální dysfunkce, která pokračovala po přerušení léčby, včetně erektilní dysfunkce, sníženého libida a poruch ejakulace (např. snížený objem ejakulátu). Tyto příhody byly vzácně hlášeny u mužů užívajících PROSCAR k léčbě BPH. Většina mužů byla starší a užívala souběžně léky a/nebo měla přidružená onemocnění. Nezávislá role přípravku PROSCAR 5 mg při těchto příhodách není známa.
- mužská neplodnost a/nebo špatná kvalita semene byly hlášeny vzácně u mužů užívajících PROSCAR 5 mg k léčbě BPH. Po vysazení finasteridu byla hlášena normalizace nebo zlepšení špatné kvality semene. Nezávislá role přípravku PROSCAR v těchto příhodách není známa.
- Deprese
- mužská rakovina prsu.
Následující další nežádoucí příhody související se sexuální dysfunkcí, které pokračovaly po přerušení léčby, byly hlášeny v postmarketingových zkušenostech s finasteridem v nižších dávkách používaných k léčbě mužské plešatosti. Protože událost je hlášena dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout její frekvenci nebo stanovit příčinnou souvislost s expozicí drogám:
- poruchy orgasmu
DROGOVÉ INTERAKCE
Cytochrome P450-Linked Drug Metabolizing Enzyme System
Nebyly zjištěny žádné klinicky významné lékové interakce. Nezdá se, že by finasterid ovlivňoval enzymový systém metabolizující léčiva vázaný na cytochrom P450. Sloučeniny, které byly testovány u člověka, zahrnovaly antipyrin, digoxin, propranolol, theofylin a warfarin a nebyly nalezeny žádné klinicky významné interakce.
Jiná souběžná terapie
I když nebyly provedeny specifické interakční studie, byl PROSCAR 5 mg současně používán v klinických studiích s acetaminofenem, kyselinou acetylsalicylovou, α-blokátory, inhibitory angiotenzin-konvertujícího enzymu (ACE), analgetiky, antikonvulzivními látkami, beta-adrenergními blokátory, diuretiky, vápníkem blokátory kanálů, srdeční nitráty, inhibitory HMG-CoA reduktázy, nesteroidní protizánětlivé léky (NSAID), benzodiazepiny, antagonisty H2Â a chinolonová antiinfektiva bez známek klinicky významných nežádoucích interakcí.
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Účinky na prostatický specifický antigen (PSA) a použití PSA při detekci rakoviny prostaty
klinických studiích přípravek PROSCAR snížil sérovou koncentraci PSA přibližně o 50 % během šesti měsíců léčby. Tento pokles je předvídatelný v celém rozsahu hodnot PSA u pacientů se symptomatickou BPH, i když se může u jednotlivců lišit.
Pro interpretaci sériových PSA u mužů užívajících PROSCAR by měla být stanovena nová výchozí hodnota PSA alespoň šest měsíců po zahájení léčby a poté by PSA měla být pravidelně monitorována. Jakékoli potvrzené zvýšení z nejnižší hodnoty PSA při užívání přípravku PROSCAR 5 mg může signalizovat přítomnost rakoviny prostaty a mělo by být vyhodnoceno, i když jsou hladiny PSA stále v normálním rozmezí pro muže, kteří neužívají inhibitor 5α reduktázy. Nesoulad s léčbou PROSCAR může také ovlivnit výsledky testu PSA. Pro interpretaci izolované hodnoty PSA u pacientů léčených přípravkem PROSCAR 5 mg po dobu šesti měsíců nebo déle by měly být hodnoty PSA zdvojnásobeny pro srovnání s normálními rozsahy u neléčených mužů. Tyto úpravy zachovávají užitečnost PSA k detekci rakoviny prostaty u mužů léčených přípravkem PROSCAR.
PROSCAR může také způsobit snížení PSA v séru v přítomnosti rakoviny prostaty.
Poměr volného a celkového PSA (procento volného PSA) zůstává konstantní i pod vlivem přípravku PROSCAR. Pokud se lékaři rozhodnou použít procento volného PSA jako pomůcku při detekci karcinomu prostaty u mužů podstupujících léčbu finasteridem, nezdá se, že by bylo nutné jeho hodnotu upravovat.
Zvýšené riziko rakoviny prostaty vysokého stupně
Muži ve věku 55 a více let s normálním digitálním rektálním vyšetřením a PSA ≤ 3,0 ng/ml na začátku užívající finasterid 5 mg/den v 7leté studii prevence rakoviny prostaty (PCPT) měli zvýšené riziko rakoviny prostaty podle Gleasonova skóre 8-10 (finasterid 1,8 % vs. placebo 1,1 %). [Vidět INDIKACE a NEŽÁDOUCÍ REAKCE .] Podobné výsledky byly pozorovány ve 4leté placebem kontrolované klinické studii s jiným inhibitorem 5α-reduktázy (dutasterid, AVODART) (1 % dutasterid vs 0,5 % placebo). Inhibitory 5αreduktázy mohou zvýšit riziko rozvoje rakoviny prostaty vysokého stupně. Nebylo stanoveno, zda účinek inhibitorů 5α-reduktázy na snížení objemu prostaty nebo faktory související se studií ovlivnily výsledky těchto studií.
Expozice žen
Riziko pro mužský plod
PROSCAR je kontraindikován u těhotných žen a u žen, které mohou být potenciálně těhotné a není indikován pro použití u žen. Na základě studií na zvířatech a mechanismu účinku může PROSCAR 5 mg způsobit abnormální vývoj zevních genitálií u mužského plodu, pokud je podán těhotné ženě. Ženy, které jsou těhotné nebo mohou být potenciálně těhotné, by neměly manipulovat s rozdrcenými nebo rozlomenými tabletami PROSCAR 5 mg. Tablety PROSCAR 5 mg jsou potažené a zabrání kontaktu s léčivou látkou při běžné manipulaci za předpokladu, že tablety nebyly rozlomeny nebo rozdrceny. Pokud se těhotná žena dostane do kontaktu s rozdrcenými nebo rozbitými tabletami PROSCAR 5 mg, kontaktní oblast by měla být okamžitě omyta mýdlem a vodou. [Vidět KONTRAINDIKACE ,A Použití u konkrétních populací ,A KLINICKÁ FARMAKOLOGIE , a JAK DODÁVÁNO .]
Pediatričtí pacienti a ženy
PROSCAR není indikován pro použití u pediatrických pacientů [viz Použití u konkrétních populací a KLINICKÁ FARMAKOLOGIE ] nebo ženy [viz také VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ,A Použití u konkrétních populací ,A KLINICKÁ FARMAKOLOGIE , a JAK DODÁVÁNO ].
Vliv na vlastnosti spermatu
Léčba přípravkem PROSCAR po dobu 24 týdnů k vyhodnocení parametrů spermatu u zdravých mužských dobrovolníků neodhalila žádné klinicky významné účinky na koncentraci spermií, pohyblivost, morfologii nebo pH. Byl pozorován střední pokles objemu ejakulátu o 0,6 ml (22,1 %) se současným snížením celkového množství spermií na ejakulát. Tyto parametry zůstaly v normálním rozmezí a byly reverzibilní po přerušení léčby s průměrnou dobou návratu k výchozí hodnotě 84 týdnů.
Zvážení jiných urologických stavů
Před zahájením léčby přípravkem PROSCAR 5 mg je třeba zvážit další urologická onemocnění, která mohou způsobit podobné příznaky. Kromě toho může koexistovat rakovina prostaty a BPH.
Pacienti s velkým reziduálním objemem moči a/nebo výrazně sníženým průtokem moči by měli být pečlivě sledováni kvůli obstrukční uropatii. Tito pacienti nemusí být kandidáty na léčbu finasteridem.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( INFORMACE PRO PACIENTA ).
Zvýšené riziko rakoviny prostaty vysokého stupně
Pacienti by měli být informováni, že u mužů léčených inhibitory 5α-reduktázy indikovanými k léčbě BPH, včetně přípravku PROSCAR 5 mg, došlo k nárůstu rakoviny prostaty vysokého stupně ve srovnání s těmi, kteří byli léčeni placebem ve studiích zaměřených na použití těchto léků k prevenci prostaty. rakovina [viz INDIKACE ,A VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , a NEŽÁDOUCÍ REAKCE ].
Expozice žen - Riziko pro mužský plod
Lékaři by měli pacienty informovat, že ženy, které jsou těhotné nebo mohou být potenciálně těhotné, by neměly manipulovat s rozdrcenými nebo rozbitými tabletami PROSCAR z důvodu možnosti absorpce finasteridu a následného potenciálního rizika pro mužský plod. Tablety PROSCAR jsou potažené a zabrání kontaktu s účinnou látkou při běžné manipulaci za předpokladu, že tablety nebyly rozbity nebo rozdrceny. Pokud žena, která je těhotná nebo může být těhotná, přijde do kontaktu s rozdrcenými nebo rozbitými tabletami PROSCAR, kontaktní oblast by měla být okamžitě omyta mýdlem a vodou [viz. KONTRAINDIKACE ,A VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ,A Použití u konkrétních populací a JAK DODÁVÁNO ].
Další pokyny
Lékaři by měli pacienty informovat, že objem ejakulátu může být u některých pacientů během léčby přípravkem PROSCAR snížen. Zdá se, že tento pokles nenarušuje normální sexuální funkce. U pacientů léčených přípravkem PROSCAR se však může objevit impotence a snížené libido [viz NEŽÁDOUCÍ REAKCE ].
Lékaři by měli pacienty poučit, aby neprodleně hlásili jakékoli změny na prsou, jako jsou bulky, bolest nebo výtok z bradavek. Byly hlášeny změny prsů včetně zvětšení prsou, citlivosti a novotvaru [viz NEŽÁDOUCÍ REAKCE ].
Lékaři by měli své pacienty poučit, aby si před zahájením léčby přípravkem PROSCAR 5 mg přečetli příbalovou informaci pro pacienty a aby si ji znovu přečetli při každém obnovení předpisu, aby byli informováni o aktuálních informacích pro pacienty o přípravku PROSCAR.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Ve 24měsíční studii na potkanech Sprague-Dawley, kterým byly podávány dávky finasteridu až 160 mg/kg/den u samců a 320 mg/kg/den u samic, nebyly pozorovány žádné známky tumorigenního účinku. Tyto dávky vyvolaly příslušnou systémovou expozici u potkanů 111krát a 274krát vyšší než u člověka, kterému byla podávána doporučená dávka pro člověka 5 mg/den. Všechny výpočty expozice byly založeny na vypočtené AUC(0-24 hod) pro zvířata a průměrné AUC(0-24 hod) pro člověka (0,4 μg•hod/ml).
19měsíční studii karcinogenity u myší CD-1 bylo pozorováno statisticky významné (p≤0,05) zvýšení výskytu adenomů testikulárních Leydigových buněk při 228násobku expozice u člověka (250 mg/kg/den). U myší při 23násobku expozice u člověka, odhadované (25 mg/kg/den) au potkanů při 39násobku expozice u člověka (40 mg/kg/den) bylo pozorováno zvýšení výskytu hyperplazie Leydigových buněk. U obou druhů hlodavců léčených vysokými dávkami finasteridu byla prokázána pozitivní korelace mezi proliferativními změnami v Leydigových buňkách a zvýšením sérových hladin LH (2 až 3krát nad kontrolou). Žádné změny Leydigových buněk související s lékem nebyly pozorovány u potkanů ani psů léčených finasteridem po dobu 1 roku při 30 a 350násobné dávce (20 mg/kg/den a 45 mg/kg/den) nebo u myší léčených po dobu 19 měsíců při 2,3násobek expozice člověka, odhadovaná (2,5 mg/kg/den).
Mutageneze
Nebyl pozorován žádný důkaz mutagenity v testu bakteriální mutageneze in vitro, testu mutageneze savčích buněk nebo v testu in vitro alkalické eluce. V in vitro testu chromozomových aberací s použitím ovariálních buněk čínského křečka došlo k mírnému zvýšení chromozomových aberací. Tyto koncentrace odpovídají 4000-5000násobku maximálních plazmatických hladin u člověka při celkové dávce 5 mg. V in vivo testu chromozomových aberací u myší nebylo pozorováno žádné zvýšení chromozomových aberací související s léčbou u finasteridu v maximální tolerované dávce 250 mg/kg/den (228násobek expozice u člověka), jak bylo stanoveno ve studiích karcinogenity.
Zhoršení Plodnosti
pohlavně dospělých samců králíků léčených finasteridem v dávce 543krát vyšší, než je expozice u člověka (80 mg/kg/den) po dobu až 12 týdnů, nebyl pozorován žádný vliv na fertilitu, počet spermií nebo objem ejakulátu. U pohlavně dospělých samců potkanů léčených 61násobkem expozice u člověka (80 mg/kg/den) nebyly po 6 nebo 12 týdnech léčby pozorovány žádné významné účinky na fertilitu; když však léčba pokračovala po dobu až 24 nebo 30 týdnů, došlo ke zjevnému snížení plodnosti, plodnosti a souvisejícímu významnému snížení hmotnosti semenných váčků a prostaty. Všechny tyto účinky byly reverzibilní do 6 týdnů po ukončení léčby. U potkanů nebo králíků nebyl pozorován žádný účinek na varlata nebo páření související s léčivem. Toto snížení plodnosti u potkanů léčených finasteridem je sekundární vzhledem k jeho účinku na pomocné pohlavní orgány (prostata a semenné váčky), což má za následek selhání tvorby semenné zátky. Semenná zátka je nezbytná pro normální plodnost u potkanů a není relevantní u člověka.
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
PROSCAR je kontraindikován u těhotných žen a není indikován pro použití u žen. Na základě studií na zvířatech a mechanismu účinku může PROSCAR 5 mg způsobit abnormální vývoj vnějších genitálií u mužského plodu, pokud je podáván těhotné ženě [viz. VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
Ve studii embryo-fetálního vývoje u potkanů došlo k na dávce závislému zvýšení hypospadií, které se objevilo u 3,6 až 100 % samčích potomků březích potkanů, kterým byl perorálně podáván finasterid během období velké organogeneze v dávkách přibližně 0,1 až 86násobku maximální doporučená dávka pro člověka (MRHD) 5 mg/den (na základě AUC při dávkách pro zvířata 0,1 až 100 mg/kg/den).
Snížená hmotnost prostaty a semenných váčků, opožděná separace předkožky a přechodný vývoj bradavek byly také pozorovány u samčích potomků při perorálních mateřských dávkách přibližně 0,03násobku MRHD (na základě AUC při dávce 0,03 mg/kg/den pro zvířata) spolu se sníženou anogenitální vzdáleností u samčích potomků při perorálních mateřských dávkách přibližně 0,003násobku MRHD (na základě AUC při dávce pro zvířata 0,003 mg/kg/den).
PROSCAR je inhibitor 5α-reduktázy typu II, který zabraňuje přeměně testosteronu na 5α-dihydrotestosteron (DHT), hormon nezbytný pro normální vývoj mužských genitálií. Pokud je tento lék užíván během těhotenství nebo pokud pacientka otěhotní během užívání tohoto léku, pacientka by měla být informována o potenciálním riziku pro mužský plod.
Abnormální vývoj mužských genitálií je očekávaným důsledkem, když je přeměna testosteronu na 5α-dihydrotestosteron (DHT) inhibována inhibitory 5α-reduktázy. Tyto výsledky jsou podobné jako u kojenců mužského pohlaví s genetickým deficitem 5α-reduktázy. Ženy mohou být vystaveny finasteridu při kontaktu s rozdrcenými nebo rozbitými tabletami přípravku PROSCAR nebo spermatem mužského partnera užívajícího přípravek PROSCAR. Pokud jde o expozici finasteridu přes kůži, tablety PROSCAR 5 mg jsou potažené a zabrání kontaktu pokožky s finasteridem při běžné manipulaci, pokud tablety nebyly rozdrceny nebo rozbité. Ženy, které jsou těhotné nebo mohou být potenciálně těhotné, by neměly manipulovat s rozdrcenými nebo rozbitými tabletami PROSCAR 5 mg z důvodu možné expozice mužského plodu. Pokud jde o potenciální expozici finasteridu prostřednictvím spermatu, byly provedeny tři studie, které měřily koncentrace finasteridu ve spermatu u mužů užívajících PROSCAR 5 mg/den. V těchto studiích bylo nejvyšší množství finasteridu ve spermatu odhadováno na 50 až 100krát nižší než dávka finasteridu (5 μg), která neměla žádný vliv na hladiny cirkulujícího DHT u mužů [viz. Data a KLINICKÁ FARMAKOLOGIE ].
Data
Lidská data
Ve 2 studiích se zdravými jedinci (n=69), kteří dostávali PROSCAR 5 mg/den po dobu 6-24 týdnů, se koncentrace finasteridu ve spermatu pohybovaly od nedetekovatelných ( KLINICKÁ FARMAKOLOGIE ].
Údaje o zvířatech
Ve studii embryo-fetálního vývoje dostávaly březí krysy finasterid během období hlavní organogeneze (6. až 17. den březosti). Při dávkách perorálního finasteridu u matky přibližně 0,1 až 86násobku maximální doporučené dávky pro člověka (MRHD) 5 mg/den (na základě AUC při dávkách 0,1 až 100 mg/kg/den u zvířat) došlo k na dávce závislému zvýšení hypospadie který se vyskytl u 3,6 až 100 % mužských potomků. Násobky expozice byly odhadnuty s použitím údajů od nebřezích krys. 16. až 17. den březosti je kritickým obdobím u samců plodu potkanů pro diferenciaci vnějších genitálií. Při perorálních dávkách matek přibližně 0,03násobku MRHD (na základě AUC při dávce 0,03 mg/kg/den pro zvířata) měli samčí potomci sníženou hmotnost prostaty a semenných váčků, opožděnou separaci předkožky a přechodný vývoj bradavek. U samců březích potkaních samců, kteří dostávali přibližně 0,003násobek MRHD (na základě AUC při zvířecí dávce 0,003 mg/kg/den), došlo ke snížení anogenitální vzdálenosti. U samic nebyly pozorovány žádné abnormality při jakékoli mateřské dávce finasteridu.
Nebyly pozorovány žádné vývojové abnormality u potomků neléčených samic spářených s potkaními samci léčenými finasteridem, kteří dostávali přibližně 61násobek MRHD (na základě AUC při dávce pro zvířata 80 mg/kg/den). Mírně snížená plodnost byla pozorována u samčích potomků po podání přibližně 3násobku MRHD (na základě AUC při zvířecí dávce 3 mg/kg/den) samicím potkanů během pozdní březosti a laktace. Za těchto podmínek nebyly u samic pozorovány žádné účinky na fertilitu.
Nebyly pozorovány žádné známky malformací samčích zevních genitálií nebo jiných abnormalit u plodů králíků vystavených finasteridu během období hlavní organogeneze (6.–18. den gestace) při mateřských perorálních dávkách až 100 mg/kg/den (úrovně expozice finasteridu nebyly měřeno u králíků). Tato studie však možná nezahrnovala kritické období pro účinky finasteridu na vývoj samčích vnějších genitálií u králíka.
Účinky expozice matce finasteridu na plod během období embryonálního a fetálního vývoje byly hodnoceny u opice rhesus (20.–100. den březosti), u druhu a období vývoje, které více predikují specifické účinky u lidí než studie na potkanech a králících. Intravenózní podávání finasteridu březím opicím v dávkách až 800 ng/den (odhadovaná maximální koncentrace v krvi 1,86 ng/ml nebo přibližně 143násobek nejvyšší odhadované expozice březích samic finasteridu ze spermatu mužů užívajících 5 mg/den) bez abnormalit u plodů mužského pohlaví. Potvrzením relevance modelu makaka pro vývoj lidského plodu je perorální podání dávky finasteridu (2 mg/kg/den nebo přibližně 18 000násobek nejvyšší odhadované hladiny finasteridu v krvi ze spermatu mužů užívajících 5 mg/den) březích opic vedly k abnormalitám vnějších genitálií u samčích plodů. U plodů mužského pohlaví nebyly pozorovány žádné jiné abnormality a žádné abnormality související s finasteridem nebyly pozorovány u plodů ženského pohlaví v jakékoli dávce.
Laktace
Shrnutí rizik
PROSCAR není indikován k použití u žen.
Ženy a muži reprodukčního potenciálu
Neplodnost
Ženy
PROSCAR není indikován k použití u žen.
Muži
Léčba přípravkem PROSCAR po dobu 24 týdnů k vyhodnocení parametrů spermatu u zdravých mužských dobrovolníků neodhalila žádné klinicky významné účinky na koncentraci spermií, pohyblivost, morfologii nebo pH. Byl pozorován střední pokles objemu ejakulátu o 0,6 ml (22,1 %) se současným snížením celkového množství spermií na ejakulát. Tyto parametry zůstaly v normálním rozmezí a byly reverzibilní po přerušení léčby s průměrnou dobou návratu k výchozí hodnotě 84 týdnů [viz. VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Po uvedení přípravku na trh byly hlášeny případy mužské neplodnosti a/nebo špatné kvality semene; po vysazení finasteridu byla hlášena normalizace nebo zlepšení kvality semene [viz NEŽÁDOUCÍ REAKCE ].
Pediatrické použití
PROSCAR 5 mg není indikován k použití u pediatrických pacientů.
Bezpečnost a účinnost u pediatrických pacientů nebyla stanovena.
Geriatrické použití
celkového počtu subjektů zahrnutých do PLESS bylo 1480 a 105 subjektů 65 a více a 75 a více, v tomto pořadí. Mezi těmito subjekty a mladšími subjekty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti a jiné hlášené klinické zkušenosti neidentifikovaly rozdíly v odpovědích mezi staršími a mladšími pacienty. U starších osob není nutná žádná úprava dávkování [viz KLINICKÁ FARMAKOLOGIE a Klinické studie ].
Poškození jater
Při podávání PROSCARu u pacientů s abnormalitami jaterních funkcí je třeba postupovat opatrně, protože finasterid je extenzivně metabolizován v játrech [viz. KLINICKÁ FARMAKOLOGIE ].
Renální poškození
U pacientů s poruchou funkce ledvin není nutná žádná úprava dávkování (viz KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
Pacienti dostávali jednotlivé dávky přípravku PROSCAR 5 mg až 400 mg a opakované dávky přípravku PROSCAR 5 mg až 80 mg/den po dobu tří měsíců bez nežádoucích účinků. Dokud nebudou získány další zkušenosti, nelze doporučit žádnou specifickou léčbu předávkování přípravkem PROSCAR.
Významná letalita byla pozorována u myších samců a samic při jednorázových perorálních dávkách 1500 mg/m2 (500 mg/kg) a u samic a samců potkanů při jednorázových perorálních dávkách 2360 mg/m2 (400 mg/kg) a 5900 mg/m2Â (1000 mg/kg).
KONTRAINDIKACE
PROSCAR je kontraindikován v následujících případech:
- Přecitlivělost na kteroukoli složku tohoto léku.
- Těhotenství. Užívání finasteridu je kontraindikováno u žen, pokud jsou nebo mohou být těhotné. Vzhledem ke schopnosti inhibitorů 5α-reduktázy typu II inhibovat přeměnu testosteronu na 5α-dihydrotestosteron (DHT), může finasterid způsobit abnormality vnějších genitálií plodu mužského pohlaví těhotné ženy, která dostává finasterid. Pokud je tento lék užíván během těhotenství nebo pokud během užívání tohoto léku dojde k otěhotnění, těhotná žena by měla být informována o potenciálním riziku pro mužský plod. [Viz také VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ,A Použití u konkrétních populací , a JAK DODÁVÁNO .] U samic potkanů vyvolaly nízké dávky finasteridu podávané během březosti abnormality vnějších genitálií u samčích potomků.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Vývoj a zvětšení prostaty je závislé na silném androgenu, 5α-dihydrotestosteronu (DHT). 5α-reduktáza typu II metabolizuje testosteron na DHT v prostatě, játrech a kůži. DHT indukuje androgenní účinky vazbou na androgenní receptory v buněčných jádrech těchto orgánů.
Finasterid je kompetitivní a specifický inhibitor 5α-reduktázy typu II, se kterým pomalu tvoří stabilní enzymový komplex. Obrat z tohoto komplexu je extrémně pomalý (t½ ∼ 30 dní). To bylo prokázáno jak in vivo, tak in vitro. Finasterid nemá žádnou afinitu k androgennímu receptoru. U člověka jsou po podání finasteridu sníženy 5α-redukované steroidní metabolity v krvi a moči.
Farmakodynamika
člověka jediná 5mg perorální dávka přípravku PROSCAR způsobí rychlé snížení koncentrace DHT v séru s maximálním účinkem pozorovaným 8 hodin po první dávce. Potlačení DHT je udržováno během 24hodinového dávkovacího intervalu a při pokračující léčbě. Bylo prokázáno, že denní dávkování přípravku PROSCAR v dávce 5 mg/den po dobu až 4 let snižuje koncentraci DHT v séru přibližně o 70 %. Střední hladina cirkulujícího testosteronu se zvýšila přibližně o 10-20 %, ale zůstala ve fyziologickém rozmezí. V samostatné studii u zdravých mužů léčených finasteridem 1 mg denně (n=82) nebo placebem (n=69) byly průměrné cirkulující hladiny testosteronu a estradiolu zvýšeny přibližně o 15 % ve srovnání s výchozí hodnotou, ale zůstaly v mezích fyziologický rozsah.
pacientů užívajících PROSCAR 5 mg/den bylo pozorováno asi 10% zvýšení luteinizačního hormonu (LH) a folikuly stimulujícího hormonu (FSH), ale hladiny zůstaly v normálním rozmezí. U zdravých dobrovolníků léčba přípravkem PROSCAR 5 mg nezměnila odpověď LH a FSH na hormon uvolňující gonadotropin, což naznačuje, že osa hypotalamus-hypofýza-varlata nebyla ovlivněna.
U pacientů s BPH nemá PROSCAR žádný vliv na cirkulující hladiny kortizolu, prolaktinu, hormonu stimulujícího štítnou žlázu nebo tyroxinu. Nebyl pozorován žádný klinicky významný účinek na profil lipidů v plazmě (tj. celkový cholesterol, lipoproteiny s nízkou hustotou, lipoproteiny s vysokou hustotou a triglyceridy) nebo minerální hustotu kostí.
Dospělí muži s geneticky zděděným nedostatkem 5α-reduktázy typu II mají také snížené hladiny DHT. Kromě souvisejících urogenitálních defektů přítomných při narození nebyly u těchto jedinců pozorovány žádné další klinické abnormality související s deficitem 5α-reduktázy typu II. Tito jedinci mají po celý život malou prostatu a nevyvine se u nich BPH.
U pacientů s BPH léčených finasteridem (1-100 mg/den) po dobu 7-10 dní před prostatektomií byl naměřen přibližně o 80 % nižší obsah DHT v prostatické tkáni odstraněné při operaci ve srovnání s placebem; koncentrace testosteronu v tkáni byla zvýšena až 10krát nad hladiny před léčbou ve srovnání s placebem. Snížil se také intraprostatický obsah PSA.
zdravých dobrovolníků mužského pohlaví léčených přípravkem PROSCAR 5 mg po dobu 14 dnů vedlo přerušení léčby k návratu hladin DHT na úroveň před léčbou přibližně za 2 týdny. U pacientů léčených po dobu tří měsíců se objem prostaty, který poklesl přibližně o 20 %, vrátil přibližně po třech měsících po přerušení léčby k výchozí hodnotě.
Farmakokinetika
Vstřebávání
Ve studii s 15 zdravými mladými subjekty byla průměrná biologická dostupnost 5mg tablet finasteridu 63 % (rozmezí 34–108 %), na základě poměru plochy pod křivkou (AUC) vzhledem k intravenózní (IV) referenční dávce . Maximální plazmatická koncentrace finasteridu byla v průměru 37 ng/ml (rozmezí 27-49 ng/ml) a bylo jí dosaženo 1-2 hodiny po podání dávky. Biologická dostupnost finasteridu nebyla potravou ovlivněna.
Rozdělení
Průměrný distribuční objem v ustáleném stavu byl 76 litrů (rozmezí 44-96 litrů). Přibližně 90 % cirkulujícího finasteridu se váže na plazmatické proteiny. Po opakovaných dávkách nastává fáze pomalé akumulace finasteridu. Po podávání 5 mg/den finasteridu po dobu 17 dnů byly plazmatické koncentrace finasteridu o 47 a 54 % vyšší než po první dávce u mužů ve věku 45–60 let (n=12) a ≥70 let (n=12). , resp. Průměrné minimální koncentrace po 17 dnech podávání byly 6,2 ng/ml (rozmezí 2,49,8 ng/ml) a 8,1 ng/ml (rozmezí 1,8-19,7 ng/ml) v obou věkových skupinách. Přestože v této studii nebylo dosaženo ustáleného stavu, průměrná minimální plazmatická koncentrace v jiné studii u pacientů s BPH (průměrný věk, 65 let) užívajících 5 mg/den byla 9,4 ng/ml (rozmezí 7,1-13,3 ng/ml; n= 22) po více než roce podávání.
Bylo prokázáno, že finasterid prochází hematoencefalickou bariérou, ale nezdá se, že by se distribuoval přednostně do CSF.
Ve 2 studiích se zdravými jedinci (n=69), kteří dostávali PROSCAR 5 mg/den po dobu 6-24 týdnů, se koncentrace finasteridu ve spermatu pohybovaly od nedetekovatelných ( Použití u konkrétních populací ].
Metabolismus
Finasterid je rozsáhle metabolizován v játrech, primárně prostřednictvím podrodiny enzymů cytochromu P450 3A4. Byly identifikovány dva metabolity, monohydroxylovaný t-butylový postranní řetězec a metabolity monokarboxylové kyseliny, které nevykazují více než 20 % inhibiční aktivity finasteridu na 5α-reduktázu.
Vylučování
U zdravých mladých jedinců (n=15) byla průměrná plazmatická clearance finasteridu 165 ml/min (rozmezí 70279 ml/min) a průměrný poločas eliminace v plazmě 6 hodin (rozmezí 3-16 hodin). Po perorální dávce 14C-finasteridu u člověka (n=6) bylo průměrně 39 % (rozmezí 32-46 %) dávky vyloučeno močí ve formě metabolitů; 57 % (rozmezí 51-64 %) bylo vyloučeno stolicí.
Průměrný terminální poločas finasteridu u subjektů ve věku ≥ 70 let byl přibližně 8 hodin (rozmezí 6–15 hodin; n=12), ve srovnání s 6 hodinami (rozmezí 4–12 hodin; n=12) u subjektů 45-60 let věku. V důsledku toho byla průměrná AUC(0-24 hod) po 17 dnech podávání o 15 % vyšší u subjektů ve věku ≥70 let než u subjektů ve věku 45-60 let (p=0,02).
Pediatrická
Farmakokinetika finasteridu nebyla u pacientů mladších 18 let zkoumána.
Finasterid není indikován k použití u pediatrických pacientů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ,A Použití u konkrétních populací ].
Rod
Finasterid není indikován k použití u žen [viz KONTRAINDIKACE ,A VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ,A Použití u konkrétních populací , a JAK DODÁVÁNO ].
Geriatrický
U starších pacientů není nutná žádná úprava dávkování. Přestože je rychlost eliminace finasteridu u starších pacientů snížena, tyto nálezy nemají klinický význam. [Vidět Farmakokinetika a Použití u konkrétních populací .]
Závod
Vliv rasy na farmakokinetiku finasteridu nebyl studován.
Poškození jater
Vliv poruchy funkce jater na farmakokinetiku finasteridu nebyl studován. Opatrnosti je třeba při podávání přípravku PROSCAR 5 mg pacientům s abnormalitami jaterních funkcí, protože finasterid je extenzivně metabolizován v játrech. Renální poškození
pacientů s poruchou funkce ledvin není nutná žádná úprava dávkování. U pacientů s chronickým poškozením ledvin s clearance kreatininu v rozmezí od 9,0 do 55 ml/min byly AUC, maximální plazmatická koncentrace, poločas a vazba na proteiny po jednorázové dávce 14C-finasteridu podobné hodnotám získaným u zdravých dobrovolníků. U pacientů s poruchou funkce ledvin bylo sníženo vylučování metabolitů močí. Tento pokles byl spojen se zvýšením exkrece metabolitů stolicí. Plazmatické koncentrace metabolitů byly významně vyšší u pacientů s poruchou funkce ledvin (na základě 60% zvýšení AUC celkové radioaktivity). Nicméně finasterid byl dobře tolerován u pacientů s BPH s normální funkcí ledvin, kteří dostávali až 80 mg/den po dobu 12 týdnů, kde by expozice těchto pacientů metabolitům byla pravděpodobně mnohem vyšší.
Klinické studie
Monoterapie
PROSCAR 5 mg/den byl zpočátku hodnocen u pacientů se symptomy BPH a zvětšenou prostatou digitálním rektálním vyšetřením ve dvou 1letých, placebem kontrolovaných, randomizovaných, dvojitě zaslepených studiích a jejich 5letých otevřených rozšířeních.
PROSCAR 5 mg byl dále hodnocen v PROSCAR Long-Term Efficacy and Safety Study (PLESS), dvojitě zaslepené, randomizované, placebem kontrolované, 4leté, multicentrické studii. Do studie bylo randomizováno 3040 pacientů ve věku 45 až 78 let se středně závažnými až závažnými příznaky BPH a zvětšenou prostatou při digitálním rektálním vyšetření (1524 na finasterid, 1516 na placebo) a 3016 pacientů bylo hodnoceno z hlediska účinnosti. Čtyřletou studii dokončilo 1883 pacientů (1000 ve skupině s finasteridem, 883 ve skupině s placebem).
Vliv na skóre příznaků
Symptomy byly kvantifikovány pomocí skóre podobného skóre Americké urologické asociace Symptom Score, které hodnotilo jak obstrukční symptomy (zhoršení velikosti a síly proudu, pocit neúplného vyprázdnění močového měchýře, opožděné nebo přerušované močení), tak iritační symptomy (nykturie, denní frekvence, potřeba napínat nebo tlačit proud moči) hodnocením na stupnici od 0 do 5 pro šest symptomů a na stupnici od 0 do 4 pro jeden symptom, takže celkové možné skóre je 34.
Pacienti v PLESS měli na začátku středně těžké až těžké symptomy (průměr přibližně 15 bodů na 0-34 bodové škále). Pacienti randomizovaní k léčbě PROSCAR, kteří zůstali na terapii po dobu 4 let, měli průměrné (± 1 SD) snížení skóre symptomů o 3,3 (± 5,8) bodů ve srovnání s 1,3 (± 5,6) body ve skupině s placebem. (Viz obrázek 1.) Statisticky významné zlepšení skóre symptomů bylo evidentní po 1 roce u pacientů léčených PROSCARem vs.
Obrázek 1 Skóre příznaků v PLESS
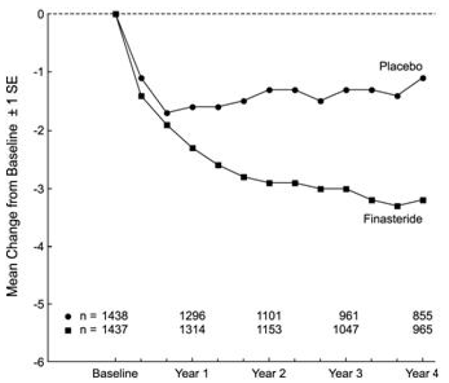
Výsledky pozorované v dřívějších studiích byly srovnatelné s výsledky pozorovanými v PLESS. Ačkoli u některých pacientů bylo pozorováno brzké zlepšení močových symptomů, bylo obecně nutné provést terapeutickou studii v délce alespoň 6 měsíců, aby bylo možné posoudit, zda bylo dosaženo příznivé odpovědi na zmírnění symptomů. Zlepšení symptomů BPH bylo pozorováno během prvního roku a přetrvávalo během dalších 5 let otevřených prodloužených studií.
Vliv na akutní zadržování moči a potřebu chirurgického zákroku
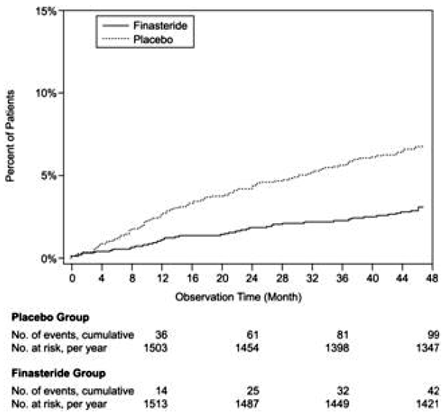
PLESS byla účinnost hodnocena také hodnocením selhání léčby. Selhání léčby bylo prospektivně definováno jako urologické příhody související s BPH nebo klinické zhoršení, nedostatek zlepšení a/nebo potřeba alternativní terapie. Urologické příhody související s BPH byly definovány jako urologická chirurgická intervence a akutní retence moči vyžadující katetrizaci. Kompletní informace o události byly k dispozici u 92 % pacientů. Následující tabulka (Tabulka 5) shrnuje výsledky.
Ve srovnání s placebem byl PROSCAR spojen s významně nižším rizikem akutní retence moči nebo nutnosti chirurgického zákroku souvisejícího s BPH [13,2 % u placeba oproti 6,6 % u PROSCARu; 51% snížení rizika, 95% CI: (34 až 63 %)]. Ve srovnání s placebem byl přípravek PROSCAR 5 mg spojen s významně nižším rizikem chirurgického zákroku [10,1 % u placeba oproti 4,6 % u přípravku PROSCAR; 55% snížení rizika, 95% CI: (37 až 68 %)] a s významně nižším rizikem akutní retence moči [6,6 % u placeba vs 2,8 % u PROSCAR; 57% snížení rizika, 95% CI: (34 až 72 %)]; viz obrázky 2 a 3.
Obrázek 2 Procento pacientů po operaci BPH, včetně TURP
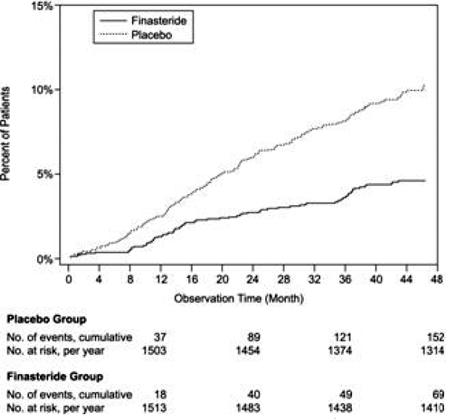
Obrázek 3 Procento pacientů s rozvojem akutní retence moči (spontánní a vysrážené)
Vliv na maximální průtok moči
pacientů v PLESS, kteří zůstali na terapii po dobu trvání studie a měli hodnotitelné údaje o průtoku moči, zvýšil PROSCAR 5 mg maximální průtok moči o 1,9 ml/s ve srovnání s 0,2 ml/s ve skupině s placebem.
Mezi léčebnými skupinami byl jasný rozdíl v maximální rychlosti průtoku moči ve prospěch PROSCAR 5 mg do 4. měsíce (1,0 vs 0,3 ml/s), který byl zachován po celou dobu studie. V dřívějších jednoletých studiích bylo zvýšení maximální rychlosti průtoku moči srovnatelné s PLESS a udrželo se během prvního roku a během dalších 5 let otevřených prodloužených studií.
Vliv na objem prostaty
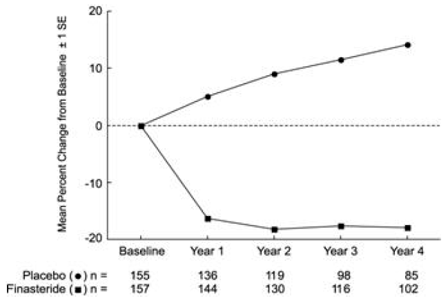
PLESS byl u podskupiny pacientů každoročně hodnocen objem prostaty zobrazením magnetickou rezonancí (MRI). U pacientů léčených přípravkem PROSCAR 5 mg, kteří zůstali na terapii, byl objem prostaty snížen ve srovnání s výchozí hodnotou i s placebem v průběhu 4leté studie. PROSCAR snížil objem prostaty o 17,9 % (z výchozích 55,9 cm3 na 45,8 cm3 po 4 letech) ve srovnání se zvýšením o 14,1 % (z 51,3 cm3 na 58,5 cm3) ve skupině s placebem (p
Výsledky pozorované v dřívějších studiích byly srovnatelné s výsledky pozorovanými v PLESS. Průměrný objem prostaty na začátku se pohyboval mezi 40-50 ccm. Snížení objemu prostaty bylo pozorováno během prvního roku a udrželo se během dalších pěti let otevřených prodloužených studií.
Obrázek 4 Objem prostaty v PLESS
Objem prostaty jako prediktor terapeutické odpovědi
Metaanalýza kombinující jednoletá data ze sedmi dvojitě zaslepených, placebem kontrolovaných studií podobného designu, zahrnujících 4 491 pacientů se symptomatickou BPH, prokázala, že u pacientů léčených přípravkem PROSCAR se velikost symptomové odpovědi a stupeň zlepšení v maximální rychlost průtoku moči byla vyšší u pacientů se zvětšenou prostatou na začátku studie.
Kombinace s terapií alfa-blokátorem
Studie Medical Therapy of Prostatic Symptoms (MTOPS) byla dvojitě zaslepená, randomizovaná, placebem kontrolovaná, multicentrická, 4 až 6letá studie (v průměru 5 let) u 3047 mužů se symptomatickou BPH, kteří byli randomizováni k léčbě PROSCAR 5 mg/den (n=768), doxazosin 4 nebo 8 mg/den (n=756), kombinace přípravku PROSCAR 5 mg/den a doxazosinu 4 nebo 8 mg/den (n=786), nebo placebo (n=737 ). Všichni účastníci podstupovali týdenní titraci doxazosinu (nebo jeho placeba) od 1 do 2 až 4 až 8 mg/den. Pouze ti, kteří tolerovali dávku 4 nebo 8 mg, byli ve studii ponecháni na doxazosinu (nebo jeho placebu). Konečná tolerovaná dávka účastníka (buď 4 mg nebo 8 mg) byla podávána na konci 4. týdne. Konečná dávka doxazosinu byla podávána jednou denně před spaním.
Průměrný věk pacientů v době randomizace byl 62,6 let (±7,3 let). Pacienti byli běloši (82 %), Afroameričané (9 %), Hispánci (7 %), Asiaté (1 %) nebo původní Američané (
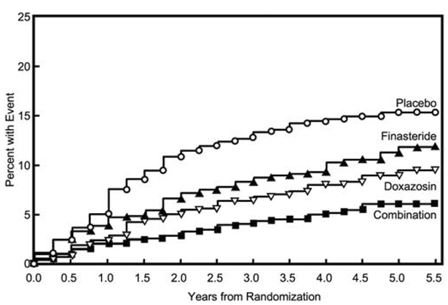
Primárním cílovým parametrem bylo složené měření prvního výskytu kteréhokoli z následujících pěti výsledků: ≥4 body potvrzené zvýšení skóre symptomů oproti výchozí hodnotě, akutní retence moči, renální insuficience související s BPH (zvýšení kreatininu), rekurentní infekce močových cest nebo urosepse nebo inkontinence. Ve srovnání s placebem vedla léčba přípravkem PROSCAR 5 mg, doxazosinem nebo kombinovanou terapií ke snížení rizika výskytu jedné z těchto pěti výsledných příhod o 34 % (p=0,002), 39 % (p
většiny příhod (274 z 351; 78 %) bylo potvrzené zvýšení skóre příznaků o ≥ 4 body, označované jako progrese skóre příznaků. Riziko progrese skóre příznaků se snížilo o 30 % (p=0,016), 46 % (p
Obrázek 5 Kumulativní výskyt 4bodového vzestupu skóre symptomů AUA podle léčebné skupiny
Léčba přípravkem PROSCAR 5 mg, doxazosinem nebo kombinací přípravku PROSCAR s doxazosinem snížila průměrné skóre příznaků oproti výchozí hodnotě ve 4. roce. Tabulka 7 uvádí průměrnou změnu skóre příznaků AUA oproti výchozí hodnotě podle léčebné skupiny u pacientů, kteří zůstali na terapii čtyři roky.
Výsledky MTOPS jsou v souladu se zjištěními 4leté placebem kontrolované studie PLESS [viz. Monoterapie ] v tom, že léčba přípravkem PROSCAR snižuje riziko akutní retence moči a potřebu operace související s BPH. U MTOPS bylo riziko rozvoje akutní retence moči sníženo o 67 % u pacientů léčených přípravkem PROSCAR ve srovnání s pacienty léčenými placebem (0,8 % u přípravku PROSCAR a 2,4 % u placeba). Také riziko potřeby invazivní terapie související s BPH bylo sníženo o 64 % u pacientů léčených přípravkem PROSCAR ve srovnání s pacienty léčenými placebem (2,0 % u přípravku PROSCAR 5 mg a 5,4 % u placeba).
Souhrn klinických studií
Údaje z těchto studií, které ukazují zlepšení symptomů souvisejících s BPH, snížení selhání léčby (urologické příhody související s BPH), zvýšení maximálního průtoku moči a snížení objemu prostaty naznačují, že PROSCAR zastavuje proces onemocnění BPH u mužů s zvětšená prostata.
INFORMACE PRO PACIENTA
Nebyly poskytnuty žádné informace. Podívejte se prosím na VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ sekce.
