Léčba astmatu: Combivent 50/20mcg Levosalbutamol Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Combivent® (ipratropium bromid a albuterol sulfát) Inhalační aerosol
Bronchodilatační aerosol pouze pro orální inhalaci
POPIS
COMBIVENT Inhalační aerosol je kombinací ipratropium bromidu (jako monohydrát) a albuterol sulfátu.
Ipratropium bromid je anticholinergní bronchodilatátor chemicky popsaný jako 8-azoniabicyklo[3.2.1] oktan, 3-(3-hydroxy-1-oxo-2-fenylpropoxy)-8-methyl8-(1-methylethyl)-, bromid monohydrát, ( 3-endo, 8-syn)-: syntetická kvartérní amoniová sloučenina chemicky příbuzná atropinu. Ipratropium bromid je bílá až téměř bílá krystalická látka, volně rozpustná ve vodě a methanolu, těžce rozpustná v ethanolu a nerozpustná v lipofilních rozpouštědlech, jako je ether, chloroform a fluorované uhlovodíky.
Strukturní vzorec je:
 C20H30BrNO3•H2O ipratropium bromid Mol. Hmot. 430,4
C20H30BrNO3•H2O ipratropium bromid Mol. Hmot. 430,4
Albuterol sulfát, chemicky známý jako (1,3-benzendimethanol, α'-[[(1,1dimethylethyl)amino]methyl]-4-hydroxy, sulfát (2:1) (sůl), (±)- je relativně selektivní beta2-adrenergní bronchodilatátor. Albuterol je oficiální generický název ve Spojených státech. Světovou zdravotnickou organizací doporučený název léku je salbutamol. Albuterol sulfát je bílý až téměř bílý krystalický prášek, volně rozpustný ve vodě a mírně rozpustný v alkoholu, chloroform a ether. Strukturní vzorec je:
 (C13H21NO3)2•H2SO4 albuterolsulfát Mol. Hmot. 576,7
(C13H21NO3)2•H2SO4 albuterolsulfát Mol. Hmot. 576,7
Combivent® (ipratropium bromid a albuterol sulfát) inhalační aerosol obsahuje mikrokrystalickou suspenzi ipratropium bromidu a albuterol sulfátu v tlakové aerosolové jednotce s odměřenou dávkou pro perorální inhalační podání. Inhalační jednotka 200 má čistou hmotnost 14,7 gramů. Každá aktivace odměří 21 mcg ipratropium bromidu a 120 mcg albuterol sulfátu z ventilu a dodává 18 mcg ipratropium bromidu a 103 mcg albuterol sulfátu (ekvivalent 90 mcg albuterolové báze) z náustku. Pomocnými látkami jsou dichlordifluormethan, dichlortetrafluorethan a trichlormonofluormethan jako hnací látky a sójový lecitin.
INDIKACE
COMBIVENT Inhalační aerosol je indikován k použití u pacientů s chronickou obstrukční plicní nemocí (CHOPN) s běžným aerosolovým bronchodilatátorem, u kterých jsou nadále známky bronchospasmu a kteří potřebují druhý bronchodilatátor.
DÁVKOVÁNÍ A PODÁVÁNÍ
Dávka COMBIVENT® inhalačního aerosolu jsou dvě inhalace čtyřikrát denně. Pacienti mohou podle potřeby užívat další inhalace; celkový počet inhalací by však neměl překročit 12 za 24 hodin. Bezpečnost a účinnost dalších dávek COMBIVENT inhalačního aerosolu delších než 12 vdechů/24 hodin nebyla studována. Rovněž bezpečnost a účinnost dalších dávek ipratropia nebo albuterolu k doporučeným dávkám inhalačního aerosolu Combivent® (ipratropium bromid a albuterol sulfát) nebyla studována. Před prvním použitím a v případech, kdy aerosol nebyl používán déle než 24 hodin, se doporučuje třikrát „vyzkoušet“ sprej. Vyvarujte se vstříknutí do očí.
JAK DODÁVÁNO
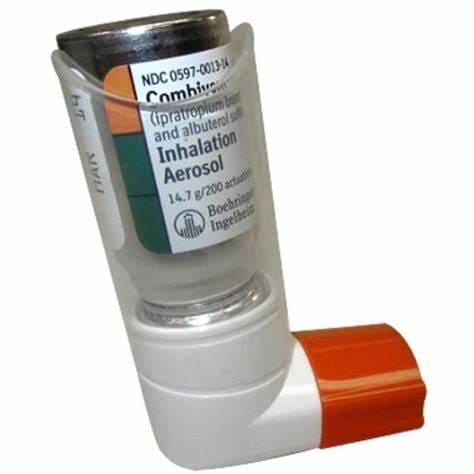
COMBIVENT Inhalační aerosol je dodáván jako inhalátor s odměřenými dávkami s bílým náustkem, který má čirý bezbarvý návlek a oranžový ochranný uzávěr. Kanystr COMBIVENT 20 mcg inhalačního aerosolu se má používat pouze s náustkem COMBIVENT 20 mcg inhalačního aerosolu a nikoli s jinými náustky. Tento náustek by se neměl používat s jinými aerosolovými léky. Každá aktivace odměří 21 mcg ipratropium bromidu a 120 mcg albuterol sulfátu z ventilu a dodává 18 mcg ipratropium bromidu a 103 mcg albuterol sulfátu (ekvivalent 90 mcg albuterolové báze) z náustku.
Každý 14,7 gramový kanystr poskytuje dostatek léku na 200 aktivací ( NDC 0597-001314).
Varování: Kanystr by měl být zlikvidován po použití označeného počtu aktivací. Po tomto okamžiku nelze zajistit správné množství léku při každém spuštění, i když nádobka není zcela prázdná.
Skladujte při teplotě 25 °C (77 °F); povoleny výlety do 15°-30°C (59°-86°F) [vidět USP řízená pokojová teplota ]. Pro dosažení nejlepších výsledků skladujte nádobku před použitím při pokojové teplotě. Vyvarujte se nadměrné vlhkosti. Před použitím nádobku alespoň 10 sekund silně protřepejte.
Lékařské dotazy směřujte na: http://us.boehringer-ingelheim.com, (800) 542-6257 nebo (800) 459-9906 TTY.
Poznámka: Níže uvedené odsazené prohlášení je vyžadováno federálním vládním zákonem o čistém ovzduší pro všechny produkty obsahující nebo vyrobené s chlorfluoruhlovodíky (CFC):
Varování: Obsahuje trichlormonofluormethan (CFC-11), dichlordifluormethan (CFC-12) a dichlortetrafluorethan (CFC-114), látky, které poškozují veřejné zdraví a životní prostředí ničením ozónu v horních vrstvách atmosféry.
Oznámení podobné výše uvedenému Varování byl zařazen do informací pro pacienta o tomto produktu podle předpisů Agentury pro ochranu životního prostředí (EPA). Varování pacienta uvádí, že pacient by se měl poradit se svým lékařem, pokud má nějaké dotazy ohledně alternativ.
Obsah pod tlakem: Nepropichujte. Nepoužívejte ani neskladujte v blízkosti tepla nebo otevřeného ohně. Vystavení teplotám nad 120 °F může způsobit prasknutí. Nikdy nevhazujte inhalátor do ohně nebo spalovny.
Distribuce: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 USA. Ipratropium bromid v licenci: Boehringer Ingelheim International GmbH. Revize: srpen 2012
VEDLEJŠÍ EFEKTY
Informace o nežádoucích účincích týkající se inhalačního aerosolu Combivent® (ipratropium bromid a albuterol sulfát) jsou odvozeny ze dvou 12týdenních kontrolovaných klinických studií (N=358 pro COMBIVENT inhalační aerosol), jak je vidět v tabulce 1.
Mezi další nežádoucí účinky hlášené u méně než dvou procent pacientů ve skupině léčené COMBIVENT Inhalačním aerosolem patří edém, únava, hypertenze, závratě, nervozita, parestézie, třes, dysfonie, nespavost, průjem, sucho v ústech, dyspepsie, zvracení, arytmie, palpitace, tachykardie, artralgie, angina pectoris, zvýšené sputum, perverze chuti a infekce/dysurie močových cest.
Reakce alergického typu, jako jsou kožní reakce včetně vyrážky, svědění a kopřivky (včetně obří kopřivky), angioedém včetně jazyka, rtů a obličeje, laryngospasmus a anafylaktická reakce byly hlášeny u Combivent® (ipratropium bromid a albuterol sulfát) Inhalační aerosol , v některých případech s pozitivním znovuobnovením. Mnoho z těchto pacientů mělo v anamnéze alergie na jiné léky a/nebo potraviny včetně sóji (viz KONTRAINDIKACE ).
Postmarketingové zkušenosti
5leté placebem kontrolované studii došlo k hospitalizacím pro supraventrikulární tachykardii a/nebo fibrilaci síní s incidencí 0,5 % u pacientů s CHOPN, kteří dostávali Atrovent® (ipratropium bromid) inhalační aerosol CFC.
Další nežádoucí účinky zjištěné z publikované literatury a/nebo postmarketingového sledování při užívání přípravků obsahujících ipratropium-bromid (samostatně nebo v kombinaci s albuterolem) zahrnují: přecitlivělost, edém hltanu, edém úst, retenci moči, mydriázu, bronchospasmus ( včetně paradoxního bronchospasmu), případy precipitace nebo zhoršení glaukomu s úzkým úhlem, glaukom, zvýšený nitrooční tlak, akutní bolest oka, halo vidění, rozmazané vidění, porucha akomodace, podráždění oka, edém rohovky, překrvení spojivek, ucpaný nos, vysychání sekretů , slizniční vředy, stomatitida, podráždění aerosolem, podráždění krku, sucho v krku, sípání, exacerbace příznaků CHOPN, chrapot, bušení srdce, pálení žáhy, ospalost, stimulace CNS, potíže s koordinací, návaly horka, alopecie, hypotenze, edém, gastrointestinální potíže (průjem, nevolnost, zvracení), porucha gastrointestinální motility, zácpa, hypokalémie, duševní porucha, hyperhidróza, svalové křeče, svalová slabost, myalgie, astenie, ischemie myokardu, snížený diastolický krevní tlak a zvýšený systolický krevní tlak.
Při užívání přípravků obsahujících albuterol byla hlášena metabolická acidóza.
DROGOVÉ INTERAKCE
COMBIVENT Inhalační aerosol byl používán současně s jinými léky, včetně sympatomimetických bronchodilatátorů, methylxanthinů a perorálních a inhalačních steroidů, běžně používaných při léčbě chronické obstrukční plicní nemoci. S výjimkou albuterolu neexistují žádné formální studie plně hodnotící interakční účinky COMBIVENT inhalačního aerosolu a těchto léků s ohledem na bezpečnost a účinnost.
Anticholinergní látky
Existuje možnost aditivní interakce se současně užívanými anticholinergními léky. Vyhněte se proto současnému podávání přípravku COMBIVENT 50 mg inhalační aerosol s jinými léky obsahujícími anticholinergika.
Beta-adrenergní látky
Při současném podávání COMBIVENT Inhalation Aerosol a dalších sympatomimetik se doporučuje opatrnost kvůli zvýšenému riziku nežádoucích kardiovaskulárních účinků.
Látky blokující beta-receptory a albuterol vzájemně inhibují účinek. U pacientů s hyperreaktivními dýchacími cestami by měly být beta-blokátory používány s opatrností.
Diuretika
Změny EKG a/nebo hypokalémie, které mohou být důsledkem podávání draslík nešetřících diuretik (jako jsou kličková nebo thiazidová diuretika), mohou být beta-agonisty akutně zhoršeny, zvláště když je překročena doporučená dávka beta-agonistů. Přestože klinický význam těchto účinků není znám, doporučuje se opatrnost při současném podávání léků obsahujících beta-agonisty, jako je COMBIVENT Inhalační aerosol, s diuretiky nešetřícími draslík. Zvažte sledování hladin draslíku.
Inhibitory monoaminooxidázy nebo tricyklická antidepresiva
COMBIVENT Inhalační aerosol by měl být podáván s extrémní opatrností pacientům léčeným inhibitory monoaminooxidázy nebo tricyklickými antidepresivy nebo do dvou týdnů po vysazení těchto látek, protože účinek albuterolu na kardiovaskulární systém může být zesílen. Zvažte alternativní léčbu u pacientů užívajících MAO nebo tricyklická antidepresiva.
VAROVÁNÍ
OPATŘENÍ
Všeobecné
Informace pro pacienty
Pacienty je třeba upozornit, aby si nestříkali aerosol do očí, a upozornit je, že to může vést k vysrážení nebo zhoršení glaukomu s úzkým úhlem, mydriázy, zvýšeného nitroočního tlaku, akutní bolesti nebo diskomfortu oka, dočasného rozmazaného vidění, vizuálních halo nebo barevných obrazy ve spojení s červenými očima z kongesce spojivky a rohovky. Pacienti by měli být také upozorněni, že pokud se u nich objeví jakákoli kombinace těchto příznaků, měli by se okamžitě poradit se svým lékařem.
Účinek COMBIVENT 20mcg inhalačního aerosolu by měl trvat 4 až 5 hodin nebo déle. COMBIVENT Inhalační aerosol by neměl být používán častěji, než je doporučeno. Bez porady s lékařem nezvyšujte dávku nebo frekvenci COMBIVENT inhalačního aerosolu. Pokud zjistíte, že léčba přípravkem COMBIVENT 20mcg inhalační aerosol je méně účinná pro úlevu od symptomů, vaše příznaky se zhorší a/nebo potřebujete přípravek používat častěji než obvykle, je třeba okamžitě vyhledat lékařskou pomoc. Zatímco užíváte COMBIVENT inhalační aerosol, ostatní inhalační léky by měly být užívány pouze podle pokynů svého lékaře. Pokud jste těhotná nebo kojíte, kontaktujte svého lékaře ohledně použití inhalačního aerosolu COMBIVENT. Vhodné použití přípravku Combivent® (ipratropium bromid a albuterol sulfát) Inhalační aerosol zahrnuje pochopení způsobu, jakým by měl být podáván (viz Návod k použití pro pacienta ).
Vzhledem k tomu, že se při užívání přípravku COMBIVENT 20 mcg mohou objevit závratě, poruchy akomodace, mydriáza a rozmazané vidění, pacienti by měli být upozorněni na aktivity vyžadující rovnováhu a ostrost vidění, jako je řízení auta nebo obsluha přístrojů nebo strojů.
Karcinogeneze, mutageneze, zhoršení plodnosti
Ipratropium bromid
Dvouleté studie karcinogenity při perorálním podávání na potkanech a myších neodhalily žádnou karcinogenní aktivitu při dávkách do 6 mg/kg. Tato dávka odpovídá u potkanů a myší přibližně 230násobku a 110násobku maximální doporučené denní inhalační dávky ipratropium-bromidu u dospělých na základě mg/m². Výsledky různých studií mutagenity (Amesův test, myší dominantní letální test, myší mikronukleový test a chromozomové aberace kostní dřeně u čínských křečků) byly negativní.
Fertilita samců nebo samic potkanů při perorálních dávkách až 50 mg/kg (přibližně 1900násobek maximální doporučené denní inhalační dávky u dospělých na základě mg/m²) nebyla podáním ipratropium-bromidu ovlivněna. Při perorální dávce 500 mg/kg (přibližně 19 000násobek maximální doporučené denní inhalační dávky u dospělých na bázi mg/m²) ipratropium-bromid způsobil pokles míry početí.
albuterol
Stejně jako ostatní látky ve své třídě způsobil albuterol v 2leté studii na potkanech při dietních dávkách 2, 10 a 50 mg/kg (přibližně 15 mg/kg) významné na dávce závislé zvýšení výskytu benigních leiomyomů mezovaria. 65 a 330násobek maximální doporučené denní inhalační dávky u dospělých na základě mg/m²). V jiné studii byl tento účinek blokován současným podáváním propranololu. Význam těchto zjištění pro člověka není znám. 18měsíční studie na myších s dietními dávkami až 500 mg/kg (přibližně 1600násobek maximální doporučené denní inhalační dávky u dospělých na základě mg/m²) a 99týdenní studie u křečků při perorálních dávkách až 50 mg /kg (přibližně 220násobek maximální doporučené denní inhalační dávky u dospělých na základě mg/m²) neodhalil žádný důkaz tumorigenicity. Studie s albuterolem neodhalily žádné známky mutageneze.
Reprodukční studie u potkanů s albuterol sulfátem neodhalily žádné známky poškození fertility.
Těhotenství
COMBIVENT Inhalační aerosol
Teratogenní účinky: Těhotenství kategorie C
Neexistují žádné adekvátní a dobře kontrolované studie Combivent® (ipratropium bromid a albuterol sulfát) inhalační aerosol, ipratropium bromid nebo albuterol sulfát u těhotných žen. Reprodukční studie na zvířatech nebyly s COMBIVENT inhalačním aerosolem provedeny. Ukázalo se však, že albuterol sulfát je teratogenní u myší a králíků. COMBIVENT Inhalační aerosol by měl být používán během těhotenství pouze tehdy, pokud potenciální přínos ospravedlňuje potenciální riziko pro plod.
Ipratropium bromid
Teratogenní účinky
Perorální reprodukční studie byly provedeny v dávkách 10 mg/kg u myší, 1000 mg/kg u potkanů a 125 mg/kg u králíků. Tyto dávky odpovídají u každého druhu přibližně 190, 38 000 a 9 400násobku maximální doporučené denní inhalační dávky u dospělých na základě mg/m². Inhalační reprodukční studie byly provedeny na potkanech a králících v dávkách 1,5 a 1,8 mg/kg (přibližně 55 a 140násobek maximální doporučené denní inhalační dávky u dospělých na základě mg/m²). Tyto studie neprokázaly žádný důkaz teratogenních účinků v důsledku ipratropium-bromidu. Při perorálních dávkách 90 mg/kg a vyšších u potkanů (přibližně 3 400násobek maximální doporučené denní inhalační dávky u dospělých na bázi mg/m²) byla pozorována embryotoxicita jako zvýšená resorpce. Tento účinek se nepovažuje za relevantní pro použití u lidí kvůli vysokým dávkám, při kterých byl pozorován, a rozdílu ve způsobu podání.
albuterol
Teratogenní účinky
Bylo prokázáno, že albuterol je teratogenní u myší a králíků. Reprodukční studie u myší CD-1, kterým byl subkutánně podáván albuterol (0,025, 0,25 a 2,5 mg/kg), prokázala tvorbu rozštěpu patra u 5 ze 111 (4,5 %) plodů při dávce 0,25 mg/kg (ekvivalent maximální doporučené denní inhalační dávky v dospělých na základě mg/m²) a u 10 ze 108 (9,3 %) plodů při dávce 2,5 mg/kg (přibližně 8násobek maximální doporučené denní inhalační dávky u dospělých na základě mg/m²). Žádný nebyl pozorován při dávce 0,025 mg/kg (méně než maximální doporučená denní inhalační dávka u dospělých). Rozštěp patra se také vyskytl u 22 ze 72 (30,5 %) plodů léčených 2,5 mg/kg isoproterenolu (pozitivní kontrola). Reprodukční studie s perorálním albuterolem u králíků Stride Dutch odhalila kranioschízu u 7 z 19 (37 %) plodů při dávce 50 mg/kg (přibližně 660násobek maximální doporučené denní inhalační dávky u dospělých na základě mg/m²).
Práce a dodávka
Vzhledem k možné interferenci beta-agonistů s kontraktilitou dělohy by mělo být použití inhalačního aerosolu Combivent® (ipratropium bromid a albuterol sulfát) k léčbě CHOPN během porodu omezeno na pacientky, u kterých přínosy jasně převažují nad rizikem.
Kojící matky
Není známo, zda se složky COMBIVENT Inhalační aerosol vylučují do lidského mléka.
Ipratropium bromid
Vzhledem k tomu, že kvartérní kationty nerozpustné v tucích přecházejí do mateřského mléka, je třeba postupovat opatrně, když je COMBIVENT inhalační aerosol podáván kojící matce.
albuterol
Vzhledem k možnosti tumorigenicity prokázané u albuterolu ve studiích na zvířatech by se mělo rozhodnout, zda přerušit kojení nebo přerušit podávání léku, přičemž je třeba vzít v úvahu důležitost léku pro matku.
Pediatrické použití
Bezpečnost a účinnost u pediatrické populace nebyla stanovena.
PŘEDÁVKOVAT
Předpokládá se, že účinky předávkování budou primárně souviset s albuterol sulfátem. Akutní předávkování ipratropium-bromidem inhalací je nepravděpodobné, protože ipratropium-bromid není dobře systémově absorbován po aerosolovém nebo perorálním podání. Perorální střední letální dávky ipratropium-bromidu byly vyšší než 1001 mg/kg u myší (přibližně 19 000násobek maximální doporučené denní inhalační dávky u dospělých na základě mg/m²); 1663 mg/kg u potkanů (přibližně 62 000násobek maximální doporučené denní inhalační dávky u dospělých na základě mg/m²); a 400 mg/kg u psů (přibližně 50 000násobek maximální doporučené denní inhalační dávky u dospělých, na základě mg/m²). Zatímco perorální střední letální dávka albuterol sulfátu u myší a potkanů byla vyšší než 2 000 mg/kg (přibližně 6 600 a 13 000násobek maximální doporučené denní inhalační dávky u dospělých na bázi mg/m²), inhalační střední letální dávka se nepodařilo určit. Projevy předávkování albuterolem mohou zahrnovat anginózní bolest, hypertenzi, hypokalémii, tachykardii s frekvencí až 200 tepů za minutu, metabolickou acidózu a zvýraznění farmakologických účinků uvedených v NEŽÁDOUCÍCH ÚČINCÍCH. Stejně jako u všech sympatomimetických aerosolových léků může být srdeční zástava a dokonce smrt spojena se zneužíváním. Dialýza není vhodnou léčbou při předávkování albuterolem ve formě inhalačního aerosolu; může být indikováno uvážlivé použití kardiovaskulárního blokátoru beta-receptorů, jako je metoprolol tartrát.
KONTRAINDIKACE
COMBIVENT Inhalační aerosol je kontraindikován u pacientů s anamnézou přecitlivělosti na sójový lecitin nebo příbuzné potravinářské produkty, jako jsou sójové boby a arašídy. COMBIVENT Inhalační aerosol je také kontraindikován u pacientů přecitlivělých na jakoukoli jinou složku léčivého přípravku nebo na atropin nebo jeho deriváty.
KLINICKÁ FARMAKOLOGIE
COMBIVENT 50 mg inhalační aerosol je kombinací anticholinergního bronchodilatátoru, ipratropium bromidu, a beta2-adrenergního bronchodilatátoru, albuterol sulfátu.
Mechanismus působení
Ipratropium bromid
Ipratropium bromid je anticholinergní (parasympatolytikum) látka, která na základě studií na zvířatech zřejmě inhibuje vagově zprostředkované reflexy antagonizací účinku acetylcholinu, přenašeče uvolňovaného na neuromuskulárních spojeních v plicích. Anticholinergika zabraňují zvýšení intracelulární koncentrace Ca++, která je způsobena interakcí acetylcholinu s muskarinovými receptory na hladkém svalstvu průdušek.
Albuterol sulfát
Studie in vitro a farmakologické studie in vivo prokázaly, že albuterol má ve srovnání s isoproterenolem přednostní účinek na beta2-adrenergní receptory. I když se uznává, že beta2-adrenergní receptory jsou převládajícími receptory na hladkém svalstvu průdušek, nedávné údaje naznačují, že v lidském srdci existuje populace beta2-receptorů, která zahrnuje 10 % až 50 % srdečních beta-adrenergních receptorů. Přesná funkce těchto receptorů však ještě není stanovena (viz VAROVÁNÍ ).
Aktivace beta2-adrenergních receptorů na hladkém svalstvu dýchacích cest vede k aktivaci adenylylcyklázy a ke zvýšení intracelulární koncentrace cyklického-3',5'-adenosinmonofosfátu (cyklický AMP). Toto zvýšení cyklického AMP vede k aktivaci proteinkinázy A, která inhibuje fosforylaci myosinu a snižuje intracelulární koncentrace iontového vápníku, což vede k relaxaci. Albuterol uvolňuje hladké svaly všech dýchacích cest, od průdušnice až po terminální bronchioly. Albuterol působí jako funkční antagonista k uvolnění dýchacích cest bez ohledu na obsažený spasmogen, čímž chrání před všemi bronchokonstrikčními výzvami. Zvýšené koncentrace cyklického AMP jsou také spojeny s inhibicí uvolňování mediátorů z žírných buněk v dýchacích cestách.
Ve většině klinických studií bylo prokázáno, že albuterol má ve srovnatelných dávkách větší účinek na relaxaci hladkého svalstva průdušek než isoproterenol, přičemž má méně kardiovaskulárních účinků. Všechna beta-adrenergní léčiva, včetně albuterol sulfátu, však mohou u některých pacientů vyvolat významný kardiovaskulární účinek (viz OPATŘENÍ ).
COMBIVENT 20mcg inhalační aerosol
Očekává se, že Combivent® (ipratropium bromid a albuterol sulfát) inhalační aerosol maximalizuje odpověď na léčbu u pacientů s chronickou obstrukční plicní nemocí (CHOPN) snížením bronchospasmu prostřednictvím dvou výrazně odlišných mechanismů, anticholinergního (parasympatolytika) a sympatomimetika. Současné podávání jak anticholinergika (ipratropium bromid) tak beta2-sympatomimetika (albuterol sulfát) je navrženo tak, aby bylo pro pacienta přínosem tím, že má větší bronchodilatační účinek, než když se kterýkoli lék používá samostatně v doporučeném dávkování.
Farmakokinetika
Ipratropium bromid
Velká část podané dávky se spolkne, jak ukazují studie vylučování stolicí. Ipratropium bromid je kvartérní amin. Není snadno absorbován do systémového oběhu ani z povrchu plic, ani z gastrointestinálního traktu, jak potvrdily studie hladiny v krvi a renální exkrece. Plazmatické hladiny ipratropium bromidu byly pod limitem citlivosti testu 100 pg/ml.
Poločas eliminace je asi 2 hodiny po inhalaci nebo intravenózním podání. Ipratropium-bromid se minimálně (0 až 9 % in vitro) váže na plazmatický albumin a kyselý α1-glykoprotein. Je částečně metabolizován na neaktivní produkty hydrolýzy esterů. Po intravenózním podání se přibližně polovina dávky vyloučí v nezměněné podobě močí. Autoradiografické studie na potkanech ukázaly, že ipratropium-bromid neproniká hematoencefalickou bariérou.
Albuterol sulfát
Albuterol působí u většiny pacientů déle než isoproterenol, protože není substrátem pro procesy buněčného příjmu katecholaminů ani pro metabolismus katechol-O-methyltransferázou. Místo toho je lék konjugativně metabolizován na albuterol 4'-O-sulfát.
Ve farmakokinetické studii na 12 zdravých mužských dobrovolnících se dvěma inhalacemi albuterol sulfátu, dávkou 103 mcg/inhalací přes náustek, byly maximální plazmatické koncentrace albuterolu v rozmezí od 419 do 802 pg/ml (průměr 599 ± 122 pg/ml) získány během tří hodiny po administraci. Po tomto jednorázovém podání bylo 30,8 ± 10,2 % odhadované dávky z náustku vyloučeno v nezměněné podobě 24hodinovou močí. Vzhledem k tomu, že albuterol sulfát je rychle a úplně absorbován, tato studie nedokázala rozlišit mezi plicní a gastrointestinální absorpcí.
Intravenózní farmakokinetika albuterolu byla studována na srovnatelné skupině 16 zdravých mužských dobrovolníků; průměrný terminální poločas po 30minutové infuzi 1,5 mg byl 3,9 hodiny s průměrnou clearance 439 ml/min/1,73 m².
Intravenózní studie albuterolu u potkanů prokázaly, že albuterol prošel hematoencefalickou bariérou a dosáhl koncentrací v mozku dosahujících přibližně 5 % plazmatických koncentrací. Ve strukturách mimo hematoencefalickou bariéru (šišinka mozková a hypofýza) léčivo dosáhlo koncentrací více než 100krát vyšších než v celém mozku.
Studie na březích krysách s tritiovaným albuterolem prokázaly, že přibližně 10 % cirkulujícího mateřského léku bylo přeneseno na plod. Dispozice v plicích plodu byla srovnatelná s plícemi matky, ale dispozice fetálních jater byla 1 % jaterních hladin matky.
Studie na laboratorních zvířatech (miniprasata, hlodavci a psi) prokázaly výskyt srdečních arytmií a náhlé smrti (s histologickým důkazem nekrózy myokardu), pokud byly beta-agonisty a methylxantiny podávány současně. Význam těchto zjištění při aplikaci na člověka není znám.
COMBIVENT 50 mg inhalační aerosol
Ve zkřížené farmakokinetické studii u 12 zdravých dobrovolníků mužského pohlaví porovnávající vzor absorpce a vylučování dvou inhalací Combivent® (ipratropium bromid a albuterol sulfát) inhalačního aerosolu ke dvěma účinným složkám jednotlivě, společné podávání ipratropium bromidu a albuterol sulfátu z jedné nádobka významně nezměnila systémovou absorpci ani jedné složky.
Hladiny ipratropiumbromidu zůstaly pod detekovatelnými limity (
Zvláštní populace
Farmakokinetika přípravku Combivent® (ipratropium bromid a albuterol sulfát) Inhalační aerosol nebo ipratropium bromid nebyla studována u pacientů s jaterní nebo renální insuficiencí nebo u starších osob (viz OPATŘENÍ ).
Lékové interakce
Nebyly provedeny žádné specifické farmakokinetické studie k hodnocení potenciálních lékových interakcí.
Farmakodynamika
Ipratropium bromid
Bronchodilatace po inhalaci ipratropium-bromidu je primárně lokální, místně specifický účinek, nikoli systémový.
Kontrolované klinické studie prokázaly, že ipratropium-bromid nemění ani mukociliární clearance, ani objem či viskozitu respiračních sekretů. Ve studiích bez pozitivní kontroly ipratropium-bromid neměnil velikost zornice, akomodaci ani zrakovou ostrost (viz NEŽÁDOUCÍ REAKCE ).
Ventilační/perfuzní studie neprokázaly žádné klinicky významné účinky na výměnu plicních plynů nebo arteriální tlak kyslíku. V doporučených dávkách nevyvolává ipratropium-bromid klinicky významné změny tepové frekvence nebo krevního tlaku.
Klinické testy
Ve dvou 12týdenních randomizovaných, dvojitě zaslepených, aktivně kontrolovaných klinických studiích byla u 1067 pacientů s chronickou obstrukční plicní nemocí (CHOPN) hodnocena bronchodilatační účinnost přípravku COMBIVENT 20 mcg inhalační aerosol (358 pacientů) ve srovnání s jeho složkami, ipratropium bromidem (362 pacientů) a albuterol sulfát (347 pacientů).
Sériová měření FEV1 (ukázána níže jako procentuální změna od výchozí hodnoty testovacího dne) prokázala, že COMBIVENT inhalační aerosol produkoval významně větší zlepšení funkce plic než ipratropium bromid nebo albuterol sulfát, když byly podávány samostatně. Střední doba do nástupu 15% nárůstu FEV1 byla 15 minut a střední doba do maximální FEV1 byla jedna hodina pro COMBIVENT 20 mcg inhalační aerosol a jeho složky. Střední doba trvání účinku měřená pomocí FEV1 byla 4 až 5 hodin pro COMBIVENT inhalační aerosol ve srovnání se 4 hodinami pro ipratropium bromid a 3 hodinami pro albuterol sulfát.
Procentuální změna v upravené střední hodnotě FEV1 od výchozí hodnoty testovacího dne – Analýza koncového bodu hodnotitelného souboru dat 
Tyto studie prokázaly, že každá složka inhalačního aerosolu Combivent® (ipratropium bromid a albuterol sulfát) přispěla ke zlepšení plicní funkce způsobené kombinací, zejména během prvních 4 až 5 hodin po podání dávky, a že inhalační aerosol COMBIVENT byl významně účinnější než ipratropium bromid nebo albuterol sulfát podávané samostatně.
Ve 2 kontrolovaných 12týdenních studiích COMBIVENT 50 mg inhalační aerosol nevyvolal žádnou změnu v sekundárních parametrech účinnosti včetně skóre symptomů, celkového hodnocení lékařem a ranního PEFR, které byly všechny monitorovány po celou dobu studie.
INFORMACE PRO PACIENTA
Návod k použití pro pacienta
Combivent® (ipratropium bromid a albuterol sulfát) Inhalační aerosol
Před použitím si pečlivě přečtěte celý návod
Používejte COMBIVENT 50 mg inhalační aerosol přesně podle pokynů svého lékaře. Bez porady se svým lékařem neměňte dávku ani to, jak často používáte COMBIVENT 20 mcg inhalační aerosol. Máte-li otázky ohledně svého zdravotního stavu nebo léčby, poraďte se se svým lékařem.
Informujte svého lékaře o všech lécích, které užíváte. COMBIVENT 50 mg inhalační aerosol a některé další léky se mohou vzájemně ovlivňovat. Nepoužívejte jiné inhalační léky s COMBIVENT 20 mcg inhalačním aerosolem, pokud to nepředepsal váš lékař.
1. Vložte kovovou nádobku do průhledného konce náustku (viz obrázek 1). Ujistěte se, že je nádobka zcela a pevně zasunuta do náustku. Kanystr COMBIVENT inhalačního aerosolu se má používat pouze s náustkem COMBIVENT inhalačního aerosolu. Tento náustek by se neměl používat s jinými inhalačními léky.
Obrázek 1 
2. Odstraňte oranžové ochranné víčko. Pokud víčko není na náustku, před použitím se ujistěte, že v náustku nic není. Pro dosažení nejlepších výsledků by měla mít nádobka před použitím pokojovou teplotu.
3. Protřepejte a vyzkoušejte sprej. Tento krok proveďte před prvním použitím a vždy, když nebyl aerosol používán déle než 24 hodin; jinak pokračujte přímo krokem 4.
Po intenzivním protřepávání nádobky po dobu alespoň 10 sekund (viz krok 4 pro pokyny k protřepávání) 3x „zkušební sprej“ do vzduchu. Vyvarujte se vstříknutí do očí.
4. Nádobku silně protřepávejte po dobu alespoň 10 sekund. Držte nádobku, jak je znázorněno na obrázku 2.
DŮLEŽITÉ: Intenzivní protřepání po dobu alespoň 10 sekund před každým nástřikem je velmi důležité pro správnou funkci produktu.
Pro dosažení nejlepších výsledků proveďte kroky 5 a 6 do 30 sekund po protřepání nádobky.
Obrázek 2 
5. Zhluboka ústy vydechněte (vydechněte). Držte nádobku ve vzpřímené poloze, jak je znázorněno na obrázku 3, mezi palcem a prstem (prsty), vložte náustek do úst a zavřete rty. Mějte oči zavřené, aby vám do očí nevstříkl žádný lék. Combivent® (ipratropium bromid a albuterol sulfát) Inhalační aerosol může způsobit rozmazané vidění, glaukom s úzkým úhlem nebo zhoršení tohoto stavu nebo bolest očí, pokud je lék stříkán do očí.
Obrázek 3 
6. Pomalu se nadechujte (vdechujte) ústy a zároveň si přípravek stříkejte do úst.
Chcete-li produkt nastříkat, jednou pevně zatlačte na nádobku proti náustku, jak je znázorněno na obrázku 4. Zhluboka se nadechujte.
Obrázek 4 
7. Zadržte dech na 10 sekund, sejměte náustek z úst a pomalu vydechujte, jako na obrázku 5.
Obrázek 5 
8. Počkejte přibližně 2 minuty, znovu inhalátorem silně protřepejte po dobu alespoň 10 sekund (jak je popsáno v kroku 4) a opakujte kroky 5 až 7.
9. Po použití nasaďte oranžový ochranný kryt proti prachu.
10. Udržujte náustek čistý. Opláchněte horkou vodou. Pokud použijete mýdlo, důkladně opláchněte čistou vodou. Před použitím důkladně osušte. Po zaschnutí nasaďte víčko na náustek, když lék nepoužíváte.
11. Sledujte počet použitých sprejů a po 200 sprejích zlikvidujte. I když nádobka není prázdná, po 200 stříknutích si nemůžete být jisti množstvím léku v každém stříknutí.
12. Pokud Vám předepsaná dávka nepřinese úlevu nebo se Vaše dýchací příznaky zhorší, vyhledejte ihned lékařskou pomoc.
Poznámka: Níže uvedené odsazené prohlášení je vyžadováno federálním vládním zákonem o čistém ovzduší pro všechny produkty obsahující nebo vyrobené s chlorfluoruhlovodíky (CFC):
Tento produkt obsahuje trichlormonofluormethan (CFC-11), dichlordifluormethan (CFC-12) a dichlortetrafluorethan (CFC-114), látky, které poškozují životní prostředí ničením ozónu v horních vrstvách atmosféry.
Obsah inhalačního aerosolu Combivent® (ipratropium bromid a albuterol sulfát) je pod tlakem. Nepropichujte nádobku. Nepoužívejte ani neskladujte v blízkosti tepla nebo otevřeného ohně. Vystavení teplotám nad 120 °F může způsobit prasknutí. Nádobu nikdy nevhazujte do ohně nebo spalovny.
COMBIVENT inhalační aerosol uchovávejte mimo dosah dětí.
Vyvarujte se vstříknutí do očí.
Lékařské dotazy směřujte na: http://us.boehringer-ingelheim.com, (800) 542-6257 nebo (800) 459-9906 TTY.
Skladujte při teplotě 25 °C (77 °F); povoleny výlety do 15°-30°C (59°-86°F) [vidět USP řízená pokojová teplota ]. Pro dosažení nejlepších výsledků skladujte nádobku před použitím při pokojové teplotě. Vyvarujte se nadměrné vlhkosti.
