Symbicort 160/4.5mcg Budesonide Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Symbicort 4,5 mcg a jak se používá?
Symbicort 4,5 mcg je lék na předpis používaný k léčbě příznaků astmatu a chronické obstrukční plicní nemoci. Symbicort lze užívat samostatně nebo s jinými léky.
Symbicort patří do třídy léků nazývaných Respiratory Inhalant Combos.
Není známo, zda je Symbicort 4,5 mcg bezpečný a účinný u dětí mladších 6 let.
Jaké jsou možné vedlejší účinky přípravku Symbicort 4,5 mcg?
Symbicort může způsobit závažné nežádoucí účinky včetně:
- zhoršující se dýchací potíže,
- vředy nebo bílé skvrny v ústech nebo krku,
- bolest při polykání,
- třes,
- nervozita,
- bolest na hrudi,
- rychlé nebo bušení srdce,
- kašel s hlenem,
- pocit nedostatku vzduchu,
- sípání,
- dusit se,
- jiné dýchací potíže,
- rozmazané vidění,
- tunelové vidění,
- bolest nebo zarudnutí očí,
- vidět halo kolem světel,
- horečka,
- zimnice,
- bolesti těla,
- neobvyklá únava,
- zvýšená žízeň,
- zvýšené močení,
- suchá ústa,
- ovocný zápach dechu,
- křeče v nohou,
- zácpa,
- nepravidelný srdeční tep,
- chvění v tvé hrudi,
- necitlivost nebo mravenčení,
- svalová slabost,
- ochablý pocit,
- únava,
- slabost,
- točení hlavy,
- nevolnost a
- zvracení
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky Symbicortu patří:
- bolest nebo podráždění v krku,
- bílé skvrny v ústech nebo krku,
- žaludeční nevolnost,
- zvracení,
- bolesti zad,
- bolest hlavy,
- příznaky chřipky a
- příznaky nachlazení (ucpaný nos nebo rýma, kýchání, bolest dutin nebo bolest v krku)
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku Symbicort. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
SYMBICORT 80/4,5 a SYMBICORT 160/4,5 každý obsahuje mikronizovaný budesonid a mikronizovaný dihydrát formoterol-fumarátu pouze pro perorální inhalaci.
Každý kanystr SYMBICORT 80/4.5 a SYMBICORT 160/4.5 je formulován jako tlakový inhalátor s odměřenou dávkou poháněný hydrofluoralkanem (HFA 227; 1,1,1,2,3,3,3-heptafluorpropan) obsahující buď 60 nebo 120 aktivací Dávkové formy A Síly a JAK DODÁVÁNO / Skladování A Manipulace ]. Po naplnění každá aktivace odměří buď 91/5,1 mcg nebo 181/5,1 mcg z ventilu a dodá buď 80/4,5 mcg, nebo 160/4,5 mcg (budesonid mikronizovaný/formoterol fumarát dihydrát mikronizovaný) z pohonu. Skutečné množství léčiva dodaného do plic může záviset na faktorech pacienta, jako je koordinace mezi aktivací zařízení a inspirací prostřednictvím aplikačního systému. SYMBICORT 160 mg také obsahuje povidon K25 USP jako suspendační činidlo a polyethylenglykol 1000 NF jako lubrikant.
SYMBICORT 160 mg by se měl před prvním použitím prostříknout vypuštěním dvou testovacích střiků do vzduchu směrem od obličeje a před každým nástřikem dobře protřepejte po dobu 5 sekund. V případech, kdy se inhalátor nepoužíval déle než 7 dní nebo když spadl, znovu jej naplňte tak, že před každým stříknutím po dobu 5 sekund dobře protřepejte a uvolněte dva zkušební střiky do vzduchu mimo obličej.
Jednou aktivní složkou přípravku SYMBICORT 4,5 mcg je budesonid, kortikosteroid chemicky označený jako (RS)11β, 16α, 17,21-Tetrahydroxypregna-1,4-dien-3,20-dion cyklický 16,17-acetal s butyraldehydem. Budesonid je poskytován jako směs dvou epimerů (22R a 22S). Empirický vzorec budesonidu je C25H34O6 a jeho molekulová hmotnost je 430,5. Jeho strukturní vzorec je:
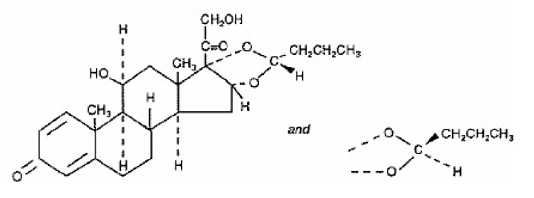
Budesonid je bílý až téměř bílý prášek bez chuti a zápachu, který je prakticky nerozpustný ve vodě a v heptanu, těžce rozpustný v ethanolu a snadno rozpustný v chloroformu. Jeho rozdělovací koeficient mezi oktanol a vodu při pH 7,4 je 1,6 x 103.
Další účinnou složkou přípravku SYMBICORT 160 mg je dihydrát formoterol-fumarátu, selektivní beta2-agonista chemicky označený jako (R*,R*)-(±)-N-[2-hydroxy-5-[1-hydroxy-2-[[ 2-(4-methoxyfenyl)-lmethylethyl]amino]ethyl]fenyl]formamid, (E)-2-butendioát (2:1), dihydrát. Empirický vzorec formoterolu je C42H56N4O14 a jeho molekulová hmotnost je 840,9. Jeho strukturní vzorec je:

Formoterol fumarát dihydrát je prášek, který je mírně rozpustný ve vodě. Jeho rozdělovací koeficient oktanol-voda při pH 7,4 je 2,6. pKa dihydrátu formoterolfumarátu při 25 °C je 7,9 pro fenolovou skupinu a 9,2 pro amino skupinu.
INDIKACE
Léčba Astma
SYMBICORT 4,5 mcg je indikován k léčbě astmatu u pacientů ve věku 6 let a starších.
SYMBICORT by měl být používán u pacientů, kteří nejsou dostatečně kontrolováni dlouhodobými léky na kontrolu astmatu, jako jsou inhalační kortikosteroidy (ICS), nebo jejichž onemocnění vyžaduje zahájení léčby jak inhalačním kortikosteroidem, tak dlouhodobě působícím beta2-adrenergním agonistou (LABA).
Důležitá omezení použití
- SYMBICORT NENÍ indikován k úlevě od akutního bronchospasmu.
Udržovací léčba chronické obstrukční plicní nemoci
SYMBICORT 160/4,5 je indikován k udržovací léčbě obstrukce dýchacích cest u pacientů s chronickou obstrukční plicní nemocí (CHOPN) včetně chronické bronchitidy a/nebo emfyzému. SYMBICORT 160/4,5 je také indikován ke snížení exacerbací CHOPN. SYMBICORT 160/4,5 je jediná síla indikovaná k léčbě CHOPN.
Důležitá omezení použití
- SYMBICORT 4,5 mcg NENÍ indikován k úlevě od akutního bronchospasmu.
DÁVKOVÁNÍ A PODÁVÁNÍ
Informace o administraci
SYMBICORT 160 mg by se měl podávat jako 2 inhalace dvakrát denně (ráno a večer, přibližně 12 hodin od sebe), každý den pouze perorální inhalační cestou. Po inhalaci by si měl pacient vypláchnout ústa vodou, aniž by polykal.
Před prvním použitím nastříkejte SYMBICORT 4,5 mcg uvolněním dvou testovacích střiků do vzduchu mimo obličej a před každým nástřikem dobře protřepejte po dobu 5 sekund. V případech, kdy se inhalátor nepoužíval déle než 7 dní nebo když spadl, znovu inhalátor naplňte tak, že před každým stříknutím dobře protřepete a uvolněte dva zkušební střiky do vzduchu mimo obličej.
Častější podávání nebo vyšší počet inhalací (více než 2 inhalace dvakrát denně) předepsané síly SYMBICORTU se nedoporučuje, protože u některých pacientů je vyšší pravděpodobnost výskytu nežádoucích účinků při vyšších dávkách formoterolu. Pacienti užívající SYMBICORT by neměli z jakéhokoli důvodu používat další LABA [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Astma
Pokud se příznaky astmatu objeví v období mezi dávkami, je třeba k okamžité úlevě užít inhalační, krátkodobě působící beta2-agonista.
Dospělí a dospívající pacienti ve věku 12 let a starší
U pacientů ve věku 12 let a starších je dávkování 2 inhalace SYMBICORT 80/4,5 nebo SYMBICORT 160/4,5 dvakrát denně.
Doporučené počáteční dávky přípravku SYMBICORT pro pacienty ve věku 12 let a starší jsou založeny na závažnosti astmatu pacientů nebo na úrovni kontroly symptomů astmatu a na riziku exacerbací při současných inhalačních kortikosteroidech.
Maximální doporučená dávka u dospělých a dospívajících pacientů ve věku 12 let a starších je SYMBICORT 160/4,5, dvě inhalace dvakrát denně.
Zlepšení kontroly astmatu po inhalačním podání SYMBICORTU může nastat během 15 minut od zahájení léčby, i když maximálního přínosu nemusí být dosaženo dříve než za 2 týdny nebo déle po zahájení léčby. Jednotliví pacienti zaznamenají různou dobu do nástupu a stupeň úlevy od symptomů.
pacientů, kteří po 1–2 týdnech léčby přípravkem SYMBICORT 80/4,5 adekvátně nereagují na úvodní dávku, může náhrada přípravkem SYMBICORT 160/4,5 zajistit další kontrolu astmatu.
Pokud dříve účinný dávkovací režim SYMBICORTU 4,5 mcg nezajistí adekvátní kontrolu astmatu, je třeba přehodnotit terapeutický režim a přidat další terapeutické možnosti (např. nahrazení nižší síly SYMBICORTU 4,5 mcg vyšší silou, přidání další inhalační dávky kortikosteroidy nebo zahajovací perorální kortikosteroidy).
Pediatričtí pacienti ve věku 6 až méně než 12 let
U pacientů ve věku od 6 do méně než 12 let je dávka 2 inhalace přípravku SYMBICORT 80/4,5 dvakrát denně.
Chronická obstrukční plicní nemoc
Pro pacienty s CHOPN je doporučená dávka SYMBICORT 160/4,5, dvě inhalace dvakrát denně.
Pokud se v období mezi dávkami objeví dušnost, k okamžité úlevě by měl být podán inhalační, krátkodobě působící beta2-agonista.
JAK DODÁVÁNO
Dávkové formy A Síly
SYMBICORT je dostupný jako inhalátor s odměřenou dávkou obsahující kombinaci budesonidu (80 nebo 160 mcg) a formoterolu (4,5 mcg) jako inhalační aerosol v následujících dvou silách: 80/4,5 a 160/4,5. Každá síla dávky obsahuje 60 nebo 120 stlačení na/kanister. Každá síla SYMBICORTU 160 mg je dodávána s červeným plastovým ovladačem s šedým protiprachovým uzávěrem.
Skladování A Manipulace
SYMBICORT je dostupný ve dvou silách a je dodáván v následujících velikostech balení:
Dávkové formy A Síly
Každá síla je dodávána jako tlaková hliníková nádobka s připojeným počítacím zařízením, červeným plastovým tělem ovladače s bílým náustkem a připojeným šedým protiprachovým uzávěrem. Každý 120 inhalační kanystr má čistou hmotnost náplně 10,2 gramů a každý 60 inhalační kanystr má čistou hmotnost náplně 6,9 gramů (SYMBICORT 80/4,5) nebo 6 gramů (SYMBICORT 160/4,5). Každá nádobka je zabalena ve fóliovém přebalovacím sáčku se sáčkem s vysoušedlem a umístěna do kartonu. Každá krabička obsahuje jeden kanystr a příbalovou informaci pro pacienty.
Kanystr SYMBICORT 4,5 mcg by měl být používán pouze s aktuátorem SYMBICORT 4,5 mcg a aktuátor SYMBICORT by neměl být používán s žádným jiným inhalačním lékem.
Po použití uvedeného počtu inhalací z nádobky nelze zajistit správné množství léku v každé inhalaci, i když se inhalátor nemusí zdát zcela prázdný a může pokračovat v provozu. Inhalátor by měl být zlikvidován po použití uvedeného počtu inhalací nebo do 3 měsíců po vyjmutí z fóliového sáčku. Nikdy neponořujte kanystr do vody, abyste zjistili množství zbývající v kanystru („plovoucí test“).
Skladujte při kontrolované pokojové teplotě 20 °C až 25 °C (68 °F až 77 °F) [viz USP]. Uchovávejte inhalátor náustkem dolů.
Pro dosažení nejlepších výsledků by měla mít nádobka před použitím pokojovou teplotu. Před použitím dobře protřepejte po dobu 5 sekund.
Udržujte mimo dosah dětí. Vyvarujte se vstříknutí do očí.
OBSAH POD TLAKEM.
Nepropichujte ani nespalujte. Neskladujte v blízkosti tepla nebo otevřeného ohně. Vystavení teplotám nad 120 °F může způsobit prasknutí. Nádobu nikdy nevhazujte do ohně nebo spalovny.
Vyrobeno pro: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850 Autor: AstraZeneca Dunkerque Production, Dunkerque, Francie. Revize: prosinec 2017
VEDLEJŠÍ EFEKTY
Použití LABA může mít za následek následující:
- Závažné astmatické příhody – hospitalizace, intubace, úmrtí [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Účinky na kardiovaskulární systém a centrální nervový systém (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Systémové a inhalační kortikosteroidy mohou mít za následek následující:
- Infekce Candida albicans [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Pneumonie nebo infekce dolních cest dýchacích u pacientů s CHOPN [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Imunosuprese [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hyperkorticismus a suprese nadledvin [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Účinky na růst u dětských pacientů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Glaukom a šedý zákal [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Zkušenosti z klinických studií u astmatu
Dospělí a dospívající pacienti ve věku 12 let a starší
Celkové údaje o bezpečnosti u dospělých a dospívajících jsou založeny na 10 aktivních a placebem kontrolovaných klinických studiích, ve kterých bylo 3393 pacientů ve věku 12 let a starších (2052 žen a 1341 mužů) s astmatem různé závažnosti léčeno přípravkem SYMBICORT 80/4,5 nebo 160 /4,5 užívané 2 inhalace jednou nebo dvakrát denně po dobu 12 až 52 týdnů. V těchto studiích měli pacienti na SYMBICORTU průměrný věk 38 let a byli převážně běloši (82 %).
Výskyt častých nežádoucích účinků v tabulce 2 níže je založen na souhrnných údajích ze tří 12týdenních, dvojitě zaslepených, placebem kontrolovaných klinických studií, ve kterých bylo 401 dospělých a dospívajících pacientů (148 mužů a 253 žen) ve věku 12 let a starších. léčena 2 inhalacemi SYMBICORTU 80/4,5 nebo SYMBICORTU 160/4,5 dvakrát denně. Skupina SYMBICORT byla složena z většinou bělošských (84 %) pacientů s průměrným věkem 38 let a průměrné procento předpokládané FEV1 na počátku bylo 76 a 68 pro léčebné skupiny 80/4,5 mcg a 160/4,5 mcg, v daném pořadí. Kontrolní ramena pro srovnání zahrnovala 2 inhalace budesonidu HFA inhalátoru s odměřenou dávkou (MDI) 80 nebo 160 mcg, inhalátoru suchého prášku formoterolu (DPI) 4,5 mcg nebo placeba (MDI a DPI) dvakrát denně. Tabulka 2 zahrnuje všechny nežádoucí příhody, které se vyskytly s incidencí > 3 % v kterékoli skupině SYMBICORT a častěji než ve skupině s placebem při dávkování dvakrát denně. Při zvažování těchto údajů je třeba vzít v úvahu zvýšenou průměrnou dobu expozice pacientů pacientům SYMBICORT, protože incidence není upravena pro nerovnováhu délky léčby.
Dlouhodobá bezpečnost – klinické studie astmatu u pacientů ve věku 12 let a starších
Dlouhodobé studie bezpečnosti u dospívajících a dospělých pacientů ve věku 12 let a starších, léčených po dobu až 1 roku v dávkách až 1280/36 mcg/den (640/18 mcg dvakrát denně), neodhalily žádné klinicky významné změny ve výskytu ani nové typy nežádoucích účinků objevujících se po delších obdobích léčby. Podobně nebyly po dobu až 1 roku pozorovány žádné významné nebo neočekávané vzory abnormalit v bezpečnostních opatřeních včetně chemie, hematologie, EKG, Holterova monitoru a hodnocení osy HPA.
Pediatričtí pacienti ve věku 6 až méně než 12 let
Údaje o bezpečnosti pro pediatrické pacienty ve věku 6 až méně než 12 let jsou založeny na 1 studii trvající 12 týdnů léčby. Pacienti (79 žen a 105 mužů), kteří při vstupu do studie dostávali inhalační kortikosteroid, byli randomizováni k léčbě SYMBICORT 80/4,5 (n=92) nebo budesonid pMDI 80 mcg (n=92), 2 inhalace dvakrát denně. Celkový bezpečnostní profil těchto pacientů byl podobný profilu pozorovanému u pacientů ve věku 12 let a starších, kteří dostávali SYMBICORT 80/4,5 dvakrát denně ve studiích podobného uspořádání. Časté nežádoucí účinky, které se vyskytly u pacientů léčených přípravkem SYMBICORT 80/4,5 s frekvencí ≥ 3 % a častěji než u pacientů léčených pouze budesonidem pMDI 80 mcg, zahrnovaly infekci horních cest dýchacích, faryngitidu, bolest hlavy a rýmu.
Zkušenosti z klinických studií s chronickou obstrukční plicní nemocí
Údaje o bezpečnosti popsané níže odrážejí expozici přípravku SYMBICORT 160/4,5 u 1783 pacientů. Přípravek SYMBICORT 160/4,5 byl studován ve dvou placebem kontrolovaných studiích plicních funkcí (trvání 6 a 12 měsíců) a dvou aktivních studiích s exacerbací (trvání 6 a 12 měsíců) u pacientů s CHOPN.
Výskyt častých nežádoucích účinků v tabulce 3 níže je založen na souhrnných údajích ze dvou dvojitě zaslepených, placebem kontrolovaných klinických studií plicních funkcí (trvání 6 a 12 měsíců), ve kterých bylo 771 dospělých pacientů s CHOPN (496 mužů a 275 žen) 40 let a starší byli léčeni přípravkem SYMBICORT 160/4,5, dvě inhalace dvakrát denně. Z těchto pacientů bylo 651 léčeno 6 měsíců a 366 bylo léčeno 12 měsíců. Skupina SYMBICORT byla složena převážně z bělošských (93 %) pacientů s průměrným věkem 63 let a průměrné procento predikované FEV1 na počátku bylo 33 %. Kontrolní ramena pro srovnání zahrnovala 2 inhalace budesonidu HFA (MDI) 160 mcg, formoterolu (DPI) 4,5 mcg nebo placeba (MDI a DPI) dvakrát denně. Tabulka 3 zahrnuje všechny nežádoucí příhody, které se vyskytly s incidencí ≥ 3 % ve skupině SYMBICORT a častěji než ve skupině s placebem. Při zvažování těchto údajů je třeba vzít v úvahu zvýšenou průměrnou dobu expozice pacienta přípravku SYMBICORT 4,5 mcg, protože výskyt není upraven pro nerovnováhu délky léčby.
Plicní infekce jiné než pneumonie (většinou bronchitida) se vyskytly u většího procenta subjektů léčených přípravkem SYMBICORT 160/4,5 ve srovnání s placebem (7,9 % vs. 5,1 %). V chemickém, hematologickém, EKG, EKG (Holterově) monitorování, HPA-ose, kostní minerální hustotě a oftalmologickém hodnocení nebyly po dobu až 1 roku pozorovány žádné klinicky významné nebo neočekávané vzorce abnormalit.
Bezpečnostní zjištění ze dvou dvojitě zaslepených, aktivně kontrolovaných studií exacerbací (v trvání 6 a 12 měsíců), ve kterých bylo 1012 dospělých pacientů s CHOPN (616 mužů a 396 žen) ve věku 40 let a starších léčeno přípravkem SYMBICORT 160/4,5, dvě inhalace dvakrát denně byly v souladu se studiemi plicních funkcí.
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během používání přípravku SYMBICORT po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku. Některé z těchto nežádoucích účinků mohly být také pozorovány v klinických studiích s přípravkem SYMBICORT.
Srdeční poruchy: angina pectoris, tachykardie, síňové a ventrikulární tachyarytmie, fibrilace síní, extrasystoly, palpitace
Endokrinní poruchy: hyperkorticismus, snížení rychlosti růstu u dětských pacientů
Oční poruchy: katarakta, glaukom, zvýšený nitrooční tlak
Gastrointestinální poruchy: orofaryngeální kandidóza, nevolnost
Poruchy imunitního systému: okamžité a opožděné hypersenzitivní reakce, jako je anafylaktická reakce, angioedém, bronchospasmus, kopřivka, exantém, dermatitida, pruritus
Poruchy metabolismu a výživy: hyperglykémie, hypokalémie
Poruchy svalové a kosterní soustavy, pojivové tkáně a kostí: svalové křeče
Poruchy nervového systému: třes, závratě
Psychiatrické poruchy: poruchy chování, poruchy spánku, nervozita, neklid, deprese, neklid
Respirační, hrudní a mediastinální poruchy: dysfonie, kašel, podráždění krku
Poruchy kůže a podkoží: kožní modřiny
Cévní poruchy: hypotenze, hypertenze
DROGOVÉ INTERAKCE
V klinických studiích nevedlo současné podávání SYMBICORTU a dalších léků, jako jsou krátkodobě působící beta2agonisté, intranazální kortikosteroidy a antihistaminika/dekongestancia ke zvýšené frekvenci nežádoucích účinků. S přípravkem SYMBICORT nebyly provedeny žádné formální studie lékových interakcí.
Inhibitory cytochromu P4503A4
Hlavní cesta metabolismu kortikosteroidů, včetně budesonidu, složky přípravku SYMBICORT, je přes izoenzym 3A4 (CYP3A4) cytochromu P450 (CYP). Po perorálním podání ketokonazolu, silného inhibitoru CYP3A4, se průměrná plazmatická koncentrace perorálně podaného budesonidu zvýšila. Současné podávání CYP3A4 může inhibovat metabolismus budesonidu a zvýšit systémovou expozici budesonidu. Při zvažování současného podávání přípravku SYMBICORT 4,5 mcg s dlouhodobým ketokonazolem a dalšími známými silnými inhibitory CYP3A4 (např. ritonavir, atazanavir, klarithromycin, indinavir, itrakonazol, nefazodon, nelfinavir, saquinavir, telithromycin) je třeba opatrnosti VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Inhibitory monoaminoxidázy a tricyklická antidepresiva
SYMBICORT by měl být podáván s opatrností pacientům léčeným inhibitory monoaminooxidázy nebo tricyklickými antidepresivy nebo do 2 týdnů po vysazení těchto přípravků, protože účinek formoterolu, složky přípravku SYMBICORT 160 mg, na cévní systém může být těmito přípravky zesílen. . V klinických studiích s přípravkem SYMBICORT dostával omezený počet pacientů s CHOPN a astmatem tricyklická antidepresiva, a proto nelze učinit žádné klinicky významné závěry o nežádoucích účincích.
Látky blokující beta-adrenergní receptory
Beta-blokátory (včetně očních kapek) mohou nejen blokovat plicní účinek beta-agonistů, jako je formoterol, složka přípravku SYMBICORT, ale mohou vyvolat těžký bronchospasmus u pacientů s astmatem. Pacienti s astmatem by proto za normálních okolností neměli být léčeni betablokátory. Za určitých okolností však nemusí existovat žádné přijatelné alternativy k použití beta-adrenergních blokátorů u pacientů s astmatem. V této situaci by bylo možné zvážit kardioselektivní beta-blokátory, i když by měly být podávány s opatrností.
Diuretika
Změny EKG a/nebo hypokalémie, které mohou být důsledkem podávání draslík nešetřících diuretik (jako jsou kličková nebo thiazidová diuretika), mohou být beta-agonisty akutně zhoršeny, zvláště když je překročena doporučená dávka beta-agonistů. Ačkoli klinický význam těchto účinků není znám, doporučuje se opatrnost při současném podávání přípravku SYMBICORT s diuretiky nešetřícími draslík.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Závažné události související s astmatem – hospitalizace, intubace a smrt
Použití LABA v monoterapii (bez IKS) u astmatu je spojeno se zvýšeným rizikem úmrtí souvisejících s astmatem [viz Salmeterol Multicenter Asthma Research Trial (SMART)]. Dostupné údaje z kontrolovaných klinických studií také naznačují, že použití LABA jako monoterapie zvyšuje riziko hospitalizace související s astmatem u pediatrických a dospívajících pacientů. Tato zjištění jsou považována za třídní účinek LABA. Při použití LABA ve fixní kombinaci s IKS údaje z velkých klinických studií neprokazují významné zvýšení rizika závažných příhod souvisejících s astmatem (hospitalizace, intubace, úmrtí) ve srovnání se samotnými IKS (viz Závažné příhody související s astmatem s ICS/LABA).
Závažné příhody související s astmatem s ICS/LABA
Byly provedeny čtyři velké, 26týdenní, randomizované, zaslepené, aktivně kontrolované klinické studie bezpečnosti, aby se vyhodnotilo riziko závažných příhod souvisejících s astmatem, když byla LABA použita ve fixní kombinaci s IKS ve srovnání se samotným IKS u pacientů s astmatem. Tři studie zahrnovaly dospělé a dospívající pacienty ve věku ≥ 12 let: jedna studie porovnávala budesonid/formoterol (SYMBICORT) s budesonidem (viz Klinické studie ]; jedna studie porovnávala inhalační prášek flutikason propionát/salmeterol s inhalačním práškem flutikason propionát; a jedna studie porovnávala mometason furoát/formoterol s mometason furoátem. Čtvrtá studie zahrnovala pediatrické pacienty ve věku 4 až 11 let a porovnávala prášek k inhalaci flutikason propionát/salmeterol s práškem k inhalaci flutikason propionát. Primárním cílovým parametrem bezpečnosti pro všechny čtyři studie byly závažné příhody související s astmatem (hospitalizace, intubace a úmrtí). Zaslepená hodnotící komise určila, zda příhody souvisely s astmatem.
Tři studie pro dospělé a dospívající byly navrženy tak, aby vyloučily rizikové rozpětí 2,0, a pediatrická studie byla navržena tak, aby vyloučila riziko 2,7. Každá jednotlivá studie splnila svůj předem stanovený cíl a prokázala noninferioritu IKS/LABA ve srovnání se samotnými IKS. Metaanalýza tří studií u dospělých a dospívajících neprokázala signifikantní zvýšení rizika závažné příhody související s astmatem u fixní kombinace IKS/LABA ve srovnání se samotným IKS (tabulka 1). Tyto studie nebyly navrženy tak, aby vyloučily veškeré riziko závažných příhod souvisejících s astmatem u IKS/LABA ve srovnání s IKS.
Pediatrická bezpečnostní studie zahrnovala 6208 pediatrických pacientů ve věku 4 až 11 let, kteří dostávali ICS/LABA (prášek k inhalaci flutikason propionát/salmeterol) nebo ICS (prášek k inhalaci flutikason propionátu). V této studii prodělalo 27/3107 (0,9 %) pacientů randomizovaných do IKS/LABA a 21/3101 (0,7 %) pacientů randomizovaných k IKS závažnou příhodu související s astmatem. Nebyla zaznamenána žádná úmrtí související s astmatem ani intubace. IKS/LABA neprokázaly signifikantně zvýšené riziko závažné příhody související s astmatem ve srovnání s IKS na základě předem stanoveného rizikového rozpětí (2,7), s odhadovaným poměrem rizik v době do první příhody 1,29 (95% CI: 0,73 , 2,27).
Multicentrický výzkum astmatu Salmeterol (SMART)
28týdenní placebem kontrolovaná studie v USA, která porovnávala bezpečnost salmeterolu s placebem, z nichž každá byla přidána k obvyklé léčbě astmatu, ukázala nárůst úmrtí souvisejících s astmatem u pacientů užívajících salmeterol (13/13 176 u pacientů léčených salmeterolem vs. 3 /13 179 u pacientů léčených placebem, relativní riziko: 4,37 [95% CI 1,25, 15,34]). Použití ICS na pozadí nebylo ve SMART vyžadováno. Zvýšené riziko úmrtí souvisejícího s astmatem je považováno za skupinový účinek monoterapie LABA.
Studie monoterapie formoterolem
Klinické studie s formoterolem používaným v monoterapii naznačovaly vyšší výskyt závažné exacerbace astmatu u pacientů užívajících formoterol než u pacientů užívajících placebo. Velikost těchto studií nebyla dostatečná pro přesnou kvantifikaci rozdílu v závažných exacerbacích astmatu mezi léčebnými skupinami.
Zhoršení Nemoci A Akutní Epizody
SYMBICORT 4,5 mcg by neměl být zahájen u pacientů během rychle se zhoršujících nebo potenciálně život ohrožujících epizod astmatu nebo CHOPN. SYMBICORT nebyl studován u pacientů s akutně se zhoršujícím astmatem nebo CHOPN. Spuštění SYMBICORTU 4,5 mcg v tomto nastavení není vhodné.
Zvyšující se užívání inhalačních, krátkodobě působících beta2-agonistů je markerem zhoršujícího se astmatu. V této situaci pacient vyžaduje okamžité přehodnocení s přehodnocením léčebného režimu, se zvláštním ohledem na možnou potřebu nahradit současnou sílu SYMBICORTU vyšší silou, přidat další inhalační kortikosteroid nebo zahájit systémové kortikosteroidy. Pacienti by neměli užívat více než 2 inhalace přípravku SYMBICORT dvakrát denně (ráno a večer).
SYMBICORT 160 mg se nemá používat k úlevě od akutních příznaků, tj. jako záchranná terapie k léčbě akutních epizod bronchospasmu. Ke zmírnění akutních příznaků, jako je dušnost, by se měl použít inhalační, krátkodobě působící beta2-agonista, nikoli SYMBICORT.
Při zahájení léčby přípravkem SYMBICORT 4,5 mcg by pacienti, kteří pravidelně užívali perorální nebo inhalační krátkodobě působící beta2-agonisty (např. 4krát denně), měli být poučeni, aby přerušili pravidelné užívání těchto léků.
Nadměrné užívání přípravku SYMBICORT 4,5 mcg a užívání s jinými dlouhodobě působícími beta2-agonisty
Stejně jako u jiných inhalačních léků obsahujících beta2-adrenergní látky by SYMBICORT 4,5 mcg neměl být používán častěji, než je doporučeno, ve vyšších dávkách, než je doporučeno, nebo ve spojení s jinými léky obsahujícími LABA, protože může dojít k předávkování. V souvislosti s nadměrným užíváním inhalačních sympatomimetik byly hlášeny klinicky významné kardiovaskulární účinky a úmrtí. Pacienti užívající SYMBICORT by neměli používat další LABA (např. salmeterol, formoterol fumarát, arformoterol tartarát) z jakéhokoli důvodu, včetně prevence cvičením indukovaného bronchospasmu (EIB) nebo léčby astmatu nebo CHOPN.
Místní efekty
klinických studiích došlo u pacientů léčených přípravkem SYMBICORT k rozvoji lokalizovaných infekcí úst a hltanu způsobených Candida albicans. Když se taková infekce rozvine, měla by být léčena vhodnou lokální nebo systémovou (tj. perorální antimykotikum), zatímco léčba přípravkem SYMBICORT 160 mg pokračuje, ale někdy může být nutné léčbu přípravkem SYMBICORT 4,5 mcg přerušit. Poučte pacienta, aby si po inhalaci vyplachoval ústa vodou bez polykání, aby se snížilo riziko orofaryngeální kandidózy.
Pneumonie a jiné infekce dolních cest dýchacích
Lékaři by měli zůstat ostražití ohledně možného rozvoje pneumonie u pacientů s CHOPN, protože klinické příznaky pneumonie a exacerbací se často překrývají. Po inhalačním podání kortikosteroidů byly hlášeny infekce dolních cest dýchacích, včetně pneumonie.
6měsíční studii plicních funkcí u 1704 pacientů s CHOPN byl u pacientů užívajících SYMBICORT 160/4,5 vyšší výskyt jiných plicních infekcí než pneumonie (např. bronchitida, virové infekce dolních cest dýchacích atd.) než u těch, kteří dostávali SYMBICORT 80/4,5 (3,2 %), formoterol 4,5 mcg (4,6 %) nebo placebo (3,3 %). Pneumonie se nevyskytla s vyšší incidencí ve skupině SYMBICORT 160/4,5 (1,1 %) ve srovnání s placebem (1,3 %). Ve 12měsíční studii plicních funkcí u 1964 pacientů s CHOPN byl také vyšší výskyt plicních infekcí jiných než pneumonie u pacientů užívajících SYMBICORT 160/4,5 (8,1 %) než u pacientů užívajících SYMBICORT 80/4,5 (6,9 %), formoterol 4,5 mcg (7,1 %) nebo placebo (6,2 %). Podobně jako v 6měsíční studii se pneumonie nevyskytla s vyšší incidencí ve skupině SYMBICORT 160/4,5 (4,0 %) ve srovnání s placebem (5,0 %).
Imunosuprese
Pacienti, kteří užívají léky, které potlačují imunitní systém, jsou náchylnější k infekci než zdraví jedinci. Například plané neštovice a spalničky mohou mít u vnímavých dětí nebo dospělých užívajících kortikosteroidy závažnější nebo dokonce smrtelný průběh. U takových dětí nebo dospělých, kteří neměli tato onemocnění nebo nebyli řádně imunizováni, je třeba věnovat zvláštní pozornost tomu, aby se zabránilo expozici. Není známo, jak dávka, cesta a délka podávání kortikosteroidů ovlivňuje riziko rozvoje diseminované infekce. Není také znám podíl základního onemocnění a/nebo předchozí léčby kortikosteroidy na riziku. Pokud dojde k expozici, může být indikována léčba imunoglobulinem proti varicella zoster (VZIG) nebo kombinovaným intravenózním imunoglobulinem (IVIG). Při expozici spalničkám může být indikována profylaxe sdruženým intramuskulárním imunoglobulinem (IG) (úplné informace o předepisování VZIG a IG naleznete v příslušných příbalových informacích). Pokud se objeví plané neštovice, lze zvážit léčbu antivirotiky. Imunitní odpověď na vakcínu proti planým neštovicím byla hodnocena u pediatrických pacientů s astmatem ve věku 12 měsíců až 8 let s inhalační suspenzí budesonidu.
Otevřená, nerandomizovaná klinická studie zkoumala imunitní odpověď na vakcínu proti planým neštovicím u 243 pacientů s astmatem ve věku 12 měsíců až 8 let, kteří byli léčeni inhalační suspenzí budesonidu v dávce 0,25 mg až 1 mg denně (n=151) nebo nekortikosteroidní léčbou astmatu (n =92) (tj. beta2-agonisté, antagonisté leukotrienového receptoru, kromony). Procento pacientů, u kterých se vyvinul titr séroprotektivních protilátek > 5,0 (hodnota gpELISA) v reakci na očkování, bylo podobné u pacientů léčených inhalační suspenzí budesonidu (85 %) ve srovnání s pacienty léčenými nekortikosteroidní léčbou astmatu (90 %). U žádného pacienta léčeného inhalační suspenzí budesonidu se v důsledku očkování nerozvinuly plané neštovice.
Inhalační kortikosteroidy by měly být používány s opatrností, pokud vůbec, u pacientů s aktivní nebo klidovou tuberkulózní infekcí dýchacích cest; neléčené systémové plísňové, bakteriální, virové nebo parazitární infekce; nebo oční herpes simplex.
Převod pacientů ze systémové kortikosteroidní terapie
Zvláštní opatrnosti je zapotřebí u pacientů, kteří byli převedeni ze systémově aktivních kortikosteroidů na inhalační kortikosteroidy, protože u pacientů s astmatem došlo během a po přechodu ze systémových kortikosteroidů na méně systémově dostupné inhalační kortikosteroidy k úmrtím v důsledku adrenální insuficience. Po vysazení systémových kortikosteroidů je k obnovení funkce hypotalamus-hypofýza-nadledviny (HPA) zapotřebí několik měsíců.
Pacienti, kteří byli dříve udržováni na 20 mg nebo více prednisonu (nebo jeho ekvivalentu) denně, mohou být nejcitlivější, zvláště když jim byly systémové kortikosteroidy téměř úplně vysazeny. Během tohoto období suprese HPA mohou pacienti vykazovat známky a příznaky adrenální insuficience, když jsou vystaveni traumatu, chirurgickému zákroku nebo infekci (zejména gastroenteritidě) nebo jiným stavům spojeným s těžkou ztrátou elektrolytů. Ačkoli SYMBICORT může zajistit kontrolu příznaků astmatu během těchto epizod, v doporučených dávkách dodává systémově menší než normální fyziologická množství glukokortikoidů a NEZAJIŠŤUJE mineralokortikoidní aktivitu, která je nezbytná pro zvládnutí těchto mimořádných událostí.
Během období stresu, těžkého astmatického záchvatu nebo těžké exacerbace CHOPN by pacienti, kteří byli vysazeni ze systémových kortikosteroidů, měli být poučeni, aby okamžitě obnovili perorální kortikosteroidy (ve velkých dávkách) a aby kontaktovali svého lékaře pro další instrukce. Tito pacienti by měli být také poučeni, aby nosili varovnou kartu s upozorněním, že mohou potřebovat doplňkové systémové kortikosteroidy během období stresu, těžkého astmatického záchvatu nebo těžké exacerbace CHOPN.
Pacienti vyžadující perorální kortikosteroidy by měli být po převedení na SYMBICORT pomalu odstaveni od systémových kortikosteroidů. Snížení prednisonu lze dosáhnout snížením denní dávky prednisonu o 2,5 mg týdně během léčby přípravkem SYMBICORT. Během vysazování perorálních kortikosteroidů by měly být pečlivě sledovány funkce plic (průměrný usilovný výdechový objem za 1 sekundu [FEV1] nebo ranní maximální výdechový průtok [PEF]), užívání beta-agonistů a příznaky astmatu nebo CHOPN. Dále je třeba u pacientů sledovat známky a příznaky adrenální insuficience, jako je únava, malátnost, slabost, nauzea a zvracení a hypotenze.
Převedení pacientů z léčby systémovými kortikosteroidy na inhalační kortikosteroidy nebo SYMBICORT může demaskovat stavy dříve potlačované léčbou systémovými kortikosteroidy (např. rýma, konjunktivitida, ekzém, artritida, eozinofilní stavy). Někteří pacienti mohou pociťovat příznaky vysazení systémově aktivních kortikosteroidů (např. bolesti kloubů a/nebo svalů, malátnost, deprese) i přes udržení nebo dokonce zlepšení respiračních funkcí.
Hyperkorticismus a útlum nadledvin
Budesonid, složka přípravku SYMBICORT, často pomůže kontrolovat astma a symptomy CHOPN s menší supresí funkce HPA než terapeuticky ekvivalentní perorální dávky prednisonu. Vzhledem k tomu, že budesonid je absorbován do krevního oběhu a může být systémově aktivní ve vyšších dávkách, lze příznivé účinky přípravku SYMBICORT na minimalizaci dysfunkce HPA očekávat pouze tehdy, pokud nejsou překročeny doporučené dávky a jednotliví pacienti jsou titrováni na nejnižší účinnou dávku.
Vzhledem k možnosti systémové absorpce inhalačních kortikosteroidů by pacienti léčení přípravkem SYMBICORT 160 mg měli být pečlivě sledováni s ohledem na jakékoli známky systémových účinků kortikosteroidů. Zvláštní pozornost by měla být věnována sledování pacientů po operaci nebo během období stresu, zda nedochází k průkazu nedostatečné odpovědi nadledvin.
Je možné, že u malého počtu pacientů se mohou objevit systémové účinky kortikosteroidů, jako je hyperkorticismus a adrenální suprese (včetně adrenální krize), zvláště pokud je budesonid podáván ve vyšších než doporučených dávkách po delší dobu. Pokud se takové účinky vyskytnou, dávka přípravku SYMBICORT by se měla snižovat pomalu, v souladu s přijatými postupy pro snížení systémových kortikosteroidů a pro zvládání příznaků astmatu.
Lékové interakce se silnými inhibitory cytochromu P450 3A4
Při zvažování současného podávání přípravku SYMBICORT 4,5 mcg s ketokonazolem a dalšími známými silnými inhibitory CYP3A4 (např. ritonavir, atazanavir, klarithromycin, indinavir, itrakonazol, nefazodon, nelfinavir, saquinavir, telitromycin) je třeba zvýšené opatrnosti, protože nežádoucí účinky související s expozicí vůči systému může dojít k budesonidu [viz DROGOVÉ INTERAKCE a KLINICKÁ FARMAKOLOGIE ].
Paradoxní bronchospasmus a symptomy horních cest dýchacích
Stejně jako u jiných inhalačních léků může SYMBICORT 160 mg vyvolat paradoxní bronchospasmus, který může být život ohrožující. Pokud se po podání přípravku SYMBICORT 160 mg objeví paradoxní bronchospasmus, je třeba jej okamžitě léčit inhalačním, krátkodobě působícím bronchodilatátorem, okamžitě přerušit podávání přípravku SYMBICORT a zahájit alternativní léčbu.
Okamžité hypersenzitivní reakce
Po podání přípravku SYMBICORT 160 mg se mohou vyskytnout okamžité hypersenzitivní reakce, které se projevují případy kopřivky, angioedému, vyrážky a bronchospasmu.
Účinky na kardiovaskulární a centrální nervový systém
Nadměrná beta-adrenergní stimulace byla spojena se záchvaty, anginou pectoris, hypertenzí nebo hypotenzí, tachykardií s frekvencí až 200 tepů/min, arytmiemi, nervozitou, bolestí hlavy, třesem, bušením srdce, nevolností, závratí, únavou, malátností a nespavostí (viz PŘEDÁVKOVÁNÍ ]. Proto by měl být SYMBICORT 160 mg, stejně jako všechny přípravky obsahující sympatomimetické aminy, používán s opatrností u pacientů s kardiovaskulárními poruchami, zejména s koronární insuficiencí, srdečními arytmiemi a hypertenzí.
Formoterol, složka přípravku SYMBICORT, může u některých pacientů vyvolat klinicky významný kardiovaskulární účinek měřený tepovou frekvencí, krevním tlakem a/nebo symptomy. Ačkoli jsou tyto účinky po podání formoterolu v doporučených dávkách méně časté, pokud se vyskytnou, může být nutné léčbu přerušit. Kromě toho bylo hlášeno, že beta-agonisté způsobují změny na EKG, jako je zploštění vlny T, prodloužení intervalu QTc a deprese segmentu ST. Klinický význam těchto nálezů není znám. V souvislosti s nadměrným užíváním inhalačních sympatomimetik byly hlášeny případy úmrtí.
Snížení hustoty kostních minerálů
Při dlouhodobém podávání přípravků obsahujících inhalační kortikosteroidy bylo pozorováno snížení kostní minerální denzity (BMD). Klinický význam malých změn BMD s ohledem na dlouhodobé následky, jako je zlomenina, není znám. Pacienti s hlavními rizikovými faktory pro snížený obsah kostních minerálů, jako je prodloužená imobilizace, rodinná anamnéza osteoporózy, postmenopauzální stav, užívání tabáku, pokročilý věk, špatná výživa nebo chronické užívání léků, které mohou snížit kostní hmotu (např. antikonvulziva, perorální kortikosteroidy ) by měly být sledovány a léčeny podle zavedených standardů péče. Vzhledem k tomu, že pacienti s CHOPN mají často více rizikových faktorů pro sníženou BMD, doporučuje se hodnocení BMD před zahájením léčby přípravkem SYMBICORT 160 mg a poté pravidelně. Pokud je pozorováno významné snížení BMD a SYMBICORT je stále považován za lékařsky důležitý pro léčbu CHOPN daného pacienta, je třeba důkladně zvážit použití léků k léčbě nebo prevenci osteoporózy.
Účinky léčby přípravkem SYMBICORT 160/4,5, SYMBICORT 80/4,5, formoterolem 4,5 mcg nebo placebem na BMD byly hodnoceny u podskupiny 326 pacientů (ženy a muži ve věku 41 až 88 let) s CHOPN ve 12měsíční plicní funkci studie. Hodnocení BMD oblastí kyčle a bederní páteře bylo prováděno na začátku a po 52 týdnech pomocí skenů rentgenové absorpce s duální energií (DEXA). Průměrné změny BMD od počátku do konce léčby byly malé (průměrné změny se pohybovaly v rozmezí -0,01 -0,01 g/cm²). Výsledky ANCOVA pro celkovou BMD páteře a celého kyčle na základě časového bodu konce léčby ukázaly, že všechny geometrické průměrné poměry LS pro srovnání párových léčebných skupin byly blízké 1, což naznačuje, že celková BMD pro celou oblast kyčle a celé oblasti páteře pro 12 -měsíční časový bod byly stabilní po celou dobu léčby.
Vliv Na Růst
Perorálně inhalované kortikosteroidy mohou při podávání pediatrickým pacientům způsobit snížení rychlosti růstu. Monitorujte růst dětských pacientů, kteří dostávají SYMBICORT rutinně (např. pomocí stadiometrie). Chcete-li minimalizovat systémové účinky perorálně inhalovaných kortikosteroidů, včetně SYMBICORTU, titrujte dávku každého pacienta na nejnižší dávku, která účinně kontroluje jeho příznaky [viz DÁVKOVÁNÍ A PODÁVÁNÍ a Použití u konkrétních populací ].
Glaukom a šedý zákal
Glaukom, zvýšený nitrooční tlak a katarakta byly hlášeny u pacientů s astmatem a CHOPN po dlouhodobém podávání inhalačních kortikosteroidů, včetně budesonidu, složky přípravku SYMBICORT. U pacientů se změnou vidění nebo s anamnézou zvýšeného nitroočního tlaku, glaukomu a/nebo katarakty je proto nutné pečlivé sledování.
Účinky léčby přípravkem SYMBICORT 160/4,5, SYMBICORT 80/4,5, formoterolem 4,5 mcg nebo placebem na rozvoj katarakty nebo glaukomu byly hodnoceny u podskupiny 461 pacientů s CHOPN ve 12měsíční studii plicních funkcí. Oční vyšetření byla provedena na začátku, 24. a 52. týdnu. Během randomizovaného léčebného období bylo 26 subjektů (6 %) se zvýšením zadního subkapsulárního skóre z výchozí hodnoty na maximální hodnotu (>0,7). Změny v zadním subkapsulárním skóre > 0,7 od výchozí hodnoty do léčebného maxima se vyskytly u 11 pacientů (9,0 %) ve skupině SYMBICORT 160/4,5, u 4 pacientů (3,8 %) ve skupině SYMBICORT 80/4,5, 5 pacientů (4,2 %) v ve skupině s formoterolem a 6 pacientů (5,2 %) ve skupině s placebem.
Eozinofilní stavy a syndrom Churg-Straussové
Ve vzácných případech se u pacientů užívajících inhalační kortikosteroidy mohou objevit systémové eozinofilní stavy. Někteří z těchto pacientů mají klinické příznaky vaskulitidy odpovídající Churg-Straussově syndromu, což je stav, který je často léčen systémovou kortikosteroidní terapií. Tyto příhody obvykle, ale ne vždy, byly spojeny se snížením a/nebo vysazením léčby perorálními kortikosteroidy po zavedení inhalačních kortikosteroidů. Lékaři by si měli dávat pozor na eozinofilii, vaskulitickou vyrážku, zhoršující se plicní symptomy, srdeční komplikace a/nebo neuropatii vyskytující se u jejich pacientů. Příčinná souvislost mezi budesonidem a těmito základními stavy nebyla stanovena.
Koexistující podmínky
SYMBICORT 4,5 mcg, stejně jako všechny léky obsahující sympatomimetické aminy, by měl být používán s opatrností u pacientů s konvulzivními poruchami nebo tyreotoxikózou a u těch, kteří neobvykle reagují na sympatomimetické aminy. Bylo hlášeno, že dávky příbuzného agonisty beta2-adrenoceptoru albuterolu při intravenózním podání zhoršovaly již existující diabetes mellitus a ketoacidózu.
Hypokalémie a hyperglykémie
Léky s beta-adrenergními agonisty mohou u některých pacientů vyvolat významnou hypokalémii, pravděpodobně prostřednictvím intracelulárního zkratu, který má potenciál vyvolat nepříznivé kardiovaskulární účinky (viz KLINICKÁ FARMAKOLOGIE ]. Pokles sérového draslíku je obvykle přechodný a nevyžaduje suplementaci. Během klinických studií s přípravkem SYMBICORT v doporučených dávkách byly zřídka pozorovány klinicky významné změny hladiny glukózy v krvi a/nebo draslíku v séru.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( INFORMACE PRO PACIENTA a návod k použití ).
Závažné události související s astmatem
Informujte pacienty s astmatem, že LABA, pokud se používá samostatně, zvyšuje riziko hospitalizace související s astmatem nebo úmrtí souvisejícího s astmatem. Dostupné údaje ukazují, že při současném použití IKS a LABA, jako je tomu u přípravku SYMBICORT, nedochází k významnému zvýšení rizika těchto příhod.
Není pro akutní příznaky
Informujte pacienty, že SYMBICORT 160 mg není určen k úlevě od akutních příznaků astmatu nebo CHOPN a že by se za tímto účelem neměly používat další dávky. Poraďte pacientům, aby léčili akutní příznaky inhalačními, krátkodobě působícími beta2-agonisty, jako je albuterol. Poskytněte pacientům takové léky a poučte je, jak by se měly používat.
Poučte pacienty, aby okamžitě vyhledali lékařskou pomoc, pokud zaznamenají některý z následujících stavů:
- Snížení účinnosti inhalačních, krátkodobě působících beta2-agonistů
- Potřeba více inhalací než obvykle u inhalačních, krátkodobě působících beta2-agonistů
- Významné snížení funkce plic, jak nastínil lékař
Řekněte pacientům, že nemají přerušovat léčbu přípravkem SYMBICORT bez doporučení lékaře/poskytovatele, protože symptomy se mohou po vysazení vrátit.
Nepoužívejte další dlouhodobě působící beta2-agonisty
Poučte pacienty, aby nepoužívali jiné LABA pro astma a CHOPN.
Místní efekty
Informujte pacienty, že se u některých pacientů vyskytly lokalizované infekce Candida albicans v ústech a hltanu. Pokud se orofaryngeální kandidóza rozvine, měla by být léčena vhodnou lokální nebo systémovou (tj. perorální) antimykotickou terapií a zároveň pokračovat v léčbě přípravkem SYMBICORT 4,5 mcg, ale někdy může být nutné léčbu přípravkem SYMBICORT dočasně přerušit pod přísným lékařským dohledem. Po vdechnutí se doporučuje vypláchnout ústa vodou bez polknutí, aby se snížilo riziko vzniku afty.
Zápal plic
Pacienti s CHOPN mají vyšší riziko pneumonie; poučte je, aby kontaktovali svého poskytovatele zdravotní péče, pokud se u nich objeví příznaky zápalu plic.
Imunosuprese
Varujte pacienty, kteří jsou na imunosupresivních dávkách kortikosteroidů, aby se vyhnuli expozici planým neštovicím nebo spalničkám, a pokud jsou vystaveni, aby se neprodleně poradili se svým lékařem. Informujte pacienty o možném zhoršení stávající tuberkulózy, plísňových, bakteriálních, virových nebo parazitárních infekcí nebo očního herpes simplex.
Hyperkorticismus a útlum nadledvin
Informujte pacienty, že SYMBICORT může způsobit systémové kortikosteroidní účinky hyperkorticismu a adrenální supresi. Dále informujte pacienty, že během a po přechodu ze systémových kortikosteroidů došlo k úmrtí v důsledku adrenální insuficience. Při přechodu na SYMBICORT by pacienti měli pomalu ustupovat ze systémových kortikosteroidů.
Snížení hustoty kostních minerálů
Informujte pacienty, kteří mají zvýšené riziko snížení BMD, že užívání kortikosteroidů může představovat další riziko.
Snížená rychlost růstu
Informujte pacienty, že perorálně inhalované kortikosteroidy, složka přípravku SYMBICORT, mohou při podávání dětským pacientům způsobit snížení rychlosti růstu. Lékaři by měli pozorně sledovat růst dětí a dospívajících užívajících kortikosteroidy jakoukoli cestou.
Oční efekty
Dlouhodobé užívání inhalačních kortikosteroidů může zvýšit riziko některých očních problémů (katarakta nebo glaukom); zvažte pravidelné oční prohlídky.
Rizika spojená s beta-agonistickou terapií
Informujte pacienty o nežádoucích účincích spojených s beta2agonisty, jako jsou palpitace, bolest na hrudi, zrychlený srdeční tep, třes nebo nervozita.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
budesonid
Dlouhodobé studie byly provedeny na potkanech a myších s perorálním podáváním ke zhodnocení karcinogenního potenciálu budesonidu.
Ve 2leté studii na potkanech Sprague-Dawley způsobil budesonid statisticky významné zvýšení výskytu gliomů u potkaních samců při perorální dávce 50 mcg/kg (přibližně ekvivalentní MRHDID u dospělých a dětí na mcg/m² základ). U samců a samic potkanů nebyla pozorována žádná tumorigenicita při příslušných perorálních dávkách až do 25 a 50 mcg/kg (přibližně ekvivalentní MRHDID u dospělých a dětí na základě mcg/m²). Ve dvou dalších 2letých studiích u samců potkanů Fischer a Sprague-Dawley nezpůsobil budesonid žádné gliomy při perorální dávce 50 mcg/kg (přibližně ekvivalentní MRHDID u dospělých a dětí na základě mcg/m²). U samců potkanů Sprague-Dawley však budesonid způsobil statisticky významné zvýšení výskytu hepatocelulárních nádorů při perorální dávce 50 mcg/kg (přibližně ekvivalentní MRHDID u dospělých a dětí na základě mcg/m²). Souběžné referenční kortikosteroidy (prednisolon a triamcinolon acetonid) v těchto dvou studiích vykazovaly podobné nálezy.
91týdenní studii na myších nezpůsobil budesonid žádnou karcinogenitu související s léčbou při perorálních dávkách až do 200 mcg/kg (přibližně dvojnásobek MRHDID u dospělých a dětí na základě mcg/m²).
Budesonid nebyl mutagenní ani klastogenní v šesti různých testovacích systémech: Ames Salmonella/mikrozomový destičkový test, myší mikronukleový test, myší lymfomový test, test chromozomových aberací v lidských lymfocytech, pohlavně vázaný recesivní letální test u Drosophila melanogaster a analýza opravy DNA u potkana kultury hepatocytů.
Fertilita a reprodukční výkonnost nebyly u potkanů ovlivněny subkutánními dávkami až do 80 mcg/kg (přibližně se rovná MRHDID na základě mcg/m²). Způsobil však snížení prenatální životaschopnosti a životaschopnosti u mláďat při narození a během laktace spolu se snížením přírůstku tělesné hmotnosti matky při subkutánních dávkách 20 mcg/kg a vyšších (méně než MRHDID na základě mcg/m² ). Žádné takové účinky nebyly zaznamenány při dávce 5 mcg/kg (méně než MRHDID na základě mcg/m²).
Formoterol
Dlouhodobé studie byly provedeny na myších s perorálním podáváním a na potkanech za použití inhalačního podávání ke zhodnocení karcinogenního potenciálu formoterol fumarátu.
Ve 24měsíční studii karcinogenity u myší CD-1 způsobil formoterol v perorálních dávkách 100 mcg/kg a vyšších (přibližně 30 a 15násobek MRHDID u dospělých a dětí, v přepočtu na mcg/m²). související zvýšení výskytu děložních leiomyomů.
Ve 24měsíční studii karcinogenity u potkanů Sprague-Dawley byl pozorován zvýšený výskyt mezovariálního leiomyomu a děložního leiomyosarkomu při inhalační dávce 130 mcg/kg (přibližně 70násobek a 35násobek MRHDID u dospělých a dětí, v uvedeném pořadí). mcg/m² základ). Při dávce 22 mcg/kg (přibližně 12násobek a 6násobek MRHDID u dospělých a dětí na základě mcg/m²) nebyly pozorovány žádné nádory.
Další beta-agonistická léčiva podobně prokázala zvýšení počtu leiomyomů genitálního traktu u samic hlodavců. Význam těchto zjištění pro použití u lidí není znám.
Formoterol nebyl mutagenní ani klastogenní v testu Ames Salmonella/mikrozomové destičky, testu myšího lymfomu, testu chromozomové aberace v lidských lymfocytech a testu mikrojader na potkanech.
samců potkanů léčených formoterolem v perorální dávce 15 000 mcg/kg (přibližně 2200násobek MRHDID na základě AUC) bylo identifikováno snížení fertility a/nebo reprodukční výkonnosti. Žádný takový účinek nebyl pozorován při dávce 3000 mcg/kg (přibližně 1600násobek MRHDID na základě mcg/m²). V samostatné studii se samci potkanů léčených perorální dávkou 15 000 mcg/kg (přibližně 8000násobek MRHDID na bázi mcg/m²) byly zjištěny testikulární tubulární atrofie a spermatické zbytky ve varlatech a oligospermie v nadvarlatech. U potkaních samic nebyl zjištěn žádný účinek na fertilitu při dávkách až 15 000 mcg/kg (přibližně 1100násobek MRHDID na základě AUC).
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
Neexistují žádné adekvátní a dobře kontrolované studie přípravku SYMBICORT 160 mg nebo jedné z jeho jednotlivých složek, formoterol fumarátu, u těhotných žen; jsou však dostupné studie pro další složku budesonid. V reprodukčních studiích na zvířatech byl SYMBICORT 4,5 mcg podaný inhalační cestou teratogenní, embryocidní a snižoval hmotnost plodů u potkanů při nižších než maximální doporučená denní inhalační dávka pro člověka (MRHDID) na základě mcg/m². Samotný budesonid podávaný subkutánně byl teratogenní, embryocidní a snižoval hmotnost plodů u potkanů a králíků při nižších hodnotách než MRHDID, ale tyto účinky nebyly pozorovány u potkanů, kteří dostávali inhalační dávky až 4krát vyšší než MRHDID. Studie na těhotných ženách neprokázaly, že by samotný inhalační budesonid zvyšoval riziko abnormalit při podávání během těhotenství. Zkušenosti s perorálními kortikosteroidy naznačují, že hlodavci jsou náchylnější k teratogenním účinkům expozice kortikosteroidům než lidé. Samotný formoterol fumarát podávaný perorálně byl teratogenní u potkanů a králíků při 1600 a 65 000násobku MRHDID. Formoterol fumarát byl také embryocidní, zvýšil ztrátu mláďat při narození a během laktace a snížil hmotnost mláďat u potkanů na 110násobek MRHDID. Tyto nežádoucí účinky se obecně vyskytovaly ve velkých násobcích MRHDID, když byl formoterol fumarát podáván perorálně k dosažení vysokých systémových expozic. U potkanů, kteří dostávali inhalační dávky až 375krát vyšší než MRHDID, nebyly pozorovány žádné teratogenní, embryocidní nebo vývojové účinky.
Odhadované základní riziko závažných vrozených vad a potratu u uvedených populací není známo. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 % až 4 % a 15 % až 20 %.
Klinické úvahy
Mateřské a/nebo embryo/fetální riziko spojené s onemocněním
U žen s nedostatečně nebo středně kontrolovaným astmatem existuje zvýšené riziko několika perinatálních nežádoucích účinků, jako je preeklampsie u matky a nedonošenosti, nízká porodní hmotnost a malé dítě vzhledem ke gestačnímu věku u novorozence. Těhotné ženy s astmatem by měly být pečlivě sledovány a podle potřeby upravována medikace k udržení optimální kontroly astmatu.
Práce nebo dodávka
Neexistují žádné dobře kontrolované studie na lidech, které by zkoumaly účinky přípravku SYMBICORT 4,5 mcg během porodu a porodu. Vzhledem k možné interferenci beta-agonistů s kontraktilitou dělohy by mělo být použití přípravku SYMBICORT 4,5 mcg během porodu omezeno na pacientky, u kterých přínosy jasně převažují nad riziky.
Data
Lidská data
Studie na těhotných ženách neprokázaly, že by inhalovaný budesonid zvyšoval riziko abnormalit při podávání během těhotenství. Výsledky velké populační prospektivní kohortové epidemiologické studie zkoumající data ze tří švédských registrů pokrývajících přibližně 99 % těhotenství v letech 1995-1997 (tj. švédský lékařský registr narození; registr vrozených malformací; registr dětských kardiologických vad) nenaznačují žádné zvýšené riziko na vrozené vývojové vady z užívání inhalačního budesonidu během časného těhotenství. Vrozené malformace byly studovány u dětí v roce 2014 narozených matkám, které uváděly užívání inhalačního budesonidu k léčbě astmatu v časném těhotenství (obvykle 10–12 týdnů po poslední menstruaci), tedy v období, kdy dochází k většině hlavních orgánových malformací. Míra zaznamenaných vrozených vad byla podobná ve srovnání s mírou běžné populace (3,8 % vs. 3,5 %). Kromě toho po expozici inhalačnímu budesonidu byl počet dětí narozených s orofaciálními rozštěpy podobný očekávanému počtu v normální populaci (4 děti vs. 3,3).
Stejná data byla použita ve druhé studii, která přinesla celkový počet 2534 kojencům, jejichž matky byly vystaveny inhalačnímu budesonidu. V této studii se míra vrozených malformací u kojenců, jejichž matky byly vystaveny inhalačnímu budesonidu během časného těhotenství, nelišila od míry u všech novorozenců ve stejném období (3,6 %).
Údaje o zvířatech
SYMBICORT
Ve studii embryo-fetálního vývoje u březích potkanů, kterým byly podávány dávky během období organogeneze od 6. do 16. březosti, vyvolal SYMBICORT 160 mg u plodů pupeční kýlu v dávkách nižších než MRHDID (na základě mcg/m² při inhalačních dávkách matky 12/ 0,66 mcg/kg/den a více). Hmotnost plodu byla snížena na přibližně 5 a 3 násobek MRHDID (na základě AUC při mateřské inhalační dávce 80/4,4 mcg/kg (budesonid/formoterol)). Nebyly zjištěny žádné teratogenní nebo embryocidní účinky při dávkách nižších než MRHDID (na základě mcg/m² při inhalační dávce 2,5/0,14 mcg/kg/den pro matku).
budesonid
Ve studii fertility a reprodukce byly samcům potkanů subkutánně podávány dávky po dobu 9 týdnů a samicím po dobu 2 týdnů před párováním a během období páření. Samice byly dávkovány až do odstavení jejich potomků. Budesonid způsobil snížení prenatální životaschopnosti a životaschopnosti u mláďat při narození a během laktace spolu se snížením přírůstku tělesné hmotnosti matky v dávkách nižších než MRHDID (na základě mcg/m² při subkutánních dávkách matky 20 mcg/ kg/den a více). Žádné takové účinky nebyly zaznamenány při dávce nižší než MRHDID (na základě mcg/m² při subkutánní dávce 5 mcg/kg/den pro matku).
Ve studii embryo-fetálního vývoje u březích králíků, kterým byly podávány dávky během období organogeneze od 6. do 18. dne březosti, způsobil budesonid ztrátu plodu, snížení hmotnosti plodu a kosterní abnormality v dávkách nižších než MRHDID (na základě mcg/m² při subkutánní dávka pro matku 25 mcg/kg/den). Ve studii embryo-fetálního vývoje u březích potkanů, kterým byly podávány dávky během období organogeneze od 6. do 15. dne březosti, vyvolal budesonid podobné nežádoucí účinky na plod v dávkách přibližně 8násobku MRHDID (na základě mcg/m² při subkutánní dávce 500 mcg/kg/den). V další studii embryo-fetálního vývoje u březích potkanů nebyly pozorovány žádné teratogenní nebo embryocidní účinky při dávkách až 4krát vyšších než MRHDID (na základě mcg/m² při inhalačních dávkách až 250 mcg/kg/den).
Ve studii peri- a postnatálního vývoje u potkanů, kterým byla dávka od 15. dne březosti do 21. dne po porodu podávána, neměl budesonid žádný vliv na porod, ale měl vliv na růst a vývoj potomstva. Přežití potomků bylo sníženo a přeživší potomci měli sníženou průměrnou tělesnou hmotnost při narození a během laktace při dávkách nižších než MRHDID a vyšších (na základě mcg/m² při subkutánních dávkách matek 20 mcg/kg/den a vyšších). K těmto zjištěním došlo v přítomnosti mateřské toxicity.
Formoterol
Ve studii fertility a reprodukce byly samcům potkanů perorálně podávány dávky po dobu 9 týdnů a samicím po dobu 2 týdnů před párováním a během období páření. Samice byly podávány buď do 19. dne březosti nebo až do odstavení jejich potomků. Samcům byla podávána dávka až do 25. týdne. Pupeční kýla byla pozorována u plodů potkanů při perorálních dávkách 1600krát a vyšších než MRHDID (na základě mcg/m² při perorálních dávkách matek 3000 mcg/kg/den a vyšších). Brachygnatie byla pozorována u plodů potkanů při dávce 8000krát vyšší než MRHDID (na základě mcg/m² při perorální dávce 15 000 mcg/kg/den pro matku). Těhotenství bylo prodlouženo dávkou 8000krát vyšší než MRHDID (na základě mcg/m² při perorální dávce 15 000 mcg/kg/den pro matku). K úmrtí plodu a mláďat došlo při dávkách přibližně 1600krát vyšší než MRHDID a vyšších (na základě mcg/m² při perorálních dávkách 3000 mcg/kg/den a vyšších) během březosti.
Ve studii embryo-fetálního vývoje u březích potkanů, kterým byly podávány dávky během období organogeneze od 6. do 15. dne březosti, nebyly pozorovány žádné teratogenní, embryocidní nebo vývojové účinky při dávkách až 375násobku MRHDID (na základě mcg/m² s inhalací matkou dávky až 690 mcg/kg/den).
Ve studii embryo-fetálního vývoje u březích králíků, kterým byly podávány dávky během období organogeneze od 6. do 18. dne březosti, byly u plodů pozorovány subkapsulární cysty na játrech při dávce 65 000krát vyšší než MRHDID (na základě mcg/m² u matky perorální dávka 60 000 mcg/kg/den). Nebyly pozorovány žádné teratogenní účinky při dávkách až 3800krát vyšší než MRHDID (na základě mcg/m² při perorálních dávkách až 3500 mcg/kg/den).
Ve studii prenatálního a postnatálního vývoje dostávaly březí samice potkanů formoterol v perorálních dávkách 0, 210, 840 a 3400 mcg/kg/den od 6. dne březosti až do období laktace. Přežití mláďat bylo sníženo od narození do 26. dne po porodu při dávkách 110krát vyšší než MRHDID a vyšších (na základě mcg/m² při perorálních dávkách matek 210 mcg/kg/den a vyšších), ačkoli neexistoval žádný důkaz o reakci na dávku vztah. Nebyly zjištěny žádné účinky související s léčbou na fyzický, funkční a behaviorální vývoj mláďat potkanů.
Laktace
Shrnutí rizik
Nejsou k dispozici žádné údaje o účincích přípravku SYMBICORT 4,5 mcg, budesonidu nebo formoterol fumarátu na kojené dítě nebo na tvorbu mléka. Budesonid, stejně jako jiné inhalační kortikosteroidy, je přítomen v lidském mléce [viz Data ]. Nejsou k dispozici žádné údaje o přítomnosti formoterol-fumarátu v mateřském mléce. Formoterol fumarát je přítomen v mléce potkanů [viz Data ]. Vývojové a zdravotní přínosy kojení by měly být zváženy spolu s klinickou potřebou matky SYMBICORT 4,5 mcg a případnými nežádoucími účinky na kojené dítě ze SYMBICORT 160 mg nebo ze základního stavu matky.
Data
Údaje u lidí s budesonidem podávaným prostřednictvím inhalátoru suchého prášku naznačují, že celková denní perorální dávka budesonidu dostupná v mateřském mléce pro kojence je přibližně 0,3 % až 1 % dávky inhalované matkou (viz KLINICKÁ FARMAKOLOGIE ]. U přípravku SYMBICORT 4,5 mcg se očekává, že dávka budesonidu dostupná pro kojence v mateřském mléce, jako procento mateřské dávky, bude podobná.
Ve studii fertility a reprodukce u potkanů byly plazmatické hladiny formoterolu měřeny u mláďat 15. den po narození [viz Použití u konkrétních populací ]. Bylo odhadnuto, že maximální plazmatická koncentrace, kterou mláďata obdržela od matky, při nejvyšší dávce 15 mg/kg, po kojení byla 4,4 % (0,24 nmol/l pro vrh vs. 5,5 nmol/l pro matku) .
Pediatrické použití
Bezpečnost a účinnost přípravku SYMBICORT u pacientů s astmatem ve věku 12 let a starších byla stanovena ve studiích trvajících až 12 měsíců. Ve dvou 12týdenních, dvojitě zaslepených, placebem kontrolovaných klíčových studiích v USA bylo 25 pacientů ve věku 12 až 17 let léčeno přípravkem SYMBICORT dvakrát denně [viz Klinické studie ]. Výsledky účinnosti v této věkové skupině byly podobné jako u pacientů ve věku 18 let a starších. Nebyly žádné zjevné rozdíly v typu nebo frekvenci nežádoucích účinků hlášených v této věkové skupině ve srovnání s pacienty ve věku 18 let a staršími.
Bezpečnost a účinnost přípravku SYMBICORT 80/4,5 u pacientů s astmatem ve věku 6 až méně než 12 let byla stanovena ve studiích trvajících až 12 týdnů [viz Klinické studie ]. Bezpečnostní profil u těchto pacientů byl konzistentní s profilem pozorovaným u pacientů ve věku 12 let a starších, kteří také dostávali SYMBICORT (viz NEŽÁDOUCÍ REAKCE ].
Bezpečnost a účinnost přípravku SYMBICORT 160 mg u pacientů s astmatem mladších 6 let nebyla stanovena.
Kontrolované klinické studie prokázaly, že perorálně inhalované kortikosteroidy včetně budesonidu, složky přípravku SYMBICORT, mohou u dětských pacientů způsobit snížení rychlosti růstu. Tento účinek byl pozorován při absenci laboratorních důkazů suprese osy HPA, což naznačuje, že rychlost růstu je citlivějším indikátorem systémové expozice kortikosteroidům u pediatrických pacientů než některé běžně používané testy funkce osy HPA. Dlouhodobý účinek tohoto snížení rychlosti růstu spojeného s perorálně inhalovanými kortikosteroidy, včetně dopadu na konečnou výšku, není znám. Potenciál „catch-up“ růstu po přerušení léčby perorálně inhalovanými kortikosteroidy nebyl dostatečně studován.
Ve studii s astmatickými dětmi ve věku 5 až 12 let došlo u pacientů léčených budesonidem DPI 200 mcg dvakrát denně (n=311) na konci jednoho roku ke snížení růstu o 1,1 centimetru ve srovnání s těmi, kteří dostávali placebo (n=418). ; rozdíl mezi těmito dvěma léčebnými skupinami se během tří let dodatečné léčby dále nezvětšil. Na konci 4 let měly děti léčené budesonidem DPI a děti léčené placebem podobnou rychlost růstu. Závěry vyvozené z této studie mohou být zkresleny nerovnoměrným používáním kortikosteroidů v léčebných skupinách a zahrnutím údajů od pacientů, kteří v průběhu studie dosáhli puberty.
Růst dětských pacientů užívajících perorálně inhalační kortikosteroidy, včetně přípravku SYMBICORT, by měl být monitorován. Pokud se zdá, že dítě nebo dospívající užívající jakýkoli kortikosteroid má supresi růstu, je třeba vzít v úvahu možnost, že je na tento účinek obzvláště citlivý. Potenciální růstové účinky prodloužené léčby by měly být zváženy oproti získaným klinickým přínosům. Aby se minimalizovaly systémové účinky perorálně inhalovaných kortikosteroidů, včetně SYMBICORTU, měl by být každý pacient titrován na nejnižší sílu, která účinně kontroluje jeho astma [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Geriatrické použití
Z celkového počtu pacientů s astmatem léčených přípravkem SYMBICORT 160 mg dvakrát denně ve dvou 12týdenních studiích a 26týdenní postmarketingové studii bylo 791 ve věku 65 let nebo více, z nichž 141 bylo ve věku 75 let nebo více.
Ve studiích CHOPN trvajících 6 až 12 měsíců bylo 810 pacientů léčených přípravkem SYMBICORT 160/4,5 dvěma inhalacemi dvakrát denně ve věku 65 let a více a z toho bylo 177 pacientů ve věku 75 let a více. Mezi těmito pacienty a mladšími pacienty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti a jiné hlášené klinické zkušenosti neidentifikovaly rozdíly v odpovědích mezi staršími a mladšími pacienty.
Stejně jako u jiných přípravků obsahujících beta2-agonisty je třeba dbát zvláštní opatrnosti při používání SYMBICORTU u geriatrických pacientů, kteří mají souběžné kardiovaskulární onemocnění, které by mohlo být beta2-agonisty nepříznivě ovlivněno.
Na základě dostupných údajů pro SYMBICORT nebo jeho aktivní složky není opodstatněná žádná úprava dávkování SYMBICORTU 4,5 mcg u geriatrických pacientů.
Poškození jater
Formální farmakokinetické studie s použitím přípravku SYMBICORT nebyly provedeny u pacientů s poruchou funkce jater. Protože však budesonid i formoterol fumarát jsou převážně odstraňovány jaterním metabolismem, může poškození jaterních funkcí vést k akumulaci budesonidu a formoterol fumarátu v plazmě. Pacienti s onemocněním jater by proto měli být pečlivě sledováni.
Renální poškození
Formální farmakokinetické studie s použitím přípravku SYMBICORT nebyly provedeny u pacientů s poruchou funkce ledvin.
PŘEDÁVKOVAT
SYMBICORT
SYMBICORT obsahuje budesonid i formoterol; proto se na SYMBICORT vztahují rizika spojená s předávkováním jednotlivých složek popsaných níže. Ve farmakokinetických studiích byly pacientům s CHOPN podávány jednotlivé dávky 960/54 mcg (12 aktivací SYMBICORT 80/4,5) a 1280/36 mcg (8 aktivací 160/4,5). Celkem 1920/54 mcg (12 aktivací SYMBICORTU 160/4,5) bylo podáno jako jedna dávka zdravým subjektům i pacientům s astmatem. V dlouhodobé aktivně kontrolované bezpečnostní studii u dospívajících a dospělých pacientů s astmatem ve věku 12 let a starších byl SYMBICORT 160/4,5 podáván po dobu až 12 měsíců v dávkách až do dvojnásobku nejvyšší doporučené denní dávky. V žádné z těchto studií nebyly pozorovány žádné klinicky významné nežádoucí účinky.
budesonid
Možnost akutních toxických účinků po předávkování budesonidem je nízká. Pokud jsou používány v nadměrných dávkách po delší dobu, mohou se objevit systémové kortikosteroidní účinky, jako je hyperkorticismus (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Budesonid v pětinásobku nejvyšší doporučené dávky (3200 mcg denně) podávaný lidem po dobu 6 týdnů způsobil významné snížení (27 %) odpovědi plazmatického kortizolu na 6hodinovou infuzi ACTH ve srovnání s placebem (+1 %). Odpovídajícím účinkem 10 mg prednisonu denně bylo 35% snížení odpovědi plazmatického kortizolu na ACTH.
Formoterol
Předávkování formoterolem by pravděpodobně vedlo k zveličení účinků, které jsou typické pro beta2agonisty: záchvaty, angina pectoris, hypertenze, hypotenze, tachykardie, síňové a ventrikulární tachyarytmie, nervozita, bolest hlavy, třes, bušení srdce, svalové křeče, nevolnost, závratě, poruchy spánku , metabolická acidóza, hyperglykémie, hypokalémie. Stejně jako u všech sympatomimetických léků může být se zneužíváním formoterolu spojena zástava srdce a dokonce smrt. Nebyly pozorovány žádné klinicky významné nežádoucí účinky, když byl formoterol podáván dospělým pacientům s akutní bronchokonstrikcí v dávce 90 mcg/den po dobu 3 hodin nebo stabilním astmatikům 3krát denně v celkové dávce 54 mcg/den po dobu 3 dnů.
Léčba předávkování formoterolem spočívá ve vysazení medikace spolu se zahájením vhodné symptomatické a/nebo podpůrné terapie. Je možné zvážit uvážlivé použití kardioselektivního blokátoru beta-receptorů, přičemž je třeba mít na paměti, že taková léčba může vyvolat bronchospasmus. Neexistují dostatečné důkazy ke stanovení, zda je dialýza prospěšná při předávkování formoterolem. V případě předávkování se doporučuje monitorování srdce.
KONTRAINDIKACE
Použití přípravku SYMBICORT je kontraindikováno za následujících podmínek:
- Primární léčba status astmaticus nebo jiných akutních epizod astmatu nebo CHOPN, kde jsou nutná intenzivní opatření.
- Přecitlivělost na kteroukoli složku přípravku SYMBICORT.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
SYMBICORT
SYMBICORT obsahuje budesonid i formoterol; proto se na SYMBICORT vztahují níže popsané mechanismy účinku pro jednotlivé složky. Tyto léky představují dvě třídy léků (syntetický kortikosteroid a dlouhodobě působící selektivní agonista beta2-adrenoceptoru), které mají různé účinky na klinické, fyziologické a zánětlivé ukazatele CHOPN a astmatu.
budesonid
Budesonid je protizánětlivý kortikosteroid, který vykazuje silnou glukokortikoidní aktivitu a slabou mineralokortikoidní aktivitu. Ve standardních in vitro a zvířecích modelech má budesonid přibližně 200krát vyšší afinitu ke glukokortikoidnímu receptoru a 1000krát vyšší topickou protizánětlivou účinnost než kortizol (test ušního edému krysího krotonového oleje). Jako měřítko systémové aktivity je budesonid 40krát účinnější než kortizol při subkutánním podání a 25krát účinnější při perorálním podání v testu involuce brzlíku u potkana.
Ve studiích afinity ke glukokortikoidnímu receptoru byla forma budesonidu 22R dvakrát tak aktivní než epimer 22S. Studie in vitro ukázaly, že tyto dvě formy budesonidu se vzájemně nekonvertují.
Zánět je důležitou složkou v patogenezi CHOPN a astmatu. Kortikosteroidy mají širokou škálu inhibičních aktivit proti více typům buněk (např. žírné buňky, eozinofily, neutrofily, makrofágy a lymfocyty) a mediátorům (např. histamin, eikosanoidy, leukotrieny a cytokiny), které se podílejí na alergických a nealergických reakcích zánět. Tyto protizánětlivé účinky kortikosteroidů mohou přispívat k jejich účinnosti u CHOPN a astmatu.
Studie u astmatických pacientů prokázaly příznivý poměr mezi lokální protizánětlivou aktivitou a systémovými účinky kortikosteroidů v širokém rozmezí dávek budesonidu. To je vysvětleno kombinací relativně vysokého lokálního protizánětlivého účinku, rozsáhlé degradace perorálně absorbovaného léčiva při prvním průchodu játry (85 %-95 %) a nízké účinnosti vytvořených metabolitů.
Formoterol
Formoterol fumarát je dlouhodobě působící selektivní beta2-adrenergní agonista (beta2-agonista) s rychlým nástupem účinku. Inhalovaný formoterol fumarát působí lokálně v plicích jako bronchodilatátor. Studie in vitro ukázaly, že formoterol má více než 200krát vyšší agonistickou aktivitu na beta2-receptorech než na beta1receptorech. In vitro vazebná selektivita na beta2-nad beta1-adrenoceptory je vyšší pro formoterol než pro albuterol (5krát), zatímco salmeterol má vyšší (3krát) poměr beta2-selektivity než formoterol.
Ačkoli beta2-receptory jsou převládajícími adrenergními receptory v hladkém svalstvu průdušek a beta1receptory jsou převládajícími receptory v srdci, existují také beta2-receptory v lidském srdci, které tvoří 10 % až 50 % celkových beta-adrenergních receptorů. Přesná funkce těchto receptorů nebyla stanovena, ale zvyšují možnost, že i vysoce selektivní beta2-agonisté mohou mít účinky na srdce.
Farmakologické účinky léků na bázi agonistů beta2-adrenoceptorů, včetně formoterolu, lze alespoň částečně připsat stimulaci intracelulární adenylcyklázy, enzymu, který katalyzuje konverzi adenosintrifosfátu (ATP) na cyklický-3',5'-adenosinmonofosfát ( cyklický AMP). Zvýšené hladiny cyklického AMP způsobují relaxaci hladkého svalstva průdušek a inhibici uvolňování mediátorů okamžité hypersenzitivity z buněk, zejména ze žírných buněk.
Testy in vitro ukazují, že formoterol je inhibitorem uvolňování mediátorů žírných buněk, jako jsou histamin a leukotrieny, z lidských plic. Formoterol také inhibuje histaminem indukovanou extravazaci plazmatického albuminu u anestetizovaných morčat a inhibuje alergenem indukovaný příliv eozinofilů u psů s hyperreaktivitou dýchacích cest. Význam těchto in vitro a zvířecích nálezů pro člověka není znám.
Farmakodynamika
Astma
Kardiovaskulární účinky
Ve zkřížené studii s jednorázovou dávkou zahrnující 201 pacientů s perzistujícím astmatem byla léčba jednorázovou dávkou 4,5, 9 a 18 mcg formoterolu v kombinaci s 320 mcg budesonidu podávaného prostřednictvím SYMBICORTU srovnávána se samotným budesonidem 320 mcg. V porovnání s budesonidem byla prokázána zlepšení FEV1 na základě dávky. Po dávce byly získány EKG a vzorky krve na glukózu a draslík. U přípravku SYMBICORT 4,5 mcg bylo pozorováno malé průměrné zvýšení sérové glukózy a snížení sérového draslíku (+0,44 mmol/la -0,18 mmol/l při nejvyšší dávce) se zvyšujícími se dávkami formoterolu ve srovnání s budesonidem. V EKG způsobil SYMBICORT malé průměrné zvýšení srdeční frekvence závislé na dávce (přibližně 3 tepy za minutu při nejvyšší dávce) a intervaly QTc (3–6 ms) ve srovnání se samotným budesonidem. Žádný subjekt neměl hodnotu QT nebo QTc ≥500 ms.
Ve Spojených státech pět 12týdenních, aktivním a placebem kontrolovaných studií a jedna 6měsíční aktivně kontrolovaná studie hodnotila 2976 pacientů ve věku 6 let a starších s astmatem. Systémové farmakodynamické účinky formoterolu (srdeční/puls, krevní tlak, QTc interval, draslík a glukóza) byly podobné u pacientů léčených přípravkem SYMBICORT ve srovnání s pacienty léčenými formoterolem ve formě suchého inhalačního prášku 4,5 mcg, 2 inhalace dvakrát denně. Žádný pacient neměl během léčby hodnotu QT nebo QTc ≥500 ms.
Ve třech placebem kontrolovaných studiích u dospívajících a dospělých s astmatem ve věku 12 let a starších mělo celkem 1232 pacientů (553 pacientů ve skupině SYMBICORT 160 mg) hodnotitelné nepřetržité 24hodinové elektrokardiografické monitorování. Celkově nebyly zjištěny žádné významné rozdíly ve výskytu ventrikulární nebo supraventrikulární ektopie a žádný důkaz zvýšeného rizika klinicky významné dysrytmie ve skupině SYMBICORT 160 mg ve srovnání s placebem.
Efekty osy HPA
Celkově nebyly u dospělých nebo dospívajících pacientů léčených přípravkem SYMBICORT v dávkách až 640/18 mcg/den ve srovnání s budesonidem pozorovány žádné klinicky významné účinky na osu HPA, měřeno 24hodinovým kortizolem v moči.
Chronická obstrukční plicní nemoc
Kardiovaskulární účinky
Ve dvou studiích funkce plic s CHOPN, trvajících 6 měsíců a 12 měsíců, zahrnujících 3668 pacientů s CHOPN, nebyly pozorovány žádné klinicky významné rozdíly v tepové frekvenci, krevním tlaku, draslíku a glukóze mezi SYMBICORTem, jednotlivými složkami SYMBICORTU 160 mg, a placebem (viz Klinické studie ].
EKG zaznamenané při více klinických návštěvách při léčbě v obou studiích neprokázaly žádné klinicky významné rozdíly srdeční frekvence, PR intervalu, trvání QRS, srdeční frekvence, známek srdeční ischemie nebo arytmií mezi monoprodukty SYMBICORT 160/4,5 a placebem, vše podané jako 2 inhalace dvakrát denně. Na základě EKG se u 6 pacientů léčených přípravkem SYMBICORT 160/4,5, u 6 pacientů léčených formoterolem 4,5 mcg a u 6 pacientů ve skupině s placebem objevila fibrilace síní nebo flutter, které nebyly na začátku přítomny. Ve skupinách užívajících SYMBICORT 160/4,5, formoterol 4,5 mcg nebo placebo nebyly žádné případy přetrvávající ventrikulární tachykardie.
Ve 12měsíční studii mělo 520 pacientů hodnotitelné kontinuální 24hodinové (Holterovo) monitorování EKG před první dávkou a přibližně po 1 a 4 měsících léčby. Mezi skupinami léčenými přípravkem SYMBICORT 160/4,5, formoterolem nebo placebem užívanými ve 2 inhalacích dvakrát denně nebyly pozorovány žádné klinicky významné rozdíly v komorových nebo supraventrikulárních arytmiích, komorových nebo supraventrikulárních ektopických tepech nebo srdeční frekvenci. Na základě monitorování EKG (Holter) se u jednoho pacienta na SYMBICORTU 160/4,5, u žádného pacienta na formoterolu 4,5 mcg a u tří pacientů ve skupině s placebem objevila fibrilace síní nebo flutter, které nebyly na začátku přítomny.
Efekty osy HPA
24 hodinová měření kortizolu v moči byla shromážděna u souhrnné podskupiny (n=616) pacientů ze dvou studií funkce plic s CHOPN. Údaje naznačovaly přibližně o 30 % nižší průměrné 24hodinové hodnoty volného kortizolu v moči po chronickém podávání (> 6 měsíců) přípravku SYMBICORT ve srovnání s placebem. Zdá se, že SYMBICORT 4,5 mcg vykazuje srovnatelnou supresi kortizolu jako budesonid 160 mcg samotný nebo současné podávání budesonidu 160 mcg a formoterolu 4,5 mcg. U pacientů léčených přípravkem SYMBICORT 160 mg nebo placebem po dobu až 12 měsíců bylo procento pacientů, u kterých došlo k posunu z normálního na nízké pro toto opatření, obecně srovnatelné.
Další produkty Budesonid
Aby se potvrdilo, že systémová absorpce není významným faktorem v klinické účinnosti inhalovaného budesonidu, byla provedena klinická studie u pacientů s astmatem, která porovnávala 400 mcg budesonidu podávaného pomocí tlakového inhalátoru s odměřenou dávkou s rozpěrkou trubice se 1400 mcg perorálního budesonidu a placeba . Studie prokázala účinnost inhalačního budesonidu, ale ne perorálně podaného budesonidu, a to i přes srovnatelné systémové hladiny. Terapeutický účinek konvenčních dávek perorálně inhalovaného budesonidu se tedy z velké části vysvětluje jeho přímým působením na dýchací cesty.
Bylo prokázáno, že inhalovaný budesonid snižuje reaktivitu dýchacích cest vůči různým modelům expozice, včetně histaminu, metacholinu, disiřičitanu sodného a adenosinmonofosfátu u pacientů s hyperreaktivními dýchacími cestami. Klinický význam těchto modelů není jistý.
Předběžná léčba inhalačním budesonidem v dávce 1600 mcg denně (800 mcg dvakrát denně) po dobu 2 týdnů snížila akutní (reakce v rané fázi) a opožděnou (reakce v pozdní fázi) pokles FEV1 po stimulaci inhalačním alergenem.
Systémové účinky inhalačních kortikosteroidů souvisí se systémovou expozicí těmto lékům. Farmakokinetické studie prokázaly, že u dospělých i dětí s astmatem je systémová expozice budesonidu nižší u SYMBICORTU 160 mg ve srovnání s inhalačním budesonidem podávaným ve stejné dodané dávce pomocí inhalátoru suchého prášku [viz KLINICKÁ FARMAKOLOGIE ]. Proto by se očekávalo, že systémové účinky (osa HPA a růst) budesonidu dodávaného ze SYMBICORTU nebudou větší, než jaké se uvádí pro inhalovaný budesonid při podávání ve srovnatelných dávkách pomocí inhalátoru suchého prášku [viz Použití u konkrétních populací ].
Efekty osy HPA
Účinky inhalovaného budesonidu podávaného prostřednictvím inhalátoru suchého prášku na osu HPA byly studovány u 905 dospělých a 404 pediatrických pacientů s astmatem. U většiny pacientů zůstala schopnost zvýšit produkci kortizolu v reakci na stres, hodnocená testem stimulace kosyntropinem (ACTH), nedotčena při léčbě budesonidem v doporučených dávkách. U dospělých pacientů léčených 100, 200, 400 nebo 800 mcg dvakrát denně po dobu 12 týdnů mělo 4 %, 2 %, 6 % a 13 %, v tomto pořadí, abnormální stimulovanou odpověď kortizolu (zhodnoceno maximum kortizolu
Další přípravky Formoterol
Zatímco farmakodynamický účinek je prostřednictvím stimulace beta-adrenergních receptorů, nadměrná aktivace těchto receptorů obvykle vede k třesu a křečím kosterního svalstva, nespavosti, tachykardii, poklesu plazmatického draslíku a zvýšení plazmatické glukózy. Inhalovaný formoterol, stejně jako jiné beta2-adrenergní agonisty, může vyvolat kardiovaskulární účinky závislé na dávce a účinky na hladinu glukózy v krvi a/nebo draslík v séru (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Pro SYMBICORT 160 mg jsou tyto účinky podrobně popsány v části Klinická farmakologie, farmakodynamika, SYMBICORT (12.2).
Použití léků LABA může vést k toleranci k bronchoprotektivním a bronchodilatačním účinkům.
Rebound bronchiální hyperreaktivita po ukončení chronické dlouhodobě působící léčby beta-agonisty nebyla pozorována.
Farmakokinetika
SYMBICORT
Vstřebávání
budesonid
Zdravé předměty
Perorálně inhalovaný budesonid se rychle vstřebává v plicích a maximální koncentrace je typicky dosaženo do 20 minut. Po perorálním podání budesonidu bylo maximální plazmatické koncentrace dosaženo přibližně za 1 až 2 hodiny a absolutní systémová dostupnost byla 6 %-13 % v důsledku rozsáhlého metabolismu prvního průchodu játry. Naproti tomu většina budesonidu dodaného do plic byla systémově absorbována. U zdravých subjektů bylo 34 % odměřené dávky uloženo v plicích (jak bylo stanoveno metodou plazmatické koncentrace a za použití inhalátoru suchého prášku obsahujícího budesonid) s absolutní systémovou dostupností 39 % odměřené dávky.
Po podání SYMBICORTU 160/4,5 ve dvou nebo čtyřech inhalacích dvakrát denně po dobu 5 dnů u zdravých jedinců se plazmatická koncentrace budesonidu obecně zvyšovala úměrně dávce. Index akumulace pro skupinu, která dostávala 2 inhalace dvakrát denně, byl 1,32 pro budesonid.
Pacienti s astmatem
Ve studii s jednorázovou dávkou byly pacientům se středně těžkým astmatem podávány vyšší než doporučené dávky přípravku SYMBICORT (12 inhalací přípravku SYMBICORT 160/4,5). Maximální plazmatická koncentrace budesonidu 4,5 nmol/l byla dosažena 20 minut po podání dávky. Tato studie prokázala, že celková systémová expozice budesonidu u přípravku SYMBICORT 4,5 mcg byla přibližně o 30 % nižší než u inhalovaného budesonidu prostřednictvím inhalátoru suchého prášku (DPI) při stejné podané dávce. Po podání přípravku SYMBICORT byl poločas budesonidové složky 4,7 hodiny.
Ve studii s opakovanými dávkami byla nejvyšší doporučená dávka přípravku SYMBICORT (160/4,5, dvě inhalace dvakrát denně) podávána pacientům se středně těžkým astmatem a zdravým subjektům po dobu 1 týdne. Maximální plazmatická koncentrace budesonidu 1,2 nmol/l se u pacientů s astmatem objevila za 21 minut. Maximální plazmatická koncentrace budesonidu byla u pacientů s astmatem o 27 % nižší než u zdravých subjektů. Celková systémová expozice budesonidu však byla srovnatelná s expozicí u pacientů s astmatem.
Maximální rovnovážné plazmatické koncentrace budesonidu podávaného pomocí DPI u dospělých s astmatem byly v průměru 0,6 a 1,6 nmol/l při dávkách 180 mcg a 360 mcg dvakrát denně. U astmatických pacientů vykazoval budesonid lineární zvýšení AUC a Cmax se zvyšující se dávkou po jednorázovém i opakovaném podání inhalačního budesonidu.
Pacienti s CHOPN
Ve studii s jednorázovou dávkou bylo pacientům s CHOPN podáno 12 inhalací přípravku SYMBICORT 80/4,5 (celková dávka 960/54 mcg). Průměrná maximální plazmatická koncentrace budesonidu 3,3 nmol/l se objevila 30 minut po podání. Systémová expozice budesonidu byla srovnatelná mezi SYMBICORT pMDI a současným podáváním budesonidu prostřednictvím inhalátoru s odměřenými dávkami a formoterolu prostřednictvím inhalátoru suchého prášku (budesonid 960 mcg a formoterol 54 mcg). Ve stejné studii byla otevřená skupina pacientů se středně těžkým astmatem rovněž léčena stejnou vyšší dávkou přípravku SYMBICORT. U budesonidu vykazovali pacienti s CHOPN o 12 % vyšší AUC a o 10 % nižší Cmax ve srovnání s pacienty s astmatem.
6měsíční pivotní klinické studii plicních funkcí byly získány farmakokinetické údaje budesonidu v ustáleném stavu u podskupiny pacientů s CHOPN s léčebnými rameny SYMBICORT 4,5 mcg pMDI 160/4,5, SYMBICORT 160 mg pMDI 80/4,5, budesonid 160 budesonid 160 mcg a formoterol 4,5 mcg podávané společně, vše podáváno jako 2 inhalace dvakrát denně. Systémová expozice budesonidu (AUC a Cmax) se úměrně zvýšila s dávkami od 80 mcg do 160 mcg a byla obecně podobná mezi 3 léčebnými skupinami, které dostávaly stejnou dávku budesonidu (SYMBICORT 4,5 mcg pMDI 160/4,5, budesonid 160 mcg, 0 budesonid a 16 formoterol 4,5 mcg podávaný společně).
Formoterol
Inhalovaný formoterol se rychle vstřebává; maximálních plazmatických koncentrací je typicky dosaženo při prvním odběru plazmy, během 5-10 minut po podání dávky. Stejně jako u mnoha léčivých přípravků pro orální inhalaci je pravděpodobné, že většina dodaného inhalovaného formoterolu je spolknuta a poté absorbována z gastrointestinálního traktu.
Zdravé předměty
Po podávání SYMBICORTU (160/4,5, dvě nebo čtyři inhalace dvakrát denně) po dobu 5 dnů zdravým subjektům se plazmatická koncentrace formoterolu obecně zvýšila úměrně dávce. Akumulační index pro skupinu, která dostávala 2 inhalace dvakrát denně, byl 1,77 pro formoterol.
Pacienti s astmatem
Ve studii s jednorázovou dávkou byly pacientům se středně těžkým astmatem podávány vyšší než doporučené dávky přípravku SYMBICORT (12 inhalací přípravku SYMBICORT 160/4,5). Maximální plazmatická koncentrace formoterolu 136 pmol byla dosažena 10 minut po podání dávky. Přibližně 8 % podané dávky formoterolu bylo nalezeno v moči jako nezměněné léčivo.
Ve studii s opakovanými dávkami byla nejvyšší doporučená dávka přípravku SYMBICORT (160/4,5, dvě inhalace dvakrát denně) podávána pacientům se středně těžkým astmatem a zdravým subjektům po dobu 1 týdne. Maximální plazmatická koncentrace formoterolu 28 pmol/l se u pacientů s astmatem objevila za 10 minut. Maximální plazmatická koncentrace formoterolu byla u pacientů s astmatem asi o 42 % nižší než u zdravých subjektů. Celková systémová expozice formoterolu však byla srovnatelná s expozicí u pacientů s astmatem.
Pacienti s CHOPN
Po jednorázovém podání 12 inhalací přípravku SYMBICORT 80/4,5 bylo rychle dosaženo průměrné maximální plazmatické koncentrace formoterolu 167 pmol/l za 15 minut po podání. Expozice formoterolu byla mírně vyšší (~16-18 %) ze SYMBICORTU 160 mg pMDI ve srovnání se současným podáváním budesonidu prostřednictvím inhalátoru s odměřenými dávkami a formoterolu prostřednictvím inhalátoru suchého prášku (celková dávka budesonidu 960 mcg a formoterolu 54 mcg). Ve stejné studii byla otevřená skupina pacientů se středně těžkým astmatem léčena stejnou dávkou přípravku SYMBICORT. Pacienti s CHOPN vykazovali o 12–15 % vyšší AUC a Cmax formoterolu ve srovnání s pacienty s astmatem.
6měsíční pivotní klinické studii plicních funkcí byly získány farmakokinetické údaje formoterolu v ustáleném stavu u podskupiny pacientů s CHOPN s léčebnými rameny SYMBICORT 160 mg pMDI 160/4,5, SYMBICORT 160 mg pMDI 80/4,5, formoterol00gson budeg,65. mcg a formoterol 4,5 mcg podávané společně, vše podáváno jako 2 inhalace dvakrát denně. Systémová expozice formoterolu, jak dokládá AUC, byla asi o 30 % a 16 % vyšší u SYMBICORT pMDI ve srovnání s léčebným ramenem samotným formoterolem a souběžným podáváním jednotlivých složek budesonidu a formoterolu, v daném pořadí.
Rozdělení
budesonid
Distribuční objem budesonidu byl přibližně 3 l/kg. Na plazmatické proteiny se vázal z 85–90 %. Vazba na proteiny byla konstantní v celém koncentračním rozsahu (1-100 nmol/l) dosaženém a překročení doporučených inhalačních dávek. Budesonid vykazoval malou nebo žádnou vazbu na globulin vázající kortikosteroidy. Budesonid se rychle ekvilibroval s červenými krvinkami způsobem nezávislým na koncentraci s poměrem krevní plazmy asi 0,8.
Formoterol
V rozmezí koncentrací 10-500 nmol/l byla vazba na plazmatické proteiny pro RR a SS enantiomery formoterolu 46 % a 58 %. Koncentrace formoterolu použité k posouzení vazby na plazmatické proteiny byly vyšší než koncentrace dosažené v plazmě po inhalaci jedné dávky 54 mcg.
Metabolismus
budesonid
Studie in vitro s homogenáty lidských jater ukázaly, že budesonid byl rychle a rozsáhle metabolizován. Byly izolovány dva hlavní metabolity tvořené izoenzymem 3A4 (CYP3A4) katalyzovanou biotransformací cytochromu P450 (CYP) a identifikovány jako 16α-hydroxyprednisolon a 6ß-hydroxybudesonid. Kortikosteroidní aktivita každého z těchto dvou metabolitů byla nižší než 1 % aktivity původní sloučeniny. Nebyly zjištěny žádné kvalitativní rozdíly mezi metabolickými vzory in vitro a in vivo. V preparátech lidských plic a séra byla pozorována zanedbatelná metabolická inaktivace.
Formoterol
Primární metabolismus formoterolu probíhá přímou glukuronidací a O-demethylací s následnou konjugací na neaktivní metabolity. Sekundární metabolické dráhy zahrnují deformylaci a sulfátovou konjugaci. CYP2D6 a CYP2C byly identifikovány jako primární odpovědné za Odemethylaci.
Odstranění
budesonid
Budesonid byl vylučován močí a stolicí ve formě metabolitů. Přibližně 60 % intravenózně radioaktivně značené dávky bylo nalezeno v moči.
V moči nebyl detekován žádný nezměněný budesonid. Forma 22R budesonidu byla přednostně vylučována játry se systémovou clearance 1,4 l/min oproti 1,0 l/min u formy 22S. Terminální poločas, 2 až 3 hodiny, byl stejný pro oba epimery a byl nezávislý na dávce.
Formoterol
Vylučování formoterolu bylo studováno u čtyř zdravých subjektů po současném podání radioaktivně značeného formoterolu perorální a intravenózní cestou. V této studii bylo 62 % radioaktivně značeného formoterolu vyloučeno močí, zatímco 24 % bylo vyloučeno stolicí.
Zvláštní populace
Geriatrický
Farmakokinetika přípravku SYMBICORT 4,5 mcg u geriatrických pacientů nebyla specificky studována.
Pediatrická
Plazmatické koncentrace budesonidu byly měřeny po podání čtyř inhalací přípravku SYMBICORT 160/4,5 ve studii s jednorázovou dávkou u pediatrických pacientů s astmatem ve věku 6 až méně než 12 let. Vrcholové koncentrace budesonidu 1,4 nmol/l se objevily 20 minut po podání dávky. Tato studie také prokázala, že celková systémová expozice budesonidu u přípravku SYMBICORT 4,5 mcg byla přibližně o 30 % nižší než u inhalovaného budesonidu prostřednictvím inhalátoru suchého prášku, který byl také hodnocen při stejné podané dávce. Cmax a AUC0-inf budesonidu normalizované na dávku po inhalaci jednorázové dávky u dětí ve věku 6 až méně než 12 let byly číselně nižší než hodnoty pozorované u dospělých.
Po 2 inhalacích přípravku SYMBICORT 160/4,5 dvakrát denně byly Cmax a AUC0-6 formoterolu v rovnovážném stavu u dětí ve věku 6 až méně než 12 let srovnatelné s hodnotami pozorovanými u dospělých.
Pohlaví/rasa
Specifické studie ke zkoumání účinků pohlaví a rasy na farmakokinetiku přípravku SYMBICORT nebyly provedeny. Populační PK analýza dat SYMBICORT 4,5 mcg ukazuje, že pohlaví neovlivňuje farmakokinetiku budesonidu a formoterolu. Vzhledem k nízkému počtu nebělošských hodnocených pro PK nelze činit žádné závěry o vlivu rasy.
Kojící matky
Dispozice budesonidu při podávání inhalací z inhalátoru suchého prášku v dávkách 200 nebo 400 mcg dvakrát denně po dobu alespoň 3 měsíců byla studována u osmi kojících žen s astmatem od 1 do 6 měsíců po porodu. Systémová expozice budesonidu u těchto žen se zdá být srovnatelná se systémovou expozicí u nekojících žen s astmatem z jiných studií. Mateřské mléko získané během osmi hodin po podání dávky odhalilo, že maximální koncentrace budesonidu pro celkovou denní dávku 400 a 800 mcg byla 0,39 a 0,78 nmol/l a nastala do 45 minut po podání. Odhadovaná perorální denní dávka budesonidu z mateřského mléka kojenci je přibližně 0,007 a 0,014 mcg/kg/den pro dva dávkové režimy použité v této studii, což představuje přibližně 0,3 % až 1 % dávky inhalované matkou. Hladiny budesonidu ve vzorcích plazmy získaných od pěti kojenců asi 90 minut po kojení (a asi 140 minut po podání léku matce) byly pod kvantifikovatelnými hladinami ( Použití u konkrétních populací ].
Renální nebo jaterní nedostatečnost
Neexistují žádné údaje týkající se specifického použití přípravku SYMBICORT u pacientů s poruchou funkce jater nebo ledvin. Snížená funkce jater může ovlivnit vylučování kortikosteroidů. Farmakokinetika budesonidu byla ovlivněna zhoršenou funkcí jater, o čemž svědčí dvojnásobná systémová dostupnost po perorálním požití. Farmakokinetika intravenózního budesonidu však byla u pacientů s cirhózou au zdravých subjektů podobná. Specifické údaje o formoterolu nejsou k dispozici, ale protože je formoterol primárně eliminován jaterním metabolismem, lze u pacientů s těžkou poruchou funkce jater očekávat zvýšenou expozici.
Lékové interakce
Byla provedena zkřížená studie s jednorázovou dávkou s cílem porovnat farmakokinetiku osmi inhalací následujících látek: budesonid, formoterol a budesonid plus formoterol podávaných současně. Výsledky studie ukázaly, že neexistuje žádný důkaz farmakokinetické interakce mezi dvěma složkami přípravku SYMBICORT.
Inhibitory enzymů Cytochromu P450
ketokonazol
Ketokonazol, silný inhibitor izoenzymu 3A4 (CYP3A4) cytochromu P450 (CYP), hlavního metabolického enzymu pro kortikosteroidy, zvýšil plazmatické hladiny perorálně podaného budesonidu.
Cimetidin
V doporučených dávkách měl cimetidin, nespecifický inhibitor enzymů CYP, mírný, ale klinicky nevýznamný účinek na farmakokinetiku perorálního budesonidu.
Specifické studie lékových interakcí s formoterolem nebyly provedeny.
Toxikologie zvířat a/nebo farmakologie
Preklinický
Studie na laboratorních zvířatech (miniprasata, hlodavci a psi) prokázaly výskyt srdečních arytmií a náhlé smrti (s histologickým důkazem nekrózy myokardu), pokud jsou beta-agonisté a methylxantiny podávány současně. Klinický význam těchto nálezů není znám.
Klinické studie
Astma
Pacienti s astmatem ve věku 12 let a starší
Ve dvou klinických studiích srovnávajících SYMBICORT 4,5 mcg s jednotlivými složkami byla zlepšení ve většině koncových bodů účinnosti větší u SYMBICORTU než při použití samotného budesonidu nebo formoterolu. Jedna klinická studie navíc prokázala podobné výsledky mezi přípravkem SYMBICORT a současným užíváním budesonidu a formoterolu v odpovídajících dávkách ze samostatných inhalátorů.
Bezpečnost a účinnost přípravku SYMBICORT 160 mg byla prokázána ve dvou randomizovaných, dvojitě zaslepených, placebem kontrolovaných klinických studiích v USA zahrnujících 1076 pacientů ve věku 12 let a starších. Fixní dávky SYMBICORTU 160/9 mcg a 320/9 mcg dvakrát denně (každá dávka podaná jako 2 inhalace o síle 80/4,5 a 160/4,5 mcg, v tomto pořadí) byly porovnány s monokomponentami (budesonid a formoterol) a placebem poskytnout informace o vhodném dávkování pro pokrytí rozsahu závažnosti astmatu.
Studie 1: Klinická studie se SYMBICORT 160/4,5
Tato 12týdenní studie hodnotila 596 pacientů ve věku 12 let a starších srovnáním SYMBICORT 160/4,5, volné kombinace budesonidu 160 mcg plus formoterolu 4,5 mcg v samostatných inhalátorech, 160 mcg formoterolu, budesonidu 4,5; každá se podává jako 2 inhalace dvakrát denně. Studie zahrnovala 2týdenní zaváděcí období s budesonidem 80 mcg, 2 inhalacemi dvakrát denně. Většina pacientů měla středně těžké až těžké astma a před vstupem do studie užívala střední až vysoké dávky inhalačních kortikosteroidů. Randomizace byla stratifikována podle předchozí léčby inhalačními kortikosteroidy (71,6 % na středních a 28,4 % na vysokých dávkách inhalačních kortikosteroidů). Průměrné procento předpokládané FEV1 na počátku bylo 68,1 % a bylo podobné napříč léčebnými skupinami. Koprimární koncové body účinnosti byly 12hodinový průměr po podání dávky FEV1 v týdnu 2 a FEV1 před podáním průměrné hodnoty v průběhu studie. Studie také požadovala, aby pacienti, kteří splnili předem definované kritérium pro zhoršení astmatu, byli vyřazeni. Předdefinovanými kritérii pro zhoršení astmatu byl klinicky významný pokles FEV1 nebo PEF, zvýšení záchranného salbuterolu, noční probouzení kvůli astmatu, pohotovostní intervence nebo hospitalizace kvůli astmatu nebo požadavek na léčbu astmatu, kterou protokol nepovoluje. U kritéria nočního probouzení kvůli astmatu bylo pacientům umožněno zůstat ve studii podle uvážení zkoušejícího, pokud nebylo splněno žádné z dalších kritérií pro zhoršení astmatu. Procento pacientů, kteří odstoupili kvůli nebo splňujícím předem definovaná kritéria pro zhoršení astmatu, je uvedeno v tabulce 4.
Průměrná procentuální změna od výchozí hodnoty FEV1 měřená bezprostředně před podáním dávky (před podáním dávky) po dobu 12 týdnů je zobrazena na obrázku 1. Protože tato studie používala předem definovaná kritéria pro vysazení pro zhoršení astmatu, která způsobila rozdílnou míru vysazení v léčebných skupinách, před jsou také uvedeny výsledky FEV1 dávky při poslední dostupné návštěvě studie (konec léčby, EOT). Pacienti užívající SYMBICORT 160/4,5 měli signifikantně větší průměrné zlepšení oproti výchozí hodnotě FEV1 před podáním dávky na konci léčby (0,19 l, 9,4 %) ve srovnání s budesonidem 160 mcg (0,10 l, 4,9 %), formoterolem 4,5 mcg (-0,12 L, -4,8 %) a placebo (-0,17 L, -6,9 %).
Obrázek 1: Průměrná procentní změna od výchozí hodnoty FEV1 před podáním dávky za 12 týdnů (studie 1)
INFORMACE PRO PACIENTA
SYMBICORT (SIM-bi-kort) (budesonid 80 mcg a formoterol fumarát dihydrát 4,5 mcg) Inhalační aerosol
SYMBICORT (SIM-bi-kort) (budesonid 160 mcg a formoterol fumarát dihydrát 4,5 mcg) Inhalační aerosol
Co je SYMBICORT?
SYMBICORT kombinuje inhalační kortikosteroidní lék (ICS), budesonid a lék s dlouhodobým účinkem beta2-adrenergního agonisty (LABA), formoterol.
- Inhalační kortikosteroidy pomáhají snižovat zánět v plicích. Zánět v plicích může vést k problémům s dýcháním.
- Léky LABA se používají u lidí s chronickou obstrukční plicní nemocí (CHOPN) a astmatem. Léky LABA pomáhají svalům kolem dýchacích cest v plicích zůstat uvolněné, aby se zabránilo příznakům, jako je sípání, kašel, tlak na hrudi a dušnost. Tyto příznaky se mohou objevit, když se svaly kolem dýchacích cest napnou. To ztěžuje dýchání. V závažných případech může sípání zastavit dýchání a může vést ke smrti, pokud není okamžitě léčeno.
SYMBICORT 4,5 mcg se nepoužívá k úlevě při náhlých potížích s dýcháním a nenahradí záchranný inhalátor. SYMBICORT se používá k léčbě astmatu a CHOPN následovně:
- Astma: SYMBICORT se používá ke kontrole příznaků astmatu a prevenci příznaků, jako je sípání u dospělých a dětí ve věku 6 let a starších. SYMBICORT 4,5 mcg obsahuje formoterol. Léky LABA, jako je formoterol, pokud se užívají samostatně, zvyšují riziko úmrtí a hospitalizací v důsledku astmatických problémů. SYMBICORT obsahuje ICS a LABA. Při současném použití IKS a LABA nedochází k významnému zvýšení rizika hospitalizací a úmrtí na astmatické problémy. SYMBICORT 160 mg není určen pro dospělé a děti s astmatem, kteří jsou dobře kontrolováni léky na kontrolu astmatu, jako je nízká až střední dávka IKS. SYMBICORT 160 mg je určen pro dospělé a děti s astmatem, kteří potřebují lék IKS i LABA. Není známo, zda je SYMBICORT bezpečný a účinný u dětí mladších 6 let s astmatem.
- COPD: CHOPN je dlouhodobé (chronické) onemocnění plic, které zahrnuje chronickou bronchitidu, emfyzém nebo obojí. SYMBICORT 160/4,5 mcg se používá dlouhodobě, jako 2 inhalace 2krát denně, ke zlepšení příznaků CHOPN pro lepší dýchání a ke snížení počtu vzplanutí (zhoršení příznaků CHOPN na několik dní).
Nepoužívejte SYMBICORT:
- k léčbě náhlých závažných příznaků astmatu nebo CHOPN.
- jestliže jste alergický(á) na kteroukoli složku přípravku SYMBICORT. Seznam složek přípravku SYMBICORT naleznete na konci této příbalové informace.
Před použitím přípravku SYMBICORT informujte svého poskytovatele zdravotní péče o všech svých zdravotních potížích, včetně toho, zda:
- mít problémy se srdcem.
- mají vysoký krevní tlak.
- mít záchvaty.
- mít problémy se štítnou žlázou.
- mít cukrovku.
- mít problémy s játry.
- mít osteoporózu.
- mít problém s imunitním systémem.
- máte oční problémy, jako je zvýšený tlak v oku, glaukom nebo šedý zákal.
- jsou alergičtí na jakékoli léky.
- mají jakýkoli typ virové, bakteriální, plísňové nebo parazitární infekce.
- jsou vystaveni planým neštovicím nebo spalničkám.
- jste těhotná nebo plánujete otěhotnět. Není známo, zda SYMBICORT 4,5 mcg může poškodit vaše nenarozené dítě.
- kojí. Budesonid, jedna z účinných látek přípravku SYMBICORT, přechází do mateřského mléka. Vy a váš poskytovatel zdravotní péče byste se měli rozhodnout, zda budete užívat SYMBICORT 160 mg během kojení.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků. SYMBICORT a některé další léky se mohou vzájemně ovlivňovat. To může způsobit závažné nežádoucí účinky. Zejména informujte svého poskytovatele zdravotní péče, pokud užíváte antimykotika nebo léky proti HIV.
Znát všechny léky, které užíváte. Veďte si seznam a ukažte jej svému poskytovateli zdravotní péče a lékárníkovi pokaždé, když dostanete nový lék.
Jak mám používat SYMBICORT?
Viz podrobné pokyny k používání SYMBICORTU na konci této příbalové informace. Nepoužívejte SYMBICORT 4,5 mcg, pokud vás to váš poskytovatel zdravotní péče nenaučil a vy všemu nerozumíte. Máte-li nějaké otázky, zeptejte se svého poskytovatele zdravotní péče nebo lékárníka.
- Používejte SYMBICORT přesně podle předpisu. Neužívejte SYMBICORT 160 mg častěji, než je předepsáno. SYMBICORT se dodává ve 2 silách. Váš poskytovatel zdravotní péče předepsal sílu, která je pro vás nejlepší. Všimněte si rozdílů mezi přípravkem SYMBICORT a jinými inhalačními léky, včetně rozdílů v předepsaném použití a fyzickém vzhledu.
- Děti by měly používat SYMBICORT s pomocí dospělé osoby podle pokynů poskytovatele zdravotní péče o dítě.
- SYMBICORT 160 mg se má užívat každý den jako 2 vstřiky ráno a 2 vstřiky večer s odstupem asi 12 hodin.
- Pokud vynecháte dávku přípravku SYMBICORT 160 mg, měli byste si vzít další dávku ve stejnou dobu, jakou obvykle užíváte.
- Vypláchněte si ústa vodou a po každé dávce (2 vdechnutí) SYMBICORTU vodu vyplivněte. Nepolykejte vodu. To pomůže snížit šanci na získání plísňové infekce (drozd) v ústech a krku.
- Pokud užijete příliš mnoho SYMBICORTU, zavolejte svého poskytovatele zdravotní péče nebo jděte na pohotovost v nejbližší nemocnici, pokud máte nějaké neobvyklé příznaky, jako je zhoršující se dušnost, bolest na hrudi, zrychlená srdeční frekvence nebo třes.
- Nestříkejte SYMBICORT 4,5 mcg do očí. Pokud se vám náhodou dostane SYMBICORT 160 mg do očí, vypláchněte si oči vodou, a pokud zarudnutí nebo podráždění přetrvává, poraďte se se svým lékařem.
- Neměňte ani nevysazujte žádné léky používané ke kontrole nebo léčbě vašich dýchacích potíží. Váš poskytovatel zdravotní péče vám léky podle potřeby změní.
- Pokud používáte SYMBICORT 2krát denně, z jakéhokoli důvodu nepoužívejte jiné léky, které obsahují LABA. Zeptejte se svého poskytovatele zdravotní péče nebo lékárníka, zda některý z vašich dalších léků jsou léky LABA.
- SYMBICORT 4,5 mcg nezmírňuje náhlé příznaky. Vždy mějte u sebe záchranný inhalační lék k léčbě náhlých příznaků. Pokud nemáte záchranný inhalátor, zavolejte svého poskytovatele zdravotní péče, aby vám jej předepsal.
- Zavolejte svého poskytovatele zdravotní péče nebo okamžitě vyhledejte lékařskou péči, pokud:
- Vaše dýchací potíže se při užívání SYMBICORTU zhorší.
- musíte svůj záchranný inhalátor používat častěji než obvykle.
- váš záchranný inhalační lék na vás nepůsobí tak dobře při zmírňování příznaků.
- vaše výsledky špičkového průtokoměru se snižují. Váš poskytovatel zdravotní péče vám sdělí čísla, která jsou pro vás ta pravá.
- Vaše příznaky se nezlepší po pravidelném užívání SYMBICORTU 160 mg po dobu 1 týdne.
Jaké jsou možné vedlejší účinky přípravku SYMBICORT?
SYMBICORT 4,5 mcg může způsobit závažné nežádoucí účinky, včetně:
- Použití příliš velkého množství léku LABA může způsobit:
- bolest na hrudi
- zvýšený krevní tlak
- rychlý a nepravidelný srdeční tep
- bolest hlavy
- třes
- nervozita
- Plísňová infekce v ústech nebo krku (aft). Po použití přípravku SYMBICORT 4,5 mcg si vypláchněte ústa vodou bez polknutí, abyste snížili pravděpodobnost vzniku afty.
- Pneumonie a další infekce dolních cest dýchacích. Lidé s CHOPN mají vyšší šanci na zápal plic a další plicní infekce. Inhalační kortikosteroidy mohou zvýšit pravděpodobnost vzniku zápalu plic. Zavolejte svého poskytovatele zdravotní péče, pokud zaznamenáte některý z těchto příznaků:
- zvýšení produkce hlenu (sputa).
- změna barvy hlenu
- horečka
- zimnice
- zvýšený kašel
- zvýšené problémy s dýcháním
- Účinky na imunitní systém a vyšší pravděpodobnost infekcí. Informujte svého poskytovatele zdravotní péče o jakýchkoli příznacích infekce, jako jsou:
- horečka
- bolest
- bolesti těla
- zimnice
- cítit se unaveně
- nevolnost
- zvracení
- Nedostatek adrenalinu. Adrenální insuficience je stav, kdy nadledvinky nevytvářejí dostatek steroidních hormonů. To se může stát, když přestanete užívat perorální kortikosteroidy a začnete užívat inhalační kortikosteroidy.
- Zvýšené sípání hned po užití SYMBICORTU. Vždy mějte u sebe záchranný inhalátor k léčbě náhlého sípání.
- Závažné alergické reakce zahrnující vyrážku, kopřivku, otok obličeje, úst a jazyka a problémy s dýcháním. Zavolejte svého poskytovatele zdravotní péče nebo vyhledejte pohotovostní lékařskou péči, pokud se u vás objeví příznaky závažné alergické reakce.
- Nižší kostní minerální hustota. To se může stát u lidí, kteří mají vysokou šanci na nízkou hustotu kostních minerálů (osteoporózu). Váš poskytovatel zdravotní péče by vás měl během léčby přípravkem SYMBICORT kontrolovat.
- Zpomalený růst u dětí. Při používání SYMBICORTU by měl být pravidelně kontrolován růst dítěte.
- Oční problémy včetně glaukomu a šedého zákalu. Během používání přípravku SYMBICORT byste měli podstupovat pravidelné oční prohlídky.
- Otok vašich krevních cév. To se může stát u lidí s astmatem. Okamžitě informujte svého poskytovatele zdravotní péče, pokud máte:
- pocit mravenčení nebo
- příznaky podobné chřipce necitlivost paží nebo nohou
- bolest a otok dutin
- vyrážka
- Snížení hladiny draslíku v krvi (hypokalémie).
- Zvýšení hladiny cukru v krvi (hyperglykémie).
Mezi nejčastější vedlejší účinky přípravku SYMBICORT patří:
Lidé s astmatem:
- podráždění hrdla
- bolest hlavy
- infekce horních cest dýchacích
- bolest krku
- záněty sliznic dutin
- chřipka (sinusitida)
- ucpaný nos
- bolesti zad
- zvracení
- žaludeční nevolnost
- soor v ústech a krku. Po použití si vypláchněte ústa vodou bez polknutí, abyste zabránili vzniku afty
Lidé s CHOPN:
- podráždění hrdla.
- soor v ústech a krku. Po použití si vypláchněte ústa vodou bez polknutí, abyste zabránili vzniku afty.
- infekce a záněty sliznic průdušek (bronchitida).
- zánět sliznic v dutinách (sinusitida).
- infekce horních cest dýchacích.
Informujte svého poskytovatele zdravotní péče o jakémkoli nežádoucím účinku, který vás obtěžuje nebo který nezmizí.
Toto nejsou všechny možné vedlejší účinky přípravku SYMBICORT.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Nežádoucí účinky můžete také hlásit společnosti AstraZeneca na čísle 1-800-236-9933.
Jak mám uchovávat SYMBICORT?
- Skladujte SYMBICORT při pokojové teplotě mezi 68 °F až 77 °F (20 °C až 25 °C).
- Uchovávejte SYMBICORT s náustkem dolů.
- Obsah kanystru SYMBICORT je pod tlakem. Nepropichujte ani nevhazujte kanystr do ohně nebo spalovny. Nepoužívejte ani neskladujte v blízkosti tepla nebo otevřeného ohně. Skladování nad 120 °F může způsobit prasknutí kanystru.
- SYMBICORT 160 mg vyhoďte, když počítadlo dosáhne nuly („0“) nebo 3 měsíce poté, co vyjmete SYMBICORT z fóliového sáčku, podle toho, co nastane dříve.
- Uchovávejte SYMBICORT 4,5 mcg a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a efektivním používání přípravku SYMBICORT.
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v příbalové informaci pro pacienty. Nepoužívejte SYMBICORT 4,5 mcg na stav, pro který nebyl předepsán. Nedávejte SYMBICORT jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Můžete požádat svého poskytovatele zdravotní péče nebo lékárníka o informace o přípravku SYMBICORT 4,5 mcg, který je určen pro zdravotníky.
Jaké složky obsahuje SYMBICORT 4,5 mcg?
Účinné látky: mikronizovaný budesonid a mikronizovaný dihydrát formoterol fumarátu
Neaktivní složky: hydrofluroalkan (HFA 227), povidon K25 USP a polyethylenglykol 1000 NF
Návod k použití
SYMBICORT (SIM-bi-kort) (budesonid 80 mcg a formoterol fumarát dihydrát 4,5 mcg) Inhalační aerosol
SYMBICORT (SIM-bi-kort) (budesonid 160 mcg a formoterol fumarát dihydrát 4,5 mcg) Inhalační aerosol
Obrázek 1  Vzpřímená poloha
Vzpřímená poloha
Jak se SYMBICORT používá
Při používání SYMBICORT postupujte podle níže uvedených pokynů. Lék budete vdechovat (inhalovat). Máte-li jakékoli otázky, zeptejte se svého lékaře nebo lékárníka.
Příprava inhalátoru SYMBICORT k použití
Obrázek 2 
5. Naplňte svůj inhalátor SYMBICORT
Před prvním použitím přípravku SYMBICORT jej budete muset naplnit. Chcete-li prostříknout SYMBICORT 160 mg, držte jej ve svislé poloze. Viz obrázek 1. Dobře protřepejte inhalátor SYMBICORT 4,5 mcg po dobu 5 sekund. Držte svůj inhalátor SYMBICORT 160 mg směrem od sebe a pevně a úplně zatlačte na horní část počítadla inhalátoru SYMBICORT 160 mg, aby se uvolnil zkušební sprej. Poté znovu protřepejte po dobu 5 sekund a uvolněte druhý zkušební sprej. Váš inhalátor SYMBICORT 160 mg je nyní naplněn a připraven k použití. Po prvním naplnění inhalátoru SYMBICORT bude počítadlo ukazovat buď 120 nebo 60, v závislosti na velikosti, která vám byla poskytnuta.
Pokud inhalátor SYMBICORT nepoužíváte déle než 7 dní nebo pokud jej upustíte, budete ho muset znovu prostříknout.
Způsoby, jak držet inhalátor SYMBICORT 160 mg pro použití
Obrázek 3 
NEBO
Obrázek 4 
Pomocí inhalátoru SYMBICORT
6. Dobře protřepejte inhalátor SYMBICORT 160 mg po dobu 5 sekund. Odstraňte kryt náustku. Zkontrolujte, zda v náustku nejsou cizí předměty.
7. Plně vydechněte (vydechněte). Přidržte inhalátor SYMBICORT u úst. Vložte bílý náustek zcela do úst a sevřete kolem něj rty. Ujistěte se, že je inhalátor SYMBICORT 4,5 mcg ve svislé poloze a že otvor náustku směřuje k zadní části vašeho krku (viz obrázek 5).
Obrázek 5 
8. Zhluboka a pomalu se nadechněte ústy. Pevně a úplně zatlačte na horní část počítadla na inhalátoru SYMBICORT, aby se uvolnil lék (viz obrázky 3 a 4).
9. Pokračujte v nádechu (nádechu) a zadržte dech asi na 10 sekund nebo na tak dlouho, jak je to pohodlné. Před výdechem (výdechem) uvolněte prst z horní části pultu. Udržujte inhalátor SYMBICORT ve svislé poloze a vyjměte jej z úst.
10. Znovu protřepejte inhalátor SYMBICORT po dobu 5 sekund a opakujte kroky 7 až 9.
Po použití inhalátoru SYMBICORT
11. Po použití zavřete kryt náustku zatlačením, dokud nezapadne na místo.
12. Po ukončení užívání SYMBICORTU (2 vdechnutí) si vypláchněte ústa vodou. Vyplivněte vodu. Nepolykejte to.
Čtení počítadla
- Šipka na počítadle v horní části inhalátoru SYMBICORT ukazuje na počet inhalací (vdechů) zbývajících ve vašem inhalátoru.
ČELIT 
- Počítadlo bude odpočítávat pokaždé, když vypustíte dávku léku (buď při plnění inhalátoru SYMBICORT nebo při užívání léku).
- Když se šipka na počítadle přiblíží 20, všimnete si začátku žluté oblasti, která vám dává vědět, že je čas zavolat svému poskytovateli zdravotní péče o doplnění.
ČELIT 
- Je důležité, abyste věnovali pozornost počtu inhalací (vdechů) zbývajících ve vašem inhalátoru SYMBICORT 160 mg čtením počítadla. SYMBICORT vyhoďte, když počítadlo ukazuje nulu („0“) nebo 3 měsíce poté, co vyjmete inhalátor SYMBICORT 160 mg z fóliového sáčku, podle toho, co nastane dříve. Váš inhalátor SYMBICORT nemusí být prázdný a může pokračovat v provozu, ale pokud jej budete nadále používat, nedostanete správné množství léku. Použijte nový inhalátor SYMBICORT a řiďte se pokyny pro plnění (viz pokyn 5 výše).
Jak čistit inhalátor SYMBICORT
Každých 7 dní vyčistěte bílý náustek vašeho inhalátoru SYMBICORT 4,5 mcg. Pro čištění náustku:
- Odstraňte šedý kryt náustku
- Otřete vnitřní a vnější stranu bílého otvoru náustku čistým a suchým hadříkem
- Nasaďte kryt náustku
- Nevkládejte inhalátor SYMBICORT do vody
- Nesnažte se rozebrat svůj SYMBICORT inhalátor
Tyto informace pro pacienty a návod k použití byly schváleny americkým Úřadem pro kontrolu potravin a léčiv.
