Cordarone 100mg, 50mg Amiodarone Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Cordarone 100 mg a jak se používá?
Cordarone 100 mg IV je lék na předpis používaný k léčbě příznaků nepravidelného srdečního rytmu (ventrikulární arytmie).
- Cordarone IV lze užívat samostatně nebo s jinými léky.
- Cordarone 50 mg IV patří do třídy léků nazývaných Antidysrytmisc, III.
Jaké jsou možné vedlejší účinky přípravku Cordarone 100 mg?
Cordarone 100 mg může způsobit závažné nežádoucí účinky, včetně:
- dušnost,
- mdloby,
- rychlý nebo nepravidelný srdeční tep,
- bolest na hrudi,
- sípání a
- potíže s dýcháním
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Cordarone 100 mg IV patří:
- nízký krevní tlak (hypotenze),
- pomalý srdeční tep,
- srdeční zástava,
- nevolnost,
- horečka,
- městnavé srdeční selhání,
- abnormální srdeční rytmus,
- kardiogenního šoku a
- abnormality jaterních testů
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Cordarone. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
Plicní, jaterní a srdeční TOXICITA
CORDARONE 100 mg je určen k použití pouze u pacientů s indikovanými život ohrožujícími arytmiemi, protože jeho použití je doprovázeno značnou toxicitou (viz INDIKACE A POUŽITÍ).
CORDARONE může způsobit plicní toxicitu (hypersenzitivní pneumonitidu nebo intersticiální/alveolární pneumonitidu), která má za následek klinicky manifestní onemocnění v míře až 17 % u některých sérií pacientů. Plicní toxicita byla smrtelná asi v 10 % případů. Při zahájení léčby přípravkem CORDARONE 100 mg získejte základní rentgenové vyšetření hrudníku a vyšetření funkce plic, včetně difuzní kapacity. Opakujte anamnézu, fyzikální vyšetření a rentgen hrudníku každé 3 až 6 měsíců (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ).
CORDARONE může způsobit hepatotoxicitu, která může být smrtelná. Získejte výchozí a periodické jaterní transaminázy a přerušte nebo snižte dávku, pokud zvýšení překročí trojnásobek normální hodnoty nebo se zdvojnásobí u pacienta se zvýšenou výchozí hodnotou. Přerušte léčbu přípravkem CORDARONE, pokud se u pacienta objeví známky nebo příznaky klinického poškození jater (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ).
CORDARONE může zhoršit arytmie. Zahajte CORDARONE 50 mg v klinickém prostředí, kde jsou dostupné kontinuální elektrokardiogramy a srdeční resuscitace (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ).
POPIS
CORDARONE (amiodaron HCl) je antiarytmikum, dostupné pro perorální podání jako růžové tablety s rýhou obsahující 200 mg amiodaronu hydrochloridu. Neaktivní složky jsou koloidní oxid křemičitý, laktóza, stearát hořečnatý, povidon, škrob a FD&C Red 40. CORDARONE je derivát benzofuranu: 2-butyl-3-benzofuranyl 4-[2-(diethylamino)-ethoxy]-3, 5-dijodfenylketonhydrochlorid.
Strukturní vzorec je následující:
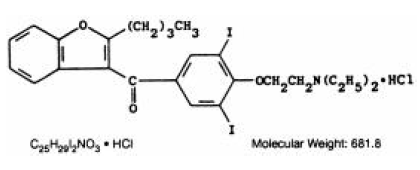
Amiodaron HCl je bílý až krémově zbarvený krystalický prášek. Je mírně rozpustný ve vodě, rozpustný v alkoholu a volně rozpustný v chloroformu. Obsahuje 37,3 % hmotnostních jódu.
INDIKACE
CORDARONE je indikován k léčbě dokumentované, život ohrožující rekurentní fibrilace komor a život ohrožující rekurentní hemodynamicky nestabilní tachykardie u dospělých, kteří nereagovali na adekvátní dávky jiných dostupných antiarytmik nebo u nichž nelze tolerovat alternativní léky.
DÁVKOVÁNÍ A PODÁVÁNÍ
Dávkování musí být individualizováno na základě závažnosti arytmie a odpovědi. Použijte nejnižší účinnou dávku. Získejte základní rentgen hrudníku, testy funkce plic, testy funkce štítné žlázy a jaterní aminotransferázy. Před zahájením léčby upravte hypokalémii, hypomagnezémii a hypokalcémii
Doporučené dávkování
Zahajte léčbu nasycovacími dávkami 800 až 1600 mg/den, dokud nenastane počáteční terapeutická odpověď (obvykle 1 až 3 týdny). Jakmile je dosaženo adekvátní kontroly arytmie nebo pokud se nežádoucí účinky stanou prominentními, snižte dávku CORDARONE 50 mg na 600 až 800 mg/den po dobu jednoho měsíce a poté na udržovací dávku, obvykle 400 mg/den.
Správa
CORDARONE podávejte důsledně s ohledem na jídlo [viz KLINICKÁ FARMAKOLOGIE ]. Podávání CORDARONE v rozdělených dávkách s jídlem se doporučuje pro celkové denní dávky 1000 mg nebo vyšší, nebo když se objeví gastrointestinální intolerance.
JAK DODÁVÁNO
Dávkové formy A Síly
200 mg tablety: kulaté, konvexní, růžové tablety s vyvýšeným „C“ a označeným „200“ na jedné straně, s půlicí rýhou na druhé straně a označením „WYETH“ a „4188“.
Skladování A Manipulace
CORDARONE® (amiodaron HCl) tablety jsou dostupné v lahvičkách po 60 tabletách takto:
200 mg , NDC 0008-4188-04, kulaté, konvexní, růžové tablety s vyvýšeným „C“ a označením „200“ na jedné straně, s půlicí rýhou na druhé straně a označením „WYETH“ a „4188“.
Uchovávejte těsně uzavřené.
Skladujte při kontrolované pokojové teplotě, 20° až 25°C (68° až 77°F).
Chraňte před světlem.
Dávkujte v nepropustné, nepropustné nádobě.
Výrobce Sanofi Winthrop Industrie, 1, rue de la Vierge, 33440 Ambares, Francie. Distribuuje: Wyeth Pharmaceuticals Inc., dceřiná společnost společnosti Pfizer Inc., Philadelphia, PA 19101. Revize: říjen 2018
VEDLEJŠÍ EFEKTY
Následující závažné nežádoucí účinky jsou podrobněji popsány v jiných částech informací o předepisování:
- Plicní toxicita [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Poranění jater [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Zhoršená arytmie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Zrakové postižení a ztráta zraku [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Abnormality štítné žlázy [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Bradykardie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Periferní neuropatie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Fotosenzitivita a změna barvy kůže [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Při obvyklé udržovací dávce (400 mg/den) a vyšší způsobuje CORDARONE 100 mg nežádoucí účinky asi u tří čtvrtin všech pacientů, což vede k přerušení léčby u 7 až 18 %.
V průzkumech téměř 5 000 pacientů léčených v otevřených studiích v USA a v publikovaných zprávách o léčbě přípravkem CORDARONE zahrnovaly nežádoucí účinky nejčastěji vyžadující přerušení léčby přípravkem CORDARONE plicní infiltráty nebo fibrózu, paroxysmální ventrikulární tachykardii, městnavé srdeční selhání a zvýšení jaterních enzymů. Mezi další příznaky způsobující přerušení léčby patřily méně často poruchy vidění, fotosenzitivita, modré zbarvení kůže, hypertyreóza a hypotyreóza.
Následující míry nežádoucích účinků jsou založeny na retrospektivní studii 241 pacientů léčených po dobu 2 až 1 515 dnů (průměrně 441,3 dnů):
Štítná žláza
Časté: Hypotyreóza, hypertyreóza.
Kardiovaskulární
Časté: městnavé srdeční selhání, srdeční arytmie, dysfunkce SA uzlu.
Gastrointestinální
Velmi časté: Nevolnost, zvracení.
Časté: Zácpa, anorexie, bolest břicha.
Dermatologické
Časté: Solární dermatitida/fotosenzitivita.
Neurologické
Časté: Malátnost a únava, třes/abnormální mimovolní pohyby, nedostatek koordinace, abnormální chůze/ataxie, závratě, parestézie, snížené libido, nespavost, bolest hlavy, poruchy spánku.
Oční
Časté: Poruchy zraku.
Jaterní
Časté: Abnormální jaterní testy, nespecifické jaterní poruchy.
Respirační
Časté: Plicní zánět nebo fibróza.
jiný
Časté: návaly horka, abnormální chuť a čich, edém, abnormální slinění, abnormality koagulace.
Méně časté: Modré zbarvení kůže, vyrážka, spontánní ekchymóza, alopecie, hypotenze a abnormality srdečního převodu.
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během používání přípravku CORDARONE po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Hematologické hemolytická anémie, aplastická anémie, pancytopenie, neutropenie, trombocytopenie, agranulocytóza, granulom.
Imunní : anafylaktická/anafylaktoidní reakce (včetně šoku), angioedém.
Neurologické : pseudotumor cerebri, parkinsonské příznaky jako akineze a bradykineze (někdy reverzibilní po přerušení léčby), demyelinizační polyneuropatie.
Psychiatrické : halucinace, stav zmatenosti, dezorientace, delirium.
Srdeční : hypotenze (někdy smrtelná), sinusová zástava.
Respirační : eozinofilní pneumonie, syndrom akutní respirační tísně v pooperačním stavu, bronchospasmus, bronchiolitis obliterans organizující se pneumonie, plicní alveolární krvácení, pleurální výpotek, pleuritida.
Gastrointestinální : pankreatitida, akutní pankreatitida.
Jaterní : hepatitida, cholestatická hepatitida, cirhóza.
Poruchy kůže a podkožní tkáně kopřivka, toxická epidermální nekrolýza (někdy fatální), multiformní erytém, Stevens-Johnsonův syndrom, exfoliativní dermatitida, bulózní dermatitida, léková vyrážka s eozinofilií a systémovými příznaky (DRESS), ekzém, svědění, rakovina kůže, syndrom podobný lupusu.
Muskuloskeletální : myopatie, svalová slabost, rhabdomyolýza.
Renální : poškození ledvin, renální insuficience, akutní renální selhání.
Reprodukční : epididymitida, impotence.
Tělo jako celek : horečka, sucho v ústech.
Endokrinní a metabolické : uzliny štítné žlázy/ rakovina štítné žlázy, syndrom nepřiměřené sekrece antidiuretického hormonu (SIADH).
Cévní : vaskulitida.
DROGOVÉ INTERAKCE
Vzhledem k dlouhému poločasu amiodaronu očekávejte, že lékové interakce přetrvají týdny až měsíce po vysazení amiodaronu.
Lékové interakce s amiodaronem jsou popsány v tabulce 1 níže.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Přetrvávání nežádoucích účinků
Vzhledem k dlouhému poločasu amiodaronu (15 až 142 dnů) a jeho aktivního metabolitu desethylamiodaronu (14 až 75 dnů) mohou nežádoucí účinky a lékové interakce přetrvávat několik týdnů po vysazení amiodaronu (viz KLINICKÁ FARMAKOLOGIE ].
Plicní toxicita
CORDARONE může způsobit klinický syndrom kašle a progresivní dušnosti doprovázený funkčními, rentgenovými, galliovým skenem a patologickými údaji odpovídajícími plicní toxicitě. Sekundární plicní toxicita po CORDARONE může být důsledkem buď nepřímé nebo přímé toxicity, kterou představuje hypersenzitivní pneumonitida (včetně eozinofilní pneumonie) nebo intersticiální/alveolární pneumonitida. Udává se, že míra plicní toxicity dosahuje až 17 % a je smrtelná asi v 10 % případů. Při zahájení léčby přípravkem CORDARONE 50 mg získejte základní rentgenové vyšetření hrudníku a vyšetření funkce plic, včetně difuzní kapacity. Opakujte anamnézu, fyzikální vyšetření a rentgen hrudníku každé 3 až 6 měsíců nebo pokud se objeví příznaky. Pokud se u pacienta objeví známky nebo příznaky plicní toxicity, zvažte alternativní antiarytmickou léčbu. Prednison 40 až 60 mg/den postupně snižovaný během několika týdnů může být užitečný při léčbě plicní toxicity.
Syndrom respirační tísně dospělých (ARDS)
Po operaci byl výskyt ARDS hlášen u pacientů léčených CORDARONE, kteří podstoupili buď srdeční nebo nekardiální operaci. Přestože pacienti obvykle dobře reagují na intenzivní respirační terapii, ve vzácných případech byl výsledek fatální.
Poranění jater
Často je pozorováno asymptomatické zvýšení hladin jaterních enzymů, ale CORDARONE 100 mg může způsobit život ohrožující poškození jater. Histologie se podobala histologii alkoholické hepatitidy nebo cirhózy. Získejte základní a periodické jaterní transaminázy. Pokud transaminázy překročí trojnásobek normálních hodnot nebo se zdvojnásobí u pacienta se zvýšenou výchozí hodnotou, přerušte nebo snižte dávku přípravku CORDARONE 100 mg, proveďte kontrolní testy a odpovídajícím způsobem léčte.
Zhoršená arytmie
CORDARONE 100 mg může exacerbovat přítomnou arytmii u asi 2 až 5 % pacientů nebo způsobit novou komorovou fibrilaci, neustálou komorovou tachykardii, zvýšenou rezistenci ke kardioverzi a polymorfní komorovou tachykardii spojenou s prodloužením QTc (Torsade de Pointes [TdP]).
Před zahájením léčby přípravkem CORDARONE upravte hypokalémii, hypomagnezémii a hypokalcémii, protože tyto poruchy mohou zveličovat stupeň prodloužení QTc a zvyšovat potenciál TdP. Zvláštní pozornost věnujte elektrolytové a acidobazické rovnováze u pacientů, kteří trpí těžkým nebo dlouhodobým průjmem nebo užívají léky ovlivňující hladiny elektrolytů, jako jsou diuretika, laxativa, systémové kortikosteroidy nebo amfotericin B.
Zrakové poškození a ztráta zraku
Optická neuropatie a optická neuritida
pacientů léčených amiodaronem byly hlášeny případy neuropatie zrakového nervu a optické neuritidy, které obvykle vedly k poškození zraku a někdy k trvalé slepotě, a mohou se objevit kdykoli během léčby. Pokud se objeví příznaky poruchy zraku, jako jsou změny zrakové ostrosti a pokles periferního vidění, zvažte vysazení přípravku CORDARONE 100 mg a neprodleně odešlete na oční vyšetření. Během podávání CORDARONE se doporučuje pravidelné oftalmologické vyšetření včetně funduskopie a vyšetření štěrbinovou lampou (viz NEŽÁDOUCÍ REAKCE ].
Mikrodepozita rohovky
Mikrodepozita na rohovce se objevují u většiny dospělých léčených přípravkem CORDARONE. Obvykle jsou rozeznatelné pouze vyšetřením štěrbinovou lampou, ale až u 10 % pacientů vedou ke vzniku symptomů, jako jsou vizuální halo nebo rozmazané vidění. Mikrodepozita rohovky jsou reverzibilní po snížení dávky nebo ukončení léčby. Samotná asymptomatická mikrodepozita nejsou důvodem ke snížení dávky nebo přerušení léčby [viz NEŽÁDOUCÍ REAKCE ].
Abnormality štítné žlázy
CORDARONE 50 mg inhibuje periferní přeměnu tyroxinu (T4) na trijodtyronin (T3) a může způsobit zvýšené hladiny tyroxinu, snížené hladiny T3 a zvýšené hladiny neaktivního reverzního T3 (rT3) u klinicky eutyreoidních pacientů. CORDARONE 50 mg může způsobit buď hypotyreózu (uváděnou až u 10 % pacientů) nebo hypertyreózu (vyskytující se asi u 2 % pacientů). Před léčbou a pravidelně po ní sledujte funkci štítné žlázy, zejména u starších pacientů a u všech pacientů s anamnézou uzlů štítné žlázy, strumy nebo jiné dysfunkce štítné žlázy.
Hypertyreóza může vyvolat průlom arytmie. Pokud se objeví jakékoli nové známky arytmie, je třeba zvážit možnost hypertyreózy. K léčbě příznaků hypertyreózy mohou být nezbytné antithyroidní léky, β-adrenergní blokátory, dočasná léčba kortikosteroidy. Účinek antityreoidálních léků může být zpožděn u tyreotoxikózy vyvolané amiodaronem kvůli značnému množství předem vytvořených hormonů štítné žlázy uložených ve žláze. Léčba radioaktivním jódem je kontraindikována z důvodu nízkého vychytávání radiojódu spojeného s hypertyreózou vyvolanou amiodaronem. Hypertyreóza vyvolaná CORDARONE může být následována přechodným obdobím hypotyreózy.
Hypotyreóza může být primární nebo následná po vyřešení předchozí hypertyreózy vyvolané amiodaronem. V souvislosti s léčbou amiodaronem byla hlášena těžká hypotyreóza a myxedémové kóma, někdy fatální. U některých pacientů s klinickou hypotyreózou léčených amiodaronem mohou být hodnoty indexu volného tyroxinu normální. Zvládejte hypotyreózu snížením dávky nebo vysazením přípravku CORDARONE a suplementace hormony štítné žlázy.
Bradykardie
CORDARONE způsobuje symptomatickou bradykardii nebo sinusovou zástavu s potlačením únikových ložisek u 2 až 4 % pacientů. Riziko zvyšují elektrolytické poruchy nebo užívání souběžných antiarytmik nebo negativních chronotropů (viz. DROGOVÉ INTERAKCE ]. Bradykardie může vyžadovat kardiostimulátor pro kontrolu frekvence.
Po uvedení ledipasviru/sofosbuviru nebo sofosbuviru se simeprevirem u pacientů užívajících amiodaron byly hlášeny postmarketingové případy symptomatické bradykardie, některé vyžadující zavedení kardiostimulátoru a alespoň jeden fatální. Bradykardie se obvykle objevila během hodin až dnů, ale v některých případech se projevila až 2 týdny po zahájení antivirové léčby. Bradykardie obecně odezněla po přerušení antivirové léčby. Mechanismus tohoto účinku není znám. Sledujte srdeční frekvenci u pacientů užívajících nebo nedávno vysazujících amiodaron při zahájení antivirové léčby [viz DROGOVÉ INTERAKCE ].
Implantovatelné srdeční přístroje
U pacientů s implantovanými defibrilátory nebo kardiostimulátory může chronické podávání antiarytmik ovlivnit stimulační nebo defibrilační prahy. Na začátku a během léčby amiodaronem by proto měly být stanoveny prahové hodnoty stimulace a defibrilace.
Fetální toxicita
CORDARONE může způsobit poškození plodu při podání těhotné ženě. Expozice plodu může zvýšit potenciál pro srdeční, štítnou žlázu, neurovývojové, neurologické a růstové účinky u novorozenců (viz Použití u konkrétních populací ].
Periferní neuropatie
Chronické podávání CORDARONE může vést k periferní neuropatii, která nemusí vymizet, když se CORDARONE vysadí.
Fotosenzitivita a změna barvy kůže
CORDARONE vyvolává fotosenzibilizaci asi u 10 % pacientů; určitá ochrana může být poskytnuta opalovacími krémy nebo ochranným oděvem. Při dlouhodobé léčbě se může objevit modrošedé zbarvení exponované kůže. Riziko může být zvýšené u pacientů se světlou pletí nebo u pacientů s nadměrným slunečním zářením. Po vysazení léku může dojít k určité změně barvy.
Chirurgická operace
Těkavé anestetické látky
Pacienti léčení přípravkem CORDARONE 100 mg mohou být citlivější na tlumivý účinek na myokard a převodní účinky halogenovaných inhalačních anestetik.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( Průvodce léky ).
Informujte těhotné ženy o potenciálním riziku pro plod. Informujte ženy o reprodukčním potenciálu, aby informovaly svého předepisujícího lékaře o známém nebo předpokládaném těhotenství [viz Použití u konkrétních populací ].
Informujte ženy, že kojení se během léčby přípravkem CORDARONE nedoporučuje [viz Použití u konkrétních populací ].
Doporučte pacientům, aby se vyhýbali grapefruitové šťávě a třezalce tečkované.
Poraďte pacientům, aby vyhledali lékařskou pomoc, pokud se u nich objeví známky a příznaky plicní toxicity, zhoršující se arytmie, bradykardie, poruchy zraku nebo hypo- a hypertyreóza.
Štítek tohoto produktu mohl být aktualizován. Úplné informace o předepisování naleznete na www.pfizer.com.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Amiodaron HCl byl spojen se statisticky významným, na dávce závislým zvýšením výskytu nádorů štítné žlázy (folikulární adenom a/nebo karcinom) u potkanů. Výskyt nádorů štítné žlázy byl vyšší než u kontroly při nejnižší testované hladině dávky, tj. 5 mg/kg/den (přibližně 0,08násobek maximální doporučené udržovací dávky pro člověka*).
Studie mutagenity (Amesovy, mikronukleové a lysogenní testy) s CORDARONE byly negativní.
Ve studii, ve které byl amiodaron HCl podáván samcům a samicím potkanů, počínaje 9 týdny před pářením, byla pozorována snížená plodnost při dávce 90 mg/kg/den (přibližně 1,4násobek maximální doporučené udržovací dávky pro člověka*).
*600 mg u pacienta s hmotností 60 kg (dávka ve srovnání s tělesným povrchem)
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
Dostupné údaje z postmarketingových zpráv a publikovaných kazuistik naznačují, že užívání amiodaronu u těhotných žen může zvýšit riziko nežádoucích účinků na plod včetně novorozenecké hypo- a hypertyreózy, neonatální bradykardie, neurovývojových abnormalit, předčasných porodů a omezení růstu plodu. Amiodaron a jeho metabolit, desethylamiodaron (DEA), procházejí placentou. Neléčené základní arytmie, včetně ventrikulárních arytmií, během těhotenství představují riziko pro matku a plod (viz Klinické úvahy ). Ve studiích na zvířatech vedlo podávání amiodaronu králíkům, potkanům a myším během organogeneze k embryofetální toxicitě v dávkách nižších, než je maximální doporučená udržovací dávka pro člověka (viz Data ). Informujte těhotné ženy o potenciálním riziku pro plod.
Odhadované základní riziko závažných vrozených vad a potratu pro indikovanou populaci není známo. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 %-4 % a 15 %-20 %.
Klinické úvahy
Mateřské a nebo embryo/fetální riziko spojené s nemocí
Výskyt ventrikulární tachykardie je zvýšený a může být více symptomatický během těhotenství. Komorové arytmie se nejčastěji vyskytují u těhotných žen se základní kardiomyopatií, vrozenou srdeční vadou, vadou srdeční chlopně nebo prolapsem mitrální chlopně. Většina epizod tachykardie je iniciována ektopickými údery a výskyt epizod arytmie se proto může během těhotenství zvýšit v důsledku zvýšeného sklonu k mimoděložní aktivitě. Průlomové arytmie se mohou vyskytnout také během těhotenství, protože může být obtížné udržet terapeutické hladiny v důsledku zvýšeného distribučního objemu a zvýšeného metabolismu léčiva, které je v těhotenství vlastní.
Fetální/neonatální nežádoucí reakce
Bylo prokázáno, že amiodaron a jeho metabolit procházejí placentou. Nežádoucí účinky na plod spojené s užíváním amiodaronu matkou během těhotenství mohou zahrnovat neonatální bradykardii, prodloužení QT intervalu a periodické ventrikulární extrasystoly, neonatální hypotyreózu (se strumou nebo bez ní) detekovanou před porodem nebo u novorozence a hlášenou i po několika dnech expozice, neonatální hypertyroxinemii, neurovývojové abnormality nezávislé na funkci štítné žlázy, včetně zpoždění řeči a potíží s psaným jazykem a aritmetikou, opožděný motorický vývoj a ataxie, trhaný nystagmus se synchronní titubací hlavy, omezení růstu plodu a předčasný porod. Sledujte novorozence na známky a příznaky poruchy štítné žlázy a srdeční arytmie.
Práce a dodání
Během porodu se může zvýšit riziko arytmií. Pacientky léčené CORDARONE by měly být během porodu a porodu nepřetržitě sledovány (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Data
Údaje o zvířatech
březích samic potkanů a králíků během období organogeneze neměl amiodaron HCl v dávkách 25 mg/kg/den (přibližně 0,4násobek a 0,9násobek maximální doporučené udržovací dávky pro člověka*) žádné nežádoucí účinky na plod. U králíků způsobila dávka 75 mg/kg/den (přibližně 2,7násobek maximální doporučené udržovací dávky pro člověka*) potraty u více než 90 % zvířat. U potkanů byly dávky 50 mg/kg/den nebo vyšší spojeny s mírným posunem varlat a zvýšeným výskytem neúplné osifikace některých kostí lebky a prstů; při dávce 100 mg/kg/den nebo více byla snížena tělesná hmotnost plodu; při dávce 200 mg/kg/den byl pozorován zvýšený výskyt fetální resorpce. (Tyto dávky u potkanů jsou přibližně 0,8, 1,6 a 3,2násobek maximální doporučené udržovací dávky pro člověka*) Nežádoucí účinky na růst plodu a přežití byly také zaznamenány u jednoho ze dvou kmenů myší při dávce 5 mg/kg/den ( přibližně 0,04násobek maximální doporučené udržovací dávky pro člověka*).
*600 mg u pacienta s hmotností 60 kg (dávky srovnány na základě tělesného povrchu)
Laktace
Shrnutí rizik
Amiodaron a jeden z jeho hlavních metabolitů, DEA, jsou přítomny v mateřském mléce v rozmezí 3,5 % až 45 % dávky amiodaronu upravené podle hmotnosti matky. Existují případy hypotyreózy a bradykardie u kojených dětí, i když není jasné, zda jsou tyto účinky způsobeny expozicí amiodaronu v mateřském mléce. Během léčby přípravkem CORDARONE se nedoporučuje kojení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Ženy a muži reprodukčního potenciálu
Neplodnost
Na základě studií fertility na zvířatech může CORDARONE snižovat ženskou a mužskou plodnost. Není známo, zda je tento účinek reverzibilní. [vidět Neklinická toxikologie ].
Pediatrické použití
Bezpečnost a účinnost přípravku CORDARONE u pediatrických pacientů nebyla stanovena.
Geriatrické použití
Normální subjekty starší 65 let vykazují nižší clearance a zvýšený poločas léčiva než mladší subjekty [viz KLINICKÁ FARMAKOLOGIE ]. Obecně by měl být výběr dávky pro staršího pacienta opatrný, obvykle začínající na spodní hranici dávkovacího rozmezí, což odráží vyšší frekvenci snížené funkce jater, ledvin nebo srdce a souběžného onemocnění nebo jiné lékové terapie.
PŘEDÁVKOVAT
Vyskytly se případy, některé fatální, předávkování přípravkem CORDARONE 50 mg.
Monitorujte srdeční rytmus a krevní tlak pacienta, a pokud dojde k bradykardii, lze použít β-adrenergního agonistu nebo kardiostimulátor. Hypotenzi s nedostatečnou perfuzí tkání ošetřete pozitivně inotropními a vazopresorickými látkami. CORDARONE 50 mg ani jeho metabolit nejsou dialyzovatelné.
KONTRAINDIKACE
- Kardiogenní šok.
- Sick sinus syndrom, atrioventrikulární blok druhého nebo třetího stupně, bradykardie vedoucí k synkopě bez funkčního kardiostimulátoru.
- Známá přecitlivělost na léčivo nebo na kteroukoli jeho složku, včetně jódu.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Amiodaron je považován za antiarytmikum třídy III, ale má elektrofyziologické vlastnosti všech čtyř tříd Vaughana Williamse. Stejně jako léky třídy I blokuje amiodaron sodíkové kanály při rychlých stimulačních frekvencích a jako léky třídy II vykazuje amiodaron nekompetitivní antisympatický účinek. Jedním z jeho hlavních účinků při dlouhodobém podávání je prodloužení srdečního akčního potenciálu, což je účinek třídy III. Negativní chronotropní účinek amiodaronu v tkáních uzlin je podobný účinku léků třídy IV. Kromě blokování sodíkových kanálů blokuje amiodaron draslíkové kanály myokardu, což přispívá ke zpomalení vedení a prodloužení refrakternosti. Antisympatikus a blokace kalciových a draslíkových kanálů jsou zodpovědné za negativní dromotropní účinky na sinusový uzel a za zpomalení vedení a prodloužení refrakternosti v atrioventrikulárním (AV) uzlu. Jeho vazodilatační účinek může snížit srdeční zátěž a následně spotřebu kyslíku myokardem.
CORDARONE prodlužuje trvání akčního potenciálu všech srdečních vláken a zároveň způsobuje minimální snížení dV/dt (maximální rychlost zdvihu akčního potenciálu). Refrakterní období je prodlouženo ve všech srdečních tkáních. CORDARONE prodlužuje srdeční refrakterní periodu bez ovlivnění klidového membránového potenciálu, s výjimkou automatických buněk, kde je sklon prepotenciálu snížen, což obecně snižuje automaticitu. Tyto elektrofyziologické účinky se odrážejí ve snížení sinusové frekvence o 15 až 20 %, zvýšení PR a QT intervalů asi o 10 %, rozvoje U-vln a změn tvaru T-vlny. Tyto změny by neměly vyžadovat přerušení podávání CORDARONE 50 mg, protože jsou důkazem jeho farmakologického účinku, ačkoli CORDARONE může způsobit výraznou sinusovou bradykardii nebo zástavu dutin a srdeční blok [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Hemodynamika
Ve studiích na zvířatech a po intravenózním podání u člověka CORDARONE 100 mg uvolňuje hladké svalstvo cév, snižuje periferní cévní odpor (afterload) a mírně zvyšuje srdeční index. Po perorálním podání však CORDARONE 100 mg nevyvolává žádnou významnou změnu ejekční frakce levé komory (LVEF), a to ani u pacientů s depresí LVEF. Po akutním intravenózním podání u člověka může mít CORDARONE 100 mg mírně negativně inotropní účinek.
Farmakodynamika
Neexistuje žádný dobře prokázaný vztah mezi plazmatickou koncentrací a účinností, ale zdá se, že koncentrace mnohem nižší než 1 mg/l jsou často neúčinné a že hladiny nad 2,5 mg/l nejsou obecně potřeba. Měření plazmatické koncentrace lze použít k identifikaci pacientů, jejichž hladiny jsou neobvykle nízké a kteří by mohli mít prospěch ze zvýšení dávky nebo neobvykle vysoké, a kteří by mohli mít snížení dávky v naději na minimalizaci vedlejších účinků.
Účinky na abnormální rytmy nejsou pozorovány dříve než za 2 až 3 dny a obvykle vyžadují 1 až 3 týdny, i když je použita nasycovací dávka. Stále může docházet k pokračujícímu zvyšování účinku po delší dobu. Existují důkazy, že při použití režimu nasycovací dávky je doba do účinku kratší.
V souladu s pomalou rychlostí eliminace přetrvávají antiarytmické účinky týdny nebo měsíce po vysazení přípravku CORDARONE 50 mg, ale doba recidivy je variabilní a nepředvídatelná. Obecně platí, že když je podávání léku obnoveno po recidivě arytmie, kontrola je nastolena relativně rychle ve srovnání s počáteční odpovědí, pravděpodobně proto, že tkáňové zásoby nebyly zcela vyčerpány.
Farmakokinetika
Vstřebávání
Po perorálním podání u lidí se CORDARONE pomalu a variabilně vstřebává. Biologická dostupnost CORDARONE je přibližně 50 %. Maximální plazmatické koncentrace je dosaženo za 3 až 7 hodin po jednorázové dávce. Plazmatické koncentrace při chronickém dávkování 100 až 600 mg/den jsou přibližně úměrné dávce, s průměrným zvýšením o 0,5 mg/l na každých 100 mg/den. Tyto prostředky však zahrnují značnou individuální variabilitu.
Jídlo zvyšuje rychlost a rozsah absorpce CORDARONE. Účinky potravy na biologickou dostupnost CORDARONE byly studovány u 30 zdravých jedinců, kteří dostali jednorázovou 600mg dávku bezprostředně po konzumaci jídla s vysokým obsahem tuku a po celonočním hladovění. Plocha pod křivkou plazmatické koncentrace-čas (AUC) a maximální plazmatická koncentrace (Cmax) amiodaronu se v přítomnosti jídla zvýšila 2,3krát (rozmezí 1,7 až 3,6) a 3,8krát (rozmezí 2,7 až 4,4). Jídlo také zvýšilo rychlost absorpce amiodaronu a zkrátilo dobu do dosažení maximální plazmatické koncentrace (Tmax) o 37 %. Průměrná AUC a průměrná Cmax hlavního metabolitu amiodaronu, DEA se zvýšily o 55 % (rozmezí 58 až 101 %) a 32 % (rozmezí 4 až 84 %), ale nedošlo k žádné změně Tmax v přítomnosti jídlo.
Rozdělení
CORDARONE se silně váže na bílkoviny (přibližně 96 %). CORDARONE má velmi velký, ale proměnlivý distribuční objem, v průměru asi 60 l/kg, kvůli rozsáhlé akumulaci na různých místech, zejména v tukové tkáni a vysoce prokrvených orgánech, jako jsou játra, plíce a slezina.
U člověka byl identifikován jeden hlavní metabolit CORDARONE 50 mg, DEA; v ještě větší míře se hromadí téměř ve všech tkáních. Nejsou k dispozici žádné údaje o aktivitě DEA u lidí, ale u zvířat má významné elektrofyziologické a antiarytmické účinky obecně podobné jako samotný amiodaron. Přesná role a příspěvek DEA k antiarytmické aktivitě perorálního amiodaronu nejsou jisté. Rozvoj maximálních komorových účinků třídy III po perorálním podání 100 mg CORDARONE u lidí těsněji koreluje s akumulací DEA v průběhu času než s akumulací amiodaronu.
Odstranění
Po podání jedné dávky 12 zdravým subjektům vykazoval CORDARONE multikompartmentovou farmakokinetiku s průměrným zdánlivým plazmatickým terminálním eliminačním poločasem 58 dnů (rozmezí 15 až 142 dnů) pro amiodaron a 36 dnů (rozmezí 14 až 75 dnů) pro aktivní metabolit (DEA). U pacientů po přerušení chronické perorální léčby bylo prokázáno, že CORDARONE 100 mg má dvoufázovou eliminaci s počátečním 50% snížením plazmatických hladin po 2,5 až 10 dnech. Mnohem pomalejší terminální plazmatická eliminační fáze vykazuje poločas mateřské sloučeniny v rozmezí 26 až 107 dnů, s průměrem přibližně 53 dnů a většina pacientů v rozmezí 40 až 55 dnů. Bez období nasycovací dávky by se tedy rovnovážného stavu plazmatických koncentrací při konstantním perorálním dávkování dosáhlo mezi 130 a 535 dny, s průměrem 265 dnů. Pro metabolit byl průměrný poločas eliminace z plazmy přibližně 61 dní. Tato data pravděpodobně odrážejí počáteční eliminaci léčiva z dobře prokrvené tkáně (2,5 až 10denní poločas rozpadu), následovanou terminální fází představující extrémně pomalou eliminaci ze špatně prokrvených tkáňových kompartmentů, jako je tuk.
Značné rozdíly mezi jednotlivými subjekty v obou fázích eliminace, stejně jako nejistota ohledně toho, který kompartment je kritický pro účinek léku, vyžadují pozornost věnovanou individuálním reakcím, jakmile je dosaženo kontroly arytmie pomocí nasycovacích dávek, protože je částečně určena správná udržovací dávka. podle míry eliminace. Individualizujte udržovací dávky CORDARONE [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Metabolismus
Amiodaron je metabolizován na DEA skupinou enzymů cytochromu P450 (CYP), konkrétně CYP3A a CYP2C8. Izoenzym CYP3A je přítomen jak v játrech, tak ve střevech. In vitro vykazují amiodaron a DEA potenciál inhibovat CYP2C9, CYP2C19, CYP2D6, CYP3A, CYP2A6, CYP2B6 a CYP2C8. Amiodaron a DEA mají také potenciál inhibovat některé transportéry, jako je P-glykoprotein a transportér organických kationtů (OCT2).
Vylučování
Amiodaron je primárně eliminován jaterním metabolismem a biliární exkrecí a amiodaron nebo DEA je v moči vylučován jen zanedbatelně. Amiodaron ani DEA nejsou dialyzovatelné.
Specifické populace
Vliv věku
Normální jedinci starší 65 let vykazují nižší clearance (přibližně 100 ml/hod/kg) než mladší jedinci (přibližně 150 ml/hod/kg) a zvýšení t½ od přibližně 20 do 47 dnů.
Renální poškození
Porucha funkce ledvin neovlivňuje farmakokinetiku amiodaronu nebo DEA.
Poškození jater
Po jednorázové dávce intravenózního amiodaronu pacientům s cirhózou byly pozorovány významně nižší hodnoty Cmax a průměrné koncentrace DEA, ale průměrné hladiny amiodaronu se nezměnily.
Srdeční onemocnění
U pacientů s těžkou dysfunkcí levé komory není farmakokinetika amiodaronu významně změněna, ale je prodloužen terminální eliminační t½ DEA.
Přestože během chronické léčby perorálním amiodaronem nebyla definována žádná úprava dávkování u pacientů s renálními, jaterními nebo srdečními abnormalitami, je u starších pacientů a pacientů s těžkou dysfunkcí levé komory nutné pečlivé klinické sledování.
Lékové interakce
Účinky jiných látek na amiodaron
Grapefruitová šťáva: Grapefruitová šťáva podávaná zdravým dobrovolníkům zvýšila AUC amiodaronu o 50 % a Cmax o 84 % a snížila DEA na nekvantifikovatelné koncentrace.
Cimetidin inhibuje CYP3A a může zvýšit hladiny amiodaronu v séru.
Cholestyramin snižuje enterohepatální oběh amiodaronu, čímž zvyšuje jeho eliminaci. To má za následek snížení sérových hladin amiodaronu a jeho poločasu.
Účinky Amiodaronu Na Činidla
Substráty CYP3A
Amiodaron užívaný současně s chinidinem zvyšuje koncentraci chinidinu v séru po dvou dnech o 33 %. Amiodaron užívaný současně s prokainamidem po dobu kratší než sedm dní zvyšuje plazmatické koncentrace prokainamidu o 55 % a n-acetylprokainamidu o 33 %.
Loratadin, nesedativní antihistaminikum, je primárně metabolizován CYP3A a jeho metabolismus může být inhibován amiodaronem.
Metabolismus lidokainu může být inhibován amiodaronem.
Cyklofosfamid je proléčivo, metabolizované CYP450 včetně CYP3A na aktivní metabolit. Metabolismus cyklofosfamidu může být inhibován amiodaronem.
Klopidogrel, neaktivní thienopyridinové proléčivo, je metabolizován v játrech pomocí CYP3A na aktivní metabolit. Byla hlášena potenciální interakce mezi klopidogrelem a amiodaronem vedoucí k neúčinné inhibici agregace krevních destiček.
Makrolidová/ketolidová antibiotika
Amiodaron může inhibovat metabolismus makrolidových/ketolidových antibiotik (kromě azithromycinu) a systémových azolových antimykotik.
P-glykoproteinové substráty
Amiodaron užívaný současně s digoxinem zvyšuje koncentraci digoxinu v séru po jednom dni o 70 %.
Dabigatran-etexilát při současném užívání s perorálním amiodaronem může vést ke zvýšení sérové koncentrace dabigatranu.
Dextromethorfan je substrátem pro CYP2D6 i CYP3A. Amiodaron inhibuje CYP2D6. Chronické (> 2 týdny) perorální podávání amiodaronu narušuje metabolismus dextromethorfanu, může vést ke zvýšeným sérovým koncentracím.
INFORMACE PRO PACIENTA
CORDARONE® (KOR-DU-RON) (amiodaron) tablety
Jaké jsou nejdůležitější informace, které bych měl vědět o přípravku CORDARONE 50 mg?
CORDARONE může způsobit závažné nežádoucí účinky, které mohou vést ke smrti, včetně:
- plicní problémy
- problémy s játry
- zhoršení srdečních potíží
Zavolejte svého poskytovatele zdravotní péče nebo okamžitě vyhledejte lékařskou pomoc, pokud se u vás během léčby přípravkem CORDARONE objeví některý z následujících příznaků:
- potíže s dýcháním, sípání, dušnost, kašel, bolest na hrudi, plivání krve nebo horečka
- nevolnost nebo zvracení, hnědá nebo tmavě zbarvená moč, pocit únavy než obvykle, zežloutnutí kůže nebo očního bělma (žloutenka) nebo bolest v pravé horní části žaludku
- bušení srdce, přeskakování, rychlý nebo pomalý tlukot, točení hlavy nebo omdlévání
- problémy se zrakem, včetně rozmazaného vidění, vidět svatozáře nebo vaše oči budou citlivé na světlo. Před a během léčby přípravkem CORDARONE byste měl(a) podstupovat pravidelné oční prohlídky.
Léčba přípravkem CORDARONE by měla být zahájena v nemocnici, aby mohl být pečlivě sledován váš zdravotní stav.
CORDARONE by se měl používat pouze k léčbě lidí, u kterých byly diagnostikovány život ohrožující problémy se srdeční činností nazývané ventrikulární arytmie, pokud jiná léčba nefungovala nebo je nemůžete tolerovat.
CORDARONE 50 mg může způsobit další závažné nežádoucí účinky. Viz "Jaké jsou možné nežádoucí účinky přípravku CORDARONE 100 mg?" Pokud se u vás během léčby objeví závažné nežádoucí účinky, možná bude nutné přerušit podávání přípravku CORDARONE, změnit dávku nebo se nechat léčit. Než přestanete užívat CORDARONE, poraďte se se svým poskytovatelem zdravotní péče.
Nežádoucí účinky můžete mít i po ukončení léčby přípravkem CORDARONE, protože lék zůstává ve vašem těle měsíce po ukončení léčby.
Před a během léčby přípravkem CORDARONE 100 mg byste měl(a) pravidelně podstupovat kontroly, krevní testy, rentgen hrudníku, aby se zjistily závažné nežádoucí účinky. Před zahájením léčby přípravkem CORDARONE byste měli také podstoupit vyšetření funkce plic.
Co je CORDARONE?
CORDARONE je lék na předpis používaný k léčbě lidí, u kterých byly diagnostikovány život ohrožující problémy se srdečním rytmem nazývané ventrikulární arytmie, když jiná léčba nefungovala nebo je nemůžete tolerovat. Není známo, zda je CORDARONE bezpečný a účinný u dětí.
Kdo by neměl užívat CORDARONE 100 mg?
Neužívejte CORDARONE 100 mg, jestliže:
- máte vážný srdeční problém nazývaný kardiogenní šok
- máte určité typy srdečních onemocnění nazývaných srdeční blok, s nebo bez pomalé srdeční frekvence
- máte pomalý srdeční tep se závratěmi nebo točením hlavy a nemáte implantovaný kardiostimulátor
- jste alergický(á) na amiodaron, jód nebo na kteroukoli další složku přípravku CORDARONE. Úplný seznam složek v CORDARONE naleznete na konci tohoto Průvodce léčivy.
Před užitím přípravku CORDARONE 100 mg informujte svého poskytovatele zdravotní péče o všech svých zdravotních potížích, včetně toho, zda:
- máte problémy s plícemi nebo dýcháním
- mít problémy s játry
- máte nebo jste měli problémy se štítnou žlázou
- máte pomalý srdeční tep nebo problémy s krevním tlakem
- máte průjem nebo máte průjem po dlouhou dobu
- Vám bylo řečeno, že máte nízké hladiny draslíku, hořčíku nebo vápníku v krvi
- mít implantovaný kardiostimulátor nebo defribrilátor
- pokud plánujete operaci v celkové anestezii
- jste těhotná nebo plánujete otěhotnět. CORDARONE může poškodit vaše nenarozené dítě. Okamžitě informujte svého poskytovatele zdravotní péče, pokud během léčby přípravkem CORDARONE otěhotníte. CORDARONE 100 mg může zůstat ve vašem těle měsíce po ukončení léčby.
- kojíte nebo plánujete kojit. CORDARONE 100 mg může přecházet do vašeho mateřského mléka a může poškodit vaše dítě. Během užívání CORDARONE byste neměla kojit. CORDARONE může zůstat ve vašem těle měsíce po ukončení léčby. Promluvte si se svým poskytovatelem zdravotní péče o nejlepším způsobu krmení dítěte během této doby.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků. CORDARONE 50 mg a některé další léky se mohou vzájemně ovlivňovat a způsobit závažné nežádoucí účinky. Můžete požádat svého lékárníka o seznam léků, které interagují s CORDARONE.
Jak mám užívat CORDARONE?
- Po propuštění z nemocnice užívejte CORDARONE přesně podle pokynů svého lékaře.
- Váš poskytovatel zdravotní péče vám řekne, jaké množství CORDARONE máte užívat a kdy jej máte užívat.
- Váš poskytovatel zdravotní péče může změnit vaši dávku přípravku CORDARONE 50 mg podle potřeby, pokud je váš srdeční rytmus kontrolován nebo pokud máte určité nežádoucí účinky. Při změně dávky CORDARONE 50 mg by vás měl váš poskytovatel zdravotní péče pečlivě sledovat.
- Užívejte dávku CORDARONE pokaždé stejným způsobem, buď s jídlem nebo bez jídla.
- Pokud užijete příliš mnoho CORDARONE 100 mg, zavolejte svého poskytovatele zdravotní péče nebo jděte ihned na pohotovost v nejbližší nemocnici. Pokud vynecháte dávku, počkejte a vezměte si další dávku v obvyklou dobu. Neužívejte dvě dávky současně. Pokračujte v další pravidelné plánované dávce.
Čemu se mám vyhnout při užívání CORDARONE?
- Během léčby přípravkem CORDARONE se vyvarujte pití grapefruitové šťávy. Pití grapefruitové šťávy s přípravkem CORDARONE 50 mg může zvýšit množství přípravku CORDARONE v krvi, což může vést k nežádoucím účinkům.
- CORDARONE 100mg může způsobit, že vaše pokožka bude citlivá na sluneční záření. Mohli byste se vážně spálit. Používejte opalovací krém a noste klobouk a oblečení, které zakryje vaši pokožku, aby vás ochránilo, pokud musíte být na slunci. Pokud se spálíte, poraďte se se svým lékařem. Viz „Problémy s kůží“ v části Průvodce léčivy "Jaké jsou možné vedlejší účinky CORDARONE?" níže.
Jaké jsou možné vedlejší účinky CORDARONE?
CORADARONE může způsobit závažné nežádoucí účinky, včetně:
- Vidět "Jaké jsou nejdůležitější informace, které bych měl vědět o CORDARONE?"
- Problémy s nervy. CORDARONE 100 mg může způsobit nervové problémy. Zavolejte svého poskytovatele zdravotní péče, pokud se u vás objeví příznaky nervových problémů, včetně: pocitu „mračení“ nebo necitlivosti v rukou, nohou nebo chodidlech, svalové slabosti, nekontrolovaných pohybů, špatné koordinace nebo problémů s chůzí.
- Kožní problémy. CORDARONE může způsobit, že vaše pokožka bude citlivější na slunce nebo se změní na modrošedou. Lidé se světlou pletí nebo lidé, kteří jsou hodně vystaveni slunci, mohou být více ohroženi těmito kožními problémy. Část modrošedé barvy kůže se může vrátit k normálu po vysazení CORDARONE.
- Problémy se štítnou žlázou. CORDARONE může způsobit, že budete mít buď sníženou funkci štítné žlázy (hypotyreóza), která může být někdy závažná, nebo hyperaktivní štítnou žlázu (hypertyreóza), která může být závažná.
- Pokud se u Vás během léčby přípravkem CORDARONE rozvine snížená funkce štítné žlázy, může Váš poskytovatel zdravotní péče snížit dávku nebo ukončit léčbu přípravkem CORDARONE a případně předepsat lék, který Vám nahradí hormon štítné žlázy.
- Hyperaktivní štítná žláza může způsobit, že budete produkovat příliš mnoho hormonů štítné žlázy. I když užíváte CORDARONE, můžete mít abnormální srdeční tep. Váš poskytovatel zdravotní péče může předepsat určité léky k léčbě hyperaktivní štítné žlázy. Zavolejte svého poskytovatele zdravotní péče, pokud během léčby přípravkem CORDARONE dostanete abnormální srdeční tep. To může znamenat, že máte hyperaktivní štítnou žlázu.
- Váš poskytovatel zdravotní péče by měl provést testy ke kontrole funkce štítné žlázy před zahájením léčby přípravkem CORDARONE a v jejím průběhu.
- Zavolejte svého poskytovatele zdravotní péče, pokud se u vás během léčby přípravkem CORDARONE objeví některý z následujících příznaků problémů se štítnou žlázou:
- slabost
- hubnutí nebo přibývání na váze
- nesnášenlivost tepla nebo chladu
- řídnutí vlasů
- pocení
- změny ve vaší menstruaci
- otok krku (struma)
- nervozita
- podrážděnost
- neklid
- snížená koncentrace
- pocit deprese (u starších osob)
- třes
Mezi nejčastější vedlejší účinky CORDARONE patří:
- plicní problémy
- srdeční problémy
- srdeční problémy
- problémy s játry
CORDARONE 50 mg může ovlivnit plodnost u mužů a žen. Není známo, zda jsou účinky vratné. Promluvte si se svým poskytovatelem zdravotní péče, pokud máte obavy o plodnost.
To nejsou všechny možné vedlejší účinky CORDARONE. Další informace získáte od svého poskytovatele zdravotní péče nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám CORDARONE uchovávat?
- Uchovávejte CORDARONE 100 mg při pokojové teplotě mezi 20° až 25°C (68° až 77°F).
- CORDARONE uchovávejte v těsně uzavřené nádobě a uchovávejte CORDARONE 50 mg mimo světlo.
Uchovávejte CORDARONE 50 mg a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a efektivním používání CORDARONE
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Nepoužívejte CORDARONE na stav, pro který nebyl předepsán. Nedávejte CORDARONE jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit. Můžete požádat svého lékárníka nebo poskytovatele zdravotní péče o informace o přípravku CORDARONE, který je určen pro zdravotníky.
Jaké složky obsahuje CORDARONE 100 mg?
Aktivní složka: amiodaron HCl
Neaktivní ingredience: koloidní oxid křemičitý, laktóza, stearát hořečnatý, povidon, škrob a FD&C Red 40.
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv.
