Nimotop 30mg Nimodipine Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Nimotop 30 mg a jak se používá?
Nimotop je lék na předpis používaný k léčbě příznaků aneuryzmatu (subarachnoidálního krvácení). Nimotop lze užívat samostatně nebo s jinými léky.
Nimotop patří do třídy léků nazývaných blokátory kalciových kanálů; Neurologie, Ostatní; Blokátory vápníkových kanálů, dihydrofyridin.
Není známo, zda je Nimotop 30 mg bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Nimotop?
Nimotop může způsobit závažné nežádoucí účinky včetně:
- kopřivka,
- potíže s dýcháním,
- otok obličeje, rtů, jazyka nebo hrdla,
- točení hlavy,
- rychlý nebo pomalý srdeční tep a
- otoky nebo kotníky nebo nohy
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Nimotop patří:
- nízký krevní tlak (pocit točení hlavy),
- nevolnost,
- žaludeční nevolnost,
- pomalý srdeční tep a
- bolest svalů
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Nimotop. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
NEPODÁVEJTE NIMOTOP (nimodipin) INTRAVENÓZNĚ ANI JINÝMI PARENTERÁLNÍMI CESTAMI. SMRT A VÁŽNÉ, ŽIVOT OHROŽUJÍCÍ NEŽÁDOUCÍ UDÁLOSTI DOŠLY, POKUD BYL OBSAH TABLES NIMOTOP (nimodipin) INJEKTOVÁN PARENTERÁLNĚ (Viz VAROVÁNÍ a DÁVKOVÁNÍ A PODÁVÁNÍ).
POPIS
Nimotop® (nimodipin) patří do třídy farmakologických látek známých jako blokátory kalciových kanálů. Nimodipin je isopropyl-2-methoxyethyl-1,4-dihydro-2,6-dimethyl-4-(m-nitrofenyl)-3,5-pyridindikarboxylát. Má molekulovou hmotnost 418,5 a molekulový vzorec C21H26N2O7. Strukturní vzorec je:
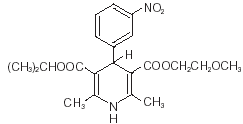
Nimodipin je žlutá krystalická látka, prakticky nerozpustná ve vodě.
Kapsle NIMOTOP® (nimodipin) jsou formulovány jako měkké želatinové kapsle pro orální podávání. Každá kapalná tobolka obsahuje 30 mg nimodipinu ve vehikulu z glycerinu, mátového oleje, čištěné vody a polyethylenglykolu 400. Obal tobolky z měkké želatiny obsahuje želatinu, glycerin, čištěnou vodu a oxid titaničitý.
INDIKACE
Nimotop® (nimodipin) je indikován ke zlepšení neurologického výsledku snížením výskytu a závažnosti ischemických deficitů u pacientů se subarachnoidálním krvácením z prasklých intrakraniálních aneuryzmat bobulí bez ohledu na jejich postiktus neurologický stav (tj. Hunt a Hess stupeň IV).
DÁVKOVÁNÍ A PODÁVÁNÍ
NEPODÁVEJTE KAPSLE NIMOTOP (nimodipin) INTRAVENÓZNĚ ANI JINÝMI PARENTERÁLNÍMI CESTAMI (viz VAROVÁNÍ). Pokud je Nimotop (nimodipin) neúmyslně podán intravenózně, klinicky významná hypotenze může vyžadovat kardiovaskulární podporu pomocí presorických látek. Specifická léčba předávkování blokátorem kalciových kanálů by měla být také okamžitě podána.
Nimotop (nimodipin) se podává perorálně ve formě slonovinově zbarvených měkkých želatinových tobolek 30 mg pro subarachnoidální krvácení.
Perorální dávka je 60 mg (dvě 30mg tobolky) každé 4 hodiny po dobu 21 po sobě jdoucích dnů, nejlépe ne méně než jednu hodinu před jídlem nebo dvě hodiny po jídle. Orální léčba Nimotop® (nimodipin) by měla začít do 96 hodin od subarachnoidálního krvácení.
Pokud tobolku nelze spolknout, např. v době chirurgického zákroku, nebo pokud je pacient v bezvědomí, je třeba jehlou 18 gauge udělat otvor na obou koncích tobolky a obsah tobolky extrahovat do injekční stříkačky. K extrakci kapaliny uvnitř kapsle lze použít parenterální injekční stříkačku, ale kapalina by měla být vždy přenesena do injekční stříkačky, do které nelze vložit jehlu a která je navržena pro perorální podání nebo pomocí nasogastrické sondy nebo PEG. Aby se minimalizovaly chyby při podávání, doporučuje se, aby injekční stříkačka použitá k podání byla označena „Není pro IV použití“. Obsah by měl být poté vyprázdněn do pacientovy in situnaso-gastrické sondy a vypláchnut 30 ml normálního fyziologického roztoku (0,9 %). V klinických studiích nebyla prokázána účinnost a bezpečnost tohoto způsobu podávání.
Pacienti s jaterní cirhózou mají podstatně sníženou clearance a přibližně dvojnásobnou Cmax. Dávkování by mělo být sníženo na 30 mg každé 4 hodiny za pečlivého sledování krevního tlaku a srdeční frekvence.
JAK DODÁVÁNO
Každá slonovinově zbarvená, měkká želatinová tobolka NIMOTOP® (nimodipin) je potištěna slovem Nimotop 30 mg a obsahuje 30 mg nimodipinu. 30mg tobolky jsou baleny v jednotkových fóliových sáčcích a dodávány v krabičkách obsahujících 100 tobolek. Výrobek je také dostupný v jednodávkových bezpečnostních fóliových sáčcích s dětskou pojistkou obsahující 30 tobolek v krabičce. Kapsle by měly být skladovány v originálním fóliovém balení výrobce při 25 °C (77 °F), odchylky povoleny do 15-30 °C (59-86 °F) [Viz USP řízená pokojová teplota.]
Kapsle by měly být chráněny před světlem a mrazem.
Distribuce: Bayer Pharmaceuticals Corporation, 400 Morgan Lane, West Haven, CT 06516. Výrobce: Catalent Pharma Solutions St. Petersburg, FL 33716. Datum revize FDA: 1/20/2006
VEDLEJŠÍ EFEKTY
Nežádoucí účinky byly hlášeny u 92 z 823 pacientů se subarachnoidálním krvácením (11,2 %), kterým byl podáván nimodipin. Nejčastěji hlášeným nežádoucím účinkem byl pokles krevního tlaku u 4,4 % těchto pacientů. Dvacet devět ze 479 (6,1 %) pacientů léčených placebem také hlásilo nežádoucí účinky. Příhody hlášené s frekvencí vyšší než 1 % jsou uvedeny níže podle dávky.
DÁVKA q4h Počet pacientů (%) Nimodipin
pacientů, kterým bylo podáváno 0,35 mg/kg q4h, 30 mg q4h nebo 120 mg q4h, nebyly hlášeny žádné další nežádoucí účinky. Nežádoucí zkušenosti s incidencí nižší než 1 % ve skupině s dávkou 60 mg q4h byly: hepatitida; svědění; gastrointestinální krvácení; trombocytopenie; anémie; bušení srdce; zvracení; proplachování; diaforéza; sípání; toxicita fenytoinu; závratě; závrať; rebound vazospasmus; žloutenka; hypertenze; hematom.
Nežádoucí účinky s četností výskytu nižší než 1 % ve skupině s dávkou 90 mg q4h byly: svědění, gastrointestinální krvácení; trombocytopenie; neurologické zhoršení; zvracení; diaforéza; městnavé srdeční selhání; hyponatrémie; snížení počtu krevních destiček; Diseminovaná intravaskulární koagulace; hluboká žilní trombóza.
Jak je vidět z tabulky, vedlejší účinky, které se zdají související s užíváním nimodipinu na základě zvýšeného výskytu při vyšší dávce nebo vyšší četnosti ve srovnání s kontrolou placeba, zahrnovaly snížení krevního tlaku, otoky a bolesti hlavy, což jsou známé farmakologické účinky blokátorů kalciových kanálů. Je však třeba poznamenat, že SAH je často doprovázena změnami vědomí, které vedou k nedostatečnému hlášení nežádoucích účinků. Pacienti, kteří dostávali nimodipin v klinických studiích pro jiné indikace, hlásili zrudnutí (2,1 %), bolest hlavy (4,1 %) a retenci tekutin (0,3 %), což jsou typické odpovědi na blokátory kalciových kanálů. Jako blokátor kalciového kanálu může mít nimodipin potenciál zhoršit srdeční selhání u citlivých pacientů nebo interferovat s AV vedením, ale tyto příhody nebyly pozorovány.
perorálním nimodipinem nebyly kauzálně spojeny žádné klinicky významné účinky na hematologické faktory, funkci ledvin nebo jater nebo metabolismus sacharidů. Byly hlášeny ojedinělé případy zvýšených hladin glukózy v séru mimo lačno (0,8 %), zvýšených hladin LDH (0,4 %), sníženého počtu krevních destiček (0,3 %), zvýšených hladin alkalické fosfatázy (0,2 %) a zvýšených hladin SGPT (0,2 %) zřídka.

Zneužívání drog a závislost
Nebyly hlášeny žádné případy zneužívání drog nebo závislosti na přípravku Nimotop® (nimodipin).
DROGOVÉ INTERAKCE
Je možné, že kardiovaskulární účinek jiných blokátorů kalciových kanálů by mohl být zvýšen přidáním přípravku Nimotop® (nimodipin).
V Evropě bylo pozorováno, že přípravek Nimotop® (nimodipin) příležitostně zesiluje účinek antihypertenziv užívaných současně pacienty trpícími hypertenzí; tento jev nebyl pozorován v severoamerických klinických studiích.
Studie na osmi zdravých dobrovolnících prokázala 50% zvýšení průměrné maximální plazmatické koncentrace nimodipinu a 90% zvýšení průměrné plochy pod křivkou po týdenní léčbě cimetidinem v dávce 1 000 mg/den a nimodipinem v dávce 90 mg/den . Tento účinek může být zprostředkován známou inhibicí jaterního cytochromu P-450 cimetidinem, což by mohlo snížit metabolismus nimodipinu při prvním průchodu játry.
VAROVÁNÍ
SMRT V DŮSLEDKU NEÚMYSLNÉ INTRAVENOZNÍ PODÁNÍ: NEPODÁVEJTE NIMOTOP (nimodipin) INTRAVENÓZNĚ ANI JINÝMI PARENTERÁLNÍMI CESTAMI. SMRT A VÁŽNÉ, ŽIVOT OHROŽUJÍCÍ NEŽÁDOUCÍ UDÁLOSTI, VČETNĚ ZÁSTAVY SRDCE, KARDIOVASKULÁRNÍHO KOlapsu, HYPOTENZE A BRADYKARDIE, KDYŽ BYL OBSAH TABLES NIMOTOP (nimodipin) A PARENINIDMOS BEZELYSALLYS.
OPATŘENÍ
Všeobecné: Krevní tlak: Nimodipin má hemodynamické účinky očekávané od blokátorů kalciových kanálů, i když obecně nejsou výrazné. Intravenózní podání obsahu tobolek Nimotop (nimodipin) však vedlo k vážným nepříznivým následkům včetně smrti, srdeční zástavy, kardiovaskulárního kolapsu, hypotenze a bradykardie. U pacientů se subarachnoidálním krvácením, kterým byl v klinických studiích podáván Nimotop® (nimodipin), bylo u přibližně 5 % hlášeno snížení krevního tlaku a přibližně 1 % kvůli tomu opustilo studii (ne všechny lze připsat nimodipinu). Přesto by měl být krevní tlak během léčby přípravkem Nimotop® (nimodipin) pečlivě sledován na základě jeho známé farmakologie a známých účinků blokátorů kalciových kanálů. (vidět VAROVÁNÍ a DÁVKOVÁNÍ A PODÁVÁNÍ )
Onemocnění jater: Metabolismus přípravku Nimotop® (nimodipin) je snížen u pacientů s poruchou funkce jater. U těchto pacientů by měl být pečlivě sledován krevní tlak a tepová frekvence a měla by jim být podávána nižší dávka (viz DÁVKOVÁNÍ A PODÁVÁNÍ ).
U pacientů léčených nimodipinem byla vzácně hlášena střevní pseudoobstrukce a ileus. Příčinná souvislost nebyla prokázána. Stav reagoval na konzervativní léčbu.
Interakce s laboratorními testy: Žádné známé.
Karcinogeneze, mutageneze, zhoršení plodnosti: Ve dvouleté studii byl pozorován vyšší výskyt adenokarcinomu dělohy a adenomu z Leydigových buněk varlat u potkanů, kterým byla podávána strava obsahující 1800 ppm nimodipinu (ekvivalent 91 až 121 mg/kg/den nimodipinu) než u kontrol s placebem . Rozdíly však nebyly statisticky významné a vyšší četnosti byly dobře v historickém kontrolním rozmezí pro tyto nádory u kmene Wistar.
91týdenní studii na myších nebylo zjištěno, že nimodipin není karcinogenní, ale vysoká dávka 1800 ppm nimodipinu v krmivu (546 až 774 mg/kg/den) zkrátila očekávanou délku života zvířat. Studie mutagenity, včetně Amesových, mikronukleových a dominantních letálních testů byly negativní. Nimodipin nezhoršil plodnost a obecnou reprodukční schopnost samců a samic potkanů Wistar po perorálních dávkách až 30 mg/kg/den, pokud byl podáván denně po dobu delší než 10 týdnů u samců a 3 týdny u samic před pářením a pokračoval do 7. dne těhotenství. Tato dávka u potkana je asi 4násobkem ekvivalentní klinické dávky 60 mg q4h u pacienta o hmotnosti 50 kg.
Těhotenství: Těhotenství kategorie C. Bylo prokázáno, že nimodipin má u himálajských králíků teratogenní účinek. Výskyt malformací a zakrnělých plodů se zvýšil při perorálních dávkách 1 a 10 mg/kg/den podávaných (žaludeční sondou) od 6. do 18. dne březosti, ale ne při 3,0 mg/kg/den v jedné ze dvou identických studií na králících. Ve druhé studii byl pozorován zvýšený výskyt zakrnělých plodů při 1,0 mg/kg/den, ale ne při vyšších dávkách. Nimodipin byl embryotoxický a způsoboval resorpci a zastavení růstu plodů u potkanů Long Evans v dávce 100 mg/kg/den podávané sondou od 6. do 15. dne březosti. Ve dvou dalších studiích na potkanech byly dávky nimodipinu 30 mg/kg/den podávané žaludeční sondou od 16. dne gestace a pokračovaly až do usmrcení (20. den březosti nebo 21. den po porodu) spojeny s vyšším výskytem kosterních variací, zakrnělých plodů a mrtvě narozená, ale bez malformací. Neexistují žádné adekvátní a dobře kontrolované studie u těhotných žen, které by přímo zhodnotily účinek na lidské plody. Nimodipin by měl být během těhotenství podáván pouze tehdy, pokud potenciální přínos ospravedlňuje potenciální riziko pro plod.
Kojící matky: Bylo prokázáno, že nimodipin a/nebo jeho metabolity se objevují v mléce potkanů v koncentracích mnohem vyšších než v mateřské plazmě. Není známo, zda se lék vylučuje do mateřského mléka. Protože se mnoho léků vylučuje do lidského mléka, kojícím matkám se doporučuje, aby při užívání léku nekojily své děti.
Pediatrické použití: Bezpečnost a účinnost u dětí nebyla stanovena.
Geriatrické použití: Klinické studie nimodipinu nezahrnovaly dostatečný počet subjektů ve věku 65 let a více, aby bylo možné určit, zda reagují odlišně od mladších subjektů. Jiné hlášené klinické zkušenosti nezjistily rozdíly v odpovědích mezi staršími a mladšími pacienty. Obecně by dávkování u starších pacientů mělo být opatrné s ohledem na vyšší frekvenci snížené funkce jater, ledvin nebo srdce a souběžného onemocnění nebo jiné lékové terapie.
PŘEDÁVKOVAT
Nebyly hlášeny žádné zprávy o předávkování při perorálním podání přípravku Nimotop® (nimodipin). Lze očekávat, že příznaky předávkování budou souviset s kardiovaskulárními účinky, jako je nadměrná periferní vazodilatace s výraznou systémovou hypotenzí. Klinicky významná hypotenze v důsledku předávkování Nimotop® (nimodipin) může vyžadovat aktivní kardiovaskulární podporu pomocí presorických látek. Specifická léčba předávkování blokátorem kalciových kanálů by měla být také okamžitě podána. Protože Nimotop® (nimodipin) je vysoce vázán na proteiny, dialýza pravděpodobně nebude přínosem.
KONTRAINDIKACE
Žádné známé.
KLINICKÁ FARMAKOLOGIE
Mechanismus účinku: Nimodipin je blokátor vápníkových kanálů. Kontraktilní procesy buněk hladkého svalstva jsou závislé na iontech vápníku, které vstupují do těchto buněk během depolarizace jako pomalé iontové transmembránové proudy. Nimodipin inhibuje přenos iontů vápníku do těchto buněk a tím inhibuje kontrakce hladkého svalstva cév. V pokusech na zvířatech měl nimodipin větší účinek na mozkové tepny než na tepny jinde v těle, možná proto, že je vysoce lipofilní, což mu umožňuje procházet hematoencefalickou bariérou; v mozkomíšním moku pacientů se subarachnoidálním krvácením (SAH) léčených nimodipinem byly zjištěny koncentrace nimodipinu až 12,5 ng/ml. Přesný mechanismus účinku nimodipinu u lidí není znám. Ačkoli klinické studie popsané níže prokazují příznivý účinek nimodipinu na závažnost neurologických deficitů způsobených cerebrálním vazospasmem po SAH, neexistuje žádný arteriografický důkaz, že lék buď zabraňuje nebo zmírňuje křeče těchto tepen. Není však známo, zda použitá arteriografická metodologie byla či nebyla adekvátní k detekci klinicky významného účinku, pokud vůbec nějaký, na vazospasmus.
Farmakokinetika a metabolismus: člověka se nimodipin po perorálním podání rychle vstřebává a maximálních koncentrací je obecně dosaženo během jedné hodiny. Terminální eliminační poločas je přibližně 8 až 9 hodin, ale dřívější rychlosti eliminace jsou mnohem rychlejší, ekvivalentní poločasu 1-2 hodin; následkem je potřeba častého (každé 4 hodiny) dávkování. Při podávání nimodipinu třikrát denně po dobu sedmi dnů nebyly žádné známky akumulace. Nimodipin se z více než 95 % váže na plazmatické proteiny. Vazba byla nezávislá na koncentraci v rozmezí 10 ng/ml až 10 ug/ml. Nimodipin je vylučován téměř výhradně ve formě metabolitů a méně než 1 % se vyloučí močí jako nezměněné léčivo. Byla identifikována řada metabolitů, z nichž všechny jsou buď neaktivní, nebo podstatně méně aktivní než původní sloučenina. Vzhledem k vysokému metabolismu při prvním průchodu játry je biologická dostupnost nimodipinu po perorálním podání v průměru 13 %. Biologická dostupnost je významně zvýšena u pacientů s jaterní cirhózou, přičemž Cmax je přibližně dvojnásobná ve srovnání s normálními pacienty, což vyžaduje snížení dávky u této skupiny pacientů (viz DÁVKOVÁNÍ A PODÁVÁNÍ ). Ve studii 24 zdravých dobrovolníků mužského pohlaví vedlo podávání tobolek nimodipinu po standardní snídani o 68 % nižší maximální plazmatické koncentrace a o 38 % nižší biologickou dostupnost ve srovnání s dávkováním nalačno.
V jediné studii s paralelními skupinami zahrnující 24 starších subjektů (ve věku 59-79 let) a 24 mladších subjektů (ve věku 22-40 let) byly pozorované AUC a Cmax nimodipinu přibližně 2krát vyšší u starší populace ve srovnání s mladší studií subjektům po perorálním podání (podané jako jedna dávka 30 mg a dávkované do ustáleného stavu 30 mg třikrát denně po dobu 6 dnů). Klinická odpověď na tyto farmakokinetické rozdíly související s věkem však nebyla považována za významnou. (Vidět OPATŘENÍ : Geriatrické použití.)
Klinické testy: Ve 4 randomizovaných, dvojitě zaslepených, placebem kontrolovaných studiích bylo prokázáno, že nimodipin snižuje závažnost neurologických deficitů vyplývajících z vazospasmů u pacientů, kteří nedávno prodělali subarachnoidální krvácení (SAH). Ve studiích byly použity dávky v rozmezí 20–30 mg až 90 mg každé 4 hodiny, přičemž ve 3 studiích byl lék podáván po dobu 21 dní a ve druhé po dobu alespoň 18 dní. Tři ze čtyř studií sledovaly pacienty po dobu 3–6 měsíců. Tři ze studií studovaly relativně dobře pacienty, se všemi nebo většinou pacientů ve stupních Hunt a Hess I - III (v podstatě bez fokálních deficitů po počátečním krvácení), čtvrtá zkoumala mnohem nemocnější pacienty, Hunt a Hess stupně III - V. Dvě studie jeden americký a jeden francouzský měli podobný design, s relativně nepoškozenými pacienty s SAH randomizovanými k nimodipinu nebo placebu. V každé z nich bylo posouzeno, zda je nějaký opožděně se vyvíjející deficit způsoben křečí nebo jinými příčinami, a deficity byly odstupňovány. Obě studie ukázaly významně méně závažných deficitů způsobených spasmem ve skupině s nimodipinem; druhá (francouzská) studie prokázala méně deficitů souvisejících se spasmy všech stupňů závažnosti. Nebyl pozorován žádný účinek na deficity nesouvisející se spasmem.
Třetí, velká studie byla provedena ve Spojeném království u pacientů s SAH se všemi stupni závažnosti (ale 89 % bylo ve stupních I-III). Nimodipin byl podáván v dávce 60 mg každé 4 hodiny. Výsledky nebyly definovány jako související nebo nesouvisející se křečemi, ale došlo k významnému snížení celkového počtu infarktů a závažného invalidizujícího neurologického výsledku po 3 měsících:
Kanadská studie zahrnovala mnohem nemocnější pacienty (Hunt a Hess stupně III-V), kteří měli vysokou míru úmrtí a invalidity a používali dávku 90 mg každé 4 hodiny, ale jinak byla podobná prvním dvěma studiím. Analýza opožděných ischemických deficitů, z nichž mnohé jsou důsledkem spasmu, ukázala významné snížení deficitů souvisejících se spasmy. Mezi analyzovanými pacienty (72 nimodipin, 82 placebo) byly následující výsledky.
Když byly zkombinovány údaje pro kanadské studie a studie Spojeného království, rozdíl v léčbě v míře úspěšnosti (tj. dobré zotavení) na Glasgowské výsledné škále byl 25,3 % (nimodipin) oproti 10,9 % (placebo) pro Hunt a Hess stupně IV nebo V. Níže uvedená tabulka ukazuje, že nimodipin má tendenci zlepšovat dobré zotavení pacientů s SAH se špatným neurologickým stavem po záchvatu, zatímco snižuje počty s těžkým postižením a vegetativním přežitím.
Studie s rozmezím dávek porovnávající dávky 30, 60 a 90 mg zjistila obecně nízkou míru neurologických deficitů souvisejících se spasmy, ale žádný vztah mezi dávkou a odezvou.
INFORMACE PRO PACIENTA
Nebyly poskytnuty žádné informace. Podívejte se prosím na VAROVÁNÍ a OPATŘENÍ sekce.
