Dostinex 0.25mg, 0.5mg Cabergoline Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Dostinex 0,25 mg a jak se používá?
Dostinex (kabergolin) je antagonista dopaminového receptoru používaný k léčbě hormonální nerovnováhy, při které je v krvi příliš mnoho prolaktinu (také nazývané hyperprolaktinémie).
Jaké jsou vedlejší účinky přípravku Dostinex?
Mezi časté nežádoucí účinky přípravku Dostinex 0,25 mg patří:
- nevolnost,
- zvracení,
- žaludeční nevolnost nebo bolest,
- špatné trávení,
- zácpa,
- plyn,
- závrať,
- pocit točení,
- točení hlavy,
- ospalost,
- nervozita,
- únava,
- bolest hlavy,
- depresivní nálada,
- návaly horka,
- pocit necitlivosti nebo mravenčení, popř
- suchá ústa.
Informujte svého lékaře, pokud zaznamenáte vzácné, ale závažné nežádoucí účinky přípravku Dostinex, včetně:
- dušnost,
- přetrvávající kašel,
- otoky kotníků nebo nohou,
- neobvyklá únava,
- mentální změny/změny nálady (jako je nervozita),
- neobvyklé silné nutkání (jako je zvýšené hraní hazardních her, zvýšené sexuální touhy),
- změny vidění,
- bolestivou menses, popř
- bolest prsou.
POPIS
Tablety DOSTINEX obsahují kabergolin, agonistu dopaminového receptoru. Chemický název kabergolinu je 1-[(6-allylergolin-8p-yl)-karbonyl]-1-[3-(dimethylamino)propyl]-3-ethylmočovina. Jeho empirický vzorec je C26H37N5O2 a jeho molekulová hmotnost je 451,62. Strukturní vzorec je následující:
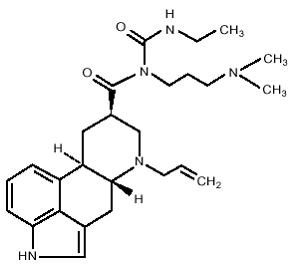
Kabergolin je bílý prášek rozpustný v ethylalkoholu, chloroformu a N,N-dimethylformamidu (DMF); mírně rozpustný v 0,1N kyselině chlorovodíkové; velmi málo rozpustný v n-hexanu; a nerozpustný ve vodě.
DOSTINEX 0,25 mg tablety pro perorální podání obsahují 0,5 mg kabergolinu. Neaktivní složky se skládají z leucinu, USP, a laktózy, NF.
INDIKACE
DOSTINEX 0,5 mg tablety je indikován k léčbě hyperprolaktinemických poruch, buď idiopatických, nebo v důsledku adenomů hypofýzy.
DÁVKOVÁNÍ A PODÁVÁNÍ
Doporučená dávka přípravku DOSTINEX 0,25 mg tablety pro zahájení léčby je 0,25 mg dvakrát týdně. Dávkování může být zvýšeno o 0,25 mg dvakrát týdně až na dávku 1 mg dvakrát týdně podle hladiny prolaktinu v séru pacienta. Před zahájením léčby by mělo být provedeno kardiovaskulární vyšetření a měla by být zvážena echokardiografie k posouzení chlopenního onemocnění.
Ke zvyšování dávky by nemělo docházet rychleji než každé 4 týdny, aby lékař mohl posoudit pacientovu odpověď na každou úroveň dávky. Pokud pacient nereaguje adekvátně a při vyšších dávkách není pozorován žádný další přínos, měla by se použít nejnižší dávka, která dosáhla maximální odpovědi, a zvážit další terapeutické přístupy. Pacienti, kteří jsou dlouhodobě léčeni přípravkem DOSTINEX 0,25 mg, by měli podstupovat pravidelné vyšetření srdečního stavu a měla by být zvážena echokardiografie.
Poté, co byla normální hladina sérového prolaktinu udržována po dobu 6 měsíců, může být léčba přípravkem DOSTINEX 0,5 mg přerušena s pravidelným sledováním hladiny prolaktinu v séru, aby se určilo, zda nebo kdy má být léčba přípravkem DOSTINEX znovu zahájena. Trvanlivost účinnosti po 24 měsících léčby přípravkem DOSTINEX nebyla stanovena.
JAK DODÁVÁNO
DOSTINEX tablety jsou bílé tablety ve tvaru tobolky s půlicí rýhou a 0,5 mg kabergolinu. Každá tableta je na jedné straně s půlicí rýhou a na obou stranách půlicí rýhy má písmeno P a písmeno U. Na druhé straně tabletu je vyryto číslo 700.
DOSTINEX je k dispozici následovně:
Lahvičky po 8 tabletách NDC 0013-7001-12
Úložný prostor
Skladujte při kontrolované pokojové teplotě 20 ° až 25 ° C (68 ° až 77 ° F) [viz USP ].
Štítek tohoto produktu mohl být aktualizován. Aktuální úplné informace o předepisování naleznete na www.pfizer.com
Distribuuje: Pharmacia & Upjohn Company Division společnosti Pfizer Inc., NY, NY 10017. Revize: září 2014
VEDLEJŠÍ EFEKTY
Bezpečnost přípravku DOSTINEX 0,25 mg tablety byla hodnocena u více než 900 pacientů s hyperprolaktinemickými poruchami. Většina nežádoucích účinků byla mírná nebo středně závažná.
Ve 4týdenní, dvojitě zaslepené, placebem kontrolované studii se léčba skládala z placeba nebo kabergolinu ve fixních dávkách 0,125, 0,5, 0,75 nebo 1,0 mg dvakrát týdně. Během prvního týdne byly dávky sníženy na polovinu. Protože možný účinek závislý na dávce byl pozorován pouze u nevolnosti, byly čtyři léčebné skupiny kabergolinem zkombinovány. Výskyt nejčastějších nežádoucích účinků během placebem kontrolované studie je uveden v následující tabulce.
Výskyt hlášených nežádoucích příhod během 4týdenního, dvojitě zaslepeného, placebem kontrolovaného hodnocení
8týdenním, dvojitě zaslepeném období srovnávací studie s bromokriptinem byl DOSTINEX (v dávce 0,5 mg dvakrát týdně) přerušen z důvodu nežádoucí příhody u 4 z 221 pacientů (2 %), zatímco bromokriptin (v dávce 2,5 mg dvakrát denně) bylo vysazeno u 14 z 231 pacientů (6 %). Nejčastějšími důvody pro přerušení léčby přípravkem DOSTINEX byly bolest hlavy, nauzea a zvracení (3, 2 a 2 pacienti v uvedeném pořadí); nejčastějšími důvody pro přerušení léčby bromokriptinem byly nauzea, zvracení, bolest hlavy a závratě nebo vertigo (10, 3, 3 a 3 pacienti). Výskyt nejčastějších nežádoucích účinků během dvojitě zaslepené části srovnávací studie s bromokriptinem je uveden v následující tabulce.
Výskyt hlášených nežádoucích příhod během 8týdenního dvojitě zaslepeného období srovnávacího testu s bromokriptinem
Následují další nežádoucí účinky, které byly hlášeny s incidencí
Tělo jako celek: otok obličeje, příznaky podobné chřipce, malátnost
Kardiovaskulární systém: hypotenze, synkopa, palpitace
Zažívací ústrojí: sucho v ústech, plynatost, průjem, anorexie
Metabolický a nutriční systém: hubnutí, přibírání na váze
Nervový systém: somnolence, nervozita, parestézie, nespavost, úzkost
Dýchací systém: ucpaný nos, epistaxe
Kůže a přílohy: akné, svědění
Speciální smysly: abnormální vidění
Urogenitální systém: dysmenorea, zvýšené libido
Bezpečnost kabergolinu byla hodnocena u přibližně 1 200 pacientů s Parkinsonovou nemocí v kontrolovaných a nekontrolovaných studiích v dávkách až 11,5 mg/den, což vysoce překračuje maximální doporučené dávkování kabergolinu pro hyperprolaktinemické poruchy. Kromě nežádoucích účinků, které se vyskytly u pacientů s hyperprolaktinemickými poruchami, byly nejčastějšími nežádoucími účinky u pacientů s Parkinsonovou chorobou dyskineze, halucinace, zmatenost a periferní edém. Srdeční selhání, pleurální výpotek, plicní fibróza a žaludeční nebo duodenální vřed se vyskytly vzácně. Byl hlášen jeden případ konstriktivní perikarditidy.
Údaje z postmarketingového sledování
V souvislosti s přípravkem DOSTINEX byly hlášeny následující příhody: srdeční valvulopatie a extrakardiální fibrotické reakce (viz VAROVÁNÍ , Srdeční valvulopatie a extrakardiální fibrotické reakce ).
souvislosti s kabergolinem byly hlášeny další příhody: hypersexualita, zvýšené libido a patologické hráčství (viz OPATŘENÍ , Psychiatrické ). Kromě toho byly u pacientů užívajících DOSTINEX hlášeny případy alopecie, agrese a psychotických poruch. Některé z těchto hlášení se vyskytly u pacientů, kteří měli předchozí nežádoucí reakce na přípravky obsahující agonisty dopaminu.
DROGOVÉ INTERAKCE
DOSTINEX 0,5 mg by neměl být podáván současně s D-antagonisty, jako jsou fenothiaziny, butyrofenony, thioxanteny nebo metoklopramid.
VAROVÁNÍ
Těhotenství
Agonisté dopaminu by se obecně neměli používat u pacientek s hypertenzí vyvolanou těhotenstvím, například preeklampsií, eklampsií a postpartální hypertenzí, pokud potenciální přínos nepřeváží možné riziko.
Fibrotické komplikace
Srdeční valvulopatie
Všichni pacienti by měli podstoupit kardiovaskulární vyšetření, včetně echokardiogramu, aby se zhodnotila potenciální přítomnost chlopenního onemocnění. Pokud je zjištěno onemocnění chlopní, pacient by neměl být léčen přípravkem DOSTINEX. (Vidět KONTRAINDIKACE ) Po uvedení přípravku na trh byly u pacientů užívajících DOSTINEX hlášeny případy srdeční valvulopatie. Tyto případy se obecně vyskytly při podávání vysokých dávek přípravku DOSTINEX (> 2 mg/den) k léčbě Parkinsonovy choroby. U pacientů užívajících nižší dávky přípravku DOSTINEX k léčbě hyperprolaktinemických poruch byly také hlášeny případy srdeční valvulopatie.
Byla provedena retrospektivní kohortová studie pro více zemí využívající záznamy z praktického lékařství a systémy propojení záznamů ve Spojeném království, Itálii a Nizozemsku s cílem posoudit souvislost mezi novým použitím agonistů dopaminu včetně kabergolinu (n = 27 812) pro Parkinsonovu chorobu a hyperprolaktinémii a srdeční onemocnění. chlopenní regurgitace (CVR), další fibrózy a další kardiopulmonální příhody během maximálně 12 let sledování. V této studii bylo užívání kabergolinu u osob s Parkinsonovou nemocí spojeno se zvýšeným rizikem CVR ve srovnání s agonisty dopaminu (DA) a levodopou neodvozenými z námelu [Incidence Rate (IR) na 10 000 osoboroků 68,1 (95 % interval spolehlivosti (CI): 37,2–115,3) pro kabergolin vs. 10,0 (95% CI: 5,2–19,4) pro neergotové DA a 11,3 (95% CI: 7,2–17,0) pro levodopu]. V analýze studie omezené na osoby s hyperprolaktinémií léčenou agonistou dopaminu (n=8 386) neměly osoby vystavené kabergolinu zvýšené riziko CVR ve srovnání s pacienty, které neužívaly (n=15 147). Zjištění týkající se rizika CVR spojeného s léčbou kabergolinem u osob s Parkinsonovou nemocí (zvýšené riziko) au osob s hyperprolaktinémií (bez zvýšeného rizika) jsou v souladu se zjištěními v jiných publikovaných studiích.
Lékaři by měli k léčbě hyperprolaktinemických poruch používat nejnižší účinnou dávku přípravku DOSTINEX a měli by pravidelně přehodnocovat potřebu pokračování v léčbě přípravkem DOSTINEX. Po zahájení léčby by mělo být provedeno klinické a diagnostické sledování (například rentgen hrudníku, CT vyšetření a srdeční echokardiogram), aby bylo možné posoudit riziko srdeční valvulopatie. Doporučená frekvence rutinního echokardiografického monitorování je každých 6 až 12 měsíců nebo podle klinické indikace s přítomností známek a symptomů, jako je edém, nový srdeční šelest, dušnost nebo městnavé srdeční selhání.
Pokud echokardiogram odhalí novou chlopenní regurgitaci, chlopenní restrikci nebo ztluštění cípu chlopně, je třeba léčbu přípravkem DOSTINEX přerušit.
DOSTINEX by měl být používán s opatrností u pacientů vystavených jiným lékům spojeným s valvulopatií.

Extrakardiální fibrotické reakce
Po uvedení přípravku DOSTINEX na trh byly hlášeny případy pleurální, perikardiální a retroperitoneální fibrózy. Některá hlášení byla u pacientů dříve léčených jinými ergotinovými agonisty dopaminu. DOSTINEX by se neměl používat u pacientů s anamnézou srdečních nebo extrakardiálních fibrotických poruch.
Fibrotické poruchy mohou mít záludný začátek a pacienti by měli být sledováni kvůli projevům progresivní fibrózy. Proto je třeba během léčby věnovat pozornost příznakům a symptomům:
- Pleuro-pulmonální onemocnění, jako je dušnost, dušnost, přetrvávající kašel nebo bolest na hrudi.
- Renální insuficience nebo ureterální/abdominální vaskulární obstrukce, která se může objevit s bolestí v bedrech/boku a edémem dolních končetin, stejně jako s případnými břišními útvary nebo citlivostí, které mohou naznačovat retroperitoneální fibrózu.
- Srdeční selhání: Případy chlopenní a perikardiální fibrózy se často manifestovaly jako srdeční selhání. Proto je třeba vyloučit chlopenní fibrózu (a konstrikční perikarditidu), pokud se takové příznaky objeví.
Klinické a diagnostické monitorování, jako je rychlost sedimentace erytrocytů, rentgen hrudníku, měření sérového kreatininu a další vyšetření by měla být zvážena na začátku léčby a podle potřeby během léčby přípravkem DOSTINEX.
Po diagnóze pleurálního výpotku nebo plicní fibrózy bylo hlášeno, že přerušení léčby přípravkem DOSTINEX vedlo ke zlepšení známek a příznaků.
OPATŘENÍ
Všeobecné
Počáteční dávky vyšší než 1,0 mg mohou způsobit ortostatickou hypotenzi. Při podávání přípravku DOSTINEX s jinými léky, o nichž je známo, že snižují krevní tlak, je třeba postupovat opatrně.
Inhibice nebo potlačení poporodní laktace
DOSTINEX 0,25 mg není indikován k inhibici nebo supresi fyziologické laktace. Použití bromokriptinu, dalšího agonisty dopaminu pro tento účel, bylo spojováno s případy hypertenze, mrtvice a záchvatů.
Poškození jater
Vzhledem k tomu, že kabergolin je rozsáhle metabolizován v játrech, je třeba opatrnosti a pečlivého sledování při podávání přípravku DOSTINEX 0,5 mg pacientům s poruchou funkce jater.
Psychiatrické
U pacientů léčených agonisty dopaminu včetně kabergolinu bylo hlášeno patologické hráčství, zvýšené libido a hypersexualita. To bylo obecně reverzibilní po snížení dávky nebo přerušení léčby (viz Údaje z postmarketingového sledování ).
Karcinogeneze, mutageneze, zhoršení plodnosti
Studie karcinogenity byly provedeny u myší a potkanů, kterým byl kabergolin podáván žaludeční sondou v dávkách až 0,98 mg/kg/den a 0,32 mg/kg/den, v daném pořadí. Tyto dávky jsou 7násobkem a 4násobkem maximální doporučené dávky pro člověka vypočtené na základě tělesného povrchu s použitím celkových mg/m/týden u hlodavců a mg/m/týden pro člověka o hmotnosti 50 kg.
Došlo k mírnému zvýšení výskytu cervikálních a děložních leiomyomů a děložních leiomyosarkomů u myší. U potkanů došlo k mírnému nárůstu maligních nádorů děložního čípku a dělohy a adenomů intersticiálních buněk. Výskyt nádorů u samic hlodavců může souviset s prodlouženou supresí sekrece prolaktinu, protože prolaktin je u hlodavců potřebný pro udržení žlutého tělíska. V nepřítomnosti prolaktinu se zvyšuje poměr estrogen/progesteron, čímž se zvyšuje riziko nádorů dělohy. U samců hlodavců bylo snížení sérových hladin prolaktinu spojeno se zvýšením sérového luteinizačního hormonu, což je považováno za kompenzační účinek k udržení testikulární syntézy steroidů. Protože se předpokládá, že tyto hormonální mechanismy jsou druhově specifické, význam těchto nádorů pro člověka není znám.
Mutagenní potenciál kabergolinu byl hodnocen a shledán jako negativní v sérii testů in vitro. Tyto testy zahrnovaly test bakteriální mutace (Ames) se Salmonella typhimurium, test genových mutací s buňkami Schizosaccharomyces pombe P1 a V79 čínského křečka, poškození a opravu DNA u Saccharomyces cerevisiae D4 a chromozomální aberace v lidských lymfocytech. Kabergolin byl také negativní v mikronukleovém testu kostní dřeně u myši.
U samic potkanů denní dávka 0,003 mg/kg po dobu 2 týdnů před pářením a během období páření inhibovala početí. Tato dávka představuje přibližně 1/28 maximální doporučené dávky pro člověka vypočtené na základě tělesného povrchu s použitím celkových mg/m/týden u potkanů a mg/m/týden pro člověka o hmotnosti 50 kg.
Těhotenství
Teratogenní účinky – kategorie B
Reprodukční studie byly provedeny s kabergolinem u myší, potkanů a králíků podávaných žaludeční sondou. (Násobky maximální doporučené dávky pro člověka v této části jsou vypočteny na základě plochy povrchu těla s použitím celkových mg/m/týden pro zvířata a mg/m/týden pro člověka o hmotnosti 50 kg.)
U myší, kterým byl během období organogeneze podáván kabergolin v dávkách až 8 mg/kg/den (přibližně 55násobek maximální doporučené dávky pro člověka), byly pozorovány maternotoxické účinky, ale žádné teratogenní účinky.
Dávka 0,012 mg/kg/den (přibližně 1/7 maximální doporučené dávky pro člověka) během období organogeneze u potkanů způsobila zvýšení postimplantačních embryofetálních ztrát. Tyto ztráty by mohly být způsobeny vlastnostmi kabergolinu inhibovat prolaktin u potkanů. Při denních dávkách 0,5 mg/kg/den (přibližně 19násobek maximální doporučené dávky pro člověka) během období organogeneze u králíků způsobil kabergolin toxicitu pro matku charakterizovanou úbytkem tělesné hmotnosti a sníženou spotřebou potravy. Dávky 4 mg/kg/den (přibližně 150násobek maximální doporučené dávky pro člověka) v období organogeneze u králíka způsobily zvýšený výskyt různých malformací. V jiné studii na králících však nebyly pozorovány žádné malformace nebo embryofetotoxicita související s léčbou při dávkách až 8 mg/kg/den (přibližně 300násobek maximální doporučené dávky pro člověka).
potkanů dávky vyšší než 0,003 mg/kg/den (přibližně 1/28 maximální doporučené dávky pro člověka) 6 dnů před porodem a během období laktace inhibovaly růst a způsobily smrt potomků v důsledku snížené sekrece mléka.
Neexistují však žádné adekvátní a dobře kontrolované studie u těhotných žen. Vzhledem k tomu, že reprodukční studie na zvířatech nejsou vždy prediktivní pro lidskou odpověď, měl by být tento lék používán během těhotenství pouze tehdy, je-li to nezbytně nutné.
Kojící matky
Není známo, zda se tento lék vylučuje do lidského mléka. Vzhledem k tomu, že mnoho léků se vylučuje do mateřského mléka a vzhledem k potenciálu závažných nežádoucích účinků kabergolinu u kojených dětí, je třeba rozhodnout, zda přerušit kojení nebo přerušit podávání léku, přičemž je třeba vzít v úvahu důležitost léku pro matku. Použití přípravku DOSTINEX k inhibici nebo potlačení fyziologické laktace se nedoporučuje (viz OPATŘENÍ sekce).
Účinek kabergolinu na snížení prolaktinu naznačuje, že bude interferovat s laktací. Kvůli této interferenci s laktací by DOSTINEX 0,5 mg neměl být podáván ženám po porodu, které kojí nebo plánují kojit.
Pediatrické použití
Bezpečnost a účinnost přípravku DOSTINEX 0,5 mg u pediatrických pacientů nebyla stanovena.
Geriatrické použití
Klinické studie přípravku DOSTINEX 0,5 mg nezahrnovaly dostatečný počet subjektů ve věku 65 a více let, aby bylo možné určit, zda reagují odlišně od mladších pacientů. Jiné hlášené klinické zkušenosti nezjistily rozdíly v odpovědích mezi staršími a mladšími pacienty. Obecně by měl být výběr dávky pro staršího pacienta opatrný, obvykle začínající na spodní hranici dávkovacího rozmezí, což odráží vyšší frekvenci snížené funkce jater, ledvin nebo srdce a souběžného onemocnění nebo jiné lékové terapie.
PŘEDÁVKOVAT
Lze očekávat, že předávkování způsobí nazální kongesci, synkopu nebo halucinace. V případě potřeby by měla být přijata opatření na podporu krevního tlaku.
KONTRAINDIKACE
Tablety DOSTINEX jsou kontraindikovány u pacientů s:
- Nekontrolovaná hypertenze nebo známá přecitlivělost na námelové deriváty.
- Anamnéza srdečních chlopňových poruch, jak naznačují anatomické známky valvulopatie kterékoli chlopně, stanovené hodnocením před léčbou včetně echokardiografického průkazu ztluštění cípu chlopně, restrikce chlopně nebo smíšené restrikční stenózy chlopně. (Vidět VAROVÁNÍ )
- Anamnéza plicních, perikardiálních nebo retroperitoneálních fibrotických poruch. (Vidět VAROVÁNÍ )
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Sekrece prolaktinu přední hypofýzou je hlavně pod hypotalamickou inhibiční kontrolou, pravděpodobně vyvíjenou uvolňováním dopaminu tuberoinfundibulárními neurony. Kabergolin je dlouhodobě působící agonista dopaminového receptoru s vysokou afinitou k D2 receptorům. Výsledky studií in vitro ukazují, že kabergolin má přímý inhibiční účinek na sekreci prolaktinu laktotrofy hypofýzy potkanů. Kabergolin snižoval hladiny prolaktinu v séru u reserpinizovaných potkanů. Studie vazby na receptory ukazují, že kabergolin má nízkou afinitu k dopaminovým D1, α1- a α2-adrenergním a 5-HT1- a 5-HT2-serotoninovým receptorům.
Klinické studie
Účinnost přípravku DOSTINEX 0,25 mg na snížení prolaktinu byla prokázána u hyperprolaktinemických žen ve dvou randomizovaných, dvojitě zaslepených, srovnávacích studiích, v jedné s placebem a ve druhé s bromokriptinem. V placebem kontrolované studii (placebo n=20; kabergolin n=168) způsobil DOSTINEX 0,5 mg pokles sérových hladin prolaktinu v závislosti na dávce, přičemž prolaktin se normalizoval po 4 týdnech léčby u 29 %, 76 %, 74 % a 95 % pacientů dostávajících 0,125, 0,5, 0,75 a 1,0 mg dvakrát týdně, v daném pořadí.
8týdenním, dvojitě zaslepeném období srovnávací studie s bromokriptinem (kabergolin n=223; bromokriptin n=236 v analýze záměrné léčby) byl prolaktin normalizován u 77 % pacientů léčených přípravkem DOSTINEX v dávce 0,5 mg dvakrát týdně ve srovnání s 59 % pacientů léčených bromokriptinem v dávce 2,5 mg dvakrát denně. K obnovení menstruace došlo u 77 % žen léčených přípravkem DOSTINEX ve srovnání se 70 % žen léčených bromokriptinem. U pacientů s galaktoreou tento příznak vymizel u 73 % pacientů léčených přípravkem DOSTINEX ve srovnání s 56 % pacientů léčených bromokriptinem.
Farmakokinetika
Vstřebávání
Po jednorázové perorální dávce 0,5 mg až 1,5 mg podané 12 zdravým dospělým dobrovolníkům byly průměrné maximální plazmatické hladiny 30 až 70 pikogramů (pg)/ml kabergolinu pozorovány během 2 až 3 hodin. V rozmezí dávek 0,5 až 7 mg se plazmatické hladiny kabergolinu zdály být úměrné dávce u 12 zdravých dospělých dobrovolníků a devíti dospělých pacientů s parkinsonskou nemocí. Studie s opakovaným podáváním u 12 zdravých dobrovolníků naznačuje, že se očekává, že ustálené hladiny po dávkovacím schématu jednou týdně budou dvakrát až třikrát vyšší než po jedné dávce. Absolutní biologická dostupnost kabergolinu není známa. Významná část podané dávky podléhá first-pass efektu. Poločas eliminace kabergolinu odhadnutý z údajů z moči 12 zdravých subjektů se pohyboval mezi 63 až 69 hodinami. Prodloužený účinek kabergolinu na snížení prolaktinu může souviset s jeho pomalou eliminací a dlouhým poločasem.
Rozdělení
zvířat, na základě celkové radioaktivity, kabergolin (a/nebo jeho metabolity) vykazoval rozsáhlou tkáňovou distribuci. Radioaktivita v hypofýze převyšovala radioaktivitu v plazmě více než 100krát a byla eliminována s poločasem přibližně 60 hodin. Toto zjištění je v souladu s dlouhotrvajícím účinkem léku na snížení prolaktinu. Celotělové autoradiografické studie u březích potkanů neprokázaly žádné vychytávání plodem, ale vysoké hladiny ve stěně dělohy. Významná radioaktivita (rodič a metabolity) zjištěná v mléce kojících potkanů naznačuje možnost expozice kojených dětí. Droga je široce distribuována po celém těle. Kabergolin se středně váže (40 % až 42 %) na lidské plazmatické proteiny způsobem nezávislým na koncentraci. Je nepravděpodobné, že by současné dávkování léků s vysokou vazbou na proteiny ovlivnilo jeho dispozici.
Metabolismus
zvířat i lidí je kabergolin rozsáhle metabolizován, převážně hydrolýzou acylmočovinové vazby nebo močovinové části. Metabolismus zprostředkovaný cytochromem P-450 se zdá být minimální. Kabergolin nezpůsobuje indukci a/nebo inhibici enzymů u potkanů. Hydrolýza acylmočoviny nebo části močoviny ruší účinek kabergolinu na snížení prolaktinu a hlavní metabolity dosud identifikované nepřispívají k terapeutickému účinku.
Vylučování
Po perorálním podání radioaktivního kabergolinu pěti zdravým dobrovolníkům bylo přibližně 22 % a 60 % dávky vyloučeno do 20 dnů močí a stolicí. Méně než 4 % dávky byla vyloučena v nezměněné podobě močí. Nonrenální a renální clearance kabergolinu jsou asi 3,2 l/min a 0,08 l/min. Vylučování močí u hyperprolaktinemických pacientů bylo podobné.
Zvláštní populace
Renální insuficience
Farmakokinetika kabergolinu nebyla změněna u 12 pacientů se středně těžkou až těžkou renální insuficiencí, jak bylo hodnoceno podle clearance kreatininu.
Jaterní nedostatečnost
U 12 pacientů s mírnou až středně závažnou jaterní dysfunkcí (Child-Pugh skóre ≤ 10) nebyl pozorován žádný vliv na průměrnou Cmax kabergolinu nebo plochu pod křivkou plazmatické koncentrace (AUC). Pacienti s těžkou insuficiencí (Child-Pugh skóre > 10) však vykazují podstatné zvýšení středních Cmax a AUC kabergolinu, a proto vyžadují opatrnost.
Starší
Vliv věku na farmakokinetiku kabergolinu nebyl studován.
Interakce jídlo-lék
U 12 zdravých dospělých dobrovolníků jídlo neměnilo kinetiku kabergolinu.
Farmakodynamika
Po jednotlivých dávkách kabergolinu zdravým dobrovolníkům (0,05 až 1,5 mg) a hyperprolaktinemickým pacientům (0,3 až 1 mg) byla dokumentována odpověď na dávku s inhibicí plazmatického prolaktinu, nástup maximálního účinku a trvání účinku. U dobrovolníků byla inhibice prolaktinu evidentní při dávkách > 0,2 mg, zatímco dávky ≥ 0,5 mg způsobily maximální supresi u většiny subjektů. Vyšší dávky vyvolávají supresi prolaktinu u větší části subjektů a s dřívějším nástupem a delším trváním účinku. U 12 zdravých dobrovolníků vedly dávky 0,5, 1 a 1,5 mg ke kompletní inhibici prolaktinu s maximálním účinkem do 3 hodin u 92 % až 100 % subjektů po dávkách 1 a 1,5 mg ve srovnání s 50 % subjektů po 0,5 mg. mg dávka.
hyperprolaktinemických pacientů (N=51) byl maximální pokles prolaktinu po jednorázové dávce 0,6 mg kabergolinu srovnatelný s 2,5 mg bromokriptinu; doba účinku byla však výrazně delší (14 dní vs. 24 hodin). Doba do maximálního účinku byla kratší u bromokriptinu než u kabergolinu (6 hodin vs. 48 hodin).
U 72 zdravých dobrovolníků vedly jednotlivé nebo opakované dávky (až 2 mg) kabergolinu k selektivní inhibici prolaktinu bez zjevného účinku na jiné hormony předního laloku hypofýzy (GH, FSH, LH, ACTH a TSH) nebo kortizol.
INFORMACE PRO PACIENTA
Pacientky by měly být poučeny, aby informovaly svého lékaře, pokud mají podezření, že jsou těhotné, otěhotněly nebo plánují otěhotnět během léčby. Při jakémkoli podezření na těhotenství by měl být proveden těhotenský test a pokračování léčby by mělo být projednáno s lékařem.
Pacienti by měli informovat svého lékaře, pokud se u nich objeví dušnost, přetrvávající kašel, potíže s dýcháním vleže nebo otoky končetin.
