Microzide 25mg Hydrochlorothiazide Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Microzide 25 mg a jak se používá?
Microzide je lék na předpis používaný k léčbě příznaků vysokého krevního tlaku (hypertenze) a otoku (edému). Microzide lze užívat samostatně nebo s jinými léky.
Microzide patří do třídy léků nazývaných diuretika, thiazid.
Není známo, zda je přípravek Microzide bezpečný a účinný u dětí mladších 6 měsíců.
Jaké jsou možné vedlejší účinky přípravku Microzide?
Microzide může způsobit závažné nežádoucí účinky včetně:
- točení hlavy,
- bolest očí,
- problémy se zrakem,
- zežloutnutí kůže nebo očí (žloutenka),
- bledá kůže,
- snadná tvorba modřin,
- neobvyklé krvácení (nos, ústa, pochva nebo konečník),
- dušnost,
- sípání,
- kašel s pěnivým hlenem,
- bolest na hrudi,
- suchá ústa,
- žízeň,
- ospalost,
- nedostatek energie,
- neklid,
- svalová bolest nebo slabost,
- rychlý srdeční tep,
- nevolnost,
- zvracení,
- málo nebo žádná moč,
- horečka,
- bolest krku,
- otok v obličeji nebo na jazyku,
- pálení v očích a
- bolest kůže následovaná červenou nebo fialovou kožní vyrážkou, která se šíří (zejména v obličeji nebo horní části těla) a způsobuje puchýře a olupování
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Microzide patří:
- nevolnost,
- zvracení,
- ztráta chuti k jídlu,
- průjem,
- zácpa,
- svalové křeče,
- závratě a
- bolest hlavy
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku Microzide. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
MICROZIDE® (hydrochlorothiazid, USP 12,5 mg) je 3,4-dihydroderivát chlorothiazidu. Jeho chemický název je 6-chlor-3,4-dihydro-2H-1,2,4-benzothiadiazin-7-sulfonamid 1,1-dioxid. Jeho empirický vzorec je C7H8CIN304S2; jeho molekulová hmotnost je 297,74; a jeho strukturní vzorec je:
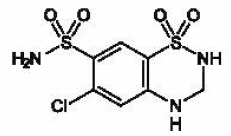
Je to bílý nebo prakticky bílý krystalický prášek, který je mírně rozpustný ve vodě, ale volně rozpustný v roztoku hydroxidu sodného.
MICROZIDE (hydrochlorothiazidová tobolka) se dodává jako 12,5 mg tobolky pro perorální podání.
Neaktivní složky : koloidní oxid křemičitý, kukuřičný škrob, monohydrát laktózy, magnesium-stearát. Želatinové kapsle obsahují D&C Red č. 28, D&C Yellow č. 10, FD&C Blue č. 1, želatinu, oxid titaničitý. Tobolky jsou potištěny jedlým inkoustem obsahujícím černý oxid železitý, D&C žlutá č. 10, FD&C modrá č. 1, FD&C modrá č. 2, FD&C červená č. 40.
INDIKACE
MICROZIDE (hydrochlorothiazidová tobolka) je indikován k léčbě hypertenze buď jako jediná terapeutická látka, nebo v kombinaci s jinými antihypertenzivy. Na rozdíl od kalium šetřících kombinovaných diuretických přípravků může být MICROZIDE (tobolka hydrochlorothiazidu) použit u pacientů, u kterých nelze riskovat rozvoj hyperkalemie, včetně pacientů užívajících ACE inhibitory.
Použití v těhotenství
Rutinní užívání diuretik u jinak zdravé ženy je nevhodné a vystavuje matku a plod zbytečnému riziku. Diuretika nebrání rozvoji toxémie v těhotenství a neexistuje žádný uspokojivý důkaz, že jsou užitečná při léčbě rozvinuté toxémie.
Edém během těhotenství může vzniknout z patologických příčin nebo z fyziologických a mechanických následků těhotenství. Diuretika jsou indikována v těhotenství, když je otok způsoben patologickými příčinami, stejně jako v nepřítomnosti těhotenství. Závislý edém v těhotenství, který je důsledkem omezení žilního návratu expandovanou dělohou, je správně léčen elevací dolních končetin a použitím podpůrné hadice; použití diuretik ke snížení intravaskulárního objemu je v tomto případě nelogické a zbytečné. Během normálního těhotenství dochází k hypervolémii, která není škodlivá ani pro plod, ani pro matku (při absenci kardiovaskulárního onemocnění), ale která je spojena s edémem, včetně generalizovaného otoku u většiny těhotných žen. Pokud tento edém způsobuje nepohodlí, zvýšená poloha vleže často poskytne úlevu. Ve vzácných případech může tento edém způsobit extrémní nepohodlí, které nelze odstranit odpočinkem. V těchto případech může být vhodná krátká kúra diuretik.
DÁVKOVÁNÍ A PODÁVÁNÍ
Pro kontrolu hypertenze : Počáteční dávka přípravku MICROZIDE (hydrochlorothiazidová tobolka) pro dospělé je jedna tobolka podávaná jednou denně, ať už se podává samostatně nebo v kombinaci s jinými antihypertenzivy. Celkové denní dávky vyšší než 50 mg se nedoporučují.
JAK DODÁVÁNO
MICROZIDE (hydrochlorothiazidová tobolka) tobolky jsou #4 Teal Opaque/Teal Opaque dvoudílné tvrdé želatinové tobolky s potiskem MICROZIDE (hydrochlorothiazidová tobolka) a 12,5 mg černým inkoustem. Dodávají se v lahvích po 100 kusech s dětským bezpečnostním uzávěrem ( NDC 52544-622-01).
Dávkujte v těsné nádobě odolné vůči světlu, jak je definováno v USP.
Uchovávejte mimo dosah dětí.
Uchovávejte při teplotě 20°-25°C (68°-77°F). [Viz USP kontrolovaná pokojová teplota.] Chraňte před světlem, vlhkostí, mrazem, -20°C (-4°F). Nádobu uchovávejte těsně uzavřenou.
Lékařské dotazy směřujte na: WATSON., Medical Communications PO Box 1953, Morristown, NJ 07962-1953. 800-272-5525. Výrobce: Watson Pharma Private Limited. Verna, Salcette, Goa 403 722 INDIE. Distribuce: Watson Pharma, Inc. Morristown, NJ 07962 USA. Revize: únor 2011
VEDLEJŠÍ EFEKTY
Bylo prokázáno, že nežádoucí účinky spojené s hydrochlorothiazidem souvisejí s dávkou. V kontrolovaných klinických studiích byly nežádoucí účinky hlášené při dávkách 12,5 mg hydrochlorothiazidu jednou denně srovnatelné s placebem. Následující nežádoucí účinky byly hlášeny pro dávky hydrochlorothiazidu 25 mg a vyšší a v každé kategorii jsou uvedeny v pořadí klesající závažnosti.
Tělo jako celek : Slabost.
Kardiovaskulární : Hypotenze včetně ortostatické hypotenze (může být zhoršena alkoholem, barbituráty, narkotiky nebo antihypertenzivy).
Zažívací Pankreatitida, žloutenka (intrahepatální cholestatická žloutenka), průjem, zvracení, sialadenitida, křeče, zácpa, podráždění žaludku, nevolnost, anorexie.
Hematologické : Aplastická anémie, agranulocytóza, leukopenie, hemolytická anémie, trombocytopenie.
Přecitlivělost : Anafylaktické reakce, nekrotizující angiitida (vaskulitida a kožní vaskulitida), respirační tíseň včetně pneumonitidy a plicního edému, fotosenzitivita, horečka, kopřivka, vyrážka, purpura.
Metabolický : Nerovnováha elektrolytů (viz OPATŘENÍ ), hyperglykémie, glykosurie, hyperurikémie.
Muskuloskeletální : Svalové křeče.
Nervový systém/psychiatrický : Vertigo, parestézie, závratě, bolesti hlavy, neklid.
Renální : Selhání ledvin, renální dysfunkce, intersticiální nefritida (viz VAROVÁNÍ ).
Kůže : Erythema multiforme včetně Stevens-Johnsonova syndromu, exfoliativní dermatitida včetně toxické epidermální nekrolýzy, alopecie.
Speciální smysly Přechodné rozmazané vidění, xanthopsie.
Urogenitální : Impotence.
Kdykoli jsou nežádoucí účinky středně závažné nebo závažné, je třeba snížit dávkování thiazidu nebo ukončit léčbu.
DROGOVÉ INTERAKCE
Při současném podávání mohou následující léky interagovat s thiazidovými diuretiky:
Alkohol, barbituráty nebo narkotika - může dojít k zesílení ortostatické hypotenze.
Antidiabetické léky - (perorální léky a inzulín) může být nutná úprava dávkování antidiabetika.
Jiná antihypertenziva - aditivní účinek nebo potenciace.
Cholestyraminové a kolestipolové pryskyřice - Cholestyraminové a kolestipolové pryskyřice vážou hydrochlorothiazid a snižují jeho absorpci z gastrointestinálního traktu až o 85, respektive 43 procent.
Kortikosteroid, ACTH - zesílená deplece elektrolytů, zejména hypokalémie.
Presorické aminy (např. norepinefrin) - možná snížená odezva na presorické aminy, ale ne dostatečná k vyloučení jejich použití.
Relaxanty kosterního svalstva, nedepolarizující (např. tubokurarin) možná zvýšená citlivost na myorelaxancium.
Lithium - obecně by neměl být podáván s diuretiky. Diuretika snižují renální clearance lithia a výrazně zvyšují riziko toxicity lithia. Před použitím těchto přípravků s MICROZIDE (hydrochlorothiazidová kapsle) si přečtěte příbalovou informaci pro přípravky s obsahem lithia.
Nesteroidní protizánětlivé léky - U některých pacientů může podávání nesteroidních protizánětlivých látek snížit diuretický, natriuretický a antihypertenzní účinek kličkových, draslík šetřících a thiazidových diuretik. Pokud se MICROZIDE (kapsule hydrochlorothiazidu) a nesteroidní protizánětlivé látky užívají současně, pacienti by měli být pečlivě sledováni, aby se zjistilo, zda je dosaženo požadovaného účinku diuretika.
Interakce drog/laboratorních testů
Před provedením testů funkce příštítných tělísek by měla být léčba thiazidy přerušena (viz BEZPEČNOSTNÍ OPATŘENÍ, Obecné ).
VAROVÁNÍ
Diabetes a hypoglykémie: Může se projevit latentní diabetes mellitus a diabetici, kterým jsou podávány thiazidy, mohou vyžadovat úpravu dávky inzulinu.
Nemoc ledvin: U pacientů s poruchou funkce ledvin se mohou vyvinout kumulativní účinky thiazidů. U takových pacientů mohou thiazidy vyvolat azotemii.
OPATŘENÍ
Stav rovnováhy elektrolytů a tekutin
V publikovaných studiích byla klinicky významná hypokalémie konzistentně méně častá u pacientů, kteří dostávali 12,5 mg hydrochlorothiazidu, než u pacientů, kteří dostávali vyšší dávky. Nicméně u pacientů, kteří mohou být ohroženi rozvojem hypokalemie, by mělo být prováděno pravidelné stanovení sérových elektrolytů. U pacientů je třeba sledovat známky poruch tekutin nebo elektrolytů, tj. hyponatrémii, hypochloremickou alkalózu a hypokalemii a hypomagnezémii.
Varovné příznaky nebo příznaky nerovnováhy tekutin a elektrolytů zahrnují sucho v ústech, žízeň, slabost, letargii, ospalost, neklid, svalové bolesti nebo křeče, svalovou únavu, hypotenzi, oligurii, tachykardii a gastrointestinální poruchy, jako je nauzea a zvracení.
Hypokalémie se může vyvinout, zvláště při rychlé diuréze, je-li přítomna těžká cirhóza, při současném užívání kortikosteroidů nebo adrenokortikotropních hormonů (ACTH) nebo po dlouhodobé léčbě. Interference s dostatečným perorálním příjmem elektrolytů také přispěje k hypokalémii. Hypokalémie a hypomagnezémie mohou vyvolat ventrikulární arytmie nebo senzibilizovat či zveličovat reakci srdce na toxické účinky digitalisu. Hypokalemii lze předejít nebo ji léčit suplementací draslíku nebo zvýšeným příjmem potravin bohatých na draslík.
Diluční hyponatremie je život ohrožující a může se objevit u edematózních pacientů v horkém počasí; vhodnou terapií je spíše omezení vody než podávání soli, s výjimkou vzácných případů, kdy je hyponatrémie život ohrožující. Při skutečné depleci solí je terapií volby vhodná náhrada.
Hyperurikémie
U některých pacientů užívajících thiazidová diuretika se může vyvolat hyperurikémie nebo akutní dna.
Porucha funkce jater
Thiazidy by měly být používány s opatrností u pacientů s poruchou funkce jater. U pacientů se závažným onemocněním jater mohou vyvolat jaterní kóma.
Onemocnění příštítných tělísek
Thiazidy snižují vylučování vápníku a u několika pacientů na dlouhodobé léčbě thiazidy byly pozorovány patologické změny v příštítných tělíscích s hyperkalcémií a hypofosfatémií.
Karcinogeneze, mutageneze, zhoršení plodnosti
Dvouleté studie krmení u myší a potkanů provedené pod záštitou Národního toxikologického programu (NTP) neodhalily žádné důkazy o karcinogenním potenciálu hydrochlorothiazidu u myších samic (v dávkách až přibližně 600 mg/kg/den) nebo u samců a samice potkanů (v dávkách přibližně 100 mg/kg/den). NTP však našel nejednoznačný důkaz hepatokarcinogenity u samců myší. Hydrochlorothiazid nebyl genotoxický in vitro v Amesově testu mutagenity Salmonella typhimurium kmenů TA 98, TA 100, TA 1535, TA 1537 a TA 1538 a v testu ovarií čínského křečka (CHO) na chromozomální aberace při použití in vivo. chromozomy myších zárodečných buněk, chromozomy kostní dřeně čínského křečka a pohlavně vázaný recesivní letální gen Drosophila. Pozitivní výsledky testů byly získány pouze v in vitro CHO Sister Chromatid Exchange (klastogenicita) a v testech na myších lymfomových buňkách (mutagenita) s použitím koncentrací hydrochlorothiazidu od 43 do 1300 mcg/ml a v testu Aspergillus nidulans non-disjunktion at blíže nespecifikovanou koncentraci.
Hydrochlorothiazid neměl žádné nežádoucí účinky na fertilitu myší a potkanů jakéhokoli pohlaví ve studiích, kde byly tyto druhy vystaveny prostřednictvím stravy dávkám až 100 a 4 mg/kg, v daném pořadí, před početím a během březosti.
Těhotenství
Teratogenní účinky
Těhotenství kategorie B: Studie, ve kterých byl hydrochlorothiazid perorálně podáván březím myším a potkanům během jejich příslušných období velké organogeneze v dávkách až 3 000 a 1 000 mg hydrochlorothiazidu/kg, neposkytly žádné důkazy o poškození plodu.
Neexistují však žádné adekvátní a dobře kontrolované studie u těhotných žen. Vzhledem k tomu, že reprodukční studie na zvířatech nejsou vždy prediktivní pro lidskou odpověď, měl by být tento lék používán během těhotenství pouze tehdy, je-li to nezbytně nutné.
Neteratogenní účinky
Thiazidy procházejí placentární bariérou a objevují se v pupečníkové krvi. Existuje riziko fetální nebo novorozenecké žloutenky, trombocytopenie a případně dalších nežádoucích účinků, které se vyskytly u dospělých.
Kojící matky
Thiazidy se vylučují do mateřského mléka. Vzhledem k možnosti závažných nežádoucích účinků u kojených dětí je třeba rozhodnout, zda přerušit kojení nebo přerušit hydrochlorothiazid, přičemž je třeba vzít v úvahu důležitost léku pro matku.
Pediatrické použití
Bezpečnost a účinnost u pediatrických pacientů nebyla stanovena.
Použití pro starší osoby
U starších pacientů (tj. > 65 let) může být při hydrochlorothiazidu pozorováno větší snížení krevního tlaku a zvýšení nežádoucích účinků. Proto se doporučuje zahájit léčbu nejnižší dostupnou dávkou hydrochlorothiazidu (12,5 mg). Pokud je nutná další titrace, je třeba použít přírůstky po 12,5 mg.
PŘEDÁVKOVAT
Nejčastějšími pozorovanými příznaky a symptomy jsou ty, které jsou způsobeny deplecí elektrolytů (hypokalémie, hypochlorémie, hyponatremie) a dehydratací v důsledku nadměrné diurézy. Pokud byl také podán digitalis, hypokalémie může zvýraznit srdeční arytmie.
případě předávkování je třeba použít symptomatická a podpůrná opatření. Je třeba vyvolat zvracení nebo provést výplach žaludku. Upravte dehydrataci, nerovnováhu elektrolytů, jaterní kóma a hypotenzi zavedenými postupy. Je-li to nutné, poskytněte kyslík nebo umělé dýchání při poruše dýchání. Stupeň, do kterého je hydrochlorothiazid odstraněn hemodialýzou, nebyl stanoven.
Perorální LD50 hydrochlorothiazidu je u myši a potkana vyšší než 10 g/kg.
KONTRAINDIKACE
Hydrochlorothiazid je kontraindikován u pacientů s anurií. Přecitlivělost na tento přípravek nebo jiné léky odvozené od sulfonamidů je také kontraindikována.
KLINICKÁ FARMAKOLOGIE
Hydrochlorothiazid blokuje reabsorpci sodíkových a chloridových iontů, a tím zvyšuje množství sodíku procházející distálním tubulem a objem vyloučené vody. Část dalšího sodíku přítomného v distálním tubulu se tam vymění za ionty draslíku a vodíku. Při pokračujícím užívání hydrochlorothiazidu a depleci sodíku mají kompenzační mechanismy tendenci tuto výměnu zvyšovat a mohou způsobit nadměrnou ztrátu draslíkových, vodíkových a chloridových iontů. Hydrochlorothiazid také snižuje vylučování vápníku a kyseliny močové, může zvýšit vylučování jodidu a může snížit rychlost glomerulární filtrace. Metabolická toxicita spojená s nadměrnými změnami elektrolytů způsobenými hydrochlorothiazidem se ukázala jako závislá na dávce.
Farmakokinetika a metabolismus
Hydrochlorothiazid se po perorálním podání dobře vstřebává (65 % až 75 %). Absorpce hydrochlorothiazidu je snížena u pacientů s městnavým srdečním selháním.
Maximální plazmatické koncentrace jsou pozorovány během 1 až 5 hodin po podání a po perorálním podání dávky 12,5 až 100 mg se pohybují od 70 do 490 ng/ml. Plazmatické koncentrace jsou lineárně závislé na podané dávce. Koncentrace hydrochlorothiazidu jsou 1,6 až 1,8krát vyšší v plné krvi než v plazmě. Vazba na sérové proteiny byla hlášena jako přibližně 40 % až 68 %. Plazmatický eliminační poločas byl hlášen 6 až 15 hodin. Hydrochlorothiazid je vylučován primárně ledvinami. Po perorálních dávkách 12,5 až 100 mg se 55 % až 77 % podané dávky objeví v moči a více než 95 % absorbované dávky se vyloučí močí jako nezměněné léčivo. U pacientů s onemocněním ledvin jsou plazmatické koncentrace hydrochlorothiazidu zvýšené a eliminační poločas je prodloužen.
Když se MICROZIDE (kapsule hydrochlorothiazidu) podává s jídlem, jeho biologická dostupnost se sníží o 10 %, maximální plazmatická koncentrace se sníží o 20 % a doba dosažení maximální koncentrace se zvýší z 1,6 na 2,9 hodin.
Farmakodynamika
Předpokládá se, že akutní antihypertenzní účinky thiazidů jsou důsledkem snížení objemu krve a srdečního výdeje, sekundárně k natriuretickému účinku, i když byl také navržen přímý vazodilatační mechanismus. Při chronickém podávání se objem plazmy vrací k normálu, ale periferní vaskulární rezistence je snížena. Přesný mechanismus antihypertenzního účinku hydrochlorothiazidu není znám.
Thiazidy neovlivňují normální krevní tlak. Nástup účinku nastává do 2 hodin po podání, maximální účinek je pozorován přibližně za 4 hodiny a aktivita přetrvává až 24 hodin.
Klinické studie
Ve 4týdenní dvojitě zaslepené, placebem kontrolované studii s paralelními skupinami s 87 pacienty měli pacienti, kteří dostávali MICROZIDE (kapsule hydrochlorothiazidu), snížení systolického a diastolického krevního tlaku vsedě, které bylo významně větší než u pacientů, kteří dostávali placebo. V publikovaných placebem kontrolovaných studiích porovnávajících 12,5 mg hydrochlorothiazidu s 25 mg dávka 12,5 mg zachovala většinu snížení krevního tlaku korigovaného placebem pozorovaného u 25 mg.
INFORMACE PRO PACIENTA
Nebyly poskytnuty žádné informace. Podívejte se prosím na VAROVÁNÍ a OPATŘENÍ sekce.
