Mircette 0.15/0.02 mg Desogestrel Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Mircette 0,15 mg a jak se používá?
Mircette je lék na předpis používaný jako antikoncepce k zabránění otěhotnění. Mircette lze užívat samostatně nebo s jinými léky.
Mircette patří do třídy léků nazývaných estrogeny/progestiny; Antikoncepce, orální.
Není známo, zda je přípravek Mircette bezpečný a účinný u dětí před menstruací.
Jaké jsou možné vedlejší účinky přípravku Mircette?
Mircette může způsobit závažné nežádoucí účinky, včetně:
- kopřivka,
- potíže s dýcháním,
- otok obličeje, rtů, jazyka nebo hrdla,
- náhlá necitlivost nebo slabost (zejména na jedné straně těla),
- náhlá silná bolest hlavy,
- nezřetelná řeč,
- problémy s viděním nebo rovnováhou,
- náhlá ztráta zraku,
- bodavá bolest na hrudi,
- dušnost,
- vykašlávání krve,
- bolest nebo teplo v jedné nebo obou nohách,
- bolest nebo tlak na hrudi,
- bolest šířící se do čelisti nebo ramene,
- nevolnost,
- pocení,
- ztráta chuti k jídlu,
- bolest v horní části žaludku,
- únava,
- horečka,
- tmavá moč,
- stolice hliněné barvy,
- zežloutnutí kůže nebo očí (žloutenka),
- těžká bolest hlavy,
- rozmazané vidění,
- bušení do krku nebo uší,
- otoky rukou, kotníků nebo nohou,
- změny ve vzoru nebo závažnosti migrénových bolestí hlavy,
- bulka v prsou,
- problémy se spánkem,
- slabost,
- pocit únavy a
- změny nálady
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Mircette patří:
- nevolnost,
- zvracení (zejména když poprvé začnete užívat tento lék),
- citlivost prsou,
- průlomové krvácení,
- akné,
- ztmavnutí pokožky obličeje,
- přírůstek hmotnosti a
- problémy s kontaktními čočkami
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Mircette. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Pacienti by měli být poučeni, že tento produkt nechrání před infekcí HIV (AIDS) a jinými pohlavně přenosnými chorobami.
POPIS
Tablety Mircette® (desogestrel/ethinylestradiol a ethinylestradiol) poskytují režim perorální antikoncepce obsahující 21 bílých kulatých tablet, z nichž každá obsahuje 0,15 mg desogestrelu (13-ethyl11-methylen-18,19-dinor-17 alfa-pregn-20-en- -yn-17-ol), 0,02 mg ethinylestradiolu (19-nor17 alfa-pregna-1,3,5 (10)-trien-20-yn-3,17-diol) a neaktivní složky, které zahrnují koloidní oxid křemičitý , hypromelóza, monohydrát laktózy, polyethylenglykol, povidon, předbobtnalý škrob, kyselina stearová a vitamín E, následované 2 inertními světlezelenými kulatými tabletami s následujícími neaktivními složkami: FD&C blue no. 1 hliníkový lak, FD & C žlutá č. 6 hliníkový lak, D&C žlutá č. 10 hliníkový lak, monohydrát laktózy, stearát hořečnatý, mikrokrystalická celulóza a předbobtnalý škrob. Mircette® také obsahuje 5 žlutých kulatých tablet obsahujících 0,01 mg ethinylestradiolu (19-nor-17 alfa-pregna-1,3,5 (10)-trien-20-yne3,17-diol) a neaktivní složky, které zahrnují koloidní oxid křemičitý , D&C žlutá č. 10, hliníkový lak, FD&C žlutá č. 6 hlinitý lak, hypromelóza, monohydrát laktózy, polyethylenglykol, povidon, polysorbát 80, předbobtnalý škrob, kyselina stearová, oxid titaničitý a vitamin E. Molekulární hmotnosti desogestrelu a ethinylestradiolu jsou 310,48 a 296,40 v tomto pořadí. Strukturní vzorce jsou následující:
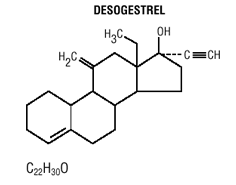
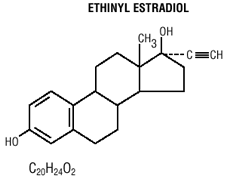
INDIKACE
Tablety Mircette® (desogestrel/ethinylestradiol a ethinylestradiol) jsou indikovány k prevenci těhotenství u žen, které se rozhodnou používat tento přípravek jako metodu antikoncepce.
Perorální antikoncepce je vysoce účinná. Tabulka II uvádí typické četnosti náhodných těhotenství u uživatelek kombinované perorální antikoncepce a jiných metod antikoncepce. Účinnost těchto antikoncepčních metod, kromě sterilizace, závisí na spolehlivosti, se kterou se používají. Správné a důsledné používání těchto metod může mít za následek nižší poruchovost.
TABULKA II: Procento žen, které zažily nechtěné těhotenství během prvního roku typického užívání a prvního roku dokonalého užívání antikoncepce a procento pokračujícího užívání na konci prvního roku, Spojené státy americké.
DÁVKOVÁNÍ A PODÁVÁNÍ
dosažení maximální antikoncepční účinnosti se tablety Mircette® (desogestrel/ethinylestradiol a ethinylestradiol) musí užívat přesně podle pokynů a v intervalech nepřesahujících 24 hodin. Mircette® může být spuštěn buď s nedělním startem, nebo startem z 1. dne.
POZNÁMKA: Na každém dávkovači cyklistických balíčků jsou předtištěny dny v týdnu počínaje nedělí, aby se usnadnil režim nedělního startu. S každým dávkovačem balíčků cyklů je dodáváno šest různých „proužků s denními štítky“, aby bylo možné přizpůsobit režim spuštění 1. dne. V tomto případě by pacientka měla umístit samolepicí „proužek denního štítku“, který odpovídá jejímu počátečnímu dni, na předtištěné dny.
DŮLEŽITÉ: Je třeba zvážit možnost ovulace a početí před zahájením užívání přípravku Mircette®.
žen, které se rozhodly nekojit, lze užívání přípravku Mircette k antikoncepci zahájit 4 týdny po porodu. Pokud jsou tablety podávány v poporodním období, je třeba vzít v úvahu zvýšené riziko tromboembolické nemoci spojené s poporodním obdobím (viz KONTRAINDIKACE a VAROVÁNÍ ohledně tromboembolické nemoci. Viz také OPATŘENÍ pro Kojící matky ).
Pokud pacientka začne užívat Mircette® po porodu a ještě nedostala menstruaci, měla by být poučena, aby používala jinou metodu antikoncepce, dokud nebude denně po dobu 7 dnů užívána bílá tableta.
Nedělní začátek
Při zahájení nedělního startovacího režimu by měla být použita jiná metoda antikoncepce až po prvních 7 po sobě jdoucích dnech podávání.
Při nedělním začátku se tablety užívají denně bez přerušení následovně: První bílá tableta se má užít první neděli po začátku menstruace (pokud menstruace začíná v neděli, první bílá tableta se užije v ten den). Užívá se jedna bílá tableta denně po dobu 21 dnů, dále 1 světlezelená (inertní) tableta denně po dobu 2 dnů a 1 žlutá (aktivní) tableta denně po dobu 5 dnů. U všech následujících cyklů pak pacientka zahájí nový režim s 28 tabletami následující den (v neděli) po užití poslední žluté tablety. [Pokud přecházíte z nedělní perorální antikoncepce, první tableta Mircette® (desogestrel/ethinylestradiol a ethinylestradiol) by se měla užít druhou neděli po poslední tabletě 21denního režimu nebo by se měla užít první neděli po poslední neaktivní tableta 28denního režimu.]
Pokud pacientka vynechá 1 bílou tabletu, měla by užít vynechanou tabletu, jakmile si vzpomene. Pokud pacient vynechá 2 po sobě jdoucí bílé tablety v týdnu 1 nebo v týdnu 2, pacient by měl užít 2 tablety v den, kdy si vzpomene, a 2 tablety následující den; poté by pacientka měla pokračovat v užívání 1 tablety denně, dokud nedokončí cyklus balení. Pacientka by měla být poučena, aby používala záložní metodu antikoncepce, pokud má pohlavní styk do 7 dnů po vynechání pilulek. Pokud pacient vynechá 2 po sobě jdoucí bílé tablety ve třetím týdnu nebo vynechá 3 nebo více bílých tablet za sebou kdykoli během cyklu, pacient by měl pokračovat v užívání 1 bílé tablety denně až do příští neděle. V neděli by měl pacient vyhodit zbytek tohoto balíčku cyklu a tentýž den začít nový balíček cyklu. Pacientka by měla být poučena, aby používala záložní metodu antikoncepce, pokud má pohlavní styk do 7 dnů po vynechání pilulek.
Den 1 Start
První den menstruace se počítá jako „Den 1“ a tablety se užívají bez přerušení následovně: Jedna bílá tableta denně po dobu 21 dnů, jedna světle zelená (inertní) tableta denně po dobu 2 dnů a následně 1 žlutá (ethinylestradiol) tableta denně. po dobu 5 dnů. U všech následujících cyklů pak pacient zahájí nový režim s 28 tabletami následující den po užití poslední žluté tablety. [Pokud přecházíte přímo z jiné perorální antikoncepce, měla by se první bílá tableta užít první den menstruace, která začíná po poslední AKTIVNÍ tabletě předchozího přípravku.]
Pokud pacientka vynechá 1 bílou tabletu, měla by užít vynechanou tabletu, jakmile si vzpomene. Pokud pacient vynechá 2 po sobě jdoucí bílé tablety v týdnu 1 nebo v týdnu 2, pacient by měl užít 2 tablety v den, kdy si vzpomene, a 2 tablety následující den; poté by pacientka měla pokračovat v užívání 1 tablety denně, dokud nedokončí cyklus balení. Pacientka by měla být poučena, aby používala záložní metodu antikoncepce, pokud má pohlavní styk do 7 dnů po vynechání pilulek. Pokud pacient vynechá 2 po sobě jdoucí bílé tablety ve třetím týdnu nebo pokud pacient vynechá 3 nebo více bílých tablet za sebou kdykoli během cyklu, pacient by měl vyhodit zbytek tohoto balení cyklu a začít nový cyklus balení, který stejný den. Pacientka by měla být poučena, aby používala záložní metodu antikoncepce, pokud má pohlavní styk do 7 dnů po vynechání pilulek.
Všechny perorální antikoncepce
Častým důvodem, proč pacientky vysazují perorální antikoncepci, jsou krvácení z průniku, špinění a amenorea. U krvácení z průniku, stejně jako u všech případů nepravidelného krvácení z pochvy, je třeba mít na paměti nefunkční příčiny. U nediagnostikovaného přetrvávajícího nebo opakujícího se abnormálního krvácení z pochvy jsou indikována adekvátní diagnostická opatření k vyloučení těhotenství nebo malignity. Pokud bylo vyloučeno těhotenství i patologie, může problém vyřešit čas nebo změna na jiný preparát. Přechod na perorální antikoncepci s vyšším obsahem estrogenu, i když je potenciálně užitečný pro minimalizaci menstruačních nepravidelností, by se měl provádět pouze v případě potřeby, protože to může zvýšit riziko tromboembolické nemoci.
Užívání perorální antikoncepce v případě vynechání menstruace:
JAK DODÁVÁNO
Mircette ® (desogestrel/ethinylestradiol a ethinylestradiol) Tablety obsahují 21 kulatých bílých tablet, 2 kulaté zelené tablety a 5 kulatých žlutých tablet v blistru v recyklovatelném plastovém dávkovači. Jedna bílá tableta (vyraženo „dp“ na jedné straně a „021“ na druhé straně) obsahuje 0,15 mg desogestrelu a 0,02 mg ethinylestradiolu. Každá zelená tableta (vyraženo „dp“ na jedné straně a „331“ na druhé straně) obsahuje inertní složky. Jedna žlutá tableta (vyraženo „dp“ na jedné straně a „457“ na druhé straně) obsahuje 0,01 mg ethinylestradiolu.
Krabice po 6 NDC 51285-114-58
Uchovávejte při teplotě 20° až 25°C (68° až 77°F) [Viz USP řízená pokojová teplota ].
REFERENCE
1. Hatcher RA, Trussell J, Stewart F a kol. Antikoncepční technologie: Sedmnácté přepracované vydání, New York: Irvington Publishers, 1998, v tisku.
2. Stadel BV. Perorální antikoncepce a kardiovaskulární onemocnění. (Pt. 1). N Engl J Med 1981; 305:612–618.
3. Stadel BV. Perorální antikoncepce a kardiovaskulární onemocnění. (Pt. 2). N Engl J Med 1981; 305:672–677.
44. Shapiro S. Perorální antikoncepce – čas na inventuru. N Engl J Med 1987; 315:450–451.
73. Studie Cancer and Steroid Hormone Centers for Disease Control a National Institute of Child Health and Human Development: Perorální antikoncepční užívání a riziko rakoviny vaječníků. JAMA 1983; 249:1596–1599.
74. Studie Cancer and Steroid Hormone Centers for Disease Control a National Institute of Child Health and Human Development: Kombinované užívání perorální antikoncepce a riziko rakoviny endometria. JAMA 1987; 257:796-800.
75. Ory HW. Funkční ovariální cysty a perorální antikoncepce: chirurgicky potvrzená negativní souvislost. JAMA 1974; 228:68–69.
76. Ory HW, Cole P, Macmahon B, Hoover R. Perorální antikoncepce a snížené riziko benigního onemocnění prsu. N Engl J Med 1976; 294:419-422.
77. Ory HW. Neantikoncepční zdravotní přínosy užívání perorální antikoncepce. Fam Plann Perspect 1982; 14:182–184.
78. Ory HW, Forrest JD, Lincoln R. Making Choices: Hodnocení zdravotních rizik a přínosů antikoncepčních metod. New York, Institut Alana Guttmachera, 1983; p. 1.
90. Godsland, I a kol. Účinky různých formulací perorálních kontraceptiv na metabolismus lipidů a sacharidů. N Engl J Med 1990; 323:1375-81.
91. Kloosterboer, HJ a kol. Selektivita ve vazbě progesteronu a androgenního receptoru progestogenů používaných v perorální antikoncepci. Antikoncepce, 1988; 38:325–32.
92. Van der Vies, J a de Visser, J. Endokrinologické studie s desogestrelem. Arzneim. Forsch./Drug Res., 1983; 33(l),2:231–6.
93. Údaje ve spisu, Organon Inc.
94. Fotherby, K. Perorální antikoncepce, lipidy a kardiovaskulární onemocnění. Antikoncepce, 1985; sv. 31; 4:367–94.
95. Lawrence, DM a kol. Snížený globulin vázající pohlavní hormony a odvozené hladiny volného testosteronu u žen s těžkým akné. Klinická endokrinologie, 1981; 15:87–91.
96. Cullberg, G a kol. Účinky nízké dávky kombinace desogestrel-ethinylestradiol na hirsutismus, androgeny a globulin vázající pohlavní hormony u žen se syndromem polycystických vaječníků. Acta Obstet Gynecol Scand, 1985; 64:195–202.
97. Jung-Hoffmann, C a Kuhl, H. Rozdílné účinky dvou nízkodávkových perorálních kontraceptiv na globulin vázající pohlavní hormony a volný testosteron. AJOG, 1987; 156:199–203.
98. Hammond, G a kol. Koncentrace proteinu vázajícího steroidy v séru, distribuce progestogenů a biologická dostupnost testosteronu během léčby antikoncepčními přípravky obsahujícími desogestrel nebo levonorgestrel. Fertil. Steril., 1984; 42:44–51.
99. Palatsi, R a kol. Celkový a nevázaný testosteron a globulin vázající pohlavní hormony (SHBG) v séru u pacientek s akné léčených dvěma různými perorálními kontraceptivy. Acta Derm Venereol, 1984; 64:517–23.
Teva Women'S Health, Inc., dceřiná společnost Teva Pharmaceuticals USA, Inc. Sellersville, PA 18960. Rev. 06/2012
VEDLEJŠÍ EFEKTY
S užíváním perorální antikoncepce bylo spojeno zvýšené riziko následujících závažných nežádoucích účinků (viz VAROVÁNÍ sekce):
- Tromboflebitida a žilní trombóza s embolií nebo bez embolie
- Arteriální tromboembolismus
- Plicní embolie
- Infarkt myokardu
- Mozkové krvácení
- Mozková trombóza
- Hypertenze
- Onemocnění žlučníku
- Jaterní adenomy nebo benigní nádory jater
Existují důkazy o souvislosti mezi následujícími stavy a užíváním perorální antikoncepce:
- Mezenteriální trombóza
- Trombóza sítnice
Následující nežádoucí účinky byly hlášeny u pacientů užívajících perorální antikoncepci a předpokládá se, že souvisejí s lékem:
- Nevolnost
- Zvracení
- Gastrointestinální příznaky (jako jsou křeče v břiše a nadýmání)
- Průlomové krvácení
- špinění
- Změna menstruačního toku
- Amenorea
- Dočasná neplodnost po přerušení léčby
- Otok
- Melasma, které může přetrvávat
- Změny prsou: citlivost, zvětšení, sekrece
- Změna hmotnosti (zvýšení nebo snížení)
- Změna cervikální eroze a sekrece
- Snížení laktace při podání bezprostředně po porodu
- Cholestatická žloutenka
- Migréna
- Vyrážka (alergická)
- Duševní deprese
- Snížená tolerance vůči sacharidům
- Vaginální kandidóza
- Změna zakřivení rohovky (zostření)
- Nesnášenlivost kontaktních čoček
Následující nežádoucí účinky byly hlášeny u uživatelek perorální antikoncepce a souvislost nebyla potvrzena ani vyvrácena:
- Předmenstruační syndrom
- Šedý zákal
- Změny chuti k jídlu
- Syndrom podobný cystitidě
- Bolest hlavy
- Nervozita
- Závrať
- Hirsutismus
- Ztráta vlasů na pokožce hlavy
- Multiformní erytém
- Erythema nodosum
- Hemoragická erupce
- Vaginitida
- porfyrie
- Porucha funkce ledvin
- Hemolyticko-uremický syndrom
- Akné
- Změny libida
- Kolitida
- Budd-Chiariho syndrom
DROGOVÉ INTERAKCE
Se současným užíváním rifampinu je spojena snížená účinnost a zvýšený výskyt krvácení z průniku a menstruačních nepravidelností. Podobná souvislost, i když méně výrazná, byla navržena s barbituráty, fenylbutazonem, fenytoinem sodným, karbamazepinem a možná s griseofulvinem, ampicilinem a tetracykliny (72).
Ukázalo se, že kombinovaná hormonální antikoncepce při současném podávání významně snižuje plazmatické koncentrace lamotriginu, pravděpodobně v důsledku indukce glukuronidace lamotriginu. To může snížit kontrolu záchvatů; proto může být nutná úprava dávkování lamotriginu.
Chcete-li získat další informace o interakcích s hormonální antikoncepcí nebo o potenciálu enzymových změn, podívejte se na označení současně užívaného léku.
Interakce s laboratorními testy
Některé endokrinní a jaterní testy a krevní složky mohou být ovlivněny perorální antikoncepcí:
VAROVÁNÍ
Kouření cigaret zvyšuje riziko závažných kardiovaskulárních vedlejších účinků při užívání perorální antikoncepce. Toto riziko se zvyšuje s věkem a při silném kouření (15 a více cigaret denně) a je poměrně výrazné u žen starších 35 let. Ženám, které užívají perorální antikoncepci, je třeba důrazně doporučit, aby nekouřily.
Užívání perorální antikoncepce je spojeno se zvýšeným rizikem několika závažných stavů včetně infarktu myokardu, tromboembolie, cévní mozkové příhody, neoplazie jater a onemocnění žlučníku, ačkoli riziko závažné morbidity nebo mortality je u zdravých žen bez základních rizikových faktorů velmi malé. Riziko morbidity a mortality se významně zvyšuje v přítomnosti dalších základních rizikových faktorů, jako je hypertenze, hyperlipidémie, obezita a diabetes.
Praktičtí lékaři předepisující perorální antikoncepci by měli znát následující informace týkající se těchto rizik.
Informace obsažené v tomto příbalovém letáku jsou v zásadě založeny na studiích provedených u pacientek, které užívaly perorální antikoncepci s přípravky obsahujícími vyšší dávky estrogenů a progestogenů, než jaké se dnes běžně používají. Účinek dlouhodobého užívání perorální antikoncepce s formulacemi s nižšími dávkami estrogenů i progestogenů zbývá určit.
rámci tohoto označování jsou uváděné epidemiologické studie dvou typů: retrospektivní studie nebo studie případové kontroly a prospektivní nebo kohortové studie. Případové kontrolní studie poskytují míru relativního rizika onemocnění, jmenovitě poměr výskytu onemocnění mezi uživatelkami orální antikoncepce a mezi neuživatelkami. Relativní riziko neposkytuje informaci o skutečném klinickém výskytu onemocnění. Skupinové studie poskytují míru přiřaditelného rizika, což je rozdíl ve výskytu onemocnění mezi uživatelkami a neuživatelkami perorální antikoncepce. Přičitatelné riziko poskytuje informaci o skutečném výskytu onemocnění v populaci (Upraveno podle odkazů 2 a 3 se svolením autora). Pro další informace je čtenář odkázán na text o epidemiologických metodách.
Tromboembolické poruchy a další cévní problémy
Tromboembolismus
Zvýšené riziko tromboembolické a trombotické choroby spojené s užíváním perorální antikoncepce je dobře známo. Případové kontrolní studie zjistily, že relativní riziko uživatelek ve srovnání s ženami, které neužívají, je 3 pro první epizodu povrchové žilní tromboembolické choroby, 4 až 11 pro hlubokou žilní trombózu nebo plicní embolii a 1,5 až 6 pro ženy s predisponujícími stavy k žilní tromboembolická nemoc (2,3,19–24). Kohortové studie ukázaly, že relativní riziko je poněkud nižší, asi 3 u nových případů a asi 4,5 u nových případů vyžadujících hospitalizaci [25]. Riziko tromboembolické nemoci spojené s perorálními kontraceptivy nesouvisí s délkou užívání a mizí po ukončení užívání pilulek (2).
Několik epidemiologických studií ukazuje, že perorální antikoncepce třetí generace, včetně těch obsahujících desogestrel, jsou spojeny s vyšším rizikem žilního tromboembolismu než některá perorální antikoncepce druhé generace (102–104). Obecně tyto studie naznačují přibližně dvojnásobné zvýšené riziko, což odpovídá dalšímu 1 až 2 případům žilního tromboembolismu na 10 000 žen-roků užívání. Údaje z dalších studií však toto dvojnásobné zvýšení rizika neprokázaly.
Při užívání perorální antikoncepce bylo hlášeno dvojnásobné až čtyřnásobné zvýšení relativního rizika pooperačních tromboembolických komplikací [9,26]. Relativní riziko žilní trombózy u žen, které mají predisponující onemocnění, je dvakrát vyšší než u žen bez těchto onemocnění [9,26]. Je-li to možné, měla by být perorální antikoncepce vysazena alespoň čtyři týdny před a po dobu dvou týdnů po elektivním chirurgickém zákroku typu spojeného se zvýšeným rizikem tromboembolie a během a po dlouhodobé imobilizaci. Vzhledem k tomu, že období bezprostředně po porodu je také spojeno se zvýšeným rizikem tromboembolie, neměly by ženy, které se rozhodly nekojit, začít s perorální antikoncepcí nejdříve čtyři týdny po porodu.
Infarkt myokardu
Zvýšené riziko infarktu myokardu bylo připisováno užívání perorální antikoncepce. Toto riziko je primárně u kuřaček nebo žen s jinými základními rizikovými faktory pro onemocnění koronárních tepen, jako je hypertenze, hypercholesterolémie, morbidní obezita a diabetes. Relativní riziko srdečního infarktu u současných uživatelek perorální antikoncepce se odhaduje na dvě až šest (4–10). Riziko je velmi nízké u žen do 30 let.
Bylo prokázáno, že kouření v kombinaci s užíváním perorální antikoncepce významně přispívá k incidenci infarktu myokardu u žen ve věku kolem třiceti let nebo starších, přičemž většinu případů nadměrného výskytu představuje kouření (11). Bylo prokázáno, že úmrtnost spojená s onemocněním krevního oběhu se podstatně zvýšila u kuřaček ve věku nad 35 let a nekuřaček ve věku nad 40 let (tabulka III) u žen, které užívají perorální antikoncepci.
TABULKA III: ÚMRTNOST NA OCĚHOVÉ ONEMOCNĚNÍ NA 100 000 ŽENYCH PODLE VĚKU, KOUŘENÍ A UŽÍVÁNÍ ORÁLNÍ ANTIKONCEPCE
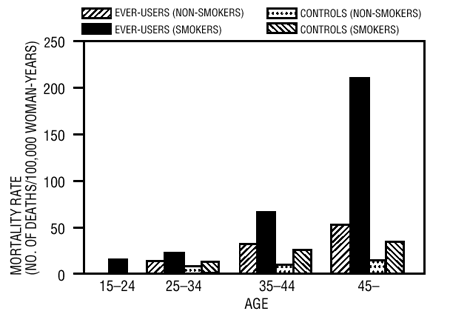
Převzato z PM Layde a V. Beral, č.j. #12.
Perorální antikoncepce může zesílit účinky dobře známých rizikových faktorů, jako je hypertenze, diabetes, hyperlipidemie, věk a obezita (13). Zejména je známo, že některé gestageny snižují HDL cholesterol a způsobují glukózovou intoleranci, zatímco estrogeny mohou vytvářet stav hyperinzulinismu (14–18). Bylo prokázáno, že perorální antikoncepce zvyšuje mezi uživatelkami krevní tlak (viz VAROVÁNÍ ). Podobné účinky na rizikové faktory byly spojeny se zvýšeným rizikem srdečních onemocnění. Perorální antikoncepce musí být používána s opatrností u žen s rizikovými faktory kardiovaskulárního onemocnění.
Cerebrovaskulární onemocnění
Bylo prokázáno, že perorální antikoncepce zvyšuje jak relativní, tak i přisuzitelná rizika cerebrovaskulárních příhod (trombotické a hemoragické mrtvice), ačkoli obecně je riziko největší u starších (> 35 let), hypertoniček, které také kouří. Bylo zjištěno, že hypertenze je rizikovým faktorem jak pro uživatele, tak pro neuživatele, a to pro oba typy mrtvice, zatímco kouření interagovalo ke zvýšení rizika hemoragických mrtvic (27–29).
Ve velké studii bylo prokázáno, že relativní riziko trombotických mrtvic se pohybuje od 3 u normotenzních uživatelů do 14 u uživatelů s těžkou hypertenzí (30). Relativní riziko hemoragické cévní mozkové příhody se uvádí 1,2 u nekuřaček užívajících perorální antikoncepci, 2,6 u kuřaček, které perorální antikoncepci neužívaly, 7,6 u kuřaček užívajících perorální antikoncepci, 1,8 u normotenzních uživatelek a 25,7 u uživatelek s těžkou hypertenzí ( 30). Připisované riziko je také vyšší u starších žen (3).
Na dávce závislé riziko vaskulárního onemocnění z perorální antikoncepce
Byla pozorována pozitivní souvislost mezi množstvím estrogenu a gestagenu v perorálních kontraceptivech a rizikem vaskulárního onemocnění (31–33). Pokles sérových lipoproteinů s vysokou hustotou (HDL) byl hlášen u mnoha progestačních látek (14–16). Pokles sérových lipoproteinů s vysokou hustotou je spojen se zvýšeným výskytem ischemické choroby srdeční. Protože estrogeny zvyšují HDL cholesterol, závisí čistý účinek perorální antikoncepce na rovnováze dosažené mezi dávkami estrogenu a progestogenu a na povaze a absolutním množství progestogenů použitých v antikoncepčních přípravcích. Při výběru perorální antikoncepce je třeba vzít v úvahu množství obou hormonů.
Minimalizace expozice estrogenu a gestagenu je v souladu s dobrými principy terapie. Pro jakoukoli konkrétní kombinaci estrogen/progestogen by měl být předepsaný režim dávkování takový, který obsahuje nejmenší množství estrogenu a progestogenu, které je kompatibilní s nízkou mírou selhání a potřebami jednotlivého pacienta. Nové akceptory perorálních kontraceptiv by měly být zahájeny s přípravky obsahujícími 0,035 mg nebo méně estrogenu.
Přetrvávání rizika cévních onemocnění
Existují dvě studie, které prokázaly přetrvávání rizika vaskulárního onemocnění u uživatelky perorální antikoncepce. Ve studii ve Spojených státech přetrvává riziko rozvoje infarktu myokardu po vysazení perorální antikoncepce po dobu nejméně 9 let u žen ve věku 40 až 49 let, které užívaly perorální antikoncepci po dobu pěti nebo více let, ale toto zvýšené riziko nebylo prokázáno u ostatní věkové skupiny (8). V jiné studii ve Velké Británii přetrvávalo riziko rozvoje cerebrovaskulárního onemocnění po dobu nejméně 6 let po vysazení perorální antikoncepce, ačkoli zvýšené riziko bylo velmi malé [34]. Obě studie však byly provedeny s perorálními antikoncepčními přípravky obsahujícími 50 mikrogramů nebo více estrogenu.
Odhady úmrtnosti při užívání antikoncepce
Jedna studie shromáždila údaje z různých zdrojů, které odhadly úmrtnost spojenou s různými metodami antikoncepce v různém věku (tabulka IV). Tyto odhady zahrnují kombinované riziko úmrtí spojené s antikoncepčními metodami plus riziko připisované těhotenství v případě selhání metody. Každá metoda antikoncepce má své specifické výhody a rizika. Studie dospěla k závěru, že s výjimkou uživatelek perorální antikoncepce ve věku 35 let a starších, které kouří, a 40 let a starších, které nekouří, je úmrtnost spojená se všemi metodami antikoncepce nízká a nižší než úmrtnost související s porodem.
Pozorování možného nárůstu rizika úmrtnosti s věkem u uživatelek perorální antikoncepce je založeno na údajích shromážděných v 70. letech 20. století – ale až v roce 1983 (35). Současná klinická praxe však zahrnuje použití přípravků s nižším obsahem estrogenu v kombinaci s pečlivým zvážením rizikových faktorů.
Kvůli těmto změnám v praxi a také kvůli některým omezeným novým údajům, které naznačují, že riziko kardiovaskulárních onemocnění při užívání perorální antikoncepce může být nyní nižší, než bylo dříve pozorováno (100 101), byl Poradní výbor pro drogy pro plodnost a zdraví matek v roce 1989 požádali o přezkoumání tohoto tématu. Výbor došel k závěru, že ačkoli se rizika kardiovaskulárních onemocnění mohou zvýšit užíváním perorální antikoncepce po 40 letech u zdravých nekuřaček (dokonce i u novějších přípravků s nízkými dávkami), existují také větší potenciální zdravotní rizika související s těhotenstvím u starších žen as alternativními chirurgickými a lékařskými postupy, které mohou být nezbytné, pokud tyto ženy nemají přístup k účinným a přijatelným prostředkům antikoncepce.
Výbor proto doporučil, aby přínosy užívání nízkých dávek perorální antikoncepce zdravými nekuřáky nad 40 let převážily možná rizika. Starší ženy, stejně jako všechny ženy, které užívají perorální antikoncepci, by samozřejmě měly užívat formulaci s nejnižší možnou dávkou, která je účinná.
TABULKA IV: ROČNÍ POČET ÚMRTÍ SPOJENÝCH S PORODEM NEBO METODOU SPOJENÝCH S KONTROLOU PLODNOSTI NA 100 000 NESTERILNÍCH ŽEN, PODLE METODY KONTROLY PLODNOSTI PODLE VĚKU
Karcinom reprodukčních orgánů a prsů
Byla provedena řada epidemiologických studií výskytu rakoviny prsu, endometria, vaječníků a děložního čípku u žen užívajících perorální antikoncepci. Přestože existují protichůdné zprávy, většina studií naznačuje, že užívání perorální antikoncepce není spojeno s celkovým zvýšením rizika vzniku rakoviny prsu. Některé studie uvádějí zvýšené relativní riziko vzniku rakoviny prsu, zejména v mladším věku. Zdá se, že toto zvýšené relativní riziko souvisí s délkou užívání (36–43, 79–89).
Některé studie naznačují, že užívání perorální antikoncepce bylo u některých populací žen spojeno se zvýšením rizika cervikální intraepiteliální neoplazie (45–48). Přetrvávají však spory o tom, do jaké míry mohou být tato zjištění způsobena rozdíly v sexuálním chování a dalšími faktory.
Jaterní neoplazie
Benigní jaterní adenomy jsou spojeny s užíváním perorální antikoncepce, i když výskyt benigních nádorů je v USA vzácný. Nepřímé výpočty odhadly přiřaditelné riziko v rozmezí 3,3 případů/100 000 pro uživatele, což je riziko, které se zvyšuje po čtyřech a více letech užívání, zejména u perorálních kontraceptiv ve vyšších dávkách (49). Ruptura vzácných benigních jaterních adenomů může způsobit smrt intraabdominálním krvácením [50,51].
Studie z Británie prokázaly zvýšené riziko rozvoje hepatocelulárního karcinomu (52–54) u dlouhodobých (> 8 let) uživatelek perorální antikoncepce. Tyto rakoviny jsou však v USA extrémně vzácné a připisované riziko (nadměrný výskyt) rakoviny jater u uživatelek perorální antikoncepce se blíží méně než jedné na milion uživatelů.
Oční léze
Byly hlášeny klinické případy trombózy sítnice spojené s užíváním perorální antikoncepce. Perorální antikoncepce by měla být vysazena, pokud dojde k nevysvětlitelné částečné nebo úplné ztrátě zraku; nástup proptózy nebo diplopie; edém papily; nebo retinální vaskulární léze. Okamžitě by měla být přijata vhodná diagnostická a terapeutická opatření.
Užívání perorální antikoncepce před nebo během časného těhotenství
Rozsáhlé epidemiologické studie neodhalily žádné zvýšené riziko vrozených vad u žen, které před těhotenstvím užívaly perorální antikoncepci (55–57). Studie také nenaznačují teratogenní účinek, zejména pokud jde o srdeční anomálie a defekty zmenšení končetin (55,56,58,59), když jsou perorální antikoncepce neúmyslně užívány během časného těhotenství.
Podávání perorální antikoncepce k vyvolání krvácení z vysazení by nemělo být používáno jako test na těhotenství. Perorální antikoncepce by se během těhotenství neměla používat k léčbě hrozícího nebo obvyklého potratu. Doporučuje se, aby u každé pacientky, která vynechala dvě po sobě jdoucí menstruace, bylo před pokračováním v užívání perorální antikoncepce vyloučeno těhotenství. Pokud pacientka nedodržuje předepsané schéma, je třeba zvážit možnost těhotenství při první vynechané menstruaci. Užívání perorální antikoncepce by mělo být přerušeno, dokud není vyloučeno těhotenství.
Onemocnění žlučníku
Dřívější studie uváděly zvýšené celoživotní relativní riziko operace žlučníku u uživatelek perorální antikoncepce a estrogenů (60,61). Novější studie však ukázaly, že relativní riziko rozvoje onemocnění žlučníku mezi uživatelkami perorální antikoncepce může být minimální [62–64]. Nedávné poznatky o minimálním riziku mohou souviset s užíváním perorálních antikoncepčních přípravků obsahujících nižší hormonální dávky estrogenů a gestagenů.
Metabolické účinky sacharidů a lipidů
Bylo prokázáno, že perorální antikoncepce způsobuje snížení glukózové tolerance u významného procenta uživatelek (17). Perorální antikoncepce obsahující více než 75 mikrogramů estrogenů způsobuje hyperinzulinismus, zatímco nižší dávky estrogenu způsobují menší intoleranci glukózy (65). Progestageny zvyšují sekreci inzulinu a vytvářejí inzulinovou rezistenci, přičemž tento účinek se u různých progestačních činidel liší (17,66). Zdá se však, že u nediabetických žen perorální antikoncepce nemá žádný vliv na hladinu glukózy v krvi nalačno (67). Kvůli těmto prokázaným účinkům by měly být prediabetické a diabetické ženy při užívání perorální antikoncepce pečlivě sledovány.
Malá část žen bude mít přetrvávající hypertriglyceridémii během užívání pilulek. Jak již bylo zmíněno dříve (viz VAROVÁNÍ u uživatelek perorální antikoncepce byly hlášeny změny v hladinách triglyceridů a lipoproteinů v séru.
Zvýšený krevní tlak
Zvýšení krevního tlaku bylo hlášeno u žen užívajících perorální antikoncepci (68) a toto zvýšení je pravděpodobnější u starších uživatelek perorální antikoncepce (69) a při pokračujícím užívání (61). Údaje z Royal College of General Practitioners (12) a následné randomizované studie ukázaly, že výskyt hypertenze se zvyšuje se zvyšujícím se množstvím progestogenů.
Ženy s anamnézou hypertenze nebo onemocnění souvisejících s hypertenzí nebo onemocněním ledvin (70) by měly být povzbuzovány k používání jiné metody antikoncepce. Pokud se ženy rozhodnou užívat perorální antikoncepci, měly by být pečlivě sledovány a pokud dojde k významnému zvýšení krevního tlaku, perorální kontraceptiva by měla být vysazena. U většiny žen se zvýšený krevní tlak po vysazení perorální antikoncepce vrátí k normálu (69) a není žádný rozdíl ve výskytu hypertenze mezi někdy a nikdy neužívajícími (68,70,71).
Bolest hlavy
Nástup nebo exacerbace migrény nebo rozvoj bolesti hlavy s novým vzorem, který je opakující se, přetrvávající nebo závažný, vyžaduje vysazení perorální antikoncepce a zhodnocení příčiny.
Nepravidelnosti krvácení
U pacientek užívajících perorální antikoncepci se někdy setkáváme s krvácením z průniku a špiněním, zejména během prvních tří měsíců užívání. Je třeba zvážit nehormonální příčiny a přijmout adekvátní diagnostická opatření k vyloučení malignity nebo těhotenství v případě krvácení z průniku, jako v případě jakéhokoli abnormálního vaginálního krvácení. Pokud byla patologie vyloučena, může problém vyřešit čas nebo změna na jinou formulaci. V případě amenorey je třeba vyloučit těhotenství.
Některé ženy se mohou setkat s amenoreou po užití pilulky nebo oligomenoreou, zejména pokud již takový stav existoval.
Mimoděložní těhotenství
Při selhání antikoncepce se může objevit mimoděložní i intrauterinní těhotenství.
OPATŘENÍ
Všeobecné
Pacienti by měli být poučeni, že tento produkt nechrání před infekcí HIV (AIDS) a jinými pohlavně přenosnými chorobami.
Fyzikální vyšetření a sledování
Je dobrou lékařskou praxí, aby všechny ženy podstupovaly každoroční anamnézu a fyzikální vyšetření, včetně žen užívajících perorální antikoncepci. Fyzikální vyšetření však může být odloženo až po zahájení perorální antikoncepce, pokud o to žena požádá a lékař to uzná za vhodné. Fyzikální vyšetření by mělo zahrnovat zvláštní zmínku o krevním tlaku, prsou, břiše a pánevních orgánech, včetně cervikální cytologie a příslušných laboratorních testech. V případě nediagnostikovaného, přetrvávajícího nebo opakujícího se abnormálního vaginálního krvácení je třeba provést vhodná opatření k vyloučení malignity. Ženy se silnou rodinnou anamnézou rakoviny prsu nebo ženy, které mají prsní uzliny, by měly být sledovány zvláště pečlivě.
Poruchy lipidů
Ženy, které jsou léčeny pro hyperlipidemii, by měly být pečlivě sledovány, pokud se rozhodnou užívat perorální antikoncepci. Některé gestageny mohou zvýšit hladiny LDL a mohou ztížit kontrolu hyperlipidemií.
Funkce jater
Pokud se u kterékoli ženy užívající takové léky objeví žloutenka, je třeba léčbu přerušit. U pacientů s poruchou funkce jater mohou být steroidní hormony špatně metabolizovány.
Zadržování tekutin
Perorální antikoncepce může způsobit určitý stupeň zadržování tekutin. Měly by být předepisovány s opatrností a pouze s pečlivým sledováním u pacientů se stavy, které by se mohly zhoršit zadržováním tekutin.
Emoční poruchy
Ženy s depresí v anamnéze by měly být pečlivě sledovány a lék vysadit, pokud se deprese ve vážném rozsahu vrátí.
Kontaktní čočky
Nositelé kontaktních čoček, u kterých dojde ke změnám zraku nebo ke změně tolerance čočky, by měli být vyšetřeni oftalmologem.
Karcinogeneze
Vidět VAROVÁNÍ sekce.
Těhotenství
Kategorie těhotenství X (viz KONTRAINDIKACE a VAROVÁNÍ sekce).
Kojící matky
V mléce kojících matek byla zjištěna malá množství perorálních antikoncepčních steroidů a bylo hlášeno několik nežádoucích účinků na dítě, včetně žloutenky a zvětšení prsou. Navíc perorální antikoncepce podávaná v poporodním období může narušovat laktaci snížením množství a kvality mateřského mléka. Pokud je to možné, kojící matce by se mělo doporučit, aby nepoužívala perorální antikoncepci, ale používala jiné formy antikoncepce, dokud dítě zcela neodstaví.
Pediatrické použití
Bezpečnost a účinnost tablet Mircette® (desogestrel/ethinylestradiol a ethinylestradiol) byla stanovena u žen v reprodukčním věku. Očekává se, že bezpečnost a účinnost bude stejná pro postpubertální dospívající do 16 let a pro uživatele ve věku 16 let a starší. Použití tohoto produktu před menarche není indikováno.
Informace pro pacienta
Vidět Označení pacienta
REFERENCE
1. Hatcher RA, Trussell J, Stewart F a kol. Antikoncepční technologie: Sedmnácté přepracované vydání, New York: Irvington Publishers, 1998, v tisku.
2. Stadel BV. Perorální antikoncepce a kardiovaskulární onemocnění. (Pt. 1). N Engl J Med 1981; 305:612–618.
3. Stadel BV. Perorální antikoncepce a kardiovaskulární onemocnění. (Pt. 2). N Engl J Med 1981; 305:672–677.
4. Adam SA, Thorogood M. Opakovaná perorální antikoncepce a infarkt myokardu: účinky nových přípravků a vzorce předepisování. Br J Obstet a Gynecol 1981; 88:838–845.
5. Mann JI, Inman WH. Perorální antikoncepce a úmrtí na infarkt myokardu. Br Med J 1975; 2(5965):245–248.
6. Mann JI, Vessey MP, Thorogood M, Doll R. Infarkt myokardu u mladých žen se zvláštním zřetelem na praxi orální antikoncepce. Br Med J 1975; 2(5956):241–245.
7. Royal College of General Practitioners' Oral Contraception Study: Další analýzy úmrtnosti uživatelek perorální antikoncepce. Lancet 1981; 1:541–546.
8. Slone D, Shapiro S, Kaufman DW, Rosenberg L, Miettinen OS, Stolley PD. Riziko infarktu myokardu v souvislosti se současným a vysazeným užíváním perorální antikoncepce. N Engl J Med 1981; 305:420–424.
9. Vessey MP. Ženské hormony a cévní onemocnění — epidemiologický přehled. Br J Fam Plann 1980; 6:1–12.
10. Russell-Briefel RG, Ezzati TM, Fulwood R, Perlman JA, Murphy RS. Stav kardiovaskulárního rizika a užívání perorální antikoncepce, Spojené státy americké, 1976–80. Prevent Med 1986; 15:352–362.
11. Goldbaum GM, Kendrick JS, Hogelin GC, Gentry EM. Relativní dopad kouření a užívání perorální antikoncepce na ženy ve Spojených státech. JAMA 1987; 258:1339–1342.
12. Layde PM, Beral V. Další analýzy úmrtnosti uživatelek perorální antikoncepce: Royal College General Practitioners' Oral Contraception Study. (Tabulka 5) Lancet 1981; 1:541–546.
13. Knopp RH. Riziko arteriosklerózy: role perorální antikoncepce a postmenopauzálních estrogenů. J Reprod Med 1986; 31(9) (Dodatek):913–921.
14. Krauss RM, Roy S, Mishell DR, Casagrande J, Pike MC. Účinky dvou nízkodávkových perorálních kontraceptiv na sérové lipidy a lipoproteiny: Diferenciální změny v podtřídách lipoproteinů s vysokou hustotou. Am J Obstet 1983; 145:446–452.
15. Wahl P, Walden C, Knopp R, Hoover J, Wallace R, Heiss G, Rifkind B. Vliv účinnosti estrogen/progestin na lipid/lipoprotein cholesterol. N Engl J Med 1983; 308:862–867.
16. Wynn V, Niththyananthan R. Účinek progestinu v kombinovaných perorálních kontraceptivech na sérové lipidy se zvláštním ohledem na lipoproteiny s vysokou hustotou. Am J Obstet Gynecol 1982; 142:766–771.
17. Wynn V, Godsland I. Účinky perorální antikoncepce a metabolismus sacharidů. J Reprod Med 1986; 31 (9) (Dodatek):892–897.
18. LaRosa JC. Aterosklerotické rizikové faktory kardiovaskulárních onemocnění. J Reprod Med 1986; 31 (9) (Dodatek):906–912.
19. Inman WH, Vessey MP. Vyšetřování úmrtí na plicní, koronární a cerebrální trombózu a embolii u žen v plodném věku. Br Med J 1968; 2 (5599):193–199.
20. Maguire MG, Tonascia J, Sartwell PE, Stolley PD, Tockman MS. Zvýšené riziko trombózy v důsledku perorální antikoncepce: další zpráva. Am J Epidemiol 1979; 110 (2): 188–195.
21. Pettiti DB, Wingerd J, Pellegrin F, Ramacharan S. Riziko vaskulárního onemocnění u žen: kouření, perorální antikoncepce, neantikoncepční estrogeny a další faktory. JAMA 1979; 242:1150–1154.
22. Vessey MP, Doll R. Zkoumání vztahu mezi užíváním perorální antikoncepce a tromboembolickou nemocí. Br Med J 1968; 2 (5599): 199-205.
23. Vessey MP, Doll R. Zkoumání vztahu mezi užíváním perorální antikoncepce a tromboembolickou nemocí. Další zpráva. Br Med J 1969; 2 (5658): 651–657.
24. Porter JB, Hunter JR, Danielson DA, Jick H, Stergachis A. Perorální antikoncepce a nefatální vaskulární onemocnění – nedávná zkušenost. Obstet Gynecol 1982; 59 (3): 299-302.
25. Vessey M, Doll R, Peto R, Johnson B, Wiggins P. Dlouhodobá následná studie žen používajících různé metody antikoncepce: průběžná zpráva. Biosocial Sci 1976; 8:375–427.
26. Royal College of General Practitioners: Perorální antikoncepce, žilní trombóza a křečové žíly. J Royal Coll Gen Pract 1978; 28:393–399.
27. Kolaborativní skupina pro studium cévní mozkové příhody u mladých žen: Perorální antikoncepce a zvýšené riziko mozkové ischemie nebo trombózy. N Engl J Med 1973; 288:871-878.
28. Petitti DB, Wingerd J. Používání perorální antikoncepce, kouření cigaret a riziko subarachnoidálního krvácení. Lancet 1978; 2:234–236.
29. Inman WH. Perorální antikoncepce a fatální subarachnoidální krvácení. Br Med J 1979; 2 (6203):1468–70.
30. Kolaborativní skupina pro studium mrtvice u mladých žen: Perorální antikoncepce a mrtvice u mladých žen: související rizikové faktory. JAMA 1975; 231:718-722.
31. Inman WH, Vessey MP, Westerholm B, Engelund A. Tromboembolická nemoc a steroidní obsah perorálních kontraceptiv. Zpráva pro Výbor pro bezpečnost léčiv. Br Med J 1970; 2:203–209.
32. Meade TW, Greenberg G, Thompson SG. Progestageny a kardiovaskulární reakce spojené s perorálními kontraceptivy a srovnání bezpečnosti 50- a 35-mcg estrogenových přípravků. Br Med J 1980; 280 (6224):1157–1161.
33. Kay ČR. Progestogeny a arteriální onemocnění – důkazy ze studie Royal College of General Practitioners' Study. Am J Obstet Gynecol 1982; 142:762–765.
34. Royal College of General Practitioners: Výskyt arteriálních onemocnění mezi uživatelkami perorální antikoncepce. J Royal Coll Gen Pract 1983; 33:75–82.
35. Ory HW. Úmrtnost spojená s plodností a kontrolou plodnosti: 1983. Perspektivy plánování rodiny 1983; 15:50–56.
36. Studie Cancer and Steroid Hormone Centers for Disease Control a National Institute of Child Health and Human Development: Orální antikoncepční užívání a riziko rakoviny prsu. N Engl J Med 1986; 315:405–411.
37. Pike MC, Henderson BE, Krailo MD, Duke A, Roy S. Riziko rakoviny prsu u mladých žen a používání perorální antikoncepce: možný modifikující účinek formulace a věk při použití. Lancet 1983; 2:926–929.
38. Paul C, Skegg DG, Spears GFS, Kaldor JM. Perorální antikoncepce a rakovina prsu: Národní studie. Br Med J 1986; 293:723–725.
39. Miller DR, Rosenberg L, Kaufman DW, Schottenfeld D, Stolley PD, Shapiro S. Riziko rakoviny prsu ve vztahu k časnému užívání perorální antikoncepce. Obstet Gynecol 1986; 68:863–868.
40. Olson H, Olson KL, Moller TR, Ranstam J, Holm P. Užívání orální antikoncepce a rakovina prsu u mladých žen ve Švédsku (dopis). Lancet 1985; 2:748–749.
41. McPherson K, Vessey M, Neil A, Doll R, Jones L, Roberts M. Časné užívání antikoncepce a rakovina prsu: Výsledky jiné studie případu a kontroly. Br J Cancer 1987; 56:653–660
42. Huggins GR, Zucker PF. Perorální antikoncepce a neoplazie: aktualizace z roku 1987. Fertil Steril 1987; 47:733–761.
43. McPherson K, Drife JO. Pilulka a rakovina prsu: proč ta nejistota? Br Med J 1986; 293:709-710.
45. Ory H, Naib Z, Conger SB, Hatcher RA, Tyler CW. Volba antikoncepce a prevalence cervikální dysplazie a karcinomu in situ. Am J Obstet Gynecol 1976; 124:573–577.
46. Vessey MP, Lawless M, McPherson K, Yeates D. Neoplazie děložního čípku a antikoncepce: možný nepříznivý účinek pilulky. Lancet 1983; 2:930.
47. Brinton LA, Huggins GR, Lehman HF, Malli K, Savitz DA, Trapido E, Rosenthal J, Hoover R. Dlouhodobé užívání perorální antikoncepce a riziko invazivní rakoviny děložního čípku. Int J Cancer 1986; 38:339–344.
48. Kolaborativní studie WHO neoplazie a steroidní antikoncepce: Invazivní rakovina děložního čípku a kombinovaná perorální antikoncepce. Br Med J 1985; 209:961–965.
49. Rooks JB, Ory HW, Ishak KG, Strauss LT, Greenspan JR, Hill AP, Tyler CW. Epidemiologie hepatocelulárního adenomu: role užívání perorální antikoncepce. JAMA 1979; 242:644–648.
50. Bein NN, Zlatník HS. Recidivující masivní krvácení z benigních jaterních nádorů sekundárně po perorální antikoncepci. Br J Surg 1977; 64:433–435.
51. Klatskin G. Nádory jater: možný vztah k užívání perorální antikoncepce. Gastroenterology 1977; 73:386–394.
52. Henderson BE, Preston-Martin S, Edmondson HA, Peters RL, Pike MC. Hepatocelulární karcinom a perorální antikoncepce. Br J Cancer 1983; 48:437–440.
53. Neuberger J, Forman D, Doll R, Williams R. Perorální antikoncepce a hepatocelulární karcinom. Br Med J 1986; 292:1355–1357.
54. Forman D, Vincent TJ, Doll R. Rakovina jater a perorální antikoncepce. Br Med J 1986; 292:1357–1361.
55. Harlap S, Eldor J. Narození po selhání orální antikoncepce. Obstet Gynecol 1980; 55:447–452.
56. Savolainen E, Saksela E, Saxen L. Teratogenní rizika perorální antikoncepce analyzovaná v národním registru malformací. Am J Obstet Gynecol 1981; 140:521–524.
57. Janerich DT, Piper JM, Glebatis DM. Perorální antikoncepce a vrozené vady. Am J Epidemiol 1980; 112:73–79.
58. Ferencz C, Matanoski GM, Wilson PD, Rubin JD, Neill CA, Gutberlet R. Mateřská hormonální terapie a vrozená srdeční vada. Teratologie 1980; 21:225–239.
59. Rothman KJ, Fyler DC, Goldbatt A, Kreidberg MB. Exogenní hormony a další expozice drogám u dětí s vrozenou srdeční vadou. Am J Epidemiol 1979; 109:433–439.
60. Boston Collaborative Drug Surveillance Program: Perorální antikoncepce a žilní tromboembolické onemocnění, chirurgicky potvrzené onemocnění žlučníku a nádory prsu. Lancet 1973; 1:1399–1404.
61. Royal College of General Practitioners: Perorální antikoncepce a zdraví. New York, Pittman, 1974.
62. Layde PM, Vessey MP, Yeates D. Riziko onemocnění žlučníku: kohortová studie mladých žen navštěvujících kliniky plánovaného rodičovství. J Epidemiol Community Health 1982; 36:274–278.
63. Římská skupina pro epidemiologii a prevenci cholelitiázy (GREPCO): Prevalence onemocnění žlučových kamenů v italské populaci dospělých žen. Am J Epidemiol 1984; 119:796–805.
64. Strom BL, Tamragouri RT, Morse ML, Lazar EL, West SL, Stolley PD, Jones JK. Perorální antikoncepce a další rizikové faktory onemocnění žlučníku. Clin Pharmacol Ther 1986; 39:335–341.
65. Wynn V, Adams PW, Godsland IF, Melrose J, Niththyananthan R, Oakley NW, Seedj A. Srovnání účinků různých kombinovaných přípravků orální antikoncepce na metabolismus sacharidů a lipidů. Lancet 1979; 1:1045–1049.
66. Wynn V. Vliv progesteronu a progestinů na metabolismus sacharidů. V progesteronu a progestinu. Edited by Bardin CW, Milgrom E, Mauvis-Jarvis P. New York, Raven Press, 1983, s. 395–410.
67. Perlman JA, Roussell-Briefel RG, Ezzati TM, Lieberknecht G. Orální glukózová tolerance a účinnost orálních antikoncepčních progestogenů. J Chronic Dis 1985; 38:857–864.
68. Royal College of General Practitioners' Oral Contraception Study: Vliv gestagenové složky na hypertenzi a benigní onemocnění prsu u kombinovaných perorálních kontraceptiv. Lancet 1977;
69. Fisch IR, Frank J. Perorální antikoncepce a krevní tlak. JAMA 1977; 237:2499–2503.
70. Laragh AJ. Perorální antikoncepce vyvolala hypertenzi – o devět let později. Am J Obstet Gynecol 1976; 126:141–147.
71. Ramcharan S, Peritz E, Pellegrin FA, Williams WT. Výskyt hypertenze v kohortě Walnut Creek Contraceptive Drug Study. In Farmakologie steroidních antikoncepčních léků. Garattini S, Berendes HW. Eds. New York, Raven Press, 1977, s. 277–288. (Monografie Institutu Maria Negriho pro farmakologický výzkum, Milán).
73. Studie Cancer and Steroid Hormone Centers for Disease Control a National Institute of Child Health and Human Development: Perorální antikoncepční užívání a riziko rakoviny vaječníků. JAMA 1983; 249:1596–1599.
79. Schlesselman J, Stadel BV, Murray P, Lai S. Rakovina prsu ve vztahu k časnému užívání perorální antikoncepce 1988; 259:1828–1833.
80. Hennekens CH, Speizer FE, Lipnick RJ, Rosner B, Bain C, Belanger C, Stampfer MJ, Willett W, Peto R. Případově kontrolovaná studie užívání perorální antikoncepce a rakoviny prsu. JNCI 1984; 72:39–42.
81. LaVecchia C, Decarli A, Fasoli M, Franceschi S, Gentile A, Negri E, Parazzini F, Tognoni G. Perorální antikoncepce a rakoviny prsu a ženského pohlavního ústrojí. Průběžné výsledky případové a kontrolní studie. Br. J. Cancer 1986; 54:311–317.
82. Meirik O, Lund E, Adami H, Bergstrom R, Christoffersen T, Bergsjo P. Použití perorální antikoncepce u rakoviny prsu u mladých žen. Společná národní případová-kontrolní studie ve Švédsku a Norsku. Lancet 1986; 11:650–654.
83. Kay ČR, Hannaford PC. Rakovina prsu a pilulka – další zpráva ze studie orální antikoncepce Royal College of General Practitioners. Br. J. Cancer 1988; 58:675–680.
84. Stadel BV, Lai S, Schlesselman JJ, Murray P. Perorální antikoncepce a premenopauzální karcinom prsu u nulipar. Antikoncepce 1988; 38:287–299.
85. Miller DR, Rosenberg L, Kaufman DW, Stolley P, Warshauer ME, Shapiro S. Rakovina prsu před dosažením věku 45 let a užívání perorální antikoncepce: Nové poznatky. Dopoledne. J. Epidemiol 1989; 129:269–280.
86. The UK National Case-Control Study Group, užívání orální antikoncepce a riziko rakoviny prsu u mladých žen. Lancet 1989; 1:973–982.
87. Schlesselman JJ. Rakovina prsu a reprodukčního traktu ve vztahu k užívání perorální antikoncepce. Antikoncepce 1989; 40:1–38.
88. Vessey MP, McPherson K, Villard-Mackintosh L, Yeates D. Perorální antikoncepce a rakovina prsu: nejnovější poznatky ve velké kohortové studii. Br. J. Cancer 1989; 59:613–617.
89. Jick SS, Walker AM, Stergachis A, Jick H. Perorální antikoncepce a rakovina prsu. Br. J. Cancer 1989; 59:618–621.
100. Porter JB, Hunter J, Jick H a kol. Perorální antikoncepce a nefatální cévní onemocnění. Obstet Gynecol 1985; 66:1–4.
101. Porter JB, Jick H, Walker AM. Úmrtnost mezi uživateli perorální antikoncepce. Obstet Gynecol 1987; 7029–32.
102. Jick H, Jick SS, Gurewich V, Myers MW, Vasilakis C. Riziko idiopatické kardiovaskulární smrti a nefatálního žilního tromboembolismu u žen užívajících perorální antikoncepci s různými progestagenními složkami. Lancet, 1995; 346:1589-93.
103. Kolaborativní studie Světové zdravotnické organizace kardiovaskulárních onemocnění a steroidní hormonální antikoncepce. Účinek různých progestagenů v perorálních kontraceptivech s nízkým obsahem estrogenu na žilní tromboembolické onemocnění. Lancet, 1995; 346:1582-88.
104. Spitzer WO, Lewis MA, Heinemann LAJ, Thorogood M, MacRae KD jménem Nadnárodní výzkumné skupiny pro orální antikoncepci a zdraví mladých žen. Orální antikoncepce třetí generace a riziko žilních tromboembolických poruch: Mezinárodní případová a kontrolní studie. Br Med J, 1996; 312:83–88.
105. Christensen J, Petrenaite V, Atterman J, et al. Perorální antikoncepce indukuje metabolismus lamotriginu: důkaz z dvojitě zaslepené, placebem kontrolované studie. Epilepsie 2007;48(3):484-489.
PŘEDÁVKOVAT
Po akutním požití velkých dávek perorální antikoncepce malými dětmi nebyly hlášeny závažné nežádoucí účinky. Předávkování může způsobit nevolnost a u žen se může objevit krvácení z vysazení.
Neantikoncepční zdravotní výhody
Následující neantikoncepční zdravotní přínosy spojené s užíváním perorální antikoncepce jsou podpořeny epidemiologickými studiemi, které ve velké míře využívaly formulace perorální antikoncepce obsahující dávky estrogenu přesahující 0,035 mg ethinylestradiolu nebo 0,05 mg mestranolu (73–78).
Účinky na menstruaci
- zvýšená pravidelnost menstruačního cyklu
- snížená ztráta krve a snížený výskyt anémie z nedostatku železa
- snížený výskyt dysmenorey
Účinky související s inhibicí ovulace
- snížený výskyt funkčních ovariálních cyst
- snížený výskyt mimoděložních těhotenství
Účinky z dlouhodobého užívání
- snížený výskyt fibroadenomů a fibrocystických onemocnění prsu
- snížený výskyt akutních zánětlivých onemocnění pánve
- snížený výskyt rakoviny endometria
- snížený výskyt rakoviny vaječníků
KONTRAINDIKACE
Perorální antikoncepce by neměly být používány u žen, které mají v současnosti následující onemocnění:
- Tromboflebitida nebo tromboembolické poruchy
- Hluboká žilní tromboflebitida nebo tromboembolické poruchy v anamnéze
- Onemocnění cerebrálních cév nebo koronárních tepen
- Známý nebo suspektní karcinom prsu
- Karcinom endometria nebo jiná známá nebo předpokládaná estrogen-dependentní neoplazie
- Nediagnostikované abnormální genitální krvácení
- Cholestatická žloutenka v těhotenství nebo žloutenka s předchozím užíváním pilulek
- Jaterní adenomy nebo karcinomy
- Známé nebo předpokládané těhotenství
KLINICKÁ FARMAKOLOGIE
Kombinovaná perorální antikoncepce působí supresí gonadotropinů. Ačkoli primárním mechanismem tohoto účinku je inhibice ovulace, další změny zahrnují změny v cervikálním hlenu (které zvyšují obtížnost vstupu spermií do dělohy) a endometriu (které snižují pravděpodobnost implantace).
Studie vazby na receptory, stejně jako studie na zvířatech, ukázaly, že etonogestrel, biologicky aktivní metabolit desogestrelu, kombinuje vysokou progestační aktivitu s minimální vnitřní androgenitou (91,92). Význam tohoto posledního zjištění u lidí není znám.
Farmakokinetika
Vstřebávání
Desogestrel je rychle a téměř úplně absorbován a přeměněn na etonogestrel, jeho biologicky aktivní metabolit. Po perorálním podání je relativní biologická dostupnost desogestrelu ve srovnání s roztokem, měřená hladinami etonogestrelu v séru, přibližně 100 %. Tablety Mircette® (desogestrel/ethinylestradiol a ethinylestradiol) poskytují dva různé režimy podávání ethinylestradiolu; 0,02 mg v kombinované tabletě [bílá] a 0,01 mg ve žluté tabletě. Ethinylestradiol je rychle a téměř úplně absorbován. Po jedné dávce kombinované tablety Mircette® [bílá] je relativní biologická dostupnost ethinylestradiolu přibližně 93 %, zatímco relativní biologická dostupnost 0,01 mg tablety [žlutá] je 99 %. Vliv potravy na biologickou dostupnost tablet Mircette® po perorálním podání nebyl hodnocen.
Farmakokinetika etonogestrelu a ethinylestradiolu po podání více dávek tablet Mircette® byla stanovena během třetího cyklu u 17 subjektů. Plazmatické koncentrace etonogestrelu a ethinylestradiolu dosáhly rovnovážného stavu do 21. dne. AUC(0–24) pro etonogestrel v rovnovážném stavu 21. den byla přibližně 2,2krát vyšší než AUC(0–24) 1. den třetího cyklu . Farmakokinetické parametry etonogestrelu a ethinylestradiolu během třetího cyklu po podání více dávek tablet Mircette® jsou shrnuty v tabulce I.
TABULKA I: PRŮMĚRNÉ (SD) FARMAKOKINETICKÉ PARAMETRY Mircette® ZA 28 DENNÍ DÁVKOVACÍ OBDOBÍ VE TŘETÍM CYKLU (n=17).
Rozdělení
Bylo zjištěno, že etonogestrel, aktivní metabolit desogestrelu, se z 99 % váže na proteiny, primárně na globulin vázající pohlavní hormony (SHBG). Ethinylestradiol se váže přibližně z 98,3 % především na plazmatický albumin. Ethinylestradiol se neváže na SHBG, ale indukuje syntézu SHBG. Desogestrel v kombinaci s ethinylestradiolem nepůsobí proti estrogenem indukovanému zvýšení SHBG, což má za následek nižší sérové hladiny volného testosteronu (96–99).
Metabolismus
Desogestrel:
Desogestrel je rychle a úplně metabolizován hydroxylací ve střevní sliznici a při prvním průchodu játry na etonogestrel. Byly také identifikovány další metabolity (tj. 3α-OH-desogestrel, 3β-OHdesogestrel a 3α-OH-5α-H-desogestrel) bez farmakologického účinku a tyto metabolity mohou podléhat konjugaci s glukuronidem a sulfátem.
Ethinylestradiol:
Ethinylestradiol podléhá významnému stupni presystémové konjugace (fáze II metabolismu). Konjugace střevní stěnou unikající ethinylestradiol prochází metabolismem fáze I a konjugací v játrech (metabolismus fáze II). Hlavní metabolity fáze I jsou 2-OH-ethinylestradiol a 2-methoxy-ethinylestradiol. Sulfátové a glukuronidové konjugáty jak ethinylestradiolu, tak metabolitů fáze I, které jsou vylučovány žlučí, mohou projít enterohepatální cirkulací.
Vylučování
Etonogestrel a ethinylestradiol se vylučují močí, žlučí a stolicí. V rovnovážném stavu, 21. den, je poločas eliminace etonogestrelu 27,8±7,2 hodin a poločas eliminace ethinylestradiolu pro kombinovanou tabletu je 23,9±25,5 hodin. U 0,01 mg tablety ethinylestradiolu [žlutá] je poločas eliminace v ustáleném stavu, 28. den, 18,9±8,3 hodiny.
Zvláštní populace
Závod
Neexistují žádné informace, které by určovaly účinek rasy na farmakokinetiku tablet Mircette® (desogestrel/ethinylestradiol a ethinylestradiol).
Jaterní nedostatečnost
Nebyly provedeny žádné formální studie, které by vyhodnotily účinek onemocnění jater na dispozici Mircette®.
Renální insuficience
Nebyly provedeny žádné formální studie, které by vyhodnotily účinek onemocnění ledvin na dispozice přípravku Mircette®.
Lékové interakce
V literatuře byly popsány interakce mezi desogestrelem/ethinylestradiolem a jinými léky. Nebyly provedeny žádné formální studie lékových interakcí (viz OPATŘENÍ sekce).
REFERENCE
90. Godsland, I a kol. Účinky různých formulací perorálních kontraceptiv na metabolismus lipidů a sacharidů. N Engl J Med 1990; 323:1375-81.
91. Kloosterboer, HJ a kol. Selektivita ve vazbě progesteronu a androgenního receptoru progestogenů používaných v perorální antikoncepci. Antikoncepce, 1988; 38:325–32.
92. Van der Vies, J a de Visser, J. Endokrinologické studie s desogestrelem. Arzneim. Forsch./Drug Res., 1983; 33(l),2:231–6.
96. Cullberg, G a kol. Účinky nízké dávky kombinace desogestrel-ethinylestradiol na hirsutismus, androgeny a globulin vázající pohlavní hormony u žen se syndromem polycystických vaječníků. Acta Obstet Gynecol Scand, 1985; 64:195–202.
97. Jung-Hoffmann, C a Kuhl, H. Rozdílné účinky dvou nízkodávkových perorálních kontraceptiv na globulin vázající pohlavní hormony a volný testosteron. AJOG, 1987; 156:199–203.
98. Hammond, G a kol. Koncentrace proteinu vázajícího steroidy v séru, distribuce progestogenů a biologická dostupnost testosteronu během léčby antikoncepčními přípravky obsahujícími desogestrel nebo levonorgestrel. Fertil. Steril., 1984; 42:44–51.
99. Palatsi, R a kol. Celkový a nevázaný testosteron a globulin vázající pohlavní hormony (SHBG) v séru u pacientek s akné léčených dvěma různými perorálními kontraceptivy. Acta Derm Venereol, 1984; 64:517–23.
INFORMACE PRO PACIENTA
Mircette ® (desogestrel/ethinylestradiol a ethinylestradiol) Tablety
Tento přípravek (stejně jako všechny perorální antikoncepce) je určen k prevenci těhotenství. Nechrání před infekcí HIV (AIDS) a jinými pohlavně přenosnými chorobami.
UPOZORNĚNÍ: Toto označení je čas od času revidováno, jakmile budou k dispozici nové důležité lékařské informace. Proto si toto označení pečlivě prostudujte.
POPIS
Následující perorální antikoncepční přípravek obsahuje kombinaci progestinu a estrogenu, dvou druhů ženských hormonů:
Jedna bílá tableta obsahuje 0,15 mg desogestrelu a 0,02 mg ethinylestradiolu. Každá světle zelená tableta obsahuje inertní složky a každá žlutá tableta obsahuje 0,01 mg ethinylestradiolu.
ÚVOD
Každá žena, která uvažuje o užívání perorální antikoncepce (antikoncepční pilulky nebo pilulky), by měla rozumět výhodám a rizikům používání této formy antikoncepce. Tato příbalová informace vám poskytne mnoho informací, které budete k tomuto rozhodnutí potřebovat, a také vám pomůže určit, zda u vás existuje riziko vzniku některého ze závažných nežádoucích účinků pilulky. Řekne vám, jak správně užívat pilulku, aby byla co nejúčinnější. Tato příbalová informace však nenahrazuje pečlivou diskusi mezi vámi a vaším lékařem nebo poskytovatelem zdravotní péče. Měli byste s ním probrat informace uvedené v této příbalové informaci, a to jak při prvním zahájení užívání pilulky, tak během vašich opakovaných návštěv. Během užívání pilulky byste se také měli řídit radami svého lékaře nebo poskytovatele zdravotní péče ohledně pravidelných kontrol.
ÚČINNOST PERORÁLNÍ ANTIKONCEPCE
Perorální antikoncepce nebo „antikoncepční pilulky“ nebo „pilulky“ se používají k prevenci těhotenství a jsou účinnější než jiné nechirurgické metody kontroly porodnosti. Při správném užívání je šance na otěhotnění menší než 1 % (1 těhotenství na 100 žen za rok užívání), pokud se užívají perfektně, aniž by chyběly nějaké pilulky. Typická poruchovost je ve skutečnosti 5 % ročně. Šance na otěhotnění se zvyšuje s každou vynechanou pilulkou během menstruačního cyklu.
Pro srovnání, typická míra selhání u jiných metod antikoncepce během prvního roku používání je následující:
KDO BY NEMĚL UŽÍVAT PERORÁLNÍ ANTIKONCEPCI
Kouření cigaret zvyšuje riziko závažných kardiovaskulárních vedlejších účinků při užívání perorální antikoncepce. Toto riziko se zvyšuje s věkem a při silném kouření (15 a více cigaret denně) a je poměrně výrazné u žen starších 35 let. Ženám, které užívají perorální antikoncepci, se důrazně nedoporučuje kouřit.
Některé ženy by neměly užívat pilulku. Například byste neměli užívat pilulku, pokud jste těhotná nebo si myslíte, že byste mohla být těhotná. Také byste neměli užívat pilulku, pokud máte některý z následujících stavů:
- Srdeční infarkt nebo mrtvice v anamnéze
- Krevní sraženiny v nohách (tromboflebitida), plicích (plicní embolie) nebo očích
- Historie krevních sraženin v hlubokých žilách vašich nohou
- Bolest na hrudi (angina pectoris)
- Známá nebo suspektní rakovina prsu nebo rakovina sliznice dělohy, děložního čípku nebo pochvy
- Nevysvětlitelné vaginální krvácení (dokud lékař nestanoví diagnózu)
- Zežloutnutí očního bělma nebo kůže (žloutenka) během těhotenství nebo během předchozího užívání pilulky
- Nádor jater (benigní nebo rakovinný)
- Známé nebo předpokládané těhotenství.
Informujte svého lékaře nebo poskytovatele zdravotní péče, pokud jste někdy měli některý z těchto stavů. Váš lékař nebo poskytovatel zdravotní péče vám může doporučit jinou metodu antikoncepce.
DALŠÍ ÚVAHY PŘED UŽÍVÁNÍM PERORÁLNÍ ANTIKONCEPCE
Informujte svého lékaře nebo poskytovatele zdravotní péče, pokud máte:
- Prsní uzliny, fibrocystické onemocnění prsu, abnormální rentgen prsu nebo mamograf
- Diabetes
- Zvýšený cholesterol nebo triglyceridy
- Vysoký krevní tlak
- Migréna nebo jiné bolesti hlavy nebo epilepsie
- Duševní deprese
- Onemocnění žlučníku, srdce nebo ledvin
- Anamnéza slabé nebo nepravidelné menstruace.
Ženy s kterýmkoli z těchto stavů by měly být často kontrolovány svým lékařem nebo poskytovatelem zdravotní péče, pokud se rozhodnou užívat perorální antikoncepci.
Nezapomeňte také informovat svého lékaře nebo poskytovatele zdravotní péče, pokud kouříte nebo užíváte nějaké léky.
RIZIKO UŽÍVÁNÍ ORÁLNÍ ANTIKONCEPCE
1. Riziko vzniku krevních sraženin
Krevní sraženiny a ucpání krevních cév jsou jedním z nejzávažnějších vedlejších účinků užívání perorální antikoncepce a mohou způsobit smrt nebo vážné postižení. Zejména sraženina v noze může způsobit tromboflebitidu a sraženina, která se dostane do plic, může způsobit náhlé ucpání cévy přivádějící krev do plic. Rizika těchto nežádoucích účinků mohou být větší u perorálních kontraceptiv obsahujících desogestrel, jako je Mircette®, než u některých jiných pilulek s nízkou dávkou. Vzácně se sraženiny vyskytují v krevních cévách oka a mohou způsobit slepotu, dvojité vidění nebo zhoršené vidění.
Pokud užíváte perorální antikoncepci a potřebujete plánovaný chirurgický zákrok, potřebujete zůstat na lůžku kvůli dlouhodobé nemoci nebo jste nedávno porodili dítě, můžete být vystaveni riziku vzniku krevních sraženin. Měli byste se poradit se svým lékařem nebo poskytovatelem zdravotní péče o vysazení perorální antikoncepce tři až čtyři týdny před operací a neužívat perorální antikoncepci dva týdny po operaci nebo během odpočinku na lůžku. Také byste neměla užívat perorální antikoncepci krátce po porodu. Je vhodné počkat alespoň čtyři týdny po porodu, pokud nekojíte, nebo čtyři týdny po potratu ve druhém trimestru. Pokud kojíte, měla byste před užitím pilulky počkat, dokud dítě neodstavíte (viz Kojení v OBECNÁ OPATŘENÍ ).
Riziko onemocnění krevního oběhu u uživatelek perorální antikoncepce může být vyšší u uživatelek pilulek s vysokou dávkou a může být vyšší s delší dobou užívání perorální antikoncepce. Některá z těchto zvýšených rizik mohou navíc přetrvávat řadu let po vysazení perorální antikoncepce. Riziko žilního tromboembolického onemocnění spojeného s perorálními kontraceptivy se nezvyšuje s délkou užívání a mizí po ukončení užívání pilulek. Riziko abnormální srážlivosti krve se zvyšuje s věkem jak u uživatelek, tak u neužívatelek perorální antikoncepce, ale zdá se, že zvýšené riziko z perorální antikoncepce je přítomno v každém věku. U žen ve věku 20 až 44 let se odhaduje, že asi 1 z 2 000 užívajících perorální antikoncepci bude každý rok hospitalizována kvůli abnormální srážlivosti. Mezi neuživateli ve stejné věkové skupině by byl každý rok hospitalizován asi 1 z 20 000. U žen užívajících perorální antikoncepci obecně se odhaduje, že u žen ve věku od 15 do 34 let je riziko úmrtí v důsledku poruchy krevního oběhu přibližně 1 z 12 000 za rok, zatímco u žen, které neužívají, je toto riziko přibližně 1 z 50 000 za rok. Ve věkové skupině 35 až 44 let se riziko odhaduje na asi 1 ku 2 500 ročně u uživatelek perorální antikoncepce a asi 1 ku 10 000 za rok u neuživatelů.
2. Srdeční infarkty a mrtvice
Perorální antikoncepce může zvýšit sklon k rozvoji mozkové mrtvice (zástava nebo prasknutí krevních cév v mozku) a anginy pectoris a srdečních záchvatů (ucpání krevních cév v srdci). Kterýkoli z těchto stavů může způsobit smrt nebo vážné postižení.
Kouření výrazně zvyšuje možnost srdečních infarktů a mrtvice. Kromě toho kouření a užívání perorální antikoncepce výrazně zvyšují šance na rozvoj a úmrtí na srdeční onemocnění.
3. Onemocnění žlučníku
Uživatelky perorální antikoncepce mají pravděpodobně vyšší riziko onemocnění žlučníku než neuživatelky, i když toto riziko může souviset s pilulkami obsahujícími vysoké dávky estrogenů.
4. Nádory jater
Ve vzácných případech může perorální antikoncepce způsobit benigní, ale nebezpečné jaterní nádory. Tyto benigní nádory jater mohou prasknout a způsobit smrtelné vnitřní krvácení. Kromě toho byla ve dvou studiích nalezena možná, ale ne definitivní souvislost s pilulkou a rakovinou jater, ve kterých bylo zjištěno, že několik žen, u kterých se vyvinuly tyto velmi vzácné druhy rakoviny, užívaly perorální antikoncepci po dlouhou dobu. Rakoviny jater jsou však extrémně vzácné. Šance vzniku rakoviny jater z užívání pilulky je tak ještě vzácnější.
5. Rakovina reprodukčních orgánů a prsů
Mezi studiemi ohledně rakoviny prsu a užívání perorální antikoncepce existuje konflikt. Některé studie uvádějí zvýšené riziko vzniku rakoviny prsu, zejména v mladším věku. Zdá se, že toto zvýšené riziko souvisí s délkou užívání. Většina studií nezjistila žádné celkové zvýšení rizika vzniku rakoviny prsu.
Některé studie zjistily zvýšený výskyt rakoviny děložního čípku u žen, které užívají perorální antikoncepci. Toto zjištění však může souviset s jinými faktory, než je užívání perorální antikoncepce. Neexistují dostatečné důkazy, které by vyloučily možnost, že pilulky mohou způsobit takové rakoviny.
ODHADOVANÉ RIZIKO ÚMRTÍ ZPŮSOBENÉ METODOU KONTROLY NEBO TĚHOTENSTVÍ
Všechny metody antikoncepce a těhotenství jsou spojeny s rizikem rozvoje určitých onemocnění, které mohou vést k invaliditě nebo smrti. Byl vypočten odhad počtu úmrtí souvisejících s různými metodami antikoncepce a těhotenstvím a je uveden v následující tabulce.
ROČNÍ POČET ÚMRTÍ SPOJENÝCH S PORODEM NEBO METODOU SPOJENÝCH S KONTROLOU PLODNOSTI NA 100 000 NESTERILNÍCH ŽEN, METODOU KONTROLY PLODNOSTI PODLE VĚKU
Ve výše uvedené tabulce je riziko úmrtí na jakoukoli metodu antikoncepce nižší než riziko porodu, s výjimkou uživatelek perorální antikoncepce starších 35 let, které kouří a uživatelek pilulek starších 40 let, i když nekouří. V tabulce je vidět, že u žen ve věku 15 až 39 let bylo riziko úmrtí nejvyšší s těhotenstvím (7 až 26 úmrtí na 100 000 žen v závislosti na věku). Mezi uživatelkami pilulek, které nekouří, je riziko úmrtí vždy nižší než riziko spojené s těhotenstvím pro jakoukoli věkovou skupinu, ačkoli ve věku nad 40 let se riziko zvyšuje na 32 úmrtí na 100 000 žen, ve srovnání s 28 úmrtími spojenými s těhotenstvím v té době. stáří. U uživatelek pilulek, které kouří a jsou starší 35 let, však odhadovaný počet úmrtí převyšuje počet úmrtí u jiných metod antikoncepce. Pokud je žena starší 40 let a kouří, její odhadované riziko úmrtí je čtyřikrát vyšší (117/100 000 žen) než odhadované riziko spojené s těhotenstvím (28/100 000 žen) v této věkové skupině.
Návrh, aby ženy nad 40 let, které nekouří, neužívaly perorální antikoncepci, je založen na informacích ze starších pilulek s vysokými dávkami a na méně selektivním užívání pilulek, než je dnes praktikováno. Poradní výbor FDA diskutoval o tomto problému v roce 1989 a doporučil, aby přínosy užívání perorální antikoncepce zdravými nekuřáky staršími 40 let převážily možná rizika. Všechny ženy, zejména starší ženy, jsou však varovány, aby užívaly pilulku s nejnižší dávkou, která je účinná.
VAROVNÉ SIGNÁLY
Pokud se některý z těchto nežádoucích účinků vyskytne během užívání perorální antikoncepce, okamžitě kontaktujte svého lékaře nebo poskytovatele zdravotní péče:
- Ostrá bolest na hrudi, kašel krve nebo náhlá dušnost (indikující možnou sraženinu v plicích)
- Bolest v lýtku (indikující možnou sraženinu v noze)
- Drtivá bolest na hrudi nebo tíha na hrudi (indikující možný srdeční infarkt)
- Náhlá silná bolest hlavy nebo zvracení, závratě nebo mdloby, poruchy vidění nebo řeči, slabost nebo necitlivost v paži nebo noze (indikující možnou mrtvici)
- Náhlá částečná nebo úplná ztráta zraku (indikující možnou sraženinu v oku)
- Bulky v prsou (indikující možnou rakovinu prsu nebo fibrocystické onemocnění prsu; požádejte svého lékaře nebo poskytovatele zdravotní péče, aby vám ukázal, jak si prsa vyšetřit)
- Silná bolest nebo citlivost v oblasti žaludku (indikující možný prasklý nádor jater)
- Potíže se spánkem, slabost, nedostatek energie, únava nebo změna nálady (možná svědčící o těžké depresi)
- Žloutenka nebo zežloutnutí kůže nebo očních bulv, často doprovázené horečkou, únavou, ztrátou chuti k jídlu, tmavě zbarvenou močí nebo světlými pohyby střev (indikující možné problémy s játry).
NEŽÁDOUCÍ ÚČINKY PERORÁLNÍ ANTIKONCEPCE
1. Vaginální krvácení
Během užívání pilulek se může objevit nepravidelné vaginální krvácení nebo špinění. Nepravidelné krvácení se může lišit od mírného špinění mezi menstruačními obdobími až po krvácení z průniku, které je velmi podobné pravidelné menstruaci. Nepravidelné krvácení se objevuje nejčastěji během prvních několika měsíců užívání perorální antikoncepce, ale může se objevit i poté, co jste pilulku nějakou dobu užívala. Takové krvácení může být dočasné a obvykle neznamená žádné vážné problémy. Je důležité pokračovat v užívání pilulek podle plánu. Pokud se krvácení objeví ve více než jednom cyklu nebo trvá déle než několik dní, poraďte se se svým lékařem nebo poskytovatelem zdravotní péče.
2. Kontaktní čočky
Pokud nosíte kontaktní čočky a zaznamenáte změnu vidění nebo neschopnost čočky nosit, kontaktujte svého lékaře nebo poskytovatele zdravotní péče.
3. Zadržování tekutin
Perorální antikoncepce může způsobit edém (retenci tekutin) s otoky prstů nebo kotníků a může zvýšit váš krevní tlak. Pokud zaznamenáte zadržování tekutin, kontaktujte svého lékaře nebo poskytovatele zdravotní péče.
4. Melasma
Je možné skvrnité ztmavnutí kůže, zejména obličeje.
5. Jiné nežádoucí účinky
Další nežádoucí účinky mohou zahrnovat nevolnost a zvracení, změnu chuti k jídlu, bolest hlavy, nervozitu, deprese, závratě, ztrátu vlasů na hlavě, vyrážku a vaginální infekce.
Pokud vás některý z těchto nežádoucích účinků obtěžuje, zavolejte svého lékaře nebo poskytovatele zdravotní péče.
OBECNÁ OPATŘENÍ
1. Vynechání menstruace a užívání perorální antikoncepce před nebo během časného těhotenství
Mohou nastat situace, kdy nemusíte pravidelně menstruovat poté, co jste dokončili cyklus pilulek. Pokud jste pilulky užívala pravidelně a vynechala jste jednu menstruaci, pokračujte v užívání pilulek pro další cyklus, ale ujistěte se, že o tom informujte svého lékaře nebo poskytovatele zdravotní péče, než tak učiníte. Pokud jste neužívala pilulky denně podle pokynů a vynechala jste menstruaci, nebo jste vynechala dvě po sobě jdoucí menstruace, můžete být těhotná. Okamžitě se poraďte se svým lékařem nebo poskytovatelem zdravotní péče, abyste zjistili, zda jste těhotná. Nepokračujte v užívání perorální antikoncepce, dokud si nebudete jistá, že nejste těhotná, ale pokračujte v používání jiné metody antikoncepce.
Neexistují žádné nezvratné důkazy o tom, že užívání perorální antikoncepce je spojeno s nárůstem vrozených vad, je-li neúmyslně užíváno během časného těhotenství. Dříve několik studií uvádělo, že perorální antikoncepce může být spojena s vrozenými vadami, ale tyto studie nebyly potvrzeny. Nicméně perorální antikoncepce nebo jakékoli jiné léky by se během těhotenství neměly používat, pokud to není nezbytně nutné a předepsané vaším lékařem nebo poskytovatelem zdravotní péče. Měli byste se poradit se svým lékařem nebo poskytovatelem zdravotní péče o rizicích pro vaše nenarozené dítě jakýchkoli léků užívaných během těhotenství.
2. Během kojení
Pokud kojíte, poraďte se se svým lékařem nebo poskytovatelem zdravotní péče, než začnete užívat perorální antikoncepci. Část drogy bude předána dítěti v mléce. Bylo hlášeno několik nežádoucích účinků na dítě, včetně zežloutnutí kůže (žloutenky) a zvětšení prsou. Kromě toho může perorální antikoncepce snížit množství a kvalitu vašeho mléka. Pokud je to možné, nepoužívejte perorální antikoncepci během kojení. Měla byste používat jinou metodu antikoncepce, protože kojení poskytuje pouze částečnou ochranu před otěhotněním a tato částečná ochrana se výrazně snižuje, pokud kojíte delší dobu.
O zahájení perorální antikoncepce byste měli uvažovat až po úplném odstavení dítěte.
3. Laboratorní testy
Pokud máte naplánované nějaké laboratorní testy, informujte svého lékaře nebo poskytovatele zdravotní péče, že užíváte antikoncepční pilulky. Některé krevní testy mohou být ovlivněny antikoncepčními pilulkami.
4. Lékové interakce
Některé léky mohou interagovat s antikoncepčními pilulkami, aby byly méně účinné při prevenci těhotenství nebo mohly způsobit zvýšení krvácení z průniku. Mezi takové léky patří rifampin, léky používané na epilepsii, jako jsou barbituráty (například fenobarbital), fenytoin (Dilantin® je jedna značka tohoto léku), fenylbutazon (jedna značka je Butazolidin®) a možná určitá antibiotika. Možná budete muset používat další antikoncepci, když užíváte léky, které mohou snížit účinnost perorální antikoncepce.
Antikoncepční pilulky mohou interagovat s lamotriginem, což je antikonvulzivum používané k léčbě epilepsie. To může zvýšit riziko záchvatů, takže váš lékař možná bude muset upravit dávku lamotriginu.
Některé léky mohou snížit účinnost antikoncepční pilulky, včetně:
- Barbituráty
- Bosentan
- karbamazepin
- Felbamate
- Griseofulvin
- oxkarbazepin
- fenytoin
- rifampin
- třezalka tečkovaná
- topiramát
Stejně jako u všech přípravků na předpis byste měli informovat svého poskytovatele zdravotní péče o všech dalších lécích a rostlinných produktech, které užíváte. Možná budete muset používat bariérovou antikoncepci, když užíváte léky nebo produkty, které mohou snížit účinnost antikoncepčních pilulek.
5. Pohlavně přenosné choroby
Tento přípravek (stejně jako všechny perorální antikoncepce) je určen k prevenci těhotenství. Nechrání před přenosem HIV (AIDS) a dalších pohlavně přenosných chorob, jako jsou chlamydie, genitální herpes, genitální bradavice, kapavka, hepatitida B a syfilis.
JAK SE TABULKA UŽÍVÁ
DŮLEŽITÉ BODY, KTERÉ SI ZAPAMATUJTE
NEŽ ZAČNETE UŽÍVAT prášky:
1. PŘEČTĚTE SI TYTO POKYNY:
Než začnete užívat své prášky.
Kdykoli si nejste jisti, co dělat.
2. SPRÁVNÝ ZPŮSOB UŽÍVÁNÍ TABULKY JE UŽÍVAT KAŽDÝ DEN SOUČASNĚ JEDNU PULLETKU.
Pokud vynecháte pilulky, můžete otěhotnět. To zahrnuje pozdní spuštění balíčku.
Čím více pilulek vynecháte, tím je pravděpodobnější, že otěhotníte.
3. MNOHO ŽEN MÁ ŠPIČENÍ NEBO SVĚTLO KRVÁCÍ, NEBO SE MOHLO BĚHEM PRVNÍCH 1 AŽ 3 BALENÍ TABULEK NEVYVOLAT.
Pokud je vám špatně od žaludku, nepřestávejte pilulku užívat. Problém obvykle zmizí. Pokud to nezmizí, poraďte se se svým lékařem nebo poskytovatelem zdravotní péče.
4. CHYBĚJÍCÍ TABULKY MOHOU TAKÉ ZPŮSOBIT ŠKUROVÁNÍ NEBO SVÉ KRVÁCENÍ, i když si tyto vynechané pilulky doplníte.
Ve dnech, kdy si vezmete 2 pilulky, abyste nahradili vynechané pilulky, by vám také mohlo být trochu špatně od žaludku.
5. POKUD MÁTE ZVRACENÍ NEBO PRŮJMU, z jakéhokoli důvodu, nebo POKUD UŽÍVÁTE NĚJAKÉ LÉKY, včetně některých antibiotik, vaše pilulky nemusí tak dobře fungovat.
Používejte záložní metodu (jako jsou kondomy, pěna nebo houba), dokud se neporadíte se svým lékařem nebo poskytovatelem zdravotní péče.
6. POKUD MÁTE PROBLÉMY VZPAMATOVAT SI TABULKU, poraďte se se svým lékařem nebo poskytovatelem zdravotní péče o tom, jak si usnadnit užívání pilulek nebo o použití jiné metody antikoncepce.
7. POKUD MÁTE JAKÉKOLI DOTAZY NEBO NEJSTE SI JISTI INFORMACÍ V TOMTO LETÁKU, zavolejte svého lékaře nebo poskytovatele zdravotní péče.
NEŽ ZAČNETE UŽÍVAT PRÁŠKY
8. ROZHODNĚTE SE, V KTEROU DENNÍ ČASU SI CHCETE UŽÍT PILULKU.
Je důležité užívat ho každý den přibližně ve stejnou dobu.
8. PODÍVEJTE SE NA VAŠE BALENÍ TABULEK: BUDE OBSAHOVAT 28 PALUBEK:
Toto balení 28 pilulek obsahuje 26 „aktivních“ [bílých a žlutých] pilulek (s hormony) a 2 „neaktivní“ [světle zelené] pilulky (bez hormonů).
10. NAJDETE TAKÉ:
1) kde na balení začít užívat pilulky,
2) v jakém pořadí užívat pilulky (postupujte podle šipek) a
3) čísla týdnů, jak je znázorněno na obrázku níže.
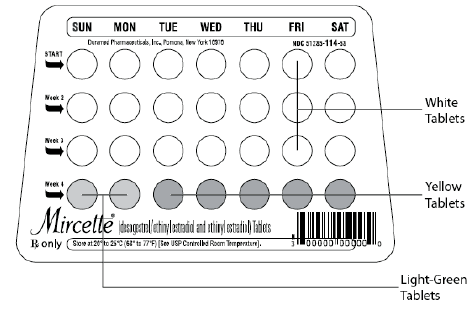
11. UJISTĚTE SE, ŽE MÁTE VŽDY PŘIPRAVENO:
JINÝ DRUH KONTROLACE PORODNOSTI (jako jsou kondomy, pěna nebo houba), který můžete použít jako zálohu v případě, že vám chybí pilulky.
NAVÍC, PLNÉ BALENÍ TABULEK.
KDY ZAČÍT S PRVNÍM BALENÍM TABULEK
Máte na výběr, kterým dnem začnete užívat své první balení pilulek. Rozhodněte se se svým lékařem nebo poskytovatelem zdravotní péče, který den je pro vás nejlepší. Vyberte si denní dobu, kterou si budete snadno pamatovat.
DEN 1 ZAČÁTEK
12. Vyberte si denní štítek, který začíná prvním dnem menstruace (to je den, kdy začnete krvácet nebo špinit, i když je skoro půlnoc, kdy krvácení začíná).
13. Umístěte tento denní štítek do dávkovače cyklických tablet přes oblast, na které jsou vytištěny dny v týdnu (počínaje nedělí).
Poznámka: Pokud je prvním dnem vaší menstruace neděle, můžete kroky #1 a #2 přeskočit.
14. Užijte první „aktivní“ [bílou] pilulku z prvního balení během prvních 24 hodin menstruace.
15. Nebudete muset používat záložní metodu antikoncepce, protože začnete užívat pilulku na začátku menstruace.
ZAČÁTEK NEDĚLE
16. Užijte první „aktivní“ [bílou] pilulku z prvního balení v neděli po začátku menstruace, i když stále krvácíte. Pokud vaše menstruace začíná v neděli, začněte s balením ještě tentýž den.
17. Použijte jinou metodu antikoncepce jako záložní metodu, pokud máte sex kdykoli od neděle, kdy začnete své první balení, do příští neděle (7 dní). Kondomy, pěna nebo houba jsou dobrými záložními metodami antikoncepce.
CO DĚLAT BĚHEM MĚSÍCE
18. UŽÍVEJTE KAŽDÝ DEN SOUČASNĚ JEDNU PALULKU, DOKUD NEBUDE BALENÍ PRÁZDNÉ.
Nevynechávejte pilulky, i když mezi jednotlivými menstruacemi špiníte nebo krvácíte nebo je vám špatně od žaludku (nevolnost).
Nevynechávejte pilulky, i když nemáte příliš často sex.
19. KDYŽ DOKONČÍTE BALENÍ NEBO VYMĚNÍTE ZNAČKU prášků:
21 pilulek : Počkejte 7 dní, než začnete s dalším balením. Během tohoto týdne pravděpodobně dostanete menstruaci. Ujistěte se, že mezi 21denními baleními neuplyne více než 7 dní.
28 pilulek : Další balení začněte den po poslední pilulce. Mezi baleními nečekejte žádné dny.
CO DĚLAT, KDYŽ VÁM POUZE PÁLE
Pokud vynecháte 1 „aktivní“ [bílou] pilulku:
20. Vezměte si to, jakmile si vzpomenete. Další pilulku si vezměte v obvyklou dobu. To znamená, že si vezmete 2 pilulky za 1 den.
21. Pokud máte sex, nemusíte používat záložní metodu antikoncepce. Pokud vynecháte 2 „aktivní“ [bílé] pilulky za sebou v 1. NEBO 2. TÝDNU vašeho balení:
22. Užijte 2 pilulky v den, na který si vzpomenete, a 2 pilulky další den.
23. Poté užívejte 1 pilulku denně, dokud nedokončíte balení.
24. MŮŽETE Otěhotnět, pokud budete mít sex do 7 dnů po vynechání pilulek. MUSÍTE použít jinou metodu antikoncepce (jako jsou kondomy, pěna nebo houba) jako záložní metodu po dobu těchto 7 dnů.
Pokud vynecháte 2 „aktivní“ [bílé] pilulky za sebou ve 3. TÝDNU:
25. Pokud jste začátečník dne 1:
Vyhoďte zbytek balení pilulek a tentýž den začněte užívat nové balení.
Pokud jste nedělní začátečník:
Pokračujte v užívání 1 pilulky každý den až do neděle.
V neděli VYHOĎTE zbytek balení a tentýž den začněte s novým balením pilulek.
26. Možná nebudete mít tento měsíc menstruaci, ale to se očekává. Pokud však vynecháte menstruaci 2 měsíce po sobě, zavolejte svého lékaře nebo poskytovatele zdravotní péče, protože můžete být těhotná.
27. MŮŽETE Otěhotnět, pokud budete mít sex do 7 dnů po vynechání pilulek. MUSÍTE použít jinou metodu antikoncepce (jako jsou kondomy, pěna nebo houba) jako záložní metodu po dobu těchto 7 dnů.
jestli ty SLEČNA 3 NEBO VÍCE „aktivní“ [bílé] pilulky v řadě (během prvních 3 týdnů):
28. Pokud jste začátečník dne 1:
Vyhoďte zbytek balení pilulek a tentýž den začněte užívat nové balení.
Pokud jste nedělní začátečník:
Pokračujte v užívání 1 pilulky každý den až do neděle.
V neděli VYHOĎTE zbytek balení a tentýž den začněte s novým balením pilulek.
29. Možná nebudete mít tento měsíc menstruaci, ale to se očekává. Pokud však vynecháte menstruaci 2 měsíce po sobě, zavolejte svého lékaře nebo poskytovatele zdravotní péče, protože můžete být těhotná.
30. MŮŽETE Otěhotnět, pokud budete mít sex do 7 dnů po vynechání pilulek. MUSÍTE použít jinou metodu antikoncepce (jako jsou kondomy, pěna nebo houba) jako záložní metodu po dobu těchto 7 dnů.
PŘIPOMÍNKA PRO TY, KTEŘÍ UŽÍVAJÍ 28DENNÍ BALÍČKY
Pokud zapomenete některou ze 2 [světle zelených] nebo 5 [žlutých] pilulek ve 4. týdnu:
ZAHOĎTE prášky, které jste vynechali.
Pokračujte v užívání 1 pilulky každý den, dokud se balení nevyprázdní.
Nepotřebujete záložní metodu.
KONEČNĚ, POKUD SI STÁLE NEJSTE JISTÍ, CO DĚLAT S PRÁŠKAMI, KTERÉ JSTE ZMEŠKALI
Kdykoli máte sex, použijte ZÁLOŽNÍ METODU.
UŽÍVEJTE KAŽDÝ DEN JEDNU „AKTIVNÍ“ [BÍLOU] PALUBKU, dokud se nedostanete ke svému lékaři nebo poskytovateli zdravotní péče.
TĚHOTENSTVÍ V DŮSLEDKU SELHÁNÍ prášků
Výskyt selhání pilulek vedoucího k těhotenství je přibližně jedno procento (tj. jedno těhotenství na 100 žen za rok), pokud se užívá každý den podle pokynů, ale typičtější míra selhání je asi 5 %. Pokud dojde k selhání, je riziko pro plod minimální.
TĚHOTENSTVÍ PO VYsazení PILULKY
Po ukončení užívání perorální antikoncepce může dojít k určitému zpoždění v otěhotnění, zvláště pokud jste měla nepravidelné menstruační cykly předtím, než jste užívala perorální antikoncepci. Po vysazení pilulky a přání těhotenství může být vhodné odložit početí, dokud nezačnete pravidelně menstruovat.
Nezdá se, že by došlo k žádnému nárůstu vrozených vad u novorozenců, pokud těhotenství nastane brzy po vysazení pilulky.
PŘEDÁVKOVÁNÍ
Po požití velkých dávek perorální antikoncepce malými dětmi nebyly hlášeny závažné nežádoucí účinky. Předávkování může u žen způsobit nevolnost a krvácení z vysazení. V případě předávkování kontaktujte svého lékaře, zdravotníka nebo lékárníka.
JINÁ INFORMACE
Váš lékař nebo poskytovatel zdravotní péče odebere lékařskou a rodinnou anamnézu před předepsáním perorální antikoncepce a vyšetří vás. Fyzikální vyšetření může být odloženo na jiný čas, pokud o to požádáte a váš lékař nebo poskytovatel zdravotní péče se domnívá, že je dobré ji odložit. Měli byste být znovu vyšetřeni alespoň jednou ročně. Nezapomeňte informovat svého lékaře nebo poskytovatele zdravotní péče, pokud se v rodinné anamnéze vyskytl některý ze stavů uvedených dříve v této příbalové informaci. Ujistěte se, že dodržujete všechny schůzky se svým lékařem nebo poskytovatelem zdravotní péče, protože je čas zjistit, zda existují časné příznaky vedlejších účinků užívání perorální antikoncepce.
Nepoužívejte lék na jiný stav, než na který byl předepsán. Tento lék byl předepsán speciálně vám; nedávejte to ostatním, kteří mohou chtít antikoncepční pilulky.
ZDRAVOTNÍ PŘÍNOSY PERORÁLNÍ ANTIKONCEPCE
Kromě prevence těhotenství může užívání kombinované perorální antikoncepce poskytnout určité výhody. Oni jsou:
- menstruační cykly se mohou stát pravidelnějšími.
- průtok krve během menstruace může být lehčí a může se ztratit méně železa. Proto je méně pravděpodobný výskyt anémie z nedostatku železa.
- bolest nebo jiné příznaky během menstruace se mohou setkat méně často.
- ektopické (tubární) těhotenství se může vyskytovat méně často.
- méně často se mohou vyskytovat nerakovinné cysty nebo bulky v prsu.
- akutní zánětlivé onemocnění pánve se může vyskytovat méně často.
- užívání perorální antikoncepce může poskytnout určitou ochranu proti rozvoji dvou forem rakoviny: rakoviny vaječníků a rakoviny děložní sliznice.
Pokud chcete více informací o antikoncepčních pilulkách, zeptejte se svého lékaře, poskytovatele zdravotní péče nebo lékárníka. Mají techničtější leták nazvaný Informace o předepisování, který si možná budete chtít přečíst.
