Brand Temovate 15g Clobetasol Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Temovate a jak se používá?
Temovate je lék na předpis používaný k léčbě příznaků psoriázy plaku a pokožky hlavy a dermatóz reagujících na kortikosteroidy. Temovate lze užívat samostatně nebo s jinými léky.
Temovate patří do třídy léků nazývaných Kortikosteroidy, Topické.
Není známo, zda je Temovate bezpečný a účinný u dětí mladších 12 let.
Jaké jsou možné vedlejší účinky přípravku Temovate?
Temovate může způsobit závažné nežádoucí účinky, včetně:
- zhoršení stavu vaší pokožky,
- zarudnutí, teplo, otok, mokvání nebo silné podráždění jakékoli ošetřené kůže,
- rozmazané vidění,
- tunelové vidění,
- bolest očí,
- vidět halo kolem světel,
- zvýšená žízeň,
- suchá ústa,
- ovocný zápach dechu,
- přírůstek hmotnosti v obličeji a na ramenou,
- pomalé hojení ran,
- změna barvy kůže,
- ztenčení kůže,
- zvýšené ochlupení na těle,
- únava,
- změny nálady,
- menstruační změny a
- sexuální změny
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Temovate patří:
- pálení, svědění, otok nebo podráždění ošetřené kůže,
- suchá nebo popraskaná kůže,
- zarudnutí nebo krusta kolem vašich vlasových folikulů,
- pavoučí žíly,
- strie,
- ztenčení kůže,
- vyrážka nebo kopřivka,
- akné a
- dočasné vypadávání vlasů
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku Temovate. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
TEMOVATE® (krém a mast klobetasol propionát) Krém a mast, 0,05% obsahují aktivní sloučeninu klobetasol propionát, syntetický kortikosteroid, pro topické dermatologické použití. Clobetasol, analog prednisolonu, má vysoký stupeň glukokortikoidní aktivity a mírný stupeň mineralokortikoidní aktivity.
Chemicky je klobetasol propionát (11ß,16ß)-21-chlor-9-fluor-11-hydroxy-16-methyl-17-(1-oxopropoxy)-pregna-1,4-dien-3,20-dion a má následující strukturní vzorec:
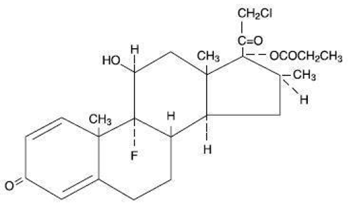
Clobetasol propionát má molekulový vzorec C25H32CIFO5 a molekulovou hmotnost 467. Je to bílý až krémově zbarvený krystalický prášek nerozpustný ve vodě.
TEMOVATE® Cream obsahuje klobetasol propionát 0,5 mg/g v krémovém základu z propylenglykolu, glycerylmonostearátu, cetostearylalkoholu, glycerylstearátu, PEG 100 stearátu, bílého vosku, chlorkresolu, citrátu sodného, monohydrátu kyseliny citronové a čištěné vody.
TEMOVATE® mast obsahuje klobetasol propionát 0,5 mg/g na bázi propylenglykolu, sorbitan seskvioleátu a bílé vazelíny.
INDIKACE
Krém a mast TEMOVATE® jsou vysoce účinné kortikosteroidní přípravky určené pro úlevu od zánětlivých a pruritických projevů dermatóz reagujících na kortikosteroidy. Léčba delší než 2 po sobě jdoucí týdny se nedoporučuje a celková dávka by neměla překročit 50 g/týden kvůli potenciálu léku potlačit osu hypotalamus-hypofýza-nadledviny (HPA). Použití u pediatrických pacientů do 12 let se nedoporučuje.
Stejně jako u jiných vysoce účinných kortikosteroidů by měla být léčba přerušena, jakmile bylo dosaženo kontroly. Pokud nedojde k žádnému zlepšení do 2 týdnů, může být nutné přehodnocení diagnózy.
DÁVKOVÁNÍ A PODÁVÁNÍ
Naneste tenkou vrstvu krému nebo masti TEMOVATE® na postižené oblasti pokožky dvakrát denně a jemně a úplně rozetřete (viz. INDIKACE A POUŽITÍ ).
Krém a mast TEMOVATE® jsou topické kortikosteroidy s velmi vysokou účinností; proto, léčba by měla být omezena na 2 po sobě jdoucí týdny a neměla by se používat množství vyšší než 50 g/týden.
Stejně jako u jiných vysoce účinných kortikosteroidů by měla být léčba přerušena, jakmile bylo dosaženo kontroly. Pokud nedojde k žádnému zlepšení do 2 týdnů, může být nutné přehodnocení diagnózy.
Krém a mast TEMOVATE® by se neměly používat s okluzivními obvazy.
Geriatrické použití
Ve studiích, kde byli geriatričtí pacienti (ve věku 65 let nebo starší, viz OPATŘENÍ byli léčeni krémem nebo mastí TEMOVATE®, bezpečnost se nelišila od bezpečnosti u mladších pacientů; proto se nedoporučuje žádná úprava dávkování.
JAK DODÁVÁNO
TEMOVATE® (klobetasol propionátový krém) krém, 0,05% je dodáván v:
30g tuby ( NDC 10337-163-30) a 60g zkumavky ( NDC 10337-163-60).
TEMOVATE® (clobetasol propionátová mast) Masť, 0,05% se dodává v:
15g zkumavky ( NDC 10337-162-15) a 30g zkumavky ( NDC 10337-162-30).
Uchovávejte při teplotě mezi 15° a 30°C (59° a 86°F). TEMOVATE® Cream by neměl být chlazený. PharmaDerm
Divize Fougera Pharmaceuticals Inc., Melville, NY 11747 USA. Revize: leden 2012
VEDLEJŠÍ EFEKTY
V kontrolovaných klinických studiích byly nejčastějšími nežádoucími účinky hlášenými u krému TEMOVATE® pocit pálení a píchání u 1 % léčených pacientů. Méně časté nežádoucí reakce byly svědění, atrofie kůže a praskání a praskání kůže.
kontrolovaných klinických studiích byly nejčastějšími nežádoucími účinky hlášenými u masti TEMOVATE® pocit pálení, podráždění a svědění u 0,5 % léčených pacientů. Méně časté nežádoucí reakce byly píchání, praskání, erytém, folikulitida, necitlivost prstů, atrofie kůže a telangiektázie.
Cushingův syndrom byl hlášen u kojenců a dospělých jako důsledek dlouhodobého užívání lokálních formulací klobetasol propionátu.
Následující další lokální nežádoucí účinky byly hlášeny u topických kortikosteroidů a mohou se vyskytovat častěji při použití okluzivních obvazů a kortikosteroidů s vyšší účinností. Tyto reakce jsou uvedeny v přibližně sestupném pořadí výskytu: suchost, akneiformní erupce, hypopigmentace, periorální dermatitida, alergická kontaktní dermatitida, sekundární infekce, podráždění, strie a miliaria.

DROGOVÉ INTERAKCE
Nebyly poskytnuty žádné informace.
VAROVÁNÍ
Nebyly poskytnuty žádné informace. Prosím podívej se BEZPEČNOSTNÍ OPATŘENÍ sekce níže.
OPATŘENÍ
Všeobecné
Krém a mast TEMOVATE® by se neměly používat při léčbě růžovky nebo periorální dermatitidy a neměly by se používat na obličej, třísla nebo podpaží.
Systémová absorpce topických kortikosteroidů může způsobit reverzibilní supresi osy HPA s potenciálem glukokortikosteroidní insuficience po vysazení léčby. Projevy Cushingova syndromu, hyperglykémie a glukosurie mohou být u některých pacientů vyvolány také systémovou absorpcí topických kortikosteroidů během léčby.
Pacienti, kteří aplikují topický steroid na velkou plochu povrchu nebo na oblasti pod okluzí, by měli být pravidelně vyšetřováni na známky suprese osy HPA. To lze provést pomocí ACTH stimulace, AM plazmatického kortizolu a testu volného kortizolu v moči. Pacienti užívající superúčinné kortikosteroidy by neměli být léčeni déle než 2 týdny v kuse a vždy by měly být léčeny pouze malé oblasti kvůli zvýšenému riziku suprese HPA.
Krém a mast TEMOVATE® způsobily supresi osy HPA při použití v dávkách pouhých 2 g/den po dobu 1 týdne u pacientů s ekzémem.
Pokud je zaznamenána suprese osy HPA, je třeba se pokusit lék vysadit, snížit frekvenci aplikace nebo nahradit méně účinným kortikosteroidem. Obnovení funkce osy HPA je obecně rychlé po vysazení topických kortikosteroidů. Vzácně se mohou objevit známky a příznaky insuficience glukokortikosteroidů, které vyžadují doplňkové systémové kortikosteroidy. Informace o systémové suplementaci naleznete v informacích o předepisování těchto produktů.
Pediatričtí pacienti mohou být náchylnější k systémové toxicitě od ekvivalentních dávek kvůli jejich většímu poměru povrchu kůže k tělesné hmotnosti (viz OPATŘENÍ : Pediatrické použití ).
Pokud dojde k podráždění, krém a mast TEMOVATE® je třeba přerušit a zahájit vhodnou léčbu. Alergická kontaktní dermatitida s kortikosteroidy je obvykle diagnostikována pozorováním selhání hojení spíše než zaznamenáním klinické exacerbace jako u většiny topických přípravků neobsahujících kortikosteroidy. Takové pozorování by mělo být potvrzeno vhodným diagnostickým náplastovým testováním.
Pokud jsou přítomny nebo se rozvinou souběžné kožní infekce, je třeba použít vhodné antifungální nebo antibakteriální činidlo. Pokud se příznivá odpověď nedostaví okamžitě, je třeba použití krému a masti TEMOVATE® přerušit, dokud nebude infekce adekvátně kontrolována.
Laboratorní testy
Následující testy mohou být užitečné při hodnocení pacientů na potlačení osy HPA:
ACTH stimulační test AM plazmatický kortizolový test Test volného kortizolu v moči
Karcinogeneze, mutageneze, zhoršení plodnosti
Nebyly provedeny dlouhodobé studie na zvířatech k hodnocení karcinogenního potenciálu klobetasol propionátu.
Studie na potkanech po subkutánním podání v dávkách až 50 mcg/kg/den odhalily, že samice vykazovaly zvýšení počtu resorbovaných embryí a snížení počtu žijících plodů při nejvyšší dávce.
Clobetasol propionát byl nemutagenní ve 3 různých testovacích systémech: Amesově testu, testu genové konverze Saccharomyces cerevisiae a fluktuačním testu E. coli B WP2.
Těhotenství
Teratogenní účinky
Kategorie těhotenství C. Bylo prokázáno, že kortikosteroidy jsou teratogenní u laboratorních zvířat, pokud jsou podávány systémově v relativně nízkých dávkách. U některých kortikosteroidů bylo prokázáno, že jsou teratogenní po dermální aplikaci laboratorním zvířatům.
Klobetasol propionát nebyl testován na teratogenitu při místní aplikaci; vstřebává se však perkutánně a při subkutánním podání byl významným teratogenem u králíka i myši. Clobetasol propionát má větší teratogenní potenciál než steroidy, které jsou méně účinné.
Studie teratogenity u myší s použitím subkutánní cesty vedly k fetotoxicitě při nejvyšší testované dávce (1 mg/kg) a teratogenitě při všech testovaných hladinách dávek až do 0,03 mg/kg. Tyto dávky jsou přibližně 1,4násobkem a 0,04násobkem místní dávky krému a masti TEMOVATE® pro člověka. Pozorované abnormality zahrnovaly rozštěp patra a skeletální abnormality.
U králíků byl klobetasol propionát teratogenní v dávkách 3 a 10 mcg/kg. Tyto dávky jsou přibližně 0,02násobkem a 0,05násobkem místní dávky krému a masti TEMOVATE® pro člověka. Pozorované abnormality zahrnovaly rozštěp patra, kranioschízu a další kosterní abnormality.
Neexistují žádné adekvátní a dobře kontrolované studie teratogenního potenciálu klobetasol propionátu u těhotných žen. Krém a mast TEMOVATE® by se měly během těhotenství používat pouze tehdy, pokud potenciální přínos ospravedlňuje potenciální riziko pro plod.
Kojící matky
Systémově podávané kortikosteroidy se objevují v lidském mléce a mohou potlačovat růst, interferovat s endogenní produkcí kortikosteroidů nebo způsobit jiné nežádoucí účinky. Není známo, zda by topické podávání kortikosteroidů mohlo vést k dostatečné systémové absorpci k produkci detekovatelných množství v lidském mléce. Vzhledem k tomu, že mnoho léků se vylučuje do lidského mléka, je třeba postupovat opatrně, když se krém nebo mast TEMOVATE® podává kojící ženě.
Pediatrické použití
Bezpečnost a účinnost krému a masti TEMOVATE® u dětských pacientů nebyla stanovena. Použití u pediatrických pacientů do 12 let se nedoporučuje. Vzhledem k vyššímu poměru plochy povrchu kůže k tělesné hmotě jsou dětští pacienti při léčbě topickými kortikosteroidy vystaveni většímu riziku suprese osy HPA a Cushingova syndromu než dospělí. Jsou proto také vystaveni většímu riziku adrenální insuficience během nebo po vysazení léčby. Při nevhodném použití topických kortikosteroidů u kojenců a dětí byly hlášeny nežádoucí účinky včetně strií.
dětí užívajících topické kortikosteroidy byly hlášeny suprese osy HPA, Cushingův syndrom, lineární retardace růstu, opožděný přírůstek hmotnosti a intrakraniální hypertenze. Mezi projevy adrenální suprese u dětí patří nízké plazmatické hladiny kortizolu a absence odpovědi na stimulaci ACTH. Mezi projevy intrakraniální hypertenze patří vypouklé fontanely, bolesti hlavy a oboustranný edém papily.
Geriatrické použití
Omezený počet pacientů ve věku 65 let nebo starších byl léčen krémem TEMOVATE® Cream (n = 231) a mastí TEMOVATE® (n = 101) v klinických studiích v USA i mimo USA. Zatímco počet pacientů je příliš malý na to, aby umožnil samostatnou analýzu účinnosti a bezpečnosti, nežádoucí účinky hlášené u této populace byly podobné těm, které uváděli mladší pacienti. Na základě dostupných údajů není zaručena žádná úprava dávkování krému a masti TEMOVATE® u geriatrických pacientů.
PŘEDÁVKOVAT
Lokálně aplikovaný krém a mast TEMOVATE® se může vstřebat v dostatečném množství k vyvolání systémových účinků (viz OPATŘENÍ ).
KONTRAINDIKACE
TEMOVATE® (klobetasol propionátový krém a mast) Krém a mast, 0,05% jsou kontraindikovány u pacientů s anamnézou přecitlivělosti na některou ze složek přípravků.
KLINICKÁ FARMAKOLOGIE
Stejně jako ostatní topické kortikosteroidy má klobetasol propionát protizánětlivé, antipruritické a vazokonstrikční vlastnosti. Mechanismus protizánětlivé aktivity topických steroidů je obecně nejasný. Předpokládá se však, že kortikosteroidy působí indukcí inhibičních proteinů fosfolipázy A2, souhrnně nazývaných lipokortiny. Předpokládá se, že tyto proteiny řídí biosyntézu silných mediátorů zánětu, jako jsou prostaglandiny a leukotrieny, inhibicí uvolňování jejich společného prekurzoru, kyseliny arachidonové. Kyselina arachidonová je uvolňována z membránových fosfolipidů fosfolipázou A2.
Farmakokinetika
Rozsah perkutánní absorpce topických kortikosteroidů je určen mnoha faktory, včetně vehikula a integrity epidermální bariéry. Nebylo prokázáno, že by okluzivní obvaz s hydrokortisonem po dobu až 24 hodin zvyšoval penetraci; nicméně okluze hydrokortizonu po dobu 96 hodin výrazně zvyšuje penetraci. Lokální kortikosteroidy se mohou absorbovat z normální neporušené kůže. Zánět a/nebo jiné chorobné procesy v kůži mohou zvýšit perkutánní absorpci.
Studie provedené s krémem a mastí TEMOVATE® ukazují, že jsou v super vysokém rozsahu účinnosti ve srovnání s jinými topickými kortikosteroidy.
INFORMACE PRO PACIENTA
Pacienti užívající topické kortikosteroidy by měli obdržet následující informace a pokyny:
