Elocon 5g Mometasone Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Elocon 5g a jak se používá?
Elocon (mometason furoate) krém, 0,1% je kortikosteroidní topický krém, lotion nebo mast indikovaný pro úlevu od zánětlivých a svědivých projevů dermatóz reagujících na kortikosteroidy u pacientů ve věku 2 let nebo starších.
Jaké jsou vedlejší účinky přípravku Elocon 5g?
Mezi běžné vedlejší účinky přípravku Elocon patří:
- vyrážka,
- svědění,
- hořící,
- zarudnutí,
- suchost,
- ztenčení nebo změkčení pokožky,
- kožní vyrážka nebo podráždění kolem úst,
- oteklé vlasové folikuly,
- pavoučí žíly,
- necitlivost nebo mravenčení,
- změny barvy ošetřované kůže,
- puchýře,
- pupínky,
- krustování ošetřené kůže, popř
- strie.
POPIS
ELOCON (mometason furoát) Krém, 0,1% obsahuje mometason furoát pro topické použití. Mometason furoát je syntetický kortikosteroid s protizánětlivým účinkem.
Chemicky je mometason furoát 9a,21-dichlor-11p,17-dihydroxy-16a-methylpregna-1,4-dien3,20-dion 17-(2-furoát), s empirickým vzorcem C27 H30CI2O6, molekulová hmotnost 521,4 a následující strukturní vzorec:
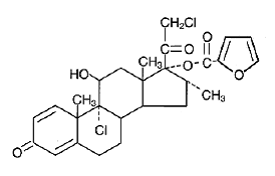
Mometason furoát je bílý až téměř bílý prášek prakticky nerozpustný ve vodě, těžce rozpustný v oktanolu a středně rozpustný v ethylalkoholu.
Každý gram ELOCON 5g Cream, 0,1% obsahuje 1 mg mometasonfuroátu v bílé až téměř bílé krémové bázi oktenylsukcinátu hlinitého škrobu (Gamma Irradiated), hexylenglykolu, hydrogenovaného sójového lecitinu, kyseliny fosforečné, čištěné vody, oxidu titaničitého, bílé měkké parafín a bílý vosk.
INDIKACE
ELOCON® Cream je kortikosteroid indikovaný k úlevě od zánětlivých a svědivých projevů dermatóz reagujících na kortikosteroidy u pacientů ve věku 2 let a starších.
DÁVKOVÁNÍ A PODÁVÁNÍ
Jednou denně naneste tenkou vrstvu krému ELOCON na postižená místa pokožky. ELOCON Cream lze použít u dětských pacientů ve věku 2 let a starších. Protože bezpečnost a účinnost krému ELOCON nebyla stanovena u pediatrických pacientů mladších 2 let; použití v této věkové skupině se nedoporučuje [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití ve specifických populacích ].
Po dosažení kontroly by měla být terapie přerušena. Pokud nedojde k žádnému zlepšení do 2 týdnů, může být nutné přehodnocení diagnózy. Bezpečnost a účinnost krému ELOCON u dětských pacientů po dobu delší než 3 týdny nebyla stanovena.
ELOCON Cream by neměl být používán s okluzivními obvazy, pokud to nenařídí lékař. ELOCON 5g Cream by neměl být aplikován v oblasti plen, pokud dítě stále potřebuje plenky nebo plastové kalhotky, protože tyto oděvy mohou představovat okluzivní obvaz.
Krém ELOCON je určen pouze k místnímu použití. Není určeno k orálnímu, oftalmologickému nebo intravaginálnímu použití.
Vyhněte se použití na obličej, třísla nebo podpaží.
JAK DODÁVÁNO
Dávkové formy A Síly
Smetana, 0,1 %. Každý gram krému ELOCON obsahuje 1 mg mometasonfuroátu v bílém až téměř bílém hladkém a homogenním krémovém základu.
Skladování A Manipulace
Krém ELOCON má bílou až téměř bílou barvu a dodává se v 15 gramech (NDC 0085-3149-01) a 50 gramech ( NDC 0085-3149-03) trubky.
Skladujte při teplotě 25 °C (77 °F); povoleny výchylky do 15-30°C (59-86°F) [viz USP řízená pokojová teplota ]. Vyvarujte se nadměrného tepla.
Vyrobeno pro: Merck Sharp & Dohme Corp., dceřiná společnost Merck & Co., Inc., Whitehouse Station, NJ 08889, USA. Výrobce: Schering-Plough Labo NV Heist-op-den-Berg, Belgie. Revize: duben 2013
VEDLEJŠÍ EFEKTY
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v klinické praxi.
V kontrolovaných klinických studiích zahrnujících 319 subjektů byla incidence nežádoucích účinků spojených s používáním ELOCON 5g krému 1,6 %. Hlášené reakce zahrnovaly pálení, pruritus a atrofii kůže. Rovněž byly obdrženy zprávy o růžovce spojené s používáním krému ELOCON 5g. V kontrolovaných klinických studiích (n=74) zahrnujících pediatrické subjekty ve věku 2 až 12 let byla incidence nežádoucích účinků spojených s používáním krému ELOCON 5g přibližně 7 %. Hlášené reakce zahrnovaly píchání, pruritus a furunkulózu.
Následující nežádoucí účinky byly hlášeny jako možná nebo pravděpodobně související s léčbou krémem ELOCON 5g během klinických studií u 4 % ze 182 pediatrických subjektů ve věku 6 měsíců až 2 let: snížené hladiny glukokortikoidů, 2; parestézie, 2; folikulitida, 1; moniliáza, 1; bakteriální infekce, 1; depigmentace kůže, 1. Následující známky atrofie kůže byly také pozorovány u 97 subjektů léčených krémem ELOCON v klinické studii: lesk, 4; telangiektázie, 1; ztráta elasticity, 4; ztráta normálních kožních znaků, 4; tenkost, 1; a modřiny, 1.
Následující další lokální nežádoucí účinky byly hlášeny u topických kortikosteroidů, ale mohou se vyskytovat častěji při použití okluzivních obvazů. Tyto reakce jsou: podráždění, suchost, folikulitida, hypertrichóza, akneiformní erupce, hypopigmentace, periorální dermatitida, alergická kontaktní dermatitida, sekundární infekce, strie a miliaria.
DROGOVÉ INTERAKCE
krémem ELOCON nebyly provedeny žádné studie lékových interakcí.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Účinky na endokrinní systém
Systémová absorpce topických kortikosteroidů může způsobit reverzibilní supresi osy hypotalamus-hypofýza-nadledviny (HPA) s potenciálem insuficience glukokortikosteroidů. K tomu může dojít během léčby nebo po jejím vysazení. Projevy Cushingova syndromu, hyperglykémie a glukosurie mohou být u některých pacientů vyvolány také systémovou absorpcí topických kortikosteroidů během léčby. Mezi faktory, které predisponují pacienta užívajícího topický kortikosteroid k potlačení osy HPA, patří použití vysoce účinných steroidů, velké plochy ošetřované plochy, dlouhodobé používání, používání okluzivních obvazů, změněná kožní bariéra, selhání jater a nízký věk.
Vzhledem k možnosti systémové absorpce může použití topických kortikosteroidů vyžadovat, aby byli pacienti pravidelně hodnoceni na potlačení osy HPA. To lze provést pomocí stimulačního testu adrenokortikotropního hormonu (ACTH).
Ve studii hodnotící účinky mometasonfuroátového krému na osu HPA bylo 15 gramů aplikováno dvakrát denně po dobu 7 dnů šesti dospělým subjektům s psoriázou nebo atopickou dermatitidou. Výsledky ukazují, že lék způsobil mírné snížení sekrece adrenálních kortikosteroidů.
Pokud je zaznamenána suprese osy HPA, je třeba se pokusit lék postupně vysadit, snížit frekvenci aplikace nebo nahradit méně účinným kortikosteroidem. Obnovení funkce osy HPA je obecně rychlé po vysazení topických kortikosteroidů. Vzácně se mohou objevit známky a příznaky insuficience glukokortikosteroidů vyžadující doplňkové systémové kortikosteroidy.
Pediatričtí pacienti mohou být náchylnější k systémové toxicitě z ekvivalentních dávek kvůli jejich většímu poměru povrchu kůže k tělesné hmotnosti [viz Použití u konkrétních populací ].
Alergická kontaktní dermatitida
Pokud dojde k podráždění, je třeba ELOCON Cream přerušit a zahájit vhodnou léčbu. Alergická kontaktní dermatitida s kortikosteroidy je obvykle diagnostikována pozorováním selhání hojení spíše než zaznamenáním klinické exacerbace jako u většiny topických přípravků neobsahujících kortikosteroidy. Takové pozorování by mělo být potvrzeno vhodným diagnostickým náplastovým testováním.
Souběžné kožní infekce
Pokud jsou přítomny nebo se rozvinou souběžné kožní infekce, je třeba použít vhodné antifungální nebo antibakteriální činidlo. Pokud se příznivá odpověď nedostaví okamžitě, je třeba používání ELOCON 5g krému přerušit, dokud nebude infekce adekvátně zvládnuta.

Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Nebyly provedeny dlouhodobé studie na zvířatech pro hodnocení karcinogenního potenciálu ELOCON 5g krému. Dlouhodobé studie karcinogenity mometasonfuroátu byly provedeny inhalační cestou u potkanů a myší. Ve dvouleté studii karcinogenity u potkanů Sprague Dawley mometasonfuroát neprokázal statisticky významný nárůst nádorů při inhalačních dávkách až do 67 mcg/kg (přibližně 0,04násobek odhadované maximální klinické lokální dávky z ELOCON 5g krému na bázi mcg/m² ). V 19měsíční studii karcinogenity u švýcarských myší CD-1 neprokázal mometasonfuroát žádné statisticky významné zvýšení výskytu nádorů při inhalačních dávkách až do 160 mcg/kg (přibližně 0,05násobek odhadované maximální klinické lokální dávky přípravku ELOCON Cream na mcg/m² základ).
Mometason furoát zvýšil chromozomální aberace v in vitro testu na ovariálních buňkách čínského křečka, ale nezvýšil chromozomální aberace v in vitro testu plicních buněk čínského křečka. Mometason furoát nebyl mutagenní v Amesově testu ani v testu myšího lymfomu a nebyl klastogenní v in vivo testu na myších mikronukleech, v testu chromozomálních aberací kostní dřeně potkana nebo testu na chromozomální aberaci samčích zárodečných buněk myší. Mometason furoát také neindukoval neplánovanou syntézu DNA in vivo v potkaních hepatocytech.
V reprodukčních studiích na potkanech nedošlo k poškození fertility u samců nebo samic potkanů při subkutánních dávkách až do 15 mcg/kg (přibližně 0,01násobek odhadované maximální klinické lokální dávky přípravku ELOCON 5g krém, na základě mcg/m²).
Použití u konkrétních populací
Těhotenství
Teratogenní účinky – kategorie těhotenství C
Neexistují žádné adekvátní a dobře kontrolované studie u těhotných žen. Proto by měl být ELOCON 5g krém používán během těhotenství pouze tehdy, pokud potenciální přínos ospravedlňuje potenciální riziko pro plod.
Bylo prokázáno, že kortikosteroidy jsou teratogenní u laboratorních zvířat, pokud jsou podávány systémově v relativně nízkých dávkách. U některých kortikosteroidů bylo prokázáno, že jsou po dermální aplikaci u laboratorních zvířat teratogenní.
Při podávání březím potkanům, králíkům a myším mometasonfuroát zvýšil malformace plodu. Dávky, které vyvolaly malformace, také snížily růst plodu, jak bylo měřeno nižší hmotností plodu a/nebo opožděnou osifikací. Mometason furoát také způsobil dystokii a související komplikace, když byl podáván potkanům na konci březosti.
myší způsobil mometasonfuroát rozštěp patra při subkutánních dávkách 60 mcg/kg a vyšších. Fetální přežití bylo sníženo na 180 mcg/kg. Při dávce 20 mcg/kg nebyla pozorována žádná toxicita. (Dávky 20, 60 a 180 mcg/kg u myši jsou přibližně 0,01, 0,02 a 0,05násobek odhadované maximální klinické lokální dávky krému ELOCON na základě mcg/m².)
U potkanů vyvolal mometasonfuroát pupeční kýly při topických dávkách 600 mcg/kg a vyšších. Dávka 300 mcg/kg způsobila zpoždění osifikace, ale žádné malformace. (Dávky 300 a 600 mcg/kg u potkanů jsou přibližně 0,2 a 0,4 násobkem odhadované maximální klinické lokální dávky ELOCON 5g krému na základě mcg/m².)
králíků způsobil mometasonfuroát mnohočetné malformace (např. flektované přední tlapky, ageneze žlučníku, pupeční kýla, hydrocefalie) při topických dávkách 150 mcg/kg a vyšších (přibližně 0,2násobek odhadované maximální klinické topické dávky z ELOCON krému na mc m² základ). V perorální studii mometasonfuroát zvýšil resorpci a způsobil rozštěp patra a/nebo malformace hlavy (hydrocefalie a klenutá hlava) v dávce 700 mcg/kg. Při dávce 2800 mcg/kg byla většina vrhů potracena nebo resorbována. Při dávce 140 mcg/kg nebyla pozorována žádná toxicita. (Dávky 140, 700 a 2800 mcg/kg u králíka jsou přibližně 0,2, 0,9 a 3,6 násobek odhadované maximální klinické lokální dávky krému ELOCON 5g na základě mcg/m².)
Když krysy dostávaly subkutánní dávky mometasonfuroátu během březosti nebo během pozdějších fází březosti, 15 mcg/kg způsobilo prodloužený a obtížný porod a snížilo počet živě narozených dětí, porodní hmotnost a časné přežití mláďat. Podobné účinky nebyly pozorovány při 7,5 mcg/kg. (Dávky 7,5 a 15 mcg/kg u potkanů jsou přibližně 0,005 a 0,01 násobek odhadované maximální klinické lokální dávky krému ELOCON na základě mcg/m².)
Kojící matky
Systémově podávané kortikosteroidy se objevují v lidském mléce a mohou potlačovat růst, interferovat s endogenní tvorbou kortikosteroidů nebo způsobit jiné nežádoucí účinky. Není známo, zda by topické podávání kortikosteroidů mohlo vést k dostatečné systémové absorpci k produkci detekovatelných množství v lidském mléce. Vzhledem k tomu, že do mateřského mléka se vylučuje mnoho léků, je třeba při podávání ELOCON 5g krému kojící ženě postupovat opatrně.
Pediatrické použití
ELOCON Cream může být používán s opatrností u pediatrických pacientů ve věku 2 let nebo starších, ačkoli bezpečnost a účinnost užívání léku po dobu delší než 3 týdny nebyla stanovena. Protože bezpečnost a účinnost ELOCON 5g krému nebyla stanovena u pediatrických pacientů mladších 2 let, jeho použití v této věkové skupině se nedoporučuje.
pediatrické studii bylo 24 subjektů s atopickou dermatitidou, z nichž 19 subjektů bylo ve věku 2 až 12 let, léčeno krémem ELOCON jednou denně. Většina subjektů vymizela během 3 týdnů. ELOCON 5g krém způsobil supresi osy HPA u přibližně 16 % pediatrických subjektů ve věku 6 až 23 měsíců, kteří před zahájením léčby vykazovali normální funkci nadledvinek podle testu Cortrosyn a byli léčeni přibližně 3 týdny v průběhu průměrná plocha povrchu těla 41 % (rozmezí 15 %-94 %). Kritéria pro supresi byla: bazální hladina kortizolu ≤ 5 mcg/dl, hladina 30 minut po stimulaci ≤ 18 mcg/dl nebo zvýšení KLINICKÁ FARMAKOLOGIE ].
Vzhledem k vyššímu poměru plochy povrchu kůže k tělesné hmotě jsou dětští pacienti při léčbě topickými kortikosteroidy vystaveni většímu riziku suprese osy HPA a Cushingova syndromu než dospělí. Jsou proto také vystaveni většímu riziku adrenální insuficience během a/nebo po vysazení léčby. Pediatričtí pacienti mohou být náchylnější než dospělí ke kožní atrofii, včetně strií, pokud jsou léčeni topickými kortikosteroidy. Pediatričtí pacienti, kteří aplikují topické kortikosteroidy na více než 20 % tělesného povrchu, jsou vystaveni vyššímu riziku suprese osy HPA.
pediatrických pacientů užívajících topické kortikosteroidy byla hlášena suprese osy HPA, Cushingův syndrom, lineární retardace růstu, opožděný přírůstek hmotnosti a intrakraniální hypertenze. Mezi projevy adrenální suprese u dětí patří nízké plazmatické hladiny kortizolu a absence odpovědi na stimulaci ACTH. Mezi projevy intrakraniální hypertenze patří vypouklé fontanely, bolesti hlavy a oboustranný edém papily.
ELOCON Cream by se neměl používat k léčbě plenkové dermatitidy.
Geriatrické použití
Klinické studie přípravku ELOCON 5g krém zahrnovaly 190 subjektů ve věku 65 let a více a 39 subjektů ve věku 75 let a více. Mezi těmito subjekty a mladšími subjekty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti a jiné hlášené klinické zkušenosti neidentifikovaly rozdíly v odpovědích mezi staršími a mladšími pacienty. Nelze však vyloučit větší citlivost některých starších jedinců.
PŘEDÁVKOVAT
Lokálně aplikovaný krém ELOCON může být absorbován v dostatečném množství, aby vyvolal systémové účinky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
KONTRAINDIKACE
Žádný.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Stejně jako ostatní topické kortikosteroidy má mometason furoát protizánětlivé, antipruritické a vazokonstrikční vlastnosti. Mechanismus protizánětlivé aktivity topických steroidů je obecně nejasný. Předpokládá se však, že kortikosteroidy působí indukcí inhibičních proteinů fosfolipázy A2, souhrnně nazývaných lipokortiny. Předpokládá se, že tyto proteiny řídí biosyntézu silných mediátorů zánětu, jako jsou prostaglandiny a leukotrieny, inhibicí uvolňování jejich společného prekurzoru kyseliny arachidonové. Kyselina arachidonová je uvolňována z membránových fosfolipidů fosfolipázou A2.
Farmakodynamika
Studie provedené s ELOCON 5g krémem ukazují, že je ve středním rozsahu účinnosti ve srovnání s jinými topickými kortikosteroidy.
Ve studii hodnotící účinky mometasonfuroátového krému na osu HPA bylo 15 gramů aplikováno dvakrát denně po dobu 7 dnů šesti dospělým subjektům s psoriázou nebo atopickou dermatitidou. Krém byl aplikován bez okluze alespoň na 30 % povrchu těla. Výsledky ukázaly, že lék způsobil mírné snížení sekrece adrenálních kortikosteroidů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Devadesát sedm pediatrických pacientů ve věku 6 až 23 měsíců s atopickou dermatitidou bylo zařazeno do otevřené studie bezpečnosti osy HPA. Krém ELOCON byl aplikován jednou denně po dobu přibližně 3 týdnů na průměrnou plochu povrchu těla 41 % (rozmezí 15 %-94 %). U přibližně 16 % jedinců, kteří vykazovali normální funkci nadledvin pomocí testu Cortrosyn před zahájením léčby, byla na konci léčby krémem ELOCON 5g pozorována suprese nadledvin. Kritéria pro supresi byla: bazální hladina kortizolu ≤ 5 mcg/dl, hladina 30 minut po stimulaci ≤ 18 mcg/dl nebo zvýšení Použití ve specifických populacích ].
Farmakokinetika
Rozsah perkutánní absorpce topických kortikosteroidů je určen mnoha faktory včetně vehikula a integrity epidermální bariéry. Studie na lidech ukazují, že přibližně 0,4 % aplikované dávky krému ELOCON 5g se dostane do oběhu po 8 hodinách kontaktu na normální kůži bez okluze. Zánět a/nebo jiné chorobné procesy v kůži mohou zvýšit perkutánní absorpci.
Klinické studie
Bezpečnost a účinnost ELOCON 5g krému pro léčbu dermatóz reagujících na kortikosteroidy byla hodnocena ve dvou randomizovaných, dvojitě zaslepených, vehikulem kontrolovaných klinických studiích, jedné u psoriázy a jedné u atopické dermatitidy. V těchto studiích bylo hodnoceno celkem 366 subjektů (12-81 let), z nichž 177 dostalo krém ELOCON a 181 subjektů dostalo krém s vehikulem. ELOCON Cream nebo vehikulový krém byly aplikovány jednou denně po dobu 21 dnů.
Dvě studie ukázaly, že ELOCON 5g krém je účinný při léčbě psoriázy a atopické dermatitidy.
INFORMACE PRO PACIENTA
Informujte pacienty o následujícím:
- Používejte ELOCON 5g krém podle pokynů lékaře. Je pouze pro vnější použití.
- Vyhněte se kontaktu s očima.
- Nepoužívejte krém ELOCON na obličej, podpaží nebo třísla, pokud to nenařídí lékař.
- ELOCON 5g krém nepoužívejte na jinou poruchu, než na kterou byl předepsán.
- Ošetřená oblast kůže by se neměla obvazovat nebo jinak zakrývat nebo obalovat tak, aby byla okluzivní, pokud to nenařídí lékař.
- Jakékoli známky lokálních nežádoucích reakcí oznamte lékaři.
- Doporučte pacientům, aby nepoužívali ELOCON 5g krém při léčbě plenkové dermatitidy. Neaplikujte ELOCON Cream do oblasti plen, protože plenky nebo plastové kalhotky mohou tvořit okluzivní obvaz.
- Po dosažení kontroly léčbu přerušte. Pokud nedojde ke zlepšení do 2 týdnů, kontaktujte lékaře.
- Bez předchozí konzultace s lékařem nepoužívejte s krémem ELOCON jiné přípravky obsahující kortikosteroidy.
