Cartia XT 180mg Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Cartia a jak se používá?
Cartia je lék na předpis používaný k léčbě příznaků bolesti na hrudi (angina pectoris), vysokého krevního tlaku (hypertenze), paroxysmální supraventrikulární tachykardie a fibrilace síní (flutter). Cartia lze užívat samostatně nebo s jinými léky.
Cartia patří do třídy léků nazývaných Antidysrytmika, IV; blokátory vápníkových kanálů; Blokátory vápníkových kanálů, nedihydropyridin.
Jaké jsou možné vedlejší účinky Cartia?
Cartia může způsobit závažné nežádoucí účinky včetně:
- bolest na hrudi,
- pomalý srdeční tep,
- bušení srdce,
- chvění v tvé hrudi,
- točení hlavy,
- otok,
- rychlý nárůst hmotnosti,
- dušnost,
- horečka,
- bolest krku,
- pálení očí,
- bolest kůže a
- červená nebo fialová kožní vyrážka s puchýři a olupováním
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky Cartia patří:
- mírná bolest hlavy,
- mírné závratě a
- příznaky nachlazení (ucpaný nos, kýchání, bolest v krku)
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Cartia. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
Diltiazem hydrochlorid je inhibitor buněčného influxu iontů vápníku (blokátor pomalého kanálu nebo antagonista vápníku). Chemicky je diltiazem hydrochlorid 1,5-benzothiazepin-4(5H)on,3-(acetyloxy)-5-[2-(dimethylamino)ethyl]-2,3-dihydro-2-(4-methoxyfenyl)-monohydrochlorid ,(+)-cis-. Chemická struktura je:
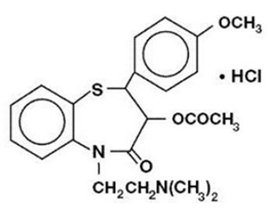
Diltiazem hydrochlorid je bílý až téměř bílý krystalický prášek s hořkou chutí. Je rozpustný ve vodě, methanolu a chloroformu. Má molekulovou hmotnost 450,98. Kapsle s prodlouženým uvolňováním diltiazem hydrochloridu (dávka jednou denně) je formulována jako tobolka s prodlouženým uvolňováním jednou denně obsahující 120 mg, 180 mg, 240 mg nebo 300 mg diltiazem hydrochloridu.
Kromě toho každá kapsle obsahuje následující neaktivní složky: acetyltributylcitrát, amoniomethakrylátový kopolymer-NF, D & C Red #28, D & C Yellow #10, D & C Yellow #10 Aluminium Lake, ethylcelulóza, FD & C Blue #1 Hliníkové jezero, FD & C modrá #2 Hliníkové jezero, FD & C červená #40, FD & C červená #40 Hliníkové jezero, želatina-NF, stearát hořečnatý, kopolymer kyseliny methakrylové-NF, propylenglykol, polysorbát 80-NF, škrob sacharóza, mastek USP a oxid titaničitý. 180 mg a 240 mg tobolky obsahují žlutý oxid železitý. Kromě toho 240mg tobolka obsahuje také černý oxid železitý a červený oxid železitý.
Pro perorální podání.
Tento lék splňuje USP Drug Release 9.
INDIKACE
Kapsle s prodlouženým uvolňováním Diltiazem hydrochloridu USP (dávka jednou denně) jsou indikovány k léčbě hypertenze. Může být použit samostatně nebo v kombinaci s jinými antihypertenzivy.
Kapsle s prodlouženým uvolňováním diltiazem hydrochloridu USP (dávka jednou denně) jsou indikovány k léčbě chronické stabilní anginy pectoris a anginy pectoris způsobené spasmem koronárních tepen.
DÁVKOVÁNÍ A PODÁVÁNÍ
Pacienti kontrolovaní diltiazemem samotným nebo v kombinaci s jinými léky mohou být převedeni na diltiazem hydrochlorid tobolky s prodlouženým uvolňováním USP (dávka jednou denně) v nejbližší ekvivalentní celkové denní dávce. U některých pacientů mohou být zapotřebí vyšší dávky tobolek s prodlouženým uvolňováním diltiazem hydrochloridu USP (dávka jednou denně). Pacienti by měli být pečlivě sledováni. Následná titrace na vyšší nebo nižší dávky může být nezbytná a měla by být zahájena, jak je klinicky odůvodněno. Obecné klinické zkušenosti s dávkami nad 360 mg jsou omezené, ale v klinických studiích byly studovány dávky do 540 mg. Výskyt nežádoucích účinků se zvyšuje se zvyšující se dávkou s AV blokádou prvního stupně, závratěmi a sinusovou bradykardií, které mají nejsilnější vztah k dávce.
Hypertenze
Dávkování je třeba upravit titrací podle individuálních potřeb pacienta. Při použití v monoterapii jsou rozumné počáteční dávky 180 až 240 mg jednou denně, ačkoli někteří pacienti mohou reagovat na nižší dávky. Maximální antihypertenzní účinek je obvykle pozorován po 14 dnech chronické terapie; proto je třeba odpovídajícím způsobem naplánovat úpravu dávkování. Obvyklé rozmezí dávek studované v klinických studiích bylo 240 až 360 mg jednou denně. Jednotliví pacienti mohou reagovat na vyšší dávky až 480 mg jednou denně.
Angina
Dávkování pro léčbu anginy pectoris by mělo být upraveno podle potřeb každého pacienta, počínaje dávkou 120 nebo 180 mg jednou denně. Jednotliví pacienti mohou reagovat na vyšší dávky až 480 mg jednou denně. V případě potřeby lze titraci provést po dobu 7 až 14 dnů.
Diltiazem Hydrochloride Kapsle s prodlouženým uvolňováním USP (dávkování jednou denně)
Současné užívání s jinými kardiovaskulárními látkami
JAK DODÁVÁNO
POZNÁMKA: VÝROBEK MŮŽE MÍT ZÁPACH.
Podmínky skladování
Uchovávejte při teplotě 20° až 25°C (68° až 77°F) [Viz USP řízená pokojová teplota ].
Vyvarujte se nadměrné vlhkosti.
Dávkujte v těsné, světlo odolné nádobě, jak je definováno v USP.
Výrobce: Actavis Laboratories FL, Inc., Fort Lauderdale, FL 33314 USA. Distribuce: Actavis Pharma, Inc., Parsippany, NJ 07054 USA. Revize: prosinec 2014
VEDLEJŠÍ EFEKTY
Závažné nežádoucí účinky byly v dosud provedených studiích vzácné, ale je třeba si uvědomit, že pacienti s poruchou komorové funkce a abnormalitami srdečního vedení byli z těchto studií obvykle vyloučeni.
Následující tabulka uvádí nejčastější nežádoucí účinky hlášené v placebem kontrolovaných studiích anginy pectoris a hypertenze u pacientů užívajících přípravek ve formě kapslí s prodlouženým uvolňováním diltiazem hydrochloridu (dávkování jednou denně) až do 360 mg s výskytem u pacientů s placebem, které jsou uvedeny pro srovnání.
Diltiazem Hydrochloride Kapsle s prodlouženým uvolňováním (jednou denně) Placebem kontrolované studie anginy pectoris a hypertenze kombinované
klinických studiích tobolek diltiazem hydrochloridu s prodlouženým uvolňováním (dávkování jednou denně), tablet diltiazem hydrochloridu a tobolek diltiazem hydrochloridu s prodlouženým uvolňováním, které zahrnovaly více než 3200 pacientů, byly nejčastějšími příhodami (tj. více než 1 %) edém (4,6 %) , bolest hlavy (4,6 %), závratě (3,5 %), astenie (2,6 %), AV blokáda prvního stupně (2,4 %), bradykardie (1,7 %), návaly horka (1,4 %), nevolnost (1,4 %) a vyrážka ( 1,2 %).
Kromě toho byly ve studiích s anginou pectoris nebo hypertenzí méně často (méně než 1 %) hlášeny následující příhody:
Kardiovaskulární: Angina, arytmie, AV blokáda (druhého nebo třetího stupně), blokáda raménka, městnavé srdeční selhání, abnormality EKG, hypotenze, palpitace, synkopa, tachykardie, ventrikulární extrasystoly.
Nervový systém: Abnormální sny, amnézie, deprese, abnormality chůze, halucinace, nespavost, nervozita, parestézie, změna osobnosti, ospalost, tinitus, třes.
Gastrointestinální: Anorexie, zácpa, průjem, sucho v ústech, dysgeuzie, dyspepsie, mírné zvýšení SGOT, SGPT, LDH a alkalické fosfatázy (viz VAROVÁNÍ , Akutní poškození jater ), žízeň, zvracení, zvýšení tělesné hmotnosti.
Dermatologické: Petechie, fotosenzitivita, pruritus, kopřivka.
Jiný: Amblyopie, zvýšení CPK, dušnost, epistaxe, podráždění očí, hyperglykémie, hyperurikémie, impotence, svalové křeče, ucpaný nos, nykturie, osteoartikulární bolesti, polyurie, sexuální potíže.
Následující postmarketingové příhody byly u pacientů užívajících diltiazem hlášeny zřídka: akutní generalizovaná exantematózní pustulóza, alergické reakce, alopecie, angioedém (včetně obličejového nebo periorbitálního edému), asystolie, multiformní erytém (včetně Stevens-Johnsonova syndromu, toxické epidermální nekrolýzy), exfoliativní dermatitida extrapyramidové příznaky, gingivální hyperplazie, hemolytická anémie, zvýšená doba krvácení, leukopenie, fotosenzitivita (včetně lichenoidní keratózy a hyperpigmentace v oblastech kůže vystavených slunci), purpura, retinopatie, myopatie a trombocytopenie. Kromě toho byly pozorovány události, jako je infarkt myokardu, které u těchto pacientů nelze snadno odlišit od přirozené historie onemocnění. Byla hlášena řada dobře zdokumentovaných případů generalizované vyrážky, některé charakterizované jako leukocytoklastická vaskulitida. Definitivní vztah příčiny a účinku mezi těmito příhodami a léčbou diltiazemem však dosud nebyl stanoven.
Chcete-li nahlásit PODezření na NEŽÁDOUCÍ REAKCE, kontaktujte společnost Actavis na čísle 1-800-272-5525 nebo FDA na čísle 1-800-FDA-1088 nebo www.fda.gov/medwatch.
DROGOVÉ INTERAKCE
Vzhledem k možnosti aditivních účinků je nutná opatrnost a pečlivá titrace u pacientů užívajících diltiazem současně s jinými látkami, o nichž je známo, že ovlivňují srdeční kontraktilitu a/nebo vedení (viz VAROVÁNÍ ). Farmakologické studie naznačují, že při použití beta-blokátorů nebo digitalisu současně s diltiazemem mohou existovat aditivní účinky na prodloužení AV vedení (viz VAROVÁNÍ ).
Stejně jako u všech léků je třeba postupovat opatrně při léčbě pacientů s více léky. Diltiazem je substrátem i inhibitorem enzymového systému cytochromu P-450 3A4. Jiná léčiva, která jsou specifickými substráty, inhibitory nebo induktory tohoto enzymového systému, mohou mít významný dopad na účinnost a profil vedlejších účinků diltiazemu. Pacienti užívající jiné léky, které jsou substráty CYP450 3A4, zejména pacienti s poruchou funkce ledvin a/nebo jater, mohou vyžadovat úpravu dávkování při zahájení nebo ukončení souběžného podávání diltiazemu, aby se udržely optimální terapeutické hladiny v krvi.
Anestetika
Potlačení srdeční kontraktility, vodivosti a automatiky, stejně jako vaskulární dilatace spojené s anestetiky, může být potencováno blokátory kalciových kanálů. Při současném použití je třeba pečlivě titrovat anestetika a blokátory kalcia.
Benzodiazepiny
Studie ukázaly, že diltiazem zvýšil AUC midazolamu a triazolamu 3 až 4krát a Cmax 2krát ve srovnání s placebem. Eliminační poločas midazolamu a triazolamu se také zvýšil (1,5 až 2,5krát) při současném podávání s diltiazemem. Tyto farmakokinetické účinky pozorované při současném podávání diltiazemu mohou vést ke zvýšeným klinickým účinkům (např. prodloužená sedace) midazolamu i triazolamu.
Beta-blokátory
Kontrolované a nekontrolované domácí studie naznačují, že současné užívání diltiazemu a betablokátorů je obvykle dobře tolerováno, ale dostupné údaje nejsou dostatečné k předpovědi účinků souběžné léčby u pacientů s dysfunkcí levé komory nebo s abnormalitami srdečního vedení.
Podávání diltiazem hydrochloridu současně s propranololem pěti normálním dobrovolníkům vedlo ke zvýšení hladin propranololu u všech subjektů a biologická dostupnost propranololu se zvýšila přibližně o 50 %. In vitro se zdá, že propranolol je ze svých vazebných míst vytěsněn diltiazemem. Pokud je kombinovaná léčba zahájena nebo ukončena ve spojení s propranololem, může být oprávněná úprava dávky propranololu (viz VAROVÁNÍ ).
buspirone
U devíti zdravých subjektů diltiazem významně zvýšil průměrnou AUC buspironu 5,5krát a Cmax 4,1krát ve srovnání s placebem. T½ a Tmax buspironu nebyly významně ovlivněny diltiazemem. Při současném podávání s diltiazemem mohou být zesílené účinky a zvýšená toxicita buspironu. Následné úpravy dávky mohou být nutné během současného podávání a měly by být založeny na klinickém hodnocení.
karbamazepin
Bylo hlášeno, že současné podávání diltiazemu s karbamazepinem vede ke zvýšeným hladinám karbamazepinu v séru (40% až 72% zvýšení), což v některých případech vede k toxicitě. Pacienti užívající tyto léky současně by měli být sledováni z hlediska potenciální lékové interakce.
Cimetidin
Studie na šesti zdravých dobrovolnících prokázala významné zvýšení maximálních plazmatických hladin diltiazemu (58 %) a plochy pod křivkou (53 %) po týdenní kúře cimetidinu v dávce 1200 mg denně a jednorázové dávce diltiazem 60 mg. Ranitidin vyvolal menší, nevýznamné zvýšení. Účinek může být zprostředkován známou inhibicí jaterního cytochromu P-450, enzymového systému odpovědného za metabolismus prvního průchodu diltiazemu, cimetidinem. Pacienti, kteří jsou v současné době léčeni diltiazemem, by měli být pečlivě sledováni z hlediska změny farmakologického účinku při zahájení a ukončení léčby cimetidinem. Může být oprávněná úprava dávky diltiazemu.
klonidin
souvislosti s užíváním klonidinu současně s diltiazemem byla hlášena sinusová bradykardie vedoucí k hospitalizaci a zavedení kardiostimulátoru. Monitorujte srdeční frekvenci u pacientů užívajících současně diltiazem a klonidin.
Cyklosporin
Farmakokinetická interakce mezi diltiazemem a cyklosporinem byla pozorována během studií zahrnujících pacienty po transplantaci ledvin a srdce. U příjemců transplantátu ledvin a srdce bylo nutné snížení dávky cyklosporinu v rozmezí od 15 % do 48 %, aby se udržely minimální koncentrace cyklosporinu podobné těm, které byly pozorovány před přidáním diltiazemu. Pokud mají být tyto látky podávány současně, je třeba monitorovat koncentrace cyklosporinu, zvláště když je léčba diltiazemem zahájena, upravena nebo přerušena.
Účinek cyklosporinu na plazmatické koncentrace diltiazemu nebyl hodnocen.
Digitální
Podávání diltiazemu s digoxinem 24 zdravým mužům zvýšilo plazmatické koncentrace digoxinu přibližně o 20 %. Jiný výzkumník nezjistil žádné zvýšení hladin digoxinu u 12 pacientů s onemocněním koronárních tepen. Vzhledem k tomu, že existují rozporuplné výsledky týkající se účinku hladin digoxinu, doporučuje se, aby byly hladiny digoxinu monitorovány při zahájení, úpravě a vysazení léčby diltiazemem, aby se předešlo možné nadměrné nebo nedostatečné digitalizaci (viz VAROVÁNÍ ).
Chinidin
Diltiazem významně zvyšuje AUC(0-→) chinidinu o 51 %, T½ o 36 % a snižuje jeho CL perorálně o 33 %. Může být oprávněné sledování nežádoucích účinků chinidinu a podle toho upravit dávku.
rifampin
Současné podávání rifampinu s diltiazemem snížilo plazmatické koncentrace diltiazemu na nedetekovatelné hladiny. Je-li to možné, je třeba se vyhnout současnému podávání diltiazemu s rifampinem nebo jakýmkoli známým induktorem CYP3A4 a zvážit alternativní léčbu.
statiny
Diltiazem je inhibitorem CYP3A4 a bylo prokázáno, že významně zvyšuje AUC některých statinů. Riziko myopatie a rhabdomyolýzy u statinů metabolizovaných CYP3A4 může být zvýšeno při současném užívání diltiazemu. Pokud je to možné, použijte statin nemetabolizovaný CYP3A4 spolu s diltiazemem; jinak by měla být zvážena úprava dávky jak diltiazemu, tak statinu spolu s pečlivým sledováním známek a příznaků jakýchkoli nežádoucích účinků souvisejících se statiny.
Ve zkřížené studii u zdravých dobrovolníků (N=10) vedlo současné podávání jedné 20mg dávky simvastatinu na konci 14denního režimu s diltiazemem SR v dávce 120 mg dvakrát denně k 5násobnému zvýšení průměrné AUC simvastatinu oproti simvastatinu sám. Jedinci se zvýšenou průměrnou expozicí diltiazemu v ustáleném stavu vykazovali vícenásobné zvýšení expozice simvastatinu. Počítačové simulace ukázaly, že při denní dávce 480 mg diltiazemu lze očekávat 8- až 9násobné průměrné zvýšení AUC simvastatinu. Pokud je nutné současné podávání simvastatinu s diltiazemem, omezte denní dávky simvastatinu na 10 mg a diltiazemu na 240 mg.
randomizované, otevřené, 4cestné zkřížené studii s deseti jedinci vedlo současné podávání diltiazemu (120 mg diltiazemu SR BID po dobu 2 týdnů) s jednou dávkou 20 mg lovastatinu k 3- až 4násobnému zvýšení průměrné AUC lovastatinu a versus samotný lovastatin. Ve stejné studii nedošlo k žádné významné změně v AUC 20 mg jednotlivé dávky pravastatinu a během současného podávání diltiazemu. Plazmatické hladiny diltiazemu nebyly lovastatinem ani pravastatinem významně ovlivněny.
VAROVÁNÍ
Srdeční vedení
Diltiazem prodlužuje refrakterní periody AV uzlu bez významného prodloužení doby zotavení sinusového uzlu, s výjimkou pacientů se syndromem nemocného sinu. Tento účinek může vzácně vést k abnormálně pomalé srdeční frekvenci (zejména u pacientů se syndromem nemocného sinu) nebo AV blokádě druhého nebo třetího stupně (13 z 3290 pacientů nebo 0,40 %). Současné užívání diltiazemu s beta-blokátory nebo digitalisem může vést k aditivním účinkům na srdeční převod. U pacienta s Prinzmetalovou angínou se po jednorázové dávce 60 mg diltiazemu rozvinuly periody asystolie (2 až 5 sekund) (viz. NEŽÁDOUCÍ REAKCE ).
Městnavé srdeční selhání
Přestože má diltiazem v izolovaných preparátech zvířecích tkání negativně inotropní účinek, hemodynamické studie u lidí s normální komorovou funkcí neprokázaly snížení srdečního indexu ani konzistentní negativní účinky na kontraktilitu (dp/dt). Akutní studie perorálního diltiazemu u pacientů s poruchou komorové funkce (ejekční frakce 24 % ± 6 %) prokázala zlepšení indexů komorové funkce bez významného snížení kontraktilní funkce (dp/dt). U pacientů s již existující poruchou komorové funkce bylo hlášeno zhoršení městnavého srdečního selhání. Zkušenosti s použitím diltiazem-hydrochloridu v kombinaci s beta-blokátory u pacientů s poruchou komorové funkce jsou omezené. Při použití této kombinace je třeba postupovat opatrně.
Hypotenze
Snížení krevního tlaku spojené s léčbou diltiazemem může příležitostně vést k symptomatické hypotenzi.
Akutní poškození jater
klinických studiích bylo pozorováno mírné zvýšení transamináz se současným zvýšením alkalické fosfatázy a bilirubinu nebo bez něj. Taková zvýšení byla obvykle přechodná a často vymizela i při pokračující léčbě diltiazemem. Ve vzácných případech byla zaznamenána významná zvýšení enzymů, jako je alkalická fosfatáza, LDH, SGOT, SGPT, a další jevy odpovídající akutnímu poškození jater. Tyto reakce se vyskytovaly brzy po zahájení terapie (1 až 8 týdnů) a byly reverzibilní po přerušení lékové terapie. Vztah k diltiazemu je v některých případech nejistý, ale v některých pravděpodobný (viz OPATŘENÍ ).
OPATŘENÍ
Všeobecné
Diltiazem hydrochlorid je rozsáhle metabolizován játry a vylučován ledvinami a žlučí. Jako u každého léku podávaného po delší dobu je třeba v pravidelných intervalech sledovat laboratorní parametry funkce ledvin a jater. Lék by měl být používán s opatrností u pacientů s poruchou funkce ledvin nebo jater. V subakutních a chronických studiích na psech a potkanech navržených tak, aby vyvolaly toxicitu, byly vysoké dávky diltiazemu spojeny s poškozením jater. Ve speciálních subakutních jaterních studiích byly perorální dávky 125 mg/kg a vyšší u potkanů spojeny s histologickými změnami v játrech, které byly po vysazení léku reverzibilní. U psů byly dávky 20 mg/kg také spojeny s jaterními změnami; tyto změny však byly při pokračujícím dávkování reverzibilní.
Dermatologické příhody (viz NEŽÁDOUCÍ REAKCE může být přechodná a může vymizet i přes pokračující užívání diltiazemu. Ojediněle však byly také hlášeny kožní erupce progredující do erythema multiforme a/nebo exfoliativní dermatitidy. Pokud dermatologická reakce přetrvává, je třeba lék vysadit.
Karcinogeneze, mutageneze, zhoršení plodnosti
24měsíční studie na potkanech s perorálními dávkami do 100 mg/kg/den a 21měsíční studie na myších s perorálními dávkami do 30 mg/kg/den neprokázaly žádné známky karcinogenity. Nebyla také zjištěna žádná mutagenní odpověď in vitro nebo in vivo v testech na savčích buňkách nebo in vitro v bakteriích. Ve studii provedené u samců a samic potkanů při perorálních dávkách až 100 mg/kg/den nebyly pozorovány žádné známky poškození fertility.
Těhotenství
Kategorie C. Reprodukční studie byly provedeny na myších, krysách a králících. Podání dávek v rozmezí pětkrát až desetkrát vyšších (na základě mg/kg) než je denní doporučená terapeutická dávka vedlo k úmrtnosti embryí a plodu. V některých studiích bylo hlášeno, že tyto dávky způsobují kosterní abnormality. V perinatálních/postnatálních studiích byl pozorován zvýšený výskyt mrtvě narozených dětí při dávkách 20krát vyšších, než je dávka u člověka.
Neexistují žádné dobře kontrolované studie u těhotných žen; proto používejte diltiazem u těhotných žen pouze tehdy, pokud potenciální přínos ospravedlňuje potenciální riziko pro plod.
Kojící matky
Diltiazem se vylučuje do mateřského mléka. Jedna zpráva naznačuje, že koncentrace v mateřském mléce se mohou blížit hladinám v séru. Pokud je použití diltiazemu považováno za nezbytné, měla by být zavedena alternativní metoda výživy kojenců.
Pediatrické použití
Bezpečnost a účinnost u pediatrických pacientů nebyla stanovena.
Geriatrické použití
Klinické studie diltiazemu nezahrnovaly dostatečný počet subjektů ve věku 65 let a více, aby bylo možné určit, zda reagují odlišně od mladších subjektů. Jiné hlášené klinické zkušenosti nezjistily rozdíly v odpovědích mezi staršími a mladšími pacienty. Obecně by měl být výběr dávky pro staršího pacienta opatrný, obvykle začínající na spodní hranici dávkovacího rozmezí, což odráží vyšší frekvenci snížené funkce jater, ledvin nebo srdce a souběžného onemocnění nebo jiné lékové terapie.
PŘEDÁVKOVAT
Orální LD50 u myší a potkanů se pohybuje od 415 do 740 mg/kg a od 560 do 810 mg/kg, v daném pořadí. Intravenózní LD50 u těchto druhů byly 60 a 38 mg/kg, v daném pořadí. Orální LD50 u psů se považuje za vyšší než 50 mg/kg, zatímco letalita byla pozorována u opic při dávce 360 mg/kg.
Toxická dávka u člověka není známa. Kvůli rozsáhlému metabolismu se hladiny v krvi po standardní dávce diltiazemu mohou lišit více než desetinásobně, což omezuje užitečnost hladin v krvi v případech předávkování.
Byly hlášeny případy předávkování diltiazemem v množství od
Události pozorované po předávkování diltiazemem zahrnovaly bradykardii, hypotenzi, srdeční blok a srdeční selhání. Většina zpráv o předávkování popisovala některá podpůrná lékařská opatření a/nebo léčbu drogami. Bradykardie často reagovala příznivě na atropin, stejně jako srdeční blok, ačkoliv srdeční stimulace byla také často využívána k léčbě srdečního bloku. K udržení krevního tlaku byly používány tekutiny a vazopresory, v případech srdečního selhání byly podávány inotropní látky. Někteří pacienti navíc dostávali léčbu s podporou ventilace, výplachem žaludku, aktivním uhlím a/nebo intravenózním vápníkem.
Účinnost intravenózního podání vápníku ke zvrácení farmakologických účinků předávkování diltiazemem byla nekonzistentní. V několika hlášených případech předávkování blokátory kalciových kanálů spojené s hypotenzí a bradykardií, které byly zpočátku refrakterní na atropin, začalo lépe reagovat na atropin poté, co pacienti dostali intravenózně vápník. V některých případech byl podáván intravenózně vápník (1 g chloridu vápenatého nebo 3 g glukonátu vápenatého) po dobu 5 minut a podle potřeby se opakoval každých 10 až 20 minut. Glukonát vápenatý byl také podáván jako kontinuální infuze rychlostí 2 g za hodinu po dobu 10 hodin. Mohou být nutné infuze vápníku po dobu 24 hodin nebo déle. Pacienti by měli být sledováni na známky hyperkalcémie.
případě předávkování nebo přehnané odpovědi je třeba kromě dekontaminace gastrointestinálního traktu použít vhodná podpůrná opatření. Zdá se, že diltiazem nelze odstranit peritoneální nebo hemodialýzou. Omezené údaje naznačují, že plazmaferéza nebo hemoperfuze aktivním uhlím mohou urychlit eliminaci diltiazemu po předávkování. Na základě známých farmakologických účinků diltiazemu a/nebo hlášených klinických zkušeností lze zvážit následující opatření:
Bradykardie: Podávejte atropin (0,6 až 1 mg). Pokud nedojde k odpovědi na vagovou blokádu, podávejte isoproterenol opatrně.
AV blok vysokého stupně: Léčte jako u bradykardie výše. Fixní AV blokáda vysokého stupně by měla být léčena kardiostimulací.
Srdeční selhání: Podávejte inotropní látky (isoproterenol, dopamin nebo dobutamin) a diuretika.
Hypotenze: Vasopresory (např. dopamin nebo norepinefrin).
Skutečná léčba a dávkování by měly záviset na závažnosti klinické situace a úsudku a zkušenostech ošetřujícího lékaře.
KONTRAINDIKACE
Diltiazem je kontraindikován u (1) pacientů se syndromem nemocného sinu s výjimkou přítomnosti funkčního komorového kardiostimulátoru, (2) pacientů s AV blokádou druhého nebo třetího stupně s výjimkou přítomnosti funkčního komorového kardiostimulátoru, (3) pacientů s hypotenze (systolická méně než 90 mm Hg), (4) pacienti, kteří prokázali přecitlivělost na lék, a (5) pacienti s akutním infarktem myokardu a plicní kongescí dokumentovanou rentgenem při příjmu.
KLINICKÁ FARMAKOLOGIE
Předpokládá se, že terapeutické účinky kapslí s prodlouženým uvolňováním diltiazem hydrochloridu USP (dávka jednou denně) souvisí s jejich schopností inhibovat buněčný tok vápenatých iontů během membránové depolarizace srdečního a vaskulárního hladkého svalstva.
Mechanismy působení
Hypertenze
Diltiazem hydrochlorid tobolky s prodlouženým uvolňováním USP (dávkování jednou denně) vyvolávají svůj antihypertenzní účinek především relaxací hladkého svalstva cév a výsledným snížením periferní vaskulární rezistence. Velikost snížení krevního tlaku souvisí se stupněm hypertenze; u hypertoniků tedy dochází k antihypertenznímu účinku, zatímco u normotoniků dochází pouze k mírnému poklesu krevního tlaku.
Angina
Bylo prokázáno, že kapsle s prodlouženým uvolňováním diltiazem hydrochloridu USP (dávkování jednou denně) zvyšují toleranci zátěže, pravděpodobně díky své schopnosti snižovat spotřebu kyslíku myokardu. Toho je dosaženo prostřednictvím snížení srdeční frekvence a systémového krevního tlaku při submaximálním a maximálním pracovním zatížení. Diltiazem se ukázal jako silný dilatátor koronárních tepen, jak epikardiálních, tak subendokardiálních. Spontánní a ergonovinem indukované spazmy koronárních tepen jsou inhibovány diltiazemem.
Na zvířecích modelech diltiazem interferuje s pomalým vnitřním (depolarizačním) proudem v excitabilní tkáni. Způsobuje rozpojení excitace-kontrakce v různých tkáních myokardu beze změn v konfiguraci akčního potenciálu. Diltiazem vyvolává relaxaci hladkého svalstva koronárních cév a dilataci velkých i malých koronárních arterií v hladinách léčiva, které způsobují malý nebo žádný negativní inotropní účinek. Výsledné zvýšení koronárního průtoku krve (epikardiální a subendokardiální) se vyskytuje u ischemických a neischemických modelů a je doprovázeno na dávce závislým snížením systémového krevního tlaku a snížením periferní rezistence.
Hemodynamické a elektrofyziologické účinky
Stejně jako ostatní antagonisté kalciových kanálů snižuje diltiazem sinoatriální a atrioventrikulární vedení v izolovaných tkáních a má negativně inotropní účinek v izolovaných preparátech. U intaktního zvířete lze při vyšších dávkách pozorovat prodloužení intervalu AH.
člověka diltiazem zabraňuje spontánním a ergonovinem vyvolaným spasmům koronárních tepen. Způsobuje snížení periferní vaskulární rezistence a mírný pokles krevního tlaku u normotenzních jedinců a ve studiích tolerance zátěže u pacientů s ischemickou chorobou srdeční snižuje součin srdeční frekvence a krevního tlaku pro jakoukoli danou zátěž. Dosavadní studie, primárně u pacientů s dobrou komorovou funkcí, neodhalily důkazy o negativním inotropním účinku; srdeční výdej, ejekční frakce a koncový diastolický tlak levé komory nebyly ovlivněny. Tyto údaje nemají žádnou prediktivní hodnotu s ohledem na účinky u pacientů se špatnou komorovou funkcí au pacientů s již existujícím poškozením komorové funkce bylo hlášeno zvýšené srdeční selhání. O interakci diltiazemu a betablokátorů u pacientů se špatnou komorovou funkcí je zatím málo údajů. Klidovou srdeční frekvenci obvykle mírně sníží diltiazem.
pacientů s hypertenzí vyvolává diltiazem hydrochlorid tobolky s prodlouženým uvolňováním USP (dávka jednou denně) antihypertenzní účinky jak v poloze na zádech, tak ve stoje. Ve dvojitě zaslepené, paralelní studii závislosti odpovědi na dávce s použitím dávek v rozmezí od 90 do 540 mg jednou denně snižovala tobolka diltiazem hydrochloridu s prodlouženým uvolňováním (dávka jednou denně) diastolický krevní tlak vleže zjevně lineárně po celou dobu studované rozmezí dávek. Změny diastolického krevního tlaku, měřené v době minima, pro placebo, 90 mg, 180 mg, 360 mg a 540 mg byly -2,9, -4,5, -6,1, -9,5 a -10,5 mm Hg, v daném pořadí. Posturální hypotenze je zřídka zaznamenána při náhlém zaujetí vzpřímené polohy. S chronickými antihypertenzními účinky není spojena žádná reflexní tachykardie. Diltiazem hydrochlorid tobolky s prodlouženým uvolňováním USP (dávkování jednou denně) snižuje vaskulární rezistenci, zvyšuje srdeční výdej (zvýšením tepového objemu); a způsobuje mírné snížení nebo žádnou změnu srdeční frekvence. Při dynamické zátěži je inhibováno zvýšení diastolického tlaku, zatímco maximální dosažitelný systolický tlak je obvykle snížen. Chronická léčba diltiazem hydrochloridem ve formě kapslí s prodlouženým uvolňováním USP (dávkování jednou denně) nezpůsobuje žádné změny nebo zvýšení plazmatických katecholaminů. Nebyla pozorována žádná zvýšená aktivita osy renin-angiotenzin-aldosteron. Kapsle s prodlouženým uvolňováním diltiazem hydrochloridu USP (dávka jednou denně) snižují renální a periferní účinky angiotensinu II. Hypertenzní zvířecí modely reagují na diltiazem snížením krevního tlaku a zvýšeným výdejem moči a natriurézou beze změny poměru sodík/draslík v moči.
Ve dvojitě zaslepené, paralelní studii závislosti odpovědi na dávce s dávkami od 60 mg do 480 mg jednou denně prodlužovala tobolka diltiazem hydrochloridu s prodlouženým uvolňováním (dávkování jednou denně) lineárně v průběhu celé dávky dobu do ukončení cvičení. studovaný rozsah. Zlepšení doby do ukončení cvičení s použitím cvičebního protokolu Bruce, měřeno na konci, pro placebo, 60 mg, 120 mg, 240 mg, 360 mg a 480 mg, bylo 29, 40, 56, 51, 69 a 68 sekund. , resp. Se zvýšením dávek tobolky s prodlouženým uvolňováním diltiazem hydrochloridu (dávka jednou denně) se snížila celková frekvence anginy pectoris. Diltiazem hydrochloridová kapsle s prodlouženým uvolňováním (dávka jednou denně), 180 mg jednou denně nebo placebo byly podávány ve dvojitě zaslepené studii pacientům, kteří dostávali souběžnou léčbu dlouhodobě působícími nitráty a/nebo beta-blokátory. Bylo pozorováno významné prodloužení doby do ukončení cvičení a významný pokles celkové frekvence anginy pectoris. V této studii byla celková frekvence nežádoucích účinků v léčebné skupině s diltiazem hydrochloridem s prodlouženým uvolňováním tobolky (dávka jednou denně) stejná jako ve skupině s placebem.
Intravenózní diltiazem v dávkách 20 mg prodlužuje dobu vedení AH a funkční a efektivní refrakterní periody AV uzlu přibližně o 20 %. Ve studii zahrnující jednorázové perorální dávky 300 mg diltiazem hydrochloridu u šesti normálních dobrovolníků bylo průměrné maximální prodloužení PR 14 % bez případů větší než AV blokády prvního stupně. Prodloužení AH intervalu spojené s diltiazemem není výraznější u pacientů se srdeční blokádou I. stupně. U pacientů se syndromem nemocného sinu diltiazem významně prodlužuje délku sinusového cyklu (v některých případech až o 50 %).
Chronické perorální podávání diltiazem hydrochloridu pacientům v dávkách až 540 mg/den vedlo k malému prodloužení PR intervalu a příležitostně způsobuje abnormální prodloužení (viz VAROVÁNÍ ).
Farmakokinetika a metabolismus
Diltiazem se dobře vstřebává z gastrointestinálního traktu a podléhá rozsáhlému first-pass efektu, což dává absolutní biologickou dostupnost (ve srovnání s intravenózním podáním) asi 40 %. Diltiazem podléhá rozsáhlému metabolismu, při kterém se v moči objeví pouze 2 až 4 % nezměněného léčiva. Léky, které indukují nebo inhibují jaterní mikrozomální enzymy, mohou změnit dispozici diltiazemu.
Měření celkové radioaktivity po krátké IV aplikaci u zdravých dobrovolníků naznačuje přítomnost dalších neidentifikovaných metabolitů, které dosahují vyšších koncentrací než diltiazem a jsou pomaleji eliminovány; poločas celkové radioaktivity je asi 20 hodin ve srovnání s 2 až 5 hodinami u diltiazemu.
Vazebné studie in vitro ukazují, že diltiazem se ze 70 až 80 % váže na plazmatické proteiny. Kompetitivní studie vazby ligandu in vitro také ukázaly, že vazba diltiazemu není ovlivněna terapeutickými koncentracemi digoxinu, hydrochlorothiazidu, fenylbutazonu, propranololu, kyseliny salicylové nebo warfarinu. Plazmatický eliminační poločas po jednorázovém nebo opakovaném podání léku je přibližně 3,0 až 4,5 hodiny. Desacetyl diltiazem je také přítomen v plazmě v hladinách 10 % až 20 % původního léčiva a je z 25 % až 50 % tak účinný jako koronární vazodilatátor jako diltiazem. Minimální terapeutické plazmatické koncentrace diltiazemu se zdají být v rozmezí 50 až 200 ng/ml. Při zvýšení síly dávky dochází k odklonu od linearity; poločas se mírně zvyšuje s dávkou. Studie, která porovnávala pacienty s normální funkcí jater a pacienty s cirhózou, zjistila prodloužení poločasu a 69% zvýšení biologické dostupnosti u pacientů s poškozením jater. Jediná studie u devíti pacientů s těžkou poruchou funkce ledvin neprokázala žádný rozdíl ve farmakokinetickém profilu diltiazemu ve srovnání s pacienty s normální funkcí ledvin.
Diltiazem hydrochloridové tobolky s prodlouženým uvolňováním (dávkování jednou denně)
Ve srovnání s režimem tablet diltiazemu v ustáleném stavu se více než 95 % léčiva absorbuje z formulace tobolek s prodlouženým uvolňováním diltiazem hydrochloridu (dávka jednou denně). Jediná 360mg dávka tobolky vede k detekovatelným plazmatickým hladinám během 2 hodin a maximálním plazmatickým hladinám mezi 10 a 14 hodinami; absorpce probíhá po celý dávkovací interval. Když byla tobolka s prodlouženým uvolňováním diltiazem hydrochloridu (dávka jednou denně) podávána společně se snídaní s vysokým obsahem tuku, rozsah absorpce diltiazemu nebyl ovlivněn. Dose-dumping se nevyskytuje. Zdánlivý eliminační poločas po jednorázovém nebo opakovaném podání je 5 až 8 hodin. Je pozorován odklon od linearity podobný tomu, který byl pozorován u tablet diltiazemu a kapslí hydrochloridu diltiazemu (dvakrát denně). Protože se dávka tobolek s prodlouženým uvolňováním diltiazem hydrochloridu (dávka jednou denně) zvyšuje z denní dávky 120 mg na 240 mg, dochází ke zvýšení plochy pod křivkou 2,7krát. Když se dávka zvýší z 240 mg na 360 mg, dojde ke zvýšení plochy pod křivkou 1,6krát.
INFORMACE PRO PACIENTA
Nebyly poskytnuty žádné informace. Podívejte se prosím na VAROVÁNÍ a OPATŘENÍ sekce.
