Micardis 20mg, 40mg, 80mg Telmisartan Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Micardis 40 mg a jak se používá?
Micardis je lék na předpis používaný k léčbě příznaků vysokého krevního tlaku (hypertenze) a ke snížení rizika kardiovaskulárních onemocnění, jako je mrtvice a srdeční infarkt. Micardis 20 mg lze užívat samostatně nebo s jinými léky.
Micardis 80 mg patří do třídy léků nazývaných ARB.
Není známo, zda je přípravek Micardis bezpečný a účinný u dětí mladších 18 let.
Jaké jsou možné vedlejší účinky přípravku Micardis?
Micardis 80 mg může způsobit závažné nežádoucí účinky, včetně:
- točení hlavy,
- otok,
- rychlý nárůst hmotnosti,
- nevolnost,
- slabost,
- štiplavý pocit,
- bolest na hrudi,
- nepravidelný srdeční tep a
- ztráta pohybu
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Micardis patří:
- ucpaný nos,
- bolest dutin,
- bolesti zad a
- průjem
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku Micardis. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
FETÁLNÍ TOXICITA
- Při zjištění těhotenství přerušte co nejdříve MICARDIS 40 mg [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
- Léky, které působí přímo na renin-angiotensinový systém, mohou způsobit zranění a smrt vyvíjejícího se plodu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
POPIS
MICARDIS 40 mg je nepeptidový antagonista receptoru angiotenzinu II (typ AT1).
Telmisartan je chemicky popsán jako 4'-[(1,4'-dimethyl-2'-propyl[2,6'-bi-1H-benzimidazol]-1'-yl)methyl ]-[l,l'-bifenyl]-2-karboxylová kyselina. Jeho empirický vzorec je C33H30N4O2, jeho molekulová hmotnost je 514,63 a jeho strukturní vzorec je:
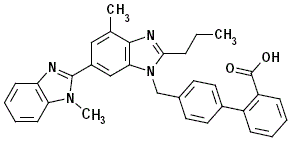
Telmisartan je bílá až slabě nažloutlá pevná látka. Je prakticky nerozpustný ve vodě a v rozmezí pH 3 až 9, málo rozpustný v silné kyselině (kromě nerozpustné v kyselině chlorovodíkové) a rozpustný v silné zásadě.
MICARDIS 20 mg je dostupný ve formě tablet pro perorální podání obsahující 20 mg, 40 mg nebo 80 mg telmisartanu. Tablety obsahují následující neaktivní složky: hydroxid sodný, meglumin, povidon, sorbitol a stearát hořečnatý. Tablety MICARDIS jsou hygroskopické a vyžadují ochranu před vlhkostí.
INDIKACE
MICARDIS HCT (telmisartan a hydrochlorothiazid) je indikován k léčbě hypertenze, ke snížení krevního tlaku. Snížení krevního tlaku snižuje riziko fatálních i nefatálních kardiovaskulárních příhod, především mozkových mrtvic a infarktů myokardu. Tyto přínosy byly pozorovány v kontrolovaných studiích antihypertenziv ze široké škály farmakologických tříd, včetně tříd, do kterých tento lék v zásadě patří. Neexistují žádné kontrolované studie prokazující snížení rizika s přípravkem MICARDIS HCT.
Kontrola vysokého krevního tlaku by měla být součástí komplexního řízení kardiovaskulárních rizik, včetně kontroly lipidů, léčby diabetu, antitrombotické léčby, odvykání kouření, cvičení a omezeného příjmu sodíku. Mnoho pacientů bude k dosažení cílů krevního tlaku potřebovat více než jeden lék. Konkrétní rady ohledně cílů a managementu naleznete v publikovaných pokynech, jako jsou pokyny Společného národního výboru pro prevenci, detekci, hodnocení a léčbu vysokého krevního tlaku (JNC) Národního vzdělávacího programu pro vysoký krevní tlak.
randomizovaných kontrolovaných studiích bylo prokázáno, že četná antihypertenziva z různých farmakologických tříd a s různými mechanismy účinku snižují kardiovaskulární morbiditu a mortalitu a lze dojít k závěru, že se jedná o snížení krevního tlaku a ne o některé další farmakologické vlastnosti. léky, které jsou z velké části zodpovědné za tyto výhody. Největším a nejkonzistentnějším kardiovaskulárním přínosem bylo snížení rizika cévní mozkové příhody, ale pravidelně bylo také pozorováno snížení infarktu myokardu a kardiovaskulární mortality.
Zvýšený systolický nebo diastolický tlak způsobuje zvýšené kardiovaskulární riziko a zvýšení absolutního rizika na mmHg je větší při vyšších krevních tlacích, takže i mírné snížení těžké hypertenze může poskytnout podstatný přínos. Snížení relativního rizika snížením krevního tlaku je v populacích podobné s různým absolutním rizikem, takže absolutní přínos je větší u pacientů s vyšším rizikem nezávisle na jejich hypertenzi (například pacienti s diabetem nebo hyperlipidémií), u takových pacientů by se dalo očekávat těžit z agresivnější léčby k cíli nižšího krevního tlaku.
Některá antihypertenziva mají menší účinky na krevní tlak (jako monoterapie) u černošských pacientů a mnoho antihypertenziv má další schválené indikace a účinky (např. na anginu pectoris, srdeční selhání nebo diabetické onemocnění ledvin). Tyto úvahy mohou vést k výběru terapie [viz Klinické studie ].
MICARDIS 40 mg HCT není indikován k počáteční léčbě hypertenze [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
MICARDIS HCT lze používat samostatně nebo v kombinaci s jinými antihypertenzivy.
DÁVKOVÁNÍ A PODÁVÁNÍ
Informace o dávkování
Zahajte léčbu pacienta, jehož krevní tlak není dostatečně kontrolován monoterapií telmisartanem 80 mg na MICARDIS 40 mg HCT, 80 mg/12,5 mg jednou denně. Dávku lze v případě potřeby titrovat až na 160 mg/25 mg po 2 až 4 týdnech.
Zahajte léčbu u pacienta, jehož krevní tlak není adekvátně kontrolován dávkou 25 mg hydrochlorothiazidu jednou denně nebo je kontrolován, ale trpí hypokalémií s tímto režimem na MICARDIS HCT 80 mg/12,5 mg jednou denně. Dávku lze v případě potřeby titrovat až na 160 mg/25 mg po 2 až 4 týdnech.
Pacienti titrovaní na jednotlivé složky (telmisartan a hydrochlorothiazid) mohou místo toho dostat odpovídající dávku přípravku MICARDIS 20 mg HCT.
MICARDIS 20 mg HCT lze podávat s jinými antihypertenzivy.
Úprava dávky pro jaterní poškození
pacientů s obstrukčními poruchami žlučových cest nebo jaterní insuficiencí zahajujte léčbu kombinací 40 mg/12,5 mg pod pečlivým lékařským dohledem. Tablety MICARDIS 40 mg HCT se nedoporučují u pacientů s těžkou poruchou funkce jater (viz Použití u konkrétních populací a KLINICKÁ FARMAKOLOGIE ].
Důležité pokyny pro administraci
Tablety MICARDIS HCT by měly být vyjmuty z blistrů až těsně před podáním.
JAK DODÁVÁNO
Dávkové formy A Síly
- 40 mg/12,5 mg, červené a bílé tablety označené logem Boehringer Ingelheim a H4
- 80 mg/12,5 mg, červené a bílé tablety označené logem Boehringer Ingelheim a H8
- 80 mg/25 mg, žlutobílé tablety označené logem Boehringer Ingelheim a H9
Skladování A Manipulace
MICARDIS 20 mg HCT je dostupný ve třech silách jako bikonvexní dvouvrstvé, podlouhlé, nepotahované tablety obsahující telmisartan a hydrochlorothiazid:
- 40 mg/12,5 mg tableta: červené a bílé (může obsahovat červené skvrny) označené symbolem společnosti Boehringer Ingelheim a H4; jednotlivě blistrově zatavené v krabičkách po 30 tabletách jako 3 x 10 karet ( NDC 0597-0043-37)
- 80 mg/12,5 mg tableta: červené a bílé (může obsahovat červené skvrny) označené symbolem společnosti Boehringer Ingelheim a H8; jednotlivě blistrově zatavené v krabičkách po 30 tabletách jako 3 x 10 karet ( NDC 0597-0044-37)
- 80 mg/25 mg tableta: žluté a bílé (může obsahovat žluté skvrny) označené symbolem společnosti Boehringer Ingelheim a H9; jednotlivě blistrově zatavené v krabičkách po 30 tabletách jako 3 x 10 karet ( NDC 0597-0042-37)
Úložný prostor
Skladujte při teplotě 25 °C (77 °F); povoleny výchylky do 15°C-30°C (59°F-86°F) [viz USP Regulovaná pokojová teplota]. Tablety by měly být vyjmuty z blistrů až těsně před podáním.
Distribuce: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 USA. Revize: říjen 2018
VEDLEJŠÍ EFEKTY
Následující nežádoucí účinky jsou diskutovány jinde v označení:
- Hypotenze [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Renální poškození [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Elektrolyty a metabolické poruchy [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Protože klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Bezpečnost přípravku MICARDIS HCT byla hodnocena u více než 1700 pacientů, včetně 716 léčených pro hypertenzi déle než 6 měsíců a 420 déle než 1 rok. Nežádoucí účinky byly omezeny na ty, které byly dříve hlášeny u telmisartanu a/nebo hydrochlorothiazidu.
Nežádoucí účinky vyskytující se s incidencí ≥ 2 % u pacientů léčených telmisartanem/hydrochlorothiazidem a ve vyšší míře než u pacientů léčených placebem, jsou uvedeny v tabulce 1 [viz Klinické studie ].
Další nežádoucí účinky pozorované u telmisartanu/hydrochlorothiazidu byly: bolest (včetně zad a břicha), dyspepsie, erytém, zvracení, bronchitida a faryngitida.
Nežádoucí účinky se vyskytovaly přibližně ve stejné míře u mužů a žen, u starších a mladších pacientů au pacientů černé a jiné rasy.
telmisartan
Další nežádoucí účinky, které byly hlášeny u telmisartanu, jsou uvedeny níže:
Autonomní nervový systém: impotence, zvýšené pocení, návaly horka
Tělo jako celek: alergie, horečka, bolest nohou, bolest na hrudi
Kardiovaskulární: palpitace, angina pectoris, abnormální EKG, hypertenze, periferní edém
Centrální nervový systém: nespavost, somnolence, migréna, parestézie, mimovolní svalové kontrakce, hypoestézie
Gastrointestinální: plynatost, zácpa, gastritida, sucho v ústech, hemoroidy, gastroezofageální reflux, bolest zubů
Hepato-biliární: zvýšení jaterních enzymů nebo sérového bilirubinu
Metabolické: dna, hypercholesterolémie, diabetes mellitus
Muskuloskeletální: artritida, artralgie, křeče nohou, myalgie
psychiatrické: úzkost, deprese, nervozita
Odporový mechanismus: infekce, absces, zánět středního ucha
Respirační: astma, rýma, dušnost, epistaxe
Kůže: dermatitida, ekzém, svědění
Močové: frekvence močení, cystitida
Cévní: cerebrovaskulární porucha
Speciální smysly: abnormální vidění, konjunktivitida, tinitus, bolest ucha
hydrochlorothiazid
Další nežádoucí účinky, které byly hlášeny u hydrochlorothiazidu, jsou uvedeny níže:
Tělo jako celek: slabost
Zažívací: pankreatitida, žloutenka (intrahepatální cholestatická žloutenka), sialadenitida, křeče, podráždění žaludku
Hematologické: aplastická anémie, agranulocytóza, leukopenie, hemolytická anémie, trombocytopenie
Přecitlivělost: purpura, fotosenzitivita, kopřivka, nekrotizující angiitida (vaskulitida a kožní vaskulitida), horečka, respirační potíže včetně pneumonitidy a plicního edému, anafylaktické reakce
Metabolické: hyperglykémie, glykosurie
Muskuloskeletální: svalový spasmus
Nervový systém/psychiatrický: neklid
Renální: intersticiální nefritida
Kůže: erythema multiforme včetně Stevens-Johnsonova syndromu, exfoliativní dermatitida včetně toxické epidermální nekrolýzy
Speciální smysly: přechodné rozmazané vidění, xanthopsie
Klinické laboratorní nálezy
Kreatinin, dusík močoviny v krvi (BUN)
Zvýšení BUN (≥11,2 mg/dl) a sérového kreatininu (≥0,5 mg/dl) bylo pozorováno u 2,8 % a 1,4 % pacientů s esenciální hypertenzí léčených tabletami MICARDIS 80 mg HCT v kontrolovaných studiích. Žádný pacient nepřerušil léčbu tabletami MICARDIS 80 mg HCT z důvodu zvýšení BUN nebo kreatininu (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během používání přípravku MICARDIS HCT po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Poruchy krve a lymfatického systému: eozinofilie
Srdeční poruchy: fibrilace síní, městnavé srdeční selhání, infarkt myokardu, tachykardie, bradykardie
Poruchy ucha a labyrintu: závrať
Obecné poruchy a podmínky v místě podání: astenie, edém
Hepato-biliární: Abnormální funkce jater/porucha jater
Poruchy imunitního systému: anafylaktická reakce
Infekce a nákazy: Infekce močových cest
Vyšetřování: zvýšené CPK
Poruchy metabolismu a výživy: hypoglykémie (u diabetiků)
Poruchy svalové a kosterní soustavy a pojivové tkáně: bolest šlach (včetně tendonitidy, tenosynovitidy), rhabdomyolýza
Poruchy nervového systému: synkopa, bolest hlavy
Poruchy ledvin a močových cest: selhání ledvin, poškození ledvin včetně akutního selhání ledvin
Poruchy reprodukčního systému a prsu: erektilní dysfunkce
Respirační, hrudní a mediastinální poruchy: kašel
Poruchy kůže a podkožní tkáně: léková erupce (toxická kožní erupce většinou hlášená jako toxikoderma, vyrážka a kopřivka), angioedém (s fatálním koncem)
Cévní porucha: ortostatická hypotenze
DROGOVÉ INTERAKCE
Činidla zvyšující sérový draslík
Současné podávání telmisartanu s jinými léky, které zvyšují hladiny draslíku v séru, může vést k hyperkalémii. U těchto pacientů monitorujte hladinu draslíku v séru.
Lithium
Při současném užívání thiazidových diuretik nebo antagonistů receptoru angiotenzinu II, včetně telmisartanu, bylo hlášeno zvýšení sérových koncentrací lithia a toxicita lithia. Monitorujte hladiny lithia u pacientů užívajících MICARDIS 80 mg HCT a lithium.
Nesteroidní protizánětlivé látky včetně selektivních inhibitorů Cyclooxygenas E-2
telmisartan
Nesteroidní protizánětlivé látky včetně selektivních inhibitorů cyklooxygenázy-2 (inhibitory COX-2): U pacientů, kteří jsou starší, s deplecí objemu (včetně těch, kteří jsou léčeni diuretiky) nebo mají sníženou funkci ledvin, je současné podávání NSAID, včetně selektivní inhibitory COX-2 spolu s ARB, včetně telmisartanu, mohou vést ke zhoršení funkce ledvin, včetně možného akutního selhání ledvin. Tyto účinky jsou obvykle reverzibilní. Antihypertenzní účinek ARB může být oslaben NSAID. Proto u pacientů užívajících MICARDIS 40 mg HCT a NSAID pravidelně sledujte renální funkce a krevní tlak.
hydrochlorothiazid
Podávání nesteroidních protizánětlivých látek, včetně selektivního inhibitoru COX2, může snížit diuretické, natriuretické a antihypertenzní účinky diuretik. Proto při současném užívání přípravku MICARDIS HCT a nesteroidních protizánětlivých látek včetně selektivních inhibitorů COX2 pečlivě sledujte, zda se dosáhne požadovaného účinku diuretika.
Dvojitá blokáda systému renin-angiotens v aldosteronu a změny funkce ledvin
Duální blokáda systému renin-angiotenzin-aldosteron (RAS) blokátory angiotenzinu, ACE inhibitory nebo aliskirenem je spojena se zvýšeným rizikem hypotenze, hyperkalemie a poškození ledvin. Do studie ONTARGET bylo zařazeno 25 620 pacientů ve věku ≥ 55 let s aterosklerotickým onemocněním nebo diabetem s poškozením koncových orgánů, přičemž byli randomizováni pouze na telmisartan (ARB), pouze ramipril (ACE inhibitor) nebo jejich kombinace a sledovali je po dobu mediánu 56 měsíců . Pacienti, kteří dostávali kombinaci ARB a ACE inhibitoru, nezískali žádný další přínos (žádné další snížení rizika kardiovaskulární smrti, infarktu myokardu, cévní mozkové příhody nebo hospitalizace v důsledku srdečního selhání) ve srovnání s monoterapií ARB nebo monoterapií inhibitorem ACE, ale zaznamenali zvýšený výskyt renální dysfunkce (např. akutní renální selhání) ve srovnání se skupinami s monoterapií.
Obecně se vyhněte kombinovanému užívání inhibitorů RAS. Pečlivě sledujte krevní tlak, renální funkce a elektrolyty u pacientů užívajících MICARDIS 40 mg HCT a další látky, které ovlivňují RAS.
Nepodávejte aliskiren současně s přípravkem MICARDIS HCT pacientům s diabetem. Vyhněte se současnému užívání aliskirenu s přípravkem MICARDIS HCT u pacientů s poruchou funkce ledvin (GFR
Digoxin
Když byl telmisartan podáván současně s digoxinem, byl pozorován střední nárůst maximální plazmatické koncentrace digoxinu (49 %) a minimální koncentrace (20 %). Monitorujte hladiny digoxinu u pacientů užívajících současně MICARDIS 40 mg HCT a digoxin.
Antidiabetika (perorální léky a inzulín)
Při současném podávání s hydrochlorothiazidem může být nutná úprava dávkování antidiabetik.
Cholestyramin A Kolestipolové Pryskyřice
Absorpce hydrochlorothiazidu je narušena v přítomnosti anexových pryskyřic. Rozložte dávku hydrochlorothiazidu a pryskyřice tak, aby se hydrochlorothiazid podával alespoň 4 hodiny před nebo 4 až 6 hodin po podání pryskyřice.
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Fetální toxicita
telmisartan
Užívání léků, které působí na renin-angiotensinový systém během druhého a třetího trimestru těhotenství, snižuje funkci ledvin plodu a zvyšuje fetální a neonatální morbiditu a úmrtí. Výsledný oligohydramnion může být spojen s hypoplazií plic plodu a deformacemi skeletu. Potenciální neonatální nežádoucí účinky zahrnují hypoplazii lebky, anurii, hypotenzi, selhání ledvin a smrt. Když je zjištěno těhotenství, přerušte léčbu přípravkem MICARDIS HCT co nejdříve.
hydrochlorothiazid
Thiazidy procházejí placentární bariérou a objevují se v pupečníkové krvi. Nežádoucí účinky zahrnují fetální nebo neonatální žloutenku a trombocytopenii [viz Použití u konkrétních populací ].
Hypotenze u pacientů s deplecí objemu nebo soli
pacientů s aktivovaným systémem renin-angiotenzin, jako jsou pacienti s deplecí objemu nebo solí (např. pacienti léčení vysokými dávkami diuretik), se po zahájení léčby přípravkem MICARDIS HCT může objevit symptomatická hypotenze. Upravte depleci objemu nebo soli před podáním přípravku MICARDIS 80 mg HCT.
Porucha funkce ledvin
Změny renálních funkcí včetně akutního renálního selhání mohou být způsobeny léky, které inhibují reninangiotensinový systém a diuretiky. Pacienti, jejichž funkce ledvin může částečně záviset na aktivitě renin-angiotenzinového systému (např. pacienti se stenózou renální arterie, chronickým onemocněním ledvin, těžkým městnavým srdečním selháním nebo deplecí objemu), mohou být zvláště ohroženi rozvojem oligurie, progresivní azotémie nebo akutní renální selhání na MICARDIS HCT. U těchto pacientů pravidelně sledujte renální funkce. Zvažte přerušení nebo přerušení léčby u pacientů, u kterých dojde ke klinicky významnému snížení renálních funkcí při léčbě přípravkem MICARDIS HCT.
Elektrolyty A Metabolické Poruchy
Léky, včetně telmisartanu, které inhibují renin-angiotensinový systém, mohou způsobit hyperkalémii, zejména u pacientů s renální insuficiencí, diabetem nebo v kombinaci s jinými blokátory angiotenzinových receptorů nebo ACE inhibitory a při současném užívání jiných léků, které zvyšují hladinu draslíku v séru (viz DROGOVÉ INTERAKCE ].
Hydrochlorothiazid může způsobit hypokalémii a hyponatrémii. Bylo prokázáno, že thiazidy zvyšují vylučování hořčíku močí; to může vést k hypomagnezémii. Hypomagnezémie může vést k hypokalémii, kterou může být obtížné léčit navzdory doplňování draslíku. Pravidelně sledujte sérové elektrolyty.
V kontrolovaných studiích využívajících kombinovanou léčbu telmisartan/hydrochlorothiazid žádný pacient, kterému bylo podáváno 40 mg/12,5 mg, 80 mg/12,5 mg nebo 80 mg/25 mg, nezaznamenal pokles draslíku ≥1,4 mEq/l a u žádného pacienta se nevyskytla hyperkalémie.
Hydrochlorothiazid snižuje vylučování vápníku močí a může způsobit zvýšení sérového vápníku.
Hydrochlorothiazid může změnit glukózovou toleranci a zvýšit sérové hladiny cholesterolu a triglyceridů.
U některých pacientů léčených thiazidy se může vyskytnout hyperurikémie nebo se může vyvolat dna. Protože telmisartan snižuje kyselinu močovou, telmisartan v kombinaci s hydrochlorothiazidem zmírňuje diuretiky indukovanou hyperurikémii.
Hypersenzitivní reakce
hydrochlorothiazid
Hypersenzitivní reakce na hydrochlorothiazid se mohou objevit u pacientů s nebo bez anamnézy alergie nebo bronchiálního astmatu, ale jsou pravděpodobnější u pacientů s takovou anamnézou (viz KONTRAINDIKACE ].
Akutní myopie a sekundární glaukom s uzavřeným úhlem
Hydrochlorothiazid, sulfonamid, může způsobit idiosynkratickou reakci vedoucí k akutní přechodné myopii a akutnímu glaukomu s uzavřeným úhlem. Symptomy zahrnují akutní nástup snížené zrakové ostrosti nebo bolesti oka a obvykle se objevují během hodin až týdnů po zahájení léčby. Neléčený akutní glaukom s uzavřeným úhlem může vést k trvalé ztrátě zraku. Primární léčbou je co nejrychlejší vysazení hydrochlorothiazidu. Pokud nitrooční tlak zůstává nekontrolovaný, může být nutné zvážit okamžitou lékařskou nebo chirurgickou léčbu. Rizikové faktory pro rozvoj akutního glaukomu s uzavřeným úhlem mohou zahrnovat anamnézu alergie na sulfonamidy nebo penicilin.
Systémový lupus erythematodes
Bylo hlášeno, že thiazidová diuretika způsobují exacerbaci nebo aktivaci systémového lupus erythematodes.
Pacienti po sympatektomii
Antihypertenzní účinky hydrochlorothiazidu mohou být zesíleny u pacientů po sympatektomii.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( INFORMACE PRO PACIENTA ).
Těhotenství
Informujte pacientky ve fertilním věku o důsledcích expozice přípravku MICARDIS 40 mg HCT během těhotenství. Diskutujte o možnostech léčby se ženami, které plánují otěhotnět. Řekněte pacientkám, aby co nejdříve hlásili těhotenství svým lékařům [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Laktace
Doporučte kojícím ženám, aby během léčby přípravkem MICARDIS HCT nekojily (viz Použití u konkrétních populací ].
Symptomatická hypotenze a synkopa
Upozorněte pacienty, že se může objevit závratě, zejména během prvních dnů léčby, a nahlaste to svému poskytovateli zdravotní péče. Informujte pacienty, že nedostatečný příjem tekutin, nadměrné pocení, průjem nebo zvracení může vést k nadměrnému poklesu krevního tlaku se stejnými následky jako závratě a možné synkopy. Poraďte pacientům, aby kontaktovali svého poskytovatele zdravotní péče, pokud se objeví synkopa [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Draslíkové doplňky
Informujte pacienty, aby nepoužívali doplňky draslíku nebo náhražky soli, které obsahují draslík, aniž by se poradili s předepisujícím poskytovatelem zdravotní péče [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a DROGOVÉ INTERAKCE ].
Akutní myopie a sekundární glaukom s uzavřeným úhlem
Poraďte pacientům, aby přerušili léčbu přípravkem MICARDIS 80 mg HCT a okamžitě vyhledali lékařskou pomoc, pokud se u nich objeví příznaky akutní myopie nebo sekundárního glaukomu s uzavřeným úhlem (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Telmisartan a hydrochlorothiazid
S kombinací telmisartanu a hydrochlorothiazidu nebyly provedeny žádné studie karcinogenity, mutagenity nebo fertility.
telmisartan
Při podávání telmisartanu ve stravě myším a potkanům po dobu až 2 let nebyla prokázána karcinogenita. Nejvyšší dávky podávané myším (1000 mg/kg/den) a potkanům (100 mg/kg/den) jsou na základě mg/m2 asi 59krát a 13krát vyšší než maximální doporučená dávka pro člověka (MRHD). telmisartan. Ukázalo se, že tyto stejné dávky poskytují průměrné systémové expozice telmisartanu >100krát a >25krát, v daném pořadí, než je systémová expozice u lidí, kteří dostávají MRHD telmisartanu (80 mg/den).
Testy genotoxicity neodhalily žádné účinky související s telmisartanem na genové ani chromozomové úrovni. Tyto testy zahrnovaly testy bakteriální mutagenity se Salmonella a E. coli (Ames), test genových mutací s buňkami V79 čínského křečka, cytogenetický test s lidskými lymfocyty a test mikrojader myší.
Při dávce 100 mg/kg/den (nejvyšší podaná dávka), přibližně 13násobku, na základě mg/m2, MRHD telmisartanu, nebyly zaznamenány žádné účinky související s léčivem na reprodukční schopnost samců a samic potkanů. Tato dávka u potkanů vedla k průměrné systémové expozici (AUC telmisartanu, jak byla stanovena 6. den březosti) alespoň 50násobku průměrné systémové expozice u lidí při MRHD (80 mg/den).
hydrochlorothiazid
Dvouleté studie krmení na myších a potkanech provedené pod záštitou Národního toxikologického programu (NTP) neodhalily žádné důkazy o karcinogenním potenciálu hydrochlorothiazidu u myších samic (v dávkách až přibližně 600 mg/kg/den) nebo u samců a samice potkanů (v dávkách až přibližně 100 mg/kg/den). NTP však našel nejednoznačný důkaz hepatokarcinogenity u samců myší.
Hydrochlorothiazid nebyl genotoxický in vitro v Amesově testu mutagenity Salmonella typhimurium kmenů TA 98, TA 100, TA 1535, TA 1537 a TA 1538 a v testu ovarií čínského křečka (CHO) na chromozomální aberace při použití in vivo. chromozomy myších zárodečných buněk, chromozomy kostní dřeně čínského křečka a pohlavně vázaný recesivní letální gen Drosophila. Pozitivní výsledky testu byly získány v in vitro testu CHO Sister Chromatid Exchange (klastogenicita), v testu na myších lymfomových buňkách (mutagenita) a v testu bez disjunkce Aspergillus nidulans.
Hydrochlorothiazid neměl žádné nepříznivé účinky na fertilitu myší a potkanů jakéhokoli pohlaví ve studiích, kde byly tyto druhy vystaveny prostřednictvím stravy dávkám až 100 a 4 mg/kg před pářením a během březosti.
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
MICARDIS HCT může způsobit poškození plodu, když je podáván těhotné ženě. Užívání léků působících na renin-angiotenzinový systém během druhého a třetího trimestru těhotenství snižuje funkci ledvin plodu a zvyšuje fetální a neonatální morbiditu a úmrtí (viz Klinické úvahy ). Většina epidemiologických studií zkoumajících abnormality plodu po expozici antihypertenzivum v prvním trimestru nerozlišuje léky ovlivňující renin-angiotensinový systém od jiných antihypertenziv. Studie s telmisartanem na potkanech a králících prokázaly fetotoxicitu pouze v dávkách toxických pro matku (viz Data ). Když je zjištěno těhotenství, přerušte léčbu přípravkem MICARDIS HCT co nejdříve.
Odhadované základní riziko závažných vrozených vad a potratu pro indikovanou populaci není známo. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 % až 4 % a 15 % až 20 %.
Klinické úvahy
Mateřské a/nebo embryo/fetální riziko spojené s onemocněním
Hypertenze v těhotenství zvyšuje u matky riziko preeklampsie, gestačního diabetu, předčasného porodu a porodních komplikací (např. nutnost císařského řezu a poporodní krvácení). Hypertenze zvyšuje riziko fetálního omezení intrauterinního růstu a intrauterinní smrti. Těhotné ženy s hypertenzí by měly být pečlivě sledovány a odpovídajícím způsobem léčeny.
Fetální/neonatální nežádoucí účinky
telmisartan
Užívání léků, které působí na RAS ve druhém a třetím trimestru těhotenství, může mít za následek následující: oligohydramnion, sníženou funkci ledvin plodu vedoucí k anurii a selhání ledvin, hypoplazii plic plodu, deformace skeletu, včetně hypoplazie lebky, hypotenzi a smrt . V neobvyklém případě, že u konkrétního pacienta neexistuje vhodná alternativa k léčbě léky ovlivňujícími renin-angiotensinový systém, informujte matku o potenciálním riziku pro plod.
U pacientek užívajících MICARDIS HCT během těhotenství proveďte sériová ultrazvuková vyšetření k posouzení intraamniotického prostředí. V závislosti na týdnu těhotenství může být vhodné fetální testování. Pokud je pozorován oligohydramnion, přerušte léčbu přípravkem MICARDIS HCT, pokud to není považováno za záchranu života matky. Pacienti a lékaři by si však měli být vědomi, že oligohydramnion se může objevit až poté, co plod utrpěl nevratné poranění.
Pečlivě sledujte kojence s anamnézou expozice přípravku MICARDIS 20 mg HCT in utero kvůli hypotenzi, oligurii a hyperkalémii. Pokud se objeví oligurie nebo hypotenze, podpořte krevní tlak a perfuzi ledvin. Výměnné transfuze nebo dialýza mohou být vyžadovány jako prostředek ke zvrácení hypotenze a nahrazení funkce ledvin [viz Použití u konkrétních populací ].
hydrochlorothiazid
Thiazidy procházejí placentou a užívání thiazidů během těhotenství je spojeno s rizikem fetální nebo neonatální žloutenky, trombocytopenie a možných dalších nežádoucích účinků, které se vyskytly u dospělých.
Data
Údaje o zvířatech
MICARDIS 40 mg HCT
Studie vývojové toxicity byla provedena na potkanech s dávkami telmisartanu/hydrochlorothiazidu 3,2/1,0, 15/4,7, 50/15,6 a 0/15,6 mg/kg/den. Ačkoli se dvě kombinace vyšších dávek jevily jako toxičtější (významné snížení přírůstku tělesné hmotnosti) pro samice než každý lék samostatně, nezdálo se, že by došlo ke zvýšení toxicity pro vyvíjející se embrya.
telmisartan
Nebyly pozorovány žádné teratogenní účinky, když byl telmisartan podáván březím potkanům v perorálních dávkách až 50 mg/kg/den a březím králíkům v perorálních dávkách až 45 mg/kg/den. U králíků byla pozorována letalita embryí spojená s mateřskou toxicitou (snížený přírůstek tělesné hmotnosti a spotřeba potravy) při dávce 45 mg/kg/den (přibližně 12násobek maximální doporučené dávky pro člověka [MRHD] 80 mg na bázi mg/m2). U potkanů byly pozorovány nežádoucí účinky v dávkách toxických pro matku (snížený přírůstek tělesné hmotnosti a konzumaci potravy) telmisartanu v dávce 15 mg/kg/den (přibližně 1,9násobek MRHD na bázi mg/m2), podávané během pozdní březosti a laktace. u novorozenců, včetně snížené životaschopnosti, nízké porodní hmotnosti, opožděného dospívání a sníženého přírůstku hmotnosti. Dávky bez pozorovaného účinku pro vývojovou toxicitu u potkanů a králíků, 5 a 15 mg/kg/den, v tomto pořadí, jsou přibližně 0,64 a 3,7krát, v tomto pořadí, na bázi mg/m2, MRHD telmisartanu (80 mg/den ).
hydrochlorothiazid
Studie, ve kterých byl hydrochlorothiazid podáván březím myším a potkanům během jejich příslušných období hlavní organogeneze v dávkách až 3 000 a 1 000 mg/kg/den, v daném pořadí (asi 600 a 400krát vyšší než MRHD), neprokázaly žádné poškození plodu. .
Thiazidy mohou procházet placentou a koncentrace dosažené v pupeční žíle se blíží koncentracím v mateřské plazmě. Hydrochlorothiazid, stejně jako jiná diuretika, může způsobit placentární hypoperfuzi. Akumuluje se v plodové vodě, přičemž udávané koncentrace jsou až 19krát vyšší než v plazmě z pupeční žíly. Užívání thiazidů během těhotenství je spojeno s rizikem fetální nebo neonatální žloutenky nebo trombocytopenie. Protože nezabraňují ani nemění průběh EPH (edém, proteinurie, hypertenze) gestózy (preeklampsie), neměly by se tyto léky používat k léčbě hypertenze u těhotných žen. Je třeba se vyhnout použití hydrochlorothiazidu pro jiné indikace (např. srdeční onemocnění) v těhotenství.
Laktace
Shrnutí rizik
Neexistují žádné informace o přítomnosti přípravku MICARDIS 20 mg HCT nebo telmisartanu v mateřském mléce, o účincích na kojené dítě nebo o účincích na produkci mléka. Omezené publikované studie uvádějí, že hydrochlorothiazid je přítomen v lidském mléce. K určení účinků hydrochlorothiazidu na kojené dítě nebo účinků hydrochlorothiazidu na produkci mléka však není dostatek informací. Telmisartan je přítomen v mléce kojících potkanů. (vidět Data ). Vzhledem k potenciálu závažných nežádoucích reakcí u kojeného dítěte, včetně hypotenze, hyperkalémie a poruchy funkce ledvin, doporučte kojící ženě, aby během léčby přípravkem MICARDIS HCT nekojila.
Data
Telmisartan byl přítomen v mléce kojících potkanů v koncentracích 1,5 až 2krát vyšších, než jsou koncentrace zjištěné v plazmě 4 až 8 hodin po podání.
Pediatrické použití
Bezpečnost a účinnost přípravku MICARDIS HCT u pediatrických pacientů nebyla stanovena.
Novorozenci s anamnézou in utero expozice MICARDIS HCT
Pokud se objeví oligurie nebo hypotenze, podpořte krevní tlak a perfuzi ledvin. Výměnné transfuze nebo dialýza mohou být nutné jako prostředek ke zvrácení hypotenze a/nebo náhradě poruchy funkce ledvin.
Geriatrické použití
kontrolovaných klinických studiích (n=1017) bylo přibližně 20 % pacientů léčených telmisartanem/hydrochlorothiazidem ve věku 65 let nebo starších a 5 % bylo ve věku 75 let nebo více. U těchto pacientů nebyly pozorovány žádné celkové rozdíly v účinnosti a bezpečnosti telmisartanu/hydrochlorothiazidu ve srovnání s mladšími pacienty. Jiné hlášené klinické zkušenosti neidentifikovaly rozdíly v odpovědích mezi staršími a mladšími pacienty, ale nelze vyloučit větší citlivost některých starších jedinců. Obecně by měl být výběr dávky pro staršího pacienta opatrný, obvykle začínající na spodní hranici dávkovacího rozmezí, což odráží vyšší frekvenci snížené funkce jater, ledvin nebo srdce a souběžných onemocnění nebo jiné lékové terapie.
Použití u pacientů s poruchou funkce jater
Pacienti s obstrukčními poruchami žlučových cest nebo jaterní insuficiencí by měli zahájit léčbu pod přísným lékařským dohledem kombinací 40 mg/12,5 mg.
telmisartan
Protože se většina telmisartanu vylučuje žlučí, lze u pacientů s obstrukčními poruchami žlučových cest nebo jaterní insuficiencí očekávat sníženou clearance a vyšší hladiny v krvi.
hydrochlorothiazid
Menší změny rovnováhy tekutin a elektrolytů mohou u pacientů s poruchou funkce jater nebo progresivním onemocněním jater vyvolat jaterní kóma.
Použití u pacientů s poruchou funkce ledvin
Bezpečnost a účinnost přípravku MICARDIS 40 mg HCT u pacientů s těžkou poruchou funkce ledvin (CrCl ≤ 30 ml/min) nebyla stanovena. U pacientů s těžkou poruchou funkce ledvin se MICARDIS 80 mg tablety HCT nedoporučuje. U pacientů s mírnou (CrCl 60 až 90 ml/min) nebo středně těžkou (CrCl 30 až 60 ml/min) poruchou funkce ledvin není nutná žádná úprava dávky.
PŘEDÁVKOVAT
telmisartan
předávkování telmisartanem u lidí jsou k dispozici omezené údaje. Nejpravděpodobnějšími projevy předávkování telmisartanem jsou hypotenze, závratě a tachykardie; bradykardie může nastat z parasympatické (vagální) stimulace. Pokud dojde k symptomatické hypotenzi, je třeba zahájit podpůrnou léčbu. Telmisartan nelze odstranit hemodialýzou.
hydrochlorothiazid
Nejčastější známky a příznaky pozorované u pacientů s předávkováním hydrochlorothiazidem jsou ty, které jsou způsobeny deplecí elektrolytů (hypokalémie, hypochlorémie, hyponatremie) a dehydratací v důsledku nadměrné diurézy. Pokud byl také podán digitalis, hypokalémie může zvýraznit srdeční arytmie. Stupeň, do kterého je hydrochlorothiazid odstraněn hemodialýzou, nebyl stanoven. Perorální LD hydrochlorothiazidu je vyšší než 10 g/kg u myší i potkanů.
KONTRAINDIKACE
MICARDIS HCT je kontraindikován:
- U pacientů, kteří jsou přecitlivělí na kteroukoli složku tohoto přípravku [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- pacientů s anurií.
- Pro současné podávání s aliskirenem u pacientů s diabetem [viz DROGOVÉ INTERAKCE ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
MICARDIS 40 mg HCT
MICARDIS 20 mg HCT je kombinací dvou léků s antihypertenzními vlastnostmi: thiazidového diuretika, hydrochlorothiazidu a blokátoru receptoru angiotenzinu II (ARB), telmisartanu.
telmisartan
Angiotenzin II vzniká z angiotenzinu I reakcí katalyzovanou angiotensin-konvertujícím enzymem (ACE, kinináza II). Angiotenzin II je hlavní presorické činidlo systému renin-angiotenzin s účinky, které zahrnují vazokonstrikci, stimulaci syntézy a uvolňování aldosteronu, srdeční stimulaci a renální reabsorpci sodíku. Telmisartan blokuje vazokonstrikční a aldosteronové sekreční účinky angiotensinu II selektivním blokováním vazby angiotenzinu II na receptor AT1 v mnoha tkáních, jako je hladký sval cév a nadledvinka. Jeho účinek je tedy nezávislý na drahách syntézy angiotenzinu II.
V mnoha tkáních se také nachází receptor AT2, ale není známo, že by AT2 byl spojen s kardiovaskulární homeostázou. Telmisartan má mnohem větší afinitu (>3 000krát) k receptoru AT1 než k receptoru AT2.
Telmisartan neinhibuje ACE (kininázu II), ani se neváže na jiné hormonální receptory nebo iontové kanály, o nichž je známo, že jsou důležité v kardiovaskulární regulaci, ani je neblokuje.
Blokáda receptoru angiotenzinu II inhibuje negativní regulační zpětnou vazbu angiotenzinu II na sekreci reninu, ale výsledná zvýšená aktivita plazmatického reninu a cirkulující hladiny angiotenzinu II nepřekonají účinek telmisartanu na krevní tlak.
hydrochlorothiazid
Hydrochlorothiazid je thiazidové diuretikum. Thiazidy ovlivňují renální tubulární mechanismy reabsorpce elektrolytů, přímo zvyšují vylučování sodné soli a chloridu v přibližně ekvivalentních množstvích. Nepřímo diuretický účinek hydrochlorothiazidu snižuje objem plazmy s následným zvýšením aktivity plazmatického reninu, zvýšením sekrece aldosteronu, zvýšením ztráty draslíku močí a snížením draslíku v séru. Spojení renin-aldosteron je zprostředkováno angiotensinem II, takže současné podávání ARB má tendenci zvrátit ztráty draslíku spojené s těmito diuretiky. Mechanismus antihypertenzního účinku thiazidů není zcela objasněn.
Farmakodynamika
telmisartan
U normálních dobrovolníků dávka telmisartanu 80 mg inhibovala presorickou odpověď na intravenózní infuzi angiotensinu II přibližně o 90 % při maximálních plazmatických koncentracích, přičemž přibližně 40 % inhibice přetrvávala po dobu 24 hodin.
Plazmatická koncentrace angiotenzinu II a aktivita plazmatického reninu se zvýšily v závislosti na dávce po jednorázovém podání telmisartanu zdravým subjektům a opakovaném podání pacientům s hypertenzí. Podání až 80 mg telmisartanu jednou denně zdravým subjektům neovlivnilo plazmatické koncentrace aldosteronu. Ve studiích s opakovanými dávkami u pacientů s hypertenzí nebyly pozorovány žádné klinicky významné změny v elektrolytech (sérovém draslíku nebo sodíku) nebo v metabolických funkcích (včetně sérových hladin cholesterolu, triglyceridů, HDL, LDL, glukózy nebo kyseliny močové).
Antihypertenzní účinky telmisartanu byly studovány v šesti placebem kontrolovaných klinických studiích zahrnujících celkem 1773 pacientů s mírnou až středně těžkou hypertenzí (diastolický krevní tlak 95 až 114 mmHg), z nichž 1031 bylo léčeno telmisartanem. Po podávání telmisartanu jednou denně byla velikost snížení krevního tlaku od výchozí hodnoty po odečtení placeba přibližně (SBP/DBP) 6-8/6 mmHg pro 20 mg, 9-13/6-8 mmHg pro 40 mg a 12 -13/7-8 mmHg pro 80 mg. Větší dávky (až 160 mg) zřejmě nezpůsobily další pokles krevního tlaku.
Nástup antihypertenzní aktivity nastává do 3 hodin, s maximálním snížením přibližně o 4 týdny. Při dávkách 20, 40 a 80 mg byl antihypertenzní účinek podávání telmisartanu jednou denně zachován po celý 24hodinový dávkovací interval.
30 pacientů s hypertenzí s normální funkcí ledvin léčených po dobu 8 týdnů telmisartanem 80 mg nebo telmisartanem 80 mg v kombinaci s hydrochlorothiazidem 12,5 mg nebyly žádné klinicky významné změny oproti výchozí hodnotě v průtoku krve ledvinami, rychlosti glomerulární filtrace, filtrační frakci, renovaskulární rezistenci, nebo clearance kreatininu.
hydrochlorothiazid
Po perorálním podání hydrochlorothiazidu začíná diuréza během 2 hodin, vrcholí přibližně za 4 hodiny a trvá přibližně 6 až 12 hodin.
Lékové interakce
hydrochlorothiazid
Alkohol, barbituráty nebo narkotika
Může dojít k zesílení ortostatické hypotenze.
Relaxanty kosterního svalstva
Možná zvýšená citlivost na svalová relaxancia, jako jsou deriváty kurare.
Kortikosteroidy, ACTH
Intenzivní deplece elektrolytů, zejména hypokalémie.
Presorické aminy (např. norepinefrin)
Možná snížená odezva na presorické aminy, ale ne dostatečná k vyloučení jejich použití.
Farmakokinetika
telmisartan
Vstřebávání:
Po perorálním podání je maximálních koncentrací (Cmax) telmisartanu dosaženo za 0,5 až 1 hodinu po podání. Jídlo mírně snižuje biologickou dostupnost telmisartanu se snížením plochy pod křivkou plazmatické koncentrace-čas (AUC) přibližně o 6 % při dávce 40 mg a přibližně o 20 % po dávce 160 mg. MICARDIS 20 mg HCT lze podávat s jídlem nebo bez jídla. Absolutní biologická dostupnost telmisartanu je závislá na dávce. Při 40 a 160 mg byla biologická dostupnost 42 %, respektive 58 %. Farmakokinetika telmisartanu s perorálně podávaným MICARDIS 20 mg je nelineární v rozmezí dávek 20 až 160 mg, s větším než proporcionálním zvýšením plazmatických koncentrací (Cmax a AUC) se zvyšujícími se dávkami. Telmisartan vykazuje bi-exponenciální kinetiku rozpadu s terminálním poločasem eliminace přibližně 24 hodin. Minimální plazmatické koncentrace telmisartanu při dávkování jednou denně jsou přibližně 10 % až 25 % maximálních plazmatických koncentrací. Telmisartan má index akumulace v plazmě 1,5 až 2,0 při opakovaném dávkování jednou denně.
Rozdělení:
Telmisartan se silně váže na plazmatické proteiny (>99,5 %), zejména na albumin a α1-kyselý glykoprotein. Vazba na plazmatické proteiny je konstantní v rozsahu koncentrací dosažených doporučenými dávkami. Distribuční objem telmisartanu je přibližně 500 litrů, což ukazuje na další tkáňovou vazbu.
Metabolismus:
Telmisartan je metabolizován konjugací za vzniku farmakologicky neaktivního acylglukuronidu; glukuronid původní sloučeniny je jediným metabolitem, který byl identifikován v lidské plazmě a moči. Po jedné dávce představuje glukuronid přibližně 11 % naměřené radioaktivity v plazmě. Izoenzymy cytochromu P450 se neúčastní metabolismu telmisartanu.
Odstranění:
Po intravenózním nebo perorálním podání telmisartanu značeného 14C byla většina podané dávky (>97 %) eliminována v nezměněné podobě stolicí prostřednictvím biliární exkrece; v moči byla nalezena pouze nepatrná množství (0,91 % a 0,49 % celkové radioaktivity).
Celková plazmatická clearance telmisartanu je >800 ml/min. Zdá se, že terminální poločas a celková clearance jsou nezávislé na dávce.
hydrochlorothiazid
Hydrochlorothiazid není metabolizován, ale je rychle vylučován ledvinami. Pokud byly plazmatické hladiny sledovány po dobu alespoň 24 hodin, bylo pozorováno, že plazmatický poločas kolísá mezi 5,6 a 14,8 hodinami. Nejméně 61 % perorálně podané dávky se vyloučí v nezměněné podobě do 24 hodin.
Hydrochlorothiazid prochází placentou, ale ne hematoencefalickou bariérou, a je vylučován do mateřského mléka.
Specifické populace
telmisartan
Renální insuficience
Telmisartan se z krve neodstraňuje hemofiltrací [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , a Použití u konkrétních populací ].
Jaterní nedostatečnost
U pacientů s jaterní insuficiencí jsou plazmatické koncentrace telmisartanu zvýšené a absolutní biologická dostupnost se blíží 100 % (viz Použití u konkrétních populací ].
Rod
Plazmatické koncentrace telmisartanu jsou obecně 2 až 3krát vyšší u žen než u mužů. V klinických studiích však nebylo u žen zjištěno žádné významné zvýšení odpovědi krevního tlaku nebo výskytu ortostatické hypotenze. Není nutná žádná úprava dávkování.
Geriatričtí pacienti
Farmakokinetika telmisartanu se neliší u starších osob a osob mladších 65 let.
Studie lékových interakcí
telmisartan
Ramipril
Současné podávání telmisartanu 80 mg jednou denně a ramiprilu 10 mg jednou denně zdravým subjektům zvyšuje v ustáleném stavu Cmax a AUC ramiprilu 2,3krát a 2,1krát a Cmax a AUC ramiprilátu 2,4krát a 1,5krát, v tomto pořadí . Naproti tomu Cmax a AUC telmisartanu klesají o 31 %, resp. 16 %. Při současném podávání telmisartanu a ramiprilu může být odpověď vyšší kvůli možným aditivním farmakodynamickým účinkům kombinovaných léků a také kvůli zvýšené expozici ramiprilu a ramiprilátu v přítomnosti telmisartanu.
Jiné drogy
Současné podávání telmisartanu nevedlo ke klinicky významné interakci s acetaminofenem, amlodipinem, glyburidem, simvastatinem, hydrochlorothiazidem, warfarinem nebo ibuprofenem. Telmisartan není metabolizován systémem cytochromu P450 a neměl in vitro žádné účinky na enzymy cytochromu P450, s výjimkou určité inhibice CYP2C19. Neočekává se, že by telmisartan interagoval s léky, které inhibují enzymy cytochromu P450; také se neočekává interakce s léky metabolizovanými enzymy cytochromu P450, s výjimkou možné inhibice metabolismu léků metabolizovaných CYP2C19.
Klinické studie
Telmisartan a hydrochlorothiazid
kontrolovaných klinických studiích s více než 2500 pacienty s hypertenzí bylo 1017 pacientů vystaveno telmisartanu (20 mg až 160 mg) a současně hydrochlorothiazidu (6,25 mg až 25 mg). Tyto studie zahrnovaly jednu faktoriální studii (studie 1) s kombinacemi telmisartanu (20 mg, 40 mg, 80 mg, 160 mg nebo placebo) a hydrochlorothiazidu (6,25 mg, 12,5 mg, 25 mg a placeba). Faktoriální studie randomizovala 818 pacientů, včetně 493 (60 %) mužů; 596 (73 %) nečernochů a 222 (27 %) černochů; a 143 (18 %) ≥65 let (střední věk byl 53 let). Průměrný krevní tlak vleže na začátku pro celou populaci byl 154/101 mmHg.
Kombinace telmisartanu a hydrochlorothiazidu vedla k aditivnímu poklesu systolického a diastolického krevního tlaku při minimálních hodnotách 16-21/9-11 mmHg při dávkách mezi 40 mg/12,5 mg a 80 mg/25 mg, ve srovnání s 9-13. /7-8 mmHg pro telmisartan 40 mg až 80 mg v monoterapii a 4/4 mmHg pro monoterapii hydrochlorothiazidem 12,5 mg. Antihypertenzní účinek byl nezávislý na věku nebo pohlaví. V placebem kontrolované studii nedošlo v podstatě k žádné změně srdeční frekvence u pacientů léčených kombinací telmisartanu a hydrochlorothiazidu.
Čtyři další studie s hypertenzními pacienty trvající alespoň šest měsíců umožnily přidání hydrochlorothiazidu pacientům, kteří buď nebyli dostatečně kontrolováni randomizovanou dávkou telmisartanu v monoterapii, nebo nedosáhli adekvátní odpovědi krevního tlaku po dokončení titrace telmisartanu nahoru. Ve studiích kontrolovaných aktivní látkou přidání 12,5 mg hydrochlorothiazidu k titrovaným dávkám telmisartanu u pacientů, kteří nedosáhli nebo neudrželi adekvátní odpověď na monoterapii telmisartanem, dále snížilo systolický a diastolický krevní tlak.
INFORMACE PRO PACIENTA
MICARDIS® HCT (my-CAR-dis HCT) (telmis artan a hydrochlorothiazid) Tablety
Přečtěte si tyto informace pro pacienty dříve, než začnete užívat tablety MICARDIS HCT a pokaždé, když dostanete náhradní náplň. Mohou se objevit nové informace. Tyto informace nenahrazují rozhovor s lékařem o vašem zdravotním stavu nebo vaší léčbě.
Jaké jsou nejdůležitější informace, které bych měl vědět o tabletách MICARDIS 20 mg HCT?
MICARDIS HCT může způsobit poškození nebo smrt nenarozeného dítěte. Pokud plánujete otěhotnět, poraďte se se svým lékařem o dalších způsobech, jak snížit krevní tlak. Pokud otěhotníte během užívání přípravku MICARDIS 20 mg HCT, informujte ihned svého lékaře.
Co je MICARDIS HCT?
MICARDIS 40 mg HCT je lék na předpis používaný k léčbě vysokého krevního tlaku (hypertenze).
MICARDIS 40 mg HCT obsahuje:
- telmisartan, blokátor receptoru pro angiotenzin (ARB)
- hydrochlorothiazid, vodní pilulka nebo diuretikum
Váš lékař Vám může předepsat další léky, které budete užívat spolu s přípravkem MICARDIS 80 mg HCT k léčbě vysokého krevního tlaku.
Není známo, zda je přípravek MICARDIS 40 mg HCT bezpečný a účinný u dětí.
Neužívejte MICARDIS 20 mg tablety HCT, pokud:
- mají nízký nebo žádný výdej moči
- jste alergický/á (přecitlivělý/á) na léčivé látky (telmisartan nebo hydrochlorothiazid) nebo na kteroukoli další složku uvedenou na konci této příbalové informace
Co bych měl říci svému lékaři před použitím MICARDIS 40 mg HCT tablety?
Než začnete MICARDIS 20 mg HCT tablety užívat, informujte svého lékaře, pokud:
- jste těhotná nebo těhotenství plánujete. Vidět "Jaké jsou nejdůležitější informace, které bych měl vědět o tabletách MICARDIS 20 mg HCT?"
- kojíte nebo plánujete kojit. MICARDIS 80 mg HCT může přecházet do vašeho mateřského mléka a může poškodit vaše dítě. Vy a váš lékař byste se měli rozhodnout, zda budete MICARDIS HCT užívat nebo kojit. Neměli byste dělat obojí. Poraďte se se svým lékařem o nejlepším způsobu krmení dítěte, pokud užíváte tablety MICARDIS HCT.
- Vám bylo řečeno, že máte abnormální hladiny tělesné soli (elektrolytů) v krvi
- mít problémy s játry
- máte astma nebo astma v anamnéze
- mít lupus
- mít cukrovku
- mít problémy s ledvinami
- mít jiné zdravotní potíže
Informujte svého lékaře o všech lécích, které užíváte, včetně léků na předpis i bez předpisu, vitamínů a bylinných doplňků. Také informujte svého lékaře, pokud pijete alkohol.
MICARDIS 20 mg HCT může ovlivnit účinek jiných léků a jiné léky mohou ovlivnit účinek přípravku MICARDIS 20 mg HCT. Zejména informujte svého lékaře, pokud užíváte:
- aliskiren
- digoxin (Lanoxin®)
- lithium (Lithobid®, uhličitan lithný, citrát lithný)
- jiné léky používané k léčbě vysokého krevního tlaku nebo srdečních potíží
- pilulky na vodu (diuretikum)
- aspirin nebo jiné nesteroidní protizánětlivé léky (NSAID)
- doplňky draslíku nebo náhražky soli obsahující draslík
- léky používané k léčbě cukrovky, včetně inzulínu
- léky proti narkotické bolesti
- prášky na spaní
- steroidní léky nebo adrenokortikotropní hormon (ACTH)
- barbituráty
- některé léky na snížení cholesterolu (pryskyřice, které se používají ke snížení cholesterolu, např. cholestyramin a colestipolové pryskyřice)
Zeptejte se svého lékaře, pokud si nejste jisti, zda užíváte některý z výše uvedených léků.
Znát léky, které užíváte. Uchovávejte si jejich seznam a ukažte jej svému lékaři nebo lékárníkovi, když dostanete nový lék.
Jak mám tablety MICARDIS HCT užívat?
- Užívejte MICARDIS 40 mg HCT tablety přesně podle pokynů svého lékaře.
- Váš lékař Vám řekne, jaké množství přípravku MICARDIS HCT máte užívat a kdy jej máte užívat.
- Neměňte svou dávku, pokud vám to neřekne lékař.
- Užívejte MICARDIS HCT jednou denně.
- Tablety MICARDIS 20 mg HCT užívejte s jídlem nebo bez jídla.
- Jestliže jste užil(a) příliš mnoho přípravku MICARDIS HCT, zavolejte svého lékaře nebo jděte ihned na pohotovost v nejbližší nemocnici.
- Číst „Jak otevřít blistr“ na konci této příbalové informace dříve, než začnete přípravek MICARDIS 20 mg HCT používat. Pokud pokynům nerozumíte, poraďte se se svým lékařem.
Jaké jsou možné vedlejší účinky přípravku MICARDIS 80 mg HCT tablety?
MICARDIS 20 mg HCT tablety mohou způsobit závažné nežádoucí účinky, včetně:
- Zranění nebo smrt vašeho nenarozeného dítěte. Vidět "Jaké jsou nejdůležitější informace, které bych měl vědět o tabletách MICARDIS HCT?"
- Nízký krevní tlak (hypotenzní ionty) se s největší pravděpodobností stane, pokud také:
- užívat léky na odvodnění (diuretika)
- jsou na dietě s nízkým obsahem soli
- získat dialyzační léčbu
- mít problémy se srdcem
- onemocnět zvracením nebo průjmem
- nepijte dostatek tekutin
- hodně se potit
- Problémy s ledvinami, která se může zhoršit, pokud již máte onemocnění ledvin. Můžete mít změny ve výsledcích testů ledvin a možná budete potřebovat nižší dávku přípravku MICARDIS 40 mg tablety HCT. Zavolejte svého lékaře, pokud se u Vás objeví:
- otoky nohou, kotníků nebo rukou
- nevysvětlitelný přírůstek hmotnosti
- Problémy s játry, což se může zhoršit u lidí, kteří již mají problémy s játry a užívají MICARDIS 40 mg HCT.
- Oční problémy. Jeden z léků v přípravku MICARDIS HCT může způsobit oční problémy, které mohou vést ke ztrátě zraku. Příznaky očních problémů se mohou objevit během hodin až týdnů po zahájení léčby přípravkem MICARDIS
HCT. Okamžitě informujte svého lékaře, pokud máte:
- snížení vidění
- bolest očí
- Alergické reakce . Okamžitě informujte svého lékaře, pokud se u Vás objeví některý z těchto příznaků:
- otok obličeje, jazyka, hrdla
- potíže s dýcháním
- Zhoršuje se lupus. Informujte svého lékaře, pokud se Váš lupus během užívání přípravku MICARDIS 20 mg HCT zhorší nebo se stane aktivním.
- Změna hladiny tělesných solí (elektrolytů) v krvi a problémy s tekutinami. Váš lékař může provést testy, aby zkontroloval vaši krev. Okamžitě zavolejte svého lékaře, pokud máte:
- suchá ústa
- žízeň
- únava
- ospalost
- neklid
- zmatek
- záchvaty
- rychlé tlukoty srdce
- slabost
- svalové bolesti nebo křeče
- velmi nízký výdej moči
- nevolnost nebo zvracení
Pokud máte pocit na omdlení nebo závratě, lehněte si a ihned zavolejte svého lékaře.
Okamžitě zavolejte svého lékaře, pokud se u Vás objeví některý z výše uvedených příznaků.
Mezi nejčastější nežádoucí účinky přípravku MICARDIS 80 mg tablety HCT patří:
- infekce horních cest dýchacích, včetně bolesti/překrvení dutin a bolesti v krku
- závrať
- cítit se unaveně
- příznaky podobné chřipce
- bolesti zad
- průjem
- nevolnost
Toto nejsou všechny možné vedlejší účinky přípravku MICARDIS 20 mg HCT tablety. Informujte svého lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje. Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám uchovávat tablety MICARDIS 80 mg HCT?
- Tablety MICARDIS HCT skladujte při pokojové teplotě 68 °F až 77 °F (20 °C až 25 °C).
- Nevyjímejte tablety MICARDIS 40 mg HCT z blistrů, dokud je neužijete.
Uchovávejte MICARDIS 80 mg HCT tablety a všechny léky mimo dosah dětí.
Obecné informace o tabletách MICARDIS 40 mg HCT:
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v příbalové informaci pro pacienty. Neužívejte tablety MICARDIS HCT pro stav, pro který nebyl předepsán. Nedávejte MICARDIS 20 mg HCT tablety jiným lidem, i když mají stejné onemocnění jako vy. Může jim to ublížit.
Tento leták s informacemi pro pacienty shrnuje nejdůležitější informace o tabletách MICARDIS HCT. Pokud chcete více informací, promluvte si se svým lékařem. Můžete požádat svého lékárníka nebo lékaře o informace o tabletách MICARDIS 20 mg HCT, které jsou určeny pro zdravotníky.
Pro aktuální informace o předepisování naskenujte níže uvedený kód nebo zavolejte společnosti Boehringer Ingelheim Pharmaceuticals, Inc. na číslo 1-800-542-6257 nebo (TTY) 1-800-459-9906.
Jaké jsou složky v tabletách MICARDIS 20 mg HCT?
Aktivní složky: telmisartan a hydrochlorothiazid
Neaktivní složky: hydroxid sodný, meglumin, povidon, sorbitol, magnesium-stearát, monohydrát laktózy, mikrokrystalická celulóza, kukuřičný škrob a sodná sůl glykolátu škrobu
Tablety 40 mg/12,5 mg a 80 mg/12,5 mg také obsahují: červený oxid železitý.
Tablety 80 mg/25 mg také obsahují: žlutý oxid železitý.
Co je vysoký krevní tlak (hypertenze)?
Krevní tlak je síla ve vašich krevních cévách, když vaše srdce bije a když vaše srdce odpočívá. Máte vysoký krevní tlak, když je síla příliš velká. Léky, které snižují váš krevní tlak, snižují riziko mrtvice nebo srdečního infarktu.
Vysoký krevní tlak způsobuje, že srdce hůře pumpuje krev tělem a způsobuje poškození krevních cév. Tablety MICARDIS 80 mg HCT mohou pomoci uvolnit krevní cévy a snížit tak krevní tlak.
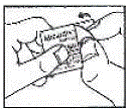
Jak otevřít blistr:
Tyto informace pro pacienty byly schváleny americkým Úřadem pro kontrolu potravin a léčiv.
