Plavix 75mg Clopidogrel Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Plavix 75 mg a jak se používá?
Plavix 75 mg je léčivý přípravek na předpis používaný k léčbě příznaků akutního koronárního syndromu, jako je mrtvice, krevní sraženina nebo závažné srdeční problémy po srdečním infarktu, silná bolest na hrudi nebo problémy s krevním oběhem. Plavix 75 mg lze užívat samostatně nebo s jinými léky.
Plavix 75 mg patří do třídy léků nazývaných protidestičkové látky, kardiovaskulární látky, protidestičkové látky, hematologie.
Není známo, zda je Plavix bezpečný a účinný u dětí.
Jaké jsou možné nežádoucí účinky přípravku Plavix 75 mg?
Plavix 75 mg může způsobit závažné nežádoucí účinky, včetně:
- bledá kůže,
- snadná tvorba modřin,
- fialové skvrny pod kůží nebo v ústech,
- zežloutnutí kůže nebo očí (žloutenka),
- rychlé tepy,
- dušnost,
- bolest hlavy,
- horečka,
- slabost,
- cítit se unaveně,
- malé nebo žádné močení,
- záchvat (křeče),
- náhlá necitlivost nebo slabost,
- zmatek a
- problémy se zrakem nebo řečí
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Plavix patří:
- zvýšené krvácení,
- krvácení z nosu,
- bolesti hlavy,
- svědění a
- modřiny
VAROVÁNÍ
SNÍŽENÝ ANTIPLIMATICKÝ ÚČINEK U PACIENTŮ SE DVĚMA ALELAMI ZTRÁTY FUNKCE GENU CYP2C19
Účinnost přípravku Plavix 75 mg vyplývá z jeho protidestičkové aktivity, která je závislá na jeho přeměně na aktivní metabolit systémem cytochromu P450 (CYP), hlavně CYP2C19 [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , KLINICKÁ FARMAKOLOGIE ]. Plavix v doporučených dávkách tvoří méně aktivního metabolitu, a tak má snížený účinek na aktivitu krevních destiček u pacientů, kteří jsou homozygotní pro nefunkční alely genu CYP2C19 (nazývané „špatní metabolizátoři CYP2C19“). K dispozici jsou testy k identifikaci pacientů, kteří jsou pomalými metabolizátory CYP2C19 [viz KLINICKÁ FARMAKOLOGIE ]. Zvažte použití jiného inhibitoru trombocytárního P2Y12 u pacientů identifikovaných jako pomalí metabolizátoři CYP2C19.
POPIS
Plavix (klopidogrel bisulfát) je thienopyridinový inhibitor receptorů krevních destiček P2Y12 ADP. Chemicky se jedná o methyl (+)-(S)-a-(2-chlorfenyl)-6,7-dihydrothieno[3,2-c]pyridin-5(4H)-acetát sulfát (1:1). Empirický vzorec clopidogrel bisulfátu je C16H16ClNO2S•H2SO4 a jeho molekulová hmotnost je 419,9. Strukturní vzorec je následující:

Clopidogrel bisulfát je bílý až téměř bílý prášek. Je prakticky nerozpustný ve vodě při neutrálním pH, ale volně rozpustný při pH 1. Je také volně rozpustný v methanolu, těžce se rozpouští v methylenchloridu a je prakticky nerozpustný v ethyletheru. Má specifickou optickou rotaci asi +56°.
Plavix pro perorální podání je poskytován buď jako růžové, kulaté, bikonvexní, vyražené, potahované tablety obsahující 97,875 mg clopidogrel bisulfátu, což je molární ekvivalent 75 mg báze klopidogrelu, nebo růžové, podlouhlé, vyražené potahované tablety obsahující 391,5 mg clopidogrel bisulfátu, což je molární ekvivalent 300 mg klopidogrelové báze.
Každá tableta obsahuje hydrogenovaný ricinový olej, hydroxypropylcelulózu, mannitol, mikrokrystalickou celulózu a polyethylenglykol 6000 jako neúčinné složky. Růžový filmový povlak obsahuje oxid železitý, hypromelózu 2910, monohydrát laktózy, oxid titaničitý a triacetin. Tablety jsou leštěné karnaubským voskem.
INDIKACE
Akutní koronární syndrom (ACS)
- Plavix 75 mg je indikován ke snížení četnosti infarktu myokardu (MI) a cévní mozkové příhody u pacientů s AKS bez elevace ST segmentu (nestabilní angina pectoris [UA]/infarkt myokardu bez elevace ST [NSTEMI]), včetně pacientů, kteří mají být léčeni lékařsky a ti, kteří mají být léčeni koronární revaskularizací. Plavix 75 mg by měl být podáván společně s aspirinem.
- Plavix je indikován ke snížení četnosti infarktu myokardu a cévní mozkové příhody u pacientů s akutním infarktem myokardu s elevací ST (STEMI), kteří mají být léčeni lékařsky. Plavix 75 mg by měl být podáván společně s aspirinem.
Nedávný infarkt myokardu, nedávná mrtvice nebo prokázaná periferní arteriální choroba
U pacientů s prokázaným onemocněním periferních tepen nebo s anamnézou nedávného infarktu myokardu (IM) nebo nedávné cévní mozkové příhody je Plavix 75 mg indikován ke snížení četnosti IM a cévní mozkové příhody.
DÁVKOVÁNÍ A PODÁVÁNÍ
Akutní koronární syndrom
pacientů, kteří potřebují protidestičkový účinek během několika hodin, zahajte Plavix jednorázovou perorální nasycovací dávkou 300 mg a poté pokračujte dávkou 75 mg jednou denně. Zahájení léčby Plavixem 75 mg bez nasycovací dávky oddálí vznik protidestičkového účinku o několik dní (viz KLINICKÁ FARMAKOLOGIE a Klinické studie ].
Nedávný infarkt myokardu, nedávná mrtvice nebo prokázaná periferní arteriální choroba
75 mg jednou denně perorálně bez nasycovací dávky [viz KLINICKÁ FARMAKOLOGIE a Klinické studie ].
JAK DODÁVÁNO
Dávkové formy A Síly
- 75 mg tablety: růžové, kulaté, bikonvexní, potahované tablety s vyraženým „75“ na jedné straně a „1171“ na druhé
- 300 mg tablety: růžové, podlouhlé, potahované tablety s vyraženým „300“ na jedné straně a „1332“ na druhé
Skladování A Manipulace
Plavix (klopidogrel bisulfát) 75 mg tablety jsou dostupné jako růžové, kulaté, bikonvexní, potahované tablety s vyraženým „75“ na jedné straně a „1171“ na druhé straně. Tablety se dodávají následovně:
NDC 63653-1171-6 Láhve po 30 NDC 63653-1171-1 Láhve po 90 NDC 63653-1171-5 Láhve po 500 NDC 63653-1171-3 Blistry po 100 ks
Plavix (klopidogrel bisulfát) 300 mg tablety jsou dostupné jako růžové, podlouhlé, potahované tablety s vyraženým „300“ na jedné straně a „1332“ na druhé straně. Tablety se dodávají následovně:
NDC 63653-1332-2 Jednodávkové balení po 30
Skladujte při teplotě 25 °C (77 °F); povoleny výchylky do 15°C-30°C (59°F-86°F) [viz USP řízená pokojová teplota ].
Distribuce: Bristol-Myers Squibb/Sanofi Pharmaceuticals Partnership, Bridgewater, NJ 08807. Revize: březen 2021
VEDLEJŠÍ EFEKTY
Následující závažné nežádoucí účinky jsou diskutovány níže a jinde v označení:
- Krvácení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Trombotická trombocytopenická purpura [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi rozdílných podmínek a trvání sledování, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Bezpečnost Plavixu byla hodnocena u více než 54 000 pacientů, včetně více než 21 000 pacientů léčených po dobu jednoho roku nebo déle. Klinicky významné nežádoucí účinky pozorované ve studiích porovnávajících Plavix 75 mg plus aspirin s placebem plus aspirinem a ve studiích porovnávajících Plavix samotný se samotným aspirinem jsou diskutovány níže.
Krvácející
LÉK
Ve studii CURE bylo užívání Plavixu s aspirinem spojeno se zvýšením velkého krvácení (především gastrointestinálního a v místech vpichu) ve srovnání s placebem s aspirinem (viz tabulka 1). Výskyt intrakraniálního krvácení (0,1 %) a fatálního krvácení (0,2 %) byl v obou skupinách stejný. Další krvácivé příhody, které byly hlášeny častěji ve skupině s klopidogrelem, byly epistaxe, hematurie a modřiny.
Celkový výskyt krvácení je popsán v tabulce 1.
SPÁCHAT
Ve studii COMMIT byly pozorovány podobné četnosti závažného krvácení ve skupinách s Plavixem 75 mg a placebem, které obě také dostávaly aspirin (viz tabulka 2).
CAPRIE (Plavix vs Aspirin)
Ve studii CAPRIE se gastrointestinální krvácení vyskytlo v míře 2,0 % u pacientů užívajících Plavix 75 mg oproti 2,7 % u pacientů užívajících aspirin; krvácení vyžadující hospitalizaci se vyskytlo v 0,7 %, resp. 1,1 %. Incidence intrakraniálního krvácení byla 0,4 % u Plavixu ve srovnání s 0,5 % u aspirinu.
Další krvácivé příhody, které byly hlášeny častěji ve skupině s Plavixem 75 mg, byly epistaxe a hematom.
Jiné nežádoucí příhody
Ve studiích CURE a CHARISMA, které porovnávaly Plavix plus aspirin se samotnou aspirinem, nebyl mezi Plavixem a placebem žádný rozdíl v četnosti nežádoucích účinků (jiných než krvácení).
Ve studii CAPRIE, která porovnávala Plavix 75 mg s aspirinem, bylo svědění častěji hlášeno u pacientů užívajících Plavix. Nebyl hlášen žádný jiný rozdíl v četnosti nežádoucích účinků (jiných než krvácení).
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během užívání Plavixu po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace neznámé velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
U pacientů léčených Plavixem byla hlášena krvácení, včetně těch s fatálním koncem.
- Poruchy krve a lymfatického systému: Agranulocytóza, aplastická anémie/pancytopenie, trombotická trombocytopenická purpura (TTP), získaná hemofilie A
- Gastrointestinální poruchy: Kolitida (včetně ulcerózní nebo lymfocytární kolitidy), pankreatitida, stomatitida, žaludeční/duodenální vřed, průjem
- Celkové poruchy a reakce v místě aplikace: Horečka
- Poruchy jater a žlučových cest: Akutní selhání jater, hepatitida (neinfekční), abnormální jaterní testy
- Poruchy imunitního systému: Hypersenzitivní reakce, anafylaktoidní reakce, sérová nemoc, inzulinový autoimunitní syndrom, které mohou vést k těžké hypoglykémii
- Poruchy svalové a kosterní soustavy, pojivové tkáně a kostí: Myalgie, artralgie, artritida
- Poruchy nervového systému: Poruchy chuti, bolest hlavy, ageuzie
- Psychiatrické poruchy: Zmatek, halucinace
- Respirační, hrudní a mediastinální poruchy: Bronchospasmus, intersticiální pneumonitida, eozinofilní pneumonie
- Poruchy ledvin a močových cest: Zvýšené hladiny kreatininu
- Poruchy kůže a podkoží: Makulopapulózní, erytematózní nebo exfoliativní vyrážka, kopřivka, bulózní dermatitida, ekzém, toxická epidermální nekrolýza, Stevens-Johnsonův syndrom, akutní generalizovaná exantematózní pustulóza (AGEP), angioedém, lékem indukovaný syndrom přecitlivělosti, léková vyrážka s eozinofilií a systémovými příznaky (DRESS) erythema multiforme, lichen planus, generalizovaný pruritus
- Cévní poruchy: Vaskulitida, hypotenze
DROGOVÉ INTERAKCE
Induktory CYP2C19
Protože je klopidogrel metabolizován na svůj aktivní metabolit částečně prostřednictvím CYP2C19, lze očekávat, že použití léků, které indukují aktivitu tohoto enzymu, povede ke zvýšení hladin aktivního metabolitu klopidogrelu.
Rifampin silně indukuje CYP2C19, což vede jak ke zvýšení hladiny aktivního metabolitu klopidogrelu, tak k inhibici krevních destiček, což může zejména zvýšit riziko krvácení. Preventivně se vyhněte současnému užívání silných induktorů CYP2C19 [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
Inhibitory CYP2C19
Klopidogrel je metabolizován na svůj aktivní metabolit částečně prostřednictvím CYP2C19. Současné užívání léků, které inhibují aktivitu tohoto enzymu, má za následek snížení plazmatických koncentrací aktivního metabolitu klopidogrelu a snížení inhibice krevních destiček [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Omeprazol nebo esomeprazol
Vyhněte se současnému užívání přípravku Plavix 75 mg s omeprazolem nebo esomeprazolem. V klinických studiích bylo prokázáno, že omeprazol významně snižuje protidestičkovou aktivitu Plavixu 75 mg, pokud je podáván současně nebo s odstupem 12 hodin. Podobné snížení protidestičkové aktivity bylo pozorováno u esomeprazolu, když byl podáván současně s Plavixem. Dexlansoprazol, lansoprazol a pantoprazol měly menší účinek na protidestičkovou aktivitu Plavixu než omeprazol nebo esomeprazol (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
Opioidy
Stejně jako u jiných perorálních inhibitorů P2Y12 současné podávání opioidních agonistů zpomaluje a snižuje absorpci klopidogrelu, pravděpodobně v důsledku zpomaleného vyprazdňování žaludku, což má za následek sníženou expozici jeho metabolitům [viz KLINICKÁ FARMAKOLOGIE ]. Zvažte použití parenterálního protidestičkového přípravku u pacientů s akutním koronárním syndromem, kteří vyžadují současné podávání morfinu nebo jiných opioidních agonistů.
Nesteroidní protizánětlivé léky (NSAID)
Současné podávání Plavixu 75 mg a NSAID zvyšuje riziko gastrointestinálního krvácení.
Warfarin (substráty CYP2C9)
Přestože podávání klopidogrelu 75 mg denně nemodifikovalo farmakokinetiku S-warfarinu (substrát CYP2C9) nebo INR u pacientů dlouhodobě léčených warfarinem, současné podávání Plavixu 75 mg s warfarinem zvyšuje riziko krvácení kvůli nezávislým účinkům na hemostáze.
Při vysokých koncentracích in vitro však klopidogrel inhibuje CYP2C9.
SSRI a SNRI
Protože selektivní inhibitory zpětného vychytávání serotoninu (SSRI) a inhibitory zpětného vychytávání serotoninu a noradrenalinu (SNRI) ovlivňují aktivaci krevních destiček, může současné podávání SSRI a SNRI s klopidogrelem zvýšit riziko krvácení.
Repaglinid (substráty CYP2C8)
Acyl-β-glukuronidový metabolit klopidogrelu je silným inhibitorem CYP2C8. Plavix 75 mg může zvýšit systémovou expozici lékům, které jsou primárně odstraňovány prostřednictvím CYP2C8, a proto je třeba upravit dávku a odpovídající monitorování.
Plavix zvýšil expozici repaglinidu 3,9krát až 5,1krát [viz KLINICKÁ FARMAKOLOGIE ]. Vyhněte se současnému užívání repaglinidu s Plavixem. Pokud se současnému užívání nelze vyhnout, začněte repaglinidem v dávce 0,5 mg před každým jídlem a nepřekračujte celkovou denní dávku 4 mg. Při současném užívání může být vyžadována zvýšená frekvence monitorování glukózy.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Snížená protidestičková aktivita u pacientů s poruchou funkce CYP2C19
Clopidogrel je proléčivo. Inhibice agregace krevních destiček klopidogrelem je dosaženo prostřednictvím aktivního metabolitu. Metabolismus klopidogrelu na jeho aktivní metabolit může být narušen genetickými variacemi v CYP2C19 [viz VAROVÁNÍ V KRABICE ].
Metabolismus klopidogrelu může být narušen také léky, které inhibují CYP2C19, jako je omeprazol nebo esomeprazol. Vyhněte se současnému užívání Plavixu s omeprazolem nebo esomeprazolem, protože oba významně snižují protidestičkovou aktivitu Plavixu (viz DROGOVÉ INTERAKCE ].
Obecné riziko krvácení
Inhibitory P2Y12 (thienopyridiny), včetně Plavixu, zvyšují riziko krvácení.
Inhibitory P2Y12 (thienopyridiny) inhibují agregaci krevních destiček po dobu životnosti destiček (7-10 dní). Protože poločas aktivního metabolitu klopidogrelu je krátký, může být možné obnovit hemostázu podáním exogenních krevních destiček; transfuze krevních destiček do 4 hodin po nasycovací dávce nebo do 2 hodin po udržovací dávce však mohou být méně účinné.
Očekává se, že použití léků, které indukují aktivitu CYP2C19, povede ke zvýšení hladin aktivního metabolitu klopidogrelu a může zesílit riziko krvácení. Preventivně se vyhněte současnému užívání silných induktorů CYP2C19 [viz DROGOVÉ INTERAKCE a KLINICKÁ FARMAKOLOGIE ].
Ukončení užívání Plavixu
Vysazení přípravku Plavix zvyšuje riziko kardiovaskulárních příhod. Pokud musí být Plavix dočasně přerušen (např. k léčbě krvácení nebo k chirurgickému zákroku s velkým rizikem krvácení), znovu jej co nejdříve obnovte. Je-li to možné, přerušte léčbu Plavixem na pět dní před takovým chirurgickým zákrokem. Jakmile je dosaženo hemostázy, pokračujte v užívání Plavixu 75 mg.
Trombotická trombocytopenická purpura (TTP)
TTP, někdy fatální, byl hlášen po použití Plavixu 75 mg, někdy po krátké expozici ( NEŽÁDOUCÍ REAKCE ].
Křížová reaktivita mezi thienopyridiny
Hypersenzitivita včetně vyrážky, angioedému nebo hematologické reakce byla hlášena u pacientů užívajících Plavix 75 mg, včetně pacientů s anamnézou hypersenzitivity nebo hematologické reakce na jiné thienopyridiny (viz KONTRAINDIKACE a NEŽÁDOUCÍ REAKCE ].
Informace pro pacienty
Doporučte pacientům, aby si přečetli označení pacientů schválené FDA ( Průvodce léky ).
Přerušení
Poraďte pacientům, aby nepřerušili léčbu Plavixem, aniž byste to nejprve projednali s poskytovatelem zdravotní péče, který jej předepsal [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Krvácející
Informujte pacienty, že:
- bude snadněji krvácet a modřiny
- zastavení krvácení bude trvat déle než obvykle
- musí hlásit jakékoli neočekávané, prodloužené nebo nadměrné krvácení nebo krev ve stolici nebo moči [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Trombotická trombocytopenická purpura
Poučte pacienty, aby okamžitě získali lékařskou pomoc, pokud zaznamenají příznaky TTP, které nelze jinak vysvětlit [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Invazivní procedury
Poraďte pacientům, aby informovali lékaře a zubní lékaře, že užívají Plavix před jakýmkoli chirurgickým nebo stomatologickým zákrokem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Inhibitory protonové pumpy
Informujte pacienty, aby během užívání Plavixu neužívali omeprazol nebo esomeprazol. Dexlansoprazol, lansoprazol a pantoprazol měly méně výrazné účinky na protidestičkovou aktivitu Plavixu 75 mg než omeprazol nebo esomeprazol (viz DROGOVÉ INTERAKCE ].
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Nebyla prokázána tumorigenicita, když byl klopidogrel podáván po dobu 78 týdnů myším a 104 týdnů potkanům v dávkách až 77 mg/kg za den, což umožnilo plazmatické expozice > 25krát vyšší než u lidí při doporučené denní dávce 75 mg.
Klopidogrel nebyl genotoxický ve čtyřech testech in vitro (Amesův test, test opravy DNA na potkaních hepatocytech, test genových mutací ve fibroblastech čínského křečka a analýza metafázních chromozomů lidských lymfocytů) a v jednom testu in vivo (mikronukleární test orální cestou v myši).
Bylo zjištěno, že klopidogrel nemá žádný vliv na fertilitu samců a samic potkanů léčených před párováním a během březosti v perorálních dávkách až 400 mg/kg denně (52násobek doporučené dávky pro člověka na základě mg/m²).
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
Dostupné údaje z případů hlášených v publikované literatuře a postmarketingového sledování s užíváním klopidogrelu u těhotných žen nezjistily žádná rizika spojená s užíváním léků pro závažné vrozené vady nebo potrat (viz Data Existují rizika pro těhotnou ženu a plod spojená s infarktem myokardu a mrtvicí [viz Klinické úvahy ]. Nebyly pozorovány žádné známky fetotoxicity, když byl klopidogrel podáván březím potkanům a králíkům během organogeneze v dávkách odpovídajících 65 a 78násobku doporučené denní dávky pro člověka (viz Data ].
Odhadované základní riziko závažných vrozených vad a potratu pro uvedené populace není známo. Všechna těhotenství mají na pozadí riziko vrozených vad, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 % až 4 % a 15 % až 20 %.
Klinické úvahy
Mateřské a/nebo embryo/fetální riziko spojené s nemocí
Infarkt myokardu a cévní mozková příhoda jsou lékařské pohotovosti. Terapie pro těhotné ženy by neměla být přerušena kvůli potenciálním obavám ohledně účinků klopidogrelu na plod.
Práce nebo dodávka
Užívání klopidogrelu během porodu zvýší riziko mateřského krvácení a krvácení. Vyhněte se neuraxiální blokádě během užívání klopidogrelu kvůli riziku páteřního hematomu. Pokud je to možné, vysaďte klopidogrel 5 až 7 dní před porodem, porodem nebo neurální blokádou.
Data
Lidská data
Dostupné údaje z publikovaných kazuistik za dvě desetiletí postmarketingového používání neidentifikovaly souvislost s užíváním klopidogrelu v těhotenství a závažnými vrozenými vadami, potraty nebo nepříznivými důsledky pro plod.
Údaje o zvířatech
Studie embryo-fetální vývojové toxikologie byly provedeny u březích potkanů a králíků s dávkami až 500 a 300 mg/kg/den, v daném pořadí, podávanými během organogeneze. Tyto dávky, odpovídající 65, resp. 78násobku doporučené denní dávky u člověka na bázi mg/m², neodhalily žádné známky poškození fertility nebo fetotoxicity způsobené klopidogrelem.
Laktace
Shrnutí rizik
Neexistují žádné údaje o přítomnosti klopidogrelu v mateřském mléce nebo účincích na produkci mléka. U malého počtu postmarketingových případů nebyly při užívání klopidogrelu u matky během kojení pozorovány žádné nežádoucí účinky na kojené děti. Studie na potkanech ukázaly, že klopidogrel a/nebo jeho metabolity jsou přítomny v mléce. Pokud je lék přítomen ve zvířecím mléce, je pravděpodobné, že lék bude přítomen v lidském mléce. Vývojové a zdravotní přínosy kojení by měly být zváženy společně s klinickou potřebou matky PLAVIX a veškerými potenciálními nežádoucími účinky na kojené dítě z PLAVIX 75 mg nebo ze základního stavu matky.
Pediatrické použití
Bezpečnost a účinnost u pediatrické populace nebyla stanovena.
Randomizovaná, placebem kontrolovaná studie (CLARINET) neprokázala klinický přínos klopidogrelu u novorozenců a kojenců s cyanotickým vrozeným srdečním onemocněním paliativním se systemic-to-pulmonálním arteriálním zkratem. Možnými faktory přispívajícími k tomuto výsledku byla dávka klopidogrelu, současné podávání aspirinu a pozdní zahájení léčby po shunt palliation. Nelze vyloučit, že studie s jiným designem by prokázala klinický přínos u této populace pacientů.
Geriatrické použití
Z celkového počtu subjektů v kontrolovaných klinických studiích CAPRIE a CURE bylo přibližně 50 % pacientů léčených přípravkem Plavix ve věku 65 let a více a 15 % bylo ve věku 75 let a více. Ve studii COMMIT bylo přibližně 58 % pacientů léčených přípravkem Plavix 75 mg ve věku 60 let a více, z nichž 26 % bylo ve věku 70 let a více.
Pozorované riziko krvácivých příhod u přípravku Plavix 75 mg plus aspirin versus placebo plus aspirin podle věkové kategorie je uvedeno v tabulce 1 a tabulce 2 pro studie CURE a COMMIT, v tomto pořadí [viz NEŽÁDOUCÍ REAKCE ]. U starších pacientů není nutná úprava dávkování.
Renální poškození
Zkušenosti u pacientů s těžkou a středně těžkou poruchou funkce ledvin jsou omezené (viz KLINICKÁ FARMAKOLOGIE ].
Poškození jater
U pacientů s poruchou funkce jater není nutná žádná úprava dávkování (viz KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
Inhibice krevních destiček přípravkem Plavix je nevratná a bude trvat po celou dobu životnosti krevních destiček. Předávkování po podání klopidogrelu může vést ke krvácivým komplikacím. Jednotlivá perorální dávka klopidogrelu v dávce 1500 nebo 2000 mg/kg byla smrtelná pro myši a potkany a při 3000 mg/kg pro paviány. Příznaky akutní toxicity byly zvracení, úlenost, obtížné dýchání a gastrointestinální krvácení u zvířat.
Na základě biologické věrohodnosti může transfuze krevních destiček obnovit schopnost srážení.
KONTRAINDIKACE
Aktivní krvácení
Plavix je kontraindikován u pacientů s aktivním patologickým krvácením, jako je peptický vřed nebo intrakraniální krvácení.
Přecitlivělost
Plavix 75 mg je kontraindikován u pacientů s přecitlivělostí (např. anafylaxí) na klopidogrel nebo kteroukoli složku přípravku (viz NEŽÁDOUCÍ REAKCE ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Klopidogrel je inhibitor aktivace a agregace krevních destiček prostřednictvím ireverzibilní vazby svého aktivního metabolitu na ADP receptory třídy P2Y12 na krevních destičkách.
Farmakodynamika
Klopidogrel musí být metabolizován enzymy CYP450, aby se vytvořil aktivní metabolit, který inhibuje agregaci krevních destiček. Aktivní metabolit klopidogrelu selektivně inhibuje vazbu adenosindifosfátu (ADP) na jeho destičkový receptor P2Y12 a následnou ADP zprostředkovanou aktivaci komplexu glykoproteinu GPIIb/IIIa, čímž inhibuje agregaci destiček. Tato akce je nevratná. V důsledku toho jsou krevní destičky vystavené aktivnímu metabolitu klopidogrelu ovlivněny po zbytek svého života (asi 7 až 10 dní). Agregace krevních destiček indukovaná jinými agonisty než ADP je také inhibována blokováním amplifikace aktivace krevních destiček uvolněným ADP.
Inhibici agregace krevních destiček v závislosti na dávce lze pozorovat 2 hodiny po jednorázovém perorálním podání Plavixu. Opakované dávky 75 mg Plavixu denně inhibují ADP-indukovanou agregaci krevních destiček první den a inhibice dosáhne ustáleného stavu mezi 3. a 7. dnem. V ustáleném stavu byla průměrná hladina inhibice pozorovaná při dávce 75 mg Plavixu denně mezi 40 % a 60 %. Po přerušení léčby se agregace krevních destiček a doba krvácení postupně vracejí k výchozím hodnotám, obvykle asi za 5 dní.
Geriatričtí pacienti
Starší (≥75 let) a mladí zdraví jedinci měli podobné účinky na agregaci krevních destiček.
Pacienti s postižením ledvin
Po opakovaných dávkách 75 mg Plavixu 75 mg denně vykazovali pacienti s těžkou poruchou funkce ledvin (clearance kreatininu od 5 do 15 ml/min) a středně těžkou poruchou funkce ledvin (clearance kreatininu od 30 do 60 ml/min) nízkou (25 %) inhibici ADP-indukovaná agregace krevních destiček.
Pacienti s poškozením jater
Po opakovaných dávkách 75 mg Plavixu denně po dobu 10 dnů u pacientů s těžkou poruchou funkce jater byla inhibice agregace krevních destiček indukovaná ADP podobná inhibici pozorované u zdravých subjektů.
Rod
V malé studii porovnávající muže a ženy byla u žen pozorována menší inhibice ADP-indukované agregace krevních destiček.
Farmakokinetika
Klopidogrel je proléčivo a je metabolizován na farmakologicky aktivní metabolit a neaktivní metabolity.
Vstřebávání
Po jednorázové a opakované perorální dávce 75 mg denně se klopidogrel rychle vstřebává. Absorpce je nejméně 50 %, na základě vylučování metabolitů klopidogrelu močí.
Vliv Jídlo
Plavix lze podávat s jídlem nebo bez jídla. Ve studii se zdravými mužskými subjekty, kdy byl Plavix 75 mg denně podáván se standardní snídaní, byla průměrná inhibice ADP-indukované agregace krevních destiček snížena o méně než 9 %. Aktivní metabolit AUC0-24 se v přítomnosti jídla nezměnil, zatímco Cmax aktivního metabolitu se snížilo o 57 %. Podobné výsledky byly pozorovány, když byla nasycovací dávka Plavixu 300 mg podána se snídaní s vysokým obsahem tuku.
Metabolismus
Klopidogrel je rozsáhle metabolizován dvěma hlavními metabolickými cestami: jedna je zprostředkována esterázami a vede k hydrolýze na neaktivní derivát karboxylové kyseliny (85 % cirkulujících metabolitů) a druhá je zprostředkována četnými enzymy cytochromu P450. Cytochromy nejprve oxidují klopidogrel na intermediární metabolit 2-oxo-klopidogrel. Následný metabolismus intermediárního metabolitu 2-oxoclopidogrelu vede k tvorbě aktivního metabolitu, thiolového derivátu klopidogrelu. Aktivní metabolit je tvořen převážně CYP2C19 za přispění několika dalších enzymů CYP, včetně CYP1A2, CYP2B6 a CYP3A. Aktivní thiolový metabolit se rychle a nevratně váže na destičkové receptory, čímž inhibuje agregaci destiček po celou dobu života destiček.
Cmax aktivního metabolitu je dvakrát vyšší po jednorázové nasycovací dávce 300 mg klopidogrelu než po čtyřech dnech udržovací dávky 75 mg. Cmax nastává přibližně 30 až 60 minut po podání. V rozmezí dávek 75 až 300 mg se farmakokinetika aktivního metabolitu odchyluje od proporcionality dávky: 4násobek dávky vede k 2,0násobku a 2,7násobku Cmax a AUC.
Odstranění
Po perorální dávce klopidogrelu značeného 14C u lidí bylo přibližně 50 % celkové radioaktivity vyloučeno močí a přibližně 46 % stolicí během 5 dnů po podání dávky. Po jednorázové perorální dávce 75 mg má klopidogrel biologický poločas přibližně 6 hodin. Poločas aktivního metabolitu je asi 30 minut.
Lékové interakce
Vliv jiných léků na Plavix
Klopidogrel je metabolizován na svůj aktivní metabolit částečně prostřednictvím CYP2C19.
Induktory CYP2C19
Současné užívání silných induktorů CYP2C19 má za následek zvýšení plazmatické koncentrace aktivního metabolitu klopidogrelu a zvýšení inhibice krevních destiček.
Rifampin: Současné podávání rifampinu 300 mg dvakrát denně po dobu 7 dnů s nasycovací dávkou 600 mg klopidogrelu u zdravých dospělých zvýšilo průměrnou AUC a Cmax thiolových metabolitů klopidogrelu 3,8krát. Průměrná inhibice agregace krevních destiček 4 hodiny po dávce byla o 34 % vyšší v přítomnosti rifampinu ve srovnání s klopidogrelem podávaným samostatně.
Inhibitory CYP2C19
Současné užívání určitých inhibitorů tohoto enzymu vede ke snížení plazmatických koncentrací aktivního metabolitu klopidogrelu a snížení inhibice krevních destiček.
Inhibitory protonové pumpy (PPI)
Účinek inhibitorů protonové pumpy (PPI) na systémovou expozici aktivnímu metabolitu klopidogrelu po opakovaných dávkách Plavixu 75 mg hodnocený ve specializovaných studiích lékových interakcí je uveden na obrázku 1.
Obrázek 1: Expozice aktivnímu metabolitu klopidogrelu po opakovaných dávkách Plavixu 75 mg samotného nebo s inhibitory protonové pumpy (PPI)
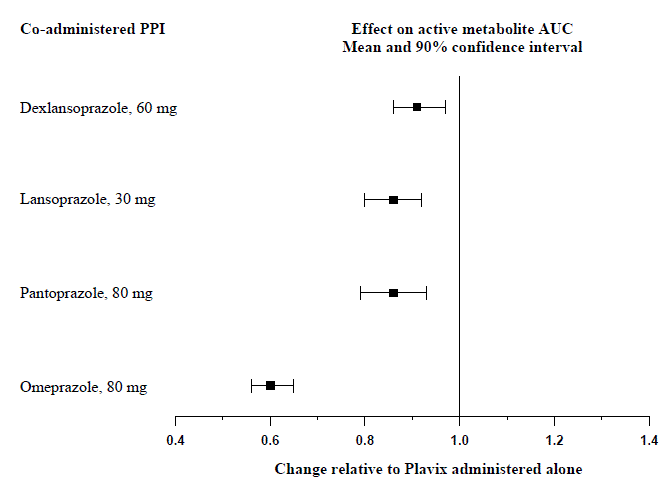
Farmakodynamické a farmakokinetické parametry měřené v těchto studiích ukázaly, že interakce byla nejvyšší u omeprazolu a nejméně u dexlansoprazolu.
Opioidy
Současné podávání 5 mg intravenózního morfinu se 600 mg nárazovou dávkou klopidogrelu zdravým dospělým snížilo AUC a Cmax thiolových metabolitů klopidogrelu o 34 %. Průměrná agregace krevních destiček byla vyšší až 2 až 4 hodiny při současném podávání morfinu.
Účinek Plavixu 75 mg na jiné léky
Studie in vitro ukázaly, že glukuronidový metabolit klopidogrelu je silným inhibitorem CYP2C8. Současné podávání repaglinidu s Plavixem zvýšilo systémovou expozici repaglinidu (AUC0-∞) 5,1krát po nasycovací dávce (300 mg) a 3,9krát v den 3 udržovací dávky (75 mg) Plavixu [viz DROGOVÉ INTERAKCE ].
Farmakogenomika
CYP2C19 se podílí na tvorbě jak aktivního metabolitu, tak intermediárního metabolitu 2-oxo-klopidogrelu. Farmakokinetika aktivního metabolitu klopidogrelu a protidestičkové účinky, měřené ex vivo testy agregace krevních destiček, se liší podle genotypu CYP2C19. Pacienti, kteří jsou homozygotní pro nefunkční alely genu CYP2C19, se nazývají „špatní metabolizátoři CYP2C19“. Přibližně 2 % bílých a 4 % černošských pacientů jsou pomalí metabolizátoři; prevalence špatného metabolismu je vyšší u asijských pacientů (např. 14 % Číňanů). K dispozici jsou testy k identifikaci pacientů, kteří jsou pomalými metabolizátory CYP2C19.
Zkřížená studie u 40 zdravých subjektů, po 10 ve čtyřech skupinách metabolizátorů CYP2C19, hodnotila farmakokinetické a protidestičkové odpovědi s použitím 300 mg následovaných 75 mg denně a 600 mg a následně 150 mg denně, každý po dobu celkem 5 dnů. Snížená expozice aktivního metabolitu a snížená inhibice agregace krevních destiček byla pozorována u pomalých metabolizátorů ve srovnání s ostatními skupinami.
Klinické studie
Akutní koronární syndrom
LÉK
Studie CURE zahrnovala 12 562 pacientů s AKS bez elevace ST (UA nebo NSTEMI) a projevujících se do 24 hodin od začátku poslední epizody bolesti na hrudi nebo symptomů odpovídajících ischemii. Pacienti museli mít buď změny na EKG kompatibilní s novou ischemií (bez elevace ST) nebo zvýšené srdeční enzymy nebo troponin I nebo T alespoň na dvojnásobek horní hranice normálu.
Pacienti byli randomizováni k léčbě Plavixem (300 mg nasycovací dávka následovaná 75 mg jednou denně) nebo placebem a byli léčeni po dobu až jednoho roku. Pacienti také dostávali aspirin (75-325 mg jednou denně) a další standardní terapie, jako je heparin. Použití inhibitorů GPIIb/IIIa nebylo povoleno tři dny před randomizací.
Populace pacientů byla převážně bílá (82 %) a zahrnovala 38 % žen a 52 % ve věku ≥ 65 let. Pouze asi 20 % pacientů podstoupilo revaskularizaci během úvodní hospitalizace a jen málo z nich podstoupilo emergentní nebo urgentní revaskularizaci.
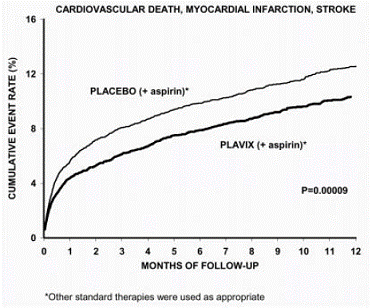
Počet pacientů s primárním výsledkem (KV úmrtí, IM nebo cévní mozková příhoda) byl 582 (9,3 %) ve skupině léčené Plavixem a 719 (11,4 %) ve skupině léčené placebem, což představuje 20% snížení relativního rizika (95 % CI 10%-28%, p
Většina přínosu přípravku Plavix se projevila v prvních dvou měsících, ale rozdíl oproti placebu byl zachován po celou dobu studie (až 12 měsíců) (viz obrázek 2).
Obrázek 2: Kardiovaskulární smrt, infarkt myokardu a mrtvice ve studii CURE
Účinek přípravku Plavix 75 mg se v různých podskupinách významně nelišil, jak ukazuje obrázek 3. Přínosy spojené s přípravkem Plavix 75 mg byly nezávislé na použití jiných akutních a dlouhodobých kardiovaskulárních terapií, včetně heparinu/LMWH, intravenózního glykoproteinu IIb/IIIa (GPIIb/IIIa) inhibitory, léky snižující hladinu lipidů, beta-blokátory a ACE inhibitory. Účinnost Plavixu byla pozorována nezávisle na dávce aspirinu (75-325 mg jednou denně). Použití perorálních antikoagulancií, nestudovaných protidestičkových léků a chronických NSAID nebylo v CURE povoleno.
Obrázek 3: Poměr rizik pro základní charakteristiky pacientů a souběžné léky/intervence během studie pro studii CURE
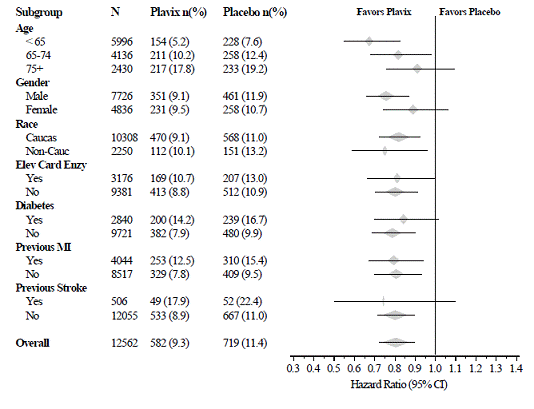
Obrázek 3: Poměr rizik pro základní charakteristiky pacientů a souběžné léky/intervence ve studii CURE (pokračování)
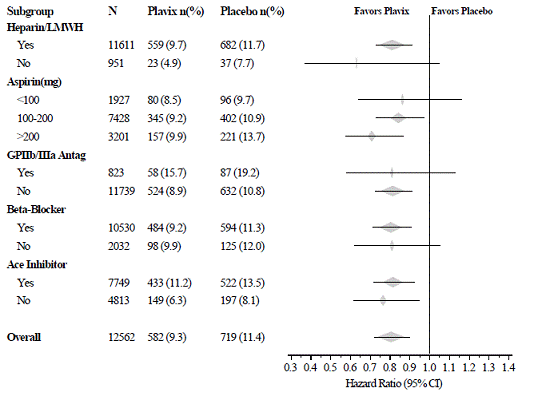
Užívání Plavixu v CURE bylo spojeno s poklesem používání trombolytické terapie (71 pacientů [1,1 %] ve skupině Plavix 75 mg, 126 pacientů [2,0 %] ve skupině s placebem; snížení relativního rizika o 43 %) a Inhibitory GPIIb/IIIa (369 pacientů [5,9 %] ve skupině Plavix 75 mg, 454 pacientů [7,2 %] ve skupině s placebem, snížení relativního rizika o 18 %). Použití Plavixu 75 mg v CURE neovlivnilo počet pacientů léčených CABG nebo PCI (s nebo bez stentování) (2253 pacientů [36,0 %] ve skupině Plavix 75 mg, 2324 pacientů [36,9 %] ve skupině s placebem; relativní snížení rizika o 4,0 %).
SPÁCHAT
pacientů se STEMI byla bezpečnost a účinnost Plavixu hodnocena v randomizované, placebem kontrolované, dvojitě zaslepené studii COMMIT. COMMIT zahrnoval 45 852 pacientů s projevy příznaků infarktu myokardu do 24 hodin s podpůrnými abnormalitami EKG (tj. ST-elevace, ST-deprese nebo blokáda levého raménka). Pacienti byli randomizováni tak, aby dostávali Plavix (75 mg jednou denně) nebo placebo v kombinaci s aspirinem (162 mg denně) po dobu 28 dnů nebo do propuštění z nemocnice, podle toho, co nastane dříve.
Primárními cílovými parametry byla smrt z jakékoli příčiny a první výskyt opakovaného infarktu, cévní mozkové příhody nebo úmrtí.
Populaci pacientů tvořilo 28 % žen a 58 % věk ≥ 60 let (26 % věk ≥ 70 let). 55 procent (55 %) pacientů dostalo trombolytika a pouze 3 % podstoupila PCI.
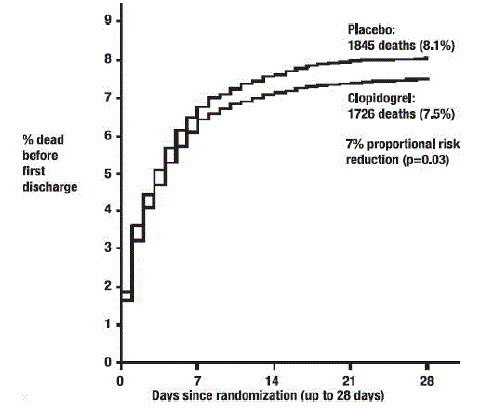
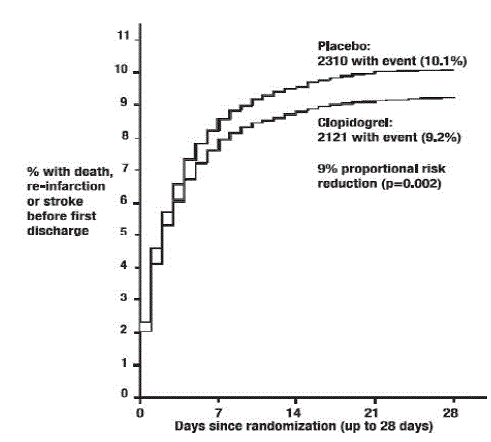
Jak ukazuje tabulka 5 a obrázek 4 a obrázek 5 níže, Plavix významně snížil relativní riziko úmrtí z jakékoli příčiny o 7 % (p=0,029) a relativní riziko kombinace reinfarktu, mrtvice nebo úmrtí o 9 % ( p=0,002).
Obrázek 4: Kumulativní četnost úmrtí ve studii COMMIT*
Obrázek 5: Kumulativní četnost příhod pro kombinovaný koncový bod Opakovaný infarkt, mrtvice nebo úmrtí ve studii COMMIT*
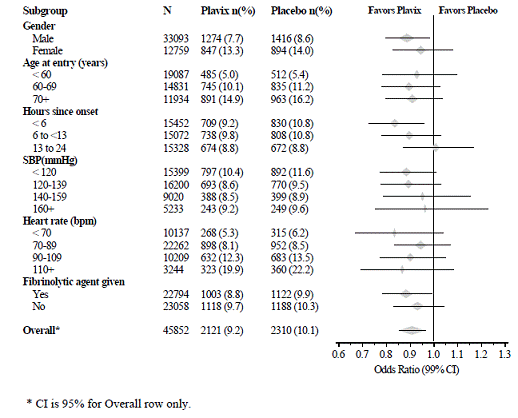
Účinek Plavixu 75 mg se významně nelišil v různých předem specifikovaných podskupinách, jak je znázorněno na obrázku 6. Účinek byl také podobný v předem nespecifikovaných podskupinách, včetně těch na základě umístění infarktu, Killipovy třídy nebo předchozí anamnézy IM. Takové analýzy podskupin by měly být interpretovány opatrně.
Obrázek 6: Účinky přidání Plavix 75 mg k aspirinu na kombinovaný primární cílový ukazatel napříč výchozími hodnotami a podskupinami souběžné medikace pro studii COMMIT
Nedávný infarkt myokardu, nedávná mrtvice nebo prokázaná periferní arteriální choroba
CAPRIE
Studie CAPRIE byla mezinárodní, randomizovaná, dvojitě zaslepená studie s paralelními skupinami s 19 185 pacienty, 304 center, srovnávající Plavix (75 mg denně) a aspirin (325 mg denně). Aby byli pacienti způsobilí k zařazení, museli mít: 1) nedávnou anamnézu infarktu myokardu (do 35 dnů); 2) nedávné anamnézy ischemické cévní mozkové příhody (během 6 měsíců) s alespoň týdenními reziduálními neurologickými příznaky; a/nebo 3) prokázané onemocnění periferních tepen (PAD). Pacienti dostávali randomizovanou léčbu v průměru 1,6 roku (maximálně 3 roky).
Primárním výsledkem studie byl čas do prvního výskytu nové ischemické cévní mozkové příhody (fatální nebo ne), nového infarktu myokardu (fatální nebo ne) nebo jiné vaskulární smrti. Úmrtí, která nelze snadno připsat nevaskulárním příčinám, byla všechna klasifikována jako vaskulární.
Jak je uvedeno v tabulce 6, přípravek Plavix byl spojen s nižším výskytem výsledných příhod, především IM. Celkové relativní snížení rizika (9,8 % vs 10,6 %) bylo 8,7 %, p=0,045. Podobné výsledky byly získány, když byla počítána mortalita ze všech příčin a cévní mozkové příhody ze všech příčin namísto vaskulární mortality a ischemických cévních mozkových příhod (snížení rizika o 6,9 %). U pacientů, kteří ve studii přežili cévní mozkovou příhodu nebo infarkt myokardu, byla incidence následných příhod nižší ve skupině s Plavixem 75 mg.
Křivky znázorňující celkovou četnost příhod jsou znázorněny na obrázku 7. Křivky příhod se brzy oddělily a nadále se rozcházely po dobu 3letého sledování.
Obrázek 7: Fatální nebo nefatální cévní příhody ve studii CAPRIE
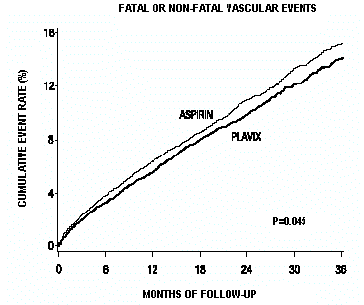
Statistická významnost upřednostňující Plavix 75 mg oproti aspirinu byla marginální (p=0,045). Protože je však aspirin sám o sobě účinný při snižování kardiovaskulárních příhod u pacientů s nedávným infarktem myokardu nebo cévní mozkovou příhodou, je účinek přípravku Plavix 75 mg podstatný.
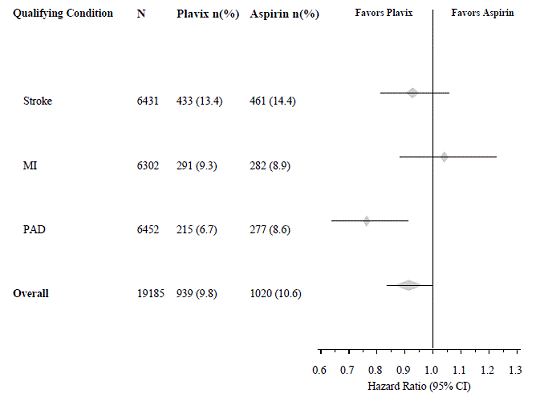
Do studie CAPRIE byla zařazena populace, která nedávno prodělala IM, nedávnou cévní mozkovou příhodu nebo PAD. Účinnost přípravku Plavix 75 mg ve srovnání s aspirinem byla v těchto podskupinách heterogenní (p=0,043) (viz obrázek 8). Tento rozdíl však může být náhodný, protože studie CAPRIE nebyla navržena tak, aby hodnotila relativní přínos přípravku Plavix 75 mg oproti aspirinu u jednotlivých podskupin pacientů. Přínos byl nejvíce patrný u pacientů, kteří byli zařazeni kvůli onemocnění periferních tepen a méně patrný u pacientů s cévní mozkovou příhodou. U pacientů, kteří byli zařazeni do studie pouze na základě nedávného infarktu myokardu, nebyl Plavix 75 mg numericky lepší než aspirin.
Obrázek 8: Poměr rizika a 95% CI podle výchozích podskupin ve studii CAPRIE
Žádný prokázaný přínos přípravku Plavix 75 mg plus aspirin u pacientů s více rizikovými faktory nebo prokázaným vaskulárním onemocněním
CHARISMA
Studie CHARISMA byla randomizovaná, dvojitě zaslepená studie s paralelními skupinami s 15 603 subjekty, která porovnávala Plavix (75 mg denně) s placebem pro prevenci ischemických příhod u pacientů s vaskulárním onemocněním nebo více rizikovými faktory aterosklerózy. Všichni jedinci byli léčeni aspirinem 75-162 mg denně. Průměrná délka léčby byla 23 měsíců. Studie neprokázala snížení výskytu primárního cílového ukazatele, složeného z KV úmrtí, IM nebo cévní mozkové příhody. Celkem 534 (6,9 %) pacientů ve skupině s Plavixem oproti 573 (7,4 %) pacientům ve skupině s placebem zaznamenalo primární výslednou příhodu (p=0,22). Krvácení všech stupňů závažnosti bylo častější u subjektů randomizovaných k léčbě Plavixem.
INFORMACE PRO PACIENTA
Plavix® (PLAV-iks) (klopidogrel bisulfát) tablety
Před zahájením užívání Plavixu a pokaždé, když dostanete náhradní náplň, si přečtěte tento Průvodce léčivými přípravky. Mohou se objevit nové informace. Tento průvodce léky nenahrazuje rozhovor s lékařem o vašem zdravotním stavu nebo léčbě.
Jaké jsou nejdůležitější informace, které bych měl vědět o Plavix 75 mg?
1. Plavix nemusí působit tak dobře u lidí, kteří:
- mají určité genetické faktory, které ovlivňují, jak tělo odbourává Plavix. Váš lékař může provést genetické testy, aby se ujistil, že Plavix je pro vás vhodný.
- užívat určité léky, zejména omeprazol (Prilosec®) nebo esomeprazol (Nexium®). Váš lékař může během užívání Plavixu změnit lék, který užíváte na problémy s žaludeční kyselostí.
2. Plavix 75 mg může způsobit krvácení, které může být vážné a někdy může vést ke smrti. Plavix je lék na ředění krve, který snižuje možnost tvorby krevních sraženin ve vašem těle. Když užíváte Plavix:
- můžete si snadněji vytvořit modřiny a krvácet
- je pravděpodobnější, že budete mít krvácení z nosu
- bude trvat déle, než se krvácení zastaví
Okamžitě zavolejte svého lékaře, pokud máte některý z těchto příznaků nebo příznaků krvácení:
- neočekávané krvácení nebo krvácení, které trvá dlouhou dobu
- krev ve vaší moči (růžová, červená nebo hnědá moč)
- červená nebo černá stolice (vypadá jako dehet)
- modřiny, které se stávají bez známé příčiny nebo se zvětšují
- vykašlávání krve nebo krevních sraženin
- zvracejte krev nebo vaše zvratky vypadají jako kávová sedlina
Nepřestávejte užívat Plavix 75 mg bez porady s lékařem, který Vám jej předepisuje. Lidé, kteří přestanou užívat Plavix 75 mg příliš brzy, mají vyšší riziko srdečního infarktu nebo úmrtí. Pokud musíte přerušit Plavix kvůli krvácení, riziko srdečního infarktu může být vyšší.
Co je Plavix 75 mg?
Plavix je lék na předpis používaný k léčbě lidí, kteří mají některý z následujících stavů:
- bolest na hrudi v důsledku srdečních problémů
- špatná cirkulace v nohou (onemocnění periferních tepen)
- srdeční příhoda
- mrtvice
Plavix se používá samostatně nebo s aspirinem, aby se snížila pravděpodobnost, že budete mít další závažný problém se srdcem nebo krevními cévami, jako je srdeční infarkt, mrtvice nebo krevní sraženina, které mohou vést ke smrti.
Krevní destičky jsou krevní buňky, které pomáhají normálnímu srážení krve. Plavix 75 mg pomáhá předcházet slepování krevních destiček a tvorbě sraženiny, která může ucpat tepnu.
Není známo, zda je Plavix 75 mg bezpečný a účinný u dětí.
Kdo by neměl užívat Plavix 75 mg?
Neužívejte Plavix, jestliže:
- v současné době trpíte stavem, který způsobuje krvácení, jako je žaludeční vřed
- jste alergický(á) na klopidogrel nebo na jiné složky přípravku Plavix. Úplný seznam složek v Plavixu naleznete na konci této příbalové informace.
Co mám říci svému lékaři, než začnu užívat Plavix 75 mg?
Než začnete Plavix užívat, informujte svého lékaře, pokud:
- máte v anamnéze střevní (gastrointestinální) nebo žaludeční vředy
- máte v anamnéze problémy s krvácením
- plánujete operaci nebo stomatologický zákrok. Vidět "Jak mám užívat Plavix?"
- jste těhotná nebo plánujete otěhotnět. Není známo, zda Plavix 75 mg poškodí vaše nenarozené dítě
- kojíte nebo plánujete kojit. Není známo, zda Plavix 75 mg přechází do vašeho mateřského mléka. Váš poskytovatel zdravotní péče by se měl rozhodnout, zda se vyvarovat nebo přerušit kojení, pokud je potřeba pokračovat v užívání Plavixu.
- jste měl/a alergii nebo reakci na jakýkoli lék používaný k léčbě Vašeho onemocnění.
Řekněte všem svým lékařům a zubnímu lékaři, že užíváte Plavix. Měli by se poradit s lékařem, který vám předepsal Plavix 75 mg, než podstoupíte jakýkoli chirurgický nebo invazivní zákrok.
Informujte svého lékaře o všech lécích, které užíváte, včetně léků na předpis, léků bez předpisu, vitamínů a bylinných doplňků.
Plavix 75 mg může ovlivnit účinek jiných léků a jiné léky mohou ovlivnit účinek Plavixu. Vidět Jaké jsou nejdůležitější informace, které bych měl vědět o Plavix 75 mg?
Plavix 75 mg může zvýšit krevní hladiny jiných léků, jako je repaglinid (Prandin®).
Užívání Plavixu s některými jinými léky může zvýšit riziko krvácení.
Zejména informujte svého lékaře, pokud užíváte:
- aspirin, zvláště pokud jste prodělal mrtvici. Vždy se poraďte se svým lékařem, zda byste k léčbě svého onemocnění měli užívat aspirin spolu s Plavixem 75 mg.
- Nesteroidní protizánětlivé léky (NSAID). Pokud si nejste jistý(á), požádejte svého lékaře nebo lékárníka o seznam léků ze skupiny NSAID.
- warfarin (Coumadin®, Jantoven®).
- selektivní inhibitory zpětného vychytávání serotoninu (SSRI) a inhibitory zpětného vychytávání serotoninu a norepinefrinu (SNRI). Pokud si nejste jistý(á), požádejte svého lékaře nebo lékárníka o seznam léků obsahujících SSRI nebo SNRI.
- rifampin (používaný k léčbě závažných infekcí)
Znát léky, které užíváte. Uchovávejte si jejich seznam, abyste je mohli ukázat svému lékaři nebo lékárníkovi, když dostanete nový lék.
Jak mám užívat Plavix?
- Užívejte Plavix přesně podle pokynů svého lékaře.
- Neměňte dávku ani nepřestávejte užívat Plavix 75 mg bez předchozí konzultace se svým lékařem. Vysazení přípravku Plavix může zvýšit riziko srdečního infarktu nebo mozkové mrtvice.
- Užívejte Plavix 75 mg s aspirinem podle pokynů svého lékaře.
- Pokud vynecháte dávku, užijte Plavix, jakmile si vzpomenete. Pokud je téměř čas na další dávku, vynechejte zapomenutou dávku. Užijte další dávku v obvyklou dobu. Neužívejte 2 dávky Plavixu 75 mg současně, pokud Vám to neřekne lékař.
- Pokud užijete příliš mnoho Plavixu, zavolejte svého lékaře nebo jděte ihned na nejbližší pohotovost.
- Poraďte se se svým lékařem o vysazení přípravku Plavix 75 mg před operací. Váš lékař Vám může říci, abyste přestal užívat Plavix 75 mg alespoň 5 dní před operací, aby se zabránilo nadměrnému krvácení během operace.
Jaké jsou možné vedlejší účinky přípravku Plavix?
Plavix 75 mg může způsobit závažné nežádoucí účinky, včetně:
- Viz "Jaké jsou nejdůležitější informace, které bych měl vědět o Plavix?"
- Problém srážlivosti krve zvaný trombotická trombocytopenická purpura (TTP). TTP se může objevit u přípravku Plavix 75 mg, někdy po krátké době (méně než 2 týdny). TTP je problém srážení krve, kdy se v krevních cévách tvoří krevní sraženiny; a může se objevit kdekoli v těle. TTP je třeba okamžitě léčit v nemocnici, protože může způsobit smrt. Okamžitě vyhledejte lékařskou pomoc, pokud máte některý z těchto příznaků a nelze je vysvětlit jiným zdravotním stavem:
- purpurové skvrny (nazývané purpura) na kůži nebo v ústech (sliznicích) v důsledku krvácení pod kůží
- vaše kůže nebo oční bělmo jsou žluté (žloutenka)
- cítíte únavu nebo slabost
- vaše kůže vypadá velmi bledě
- horečka
- rychlý srdeční tep nebo pocit dušnosti
- bolest hlavy
- změny řeči
- zmatek
- kóma
- mrtvice
- záchvat
- nízké množství moči nebo moč, která je růžová nebo obsahuje krev
- bolest v oblasti žaludku (břicha).
- nevolnost, zvracení nebo průjem
- změny vidění
- přetrvávající příznaky nízké hladiny cukru v krvi
Informujte svého lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje. Informujte svého lékaře, pokud se u Vás během užívání Plavixu objeví alergická reakce včetně kožních reakcí.
Toto nejsou všechny možné vedlejší účinky přípravku Plavix. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám Plavix 75 mg uchovávat?
- Uchovávejte Plavix 75 mg při teplotě 59 °F až 86 °F (15 °C až 30 °C).
Uchovávejte Plavix a všechny léky mimo dosah dětí.
Obecné informace o Plavixu
Léky se někdy používají k jiným účelům, než jsou ty, které jsou uvedeny v Průvodci léky. Neužívejte Plavix 75 mg na onemocnění, pro které nebyl předepsán. Nedávejte Plavix jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Tento průvodce léčivými přípravky shrnuje nejdůležitější informace o přípravku Plavix. Pokud byste chtěli více informací, poraďte se se svým lékařem. Požádejte svého lékaře nebo lékárníka o informace o přípravku Plavix, které byly napsány pro zdravotnické pracovníky.
Pro více informací navštivte www.sanofi-aventis.us nebo www.bms.com nebo volejte 1-800-321-1335.
Jaké jsou složky přípravku Plavix 75 mg?
Aktivní složka: clopidogrel bisulfát
Neaktivní složky:
Tableta: hydrogenovaný ricinový olej, hydroxypropylcelulóza, mannitol, mikrokrystalická celulóza, polyethylenglykol 6000
Filmový povlak: oxid železitý, hypromelóza 2910, monohydrát laktózy, oxid titaničitý, triacetin, karnaubský vosk
Tato příručka pro léky byla schválena americkým úřadem pro potraviny a léky.
