Léčba srdce: Coumadin 1mg, 2mg, 5mg Warfarin Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Coumadin a jak se používá?
Coumadin je lék na předpis používaný k léčbě krevních sraženin a ke snížení pravděpodobnosti tvorby krevních sraženin ve vašem těle. Krevní sraženiny mohou způsobit mrtvici, srdeční infarkt nebo jiné vážné stavy, pokud se tvoří v nohou nebo plicích.
Jaké jsou vedlejší účinky Coumadinu?
Coumadin může způsobit závažné nežádoucí účinky, včetně:
- Smrt kožní tkáně (nekróza kůže nebo gangréna). To se může stát brzy po spuštění Coumadinu. Stává se to proto, že se tvoří krevní sraženiny a blokují průtok krve do oblasti vašeho těla. Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud máte bolest, barvu nebo změnu teploty v jakékoli oblasti vašeho těla. Možná budete potřebovat okamžitou lékařskou péči, abyste zabránili smrti nebo ztrátě (amputaci) postižené části těla.
- Problémy s ledvinami. U lidí, kteří užívají Coumadin, může dojít k poškození ledvin. Okamžitě informujte svého poskytovatele zdravotní péče, pokud se ve vaší moči objeví krev. Váš poskytovatel zdravotní péče může během léčby přípravkem Coumadin provádět testy častěji, aby zkontroloval krvácení, pokud již máte problémy s ledvinami.
- "Syndrom fialových prstů." Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud vás bolí prsty na nohou a vypadají fialově nebo tmavě.
To nejsou všechny vedlejší účinky přípravku Coumadin. Další informace získáte od svého poskytovatele zdravotní péče nebo lékárníka. Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
RIZIKO KRVÁCENÍ
- COUMADIN může způsobit velké nebo smrtelné krvácení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Provádějte pravidelné monitorování INR u všech léčených pacientů [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
- Léky, dietní změny a další faktory ovlivňují hladiny INR dosažené léčbou COUMADIN 5 mg (viz DROGOVÉ INTERAKCE ].
- Poučte pacienty o preventivních opatřeních k minimalizaci rizika krvácení a hlášení známek a příznaků krvácení [viz INFORMACE PRO PACIENTA ].
POPIS
COUMADIN (warfarin sodný) tablety a COUMADIN (warfarin sodný) pro injekci obsahují warfarin sodný, antikoagulant, který působí tak, že inhibuje koagulační faktory závislé na vitaminu K. Chemický název warfarinu sodného je sodná sůl 3-(a-acetonylbenzyl)-4-hydroxykumarinu, což je racemická směs R- a S-enantiomerů. Krystalický warfarin sodný je isopropanol klatrát. Jeho empirický vzorec je C19H15NaO4 a jeho strukturní vzorec je reprezentován následujícím:
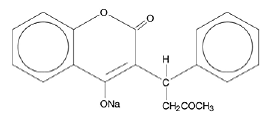
Krystalický warfarin sodný se vyskytuje jako bílý krystalický prášek bez zápachu, který se světlem zbarvuje. Je velmi rozpustný ve vodě, volně rozpustný v alkoholu a velmi málo rozpustný v chloroformu a etheru.
Tablety COUMADIN pro perorální podání také obsahují:
COUMADIN 1 mg na injekci pro intravenózní použití se dodává jako sterilní lyofilizovaný prášek, který po rekonstituci s 2,7 ml sterilní vody na injekci obsahuje:
INDIKACE
COUMADIN® je indikován pro:
- Profylaxe a léčba žilní trombózy a její extenze, plicní embolie (PE).
- Profylaxe a léčba tromboembolických komplikací spojených s fibrilací síní (AF) a/nebo náhradou srdeční chlopně.
- Snížení rizika úmrtí, recidivujícího infarktu myokardu (IM) a tromboembolických příhod, jako je mrtvice nebo systémová embolizace po infarktu myokardu.
Omezení použití
COUMADIN 2 mg nemá přímý účinek na vytvořený trombus ani nevrací ischemické poškození tkáně. Jakmile však dojde k trombu, cílem antikoagulační léčby je zabránit dalšímu rozšiřování vytvořené sraženiny a zabránit sekundárním tromboembolickým komplikacím, které mohou vést k vážným a možná smrtelným následkům.
DÁVKOVÁNÍ A PODÁVÁNÍ
Individuální dávkování
Dávkování a podávání přípravku COUMADIN 2 mg musí být individuální pro každého pacienta podle pacientovy odpovědi INR na lék. Upravte dávku na základě INR pacienta a léčeného stavu. Prostudujte si nejnovější doporučení pro klinickou praxi založenou na důkazech, pokud jde o trvání a intenzitu antikoagulace u indikovaných stavů.
Doporučené cílové rozsahy a trvání INR pro jednotlivé indikace
Zdá se, že INR vyšší než 4,0 neposkytuje žádný další terapeutický přínos u pacientů s mos a je spojeno s vyšším rizikem krvácení.
Žilní tromboembolismus (včetně hluboké žilní trombózy [DVT] a PE)
Upravte dávku warfarinu tak, aby byla zachována cílová hodnota INR 2,5 (rozsah INR, 2,0-3,0) po celou dobu léčby.
Délka léčby je založena na indikaci takto:
- U pacientů s DVT nebo PE sekundární k přechodnému (reverzibilnímu) rizikovému faktoru se doporučuje léčba warfarinem po dobu 3 měsíců.
- pacientů s nevyprovokovanou DVT nebo PE se doporučuje léčba warfarinem po dobu alespoň 3 měsíců. Po 3 měsících terapie vyhodnoťte poměr rizika a přínosu dlouhodobé léčby pro jednotlivého pacienta.
- U pacientů se dvěma epizodami nevyprovokované DVT nebo PE se doporučuje dlouhodobá léčba warfarinem. U pacienta, který dostává dlouhodobou antikoagulační léčbu, pravidelně přehodnocujte poměr rizika a přínosu pokračování takové léčby u jednotlivého pacienta.
Fibrilace síní
U pacientů s nevalvulární FS antikoagulujte warfarinem k dosažení cílové hodnoty INR 2,5 (rozmezí 2,0-3,0).
- pacientů s nevalvulární FS, která je perzistující nebo paroxysmální a mají vysoké riziko cévní mozkové příhody (tj. s některým z následujících znaků: předchozí ischemická cévní mozková příhoda, tranzitorní ischemická ataka nebo systémová embolie, nebo 2 z následujících rizikových faktorů: věk vyšší více než 75 let, středně nebo těžce narušená systolická funkce levé komory a/nebo srdeční selhání, anamnéza hypertenze nebo diabetes mellitus), doporučuje se dlouhodobá antikoagulace warfarinem.
- U pacientů s nevalvulární FS, která je perzistující nebo paroxysmální a se středním rizikem ischemické cévní mozkové příhody (tj. s 1 z následujících rizikových faktorů: věk vyšší než 75 let, středně nebo těžce narušená systolická funkce levé komory a/nebo srdeční selhání , anamnéza hypertenze nebo diabetes mellitus), doporučuje se dlouhodobá antikoagulační léčba warfarinem.
- U pacientů s FS a mitrální stenózou se doporučuje dlouhodobá antikoagulace warfarinem.
- pacientů s FS a umělými srdečními chlopněmi se doporučuje dlouhodobá antikoagulace warfarinem; cílové INR lze zvýšit a přidat aspirin v závislosti na typu a poloze chlopně a na faktorech pacienta.
Mechanické a bioprotetické srdeční chlopně
- U pacientů s mechanickou chlopní s bileafletem nebo sklopnou ploténkovou chlopní Medtronic Hall (Minneapolis, MN) v aortální poloze, kteří jsou v sinusovém rytmu a bez zvětšení levé síně, léčba warfarinem na cílové INR 2,5 (rozmezí 2,0-3,0) je doporučeno.
- U pacientů se sklopnými diskovými chlopněmi a mechanickými chlopněmi s bileafletem v mitrální poloze se doporučuje terapie warfarinem do cílové hodnoty INR 3,0 (rozmezí 2,5–3,5).
- U pacientů s klecovými kulovými nebo klecovými diskovými chlopněmi se doporučuje terapie warfarinem do cílové hodnoty INR 3,0 (rozmezí 2,5–3,5).
- pacientů s bioprotetickou chlopní v mitrální poloze se doporučuje terapie warfarinem do cílové hodnoty INR 2,5 (rozmezí 2,0–3,0) po dobu prvních 3 měsíců po zavedení chlopně. Pokud jsou přítomny další rizikové faktory pro tromboembolismus (AF, předchozí tromboembolismus, dysfunkce levé komory), doporučuje se cílové INR 2,5 (rozmezí 2,0–3,0).
Po infarktu myokardu
- U vysoce rizikových pacientů s IM (např. pacientů s velkým předním IM, pacientů s významným srdečním selháním, pacientů s intrakardiálním trombem viditelným na transtorakální echokardiografii, pacientů s FS a pacientů s tromboembolickou příhodou v anamnéze) je vhodná kombinovaná warfarin se střední intenzitou (INR, 2,0-3,0) plus nízká dávka aspirinu (≤100 mg/den) po dobu nejméně 3 měsíců po IM.
Recidivující systémová embolie a další indikace
Perorální antikoagulační léčba warfarinem nebyla plně hodnocena klinickými studiemi u pacientů s chlopenním onemocněním spojeným s FS, pacientů s mitrální stenózou a pacientů s recidivující systémovou embolií neznámé etiologie. U těchto pacientů však lze použít režim střední dávky (INR 2,0-3,0).
Počáteční a udržovací dávkování
Vhodné počáteční dávkování přípravku COUMADIN 2 mg se u různých pacientů značně liší. Ne všechny faktory odpovědné za variabilitu dávek warfarinu jsou známy a počáteční dávka je ovlivněna:
- Klinické faktory včetně věku, rasy, tělesné hmotnosti, pohlaví, souběžných léků a komorbidit
- Genetické faktory (genotypy CYP2C9 a VKORC1) [viz KLINICKÁ FARMAKOLOGIE ].
Počáteční dávku zvolte na základě očekávané udržovací dávky s přihlédnutím k výše uvedeným faktorům. Upravte tuto dávku na základě zvážení klinických faktorů specifických pro pacienta. Zvažte nižší počáteční a udržovací dávky u starších a/nebo oslabených pacientů a u asijských pacientů [viz Použití u konkrétních populací a KLINICKÁ FARMAKOLOGIE ]. Rutinní používání nasycovacích dávek se nedoporučuje, protože tato praxe může zvýšit hemoragické a jiné komplikace a nenabízí rychlejší ochranu proti tvorbě sraženin.
U každého pacienta individualizujte délku terapie. Obecně by antikoagulační léčba měla pokračovat, dokud nebezpečí trombózy a embolie nepomine [viz Doporučené cílové rozsahy a trvání INR pro jednotlivé indikace ].
Doporučené dávkování bez zohlednění genotypu
Pokud u pacienta nejsou známy genotypy CYP2C9 a VKORC1, je počáteční dávka přípravku COUMADIN 1 mg obvykle 2 až 5 mg jednou denně. U každého pacienta určete potřebu dávkování pečlivým sledováním odpovědi INR a zvážením léčené indikace. Typické udržovací dávky jsou 2 až 10 mg jednou denně.
Doporučené dávkování s ohledem na genotyp
Tabulka 1 ukazuje tři rozsahy očekávaných udržovacích dávek COUMADINu pozorovaných u podskupin pacientů s různými kombinacemi variant genu CYP2C9 a VKORC1 [viz KLINICKÁ FARMAKOLOGIE ]. Pokud je u pacienta znám genotyp CYP2C9 a/nebo VKORC1, zvažte tato rozmezí při výběru počáteční dávky. Pacienti s CYP2C9 *1/*3, *2/*2, *2/*3 a *3/*3 mohou vyžadovat delší dobu (>2 až 4 týdny) k dosažení maximálního účinku INR pro daný dávkovací režim než pacientů bez těchto variant CYP.
Monitorování k dosažení optimální antikoagulace
COUMADIN má úzké terapeutické rozmezí (index) a jeho účinek může být ovlivněn faktory, jako jsou jiné léky a vitamin K v potravě. Proto musí být během léčby přípravkem COUMADIN pečlivě sledována antikoagulace. Stanovte INR denně po podání úvodní dávky, dokud se výsledky INR nestabilizují v terapeutickém rozmezí. Po stabilizaci udržujte dávkování v terapeutickém rozmezí prováděním pravidelných INR. Frekvence provádění INR by měla být založena na klinické situaci, ale obecně přijatelné intervaly pro stanovení INR jsou 1 až 4 týdny. Proveďte další testy INR, když jsou jiné produkty warfarinu zaměněny za COUMADIN, stejně jako kdykoli jsou zahájeny, přerušeny nebo nepravidelně užívány jiné léky. Heparin, běžné souběžné léčivo, zvyšuje INR [viz Konverze z jiných antikoagulancií a DROGOVÉ INTERAKCE ].
Stanovení srážlivosti plné krve a časů krvácení nejsou účinnými opatřeními pro sledování léčby přípravkem COUMADIN 5 mg.
Renální poškození
pacientů s renálním selháním není nutná žádná úprava dávkování. Monitorujte INR častěji u pacientů se zhoršenou funkcí ledvin, abyste udrželi INR v terapeutickém rozmezí [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Zmeškaná dávka
Antikoagulační účinek přípravku COUMADIN přetrvává déle než 24 hodin. Pokud pacient vynechá dávku přípravku COUMADIN v zamýšlenou denní dobu, měl by užít dávku co nejdříve ve stejný den. Pacient by následující den neměl zdvojnásobit dávku, aby nahradil vynechanou dávku.
Intravenózní cesta podání
Intravenózní dávka přípravku COUMADIN 1 mg je stejná jako perorální dávka. Po rekonstituci podávejte COUMADIN na injekci jako pomalou bolusovou injekci do periferní žíly po dobu 1 až 2 minut.
COUMADIN 2 mg pro injekci se nedoporučuje k intramuskulární aplikaci.
Rekonstituujte lahvičku 2,7 ml sterilní vody na injekci. Výsledný výtěžek je 2,5 ml 2 mg na ml roztoku (5 mg celkem). Parenterální léčivé přípravky by měly být před podáním vizuálně zkontrolovány na přítomnost částic a změnu barvy, kdykoli to roztok a nádoba dovolí. Nepoužívejte, pokud jsou zaznamenány částice nebo změna barvy.
Po rekonstituci je COUMADIN pro injekci stabilní po dobu 4 hodin při pokojové teplotě. Neobsahuje žádné antimikrobiální konzervační látky, a proto je třeba dbát na zajištění sterility připraveného roztoku. Injekční lahvička je pouze pro jednorázové použití, veškerý nepoužitý roztok zlikvidujte.
Léčba během stomatologie a chirurgie
Některé stomatologické nebo chirurgické zákroky mohou vyžadovat přerušení nebo změnu dávkování přípravku COUMADIN. Zvažte přínosy a rizika při vysazení přípravku COUMADIN 2 mg i na krátkou dobu. Určete INR bezprostředně před jakýmkoli zubním nebo chirurgickým zákrokem. U pacientů podstupujících minimálně invazivní procedury, kteří musí být antikoagulováni před, během nebo bezprostředně po těchto procedurách, může úprava dávkování přípravku COUMADIN k udržení INR na dolní hranici terapeutického rozmezí bezpečně umožnit pokračování antikoagulace.
Konverze z jiných antikoagulancií
heparin
Vzhledem k tomu, že plného antikoagulačního účinku přípravku COUMADIN 2 mg není dosaženo za několik dní, je pro počáteční rychlou antikoagulaci preferován heparin. Během počáteční léčby přípravkem COUMADIN má interference s heparinovou antikoagulací minimální klinický význam. Konverze na COUMADIN může začít současně s léčbou heparinem nebo může být odložena o 3 až 6 dní. K zajištění terapeutické antikoagulace pokračujte v plné dávce heparinové terapie a překryjte léčbu přípravkem COUMADIN s heparinem po dobu 4 až 5 dnů a dokud přípravek COUMADIN 2 mg nevyvolá požadovanou terapeutickou odpověď stanovenou pomocí INR, v tomto okamžiku lze heparin vysadit.
Protože heparin může ovlivnit INR, pacienti užívající jak heparin, tak COUMADIN 1 mg by měli mít INR monitorován alespoň:
- 5 hodin po poslední intravenózní bolusové dávce heparinu, popř
- 4 hodiny po ukončení kontinuální nitrožilní infuze heparinu, popř
- 24 hodin po poslední subkutánní injekci heparinu.
COUMADIN 1 mg může zvýšit test aktivovaného parciálního tromboplastinového času (aPTT), a to i v nepřítomnosti heparinu. Závažné zvýšení (> 50 sekund) aPTT s INR v požadovaném rozsahu bylo identifikováno jako indikace zvýšeného rizika pooperačního krvácení.
Další antikoagulancia
Pokyny pro přechod na COUMADIN naleznete na štítcích ostatních antikoagulancií.
JAK DODÁVÁNO
Dávkové formy A Síly
Tablety
COUMADIN tablety s jednou rýhou
Pro vstřikování
Pro injekci: 5 mg, lyofilizovaný prášek v jednodávkové lahvičce.
Skladování A Manipulace
Tablety
Tablety COUMADIN jsou s jednou rýhou s jednou rýhou s číselným potiskem 1, 2, 2-1/2, 3, 4, 5, 6, 7-1/2 nebo 10 překrývajícími se a s nápisem „COUMADIN“ a s opačnou stranou prostý. COUMADIN je dostupný v lahvičkách a nemocničních jednodávkových blistrech s potencemi a barvami následovně:
Chraňte před světlem a vlhkostí. Skladujte při kontrolované pokojové teplotě (59°-86°F, 15°-30°C). Dávkujte v těsné nádobě odolné vůči světlu, jak je definováno v USP.
Uchovávejte nemocniční jednodávkové blistry v krabičce, dokud obsah nespotřebujete.
Injekce
COUMADIN pro injekční lahvičky výtěžek 5 mg warfarinu po rekonstituci s 2,7 ml sterilní vody na injekci (maximální výtěžek je 2,5 ml roztoku 2 mg/ml). Čistý obsah lahvičky je 5,4 mg lyofilizovaného prášku.
5mg lahvička (krabice po 6) - NDC 0590-0324-35
Chraňte před světlem. Uchovávejte lahvičku v krabičce až do použití. Skladujte při kontrolované pokojové teplotě (59°-86°F, 15°- 30°C).
Po rekonstituci uchovávejte při kontrolované pokojové teplotě (59°-86°F, 15°-30°C) a spotřebujte do 4 hodin.
Neuchovávejte v chladničce. Zlikvidujte veškerý nepoužitý roztok.
Speciální manipulace
Je třeba zvážit postupy pro správnou manipulaci a likvidaci potenciálně nebezpečných léků.
Pokyny k tomuto tématu byly zveřejněny [ viz REFERENCE ].
Lékárna a klinický personál, který je těhotný, by se měl vyhnout expozici rozdrceným nebo rozbitým tabletám [viz Použití u konkrétních populací ].
REFERENCE
OSHA nebezpečné drogy. OSHA. http://www.osha.gov/SLTC/hazardousdrugs/index.html.
Distribuce: Bristol-Myers Squibb Company, Princeton, New Jersey 08543 USA. Revize: červen 2017
VEDLEJŠÍ EFEKTY
Následující závažné nežádoucí účinky přípravku COUMADIN 2 mg jsou podrobněji popsány v jiných částech označení:
- Krvácení [viz BOX VAROVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a PŘEDÁVKOVAT ]
- Nekróza tkání [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Kalcifylaxe [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Akutní poškození ledvin [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Systémová atheroembolie a cholesterolová mikroembolie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Ischemie končetin, nekróza a gangréna u pacientů s HIT a HITTS [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Jiná klinická nastavení se zvýšenými riziky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Mezi další nežádoucí účinky přípravku COUMADIN 1 mg patří:
- Poruchy imunitního systému: přecitlivělost/alergické reakce (včetně kopřivky a anafylaktických reakcí)
- Cévní poruchy: vaskulitida
- Poruchy jater a žlučových cest: hepatitida, zvýšené jaterní enzymy. Cholestatická hepatitida byla spojena se současným podáváním přípravku COUMADIN a tiklopidinu.
- Gastrointestinální poruchy: nevolnost, zvracení, průjem, perverze chuti, bolest břicha, plynatost, nadýmání
- Kožní poruchy: vyrážka, dermatitida (včetně bulózních erupcí), pruritus, alopecie
- Poruchy dýchání: tracheální nebo tracheobronchiální kalcifikace
- Celkové poruchy: zimnice
DROGOVÉ INTERAKCE
Léky mohou interagovat s přípravkem COUMADIN 5 mg prostřednictvím farmakodynamických nebo farmakokinetických mechanismů. Farmakodynamické mechanismy lékových interakcí s přípravkem COUMADIN 2 mg jsou synergismus (zhoršená hemostáza, snížená syntéza koagulačních faktorů), kompetitivní antagonismus (vitamin K) a změna fyziologické regulační smyčky metabolismu vitaminu K (dědičná rezistence). Farmakokinetické mechanismy lékových interakcí s přípravkem COUMADIN jsou především indukce enzymů, inhibice enzymů a snížená vazba na plazmatické proteiny. Je důležité si uvědomit, že některé léky mohou interagovat více než jedním mechanismem. Častější monitorování INR by mělo být prováděno při zahájení nebo vysazení jiných léků, včetně rostlinných, nebo při změně dávkování jiných léků, včetně léků určených ke krátkodobému užívání (např. antibiotika, antimykotika, kortikosteroidy) [viz. BOX VAROVÁNÍ ].
Chcete-li získat další informace o interakcích s přípravkem COUMADIN nebo nežádoucích účincích souvisejících s krvácením, podívejte se na označení všech současně užívaných léků.
Interakce CYP450
Mezi izoenzymy CYP450 zapojené do metabolismu warfarinu patří CYP2C9, 2C19, 2C8, 2C18, 1A2 a 3A4. Silnější warfarin S-enantiomer je metabolizován CYP2C9, zatímco R-enantiomer je metabolizován CYP1A2 a 3A4.
- Inhibitory CYP2C9, 1A2 a/nebo 3A4 mají potenciál zvýšit účinek (zvýšení INR) warfarinu zvýšením expozice warfarinu.
- Induktory CYP2C9, 1A2 a/nebo 3A4 mají potenciál snížit účinek (snížit INR) warfarinu snížením expozice warfarinu.
Příklady inhibitorů a induktorů CYP2C9, 1A2 a 3A4 jsou níže v tabulce 2; tento seznam by však neměl být považován za úplný. Chcete-li získat další informace o potenciálu interakce CYP450, podívejte se na označení všech současně užívaných léků. Inhibiční a indukční potenciál CYP450 je třeba vzít v úvahu při zahájení, vysazení nebo změně dávky souběžně podávaných léků. Pečlivě sledujte INR, pokud je současně podávaným lékem inhibitor nebo induktor CYP2C9, 1A2 a/nebo 3A4.
Léky, které zvyšují riziko krvácení
Příklady léků, o kterých je známo, že zvyšují riziko krvácení, jsou uvedeny v tabulce 3. Vzhledem k tomu, že riziko krvácení se zvyšuje, jsou-li tyto léky užívány současně s warfarinem, pečlivě sledujte pacienty užívající jakýkoli takový lék s warfarinem.
Antibiotika a antimykotika
pacientů užívajících warfarin a antibiotika nebo antimykotika byly hlášeny změny INR, ale klinické farmakokinetické studie neprokázaly konzistentní účinky těchto látek na plazmatické koncentrace warfarinu.
Pečlivě sledujte INR při zahájení nebo ukončení jakéhokoli antibiotika nebo antimykotika u pacientů užívajících warfarin.
Botanické (bylinné) Produkty A Potraviny
Častější monitorování INR by mělo být prováděno při zahajování nebo vysazování botanicals.
Existuje několik adekvátních, dobře kontrolovaných studií hodnotících potenciál pro metabolické a/nebo farmakologické interakce mezi rostlinnými látkami a přípravkem COUMADIN 2 mg. Vzhledem k nedostatečné standardizaci výroby u rostlinných léčivých přípravků se může množství účinných látek lišit. To by mohlo dále zmást schopnost posoudit potenciální interakce a účinky na antikoagulaci.
Některá rostlinná léčiva mohou způsobit krvácivé příhody, když se užívají samostatně (např. česnek a Ginkgo biloba) a mohou mít antikoagulační, protidestičkové a/nebo fibrinolytické vlastnosti. Lze očekávat, že tyto účinky budou aditivní k antikoagulačním účinkům přípravku COUMADIN. Některá rostlinná léčiva mohou naopak účinky COUMADINu snižovat (např. koenzym Q10, třezalka tečkovaná, ženšen). Některá rostlinná léčiva a potraviny mohou interagovat s COUMADIN 2 mg prostřednictvím interakce CYP450 (např. echinacea, grapefruitová šťáva, ginkgo, zlatobýl, třezalka tečkovaná).
Množství vitaminu K v potravě může ovlivnit léčbu přípravkem COUMADIN. Poraďte pacientům užívajícím COUMADIN 1 mg, aby jedli normální, vyváženou stravu s konstantním množstvím vitamínu K. Pacienti užívající COUMADIN 5 mg by se měli vyvarovat drastických změn ve stravovacích návycích, jako je konzumace velkého množství zelené listové zeleniny.
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Krvácení
COUMADIN může způsobit velké nebo smrtelné krvácení. Krvácení je pravděpodobnější během prvního měsíce. Mezi rizikové faktory krvácení patří vysoká intenzita antikoagulace (INR >4,0), věk vyšší nebo rovný 65, anamnéza vysoce variabilních INR, anamnéza gastrointestinálního krvácení, hypertenze, cerebrovaskulární onemocnění, anémie, malignita, trauma, poškození ledvin, určité genetické faktory [viz KLINICKÁ FARMAKOLOGIE ], některá současně užívaná léčiva [viz DROGOVÉ INTERAKCE ] a dlouhou dobu léčby warfarinem.
Provádějte pravidelné monitorování INR u všech léčených pacientů. Pacienti s vysokým rizikem krvácení mohou mít prospěch z častějšího monitorování INR, pečlivé úpravy dávky na požadovaný INR a nejkratší doby trvání léčby vhodné pro klinický stav. Udržení INR v terapeutickém rozmezí však neeliminuje riziko krvácení.
Léky, dietní změny a další faktory ovlivňují hladiny INR dosažené při léčbě přípravkem COUMADIN 1 mg. Provádějte častější monitorování INR při zahájení nebo ukončení jiných léků, včetně rostlinných látek, nebo při změně dávkování jiných léků (viz DROGOVÉ INTERAKCE ].
Poučte pacienty o preventivních opatřeních k minimalizaci rizika krvácení a hlášení známek a příznaků krvácení [viz INFORMACE PRO PACIENTA ].
Nekróza tkání
Nekróza a/nebo gangréna kůže a jiných tkání je méně časté, ale závažné riziko (
určení, zda je nekróza způsobena základním onemocněním, je nutné pečlivé klinické hodnocení. Ačkoli byly zkoušeny různé způsoby léčby, žádná léčba nekrózy nebyla považována za jednotně účinnou. Pokud se objeví nekróza, přerušte léčbu přípravkem COUMADIN 5 mg. Zvažte alternativní léky, pokud je nutná pokračující antikoagulační léčba.
Kalcifylaxe
Fatální a závažná kalcifylaxe nebo kalciová uremická arteriolopatie byly hlášeny u pacientů s terminálním onemocněním ledvin a bez něj. Když je u těchto pacientů diagnostikována kalcifylaxe, přerušte léčbu přípravkem COUMADIN 5 mg a léčte kalcifylaxi podle potřeby. Zvažte alternativní antikoagulační léčbu.
Akutní poškození ledvin
U pacientů se změněnou glomerulární integritou nebo s onemocněním ledvin v anamnéze může dojít k akutnímu poškození ledvin při podávání přípravku COUMADIN 2 mg, pravděpodobně v souvislosti s epizodami nadměrné antikoagulace a hematurie (viz Použití u konkrétních populací ]. U pacientů se zhoršenou funkcí ledvin se doporučuje častější monitorování antikoagulace.
Systémové Atheroemboli A Cholesterolové Mikroemboly
Antikoagulační léčba přípravkem COUMADIN může zvýšit uvolňování ateromatózních plakových embolií. Systémové atheroembolie a cholesterolové mikroembolie se mohou projevovat různými příznaky a symptomy v závislosti na místě embolizace. Nejčastěji postiženými viscerálními orgány jsou ledviny následované slinivkou, slezinou a játry. Některé případy pokročily v nekrózu nebo smrt. Odlišný syndrom vyplývající z mikroembolií na nohou je známý jako „syndrom purpurových prstů“. Pokud takové jevy zpozorujete, přerušte léčbu přípravkem COUMADIN. Zvažte alternativní léky, pokud je nutná pokračující antikoagulační léčba.
Ischemie končetin, nekróza a gangréna u pacientů s HIT a HITTS
Nepoužívejte COUMADIN jako počáteční léčbu u pacientů s heparinem indukovanou trombocytopenií (HIT) as heparinem indukovanou trombocytopenií se syndromem trombózy (HITTS). U pacientů s HIT a HITTS se vyskytly případy ischemie končetin, nekrózy a gangrény, když byla léčba heparinem přerušena a léčba warfarinem byla zahájena nebo pokračovala. U některých pacientů zahrnovaly následky amputaci postižené oblasti a/nebo smrt. Léčba přípravkem COUMADIN může být zvážena poté, co se počet krevních destiček normalizuje.
Použití u těhotných žen s mechanickými srdečními chlopněmi
COUMADIN může způsobit poškození plodu při podání těhotné ženě. Zatímco COUMADIN je během těhotenství kontraindikován, potenciální přínosy užívání přípravku COUMADIN 1 mg mohou převážit rizika pro těhotné ženy s mechanickými srdečními chlopněmi s vysokým rizikem tromboembolie. V těchto individuálních situacích by mělo být rozhodnutí zahájit nebo pokračovat v léčbě přípravkem COUMADIN 2 mg přezkoumáno s pacientem, přičemž je třeba vzít v úvahu specifická rizika a přínosy týkající se zdravotního stavu jednotlivého pacienta, jakož i nejnovější lékařské pokyny. Expozice přípravku COUMADIN během těhotenství způsobuje uznávaný vzor hlavních vrozených malformací (embrypatie warfarinu a fetotoxicita), fatální fetální krvácení a zvýšené riziko spontánního potratu a fetální mortality. Pokud se tento lék užívá během těhotenství nebo pokud pacientka otěhotní během užívání tohoto léku, měla by být informována o potenciálním riziku pro plod (viz Použití u konkrétních populací ].
Jiná klinická nastavení se zvýšenými riziky
následujících klinických podmínkách mohou být rizika léčby přípravkem COUMADIN zvýšena:
- Středně těžké až těžké poškození jater
- Infekční onemocnění nebo poruchy střevní flóry (např. sprue, antibiotická terapie)
- Použití zavedeného katétru
- Těžká až střední hypertenze
- Deficit antikoagulační odpovědi zprostředkované proteinem C: COUMADIN snižuje syntézu přirozeně se vyskytujících antikoagulancií, proteinu C a proteinu S. Dědičné nebo získané nedostatky proteinu C nebo jeho kofaktoru, proteinu S, byly spojeny s nekrózou tkání po podání warfarinu. Současná antikoagulační léčba heparinem po dobu 5 až 7 dnů při zahájení léčby přípravkem COUMADIN 2 mg může minimalizovat výskyt tkáňové nekrózy u těchto pacientů.
- Operace oka: Při operaci šedého zákalu bylo použití přípravku COUMADIN spojeno s významným nárůstem menších komplikací s ostrou jehlou a blokem lokální anestezie, ale nebylo spojeno s potenciálně zrak ohrožujícími operačními hemoragickými komplikacemi. Vzhledem k tomu, že vysazení nebo snížení dávky přípravku COUMADIN 5 mg může vést k závažným tromboembolickým komplikacím, rozhodnutí přerušit léčbu přípravkem COUMADIN před relativně méně invazivní a složitou operací oka, jako je operace čočky, by mělo být založeno na zvážení rizik antikoagulační léčby oproti přínosům.
- Polycythemia vera
- Vaskulitida
- Diabetes mellitus
Endogenní faktory ovlivňující INR
Za zvýšenou odpověď INR mohou být zodpovědné následující faktory: průjem, poruchy jater, špatný stav výživy, steatorea nebo nedostatek vitaminu K.
Za sníženou odpověď INR mohou být zodpovědné následující faktory: zvýšený příjem vitaminu K nebo dědičná rezistence na warfarin.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( Průvodce léky ).
Pokyny pro pacienty
Doporučte pacientům, aby:
- Přísně dodržujte předepsané dávkovací schéma [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
- Pokud vynecháte předepsanou dávku přípravku COUMADIN 1 mg, vezměte si dávku co nejdříve ve stejný den, ale neužívejte dvojnásobnou dávku přípravku COUMADIN 5 mg následující den, abyste nahradili vynechanou dávku (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
- Získejte testy protrombinového času a pravidelně navštěvujte svého lékaře nebo kliniku, abyste sledovali léčbu [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
- Uvědomte si, že pokud je léčba přípravkem COUMADIN přerušena, antikoagulační účinky přípravku COUMADIN 5 mg mohou přetrvávat přibližně 2 až 5 dnů (viz KLINICKÁ FARMAKOLOGIE ].
- Vyhněte se jakékoli činnosti nebo sportu, které mohou mít za následek traumatické zranění [viz Použití u konkrétních populací ]. A říct svému lékaři, pokud často padají, protože to může zvýšit jejich riziko komplikací.
- Jezte normální, vyváženou stravu, abyste si udrželi stálý příjem vitamínu K. Vyvarujte se drastickým změnám ve stravovacích návycích, jako je konzumace velkého množství listové, zelené zeleniny [viz DROGOVÉ INTERAKCE ].
- Kontaktujte svého lékaře, aby nahlásil jakékoli závažné onemocnění, jako je těžký průjem, infekce nebo horečka [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a NEŽÁDOUCÍ REAKCE ].
- Noste s sebou identifikační údaj o tom, že užívají COUMADIN.
Rizika krvácení
Poraďte pacientům
- Okamžitě informujte svého lékaře, pokud se objeví neobvyklé krvácení nebo příznaky. Příznaky a příznaky krvácení zahrnují: bolest, otok nebo nepohodlí, prodloužené krvácení z řezných ran, zvýšený menstruační výtok nebo vaginální krvácení, krvácení z nosu, krvácení z dásní při čištění zubů, neobvyklé krvácení nebo modřiny, červená nebo tmavě hnědá moč, červená nebo dehtově černá stolice, bolest hlavy, závratě nebo slabost [viz BOX VAROVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Doprovodné léky a rostlinné přípravky (rostlinné)
Doporučte pacientům, aby:
- Neužívejte ani nepřerušujte žádné jiné léky, včetně salicylátů (např. aspirin a lokální analgetika), jiných volně prodejných léků a rostlinných (rostlinných) produktů, s výjimkou doporučení vašeho lékaře [viz DROGOVÉ INTERAKCE ].
Těhotenství A Kojení
Doporučte pacientům, aby:
- Kontaktujte jejich lékaře
- okamžitě, pokud si myslí, že jsou těhotné [viz Použití u konkrétních populací ],
- diskutovat o plánování těhotenství [viz Použití u konkrétních populací ],
- pokud uvažují o kojení [viz Použití u konkrétních populací ].
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Studie karcinogenity, mutagenity nebo fertility nebyly s warfarinem provedeny.
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
COUMADIN 1 mg je kontraindikován u žen, které jsou těhotné, s výjimkou těhotných žen s mechanickými srdečními chlopněmi, které jsou vystaveny vysokému riziku tromboembolie a u kterých mohou přínosy přípravku COUMADIN 5 mg převážit rizika (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. COUMADIN 1 mg může způsobit poškození plodu. Expozice warfarinu během prvního trimestru těhotenství způsobila vzorec vrozených malformací asi u 5 % exponovaných potomků. Protože tyto údaje nebyly shromážděny v adekvátních a dobře kontrolovaných studiích, není tento výskyt závažných vrozených vad dostatečným základem pro srovnání s odhadovaným výskytem v kontrolní skupině nebo obecné populaci v USA a nemusí odrážet výskyt pozorovaný v praxi. Při předepisování přípravku COUMADIN těhotné ženě zvažte přínosy a rizika přípravku COUMADIN a možná rizika pro plod.
Nepříznivé důsledky v těhotenství se objevují bez ohledu na zdravotní stav matky nebo užívání léků. Odhadované základní riziko závažných vrozených vad a potratu pro indikovanou populaci není známo. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 % až 4 % a 15 % až 20 %.
Klinické úvahy
Fetální/neonatální nežádoucí reakce
lidí warfarin prochází placentou a koncentrace v plazmě plodu se blíží hodnotám u matky. Expozice warfarinu během prvního trimestru těhotenství způsobila vzorec vrozených malformací asi u 5 % exponovaných potomků. Warfarinová embryopatie je charakterizována hypoplazií nosu s nebo bez tečkovaných epifýz (chondrodysplasia punctata) a retardací růstu (včetně nízké porodní hmotnosti). Byly také hlášeny abnormality centrálního nervového systému a oka, včetně dorzální dysplazie střední linie charakterizované agenezí corpus callosum, Dandy-Walkerovy malformace, střední cerebelární atrofie a ventrální střední dysplazie charakterizované atrofií optiku. Mentální retardace, slepota, schizencefalie, mikrocefalie, hydrocefalus a další nepříznivé výsledky těhotenství byly hlášeny po expozici warfarinu během druhého a třetího trimestru těhotenství (viz KONTRAINDIKACE ].
Laktace
Shrnutí rizik
Warfarin nebyl přítomen v lidském mléce matek léčených warfarinem z omezené publikované studie. Vzhledem k potenciálu závažných nežádoucích reakcí, včetně krvácení u kojeného dítěte, zvažte vývojové a zdravotní přínosy kojení spolu s klinickou potřebou matky užívat přípravek COUMADIN a případné nežádoucí účinky přípravku COUMADIN 2 mg na kojené dítě nebo základního onemocnění matky. před předepsáním přípravku COUMADIN 5 mg kojící ženě.
Klinické úvahy
Sledujte u kojících dětí modřiny nebo krvácení.
Data
Lidská data
Na základě publikovaných údajů u 15 kojících matek nebyl warfarin v mateřském mléce detekován. Mezi 15 donošenými novorozenci mělo 6 kojených dětí dokumentovaný protrombinový čas v očekávaném rozmezí. Protrombinové časy nebyly získány pro dalších 9 kojených dětí. Účinky u předčasně narozených dětí nebyly hodnoceny.
Ženy a muži reprodukčního potenciálu
Těhotenský test
COUMADIN může způsobit poškození plodu [viz Použití u konkrétních populací ].
Před zahájením léčby přípravkem COUMADIN ověřte stav těhotenství u žen s reprodukčním potenciálem.
Antikoncepce
Ženy
Informujte ženy s reprodukčním potenciálem, aby během léčby a alespoň 1 měsíc po poslední dávce přípravku COUMADIN používaly účinnou antikoncepci.
Pediatrické použití
Adekvátní a dobře kontrolované studie s přípravkem COUMADIN nebyly provedeny u žádné pediatrické populace a optimální dávkování, bezpečnost a účinnost u pediatrických pacientů není známa. Pediatrické použití přípravku COUMADIN je založeno na údajích a doporučeních pro dospělé a dostupných omezených pediatrických údajích z observačních studií a registrů pacientů. Pediatričtí pacienti, kterým je podáván COUMADIN 1 mg, by se měli vyvarovat jakékoli činnosti nebo sportu, které by mohly vést k traumatickému poranění.
Vyvíjející se hemostatický systém u kojenců a dětí vede ke změně fyziologie trombózy a odpovědi na antikoagulancia. Dávkování warfarinu u pediatrické populace se liší podle věku pacienta, přičemž kojenci mají obecně nejvyšší a dospívající mají nejnižší dávku miligramů na kilogram k udržení cílových INR. Vzhledem k měnícím se požadavkům na warfarin v důsledku věku, souběžné medikace, diety a stávajícího zdravotního stavu může být u pediatrických pacientů obtížné dosáhnout a udržet cílové rozmezí INR, a proto se doporučuje častější stanovení INR.
Míra krvácení se lišila podle populace pacientů a centra klinické péče v pediatrických observačních studiích a registrech pacientů.
Kojenci a děti, které dostávají výživu doplněnou vitamínem K, včetně kojenecké výživy, mohou být rezistentní na léčbu warfarinem, zatímco kojenci krmení lidským mlékem mohou být na léčbu warfarinem citliví.
Geriatrické použití
celkového počtu pacientů užívajících warfarin sodný v kontrolovaných klinických studiích, pro které byla data dostupná pro analýzu, bylo 1885 pacientů (24,4 %) ve věku 65 let a více, zatímco 185 pacientů (2,4 %) bylo ve věku 75 let a více. Mezi těmito pacienty a mladšími pacienty nebyly pozorovány žádné celkové rozdíly v účinnosti nebo bezpečnosti, nelze však vyloučit větší citlivost některých starších jedinců.
Zdá se, že pacienti ve věku 60 let nebo starší vykazují vyšší než očekávanou odpověď INR na antikoagulační účinky warfarinu (viz KLINICKÁ FARMAKOLOGIE ]. COUMADIN je kontraindikován u všech pacientů se senilitou bez dozoru. Buďte opatrní při podávání přípravku COUMADIN starším pacientům v jakékoli situaci nebo s jakýmkoli fyzickým stavem, kde je přítomno zvýšené riziko krvácení. Zvažte nižší zahajovací a udržovací dávky přípravku COUMADIN u starších pacientů (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Renální poškození
Renální clearance je považována za menší determinantu antikoagulační odpovědi na warfarin. U pacientů s poruchou funkce ledvin není nutná žádná úprava dávkování. Poučte pacienty s poruchou funkce ledvin užívající warfarin, aby častěji sledovali INR (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Poškození jater
Porucha funkce jater může potencovat odpověď na warfarin prostřednictvím poruchy syntézy koagulačních faktorů a sníženého metabolismu warfarinu. Při použití přípravku COUMADIN u těchto pacientů buďte opatrní.
PŘEDÁVKOVAT
Příznaky a symptomy
Krvácení (např. výskyt krve ve stolici nebo moči, hematurie, nadměrné menstruační krvácení, meléna, petechie, nadměrné podlitiny nebo přetrvávající výtok z povrchových poranění, nevysvětlitelný pokles hemoglobinu) je projevem nadměrné antikoagulace.
Léčba
Léčba nadměrné antikoagulace je založena na hladině INR, přítomnosti nebo nepřítomnosti krvácení a klinických okolnostech. Zrušení antikoagulační léčby přípravkem COUMADIN 2 mg lze dosáhnout přerušením léčby přípravkem COUMADIN 1 mg a v případě potřeby perorálním nebo parenterálním podáním vitaminu K1.
Užívání vitaminu K1 snižuje odpověď na následnou léčbu přípravkem COUMADIN a pacienti se mohou vrátit do trombotického stavu před léčbou po rychlém zvratu prodlouženého INR. Obnovení podávání přípravku COUMADIN 2 mg ruší účinek vitaminu K a pečlivou úpravou dávkování lze opět dosáhnout terapeutického INR. Je-li indikována rychlá re-antikoagulace, může být pro počáteční terapii výhodnější heparin.
Pokud je naléhavý požadavek na zvrácení účinků přípravku COUMADIN 2 mg, lze zvážit léčbu koncentrátem protrombinového komplexu (PCC), čerstvě zmrazenou plazmou nebo aktivovaným faktorem VII. S užíváním krevních produktů je spojeno riziko hepatitidy a dalších virových onemocnění; PCC a aktivovaný faktor VII jsou také spojeny se zvýšeným rizikem trombózy. Proto by se tyto přípravky měly používat pouze ve výjimečných nebo život ohrožujících krvácivých příhodách po předávkování přípravkem COUMADIN 2 mg.
KONTRAINDIKACE
COUMADIN 1 mg je kontraindikován u:
- Těhotenství
COUMADIN 2 mg je kontraindikován u žen, které jsou těhotné, s výjimkou těhotných žen s mechanickými srdečními chlopněmi, které jsou vystaveny vysokému riziku tromboembolie (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ]. COUMADIN 2 mg může způsobit poškození plodu při podání těhotné ženě. Expozice přípravku COUMADIN během těhotenství způsobuje uznávaný vzor hlavních vrozených malformací (embrypatie warfarinu a fetotoxicita), fatální fetální krvácení a zvýšené riziko spontánního potratu a fetální mortality. Pokud se COUMADIN používá během těhotenství nebo pokud pacientka otěhotní během užívání tohoto léku, měla by být informována o potenciálním riziku pro plod (viz Použití u konkrétních populací ].
COUMADIN je kontraindikován u pacientů s:
- Hemoragické tendence nebo krevní dyskrazie
- Nedávná nebo uvažovaná operace centrálního nervového systému nebo oka nebo traumatická chirurgie vedoucí k velkým otevřeným plochám [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Tendence ke krvácení spojené s:
- Aktivní ulcerace nebo zjevné krvácení gastrointestinálního, urogenitálního nebo respiračního traktu
- Krvácení centrálního nervového systému
- Mozková aneuryzmata, disekující aorta
- Perikarditida a perikardiální výpotky
- Bakteriální endokarditida
- Hrozící potrat, eklampsie a preeklampsie
- Pacienti bez dohledu se stavy spojenými s potenciálně vysokou mírou non-compliance
- Spinální punkce a další diagnostické nebo terapeutické postupy s možností nekontrolovatelného krvácení
- Hypersenzitivita na warfarin nebo na kteroukoli další složku tohoto přípravku (např. anafylaxe) [viz NEŽÁDOUCÍ REAKCE ]
- Velká regionální nebo bederní bloková anestezie
- Maligní hypertenze
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Warfarin působí tak, že inhibuje syntézu srážecích faktorů závislých na vitaminu K, které zahrnují faktory II, VII, IX a X a antikoagulační proteiny C a S. Vitamin K je nezbytným kofaktorem pro postribozomální syntézu vitaminu K- závislé faktory srážení. Vitamin K podporuje biosyntézu zbytků kyseliny γ-karboxyglutamové v proteinech, které jsou nezbytné pro biologickou aktivitu. Předpokládá se, že warfarin interferuje se syntézou srážecích faktorů inhibicí C1 podjednotky enzymového komplexu vitaminu K epoxidreduktázy (VKORC1), čímž snižuje regeneraci epoxidu vitaminu K1 [viz Farmakogenomika ].
Farmakodynamika
Antikoagulační účinek se obvykle dostaví do 24 hodin po podání warfarinu. Vrchol antikoagulačního účinku však může být opožděn o 72 až 96 hodin. Doba působení jedné dávky racemického warfarinu je 2 až 5 dnů. Účinky přípravku COUMADIN 1 mg mohou být výraznější, když se účinky denních udržovacích dávek překrývají. To je v souladu s poločasy rozpadu ovlivněných vitaminu K závislých koagulačních faktorů a antikoagulačních proteinů: Faktor II - 60 hodin, VII - 4 až 6 hodin, IX - 24 hodin, X - 48 až 72 hodin a proteiny C a S jsou přibližně 8 hodin, respektive 30 hodin.
Farmakokinetika
COUMADIN je racemická směs R- a S-enantiomerů warfarinu. S-enantiomer vykazuje 2 až 5krát vyšší antikoagulační aktivitu než R-enantiomer u lidí, ale obecně má rychlejší clearance.
Vstřebávání
Warfarin je po perorálním podání v podstatě zcela absorbován, přičemž maximální koncentrace je obvykle dosaženo během prvních 4 hodin.
Rozdělení
Warfarin se distribuuje do relativně malého zdánlivého distribučního objemu asi 0,14 l/kg. Distribuční fáze trvající 6 až 12 hodin je rozeznatelná po rychlém intravenózním nebo perorálním podání vodného roztoku. Přibližně 99 % léčiva se váže na plazmatické proteiny.
Metabolismus
Eliminace warfarinu probíhá téměř výhradně metabolismem. Warfarin je stereoselektivně metabolizován mikrozomálními enzymy jaterního cytochromu P-450 (CYP450) na neaktivní hydroxylované metabolity (převládající cesta) a reduktázami na redukované metabolity (warfarinové alkoholy) s minimální antikoagulační aktivitou. Identifikované metabolity warfarinu zahrnují dehydrowarfarin, dva diastereoizomerní alkoholy a 4'-, 6-, 7-, 8- a 10-hydroxywarfarin. Mezi izoenzymy CYP450 zapojené do metabolismu warfarinu patří CYP2C9, 2C19, 2C8, 2C18, 1A2 a 3A4. CYP2C9, polymorfní enzym, je pravděpodobně hlavní formou CYP450 lidských jater, která moduluje in vivo antikoagulační aktivitu warfarinu. Pacienti s jednou nebo více variantními alelami CYP2C9 mají sníženou clearance S-warfarinu [viz Farmakogenomika ].
Vylučování
Terminální poločas warfarinu po jedné dávce je přibližně 1 týden; účinný poločas se však pohybuje od 20 do 60 hodin, s průměrem asi 40 hodin. Clearance R-warfarinu je obecně poloviční než clearance S-warfarinu, takže protože distribuční objemy jsou podobné, poločas Rwarfarinu je delší než poločas S-warfarinu. Poločas rozpadu R-warfarinu se pohybuje od 37 do 89 hodin, zatímco poločas S-warfarinu se pohybuje od 21 do 43 hodin. Studie s radioaktivně značeným léčivem prokázaly, že až 92 % perorálně podané dávky se objeví v moči. Velmi málo warfarinu se vylučuje v nezměněné podobě močí. Vylučování močí probíhá ve formě metabolitů.
Geriatričtí pacienti
Zdá se, že pacienti ve věku 60 let nebo starší vykazují vyšší než očekávanou odpověď INR na antikoagulační účinky warfarinu. Příčina zvýšené citlivosti na antikoagulační účinky warfarinu u této věkové skupiny není známa, ale může být způsobena kombinací farmakokinetických a farmakodynamických faktorů. Omezené informace naznačují, že v clearance S-warfarinu není žádný rozdíl; nicméně u starších pacientů ve srovnání s mladými může dojít k mírnému snížení clearance R-warfarinu. Proto, jak se věk pacientů zvyšuje, je obvykle vyžadována nižší dávka warfarinu k dosažení terapeutické úrovně antikoagulace (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Asijští pacienti
Asijští pacienti mohou vyžadovat nižší zahajovací a udržovací dávky warfarinu. Nekontrolovaná studie 151 čínských ambulantních pacientů stabilizovaných na warfarinu pro různé indikace uvádí průměrnou denní potřebu warfarinu 3,3 ± 1,4 mg k dosažení INR 2 až 2,5. Věk pacientů byl nejdůležitějším určujícím faktorem potřeby warfarinu u těchto pacientů, s progresivně nižší potřebou warfarinu s rostoucím věkem.
Farmakogenomika
Polymorfismy CYP2C9 a VKORC1
S-enantiomer warfarinu je metabolizován hlavně na 7-hydroxywarfarin pomocí CYP2C9, polymorfního enzymu. Variantní alely, CYP2C9*2 a CYP2C9*3, mají za následek in vitro sníženou CYP2C9 enzymatickou 7-hydroxylaci S-warfarinu. Frekvence těchto alel u bělochů je přibližně 11 % pro CYP2C9*2 a 7 % pro CYP2C9*3.
Jiné alely CYP2C9 spojené se sníženou enzymatickou aktivitou se vyskytují s nižšími frekvencemi, včetně alel *5, *6 a *11 v populacích afrického původu a alel *5, *9 a *11 u bělochů.
Warfarin snižuje regeneraci vitaminu K z epoxidu vitaminu K v cyklu vitaminu K inhibicí VKOR, multiproteinového enzymového komplexu. Určité jednonukleotidové polymorfismy v genu VKORC1 (např. .1639G>A) byly spojeny s požadavky na různé dávky warfarinu.
Varianty genů VKORC1 a CYP2C9 obecně vysvětlují největší podíl známé variability požadavků na dávku warfarinu.
Informace o genotypu CYP2C9 a VKORC1, jsou-li k dispozici, mohou pomoci při výběru počáteční dávky warfarinu [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Klinické studie
Fibrilace síní
pěti prospektivních, randomizovaných, kontrolovaných klinických studiích zahrnujících 3711 pacientů s nerevmatickou FS, warfarin významně snížil riziko systémové tromboembolie včetně cévní mozkové příhody (viz tabulka 4). Snížení rizika se pohybovalo od 60 % do 86 % ve všech s výjimkou jedné studie (CAFA: 45 %), která byla předčasně zastavena kvůli publikovaným pozitivním výsledkům dvou z těchto studií. Výskyt velkého krvácení se v těchto studiích pohyboval od 0,6 % do 2,7 % (viz tabulka 4).
Studie u pacientů s AF i mitrální stenózou naznačují přínos antikoagulace přípravkem COUMADIN [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Mechanické a bioprotetické srdeční chlopně
V prospektivní, randomizované, otevřené, pozitivně kontrolované studii u 254 pacientů s mechanickými protetickými srdečními chlopněmi bylo zjištěno, že interval bez tromboembolie je významně delší u pacientů léčených samotným warfarinem ve srovnání s pacienty léčenými dipyridamolem/aspirinem (p
prospektivní, otevřené, klinické studii porovnávající středně intenzivní (INR 2,65) versus vysoce intenzivní (INR 9,0) terapii warfarinem u 258 pacientů s mechanickými protetickými srdečními chlopněmi se tromboembolismus vyskytl s podobnou frekvencí ve dvou skupinách (4,0 a 3,7 příhod na 100 pacientské roky). Velké krvácení bylo častější ve skupině s vysokou intenzitou. Výsledky této studie jsou uvedeny v tabulce 6.
V randomizované studii u 210 pacientů porovnávající dvě intenzity léčby warfarinem (INR 2,0-2,25 vs. INR 2,5-4,0) po dobu tří měsíců po náhradě tkáňové srdeční chlopně se tromboembolismus vyskytoval s podobnou frekvencí ve dvou skupinách (velké embolické příhody 2,0 % vs. 1,9 %, v tomto pořadí a drobné embolické příhody 10,8 % vs. 10,2 %, v tomto pořadí). Velké krvácení se vyskytlo u 4,6 % pacientů ve skupině s vyšší intenzitou INR ve srovnání s nulou ve skupině s nižší intenzitou INR.
Infarkt myokardu
WARIS (The Warfarin Re-Infarction Study) byla dvojitě zaslepená, randomizovaná studie s 1214 pacienty 2 až 4 týdny po infarktu léčených warfarinem s cílovým INR 2,8 až 4,8. Primárním cílovým parametrem byla kombinace celkové mortality a recidivujícího infarktu. Byl hodnocen sekundární cíl cerebrovaskulárních příhod. Průměrná doba sledování pacientů byla 37 měsíců. Výsledky pro každý koncový bod zvlášť, včetně analýzy vaskulární smrti, jsou uvedeny v tabulce 7.
WARIS II (The Warfarin, Aspirin, Re-Infarction Study) byla otevřená, randomizovaná studie s 3 630 pacienty hospitalizovanými pro akutní infarkt myokardu, kteří byli léčeni warfarinem na cílové INR 2,8 až 4,2, aspirinem 160 mg denně nebo warfarinem cílová INR 2,0 až 2,5 plus aspirin 75 mg denně před propuštěním z nemocnice. Primárním cílovým parametrem byla kombinace úmrtí, nefatálního reinfarktu nebo tromboembolické cévní mozkové příhody. Průměrná doba sledování byla přibližně 4 roky. Výsledky pro WARIS II jsou uvedeny v tabulce 8.
Ve dvou skupinách užívajících warfarin bylo přibližně čtyřikrát více epizod závažného krvácení než ve skupině užívající samotný aspirin. Závažné krvácivé příhody nebyly častější u pacientů užívajících aspirin plus warfarin než u pacientů užívajících samotný warfarin, ale výskyt mírných krvácivých příhod byl vyšší ve skupině s kombinovanou léčbou.
INFORMACE PRO PACIENTA
COUMADIN® (COU-ma-din) (warfarin sodný)
Jaké jsou nejdůležitější informace, které bych měl vědět o přípravku COUMADIN 5 mg?
COUMADIN může způsobit krvácení, které může být vážné a někdy vést ke smrti. Je to proto, že COUMADIN je lék na ředění krve, který snižuje možnost tvorby krevních sraženin ve vašem těle.
- Můžete mít vyšší riziko krvácení, pokud užíváte COUMADIN a:
- jsou starší 65 let
- máte v anamnéze krvácení do žaludku nebo střev
- máte vysoký krevní tlak (hypertenze)
- máte v anamnéze cévní mozkovou příhodu nebo „mini-mrtvici“ (přechodný ischemický záchvat nebo TIA)
- mít vážné onemocnění srdce
- máte nízký krevní obraz nebo rakovinu
- měli trauma, jako je nehoda nebo chirurgický zákrok
- mít problémy s ledvinami
- užívejte jiné léky, které zvyšují riziko krvácení, včetně:
- lék, který obsahuje heparin
- jiné léky k prevenci nebo léčbě krevních sraženin
- nesteroidní protizánětlivé léky (NSAID)
- užívat warfarin sodný po dlouhou dobu. Warfarin sodný je aktivní složkou přípravku COUMADIN.
Informujte svého poskytovatele zdravotní péče, pokud užíváte některý z těchto léků. Pokud si nejste jisti, zda je váš lék jedním z výše uvedených, zeptejte se svého poskytovatele zdravotní péče.
Mnoho dalších léků může interagovat s přípravkem COUMADIN 1 mg a ovlivnit potřebnou dávku nebo zvýšit nežádoucí účinky přípravku COUMADIN 1 mg. Než si promluvíte se svým poskytovatelem zdravotní péče, neměňte ani nezastavujte žádné léky ani nezačínejte s žádnými novými léky.
Během užívání přípravku COUMADIN neužívejte jiné léky, které obsahují sodnou sůl warfarinu.
- Udělejte si pravidelný krevní test, abyste zkontrolovali svou odpověď na COUMADIN. Tento krevní test se nazývá INR test. Test INR kontroluje, jak rychle se vaše krev sráží. Váš poskytovatel zdravotní péče rozhodne, jaká čísla INR jsou pro vás nejlepší. Vaše dávka přípravku COUMADIN 2 mg bude upravena tak, aby se vaše INR udrželo v cílovém rozmezí pro vás.
- Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud se u Vás objeví některý z následujících příznaků nebo příznaků problémů s krvácením:
- bolest, otok nebo nepohodlí
- bolesti hlavy, závratě nebo slabost
- neobvyklé modřiny (modřiny, které se vyvíjejí bez známé příčiny nebo se zvětšují)
- krvácení z nosu
- krvácení z dásní
- krvácení z řezných ran trvá dlouho, než se zastaví
- menstruační krvácení nebo vaginální krvácení, které je silnější než normálně
- růžová nebo hnědá moč
- červená nebo černá stolice
- vykašlávání krve
- zvracení krve nebo materiálu, který vypadá jako kávová sedlina
- Některé potraviny a nápoje mohou interagovat s přípravkem COUMADIN a ovlivnit vaši léčbu a dávku.
- Jezte normální, vyváženou stravu. Promluvte si se svým poskytovatelem zdravotní péče, než provedete jakékoli změny ve stravě. Nejezte velké množství listové, zelené zeleniny. Listová zelená zelenina obsahuje vitamín K. Některé rostlinné oleje také obsahují velké množství vitamínu K. Příliš mnoho vitamínu K může snížit účinek COUMADIN.
- Vždy řekněte všem svým poskytovatelům zdravotní péče, že užíváte COUMADIN.
- Noste nebo noste informace, že užíváte COUMADIN.
Viz "Jaké jsou možné vedlejší účinky přípravku COUMADIN 1 mg?" pro více informací o vedlejších účincích.
Co je COUMADIN?
COUMADIN je lék na předpis používaný k léčbě krevních sraženin a ke snížení pravděpodobnosti tvorby krevních sraženin ve vašem těle. Krevní sraženiny mohou způsobit mrtvici, srdeční infarkt nebo jiné vážné stavy, pokud se tvoří v nohou nebo plicích.
Kdo by neměl užívat COUMADIN?
Neužívejte COUMADIN 5 mg, pokud:
- Vaše riziko problémů s krvácením je vyšší než možný přínos léčby. Váš poskytovatel zdravotní péče rozhodne, zda je COUMADIN pro vás to pravé.
- jste těhotná, pokud nemáte mechanickou srdeční chlopeň. COUMADIN může způsobit vrozené vady, potrat nebo smrt vašeho nenarozeného dítěte.
- jste alergický(á) na warfarin nebo na kteroukoli další složku přípravku COUMADIN. Úplný seznam složek přípravku COUMADIN naleznete na konci této příbalové informace.
Před užitím přípravku COUMADIN
Informujte svého poskytovatele zdravotní péče o všech svých zdravotních stavech, včetně toho, zda:
- mít problémy s krvácením
- často padat
- mít problémy s játry
- máte problémy s ledvinami nebo podstupujete dialýzu
- mají vysoký krevní tlak
- máte srdeční problém nazývaný městnavé srdeční selhání
- mít cukrovku
- plánovat jakoukoli operaci nebo stomatologický zákrok
- mít jiné zdravotní potíže
- jste těhotná nebo plánujete otěhotnět. Viz "Kdo by neměl užívat COUMADIN 2 mg?" Před zahájením léčby přípravkem COUMADIN vám váš poskytovatel zdravotní péče provede těhotenský test. Ženy, které mohou otěhotnět, by měly během léčby a alespoň 1 měsíc po poslední dávce přípravku COUMADIN používat účinnou antikoncepci.
- kojí. Vy a váš poskytovatel zdravotní péče byste se měli rozhodnout, zda budete užívat přípravek COUMADIN a kojit. Pokud užíváte COUMADIN a kojíte, zkontrolujte, zda se u vašeho dítěte netvořily modřiny nebo krvácení.
Řekněte všem svým poskytovatelům zdravotní péče a zubařům, že užíváte COUMADIN. Měli by si promluvit s poskytovatelem zdravotní péče, který vám předepsal COUMADIN 1 mg, než budete mít žádný chirurgický nebo stomatologický zákrok. Váš COUMADIN může být nutné na krátkou dobu přerušit nebo může být nutné upravit dávku.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků. Některé z vašich dalších léků mohou ovlivnit způsob, jakým COUMADIN působí. Některé léky mohou zvýšit riziko krvácení. Vidět "Jaké jsou nejdůležitější informace, které bych měl vědět o COUMADIN?"
Jak mám užívat COUMADIN 1 mg?
- Užívejte COUMADIN 1 mg přesně podle předpisu. Váš poskytovatel zdravotní péče vám čas od času upraví dávku v závislosti na vaší odpovědi na COUMADIN.
- Musíte mít pravidelné krevní testy a navštívit je u svého poskytovatele zdravotní péče, abyste mohli sledovat svůj stav.
- Pokud vynecháte dávku přípravku COUMADIN, zavolejte svého poskytovatele zdravotní péče. Užijte dávku co nejdříve ve stejný den. Ne vezměte si následující den dvojnásobnou dávku přípravku COUMADIN 5 mg, abyste nahradili vynechanou dávku.
- Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud:
- vezměte příliš mnoho COUMADINU
- trpíte průjmem, infekcí nebo máte horečku
- spadnout nebo se zranit, zvláště když se uhodíte do hlavy. Váš poskytovatel zdravotní péče vás možná bude muset zkontrolovat.
Čemu se mám vyhnout při užívání přípravku COUMADIN 5 mg?
- Neprovádějte žádnou činnost nebo sport, které by mohly způsobit vážné zranění.
Jaké jsou možné vedlejší účinky přípravku COUMADIN?
COUMADIN může způsobit závažné nežádoucí účinky včetně:
- Vidět "Jaké jsou nejdůležitější informace, které bych měl vědět o COUMADIN?"
- Smrt kožní tkáně (nekróza kůže nebo gangréna). To se může stát brzy po spuštění COUMADIN. Stává se to proto, že se tvoří krevní sraženiny a blokují průtok krve do oblasti vašeho těla. Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud máte bolest, barvu nebo změnu teploty v jakékoli oblasti vašeho těla. Možná budete potřebovat okamžitou lékařskou péči, abyste zabránili smrti nebo ztrátě (amputaci) postižené části těla.
- Problémy s ledvinami. U lidí, kteří užívají COUMADIN, může dojít k poranění ledvin. Okamžitě informujte svého poskytovatele zdravotní péče, pokud se ve vaší moči objeví krev. Pokud již máte problémy s ledvinami, váš poskytovatel zdravotní péče může během léčby přípravkem COUMADIN 2 mg provádět testy častěji, aby zkontroloval krvácení.
- "Syndrom fialových prstů." Okamžitě zavolejte svého poskytovatele zdravotní péče, pokud vás bolí prsty na nohou a vypadají fialově nebo tmavě.
Toto nejsou všechny vedlejší účinky přípravku COUMADIN. Další informace získáte od svého poskytovatele zdravotní péče nebo lékárníka. Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1..800-FDA-1088.
Jak mám COUMADIN 5 mg uchovávat?
- Uchovávejte COUMADIN při teplotě 59 °F až 86 °F (15 °C až 30 °C).
- COUMADIN 2 mg uchovávejte v těsně uzavřené nádobě
- Uchovávejte COUMADIN mimo světlo a vlhkost.
- Postupujte podle pokynů svého poskytovatele zdravotní péče nebo lékárníka o správném způsobu, jak vyhodit zastaralý nebo nepoužitý přípravek COUMADIN.
- Těhotné ženy by neměly manipulovat s rozdrcenými nebo rozbitými tabletami COUMADIN.
Uchovávejte COUMADIN 1 mg a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a efektivním používání přípravku COUMADIN.
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Nepoužívejte COUMADIN 5 mg při onemocnění, pro které nebyl předepsán. Nedávejte COUMADIN 2 mg jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Můžete požádat svého poskytovatele zdravotní péče nebo lékárníka o informace o přípravku COUMADIN, které jsou určeny pro zdravotníky.
Jaké jsou složky v tabletách COUMADIN 1 mg?
Aktivní složka: warfarin sodný
Neaktivní složky: laktóza, škrob a stearát hořečnatý, navíc:
1 mg: D&C Red No. 6 Barium Lake
2 mg: FD&C Blue No. 2 Aluminium Lake a FD&C Red No. 40 Aluminium Lake
2,5 mg: D&C Yellow No. 10 Aluminium Lake a FD&C Blue No. 1 Aluminium Lake
3 mg: hliníkové jezero FD&C žluté č. 6, hliníkové jezero FD&C modré č. 2 a hliníkové jezero FD&C červené č. 40
4 mg: FD&C Blue No. 1 Aluminium Lake
5 mg: FD&C Yellow No. 6 Aluminium Lake
mg: FD&C Yellow No. 6 Aluminium Lake a FD&C Blue No. 1 Aluminium Lake
7,5 mg: D&C Yellow No. 10 Aluminium Lake a FD&C Yellow No. 6 Aluminium Lake
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv.
