Crestor 10mg, 20mg, 5mg Rosuvastatin Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Crestor a jak se používá?
Crestor je lék na předpis používaný ke snížení LDL cholesterolu (lipoprotein s nízkou hustotou) a triglyceridů v krvi, zpomalení progrese plaku v cévách, snížení rizika mrtvice a srdečního infarktu. Crestor 20 mg lze užívat samostatně nebo s jinými léky.
Crestor je látka snižující hladinu lipidů, statiny, inhibitory HMG-CoA reduktázy.
Není známo, zda je přípravek Crestor bezpečný a účinný u dětí mladších 8 let.
Jaké jsou možné vedlejší účinky přípravku Crestor?
Crestor může způsobit závažné nežádoucí účinky včetně:
- nevysvětlitelná bolest svalů
- citlivost svalů
- svalová slabost
- zmatek
- problémy s pamětí
- bolest v horní části žaludku
- únava
- ztráta chuti k jídlu
- tmavá moč
- zežloutnutí kůže nebo očí (žloutenka)
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Crestor patří:
- bolest hlavy
- slabost
- Bolest svalů
- nevolnost
- bolest břicha
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Crestor. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
CRESTOR (rosuvastatin kalcium) je syntetické činidlo snižující hladinu lipidů pro perorální podání.
Chemický název vápenaté soli rosuvastatinu je bis[(E)-7-[4-(4-fluorfenyl)-6-isopropyl-2-[methyl(methylsulfonyl)amino]pyrimidin-5-yl](3R,5S)-3 vápenatá sůl kyseliny ,5-dihydroxyhept-6-enové s následujícím strukturním vzorcem:
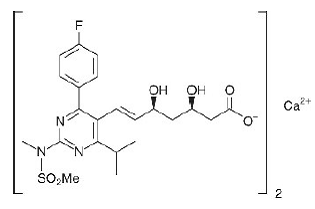
Empirický vzorec vápenaté soli rosuvastatinu je (C22H27FN3O6S)2Ca a molekulová hmotnost je 1001,14. Rosuvastatin vápenatý je bílý amorfní prášek, který je mírně rozpustný ve vodě a methanolu a mírně rozpustný v ethanolu. Rosuvastatin vápenatý je hydrofilní sloučenina s rozdělovacím koeficientem (oktanol/voda) 0,13 při pH 7,0.
CRESTOR Tablety pro perorální podání obsahují 5, 10, 20 nebo 40 mg rosuvastatinu a následující neúčinné složky: Každá tableta obsahuje: mikrokrystalickou celulózu NF, monohydrát laktózy NF, fosforečnan vápenatý NF, krospovidon NF, magnesium-stearát NF, hypromelózu NF, triacetin NF, oxid titaničitý USP, žlutý oxid železitý a červený oxid železitý NF.
INDIKACE
Hyperlipidémie a smíšená dyslipidémie
CRESTOR je indikován jako přídatná terapie k dietě ke snížení zvýšeného celkového cholesterolu, LDL-C, ApoB, nonHDL-C a triglyceridů a ke zvýšení HDL-C u dospělých pacientů s primární hyperlipidémií nebo smíšenou dyslipidémií. Látky upravující lipidy by měly být používány jako doplněk k dietě s omezeným obsahem nasycených tuků a cholesterolu, pokud reakce na dietu a nefarmakologické intervence samotné byly nedostatečné.
Pediatričtí pacienti s familiární hypercholesterolemií
CRESTOR 10 mg je indikován jako doplněk diety k:
- snížit hladiny Total-C, LDL-C a ApoB u dětí a dospívajících ve věku 8 až 17 let s heterozygotní familiární hypercholesterolemií, pokud jsou po adekvátní zkoušce dietní terapie přítomny následující nálezy: LDL-C >190 mg/dl nebo >160 mg/dl spolu s pozitivní rodinnou anamnézou předčasného kardiovaskulárního onemocnění (CVD) nebo dvou nebo více dalších rizikových faktorů KVO.
- snížit LDL-C, Total-C, nonHDL-C a ApoB u dětí a dospívajících ve věku 7 až 17 let s homozygotní familiární hypercholesterolemií, a to buď samostatně, nebo s jinou hypolipidemickou léčbou (např. LDL aferéza).
Hypertriglyceridémie
CRESTOR je indikován jako přídatná léčba k dietě k léčbě dospělých pacientů s hypertriglyceridémií.
Primární dysbetalipoproteinemie (hyperlipoproteinemie III. typu)
CRESTOR je indikován jako doplněk k dietě k léčbě dospělých pacientů s primární dysbetalipoproteinémií (hyperlipoproteinémie typu III).
Dospělí pacienti s homozygotní familiární hypercholesterolemií
CRESTOR je indikován jako doplňková léčba k jiné hypolipidemické léčbě (např. LDL aferéza) nebo samostatně, pokud taková léčba není dostupná pro snížení LDL-C, Total-C a ApoB u dospělých pacientů s homozygotní familiární hypercholesterolemií.
Zpomalení Progrese Aterosklerózy
CRESTOR 5 mg je indikován jako přídatná léčba k dietě ke zpomalení progrese aterosklerózy u dospělých pacientů jako součást léčebné strategie ke snížení celkového cholesterolu a LDL cholesterolu na cílové hladiny.
Primární prevence kardiovaskulárních chorob
jedinců bez klinicky zjevné ischemické choroby srdeční, ale se zvýšeným rizikem kardiovaskulárních onemocnění na základě věku ≥50 let u mužů a ≥60 let u žen, hsCRP ≥2 mg/l a přítomnost alespoň jednoho dalšího kardiovaskulárního onemocnění rizikovým faktorem, jako je hypertenze, nízký HDL-C, kouření nebo předčasná ischemická choroba srdeční v rodině, je CRESTOR indikován k:
- snížit riziko mrtvice
- snížit riziko infarktu myokardu
- snížit riziko arteriálních revaskularizačních výkonů
Omezení použití
CRESTOR nebyl studován u Fredricksonových dyslipidémií typu I a V.
DÁVKOVÁNÍ A PODÁVÁNÍ
Obecné informace o dávkování
Rozsah dávek přípravku CRESTOR 5 mg u dospělých je 5 až 40 mg perorálně jednou denně. Obvyklá počáteční dávka je 10 až 20 mg jednou denně. Obvyklá počáteční dávka u dospělých pacientů s homozygotní familiární hypercholesterolémií je 20 mg jednou denně.
Maximální dávka CRESTOR 20 mg 40 mg by měla být použita pouze u těch pacientů, kteří nedosáhli svého cíle LDL-C při použití dávky 20 mg (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
CRESTOR 5 mg lze podávat jako jednu dávku kdykoli během dne, s jídlem nebo bez jídla. Tableta se má spolknout celá.
Při zahájení léčby přípravkem CRESTOR nebo přechodu z jiné léčby inhibitorem HMG-CoA reduktázy by měla být nejprve použita vhodná počáteční dávka přípravku CRESTOR 10 mg a teprve poté by měla být titrována podle odpovědi pacienta a individuálního cíle léčby.
Po zahájení nebo po titraci přípravku CRESTOR by měly být hladiny lipidů analyzovány během 2 až 4 týdnů a podle toho by mělo být upraveno dávkování.
Pediatrické dávkování
U heterozygotní familiární hypercholesterolémie je doporučené rozmezí dávek 5 až 10 mg perorálně jednou denně u pacientů ve věku 8 až méně než 10 let a 5 až 20 mg perorálně jednou denně u pacientů ve věku 10 až 17 let.
homozygotní familiární hypercholesterolémie je doporučená dávka 20 mg perorálně jednou denně u pacientů ve věku 7 až 17 let.
Dávkování u asijských pacientů
U asijských pacientů zvažte zahájení léčby přípravkem CRESTOR 20 mg dávkou 5 mg jednou denně kvůli zvýšeným plazmatickým koncentracím rosuvastatinu. Zvýšenou systémovou expozici je třeba vzít v úvahu při léčbě asijských pacientů, kteří nejsou adekvátně kontrolováni v dávkách až 20 mg/den (viz Použití u konkrétních populací a KLINICKÁ FARMAKOLOGIE ].
Používejte s konkomitantní terapií
Pacienti užívající cyklosporin
Dávka přípravku CRESTOR 20 mg by neměla překročit 5 mg jednou denně [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE a KLINICKÁ FARMAKOLOGIE ].
Pacienti užívající Gemfibrozil
Vyhněte se současnému užívání přípravku CRESTOR s gemfibrozilem. Pokud se současnému užívání nelze vyhnout, zahajte CRESTOR v dávce 5 mg jednou denně. Dávka přípravku CRESTOR by neměla překročit 10 mg jednou denně (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE a KLINICKÁ FARMAKOLOGIE ].
Pacienti užívající atazanavir a ritonavir, lopinavir a ritonavir nebo simeprevir
Zahajte léčbu přípravkem CRESTOR 10 mg dávkou 5 mg jednou denně. Dávka přípravku CRESTOR by neměla překročit 10 mg jednou denně (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE a KLINICKÁ FARMAKOLOGIE ].
Dávkování u pacientů s těžkým poškozením ledvin
U pacientů s těžkou poruchou funkce ledvin (CLcr Použití u konkrétních populací a KLINICKÁ FARMAKOLOGIE ].
JAK DODÁVÁNO
Dávkové formy A Síly
5 mg: žluté, kulaté, bikonvexní, potahované tablety. Vyraženo „CRESTOR“ a „5“ na jedné straně tablety.
10 mg: růžové, kulaté, bikonvexní, potahované tablety. Vyraženo „CRESTOR“ a „10“ na jedné straně tablety.
20 mg: růžové, kulaté, bikonvexní, potahované tablety. Vyraženo „CRESTOR“ a „20“ na jedné straně tablety.
40 mg: růžové, oválné, bikonvexní, potahované tablety. Vyraženo „CRESTOR“ na jedné straně a „40“ na druhé straně tablety.
Skladování A Manipulace
CRESTOR® (rosuvastatin kalcium) tablety jsou dodávány jako:
NDC 0310-0755-90: 5 mg. Žluté, kulaté, bikonvexní, potahované tablety. Vyraženo „CRESTOR“ a „5“ na jedné straně; lahvička 90 tablet
NDC 0310-0751-90: 10 mg. Růžové, kulaté, bikonvexní, potahované tablety. Vyraženo „CRESTOR“ a „10“ na jedné straně; lahvička 90 tablet
NDC 0310-0751-39: 10 mg. Růžové, kulaté, bikonvexní, potahované tablety. Vyraženo „CRESTOR“ a „10“ na jedné straně; balení jednotkové dávky po 100 ks
NDC 0310-0752-90: 20 mg. Růžové, kulaté, bikonvexní, potahované tablety. Vyraženo „CRESTOR“ a „20“ na jedné straně; láhve 90
NDC 0310-0752-39: 20 mg. Růžové, kulaté, bikonvexní, potahované tablety. Vyraženo „CRESTOR“ a „20“ na jedné straně; balení jednotkové dávky po 100 ks
NDC 0310-0754-30: 40 mg. Růžové, oválné, bikonvexní, potahované tablety. Vyraženo „CRESTOR“ na jedné straně a „40“ na druhé straně; láhve po 30
Úložný prostor
Skladujte při kontrolované pokojové teplotě, 20-25 °C (68-77 °F) [viz USP řízená pokojová teplota ]. Chraňte před vlhkostí.
Distribuuje: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Revize: září 2018
VEDLEJŠÍ EFEKTY
Následující závažné nežádoucí účinky jsou podrobněji popsány v jiných částech štítku:
- Rabdomyolýza s myoglobinurií a akutním selháním ledvin a myopatií (včetně myozitidy) (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Abnormality jaterních enzymů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi rozdílných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v klinické praxi.
V databázi kontrolovaných klinických studií CRESTOR (placebem nebo aktivní látkou) 5394 pacientů s průměrnou délkou léčby 15 týdnů ukončilo léčbu kvůli nežádoucím účinkům 1,4 % pacientů. Nejčastější nežádoucí účinky, které vedly k přerušení léčby, byly:
- myalgie
- bolest břicha
- nevolnost
Nejčastěji hlášené nežádoucí účinky (výskyt ≥2 %) v databázi kontrolovaných klinických studií CRESTOR 5 mg u 5394 pacientů byly:
- bolest hlavy
- myalgie
- bolest břicha
- astenie
- nevolnost
Nežádoucí účinky hlášené u ≥ 2 % pacientů v placebem kontrolovaných klinických studiích a s četností vyšší než u placeba jsou uvedeny v tabulce 1. Tyto studie trvaly až 12 týdnů.
Další nežádoucí účinky hlášené v klinických studiích byly bolesti břicha, závratě, přecitlivělost (včetně vyrážky, svědění, kopřivky a angioedému) a pankreatitida. Byly také hlášeny následující laboratorní abnormality: proteinurie pozitivní na měrku a mikroskopická hematurie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]; zvýšená hladina kreatinfosfokinázy, transamináz, glukózy, glutamyltranspeptidázy, alkalické fosfatázy a bilirubinu; a abnormality funkce štítné žlázy.
Ve studii METEOR zahrnující 981 účastníků léčených rosuvastatinem 40 mg (n=700) nebo placebem (n=281) s průměrnou dobou léčby 1,7 roku, 5,6 % subjektů léčených přípravkem CRESTOR 5 mg oproti 2,8 % subjektů léčených placebem přerušeno kvůli nežádoucím reakcím. Nejčastější nežádoucí účinky, které vedly k přerušení léčby, byly: myalgie, zvýšení jaterních enzymů, bolest hlavy a nauzea (viz Klinické studie ].
Nežádoucí účinky hlášené u ≥ 2 % pacientů a s četností vyšší než u placeba jsou uvedeny v tabulce 2.
Ve studii JUPITER bylo 17 802 účastníků léčeno rosuvastatinem 20 mg (n=8901) nebo placebem (n=8901) po průměrnou dobu 2 let. Vyšší procento pacientů léčených rosuvastatinem oproti pacientům léčeným placebem, 6,6 %, resp. 6,2 %, přerušilo studijní medikaci z důvodu nežádoucí příhody, bez ohledu na kauzalitu léčby. Myalgie byla nejčastější nežádoucí reakcí, která vedla k přerušení léčby.
Ve studii JUPITER byla hlášena významně vyšší frekvence diabetes mellitus u pacientů užívajících rosuvastatin (2,8 %) oproti pacientům užívajícím placebo (2,3 %). Průměrný HbA1c byl významně zvýšen o 0,1 % u pacientů léčených rosuvastatinem ve srovnání s pacienty léčenými placebem. Počet pacientů s HbA1c > 6,5 % na konci studie byl významně vyšší u pacientů léčených rosuvastatinem oproti pacientům léčeným placebem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Klinické studie ].
Nežádoucí účinky hlášené u ≥ 2 % pacientů a s četností vyšší než u placeba jsou uvedeny v tabulce 3.
Pediatričtí pacienti s heterozygotní familiární hypercholesterolemií
Ve 12týdenní kontrolované studii u chlapců a postmenarcheálních dívek ve věku 10 až 17 let s heterozygotní familiární hypercholesterolémií s CRESTOR 5 až 20 mg denně [viz Použití u konkrétních populací a Klinické studie ], zvýšení sérové kreatinfosfokinázy (CK) >10 x ULN bylo pozorováno častěji u rosuvastatinu než u dětí léčených placebem. Čtyři ze 130 (3 %) dětí léčených rosuvastatinem (2 léčené 10 mg a 2 léčené 20 mg) měly zvýšenou CK >10 x ULN ve srovnání s 0 ze 46 dětí na placebu.
Postmarketingové zkušenosti
Následující nežádoucí účinky byly identifikovány během užívání přípravku CRESTOR po schválení: artralgie, fatální a nefatální selhání jater, hepatitida, žloutenka, trombocytopenie, deprese, poruchy spánku (včetně nespavosti a nočních můr), periferní neuropatie, intersticiální plicní onemocnění a gynekomastie. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Vzácně byly hlášeny imunitně zprostředkované nekrotizující myopatie spojené s užíváním statinů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Po uvedení přípravku na trh byly vzácně hlášeny kognitivní poruchy (např. ztráta paměti, zapomnění, amnézie, poruchy paměti a zmatenost) spojené s užíváním statinů. Tyto kognitivní problémy byly hlášeny u všech statinů. Hlášení jsou obecně nezávažná a po vysazení statinu jsou reverzibilní, s proměnlivou dobou do nástupu příznaků (1 den až roky) a vymizení příznaků (medián 3 týdny).
DROGOVÉ INTERAKCE
Cyklosporin
Cyklosporin zvyšuje expozici rosuvastatinu a může vést ke zvýšenému riziku myopatie. Proto u pacientů užívajících cyklosporin by dávka přípravku CRESTOR 10 mg neměla překročit 5 mg jednou denně (viz DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
gemfibrozil
Gemfibrozil významně zvýšil expozici rosuvastatinu. Vzhledem k pozorovanému zvýšenému riziku myopatie/rhabdomyolýzy je třeba se vyhnout kombinované léčbě přípravkem CRESTOR a gemfibrozilem. Pokud se užívá společně, dávka přípravku CRESTOR 10 mg by neměla překročit 10 mg jednou denně (viz KLINICKÁ FARMAKOLOGIE ].
Inhibitory proteázy
Současné podávání rosuvastatinu s určitými inhibitory proteázy má různé účinky na expozici rosuvastatinu a může zvýšit riziko myopatie. Simeprevir, což je inhibitor proteázy viru hepatitidy C (HCV), nebo kombinace atazanavir/ritonavir nebo lopinavir/ritonavir, což jsou inhibitory proteázy HIV-1, zvyšují expozici rosuvastatinu [viz tabulka 4 - KLINICKÁ FARMAKOLOGIE ]. U těchto inhibitorů proteáz by dávka přípravku CRESTOR 5 mg neměla překročit 10 mg jednou denně. Kombinace fosamprenavir/ritonavir nebo tipranavir/ritonavir, které jsou inhibitory HIV-1 proteázy, způsobují malou nebo žádnou změnu v expozici rosuvastatinu. Při současném podávání rosuvastatinu s inhibitory proteázy je třeba postupovat opatrně (viz DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
Kumarinové antikoagulanty
CRESTOR 20 mg významně zvýšil INR u pacientů užívajících kumarinová antikoagulancia. Proto je třeba opatrnosti při podávání kumarinových antikoagulancií spolu s přípravkem CRESTOR. U pacientů užívajících současně kumarinová antikoagulancia a CRESTOR by mělo být INR stanoveno před zahájením léčby CRESTOR a dostatečně často během časné léčby, aby se zajistilo, že nedojde k žádné významné změně INR (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
Niacin
Riziko účinků na kosterní svalstvo se může zvýšit, pokud se CRESTOR 5 mg používá v kombinaci s dávkami niacinu upravujícími lipidy (≥1 g/den); při předepisování přípravku CRESTOR je třeba postupovat opatrně [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
fenofibrát
Když byl CRESTOR 20 mg podáván současně s fenofibrátem, nebylo pozorováno žádné klinicky významné zvýšení AUC rosuvastatinu nebo fenofibrátu. Protože je známo, že riziko myopatie během léčby inhibitory HMG-CoA reduktázy se zvyšuje při současném užívání fenofibrátů, je třeba opatrnosti při předepisování fenofibrátů s přípravkem CRESTOR (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
kolchicin
Případy myopatie, včetně rhabdomyolýzy, byly hlášeny u inhibitorů HMG-CoA reduktázy, včetně rosuvastatinu, podávaných současně s kolchicinem a při předepisování přípravku CRESTOR s kolchicinem je třeba postupovat opatrně (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Účinky na kosterní svaly
U inhibitorů HMG-CoA reduktázy, včetně přípravku CRESTOR, byly hlášeny případy myopatie a rhabdomyolýzy s akutním selháním ledvin sekundárním k myoglobinurii. Tato rizika se mohou objevit při jakékoli hladině dávky, ale jsou zvýšena při nejvyšší dávce (40 mg).
CRESTOR 5 mg by měl být předepisován s opatrností pacientům s predisponujícími faktory pro myopatii (např. věk ≥ 65 let, nedostatečně léčená hypotyreóza, porucha funkce ledvin). Riziko myopatie během léčby přípravkem CRESTOR 5 mg může být zvýšeno při současném podávání některých dalších hypolipidemik (fibráty nebo niacin), gemfibrozilu, cyklosporinu, atazanaviru/ritonaviru, lopinaviru/ritonaviru nebo simepreviru (viz DÁVKOVÁNÍ A PODÁVÁNÍ a DROGOVÉ INTERAKCE ]. Případy myopatie, včetně rhabdomyolýzy, byly hlášeny u inhibitorů HMG-CoA reduktázy, včetně rosuvastatinu, podávaných současně s kolchicinem a při předepisování přípravku CRESTOR s kolchiciny je třeba postupovat opatrně (viz DROGOVÉ INTERAKCE ].
Léčba přípravkem CRESTOR by měla být přerušena, pokud se objeví výrazně zvýšené hladiny kreatinkinázy nebo je diagnostikována nebo podezření na myopatii. Léčba přípravkem CRESTOR 5 mg by měla být také dočasně přerušena u každého pacienta s akutním, závažným stavem připomínajícím myopatii nebo predisponujícím k rozvoji renálního selhání sekundárního k rhabdomyolýze (např. sepse, hypotenze, dehydratace, velký chirurgický zákrok, trauma, těžké metabolické, endokrinní, a poruchy elektrolytů nebo nekontrolované záchvaty).
Vzácně byly hlášeny případy imunitně zprostředkované nekrotizující myopatie (IMNM), autoimunitní myopatie, spojené s užíváním statinů. IMNM je charakterizována: proximální svalovou slabostí a zvýšenou sérovou kreatinkinázou, které přetrvávají i přes přerušení léčby statiny; svalová biopsie prokazující nekrotizující myopatii bez významného zánětu; zlepšení imunosupresivy.
Všichni pacienti by měli být upozorněni, aby neprodleně hlásili svému lékaři nevysvětlitelné bolesti svalů, citlivost nebo slabost, zvláště pokud jsou doprovázeny malátností nebo horečkou nebo pokud svalové známky a příznaky přetrvávají i po vysazení přípravku CRESTOR.
Abnormality jaterních enzymů
Doporučuje se provést testy jaterních enzymů před zahájením léčby přípravkem CRESTOR 10 mg a pokud se objeví známky nebo příznaky poškození jater.
inhibitorů HMG-CoA reduktázy, včetně přípravku CRESTOR, bylo hlášeno zvýšení sérových transamináz [AST (SGOT) nebo ALT (SGPT)]. Ve většině případů byla zvýšení přechodná a odezněla nebo se zlepšila při pokračující léčbě nebo po krátkém přerušení léčby. Vyskytly se dva případy žloutenky, u kterých nebylo možné určit vztah k léčbě CRESTOR, které vymizely po přerušení léčby. V těchto studiích nebyly zaznamenány žádné případy selhání jater nebo nevratného onemocnění jater. V souhrnné analýze placebem kontrolovaných studií došlo ke zvýšení sérových transamináz na > 3násobek horní hranice normálu u 1,1 % pacientů užívajících CRESTOR 5 mg oproti 0,5 % pacientů léčených placebem.
Po uvedení přípravku na trh byly vzácně hlášeny fatální a nefatální jaterní selhání u pacientů užívajících statiny, včetně rosuvastatinu. Pokud se během léčby přípravkem CRESTOR 20 mg objeví závažné poškození jater s klinickými příznaky a/nebo hyperbilirubinémií nebo žloutenkou, okamžitě přerušte léčbu. Pokud není nalezena alternativní etiologie, nerestartujte CRESTOR.
CRESTOR 5 mg by měl být používán s opatrností u pacientů, kteří konzumují značné množství alkoholu a/nebo mají v anamnéze chronické onemocnění jater (viz KLINICKÁ FARMAKOLOGIE ]. Aktivní onemocnění jater, které může zahrnovat nevysvětlitelné přetrvávající zvýšení transamináz, je kontraindikací pro použití přípravku CRESTOR (viz KONTRAINDIKACE ].
Souběžně podávaná kumarinová antikoagulancia
Při podávání antikoagulancií současně s přípravkem CRESTOR je třeba opatrnosti, protože zesiluje účinek antikoagulancií kumarinového typu na prodloužení protrombinového času/INR. U pacientů, kteří užívají kumarinová antikoagulancia a CRESTOR současně, by mělo být INR stanoveno před zahájením léčby přípravkem CRESTOR 10 mg a dostatečně často během časné léčby, aby se zajistilo, že nedojde k žádné významné změně INR (viz DROGOVÉ INTERAKCE ].
Proteinurie a hematurie
programu klinické studie CRESTOR byla u pacientů léčených přípravkem CRESTOR pozorována pozitivní proteinurie a mikroskopická hematurie. Tyto nálezy byly častější u pacientů užívajících CRESTOR 40 mg ve srovnání s nižšími dávkami CRESTOR 20 mg nebo srovnávacími inhibitory HMG-CoA reduktázy, i když to bylo obecně přechodné a nebylo spojeno se zhoršením renálních funkcí. Ačkoli klinický význam tohoto nálezu není znám, mělo by se u pacientů na léčbě přípravkem CRESTOR s nevysvětlitelnou přetrvávající proteinurií a/nebo hematurií zvážit snížení dávky během rutinního vyšetření moči.
Endokrinní účinky
U inhibitorů HMG-CoA reduktázy, včetně přípravku CRESTOR, bylo hlášeno zvýšení HbA1c a hladiny glukózy v séru nalačno. Na základě údajů z klinických studií s CRESTORem mohou v některých případech tato zvýšení překročit práh pro diagnózu diabetes mellitus (viz NEŽÁDOUCÍ REAKCE ].
Přestože klinické studie prokázaly, že samotný CRESTOR 10 mg nesnižuje bazální plazmatickou koncentraci kortizolu ani nenarušuje nadledvinovou rezervu, je třeba opatrnosti, pokud je CRESTOR podáván současně s léky, které mohou snižovat hladiny nebo aktivitu endogenních steroidních hormonů, jako je ketokonazol, spironolakton a cimetidin.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( INFORMACE PRO PACIENTA ).
Pacienti by měli být poučeni, aby neužívali 2 dávky přípravku CRESTOR během 12 hodin po sobě.
Účinky na kosterní svaly
Pacienti by měli být poučeni, aby okamžitě hlásili nevysvětlitelné svalové bolesti, citlivost nebo slabost, zvláště pokud jsou doprovázeny malátností nebo horečkou nebo pokud tyto svalové známky nebo příznaky přetrvávají i po vysazení přípravku CRESTOR.
Současné užívání antacidů
Při užívání přípravku CRESTOR 5 mg s antacidem v kombinaci s hydroxidem hlinitým a hořečnatým je třeba antacidum užít alespoň 2 hodiny po podání přípravku CRESTOR 10 mg.
Embryofetální toxicita
Informujte ženy o reprodukčním potenciálu rizika pro plod, aby během léčby používaly účinnou antikoncepci a informujte svého poskytovatele zdravotní péče o známém nebo předpokládaném těhotenství. [vidět KONTRAINDIKACE a Použití u konkrétních populací ].
Laktace
Doporučte ženám, aby během léčby přípravkem CRESTOR nekojily [viz KONTRAINDIKACE a Použití u konkrétních populací ].
Jaterní enzymy
Doporučuje se provést testy jaterních enzymů před zahájením léčby přípravkem CRESTOR a pokud se objeví známky nebo příznaky poškození jater. Všichni pacienti léčení přípravkem CRESTOR by měli být poučeni, aby neprodleně hlásili jakékoli příznaky, které mohou naznačovat poškození jater, včetně únavy, anorexie, diskomfortu v pravé horní části břicha, tmavé moči nebo žloutenky.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Ve 104týdenní studii karcinogenity u potkanů při dávkách 2, 20, 60 nebo 80 mg/kg/den orální sondou byla incidence děložních stromálních polypů významně zvýšena u samic při dávce 80 mg/kg/den při systémové expozice 20násobku lidské expozice při 40 mg/den na základě AUC. Při nižších dávkách nebyl pozorován zvýšený výskyt polypů.
Ve 107týdenní studii karcinogenity u myší, kterým bylo podáváno 10, 60 nebo 200 mg/kg/den perorální sondou, byla pozorována zvýšená incidence hepatocelulárního adenomu/karcinomu při dávce 200 mg/kg/den při systémové expozici 20násobku expozice u člověka při 40 mg/den na základě AUC. Při nižších dávkách nebyl pozorován zvýšený výskyt hepatocelulárních nádorů.
Rosuvastatin nebyl mutagenní ani klastogenní s metabolickou aktivací nebo bez ní v Amesově testu se Salmonella typhimurium a Escherichia coli, testu myšího lymfomu a testu chromozomálních aberací v plicních buňkách čínského křečka. Rosuvastatin byl negativní v in vivo mikronukleárním testu na myších.
Ve studiích fertility u potkanů s perorálními dávkami 5, 15, 50 mg/kg/den byli samci léčeni po dobu 9 týdnů před pářením a během páření a samice byly ošetřovány 2 týdny před pářením a po celou dobu páření až do 7. dne březosti. Žádné nežádoucí účinky účinek na fertilitu byl pozorován při dávce 50 mg/kg/den (systémové expozice až 10krát vyšší než expozice u člověka při dávce 40 mg/den na základě AUC). Ve varlatech psů léčených rosuvastatinem v dávce 30 mg/kg/den po dobu jednoho měsíce byly pozorovány obrovské spermatidní buňky. Spermatidické obří buňky byly pozorovány u opic po 6měsíční léčbě 30 mg/kg/den navíc k vakuolizaci semenotvorného tubulárního epitelu. Expozice u psa byla 20krát vyšší au opic 10krát vyšší než expozice u člověka při dávce 40 mg/den na základě plochy povrchu těla. Podobné nálezy byly pozorovány u jiných drog v této třídě.
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
CRESTOR 5 mg je kontraindikován pro použití u těhotných žen, protože bezpečnost u těhotných žen nebyla stanovena a není zjevný přínos léčby přípravkem CRESTOR 20 mg během těhotenství. Protože inhibitory HMG-CoA reduktázy snižují syntézu cholesterolu a možná i syntézu dalších biologicky aktivních látek odvozených od cholesterolu, může CRESTOR při podávání těhotným ženám způsobit poškození plodu. CRESTOR 5 mg by měl být přerušen, jakmile je rozpoznáno těhotenství (viz KONTRAINDIKACE ]. Omezené publikované údaje o použití rosuvastatinu jsou nedostatečné ke stanovení rizika závažných vrozených malformací nebo potratu spojeného s užíváním léků. V reprodukčních studiích na zvířatech nebyly pozorovány žádné nežádoucí vývojové účinky při perorálním podávání rosuvastatinu během organogeneze při systémových expozicích ekvivalentních maximální doporučené dávce pro člověka (MRHD) 40 mg/den u potkanů nebo králíků (na základě AUC a plochy povrchu těla, v tomto pořadí ). U potkanů a králíků došlo ke snížení přežití mláďat/plodu 12krát a ekvivalentně k MRHD 40 mg/den (viz Data ].
Odhadované základní riziko závažných vrozených vad a potratu pro indikovanou populaci není známo. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2–4 % a 15–20 %.
Data
Lidská data
Omezené publikované údaje o rosuvastatinu neprokázaly zvýšené riziko závažných vrozených malformací nebo potratu. Vzácně byly hlášeny vrozené anomálie po intrauterinní expozici jiným statinům. V přehledu přibližně 100 prospektivně sledovaných těhotenství u žen vystavených simvastatinu nebo lovastatinu nepřesáhl výskyt vrozených anomálií, spontánních potratů a úmrtí plodu/mrtvě narozených dětí to, co by se dalo očekávat v běžné populaci. Počet případů je dostatečný k vyloučení ≥3 až 4násobného nárůstu vrozených anomálií oproti základnímu výskytu. U 89 % prospektivně sledovaných těhotenství byla medikamentózní léčba zahájena před těhotenstvím a byla přerušena v určitém okamžiku prvního trimestru, když bylo těhotenství identifikováno.
Údaje o zvířatech
Rosuvastatin prochází placentou u potkanů a králíků a nachází se ve fetální tkáni a plodové vodě v 3 % a 20 % plazmatické koncentrace matky po jednorázové perorální dávce 25 mg/kg žaludeční sondou v 16. den březosti u potkanů. Vyšší distribuce ve fetální tkáni (25% plazmatická koncentrace matky) byla pozorována u králíků po jedné perorální dávce 1 mg/kg žaludeční sondou 18. den březosti.
Podávání rosuvastatinu neindikovalo teratogenní účinek u potkanů při ≤ 25 mg/kg/den nebo u králíků ≤ 3 mg/kg/den (dávky ekvivalentní MRHD 40 mg/den na základě AUC a plochy povrchu těla, v daném pořadí).
U samic potkanů, kterým bylo před pářením podáváno 5, 15 a 50 mg/kg/den a pokračovalo až do 7. dne březosti, vedlo ke snížení tělesné hmotnosti plodu (mláďata samiček) a opožděné osifikaci při dávce 50 mg/kg/den (10násobek expozice u člověka při dávka MRHD 40 mg/den na základě AUC).
březích samic potkanů, kterým byl podáván rosuvastatin v dávce 2, 10 a 50 mg/kg/den od 7. dne březosti do 21. dne laktace (odstavení), došlo ke snížení přežití mláďat při dávce 50 mg/kg/den (dávka ekvivalentní 12násobku MRHD 40 mg /den podle tělesného povrchu).
U březích králíků, kterým byl podáván rosuvastatin v dávce 0,3, 1 a 3 mg/kg/den od 6. dne březosti do 18. dne, byla při dávce 3 mg/kg/den (dávka ekvivalentní MRHD 40 mg/den) pozorována snížená životaschopnost plodu a mateřská mortalita. den podle tělesného povrchu).
Laktace
Shrnutí rizik
Užívání rosuvastatinu je během kojení kontraindikováno [viz KONTRAINDIKACE ]. Omezené údaje naznačují, že CRESTOR je přítomen v mateřském mléce. Nejsou dostupné informace o účincích léku na kojené dítě ani o účincích léku na tvorbu mléka. Vzhledem k možnosti závažných nežádoucích reakcí u kojeného dítěte informujte pacienty, že kojení se během léčby přípravkem CRESTOR nedoporučuje.
Ženy a muži reprodukčního potenciálu
Antikoncepce
CRESTOR může způsobit poškození plodu při podání těhotné ženě [viz Použití u konkrétních populací ]. Informujte ženy s reprodukčním potenciálem, aby během léčby přípravkem CRESTOR používaly účinnou antikoncepci.
Pediatrické použití
U dětí a dospívajících ve věku 8 až 17 let s heterozygotní familiární hypercholesterolémií byla bezpečnost a účinnost přípravku CRESTOR 10 mg jako doplňku k dietě ke snížení hladiny celkového cholesterolu, LDL-C a ApoB, když po adekvátní zkoušce dietní terapie LDL -C přesahuje 190 mg/dl nebo když LDL-C přesahuje 160 mg/dl a existuje pozitivní rodinná anamnéza předčasného KVO nebo dvou nebo více dalších rizikových faktorů KVO, byly stanoveny v jedné kontrolované studii a v jedné otevřené, nekontrolované soud [viz Klinické studie ]. Dlouhodobá účinnost léčby přípravkem CRESTOR zahájená v dětství ke snížení morbidity a mortality v dospělosti nebyla stanovena.

Bezpečnost a účinnost přípravku CRESTOR 5 mg u dětí a dospívajících ve věku 10 až 17 let s heterozygotní familiární hypercholesterolemií byla hodnocena v kontrolované klinické studii trvající 12 týdnů, po které následovalo 40 týdnů otevřené expozice. Pacienti léčení 5 mg, 10 mg a 20 mg denně CRESTOR 10 mg měli profil nežádoucích účinků obecně podobný jako u pacientů léčených placebem. Nebyl zjištěn žádný zjistitelný účinek přípravku CRESTOR na růst, hmotnost, BMI (index tělesné hmotnosti) nebo sexuální dospívání (viz Klinické studie ] u dětí a dospívajících (ve věku 10 až 17 let).
CRESTOR nebyl studován v kontrolovaných klinických studiích zahrnujících prepubertální pacienty nebo pacienty mladší 10 let s heterozygotní familiární hypercholesterolemií. Bezpečnost a účinnost přípravku CRESTOR však byla hodnocena ve dvouleté otevřené nekontrolované studii, která zahrnovala děti a dospívající ve věku 8 až 17 let s heterozygotní familiární hypercholesterolemií (viz Klinické studie ]. Bezpečnost a účinnost přípravku CRESTOR 5 mg při snižování LDL-C se zdála být obecně konzistentní s bezpečností a účinností pozorovanou u dospělých pacientů, a to navzdory omezením nekontrolovaného designu studie.
Děti a dospívající ve věku 7 až 15 let s homozygotní familiární hypercholesterolémií byli studováni v 6týdenní randomizované, placebem kontrolované, zkřížené studii s CRESTOR 20 mg jednou denně, po které následovalo 12 týdnů otevřené léčby [viz Klinické studie ]. Obecně byl bezpečnostní profil v této studii v souladu s dříve stanoveným bezpečnostním profilem u dospělých.
Ačkoli ne všechny nežádoucí účinky zjištěné u dospělé populace byly v klinických studiích u dětí a dospívajících pacientů pozorovány, je třeba u dětí a dospívajících zvážit stejná upozornění a opatření pro dospělé. Dospívající ženy by měly být během léčby přípravkem CRESTOR 5 mg poučeny o vhodných metodách antikoncepce (viz Použití u konkrétních populací ].
Geriatrické použití
10 275 pacientů v klinických studiích s CRESTORem bylo 3159 (31 %) ve věku 65 let a více a 698 (6,8 %) bylo ve věku 75 let a více. Mezi těmito subjekty a mladšími subjekty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti a další hlášené klinické zkušenosti neidentifikovaly rozdíly v odpovědích mezi staršími a mladšími pacienty, nelze však vyloučit větší citlivost některých starších osob.
Starší pacienti mají vyšší riziko myopatie a CRESTOR by měl být starším pacientům předepisován opatrně (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
Renální poškození
Expozice rosuvastatinu není ovlivněna mírným až středně závažným poškozením ledvin (CLcr ≥30 ml/min/1,73 m²). Expozice rosuvastatinu je zvýšena v klinicky významném rozsahu u pacientů s těžkou poruchou funkce ledvin (CLcr DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
Poškození jater
CRESTOR je kontraindikován u pacientů s aktivním onemocněním jater, které může zahrnovat nevysvětlitelné přetrvávající zvýšení hladin jaterních transamináz. Je známo, že chronické alkoholové onemocnění jater zvyšuje expozici rosuvastatinu; CRESTOR 20 mg by měl být u těchto pacientů používán s opatrností [viz KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
Asijští pacienti
Farmakokinetické studie prokázaly přibližně dvojnásobné zvýšení střední expozice rosuvastatinu u asijských subjektů ve srovnání s kavkazskými kontrolami. Dávkování CRESTORU by mělo být upraveno u asijských pacientů [viz DÁVKOVÁNÍ A PODÁVÁNÍ a KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
V případě předávkování neexistuje žádná specifická léčba. V případě předávkování je třeba pacienta léčit symptomaticky a podle potřeby zahájit podpůrná opatření. Hemodialýza významně nezvyšuje clearance rosuvastatinu.
KONTRAINDIKACE
CRESTOR 20 mg je kontraindikován u následujících stavů:
- Pacienti se známou přecitlivělostí na kteroukoli složku tohoto přípravku. U přípravku CRESTOR byly hlášeny hypersenzitivní reakce včetně vyrážky, svědění, kopřivky a angioedému (viz NEŽÁDOUCÍ REAKCE ].
- Pacienti s aktivním onemocněním jater, které může zahrnovat nevysvětlitelné přetrvávající zvýšení hladin jaterních transamináz (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Těhotenství [viz Použití u konkrétních populací ].
- Laktace. Omezené údaje naznačují, že CRESTOR 20 mg je přítomen v mateřském mléce. Protože statiny mají potenciál pro závažné nežádoucí reakce u kojených dětí, ženy, které vyžadují léčbu přípravkem CRESTOR, by neměly kojit své děti (viz Použití u konkrétních populací ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
CRESTOR 10 mg je selektivní a kompetitivní inhibitor HMG-CoA reduktázy, enzymu omezujícího rychlost, který přeměňuje 3-hydroxy-3-methylglutaryl koenzym A na mevalonát, prekurzor cholesterolu. Studie in vivo na zvířatech a studie in vitro na kultivovaných zvířecích a lidských buňkách ukázaly, že rosuvastatin má vysokou absorpci a selektivitu působení v játrech, cílovém orgánu pro snižování cholesterolu. Ve studiích in vivo a in vitro vyvolává rosuvastatin své účinky na úpravu lipidů dvěma způsoby. Za prvé, zvyšuje počet jaterních LDL receptorů na buněčném povrchu, aby se zvýšil příjem a katabolismus LDL. Za druhé, rosuvastatin inhibuje jaterní syntézu VLDL, což snižuje celkový počet částic VLDL a LDL.
Farmakodynamika
CRESTOR 5 mg v závislosti na dávce snižuje zvýšený LDL-cholesterol a snižuje celkový cholesterol a triglyceridy a zvyšuje HDL-cholesterol (viz Klinické studie ]. Terapeutická odpověď na CRESTOR 5 mg je zřejmá během 1 týdne od zahájení léčby a 90 % maximální odpovědi je obvykle dosaženo za 2 týdny. Maximální odpovědi je obvykle dosaženo do 4 týdnů a poté se udržuje. Individualizace dávkování léku by měla být založena na terapeutické odpovědi [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Farmakokinetika
Vstřebávání
V klinických farmakologických studiích u člověka bylo maximálních plazmatických koncentrací rosuvastatinu dosaženo za 3 až 5 hodin po perorálním podání. Cmax i AUC se zvýšily přibližně úměrně dávce CRESTOR 10 mg. Absolutní biologická dostupnost rosuvastatinu je přibližně 20 %.
Podávání přípravku CRESTOR s jídlem neovlivnilo AUC rosuvastatinu.
AUC rosuvastatinu se po večerním nebo ranním podání léku neliší.
Rozdělení
Průměrný distribuční objem rosuvastatinu v ustáleném stavu je přibližně 134 litrů. Rosuvastatin se z 88 % váže na plazmatické proteiny, většinou na albumin. Tato vazba je reverzibilní a nezávislá na plazmatických koncentracích.
Odstranění
Rosuvastatin je primárně eliminován vylučováním stolicí. Eliminační poločas rosuvastatinu je přibližně 19 hodin.
Metabolismus
Rosuvastatin není extenzivně metabolizován; přibližně 10 % radioaktivně značené dávky se získá jako metabolit. Hlavním metabolitem je N-desmethyl rosuvastatin, který je tvořen hlavně cytochromem P450 \ 2C9, a studie in vitro prokázaly, že N-desmethyl rosuvastatin má přibližně jednu šestinu až jednu polovinu inhibiční aktivity HMG-CoA reduktázy oproti původní sloučenině. . Celkově více než 90 % aktivní plazmatické inhibiční aktivity HMG-CoA reduktázy připadá na mateřskou sloučeninu.
Vylučování
Po perorálním podání se rosuvastatin a jeho metabolity primárně vylučují stolicí (90 %). Po intravenózní dávce bylo přibližně 28 % celkové tělesné clearance cestou ledvin a 72 % cestou jater.
Specifické populace
Rasové nebo etnické skupiny
Populační farmakokinetická analýza neodhalila žádné klinicky významné rozdíly ve farmakokinetice mezi bělošskými, hispánskými a černošskými nebo afro-karibskými skupinami. Farmakokinetické studie, včetně jedné provedené v USA, však prokázaly přibližně dvojnásobné zvýšení střední expozice (AUC a Cmax) u asijských subjektů ve srovnání s kavkazskou kontrolní skupinou.
Mužské A ženské pacienty
Mezi muži a ženami nebyly žádné rozdíly v plazmatických koncentracích rosuvastatinu.
Pediatričtí pacienti
V populační farmakokinetické analýze dvou pediatrických studií zahrnujících pacienty s heterozygotní familiární hypercholesterolemií ve věku 10 až 17 let a ve věku 8 až 17 let se expozice rosuvastatinu jevila srovnatelná nebo nižší než expozice rosuvastatinu u dospělých pacientů.
Geriatričtí pacienti
Nebyly žádné rozdíly v plazmatických koncentracích rosuvastatinu mezi starší a starší populací (věk ≥ 65 let).
Pacienti s poruchou ledvin
Mírné až středně těžké poškození ledvin (CLcr ≥30 ml/min/1,73 m²) nemělo žádný vliv na plazmatické koncentrace rosuvastatinu. Plazmatické koncentrace rosuvastatinu se však zvýšily v klinicky významném rozsahu (asi 3krát) u pacientů s těžkou poruchou funkce ledvin (CLcr 80 ml/min/ 1,73 m²).
Hemodialýza
Plazmatické koncentrace rosuvastatinu v ustáleném stavu byly u pacientů na chronické hemodialýze přibližně o 50 % vyšší ve srovnání se zdravými dobrovolníky s normální funkcí ledvin.
Pacienti s poruchou funkce jater
U pacientů s chronickým alkoholovým onemocněním jater byly plazmatické koncentrace rosuvastatinu mírně zvýšeny.
U pacientů s Child-Pugh A chorobou byly Cmax zvýšeny o 60 % a AUC o 5 % ve srovnání s pacienty s normální funkcí jater. U pacientů s Child-Pugh B chorobou byly Cmax zvýšeny o 100 % a AUC o 21 % ve srovnání s pacienty s normální funkcí jater.
Studie lékových interakcí
Clearance rosuvastatinu není v klinicky významné míře závislá na metabolismu cytochromem P450 3A4.
Rosuvastatin je substrátem pro určité transportní proteiny, včetně transportéru hepatického vychytávání polyproteinu 1B1 transportujícího organické anionty (OATP1B1) a efluxního transportéru proteinu rezistence rakoviny prsu (BCRP). Současné podávání přípravku CRESTOR 10 mg s léky, které jsou inhibitory těchto transportních proteinů (např. cyklosporin, některé inhibitory HIV proteázy), může vést ke zvýšení plazmatických koncentrací rosuvastatinu (viz DÁVKOVÁNÍ A PODÁVÁNÍ a DROGOVÉ INTERAKCE ].
Farmakogenomika
Dispozice inhibitorů HMG-CoA reduktázy, včetně rosuvastatinu, zahrnuje OATP1B1 a další transportní proteiny. Vyšší plazmatické koncentrace rosuvastatinu byly hlášeny u velmi malých skupin pacientů (n=3 až 5), kteří mají dvě snížené funkční alely genu, který kóduje OATP1B1 (SLCO1B1 521T > C). Frekvence tohoto genotypu (tj. SLCO1B1 521 C/C) je obecně nižší než 5 % ve většině rasových/etnických skupin. Dopad tohoto polymorfismu na účinnost a/nebo bezpečnost rosuvastatinu nebyl jasně stanoven.
Toxikologie zvířat a/nebo farmakologie
Toxicita centrálního nervového systému
CNS vaskulární léze, charakterizované perivaskulárním krvácením, edémem a mononukleární buněčnou infiltrací perivaskulárních prostorů, byly pozorovány u psů léčených několika dalšími členy této třídy léčiv. Chemicky podobný lék v této třídě vyvolal u psů na dávce závislou degeneraci zrakového nervu (Wallerova degenerace retinogenních vláken) v dávce, která vyvolala hladiny léku v plazmě asi 30krát vyšší než průměrná hladina léku u lidí užívajících nejvyšší doporučenou dávku. Edém, krvácení a částečná nekróza v intersticiu choroidálního plexu byly pozorovány u psí samice usmrcené 24. den umírání v dávce 90 mg/kg/den orální sondou (systémové expozice 100krát vyšší než expozice u člověka při dávce 40 mg/den na základě AUC). Zákal rohovky byl pozorován u psů léčených po dobu 52 týdnů dávkou 6 mg/kg/den orální sondou (systémové expozice 20násobné oproti lidské expozici při dávce 40 mg/den na základě AUC). Šedý zákal byl pozorován u psů léčených po dobu 12 týdnů perorální sondou v dávce 30 mg/kg/den (systémové expozice 60krát vyšší než expozice u člověka při dávce 40 mg/den na základě AUC). Dysplazie sítnice a ztráta sítnice byly pozorovány u psů léčených po dobu 4 týdnů orální sondou v dávce 90 mg/kg/den (systémové expozice 100krát vyšší než expozice u člověka při dávce 40 mg/den na základě AUC). Dávky ≤ 30 mg/kg/den (systémové expozice ≤ 60násobek lidské expozice při 40 mg/den na základě AUC) neodhalily retinální nálezy během léčby po dobu až jednoho roku.
Juvenilní toxikologická studie
Ve studii s mláďaty byla potkanům podávána orální sondou dávka 10 nebo 50 mg/kg/den od odstavení po dobu 9 týdnů před párováním, během párování a až do dne před pitvou u samců nebo až do 7. dne březosti u samic. Žádné účinky na sexuální vývoj, vzhled varlat a nadvarlat nebo fertilitu nebyly pozorovány při žádné z dávkovacích hladin (2násobek nebo až 24násobek expozice u člověka (AUC) při maximální pediatrické dávce 20 mg/den).
Klinické studie
Hyperlipidémie a smíšená dyslipidémie
CRESTOR 5 mg snižuje celkový-C, LDL-C, ApoB, nonHDL-C a TG a zvyšuje HDL-C u dospělých pacientů s hyperlipidémií a smíšenou dyslipidémií.
Studie dávkování
V multicentrické, dvojitě zaslepené, placebem kontrolované studii s rozmezím dávek u pacientů s hyperlipidémií CRESTOR podávaný v jedné denní dávce po dobu 6 týdnů významně snížil celkový C, LDL-C, nonHDL-C a ApoB napříč dávkou dosah (tabulka 6).
Aktivně řízená studie
CRESTOR 5 mg byl srovnáván s inhibitory HMG-CoA reduktázy atorvastatinem, simvastatinem a pravastatinem v multicentrické, otevřené studii s dávkovacím rozmezím u 2240 pacientů s hyperlipidémií nebo smíšenou dyslipidémií. Po randomizaci byli pacienti léčeni po dobu 6 týdnů jednorázovou denní dávkou buď CRESTOR 20 mg, atorvastatin, simvastatin nebo pravastatin (obrázek 1 a tabulka 7).
Obrázek 1: Procentuální změna LDL-C podle dávky přípravku CRESTOR 20 mg, atorvastatinu, simvastatinu a pravastatinu v týdnu 6 u pacientů s hyperlipidemií nebo smíšenou dyslipidemií 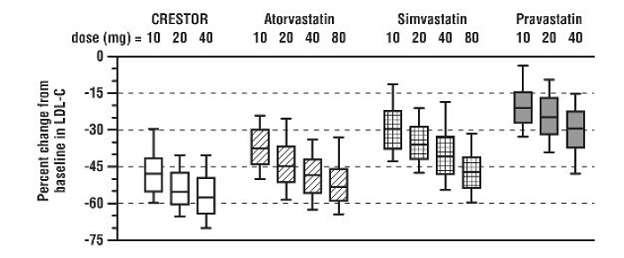
Krabicové grafy představují hodnoty 25., 50. a 75. percentilu, přičemž vousy představují hodnoty 10. a 90. percentilu. Průměrná výchozí hodnota LDL-C: 189 mg/Dl
Heterozygotní familiární hypercholesterolémie
Aktivně řízená studie
Ve studii pacientů s heterozygotní FH (výchozí průměr LDL 291) byli pacienti randomizováni do skupiny CRESTOR 20 mg nebo atorvastatin 20 mg. Dávka byla zvyšována v 6týdenních intervalech. Významné snížení LDL-C oproti výchozí hodnotě bylo pozorováno při každé dávce v obou léčebných skupinách (tabulka 8).
Hypertriglyceridémie
Studie dávka-odpověď
Ve dvojitě zaslepené, placebem kontrolované studii závislosti odpovědi na dávce u pacientů s výchozími hladinami TG od 273 do 817 mg/dl CRESTOR 10 mg podávaný v jedné denní dávce (5 až 40 mg) po dobu 6 týdnů významně snížil hladiny TG v séru ( Tabulka 9).
Primární dysbetalipoproteinemie (hyperlipoproteinemie III. typu)
randomizované, multicentrické, dvojitě zaslepené zkřížené studii 32 pacientů (27 s ε2/ε2 a 4 s mutací apo E [Arg145Cys] s primární dysbetalipoproteinémií (hyperlipoproteinémie typu III) vstoupilo do 6týdenního dietního úvodního období na NCEP Dieta s terapeutickou změnou životního stylu (TLC). CRESTOR snížil hladinu non-HDL-C (primární koncový bod) a hladiny cirkulujícího zbytkového lipoproteinu Výsledky jsou uvedeny v tabulce níže.
Homozygotní familiární hypercholesterolémie
Studie titrace dávky
otevřené studii s nucenou titrací byla u homozygotních pacientů s FH (n=40, 8-63 let) hodnocena jejich odpověď na CRESTOR 20 až 40 mg titrovaný v 6týdenním intervalu. V celkové populaci bylo průměrné snížení LDL-C oproti výchozí hodnotě 22 %. Přibližně jedné třetině pacientů prospělo zvýšení dávky z 20 mg na 40 mg s dalším snížením LDL o více než 6 %. U 27 pacientů s alespoň 15% snížením LDL-C bylo průměrné snížení LDL-C 30% (medián 28% snížení). Mezi 13 pacienty se snížením LDL-C
Pediatričtí pacienti s homozygotní familiární hypercholesterolemií
CRESTOR byl studován v randomizované, dvojitě zaslepené, placebem kontrolované, multicentrické, zkřížené studii u 14 dětí a dospívajících s homozygotní familiární hypercholesterolémií. Studie zahrnovala 4týdenní úvodní fázi diety, během níž pacienti dostávali CRESTOR 10 mg denně, zkříženou fázi, která zahrnovala dvě 6týdenní léčebná období buď CRESTOR 20 mg nebo placebem v náhodném pořadí, po nichž následovala 12- týden otevřené fáze, během které všichni pacienti dostávali CRESTOR 20 mg. Věk pacientů byl od 7 do 15 let (medián 11 let), 50 % byli muži, 71 % byli běloši, 21 % byli Asiaté, 7 % byli černoši a žádný pacient nebyl hispánského etnika. Padesát procent bylo na terapii aferézou a 57 % užívalo ezetimib. Pacienti, kteří vstoupili do studie na terapii aferézou nebo ezetimibem, pokračovali v léčbě po celou dobu studie. Průměrný LDL-C na začátku byl 416 mg/dl (rozmezí 152 až 716 mg/dl). Celkem 13 pacientů dokončilo obě léčebná období randomizované zkřížené fáze; jeden pacient stáhl souhlas kvůli nemožnosti odběru krve během fáze křížení.
CRESTOR 20 mg významně snížil LDL-C, celkový cholesterol, ApoB a non-HDL-C ve srovnání s placebem (tabulka 11).
Pediatričtí pacienti s heterozygotní familiární hypercholesterolemií
Ve dvojitě zaslepené, randomizované, multicentrické, placebem kontrolované, 12týdenní studii bylo 176 (97 mužů a 79 žen) dětí a dospívajících s heterozygotní familiární hypercholesterolémií randomizováno k léčbě rosuvastatinem v dávce 5, 10 nebo 20 mg nebo placebem denně. Věk pacientů byl od 10 do 17 let (střední věk 14 let), přičemž přibližně 30 % pacientů bylo ve věku 10 až 13 let a přibližně 17 %, 18 %, 40 % a 25 % v Tannerově stadiu II, III, IV, a V, v tomto pořadí. Samice byly minimálně 1 rok po menarché. Průměrný LDL-C na začátku byl 233 mg/dl (rozmezí 129 až 399). Po 12týdenní dvojitě zaslepené fázi následovala 40týdenní otevřená fáze titrace dávky, kdy všichni pacienti (n=173) dostávali 5 mg, 10 mg nebo 20 mg rosuvastatinu denně.
Rosuvastatin významně snížil LDL-C (primární cílový bod), celkový cholesterol a hladiny ApoB při každé dávce ve srovnání s placebem. Výsledky jsou uvedeny v tabulce 12 níže.
Na konci 12týdenního dvojitě zaslepeného léčebného období bylo procento pacientů, kteří dosáhli cílové hodnoty LDL-C nižší než 110 mg/dl (2,8 mmol/l), 0 % u placeba, 12 % u rosuvastatinu 5 mg , 41 % pro rosuvastatin 10 mg a 41 % pro rosuvastatin 20 mg. Pro 40týdenní otevřenou fázi bylo 71 % pacientů titrováno na maximální dávku 20 mg a 41 % pacientů dosáhlo cíle LDL-C 110 mg/dl.
Rosuvastatin byl také studován ve dvouleté otevřené, nekontrolované titraci do cíle, která zahrnovala 175 dětí a dospívajících s heterozygotní familiární hypercholesterolemií ve věku 8 až 17 let (79 chlapců a 96 dívek). Všichni pacienti měli zdokumentovaný genetický defekt v LDL receptoru nebo v ApoB. Přibližně 89 % byli běloši, 7 % byli Asiaté, 1 % byli černoši a méně než 1 % byli Hispánci. Průměrný LDL-C na začátku byl 236 mg/dl. Padesát osm (33 %) pacientů bylo na začátku prepubertální. Počáteční dávka rosuvastatinu pro všechny děti a dospívající byla 5 mg jednou denně. Děti ve věku 8 až méně než 10 let (n=41 na začátku) mohou titrovat na maximální dávku 10 mg jednou denně a děti a dospívající ve věku 10 až 17 let mohou titrovat na maximální dávku 20 mg jednou denně.
Snížení LDL-C oproti výchozí hodnotě bylo obecně konzistentní napříč věkovými skupinami ve studii, stejně jako s předchozími zkušenostmi v kontrolovaných studiích u dospělých i dětí.
Dlouhodobá účinnost léčby rosuvastatinem zahájené v dětství ke snížení morbidity a mortality v dospělosti nebyla stanovena.
Zpomalení Progrese Aterosklerózy
Ve studii Measuring Effects on Intima Media Thickness: an Evaluation Of Rosuvastatin 40 mg (METEOR) byl hodnocen účinek léčby přípravkem CRESTOR na aterosklerózu karotid pomocí ultrasonografie v B-módu u pacientů se zvýšeným LDL-C, s nízkým rizikem (Framinghamské riziko
Roční míra změny od výchozí hodnoty pro skupinu s placebem byla +0,0131 mm/rok (p
Na úrovni jednotlivých pacientů ve skupině léčené přípravkem CRESTOR neprokázalo 52,1 % pacientů nepřítomnost progrese onemocnění (definovaná jako negativní roční míra změny) ve srovnání s 37,7 % pacientů ve skupině s placebem.
Primární prevence kardiovaskulárních chorob
Ve studii Odůvodnění pro použití statinů v primární prevenci: Intervenční studie hodnotící Rosuvastatin (JUPITER) byl hodnocen účinek přípravku CRESTOR (kalcium rosuvastatinu) na výskyt závažných kardiovaskulárních (KV) příhod u 17 802 mužů (≥50 let). ) a ženy (≥ 60 let), které neměly žádné klinicky zjevné kardiovaskulární onemocnění, hladiny LDL-C
Primárním koncovým bodem byl složený cílový bod sestávající z doby do prvního výskytu kterékoli z následujících závažných KV příhod: KV úmrtí, nefatální infarkt myokardu, nefatální cévní mozková příhoda, hospitalizace pro nestabilní anginu pectoris nebo arteriální revaskularizační procedura.
Rosuvastatin významně snížil riziko závažných KV příhod (252 příhod ve skupině s placebem vs. 142 příhod ve skupině s rosuvastatinem) se statisticky významným (p
Obrázek 2: Čas do prvního výskytu závažných kardiovaskulárních příhod u JUPITER 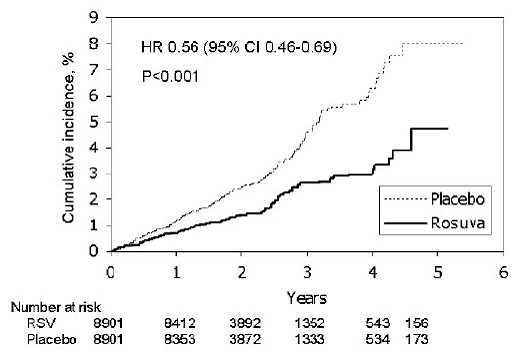
Jednotlivé složky primárního cílového ukazatele jsou uvedeny na obrázku 3. Rosuvastatin významně snížil riziko nefatálního infarktu myokardu, nefatální cévní mozkové příhody a arteriálních revaskularizačních výkonů. Mezi skupinami s rosuvastatinem a placebem nebyly žádné významné rozdíly v léčbě úmrtí z kardiovaskulárních příčin nebo hospitalizací pro nestabilní anginu pectoris.
Rosuvastatin významně snížil riziko infarktu myokardu (6 fatálních příhod a 62 nefatálních příhod u subjektů léčených placebem oproti 9 fatálním příhodám a 22 nefatálních příhod u subjektů léčených rosuvastatinem) a riziko cévní mozkové příhody (6 smrtelných příhod a 58 nefatálních příhod v subjekty léčené placebem vs. 3 fatální příhody a 30 nefatálních příhod u subjektů léčených rosuvastatinem).
post-hoc podskupinové analýze subjektů JUPITER (n=1405; rosuvastatin=725, placebo=680) s hsCRP ≥2 mg/l a bez dalších tradičních rizikových faktorů (kouření, TK ≥140/90 nebo užívající antihypertenziva, nízká HDL-C) kromě věku, po úpravě na vysoký HDL-C nebyl při léčbě rosuvastatinem žádný významný léčebný přínos.
Obrázek 3: Hlavní události CV podle léčebné skupiny v JUPITER 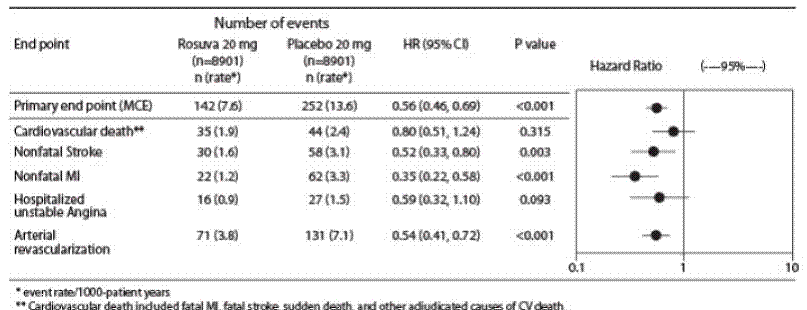
Po jednom roce zvýšil rosuvastatin HDL-C a snížil LDL-C, hsCRP, hladinu celkového cholesterolu a sérových triglyceridů (p
INFORMACE PRO PACIENTA
CRESTOR® (Kres-tor) tablety vápenaté soli rosuvastatinu
Předtím, než začnete užívat CRESTOR 20 mg, a pokaždé, když dostanete náhradní náplň, si pečlivě přečtěte tyto informace pro pacienta. Máte-li jakékoli dotazy týkající se přípravku CRESTOR, zeptejte se svého lékaře. Pouze váš lékař může určit, zda je pro vás CRESTOR vhodný.
Co je CRESTOR?
CRESTOR 20 mg je lék na předpis, který obsahuje lék snižující hladinu cholesterolu nazývaný rosuvastatin vápenatý. Většina cholesterolu ve vaší krvi se tvoří v játrech. CRESTOR 20 mg působí tak, že snižuje cholesterol dvěma způsoby: CRESTOR 5 mg blokuje enzym v játrech, který způsobuje, že játra produkují méně cholesterolu, a CRESTOR 20 mg zvyšuje vychytávání a odbourávání cholesterolu, který se již nachází v krvi.
- CRESTOR se používá spolu s dietou k:
- snížit hladinu vašeho „špatného“ cholesterolu (LDL)
- zvýšit hladinu vašeho „dobrého“ cholesterolu (HDL)
- snížit hladinu tuku v krvi (triglyceridy)
- zpomalit hromadění tukových usazenin (plaku) ve stěnách krevních cév
- CRESTOR se používá k léčbě:
- dospělí, kteří nedokážou kontrolovat hladinu cholesterolu pouze dietou a cvičením
- děti ve věku 8 až 17 let s heterozygotní familiární hypercholesterolemií (dědičný stav, který způsobuje vysoké hladiny LDL)
- děti ve věku 7 až 17 let s homozygotní familiární hypercholesterolemií (dědičný stav, který způsobuje vysoké hladiny LDL).
CRESTOR 20 mg není schválen pro použití u dětí s heterozygotní familiární hypercholesterolémií mladších 8 let nebo pro použití u dětí s homozygotní familiární hypercholesterolémií mladších než 7 let.
CRESTOR 5 mg se používá ke snížení rizika srdečního infarktu a mozkové mrtvice u mužů ve věku 50 let a starších a žen ve věku 60 let a starších, kteří nemají známé srdeční onemocnění, ale mají určité další rizikové faktory.
Není známo, zda je CRESTOR 10 mg bezpečný a účinný u lidí, kteří mají Fredricksonovu dyslipidémii typu I a V.
Kdo by neměl užívat CRESTOR?
Neužívejte CRESTOR, pokud:
- jste alergický(á) na rosuvastatin vápenatý nebo na kteroukoli složku přípravku CRESTOR. Úplný seznam složek přípravku CRESTOR naleznete na konci této příbalové informace.
- mít problémy s játry.
- jste těhotná nebo si myslíte, že byste mohla být těhotná, nebo těhotenství plánujete. CRESTOR 20 mg může poškodit vaše nenarozené dítě. Pokud otěhotníte, přestaňte CRESTOR užívat a ihned kontaktujte svého lékaře. Pokud neplánujete otěhotnět, měla byste během užívání přípravku CRESTOR používat účinnou antikoncepci (antikoncepci).
- kojí. Léky jako CRESTOR 5 mg mohou přecházet do vašeho mateřského mléka a mohou poškodit vaše dítě.
Co mám říct svému lékaři před a během užívání přípravku CRESTOR?
Informujte svého lékaře, pokud:
- máte nevysvětlitelné bolesti svalů nebo slabost
- máte nebo jste měl(a) problémy s ledvinami
- máte nebo jste měl(a) problémy s játry
- vypijte více než 2 sklenice alkoholu denně
- mít problémy se štítnou žlázou
- jsou starší 65 let
- jsou asijského původu
- jste těhotná nebo si myslíte, že byste mohla být těhotná, nebo těhotenství plánujete
- kojí
Informujte svého lékaře o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků.
Než začnete užívat jakékoli nové léky, poraďte se se svým lékařem.
Užívání přípravku CRESTOR 20 mg s některými jinými léky se může vzájemně ovlivňovat a způsobit nežádoucí účinky. CRESTOR může ovlivnit způsob účinku jiných léků a jiné léky mohou ovlivnit účinek přípravku CRESTOR.
Zejména informujte svého lékaře, pokud užíváte:
- cyklosporin (lék na imunitní systém)
- gemfibrozil (lék na bázi kyseliny fibrové ke snížení cholesterolu)
- antivirotika včetně inhibitorů proteázy HIV nebo hepatitidy C (jako je lopinavir, ritonavir, fosamprenavir, tipranavir, atazanavir nebo simeprevir)
- některé léky proti plísním (jako je itrakonazol, ketokonazol a flukonazol)
- kumarinová antikoagulancia (léky, které zabraňují tvorbě krevních sraženin, jako je warfarin)
- niacin nebo kyselina nikotinová
- deriváty kyseliny fibrové (jako je fenofibrát)
- kolchicin (lék používaný k léčbě dny)
Pokud si nejste jistý(á), požádejte svého lékaře nebo lékárníka o seznam těchto léků.
Znát všechny léky, které užíváte. Uchovávejte si jejich seznam, abyste je mohli ukázat svému lékaři a lékárníkovi, když dostanete nový lék.
Jak mám užívat CRESTOR 10 mg?
- Užívejte CRESTOR přesně podle pokynů svého lékaře.
- Užívejte CRESTOR ústy 1krát denně. Tabletu spolkněte celou.
- CRESTOR lze užívat kdykoli během dne, s jídlem nebo bez jídla.
- Ne změňte dávku nebo přestaňte CRESTOR 10 mg bez porady s lékařem, i když se cítíte dobře.
- Váš lékař může provést krevní testy, aby zkontroloval hladinu cholesterolu před a během léčby přípravkem CRESTOR. Váš lékař může v případě potřeby změnit dávku přípravku CRESTOR 10 mg.
- Váš lékař může před podáním přípravku CRESTOR zahájit dietu na snížení cholesterolu. Držte tuto dietu, když užíváte CRESTOR.
- Po užití přípravku CRESTOR počkejte alespoň 2 hodiny, než si vezmete antacidum, které obsahuje kombinaci hliníku a hydroxidu hořečnatého.
- Pokud vynecháte dávku přípravku CRESTOR 10 mg, vezměte si ji, jakmile si vzpomenete. Nicméně, neužívejte 2 dávky přípravku CRESTOR 10 mg během 12 hodin po sobě.
- Jestliže jste užil(a) příliš mnoho přípravku CRESTOR 20 mg nebo jste se předávkoval(a), zavolejte ihned svému lékaři nebo jděte na pohotovost v nejbližší nemocnici.
Jaké jsou možné vedlejší účinky přípravku CRESTOR 20 mg?
CRESTOR 10 mg může způsobit závažné nežádoucí účinky, včetně:
- Svalová bolest, citlivost a slabost (myopatie). Svalové problémy, včetně rozpadu svalů, mohou být u některých lidí vážné a vzácně způsobit poškození ledvin, které může vést ke smrti. Okamžitě informujte svého lékaře, pokud:
- máte nevysvětlitelnou svalovou bolest, citlivost nebo slabost, zvláště pokud máte horečku nebo se cítíte unavenější než obvykle, když užíváte CRESTOR.
- máte svalové problémy, které neustupují ani poté, co vám lékař řekl, abyste přestal užívat CRESTOR. Váš lékař může provést další testy, aby diagnostikoval příčinu vašich svalových problémů.
Vaše šance na svalové problémy jsou vyšší, pokud:
- užíváte během užívání přípravku CRESTOR některé další léky
- jsou starší 65 let
- máte problémy se štítnou žlázou (hypotyreóza), které nejsou kontrolovány
- mít problémy s ledvinami
- užíváte vyšší dávky přípravku CRESTOR
- Problémy s játry. Váš lékař by měl provést krevní testy, aby zkontroloval Vaše játra dříve, než začnete užívat CRESTOR 5 mg a pokud se u Vás během užívání CRESTORU objeví příznaky jaterních potíží. Okamžitě zavolejte svého lékaře, pokud máte některý z následujících příznaků jaterních problémů:
- cítit se neobvykle unavený nebo slabý
- ztráta chuti k jídlu
- bolest v horní části břicha
- tmavá moč
- zežloutnutí kůže nebo očního bělma
Mezi nejčastější nežádoucí účinky mohou patřit: bolesti hlavy, bolesti svalů, bolesti břicha, slabost a nevolnost.
Další nežádoucí účinky, které byly hlášeny u přípravku CRESTOR, zahrnují ztrátu paměti a zmatenost.
Informujte svého lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku CRESTOR. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám uchovávat CRESTOR 20 mg?
- Uchovávejte CRESTOR 10 mg při pokojové teplotě, mezi 68 °F až 77 °F (20 °C až 25 °C) a na suchém místě.
- Léky, které jsou zastaralé nebo již nepotřebné, bezpečně vyhoďte.
Uchovávejte CRESTOR 10 mg a všechny léky mimo dosah dětí.
Jaké jsou ingredience v CRESTOR?
Aktivní složka: rosuvastatin jako vápenatá sůl rosuvastatinu
Neaktivní ingredience: mikrokrystalická celulóza NF, monohydrát laktózy NF, fosforečnan vápenatý NF, krospovidon NF, stearát hořečnatý NF, hypromelóza NF, triacetin NF, oxid titaničitý USP, žlutý oxid železitý a červený oxid železitý NF.
Obecné informace o bezpečném a efektivním používání CRESTOR
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v příbalové informaci pro pacienty. Nepoužívejte CRESTOR 10 mg na stav, pro který nebyl předepsán. Nedávejte CRESTOR 20 mg jiným lidem, i když mají stejný zdravotní stav jako vy. Může jim to ublížit.
Můžete požádat svého lékárníka nebo lékaře o informace o přípravku CRESTOR 5 mg, které jsou určeny pro zdravotníky.
Tyto informace pro pacienty byly schváleny americkým Úřadem pro kontrolu potravin a léčiv, revidováno 9/2018
