Lopid 300mg Gemfibrozil Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Lopid 300 mg a jak se používá?
Lopid (gemfibrozil) je činidlo regulující lipidy používané k léčbě velmi vysokých hladin cholesterolu a triglyceridů u lidí s pankreatitidou a také se používá ke snížení rizika mrtvice, srdečního infarktu nebo jiných srdečních komplikací u lidí s vysokým cholesterolem a triglyceridy, kteří mají nepomohla jiná léčba. Lopid je k dispozici v obecné formě.
Jaké jsou vedlejší účinky přípravku Lopid 300 mg?
Mezi časté nežádoucí účinky přípravku Lopid 300 mg patří:
- žaludeční nevolnost,
- bolest žaludku/břicha,
- nevolnost,
- zvracení,
- průjem,
- bolest hlavy,
- závrať,
- ospalost,
- bolesti kloubů nebo svalů,
- ztráta zájmu o sex,
- impotence,
- potíže s orgasmem,
- pocit necitlivosti nebo mravenčení,
- neobvyklá chuť, popř
- příznaky nachlazení, jako je ucpaný nos, kýchání, bolest v krku.
Lopid 300 mg může vzácně způsobit žlučové kameny a problémy s játry.
Informujte svého lékaře, pokud zaznamenáte některý z následujících nepravděpodobných, ale závažných nežádoucích účinků přípravku Lopid 300 mg, včetně:
- silná bolest žaludku/břicha,
- přetrvávající nevolnost nebo zvracení,
- žloutnutí očí nebo kůže a
- tmavá moč.
POPIS
LOPID® (tablety gemfibrozilu, USP) je činidlo regulující lipidy. Je dostupný ve formě tablet pro perorální podání. Jedna tableta obsahuje 600 mg gemfibrozilu. Každá tableta také obsahuje stearát vápenatý, NF; kandelilový vosk, FCC; mikrokrystalická celulóza, NF; hydroxypropylcelulóza, NF; hypromelóza, USP; methylparaben, NF; Opaspray bílý; polyethylenglykol, NF; polysorbát 80, NF; propylparaben, NF; koloidní oxid křemičitý, NF; předželatinovaný škrob, NF. Chemický název je kyselina 5-(2,5-dimethylfenoxy)-2,2-dimethylpentanová s následujícím strukturním vzorcem:
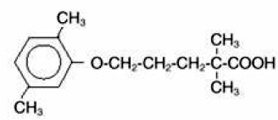
Empirický vzorec je C15H22O3 a molekulová hmotnost je 250,35; rozpustnost ve vodě a kyselině je 0,0019 % a ve zředěné zásadě je větší než 1 %. Teplota tání je 58° – 61°C. Gemfibrozil je bílá pevná látka, která je za běžných podmínek stabilní.
INDIKACE
LOPID (tablety gemfibrozilu, USP) je indikován jako doplňková terapie k dietě pro:
analýze podskupin pacientů v Helsinki Heart Study s nadprůměrnými výchozími hodnotami HDL-cholesterolu (vyššími než 46,4 mg/dl) byla incidence závažných koronárních příhod podobná pro podskupiny gemfibrozilu a placeba (viz tabulka I).
Počáteční léčba dyslipidémie je dietní terapie specifická pro typ lipoproteinové abnormality. Nadměrná tělesná hmotnost a nadměrný příjem alkoholu mohou být důležitými faktory hypertriglyceridémie a měly by být léčeny před jakoukoli medikamentózní terapií. Fyzické cvičení může být důležitým doplňkovým opatřením a bylo spojeno se zvýšením HDL-cholesterolu. Je třeba hledat a adekvátně léčit onemocnění přispívající k hyperlipidémii, jako je hypotyreóza nebo diabetes mellitus. Estrogenová terapie je někdy spojena s masivním zvýšením plazmatických triglyceridů, zejména u subjektů s familiární hypertriglyceridemií. V takových případech může přerušení estrogenové terapie odstranit potřebu specifické medikamentózní terapie hypertriglyceridémie. Užívání léků by mělo být zvažováno pouze tehdy, pokud byly učiněny přiměřené pokusy o získání uspokojivých výsledků nelékovými metodami. Pokud dojde k rozhodnutí nasadit léky, měl by být pacient poučen, že to nesnižuje důležitost dodržování diety.
DÁVKOVÁNÍ A PODÁVÁNÍ
Doporučená dávka pro dospělé je 1200 mg podaná ve dvou dílčích dávkách 30 minut před ranním a večerním jídlem (viz KLINICKÁ FARMAKOLOGIE ).
JAK DODÁVÁNO
LOPID (Tableta 737), bílé, eliptické, potahované tablety s půlicí rýhou, každá obsahující 600 mg gemfibrozilu, jsou dostupné takto:
NDC 0071-0737-20: Láhve po 60 NDC 0071-0737-30: Láhve po 500
Skladujte při kontrolované pokojové teplotě 20° – 25°C (68° – 77°F) [viz USP]. Chraňte před světlem a vlhkostí.
Distribuováno divizí Parke-Davis společnosti Pfizer Inc, NY, NY 10017. Revize: prosinec 2020
VEDLEJŠÍ EFEKTY
Ve dvojitě zaslepené kontrolované fázi primární prevence v Helsinki Heart Study dostávalo 2046 pacientů LOPID po dobu až pěti let. V této studii byly následující nežádoucí účinky statisticky častější u subjektů ve skupině LOPID:
Operace žlučníku byla provedena u 0,9 % subjektů s LOPID 300 mg a 0,5 % subjektů s placebem ve složce primární prevence, což je 64% nadbytek, který se statisticky neliší od nadbytku operací žlučníku pozorovaného ve skupině s klofibrátem ve srovnání se skupinou s placebem studie WHO . Operace žlučníku byla také častěji prováděna ve skupině LOPID ve srovnání se skupinou s placebem (1,9 % versus 0,3 %, p=0,07) ve složce sekundární prevence. Statisticky významný nárůst apendektomie ve skupině s gemfibrozilem byl pozorován také ve složce sekundární prevence (6 na gemfibrozilu versus 0 na placebu, p=0,014).
Nežádoucí reakce na nervový systém a zvláštní smysly byly častější ve skupině LOPID 300 mg. Mezi ně patřily hypestezie, parestézie a perverze chuti. Mezi další nežádoucí účinky, které byly častější u subjektů v léčebné skupině LOPID 300 mg, ale u nichž nebyla prokázána příčinná souvislost, patří katarakta, onemocnění periferních cév a intracerebrální krvácení.
jiných studií se zdá pravděpodobné, že LOPID 300 mg je v příčinné souvislosti s výskytem MUSKULOSKELETÁLNÍCH PŘÍZNAKŮ (viz. VAROVÁNÍ ), a na ABNORMÁLNÍ JATERNÍ FUNKČNÍ TESTY a HEMATOLOGICKÉ ZMĚNY (viz. OPATŘENÍ ).
Hlášení o virových a bakteriálních infekcích (běžné nachlazení, kašel, infekce močových cest) byly častější u pacientů léčených gemfibrozilem v jiných kontrolovaných klinických studiích s 805 pacienty. Další nežádoucí účinky, které byly hlášeny pro gemfibrozil, jsou uvedeny níže podle systému. Ty jsou kategorizovány podle toho, zda je kauzální vztah k léčbě LOPID pravděpodobný nebo není prokázán:
Další nežádoucí účinky, které byly hlášeny, zahrnují cholecystitidu a cholelitiázu (vidět VAROVÁNÍ ).
DROGOVÉ INTERAKCE
Inhibitory HMG-CoA reduktázy
Současné podávání LOPID 300 mg se simvastatinem je kontraindikováno (viz KONTRAINDIKACE a VAROVÁNÍ ). Vyhněte se současnému užívání LOPID s rosuvastatinem. Pokud se současnému užívání nelze vyhnout, zahajte rosuvastatin v dávce 5 mg jednou denně. Dávka rosuvastatinu by neměla překročit 10 mg jednou denně. Riziko myopatie a rhabdomyolýzy se zvyšuje při kombinované léčbě gemfibrozilem a inhibitorem HMG-CoA reduktázy. Myopatie nebo rhabdomyolýza s akutním selháním ledvin nebo bez něj byly hlášeny již tři týdny po zahájení kombinované léčby nebo po několika měsících (viz VAROVÁNÍ ). Neexistuje žádná záruka, že pravidelné sledování kreatinkinázy zabrání výskytu závažné myopatie a poškození ledvin.
Antikoagulancia
PŘI PODÁVÁNÍ WARFARINU S LOPIDEM BY MĚLO BÝT OPATRNOST. DÁVKOVÁNÍ WARFARINU BY MĚLO BÝT SNÍŽENO PRO UDRŽENÍ PROTHROMBINOVÉHO ČASU NA POŽADOVANÉ ÚROVNI, ABY SE PŘEDEŠLO KRVÁCÍM KOMPLIKACÍM. ČASTÉ STANOVENÍ PROTHROMBINŮ SE DOPORUČUJE, DOKUD NEBUDE DEFINITIVNĚ ZJIŠTĚNO, ŽE SE HLADINA PROTHROMBINŮ STABILIZUJE.
Substráty CYP2C8
Gemfibrozil je silný inhibitor CYP2C8 a může zvýšit expozici lékům metabolizovaným hlavně CYP2C8 (např. dabrafenib, enzalutamid, loperamid, montelukast, paklitaxel, pioglitazon, rosiglitazon). Proto může být nutné snížení dávkování léků, které jsou metabolizovány převážně enzymem CYP2C8, pokud je současně používán gemfibrozil (viz VAROVÁNÍ ).
Repaglinid
zdravých dobrovolníků vedlo současné podávání s gemfibrozilem (600 mg dvakrát denně po dobu 3 dnů) k 8,1krát vyšší (rozmezí 5,5 až 15,0krát) vyšší AUC repaglinidu a 28,6krát (rozmezí 18,5 až 80,1krát) vyšší plazmatická koncentrace repaglinidu 7 hodin po podání dávky. Ve stejné studii vedly gemfibrozil (600 mg dvakrát denně po dobu 3 dnů) + itrakonazol (200 mg ráno a 100 mg večer v den 1, poté 100 mg dvakrát denně v den 2-3) k 19,4-( rozmezí 12,9 až 24,7krát vyšší AUC repaglinidu a 70,4krát vyšší (rozmezí 42,9 až 119,2krát) vyšší plazmatická koncentrace repaglinidu 7 hodin po podání dávky. Navíc samotný gemfibrozil nebo gemfibrozil + itrakonazol prodlužovaly hypoglykemické účinky repaglinidu. Současné podávání gemfibrozilu a repaglinidu zvyšuje riziko těžké hypoglykémie a je kontraindikováno (viz KONTRAINDIKACE ).
Dasabuvir
Současné podávání gemfibrozilu s dasabuvirem zvýšilo AUC a Cmax dasabuviru (poměry: 11,3 a 2,01) v důsledku inhibice CYP2C8. Zvýšená expozice dasabuviru může zvýšit riziko prodloužení QT intervalu, proto je současné podávání gemfibrozilu s dasabuvirem kontraindikováno (viz KONTRAINDIKACE ).
Selexipag
Současné podávání gemfibrozilu se selexipagem zdvojnásobilo expozici selexipagu a zvýšilo expozici aktivnímu metabolitu přibližně 11krát. Současné podávání gemfibrozilu a selexipagu je kontraindikováno (viz KONTRAINDIKACE ).
Enzalutamid
U zdravých dobrovolníků, kterým byla po podání gemfibrozilu 600 mg dvakrát denně podávána jednorázová dávka enzalutamidu 160 mg, se AUC enzalutamidu a aktivního metabolitu (N-desmethyl enzalutamidu) zvýšilo 2,2krát a odpovídající Cmax se snížila o 16 %. Zvýšená expozice enzalutamidu může zvýšit riziko záchvatů. Pokud je současné podávání považováno za nezbytné, dávka enzalutamidu by měla být snížena (viz VAROVÁNÍ ).
Substráty OATP1B1
Gemfibrozil je inhibitor transportéru OATP1B1 a může zvýšit expozici lékům, které jsou substráty OATP1B1 (např. atrasentan, atorvastatin, bosentan, ezetimib, fluvastatin, glyburid, SN-38 [aktivní metabolit irinotekanu], rosuvastatin, pitastatavainprava, rifastatin, valsartan, olmesartan). Proto může být nutné snížit dávkování léků, které jsou substráty OATP1B1, pokud je současně používán gemfibrozil (viz VAROVÁNÍ ). Kombinovaná léčba gemfibrozilem se simvastatinem nebo repaglinidem, což jsou substráty OATP1B1, je kontraindikována (viz KONTRAINDIKACE ).
In vitro studie enzymů CYP, enzymů UGTA a transportéru OATP1B1
Studie in vitro ukázaly, že gemfibrozil je inhibitorem CYP1A2, CYP2C8, CYP2C9, CYP2C19, OATP1B1 a UDP-glukuronosyltransferázy (UGT) 1A1 a 1A3 (viz VAROVÁNÍ ).
Pryskyřice vázající žlučové kyseliny
AUC gemfibrozilu byla snížena o 30 %, když byl gemfibrozil podáván (600 mg) současně s léčivy ve formě granulí pryskyřice, jako je colestipol (5 g). Doporučuje se podávání léků s odstupem dvou nebo více hodin, protože expozice gemfibrozilu nebyla významně ovlivněna, když byl podáván s dvouhodinovým odstupem od kolestipolu.
kolchicin
Při chronickém podávání kolchicinu v terapeutických dávkách byla hlášena myopatie, včetně rhabdomyolýzy. Současné užívání LOPIDu může potencovat rozvoj myopatie. Zvýšené riziko mají pacienti s renální dysfunkcí a starší pacienti. Při předepisování LOPID s kolchicinem je třeba postupovat opatrně, zejména u starších pacientů nebo pacientů s renální dysfunkcí.
VAROVÁNÍ
Vzhledem k omezenější velikosti Helsinki Heart Study se pozorovaný rozdíl v úmrtnosti z jakékoli příčiny mezi skupinami s LOPID 300 mg a placebem statisticky významně neliší od 29% nadměrné úmrtnosti hlášené ve skupině s klofibráty v samostatné studii WHO devítileté sledování (viz KLINICKÁ FARMAKOLOGIE ). Mortalita související s nekoronárními srdečními chorobami vykazovala přebytek ve skupině původně randomizované k LOPID primárně kvůli úmrtím na rakovinu pozorovaným během otevřeného prodloužení.
Během pětileté primární prevence v Helsinki Heart Study byla mortalita z jakékoli příčiny 44 (2,2 %) ve skupině LOPID 300 mg a 43 (2,1 %) ve skupině s placebem; včetně období sledování 3,5 roku od ukončení studie byla kumulativní mortalita z jakékoli příčiny 101 (4,9 %) ve skupině LOPID a 83 (4,1 %) ve skupině původně randomizované na placebo (poměr rizik 1:20 ve prospěch placeba). Vzhledem k omezenější velikosti Helsinki Heart Study se pozorovaný rozdíl v úmrtnosti z jakékoli příčiny mezi skupinami s LOPID 300 mg a placebem v roce 5 nebo v roce 8,5 statisticky významně neliší od 29% nadměrné úmrtnosti hlášené v klofibrátové skupině v samostatné studii WHO po devítiletém sledování. Mortalita související s nekoronárními srdečními chorobami vykazovala přebytek ve skupině původně randomizované k LOPID 300 mg po 8,5letém sledování (65 LOPID 300 mg versus 45 nekoronárních úmrtí s placebem).
Incidence rakoviny (kromě bazaliomu) objevené během studie a během 3,5 roku po dokončení studie byla 51 (2,5 %) v obou původně randomizovaných skupinách. Kromě toho bylo ve skupině původně randomizované na LOPID 300 mg 16 bazaliomů a 9 ve skupině původně randomizované na placebo (p=0,22). Ve skupině původně randomizované na LOPID 300 mg bylo 30 (1,5 %) úmrtí připisovaných rakovině a 18 (0,9 %) ve skupině původně randomizované na placebo (p=0,11). Nežádoucí výsledky, včetně koronárních příhod, byly vyšší u pacientů s gemfibrozilem v odpovídající studii u mužů s anamnézou známého nebo suspektního ischemického onemocnění srdce ve složce sekundární prevence Helsinské srdeční studie (viz KLINICKÁ FARMAKOLOGIE ).
Byla také provedena srovnávací studie karcinogenity u potkanů, která porovnávala tři léky v této třídě: fenofibrát (10 a 60 mg/kg; 0,3 a 1,6násobek dávky pro člověka), klofibrát (400 mg/kg; 1,6násobek dávky pro člověka), a gemfibrozil (250 mg/kg; 1,7násobek lidské dávky). Pankreatické acinární adenomy byly zvýšeny u mužů a žen na fenofibrátu; hepatocelulární karcinom a pankreatické acinární adenomy byly zvýšeny u mužů a jaterní neoplastické uzliny u žen léčených klofibrátem; jaterní neoplastické uzliny byly zvýšeny u mužů a žen léčených klofibrátem; jaterní neoplastické uzliny byly zvýšeny u mužů a žen léčených gemfibrozilem, zatímco nádory testikulárních intersticiálních buněk (Leydigovy buňky) byly zvýšeny u mužů na všech třech lécích.

OPATŘENÍ
Počáteční terapie
Měly by být provedeny laboratorní studie, aby se zjistilo, že hladiny lipidů jsou trvale abnormální. Před zahájením léčby LOPID je třeba se pokusit o kontrolu sérových lipidů vhodnou dietou, cvičením, snížením hmotnosti u obézních pacientů a kontrolou jakýchkoli zdravotních problémů, jako je diabetes mellitus a hypotyreóza, které přispívají k abnormalitám lipidů.
Pokračující terapie
Je třeba provádět pravidelné stanovení sérových lipidů a lék vysadit, pokud je lipidová odpověď po třech měsících léčby nedostatečná.
Karcinogeneze, mutageneze, zhoršení plodnosti
Dlouhodobé studie byly provedeny na potkanech při 0,2 a 1,3násobku expozice u člověka (na základě AUC). Výskyt benigních jaterních uzlů a jaterních karcinomů byl významně zvýšen u samců potkanů s vysokou dávkou. Výskyt jaterních karcinomů se zvýšil také u mužů s nízkou dávkou, ale tento nárůst nebyl statisticky významný (p=0,1). Samci potkanů měli na dávce závislé a statisticky významné zvýšení benigních nádorů z Leydigových buněk. Samice potkanů s vyšší dávkou měly signifikantní zvýšení kombinovaného výskytu benigních a maligních jaterních novotvarů.
Dlouhodobé studie byly provedeny na myších při 0,1 a 0,7násobku expozice u člověka (na základě AUC). Nebyly zjištěny žádné statisticky významné rozdíly ve výskytu jaterních nádorů od kontrol, ale testované dávky byly nižší než ty, které se ukázaly jako karcinogenní u jiných fibrátů.
Studie elektronové mikroskopie prokázaly floridní proliferaci jaterních peroxisomů po podání LOPID samcům krys. Adekvátní studie pro testování proliferace peroxisomů u lidí nebyla provedena, ale byly pozorovány změny v morfologii peroxisomů. Bylo prokázáno, že k proliferaci peroxisomů dochází u lidí s kterýmkoli ze dvou dalších léků ze třídy fibrátů, když byly biopsie jater porovnány před a po léčbě u stejného jedince.
Podání přibližně 2násobku dávky pro člověka (na základě plochy povrchu) samcům potkanů po dobu 10 týdnů vedlo ke snížení fertility závislému na dávce. Následné studie ukázaly, že tento účinek byl zvrácen po období bez léku v délce přibližně osmi týdnů a nebyl přenesen na potomky.
Těhotenství
Bylo prokázáno, že LOPID 300 mg vyvolává nežádoucí účinky u potkanů a králíků v dávkách 0,5 až 3krát vyšších, než je dávka pro člověka (na základě plochy povrchu). Neexistují žádné adekvátní a dobře kontrolované studie u těhotných žen. LOPID 300 mg by měl být užíván během těhotenství pouze tehdy, pokud potenciální přínos ospravedlňuje potenciální riziko pro plod.
Podávání LOPID 300 mg samicím potkanů ve dvojnásobku lidské dávky (na základě plochy povrchu) před a během březosti způsobilo na dávce závislé snížení míry zabřeznutí, zvýšení počtu mrtvě narozených a mírné snížení hmotnosti mláďat během laktace. Byly zde také na dávce závislé zvýšené kosterní variace. Anoftalmie se vyskytla, ale zřídka.
Podání 0,6 a 2násobku dávky LOPID pro člověka (na základě plochy povrchu) potkaním samicím od 15. dne březosti až do odstavení způsobilo na dávce závislé snížení porodní hmotnosti a potlačení růstu mláďat během laktace.
Podání 1- a 3násobku dávky LOPID 300 mg pro člověka (na základě plochy povrchu) králičím samicím během organogeneze způsobilo na dávce závislé snížení velikosti vrhu a při vysoké dávce zvýšený výskyt variací parietální kosti.
Kojící matky
Není známo, zda se tento lék vylučuje do lidského mléka. Vzhledem k tomu, že mnoho léků se vylučuje do lidského mléka a vzhledem k potenciálu tumorigenicity prokázaného u LOPID ve studiích na zvířatech, je třeba rozhodnout, zda přerušit kojení nebo přerušit podávání léku, s ohledem na důležitost léku pro matku.
Hematologické změny
Po zahájení léčby LOPIDem bylo u pacientů příležitostně pozorováno mírné snížení hemoglobinu, hematokritu a bílých krvinek. Při dlouhodobém podávání se však tyto hladiny stabilizují. Vzácně byla hlášena těžká anémie, leukopenie, trombocytopenie a hypoplazie kostní dřeně.
Proto se během prvních 12 měsíců podávání LOPID 300 mg doporučují pravidelné kontroly krevního obrazu.
Funkce jater
Během podávání LOPID byly příležitostně pozorovány abnormální jaterní testy, včetně zvýšení AST, ALT, LDH, bilirubinu a alkalické fosfatázy. Ty jsou obvykle reverzibilní, když je LOPID 300 mg vysazen. Proto se doporučují pravidelné studie jaterních funkcí a léčba LOPID 300 mg by měla být ukončena, pokud abnormality přetrvávají.
Funkce ledvin
Byly hlášeny případy zhoršení renální insuficience po přidání léčby LOPID u jedinců s výchozí hodnotou plazmatického kreatininu > 2,0 mg/dl. U takových pacientů je třeba zvážit použití alternativní léčby proti rizikům a přínosům nižší dávky LOPID.
Pediatrické použití
Bezpečnost a účinnost u pediatrických pacientů nebyla stanovena.
PŘEDÁVKOVAT
Byly hlášeny případy předávkování LOPIDem. V jednom případě se 7leté dítě zotavilo po požití až 9 gramů LOPID. Příznaky hlášené při předávkování byly křeče v břiše, abnormální jaterní testy, průjem, zvýšená CPK, bolesti kloubů a svalů, nauzea a zvracení. V případě předávkování by měla být přijata symptomatická podpůrná opatření.
KONTRAINDIKACE
KLINICKÁ FARMAKOLOGIE
LOPID je činidlo regulující lipidy, které snižuje sérové triglyceridy a cholesterol lipoproteinů s velmi nízkou hustotou (VLDL) a zvyšuje cholesterol lipoproteinů s vysokou hustotou (HDL). Zatímco při léčbě LOPID 300 mg lze pozorovat mírné snížení celkového cholesterolu a cholesterolu v lipoproteinech s nízkou hustotou (LDL), léčba pacientů se zvýšenými triglyceridy v důsledku hyperlipoproteinémie typu IV často vede ke zvýšení LDL-cholesterolu. Hladiny LDL-cholesterolu u pacientů typu IIb se zvýšením sérového LDL-cholesterolu a triglyceridů jsou obecně ovlivněny léčbou LOPID 300 mg minimálně; LOPID 300 mg však v této skupině obvykle významně zvyšuje HDL-cholesterol. LOPID 300 mg zvyšuje hladiny subfrakcí HDL2 a HDL3 lipoproteinů o vysoké hustotě (HDL) a také apolipoproteinů AI a AII. Epidemiologické studie ukázaly, že jak nízký HDL-cholesterol, tak vysoký LDL-cholesterol jsou nezávislými rizikovými faktory koronárního srdečního onemocnění.
primární preventivní složce Helsinki Heart Study, ve které bylo randomizovaným, dvojitě zaslepeným, placebem kontrolovaným způsobem studováno 4081 pacientů mužského pohlaví ve věku 40 až 55 let, byla léčba LOPID 300 mg spojena s významným snížením celkových plazmatických triglyceridů. a významné zvýšení lipoproteinového cholesterolu s vysokou hustotou. U skupiny léčené LOPID jako celku bylo pozorováno mírné snížení celkového cholesterolu v plazmě a cholesterolu v lipoproteinech s nízkou hustotou, ale lipidová odpověď byla heterogenní, zejména u různých Fredricksonových typů. Studie zahrnovala subjekty se sérovým non-HDL-cholesterolem vyšším než 200 mg/dl a bez předchozí anamnézy ischemické choroby srdeční. Během pětiletého období studie zaznamenala skupina LOPID 300 mg 1,4% absolutní (34% relativní) snížení četnosti závažných koronárních příhod (náhlá srdeční úmrtí plus fatální a nefatální infarkty myokardu) ve srovnání s placebem, p=0,04 (viz Tabulka I). Ve srovnání s placebem došlo k relativnímu snížení četnosti nefatálních infarktů myokardu o 37 %, což odpovídá rozdílu souvisejícímu s léčbou 13,1 příhody na tisíc osob. Úmrtí z jakékoli příčiny během dvojitě zaslepené části studie činily celkem 44 (2,2 %) ve skupině randomizované LOPID 300 mg a 43 (2,1 %) ve skupině s placebem.
Mezi Fredricksonovými typy došlo během 5leté dvojitě zaslepené části primární prevence v Helsinki Heart Study k největšímu snížení výskytu závažných koronárních příhod u pacientů typu IIb, kteří měli zvýšení LDL-cholesterolu i celkové plazmy. triglyceridy. Tato podskupina pacientů ve skupině pacientů s gemfibrozilem typu IIb měla na začátku nižší průměrnou hladinu HDL-cholesterolu než podskupina typu IIa, která měla zvýšení LDL-cholesterolu a normální plazmatické triglyceridy. Průměrné zvýšení HDL-cholesterolu u pacientů typu IIb v této studii bylo 12,6 % ve srovnání s placebem. Průměrná změna LDL-cholesterolu u pacientů typu IIb byla –4,1 % u LOPID ve srovnání se zvýšením o 3,9 % v podskupině s placebem. Subjekty typu IIb v Helsinki Heart Study měli o 26 méně koronárních příhod na tisíc osob během pěti let ve skupině s gemfibrozilem ve srovnání s placebem. Rozdíl v koronárních příhodách byl podstatně větší mezi LOPID 300 mg a placebem u této podskupiny pacientů s triádou LDL-cholesterol >175 mg/dl (>4,5 mmol), triglyceridy >200 mg/dl (>2,2 mmol) a HDL -cholesterol
Další informace jsou dostupné z 3,5letého (8,5letého kumulativního) sledování všech subjektů, které se zúčastnily Helsinské srdeční studie. Po dokončení Helsinki Heart Study si subjekty mohly vybrat, zda začnou, přestanou nebo budou pokračovat v podávání LOPID; bez znalosti vlastních hodnot lipidů nebo dvojitě zaslepené léčby, 60 % pacientů původně randomizovaných k placebu zahájilo terapii LOPID 300 mg a 60 % pacientů původně randomizovaných k LOPIDu pokračovalo v léčbě. Po přibližně 6,5 letech po randomizaci byli všichni pacienti informováni o své původní léčebné skupině a hodnotách lipidů během pěti let dvojitě zaslepené léčby. Po dalších elektivních změnách stavu léčby LOPID užívalo drogu 61 % pacientů ve skupině původně randomizované k léčbě LOPID; ve skupině původně randomizované k placebu 65 % užívalo LOPID. Četnost příhod na 1 000, ke kterým došlo během období otevřeného sledování, je podrobně uvedena v tabulce II.
Kumulativní mortalita po 8,5 letech ukázala 20% relativní přebytek úmrtí ve skupině původně randomizované k LOPID 300 mg oproti původně randomizované skupině s placebem a 20% relativnímu poklesu srdečních příhod ve skupině původně randomizované k LOPID 300 mg oproti původně randomizované skupině s placebem (viz tabulka III). Tato analýza původně randomizované populace „intent-to-treat“ zanedbává možné komplikující účinky změny léčby během otevřené fáze. Úprava poměrů rizik s přihlédnutím k otevřenému stavu léčby z let 6,5 na 8,5 by mohla změnit uváděné poměry rizik pro úmrtnost směrem k jednotě.
Není jasné, do jaké míry lze výsledky primární prevence helsinské srdeční studie extrapolovat na další segmenty dyslipidemické populace, která nebyla studována (jako jsou ženy, mladší nebo starší muži nebo osoby s lipidovými abnormalitami omezenými pouze na HDL -cholesterol) nebo na jiné léky upravující lipidy.
Složka sekundární prevence Helsinské srdeční studie byla prováděna po dobu pěti let paralelně a ve stejných centrech ve Finsku u 628 mužů středního věku vyloučených ze složky primární prevence Helsinské srdeční studie kvůli anamnéze anginy pectoris, infarktu myokardu, nebo nevysvětlitelné změny EKG. Primárním cílovým ukazatelem účinnosti studie byly srdeční příhody (součet fatálních a nefatálních infarktů myokardu a náhlých srdečních úmrtí). Poměr rizik (LOPID:placebo) pro srdeční příhody byl 1,47 (95% hranice spolehlivosti 0,88–2,48, p=0,14). Z 35 pacientů ve skupině LOPID 300 mg, kteří prodělali srdeční příhody, mělo 12 pacientů příhody po přerušení studie. Z 24 pacientů ve skupině s placebem se srdečními příhodami 4 pacienti trpěli příhodami po přerušení studie. Ve skupině LOPID došlo k 17 srdečním úmrtím a ve skupině s placebem k 8 (poměr rizika 2,18; 95% hranice spolehlivosti 0,94–5,05, p=0,06). K deseti z těchto úmrtí ve skupině LOPID a 3 ve skupině s placebem došlo po přerušení léčby. V této studii u pacientů se známou nebo suspektní ischemickou chorobou srdeční nebyl pozorován žádný přínos léčby LOPID 300 mg ve snížení počtu srdečních příhod nebo srdečních úmrtí. LOPID 300 mg tedy prokázal přínos pouze u vybraných pacientů s dyslipidemií bez suspektní nebo prokázané ischemické choroby srdeční. Dokonce ani u pacientů s ischemickou chorobou srdeční a triádou zvýšený LDL-cholesterol, zvýšené triglyceridy plus nízký HDL-cholesterol nebyl možný účinek LOPID na koronární příhody dostatečně studován.
Během projektu Coronary Drug Project s chemicky a farmakologicky příbuzným lékem, klofibrátem, nebyla pozorována žádná účinnost u pacientů s prokázanou ischemickou chorobou srdeční. The Coronary Drug Project byla 6letá randomizovaná, dvojitě zaslepená studie zahrnující 1000 pacientů s klofibrátem, 1000 kyselinou nikotinovou a 3000 pacientů s placebem se známou ischemickou chorobou srdeční. Klinicky a statisticky signifikantní snížení infarktů myokardu bylo pozorováno ve skupině současně užívající kyselinu nikotinovou ve srovnání s placebem; u klofibrátu nebylo pozorováno žádné snížení.
Mechanismus účinku gemfibrozilu nebyl definitivně stanoven. U lidí bylo prokázáno, že LOPID 300 mg inhibuje periferní lipolýzu a snižuje extrakci volných mastných kyselin v játrech, čímž snižuje produkci triglyceridů v játrech. LOPID 300 mg inhibuje syntézu a zvyšuje clearance nosiče VLDL apolipoproteinu B, což vede ke snížení produkce VLDL.
Studie na zvířatech naznačují, že gemfibrozil může kromě zvýšení HDL-cholesterolu snižovat začleňování mastných kyselin s dlouhým řetězcem do nově vytvořených triglyceridů, urychlovat obrat a odstraňování cholesterolu z jater a zvyšovat vylučování cholesterolu stolicí. LOPID 300 mg se po perorálním podání dobře vstřebává z gastrointestinálního traktu. Maximální plazmatické hladiny se po opakovaných dávkách objevují za 1 až 2 hodiny s plazmatickým poločasem 1,5 hodiny.
Gemfibrozil je po perorálním podání tablet LOPID 300 mg zcela absorbován a dosahuje maximální plazmatické koncentrace za 1 až 2 hodiny po podání. Farmakokinetika gemfibrozilu je ovlivněna načasováním jídla ve vztahu k době dávkování. V jedné studii (odkaz 4) byly jak rychlost, tak rozsah absorpce léku významně zvýšeny při podání 0,5 hodiny před jídlem. Průměrná AUC se snížila o 14–44 %, když byl LOPID podáván po jídle ve srovnání s 0,5 hodinou před jídlem. V následné studii byla rychlost absorpce LOPID 300 mg maximální při podání 0,5 hodiny před jídlem s Cmax o 50–60 % vyšší než při podání buď s jídlem nebo nalačno. V této studii nebyly zjištěny žádné významné účinky na AUC načasování dávky ve vztahu k jídlu (viz DÁVKOVÁNÍ A PODÁVÁNÍ ).
LOPID podléhá hlavně oxidaci kruhové methylové skupiny za vzniku postupně hydroxymethylového a karboxylového metabolitu. Přibližně sedmdesát procent podané lidské dávky se vyloučí močí, většinou jako glukuronidový konjugát, méně než 2 % se vyloučí jako nezměněný gemfibrozil. Šest procent dávky připadá na stolici. Gemfibrozil se silně váže na plazmatické proteiny a existuje možnost vytěsňovacích interakcí s jinými léky (viz OPATŘENÍ ).
INFORMACE PRO PACIENTA
Nebyly poskytnuty žádné informace. Podívejte se prosím na VAROVÁNÍ a OPATŘENÍ sekce.
