Zocor 5mg, 10mg, 20mg, 40mg Simvastatin Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Zocor a jak se používá?
Zocor (simvastatin) je lék na předpis používaný ke snížení hladiny „špatného“ cholesterolu (lipoprotein s nízkou hustotou nebo LDL) a ke zvýšení hladiny „dobrého“ cholesterolu (lipoprotein s vysokou hustotou nebo HDL) a ke snížení hladiny triglycerinu a snížit riziko mrtvice a srdečního infarktu. Zocor lze užívat samostatně nebo s jinými léky.
Zocor patří do třídy léků nazývaných látky snižující hladinu lipidů, statiny, inhibitory HMG-CoA reduktázy.
Není známo, zda je přípravek Zocor bezpečný a účinný u dětí mladších 10 let.
Jaké jsou možné vedlejší účinky přípravku Zocor?
Zocor 20 mg může způsobit závažné nežádoucí účinky, včetně:
- ztráta chuti k jídlu,
- bolest břicha v pravé horní části,
- únava,
- svědění,
- tmavá moč,
- stolice hliněné barvy, a
- zežloutnutí kůže nebo očí
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Zocor patří:
- bolest hlavy,
- nevolnost,
- bolest břicha,
- zácpa a
- příznaky nachlazení (ucpaný nos, kýchání nebo bolest v krku)
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Zocor. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
ZOCOR (simvastatin) je látka snižující hladinu lipidů, která se synteticky získává z fermentačního produktu Aspergillus terreus. Po perorálním požití se simvastatin, což je neaktivní lakton, hydrolyzuje na odpovídající formu β-hydroxykyseliny. Jedná se o inhibitor 3-hydroxy-3-methylglutaryl-koenzym A (HMG-CoA) reduktázy. Tento enzym katalyzuje přeměnu HMG-CoA na mevalonát, což je časný a rychlost omezující krok v biosyntéze cholesterolu.
Simvastatin je kyselina máselná, 2,2-dimethyl-,1,2,3,7,8,8a-hexahydro-3,7-dimethyl-8-[2-(tetrahydro-4hydroxy-6-oxo-2H-pyran- 2-yl)-ethyl]-1-naftalenylester, [lS-[la,3a,7p,8p(2S*,4S*),-8ap]]. Empirický vzorec simvastatinu je C25H38O5 a jeho molekulová hmotnost je 418,57. Jeho strukturní vzorec je:
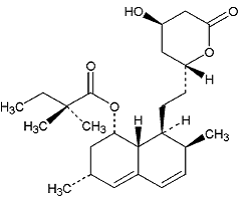
Simvastatin je bílý až téměř bílý, nehygroskopický krystalický prášek, který je prakticky nerozpustný ve vodě a snadno rozpustný v chloroformu, methanolu a ethanolu.
Tablety ZOCOR pro perorální podání obsahují buď 5 mg, 10 mg, 20 mg, 40 mg nebo 80 mg simvastatinu a následující neúčinné složky: kyselina askorbová, kyselina citrónová, hydroxypropylcelulóza, hypromelóza, oxidy železa, laktóza, stearát hořečnatý, mikrokrystalická celulóza škrob, mastek a oxid titaničitý. Butylovaný hydroxyanisol se přidává jako konzervační prostředek.
INDIKACE
Léčba látkami ovlivňujícími lipidy by měla být pouze jednou složkou intervence s více rizikovými faktory u jedinců s významně zvýšeným rizikem aterosklerotického vaskulárního onemocnění v důsledku hypercholesterolémie. Medikamentózní terapie je indikována jako doplněk diety, pokud odpověď na dietu s omezením nasycených tuků a cholesterolu a dalších nefarmakologických opatření samotná byla nedostatečná. U pacientů s ischemickou chorobou srdeční (ICHS) nebo s vysokým rizikem ICHS lze ZOCOR® zahájit současně s dietou.
Snížení rizika úmrtnosti na ICHS a kardiovaskulárních příhod
pacientů s vysokým rizikem koronárních příhod z důvodu existujícího koronárního onemocnění srdce, diabetu, onemocnění periferních cév, anamnézy cévní mozkové příhody nebo jiného cerebrovaskulárního onemocnění je ZOCOR 5 mg indikován k:
- Snížit riziko celkové mortality snížením úmrtí na ICHS.
- Snížit riziko nefatálního infarktu myokardu a mrtvice.
- Snížit potřebu koronárních a nekoronárních revaskularizačních procedur.
Hyperlipidémie
ZOCOR je určen pro:
- Snížit zvýšený celkový cholesterol (total-C), cholesterol lipoproteinů s nízkou hustotou (LDL-C), apolipoprotein B (Apo B) a triglyceridy (TG) a zvýšit cholesterol lipoproteinů s vysokou hustotou (HDL-C) u pacientů s primární hyperlipidémie (Fredrickson typ IIa, heterozygotní familiární a nefamiliární) nebo smíšená dyslipidémie (Fredrickson typ IIb).
- Snižte zvýšenou hladinu TG u pacientů s hypertriglyceridémií (hyperlipidémie Fredricksonova typu IV).
- Snižte zvýšené hladiny TG a VLDL-C u pacientů s primární dysbetalipoproteinémií (hyperlipidémie Fredricksonova typu III).
- Snižte celkový-C a LDL-C u pacientů s homozygotní familiární hypercholesterolemií (HoFH) jako doplněk k jiné léčbě snižující hladinu lipidů (např. LDL aferéza) nebo pokud taková léčba není dostupná.
Dospívající pacienti s heterozygotní familiární hypercholesterolemií (HeFH)
ZOCOR je indikován jako doplněk diety ke snížení hladin celkového C, LDL-C a Apo B u dospívajících chlapců a dívek, kteří jsou alespoň jeden rok po menarché, ve věku 10-17 let, s HeFH, pokud po adekvátní studie dietní terapie jsou přítomna následující zjištění:
- Existuje pozitivní rodinná anamnéza předčasného kardiovaskulárního onemocnění (KVO) resp
- U dospívajícího pacienta jsou přítomny dva nebo více dalších rizikových faktorů KVO.
Minimálním cílem léčby u dětských a dospívajících pacientů je dosažení průměrné hodnoty LDL-C
Omezení použití
ZOCOR 20 mg nebyl studován u stavů, kdy hlavní abnormalitou je zvýšení chylomikronů (tj. hyperlipidémie Fredricksonova typu I a V).
DÁVKOVÁNÍ A PODÁVÁNÍ
Doporučené dávkování
Obvyklé rozmezí dávkování je 5 až 40 mg/den. U pacientů s ICHS nebo s vysokým rizikem ICHS lze ZOCOR zahájit současně s dietou. Doporučená obvyklá počáteční dávka je 10 nebo 20 mg jednou denně večer. U pacientů s vysokým rizikem ICHS v důsledku stávající ICHS, diabetu, onemocnění periferních cév, anamnézy cévní mozkové příhody nebo jiného cerebrovaskulárního onemocnění je doporučená počáteční dávka 40 mg/den. Stanovení lipidů by se mělo provádět po 4 týdnech léčby a poté pravidelně.
Omezené dávkování pro 80 mg
Vzhledem ke zvýšenému riziku myopatie, včetně rhabdomyolýzy, zejména během prvního roku léčby, by mělo být použití 80mg dávky přípravku ZOCOR omezeno na pacienty, kteří užívali simvastatin 80 mg chronicky (např. po dobu 12 měsíců nebo déle). bez důkazu svalové toxicity [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Pacienti, kteří v současné době tolerují dávku 80 mg přípravku ZOCOR, u nichž je třeba zahájit léčbu interagujícím lékem, který je kontraindikován nebo je spojen s horní hranicí dávky pro simvastatin, by měli být převedeni na alternativní statin s menším potenciálem interakce lék-lék.
Vzhledem ke zvýšenému riziku myopatie, včetně rhabdomyolýzy, spojené s dávkou 80 mg přípravku ZOCOR 40 mg, pacienti, kteří nejsou schopni dosáhnout svého cíle LDL-C použitím 40 mg dávky přípravku ZOCOR 5 mg, by neměli být titrováni na dávku 80 mg , ale měla by být nasazena na alternativní léčbu (léčby) ke snížení LDL-C, která poskytuje větší snížení LDL-C.
Současné podávání s jinými léky
Pacienti užívající verapamil, diltiazem nebo dronedaron
- Dávka přípravku ZOCOR by neměla překročit 10 mg / den (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE , a KLINICKÁ FARMAKOLOGIE ].
Pacienti užívající amiodaron, amlodipin nebo ranolazin
- Dávka přípravku ZOCOR 10 mg by neměla překročit 20 mg/den [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE , a KLINICKÁ FARMAKOLOGIE ].
Pacienti s homozygotní familiární hypercholesterolemií
Doporučená dávka je 40 mg/den večer [viz DÁVKOVÁNÍ A PODÁVÁNÍ , Omezené dávkování pro 80 mg ]. ZOCOR 5 mg by se měl používat jako doplněk k jiné hypolipidemické léčbě (např. LDL aferéza) u těchto pacientů nebo pokud taková léčba není dostupná.
Expozice simvastatinu se při současném užívání lomitapidu přibližně zdvojnásobí; proto by při zahájení léčby lomitapidem měla být dávka přípravku ZOCOR snížena o 50 %. Dávkování přípravku ZOCOR 5 mg by při užívání lomitapidu nemělo překročit 20 mg/den (nebo 40 mg/den u pacientů, kteří dříve užívali přípravek ZOCOR 80 mg/den chronicky, např. po dobu 12 měsíců nebo déle, bez známek svalové toxicity).
Dospívající (10–17 let) s heterozygotní familiární hypercholesterolemií
Doporučená obvyklá počáteční dávka je 10 mg jednou denně večer. Doporučené rozmezí dávkování je 10 až 40 mg/den; maximální doporučená dávka je 40 mg/den. Dávky by měly být individualizovány podle doporučeného cíle terapie [viz Směrnice pediatrického panelu NCEP1 a Klinické studie ]. Úpravy by měly být prováděny v intervalech 4 týdnů nebo déle.
Pacienti s poruchou ledvin
Vzhledem k tomu, že ZOCOR 5 mg nepodléhá významné renální exkreci, u pacientů s mírnou až středně těžkou poruchou funkce ledvin by úprava dávkování neměla být nutná. Při podávání přípravku ZOCOR 20 mg pacientům s těžkou poruchou funkce ledvin je však nutná opatrnost; tito pacienti by měli začít dávkou 5 mg/den a být pečlivě sledováni [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
JAK DODÁVÁNO
Dávkové formy A Síly
- Tablety ZOCOR 5 mg jsou žlutohnědé, oválné, potahované tablety, s kódem MSD 726 na jedné straně a ZOCOR 5 na druhé straně.
- Tablety ZOCOR 10 mg jsou broskvové, oválné, potahované tablety, s kódem MSD 735 na jedné straně a hladké na druhé straně.
- Tablety ZOCOR 20 mg jsou hnědé, oválné, potahované tablety s kódem MSD 740 na jedné straně a hladké na druhé straně.
- Tablety ZOCOR 40 mg jsou cihlově červené, oválné, potahované tablety s kódem MSD 749 na jedné straně a hladké na druhé straně.
- Tablety ZOCOR 80 mg jsou cihlově červené potahované tablety ve tvaru tobolky s kódem 543 na jedné straně a 80 na druhé straně.
Skladování A Manipulace
č. 8146 - Tablety ZOCOR 10 mg jsou broskvové, oválné, potahované tablety s kódem MSD 735 na jedné straně a hladké na druhé straně. Dodávají se následovně:
NDC 0006-0735-31 jednotka použití láhve po 30 NDC 0006-0735-54 jednotka použití láhve po 90.
č. 8147 - Tablety ZOCOR 20 mg jsou hnědé, oválné, potahované tablety s kódem MSD 740 na jedné straně a hladké na druhé straně. Dodávají se následovně:
NDC 0006-0740-31 jednotka použití láhve po 30 NDC 0006-0740-54 jednotka použití láhve po 90.
č. 8148 - Tablety ZOCOR 40 mg jsou cihlově červené, oválné, potahované tablety s kódem MSD 749 na jedné straně a hladké na druhé straně. Dodávají se následovně:
NDC 0006-0749-31 jednotka použití láhve po 30 NDC 0006-0749-54 jednotka použití láhve po 90.
č. 6577 - Tablety ZOCOR 80 mg jsou cihlově červené potahované tablety ve tvaru tobolky s kódem 543 na jedné straně a 80 na druhé straně. Dodávají se následovně:
NDC 0006-0543-31 jednotka použití láhve po 30 NDC 0006-0543-54 jednotka použití láhve po 90.
Úložný prostor
Skladujte při teplotě 5-30°C (41-86°F).
1Národní vzdělávací program o cholesterolu (NCEP): Nejdůležitější zprávy ze zprávy panelu odborníků o hladinách cholesterolu v krvi u dětí a dospívajících. Pediatrie. 89(3):495-501. 1992.
Výrobce: Merck Sharp & Dohme Ltd. Cramlington, Northumberland, UK NE23 3JU. Upraveno: září 2020
VEDLEJŠÍ EFEKTY
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
kontrolovaných klinických studiích před uvedením na trh a jejich otevřených prodlouženích (2 423 pacientů se střední dobou sledování přibližně 18 měsíců) bylo kvůli nežádoucím účinkům vysazeno 1,4 % pacientů. Nejčastější nežádoucí účinky, které vedly k přerušení léčby, byly: gastrointestinální poruchy (0,5 %), myalgie (0,1 %) a artralgie (0,1 %). Nejčastěji hlášené nežádoucí účinky (incidence ≥ 5 %) v kontrolovaných klinických studiích se simvastatinem byly: infekce horních cest dýchacích (9,0 %), bolest hlavy (7,4 %), bolest břicha (7,3 %), zácpa (6,6 %) a nauzea (5,4 %).
Scandinavian Simvastatin Survival Study
V 4S zahrnující 4 444 (věkové rozmezí 35–71 let, 19 % žen, 100 % bělochů) léčených 20–40 mg/den ZOCORem (n=2 221) nebo placebem (n=2 223) během mediánu 5,4 let, nežádoucí reakce hlášené u ≥ 2 % pacientů a s četností vyšší než u placeba jsou uvedeny v tabulce 2.
Studie ochrany srdce
Ve studii Heart Protection Study (HPS) zahrnující 20 536 pacientů (věkové rozmezí 40–80 let, 25 % žen, 97 % bělochů, 3 % jiné rasy) léčených přípravkem ZOCOR 40 mg/den (n=10 269) nebo placebem (n= 10 267) v průměru za 5 let byly zaznamenány pouze závažné nežádoucí účinky a přerušení léčby z důvodu jakýchkoli nežádoucích účinků. Míra přerušení léčby z důvodu nežádoucích účinků byla 4,8 % u pacientů léčených přípravkem ZOCOR 10 mg ve srovnání s 5,1 % u pacientů léčených placebem. Incidence myopatie/rhabdomyolýzy byla u pacientů léčených přípravkem ZOCOR
Jiné klinické studie
klinické studii, ve které bylo 12 064 pacientů s anamnézou infarktu myokardu léčeno přípravkem ZOCOR (průměrná doba sledování 6,7 let), byl výskyt myopatie (definované jako nevysvětlitelná svalová slabost nebo bolest při sérové kreatinkináze [CK] >10krát vyšší horní hranice normálu [ULN]) u pacientů užívajících 80 mg/den byla přibližně 0,9 % ve srovnání s 0,02 % u pacientů užívajících 20 mg/den. Incidence rhabdomyolýzy (definovaná jako myopatie s CK >40krát ULN) u pacientů užívajících 80 mg/den byla přibližně 0,4 % ve srovnání s 0 % u pacientů užívajících 20 mg/den. Incidence myopatie, včetně rhabdomyolýzy, byla nejvyšší během prvního roku a poté se výrazně snížila během následujících let léčby. V této studii byli pacienti pečlivě sledováni a některé interagující léčivé přípravky byly vyloučeny.
Další nežádoucí účinky hlášené v klinických studiích byly: průjem, vyrážka, dyspepsie, plynatost a astenie.
Laboratorní testy
Bylo zaznamenáno výrazné trvalé zvýšení jaterních transamináz [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Bylo také hlášeno zvýšení alkalické fosfatázy a y-glutamyltranspeptidázy. Asi u 5 % pacientů došlo při jedné nebo více příležitostech ke zvýšení hladin CK na trojnásobek nebo vícenásobek normální hodnoty. To bylo způsobeno nekardiální frakcí CK. [vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Dospívající pacienti (věk 10–17 let)
Ve 48týdenní kontrolované studii u dospívajících chlapců a dívek, kteří byli alespoň 1 rok po menarché, ve věku 10–17 let (43,4 % ženy, 97,7 % bělochy, 1,7 % hispánci, 0,6 % multirasové) s heterozygotní familiární hypercholesterolemií (n=175), léčených placebem nebo ZOCORem (10-40 mg denně), nejčastější nežádoucí účinky pozorované v obou skupinách byly infekce horních cest dýchacích, bolest hlavy, bolest břicha a nauzea (viz Použití u konkrétních populací a Klinické studie ].
Postmarketingové zkušenosti
Vzhledem k tomu, že níže uvedené reakce jsou hlášeny dobrovolně z populace nejisté velikosti, není obecně možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku. Během postregistračního užívání simvastatinu byly identifikovány následující další nežádoucí účinky: svědění, alopecie, různé kožní změny (např. uzliny, změna barvy, suchost kůže/sliznic, změny vlasů/nehtů), závratě, svalové křeče, myalgie pankreatitida, parestézie, periferní neuropatie, zvracení, anémie, erektilní dysfunkce, intersticiální plicní onemocnění, rhabdomyolýza, hepatitida/žloutenka, fatální a nefatální selhání jater a deprese.
Vzácně byly hlášeny imunitně zprostředkované nekrotizující myopatie spojené s užíváním statinů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Vzácně byl hlášen zjevný syndrom přecitlivělosti, který zahrnoval některé z následujících projevů: anafylaxe, angioedém, lupus erytematózní syndrom, polymyalgia rheumatica, dermatomyozitida, vaskulitida, purpura, trombocytopenie, leukopenie, hemolytická anémie, pozitivní ANA, zvýšení ESR, eosinofilie artritida, artralgie, kopřivka, astenie, fotosenzitivita, horečka, zimnice, návaly horka, malátnost, dušnost, toxická epidermální nekrolýza, erythema multiforme, včetně Stevens-Johnsonova syndromu.
Po uvedení přípravku na trh byly vzácně hlášeny kognitivní poruchy (např. ztráta paměti, zapomnění, amnézie, poruchy paměti, zmatenost) spojené s užíváním statinů. Tyto kognitivní problémy byly hlášeny u všech statinů. Hlášení jsou obecně nezávažná a po vysazení statinu jsou reverzibilní, s proměnlivou dobou do nástupu příznaků (1 den až roky) a vymizení příznaků (medián 3 týdny).
DROGOVÉ INTERAKCE
Silné inhibitory CYP3A4, cyklosporin nebo danazol
Silné inhibitory CYP3A4: Simvastatin, stejně jako několik dalších inhibitorů HMG-CoA reduktázy, je substrátem CYP3A4. Simvastatin je metabolizován CYP3A4, ale nemá žádnou inhibiční aktivitu vůči CYP3A4; proto se neočekává, že by ovlivňoval plazmatické koncentrace jiných léků metabolizovaných CYP3A4.
Zvýšené plazmatické hladiny inhibiční aktivity HMG-CoA reduktázy zvyšují riziko myopatie a rhabdomyolýzy, zejména při vyšších dávkách simvastatinu. [vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ] Současné užívání léků označených jako mající silný inhibiční účinek na CYP3A4 je kontraindikováno [viz KONTRAINDIKACE ]. Pokud je léčba itrakonazolem, ketokonazolem, posakonazolem, vorikonazolem, erythromycinem, klarithromycinem nebo telithromycinem nevyhnutelná, musí být léčba simvastatinem během léčby přerušena.
Cyklosporin nebo Danazol: Riziko myopatie, včetně rhabdomyolýzy, se zvyšuje při současném podávání cyklosporinu nebo danazolu. Proto je současné užívání těchto léků kontraindikováno [viz KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
Léky na snížení hladiny lipidů, které mohou způsobit myopatii, když jsou podávány samostatně
gemfibrozil
Kontraindikováno simvastatinem [viz KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Jiné Fibráty
Při předepisování simvastatinu je třeba postupovat opatrně (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Amiodaron, dronedaron, ranolazin nebo blokátory vápníkových kanálů
Riziko myopatie, včetně rhabdomyolýzy, se zvyšuje při současném podávání amiodaronu, dronedaronu, ranolazinu nebo blokátorů kalciových kanálů, jako je verapamil, diltiazem nebo amlodipin [viz DÁVKOVÁNÍ A PODÁVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a tabulka 3 in KLINICKÁ FARMAKOLOGIE ].
Niacin
Případy myopatie/rhabdomyolýzy byly pozorovány u simvastatinu podávaného s přípravky obsahujícími niacin v dávkách upravujících lipidy (≥1 g/den niacinu). Riziko myopatie je větší u čínských pacientů. V klinické studii (medián sledování 3,9 roku) zahrnující pacienty s vysokým rizikem kardiovaskulárního onemocnění a s dobře kontrolovanými hladinami LDL-C na simvastatinu 40 mg/den s ezetimibem 10 mg/den nebo bez něj nebyl pozorován žádný přírůstek kardiovaskulární výsledky s přidáním dávek upravujících lipidy (≥1 g/den) niacinu. Současné podávání ZOCORu s lipidy upravujícími dávkami (≥1 g/den) niacinu se u čínských pacientů nedoporučuje. Není známo, zda se toto riziko týká jiných asijských pacientů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Digoxin
V jedné studii vedlo současné podávání digoxinu se simvastatinem k mírnému zvýšení koncentrací digoxinu v plazmě. Pacienti užívající digoxin by měli být při zahájení léčby simvastatinem náležitě sledováni (viz KLINICKÁ FARMAKOLOGIE ].
Kumarinové antikoagulanty
Ve dvou klinických studiích, jedné u normálních dobrovolníků a druhé u pacientů s hypercholesterolemií, simvastatin v dávce 20-40 mg/den mírně zesílil účinek kumarinových antikoagulancií: protrombinový čas, uváděný jako International Normalized Ratio (INR), se zvýšil z výchozí hodnoty 1,7 na 1,8 a od 2,6 do 3,4 ve studiích na dobrovolnících a na pacientech, v daném pořadí. U jiných statinů bylo hlášeno klinicky zjevné krvácení a/nebo zvýšený protrombinový čas u několika pacientů užívajících současně kumarinová antikoagulancia. U takových pacientů by měl být protrombinový čas stanoven před zahájením léčby simvastatinem a dostatečně často během rané léčby, aby se zajistilo, že nedojde k žádné významné změně protrombinového času. Jakmile je zdokumentován stabilní protrombinový čas, lze protrombinový čas monitorovat v intervalech obvykle doporučovaných u pacientů užívajících kumarinová antikoagulancia. Pokud se dávka simvastatinu změní nebo vysadí, je třeba opakovat stejný postup. Léčba simvastatinem nebyla spojena s krvácením nebo se změnami protrombinového času u pacientů neužívajících antikoagulancia.
kolchicin
Při současném podávání simvastatinu s kolchicinem byly hlášeny případy myopatie, včetně rhabdomyolýzy, a při předepisování simvastatinu s kolchicinem je třeba postupovat opatrně.
Daptomycin
Při podávání simvastatinu s daptomycinem byly hlášeny případy rhabdomyolýzy. Jak simvastatin, tak daptomycin mohou způsobit myopatii a rhabdomyolýzu, jsou-li podávány samostatně a riziko myopatie a rhabdomyolýzy může být při současném podávání zvýšeno. Dočasně pozastavte ZOCOR u pacientů užívajících daptomycin [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Myopatie/Rhabdomyolýza
Simvastatin občas způsobuje myopatii projevující se jako bolest svalů, citlivost nebo slabost s kreatinkinázou (CK) nad desetinásobkem horní hranice normálu (ULN). Myopatie má někdy formu rhabdomyolýzy s nebo bez akutního selhání ledvin sekundárního k myoglobinurii a vzácně se vyskytly fatální případy. Riziko myopatie zvyšuje zvýšené plazmatické hladiny simvastatinu a kyseliny simvastatinové. Predisponující faktory pro myopatii zahrnují pokročilý věk (≥ 65 let), ženské pohlaví, nekontrolovanou hypotyreózu a poruchu funkce ledvin. Čínští pacienti mohou mít zvýšené riziko myopatie [viz Použití u konkrétních populací ].
Riziko myopatie, včetně rhabdomyolýzy, závisí na dávce. databázi klinických studií, ve kterých bylo 41 413 pacientů léčeno přípravkem ZOCOR 10 mg, z nichž 24 747 (přibližně 60 %) bylo zařazeno do studií s mediánem sledování nejméně 4 roky, byla incidence myopatie přibližně 0,03 % a 0,08 %. v dávce 20 a 40 mg/den. Výskyt myopatie při dávce 80 mg (0,61 %) byl nepoměrně vyšší než výskyt pozorovaný při nižších dávkách. V těchto studiích byli pacienti pečlivě sledováni a některé interagující léčivé přípravky byly vyloučeny.
klinické studii, ve které bylo 12 064 pacientů s anamnézou infarktu myokardu léčeno přípravkem ZOCOR (průměrná doba sledování 6,7 let), byl výskyt myopatie (definované jako nevysvětlitelná svalová slabost nebo bolest při sérové kreatinkináze [CK] >10krát vyšší horní hranice normálu [ULN]) u pacientů užívajících 80 mg/den byla přibližně 0,9 % ve srovnání s 0,02 % u pacientů užívajících 20 mg/den. Incidence rhabdomyolýzy (definovaná jako myopatie s CK >40krát ULN) u pacientů užívajících 80 mg/den byla přibližně 0,4 % ve srovnání s 0 % u pacientů užívajících 20 mg/den. Incidence myopatie, včetně rhabdomyolýzy, byla nejvyšší během prvního roku a poté se výrazně snížila během následujících let léčby. V této studii byli pacienti pečlivě sledováni a některé interagující léčivé přípravky byly vyloučeny.
Riziko myopatie, včetně rhabdomyolýzy, je větší u pacientů užívajících simvastatin 80 mg ve srovnání s jinými statiny s podobnou nebo vyšší účinností při snižování LDL-C a ve srovnání s nižšími dávkami simvastatinu. Proto by dávka 80 mg přípravku ZOCOR měla být používána pouze u hospitalizovaných pacientů, kteří užívali simvastatin 80 mg chronicky (např. po dobu 12 měsíců nebo déle), aniž by byla prokázána svalová toxicita [Vidět DÁVKOVÁNÍ A PODÁVÁNÍ , Omezené dávkování pro 80 mg ]. Pokud však u pacienta, který v současné době toleruje dávku 80 mg přípravku ZOCOR, je třeba zahájit léčbu interagujícím lékem, který je kontraindikován nebo je spojen s dávkovacím stropem pro simvastatin, měl by být tento pacient převeden na alternativní statin s menším potenciálem léková interakce. Pacienti by měli být upozorněni na zvýšené riziko myopatie, včetně rhabdomyolýzy, a měli by okamžitě hlásit jakoukoli nevysvětlitelnou svalovou bolest, citlivost nebo slabost. Pokud se objeví příznaky, léčba by měla být okamžitě přerušena. [vidět Imunitně zprostředkovaná nekrotizující myopatie ]
Všichni pacienti zahajující léčbu přípravkem ZOCOR 20 mg nebo pacienti, u kterých se dávka přípravku ZOCOR zvyšuje, by měli být informováni o riziku myopatie, včetně rhabdomyolýzy, a měli by být poučeni, aby neprodleně hlásili jakoukoli nevysvětlitelnou svalovou bolest, citlivost nebo slabost, zvláště pokud jsou doprovázeny malátností nebo horečkou nebo pokud svalové příznaky a příznaky přetrvávají i po vysazení přípravku ZOCOR. Léčba přípravkem ZOCOR by měla být okamžitě přerušena, pokud je diagnostikována nebo podezření na myopatii. Ve většině případů svalové příznaky a zvýšení CK vymizely, když byla léčba okamžitě ukončena. U pacientů zahajujících léčbu přípravkem ZOCOR 5 mg nebo u pacientů, u kterých se dávka zvyšuje, lze zvážit pravidelné stanovení CK, ale neexistuje žádná záruka, že takové sledování zabrání myopatii.
Mnoho pacientů, u kterých se vyvinula rhabdomyolýza při léčbě simvastatinem, mělo komplikovanou anamnézu, včetně renální insuficience, obvykle v důsledku dlouhodobého diabetes mellitus. Takoví pacienti si zaslouží bližší sledování. Léčba přípravkem ZOCOR by měla být přerušena, pokud se objeví výrazně zvýšené hladiny CPK nebo je diagnostikována nebo podezření na myopatii. Léčba přípravkem ZOCOR by měla být také dočasně přerušena u každého pacienta s akutním nebo závažným stavem predisponujícím k rozvoji renálního selhání sekundárního k rhabdomyolýze, např. sepse; hypotenze; velký chirurgický zákrok; trauma; těžké metabolické, endokrinní nebo elektrolytové poruchy; nebo nekontrolovaná epilepsie.
Lékové interakce
Riziko myopatie a rhabdomyolýzy je zvýšeno zvýšenými plazmatickými hladinami simvastatinu a kyseliny simvastatinové. Simvastatin je metabolizován izoformou 3A4 cytochromu P450. Některé léky, které inhibují tuto metabolickou dráhu, mohou zvýšit plazmatické hladiny simvastatinu a mohou zvýšit riziko myopatie. Patří mezi ně itrakonazol, ketokonazol, posakonazol, vorikonazol, makrolidová antibiotika erythromycin a klarithromycin a ketolidové antibiotikum telithromycin, inhibitory HIV proteázy, boceprevir, telaprevir, antidepresivum nefazodon, přípravky obsahující kobicistat nebo grapefruit KLINICKÁ FARMAKOLOGIE ]. Kombinace těchto léků se simvastatinem je kontraindikována. Pokud je krátkodobá léčba silnými inhibitory CYP3A4 nevyhnutelná, musí být léčba simvastatinem v průběhu léčby přerušena (viz KONTRAINDIKACE a DROGOVÉ INTERAKCE ].
Kombinované použití simvastatinu s gemfibrozilem, cyklosporinem nebo danazolem je kontraindikováno (viz KONTRAINDIKACE a DROGOVÉ INTERAKCE ].
Při předepisování jiných fibrátů se simvastatinem je třeba opatrnosti, protože tyto látky mohou způsobit myopatii, pokud jsou podávány samostatně a riziko je zvýšené, pokud jsou podávány současně (viz DROGOVÉ INTERAKCE ].
Případy myopatie, včetně rhabdomyolýzy, byly hlášeny u simvastatinu podávaného současně s kolchicinem a při předepisování simvastatinu s kolchicinem je třeba postupovat opatrně (viz DROGOVÉ INTERAKCE ].
Je třeba pečlivě zvážit přínosy kombinovaného užívání simvastatinu s následujícími léky oproti potenciálním rizikům kombinací: jiné léky snižující hladinu lipidů (fibráty nebo, u pacientů s HoFH, lomitapid), amiodaron, dronedaron, verapamil, diltiazem, amlodipin, nebo ranolazin [viz DÁVKOVÁNÍ A PODÁVÁNÍ , DROGOVÉ INTERAKCE ].
Případy myopatie, včetně rhabdomyolýzy, byly pozorovány u simvastatinu podávaného současně s lipidy upravujícími dávkami (≥1 g/den niacinu) přípravků obsahujících niacin [viz DROGOVÉ INTERAKCE ].
Při podávání simvastatinu s daptomycinem byly hlášeny případy rhabdomyolýzy. Dočasně pozastavte ZOCOR u pacientů užívajících daptomycin [viz DROGOVÉ INTERAKCE ].
Doporučení pro předepisování interagujících látek jsou shrnuta v tabulce 1 [viz také DÁVKOVÁNÍ A PODÁVÁNÍ , DROGOVÉ INTERAKCE , KLINICKÁ FARMAKOLOGIE ].

Imunitně zprostředkovaná nekrotizující myopatie
Vzácně byly hlášeny případy imunitně zprostředkované nekrotizující myopatie (IMNM), autoimunitní myopatie, spojené s užíváním statinů. IMNM je charakterizována: proximální svalovou slabostí a zvýšenou sérovou kreatinkinázou, které přetrvávají i přes přerušení léčby statiny; pozitivní anti-HMG CoA reduktáza protilátka; svalová biopsie ukazující nekrotizující myopatii; a zlepšení pomocí imunosupresiv. Mohou být nezbytné další neuromuskulární a sérologické testy. Může být nutná léčba imunosupresivy. Před zahájením léčby jiným statinem pečlivě zvažte riziko IMNM. Pokud je léčba zahájena jiným statinem, sledujte známky a příznaky IMNM.
Jaterní dysfunkce
trvalému zvýšení (na více než 3násobek ULN) sérových transamináz došlo přibližně u 1 % pacientů, kteří dostávali simvastatin v klinických studiích. Když byla medikamentózní léčba u těchto pacientů přerušena nebo ukončena, hladiny transamináz obvykle pomalu klesaly na úroveň před léčbou. Zvýšení nebylo spojeno se žloutenkou nebo jinými klinickými příznaky nebo symptomy. Nebyla prokázána přecitlivělost.
Ve Scandinavian Simvastatin Survival Study (4S) [viz Klinické studie se počet pacientů s více než jedním zvýšením transamináz na >3X ULN v průběhu studie významně nelišil mezi skupinami se simvastatinem a placebem (14 [0,7 %] vs. 12 [0,6 %]). Zvýšené transaminázy vedly k přerušení léčby u 8 pacientů ve skupině se simvastatinem (n=2 221) au 5 pacientů ve skupině s placebem (n=2 223). Z 1 986 pacientů léčených simvastatinem ve 4S s normálními jaterními funkčními testy (LFT) na začátku se u 8 (0,4 %) rozvinulo po sobě jdoucí zvýšení LFT na >3X ULN a/nebo bylo vysazeno kvůli zvýšení transamináz během 5,4 let (medián sledování ) studie. Z těchto 8 pacientů se u 5 původně tyto abnormality rozvinuly během prvního roku. Všichni pacienti v této studii dostávali počáteční dávku 20 mg simvastatinu; 37 % bylo titrováno na 40 mg.
Ve 2 kontrolovaných klinických studiích u 1 105 pacientů byla 12měsíční incidence přetrvávajícího zvýšení jaterních transamináz bez ohledu na lékový vztah 0,9 % a 2,1 % při dávce 40 a 80 mg, v uvedeném pořadí. U žádného pacienta se po prvních 6 měsících léčby danou dávkou nerozvinuly přetrvávající abnormality jaterních funkcí.
Před zahájením léčby a poté, pokud je to klinicky indikováno, se doporučuje provést jaterní testy. Po uvedení přípravku na trh byly vzácně hlášeny fatální a nefatální jaterní selhání u pacientů užívajících statiny, včetně simvastatinu. Pokud se během léčby přípravkem ZOCOR 5 mg objeví závažné poškození jater s klinickými příznaky a/nebo hyperbilirubinémií nebo žloutenkou, okamžitě přerušte léčbu. Pokud není nalezena alternativní etiologie, nerestartujte ZOCOR. Všimněte si, že ALT může vycházet ze svalů, a proto vzestup ALT s CK může znamenat myopatii [viz Myopatie/Rhabdomyolýza ].
Lék by měl být používán s opatrností u pacientů, kteří konzumují značné množství alkoholu a/nebo mají v anamnéze onemocnění jater. Aktivní jaterní onemocnění nebo nevysvětlitelné zvýšení transamináz jsou kontraindikacemi použití simvastatinu.
Po léčbě simvastatinem bylo hlášeno středně silné (méně než 3x ULN) zvýšení sérových transamináz. Tyto změny se objevily brzy po zahájení terapie simvastatinem, byly často přechodné, nebyly doprovázeny žádnými příznaky a nevyžadovaly přerušení léčby.
Endokrinní funkce
U inhibitorů HMG-CoA reduktázy, včetně ZOCORu, bylo hlášeno zvýšení HbA1c a hladin sérové glukózy nalačno.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
72týdenní studii karcinogenity byly myším podávány denní dávky simvastatinu 25, 100 a 400 mg/kg tělesné hmotnosti, což vedlo k průměrným hladinám léčiva v plazmě přibližně 1, 4 a 8krát vyšším než průměrný léčivý přípravek v lidské plazmě (jako celková inhibiční aktivita na základě AUC) po perorální dávce 80 mg. Karcinomy jater byly významně zvýšeny u žen s vysokou dávkou au mužů se střední a vysokou dávkou s maximální incidencí 90 % u mužů. Výskyt adenomů jater byl významně zvýšen u žen se střední a vysokou dávkou. Medikamentózní léčba také významně zvýšila výskyt plicních adenomů u mužů a žen se střední a vysokou dávkou. Adenomy Harderovy žlázy (oční žlázy hlodavců) byly významně vyšší u myší s vysokou dávkou než u kontrol. Při dávce 25 mg/kg/den nebyly pozorovány žádné známky tumorigenního účinku.
samostatné 92týdenní studii karcinogenity u myší v dávkách až 25 mg/kg/den nebyly pozorovány žádné známky tumorigenního účinku (průměrné plazmatické hladiny léku byly 1krát vyšší než u lidí, kterým bylo podáno 80 mg simvastatinu, měřeno pomocí AUC).
Ve dvouleté studii na potkanech při dávce 25 mg/kg/den došlo ke statisticky významnému zvýšení výskytu folikulárních adenomů štítné žlázy u samic potkanů vystavených přibližně 11krát vyšším hladinám simvastatinu než u lidí, kterým bylo podáváno 80 mg simvastatinu (jako měřeno pomocí AUC).
Druhá dvouletá studie karcinogenity u potkanů s dávkami 50 a 100 mg/kg/den vyvolala hepatocelulární adenomy a karcinomy (u samic potkanů v obou dávkách a u samců při 100 mg/kg/den). Adenomy folikulárních buněk štítné žlázy byly zvýšeny u mužů a žen při obou dávkách; karcinomy folikulárních buněk štítné žlázy byly zvýšeny u žen při dávce 100 mg/kg/den. Zdá se, že zvýšený výskyt novotvarů štítné žlázy je v souladu s nálezy u jiných statinů. Tyto léčebné hladiny představovaly hladiny léčiva v plazmě (AUC) přibližně 7 až 15násobek (muži) a 22násobek a 25násobek (ženy) průměrné expozice léku v lidské plazmě po 80 miligramové denní dávce.
Žádný důkaz mutagenity nebyl pozorován v testu mikrobiální mutagenity (Ames) s metabolickou aktivací jater potkana nebo myši nebo bez ní. Kromě toho nebyly zaznamenány žádné známky poškození genetického materiálu v in vitro alkalickém elučním testu s použitím potkaních hepatocytů, ve studii přímé mutace savčích buněk V-79, in vitro studii chromozomových aberací v buňkách CHO nebo in vivo testu chromozomálních aberací v kostní dřeni myši.
samců potkanů léčených simvastatinem v dávce 25 mg/kg tělesné hmotnosti po dobu 34 týdnů (čtyřnásobek maximální hladiny expozice u člověka, založené na AUC, u pacientů užívajících 80 mg/den) byla snížena plodnost; tento účinek však nebyl pozorován během následné studie fertility, ve které byl simvastatin podáván ve stejné dávce potkaním samcům po dobu 11 týdnů (celý cyklus spermatogeneze včetně zrání nadvarlat). V žádné studii nebyly pozorovány žádné mikroskopické změny ve varlatech potkanů. Při dávce 180 mg/kg/den (což způsobuje úrovně expozice 22krát vyšší než u lidí užívajících 80 mg/den na základě plochy povrchu, mg/m2) byla pozorována degenerace semenotvorných kanálků (nekróza a ztráta spermatogenního epitelu). U psů se objevila atrofie varlat související s lékem, snížená spermatogeneze, degenerace spermatocytů a tvorba obrovských buněk při dávce 10 mg/kg/den (přibližně dvojnásobek expozice u člověka, na základě AUC, při 80 mg/den). Klinický význam těchto nálezů není jasný.
Použití u konkrétních populací
Těhotenství
Kategorie těhotenství X [Viz KONTRAINDIKACE ]
ZOCOR je kontraindikován u žen, které jsou nebo mohou otěhotnět. Léky snižující hladinu lipidů nemají během těhotenství žádný přínos, protože cholesterol a deriváty cholesterolu jsou potřebné pro normální vývoj plodu. Ateroskleróza je chronický proces a vysazení hypolipidemik během těhotenství by mělo mít malý dopad na dlouhodobé výsledky primární terapie hypercholesterolemie. Neexistují žádné adekvátní a dobře kontrolované studie použití přípravku ZOCOR během těhotenství; existují však vzácné zprávy o vrozených anomáliích u kojenců vystavených statinům in utero. Reprodukční studie simvastatinu na zvířatech u potkanů a králíků neprokázaly teratogenitu. Sérový cholesterol a triglyceridy se během normálního těhotenství zvyšují a cholesterol nebo jeho deriváty jsou nezbytné pro vývoj plodu. Protože statiny snižují syntézu cholesterolu a možná i syntézu dalších biologicky aktivních látek odvozených od cholesterolu, může ZOCOR při podání těhotné ženě způsobit poškození plodu. Pokud je ZOCOR 5 mg užíván během těhotenství nebo pokud pacientka otěhotní během užívání tohoto léku, pacientka by měla být informována o možném riziku pro plod.
Existují vzácné zprávy o vrozených anomáliích po intrauterinní expozici statinům. V přehledu2 přibližně 100 prospektivně sledovaných těhotenství u žen vystavených simvastatinu nebo jinému strukturálně příbuznému statinu nepřesáhl výskyt vrozených anomálií, spontánních potratů a fetálních úmrtí/mrtvých porodů hodnoty očekávané v běžné populaci. Studie však byla schopna vyloučit pouze 3- až 4násobné zvýšené riziko vrozených anomálií oproti základní frekvenci. V 89 % těchto případů byla medikamentózní léčba zahájena před otěhotněním a byla přerušena během prvního trimestru, když bylo zjištěno těhotenství.
Simvastatin nebyl teratogenní u potkanů ani králíků v dávkách (25, resp. 10 mg/kg/den), které vedly k 3násobku expozice u člověka na základě mg/m2 plochy povrchu. Ve studiích s jiným strukturně podobným statinem však byly u potkanů a myší pozorovány kosterní malformace.
Manson, JM, Freyssinges, C., Ducrocq, MB, Stephenson, WP, Postmarketing Surveillance of Lovastatin and Simvastatin Exposure during Pregnancy, Reproductive Toxicology, 10(6):439-446, 1996.
Ženám ve fertilním věku, které potřebují léčbu ZOCORem 5 mg pro poruchu lipidů, by mělo být doporučeno používat účinnou antikoncepci. U žen, které se snaží otěhotnět, je třeba zvážit přerušení léčby přípravkem ZOCOR. Pokud dojde k otěhotnění, podávání přípravku ZOCOR by mělo být okamžitě ukončeno.
Kojící matky
Není známo, zda se simvastatin vylučuje do lidského mateřského mléka. Vzhledem k tomu, že malé množství jiného léčiva z této třídy se vylučuje do mateřského mléka a vzhledem k potenciálu závažných nežádoucích účinků u kojených dětí, ženy užívající simvastatin by neměly kojit své děti. Mělo by se rozhodnout, zda přerušit kojení nebo přerušit lék, s ohledem na důležitost léku pro matku [viz KONTRAINDIKACE ].
Pediatrické použití
Bezpečnost a účinnost simvastatinu u pacientů ve věku 10-17 let s heterozygotní familiární hypercholesterolemií byla hodnocena v kontrolované klinické studii u dospívajících chlapců a dívek, kteří byli alespoň 1 rok po menarché. Pacienti léčení simvastatinem měli profil nežádoucích účinků podobný jako u pacientů léčených placebem. Dávky vyšší než 40 mg nebyly u této populace studovány. V této omezené kontrolované studii nebyl zjištěn žádný významný účinek na růst nebo sexuální dospívání u dospívajících chlapců nebo dívek nebo na délku menstruačního cyklu u dívek. [Vidět DÁVKOVÁNÍ A PODÁVÁNÍ , NEŽÁDOUCÍ REAKCE , Klinické studie ] Dospívající ženy by měly být během léčby simvastatinem konzultovány o vhodných metodách antikoncepce (viz KONTRAINDIKACE a Těhotenství ]. Simvastatin nebyl studován u pacientů mladších 10 let ani u premenarchálních dívek.
Geriatrické použití
2 423 pacientů, kteří dostávali ZOCOR 5 mg v klinických studiích fáze III, a 10 269 pacientů ve studii Heart Protection Study, kteří dostávali ZOCOR 40 mg, bylo 363 (15 %) a 5 366 (52 %) ve věku ≥ 65 let. U HPS bylo 615 (6 %) ve věku ≥ 75 let. Mezi těmito subjekty a mladšími subjekty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti a další hlášené klinické zkušenosti neidentifikovaly rozdíly v odpovědích mezi staršími a mladšími pacienty, nelze však vyloučit větší citlivost některých starších osob. Vzhledem k tomu, že pokročilý věk (≥65 let) je predisponujícím faktorem pro myopatii, měl by být ZOCOR u starších pacientů předepisován opatrně. [Vidět KLINICKÁ FARMAKOLOGIE ]
Farmakokinetická studie se simvastatinem ukázala, že průměrná plazmatická hladina aktivity statinu je přibližně o 45 % vyšší u starších pacientů ve věku 70–78 let ve srovnání s pacienty ve věku 18–30 let. V 4S bylo 1 021 (23 %) ze 4 444 pacientů ve věku 65 let nebo více. Účinnost snižování lipidů byla u starších pacientů přinejmenším stejně velká ve srovnání s mladšími pacienty a ZOCOR významně snížil celkovou mortalitu a mortalitu na ICHS u starších pacientů s ICHS v anamnéze. U HPS bylo 52 % pacientů staršího věku (4 891 pacientů ve věku 65–69 let a 5 806 pacientů ve věku 70 let nebo starších). Relativní snížení rizika úmrtí na ICHS, nefatálního IM, koronárních a nekoronárních revaskularizačních výkonů a cévní mozkové příhody bylo podobné u starších a mladších pacientů (viz Klinické studie ]. U HPS byly mezi 32 145 pacienty vstupujícími do aktivního záběhového období 2 případy myopatie/rhabdomyolýzy; tito pacienti byli ve věku 67 a 73 let. Ze 7 případů myopatie/rhabdomyolýzy mezi 10 269 pacienty přidělenými na simvastatin byly 4 ve věku 65 nebo více (ve výchozím stavu), z nichž jeden byl starší 75 let. Mezi staršími pacienty nebyly žádné celkové rozdíly v bezpečnosti. a mladší pacienti v 4S nebo HPS.
Vzhledem k tomu, že pokročilý věk (≥65 let) je predisponujícím faktorem pro myopatii, včetně rhabdomyolýzy, ZOCOR 40 mg by měl být starším pacientům předepisován s opatrností. V klinické studii u pacientů léčených simvastatinem 80 mg/den měli pacienti ve věku ≥ 65 let zvýšené riziko myopatie, včetně rhabdomyolýzy, ve srovnání s pacienty ve věku VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ]
Renální poškození
Opatrnosti je třeba při podávání přípravku ZOCOR 20 mg pacientům s těžkou poruchou funkce ledvin (viz DÁVKOVÁNÍ A PODÁVÁNÍ ]
Poškození jater
ZOCOR 10 mg je kontraindikován u pacientů s aktivním onemocněním jater, které může zahrnovat nevysvětlitelné přetrvávající zvýšení hladin jaterních transamináz (viz KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Čínští pacienti
V klinické studii, ve které byli pacienti s vysokým rizikem kardiovaskulárního onemocnění léčeni simvastatinem v dávce 40 mg/den (medián sledování 3,9 roku), byla incidence myopatie přibližně 0,05 % u nečínských pacientů (n=7367) ve srovnání s 0,24 % pro čínské pacienty (n=5468). Výskyt myopatie u čínských pacientů užívajících simvastatin 40 mg/den nebo ezetimib/simvastatin 10/40 mg/den podávaný současně s niacinem s prodlouženým uvolňováním 2 g/den byl 1,24 %.
Čínští pacienti mohou mít vyšší riziko myopatie, pacienty vhodně sledujte. Současné podávání přípravku ZOCOR 10 mg s dávkami upravujícími lipidy (≥1 g/den niacinu) přípravků obsahujících niacin se u čínských pacientů nedoporučuje (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE ].
PŘEDÁVKOVAT
Významná letalita byla pozorována u myší po jednorázové perorální dávce 9 g/m2. U potkanů a psů léčených dávkami 30 a 100 g/m2 nebyly pozorovány žádné známky letality. U hlodavců nebyly pozorovány žádné specifické diagnostické příznaky. Při těchto dávkách byly jedinými příznaky pozorovanými u psů zvracení a mukoidní stolice.
Bylo hlášeno několik případů předávkování přípravkem ZOCOR; maximální přijatá dávka byla 3,6 g. Všichni pacienti se uzdravili bez následků. V případě předávkování je třeba přijmout podpůrná opatření. Dialyzovatelnost simvastatinu a jeho metabolitů u člověka není v současnosti známa.
KONTRAINDIKACE
ZOCOR 40 mg je kontraindikován u následujících stavů:
- Současné podávání silných inhibitorů CYP3A4 (např. itrakonazol, ketokonazol, posakonazol, vorikonazol, inhibitory HIV proteázy, boceprevir, telaprevir, erythromycin, klarithromycin, telithromycin, nefazodon a přípravky obsahující kobicistat) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Současné podávání gemfibrozilu, cyklosporinu nebo danazolu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Přecitlivělost na kteroukoli složku tohoto léku (viz NEŽÁDOUCÍ REAKCE ].
- Aktivní onemocnění jater, které může zahrnovat nevysvětlitelné přetrvávající zvýšení hladin jaterních transamináz (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Ženy, které jsou těhotné nebo mohou otěhotnět. Sérový cholesterol a triglyceridy se během normálního těhotenství zvyšují a cholesterol nebo jeho deriváty jsou nezbytné pro vývoj plodu. Protože inhibitory HMG-CoA reduktázy (statiny) snižují syntézu cholesterolu a možná i syntézu dalších biologicky aktivních látek odvozených od cholesterolu, může ZOCOR 40 mg způsobit poškození plodu při podání těhotné ženě. Ateroskleróza je chronický proces a vysazení hypolipidemik během těhotenství by mělo mít malý vliv na výsledek dlouhodobé léčby primární hypercholesterolémie. Neexistují žádné adekvátní a dobře kontrolované studie použití přípravku ZOCOR během těhotenství; ve vzácných případech však byly po intrauterinní expozici statinům pozorovány vrozené anomálie. V reprodukčních studiích na potkanech a králících simvastatin neprokázal teratogenitu. ZOCOR by měl být podáván ženám ve fertilním věku pouze tehdy, je-li u těchto pacientek vysoce nepravděpodobné, že by otěhotněly. Pokud pacientka otěhotní během užívání tohoto léku, ZOCOR by měl být okamžitě přerušen a pacient by měl být informován o potenciálním riziku pro plod (viz Použití u konkrétních populací ].
- Kojící matky. Není známo, zda se simvastatin vylučuje do lidského mateřského mléka; avšak malé množství jiného léku z této třídy přechází do mateřského mléka. Protože statiny mají potenciál pro závažné nežádoucí reakce u kojených dětí, ženy, které vyžadují léčbu přípravkem ZOCOR, by neměly kojit své děti (viz Použití u konkrétních populací ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Simvastatin je proléčivo a po podání se hydrolyzuje na svou aktivní formu β-hydroxykyseliny, kyselinu simvastatinovou. Simvastatin je specifický inhibitor 3-hydroxy-3-methylglutaryl-koenzym A (HMG-CoA) reduktázy, enzymu, který katalyzuje přeměnu HMG-CoA na mevalonát, což je časný a rychlost limitující krok v biosyntetické dráze cholesterolu. Kromě toho simvastatin snižuje VLDL a TG a zvyšuje HDL-C.
Farmakodynamika
Epidemiologické studie prokázaly, že zvýšené hladiny celkového-C, LDL-C, stejně jako snížené hladiny HDL-C jsou spojeny s rozvojem aterosklerózy a zvýšeným kardiovaskulárním rizikem. Snížení LDL-C toto riziko snižuje. Nezávislý účinek zvýšení HDL-C nebo snížení TG na riziko koronární a kardiovaskulární morbidity a mortality však nebyl stanoven.
Farmakokinetika
Simvastatin je lakton, který se in vivo snadno hydrolyzuje na odpovídající β-hydroxykyselinu, silný inhibitor HMG-CoA reduktázy. Inhibice HMG-CoA reduktázy je základem pro test ve farmakokinetických studiích metabolitů β-hydroxykyseliny (aktivní inhibitory) a po hydrolýze báze aktivních plus latentních inhibitorů (celkové inhibitory) v plazmě po podání simvastatinu.
Po perorální dávce simvastatinu značeného 14C u člověka bylo 13 % dávky vyloučeno močí a 60 % stolicí. Plazmatické koncentrace celkové radioaktivity (simvastatin plus 14C-metabolity) dosáhly vrcholu za 4 hodiny a rychle klesaly na přibližně 10 % maxima do 12 hodin po podání dávky. Vzhledem k tomu, že simvastatin prochází rozsáhlou extrakcí při prvním průchodu játry, dostupnost léku do celkového oběhu je nízká (
Jak simvastatin, tak jeho metabolit β-hydroxykyselina se silně váží (přibližně 95 %) na lidské plazmatické proteiny. Studie na potkanech naznačují, že když byl podáván radioaktivně značený simvastatin, radioaktivita odvozená od simvastatinu překročila hematoencefalickou bariéru.
Hlavní aktivní metabolity simvastatinu přítomné v lidské plazmě jsou β-hydroxykyselina simvastatinu a jeho 6′-hydroxy, 6′-hydroxymethyl a 6′-exomethylenové deriváty. Maximálních plazmatických koncentrací aktivních i celkových inhibitorů bylo dosaženo během 1,3 až 2,4 hodin po podání dávky. Zatímco doporučené rozmezí terapeutické dávky je 5 až 40 mg/den, nedošlo k žádné podstatné odchylce od linearity AUC inhibitorů v celkovém oběhu při zvýšení dávky až na 120 mg. V porovnání se stavem nalačno nebyl plazmatický profil inhibitorů ovlivněn, když byl simvastatin podán těsně předtím, než American Heart Association doporučila nízkotučné jídlo.
Ve studii zahrnující 16 starších pacientů ve věku 70 až 78 let, kteří dostávali ZOCOR 40 mg/den, byla průměrná plazmatická hladina inhibiční aktivity HMG-CoA reduktázy zvýšena přibližně o 45 % ve srovnání s 18 pacienty ve věku 18-30 let. Zkušenosti z klinické studie u starších osob (n=1522) naznačují, že nebyly žádné celkové rozdíly v bezpečnosti mezi staršími a mladšími pacienty [viz Použití u konkrétních populací ].
Kinetické studie s jiným statinem, který má podobnou hlavní cestu eliminace, naznačují, že pro danou dávkovou hladinu lze u pacientů s těžkou renální insuficiencí (měřeno clearance kreatininu) dosáhnout vyšší systémové expozice.
Kyselina simvastatinová je substrátem transportního proteinu OATP1B1. Současné podávání léčivých přípravků, které jsou inhibitory transportního proteinu OATP1B1, může vést ke zvýšeným plazmatickým koncentracím kyseliny simvastatinové a zvýšenému riziku myopatie. Například bylo prokázáno, že cyklosporin zvyšuje AUC statinů; ačkoli mechanismus není zcela objasněn, zvýšení AUC kyseliny simvastatinové je pravděpodobně částečně způsobeno inhibicí CYP3A4 a/nebo OATP1B1.
Riziko myopatie zvyšuje vysoká hladina inhibiční aktivity HMG-CoA reduktázy v plazmě. Inhibitory CYP3A4 mohou zvýšit plazmatické hladiny inhibiční aktivity HMG-CoA reduktázy a zvýšit riziko myopatie (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a DROGOVÉ INTERAKCE ].
Ve studii s 12 zdravými dobrovolníky neměl simvastatin v dávce 80 mg žádný vliv na metabolismus sondy cytochromu P450, izoforma 3A4 (CYP3A4), substráty midazolam a erythromycin. To naznačuje, že simvastatin není inhibitorem CYP3A4, a proto se neočekává, že by ovlivňoval plazmatické hladiny jiných léků metabolizovaných CYP3A4.
Současné podávání simvastatinu (40 mg jednou denně po dobu 10 dnů) vedlo ke zvýšení maximálních průměrných hladin kardioaktivního digoxinu (podávaného jako jednorázová dávka 0,4 mg v den 10) přibližně o 0,3 ng/ml.
Toxikologie zvířat a/nebo farmakologie
CNS toxicita
Degenerace zrakového nervu byla pozorována u klinicky normálních psů léčených simvastatinem po dobu 14 týdnů v dávce 180 mg/kg/den, což je dávka, která produkovala průměrné hladiny léčiva v plazmě asi 12krát vyšší než průměrné hladiny léčiva v plazmě u lidí užívajících 80 mg/den.
Chemicky podobný lék v této třídě také způsobil degeneraci zrakového nervu (Wallerova degenerace retinogenních vláken) u klinicky normálních psů způsobem závislým na dávce počínaje dávkou 60 mg/kg/den, což je dávka, která vyvolala průměrné hladiny léku v plazmě asi 30krát vyšší. než je průměrná hladina léčiva v plazmě u lidí užívajících nejvyšší doporučenou dávku (měřeno celkovou inhibiční aktivitou enzymu). Tento stejný lék také vyvolal vestibulokochleární degeneraci podobnou Wallerianovi a chromatolýzu gangliových buněk sítnice u psů léčených po dobu 14 týdnů dávkou 180 mg/kg/den, což je dávka, která vedla k průměrné hladině léčiva v plazmě podobné té, která byla pozorována u 60 mg/kg/den. denní dávka.
CNS cévní léze charakterizované perivaskulárním krvácením a edémem, infiltrací perivaskulárních prostor mononukleárními buňkami, perivaskulárními fibrinovými depozity a nekrózou malých cév byly pozorovány u psů léčených simvastatinem v dávce 360 mg/kg/den, což je dávka, která produkovala průměrnou plazmatickou hladinu hladiny léku, které byly asi 14krát vyšší než průměrné plazmatické hladiny léku u lidí užívajících 80 mg/den. Podobné vaskulární léze CNS byly pozorovány u několika dalších léků této třídy.
U potkaních samic po dvou letech léčby 50 a 100 mg/kg/den (22násobek a 25násobek lidské AUC při 80 mg/den) au psů po třech měsících při 90 mg/kg/den ( 19krát) a po dvou letech v dávce 50 mg/kg/den (5krát).
Klinické studie
Klinické studie u dospělých
Snížení rizika úmrtnosti na ICHS a kardiovaskulárních příhod
4S byl hodnocen účinek léčby přípravkem ZOCOR 20 mg na celkovou mortalitu u 4 444 pacientů s ICHS a výchozí hodnotou celkového cholesterolu 212-309 mg/dl (5,5-8,0 mmol/l). V této multicentrické, randomizované, dvojitě zaslepené, placebem kontrolované studii byli pacienti léčeni standardní péčí, včetně diety, a buď ZOCOR 20-40 mg/den (n=2 221) nebo placebem (n=2 223) po střední dobu trvání 5,4 roku. V průběhu studie vedla léčba přípravkem ZOCOR k průměrnému snížení celkového cholesterolu o 25 %, LDL-C o 35 % a TG o 10 % a průměrného zvýšení HDL-C o 8 %. ZOCOR významně snížil riziko úmrtnosti o 30 % (p=0,0003, 182 úmrtí ve skupině ZOCOR 40 mg oproti 256 úmrtím ve skupině s placebem). Riziko úmrtnosti na ICHS bylo významně sníženo o 42 % (p=0,00001, 111 vs 189 úmrtí). Mezi skupinami nebyl statisticky významný rozdíl v nekardiovaskulární mortalitě. ZOCOR významně snížil riziko závažných koronárních příhod (úmrtnost na ICHS plus v nemocnici ověřený a tichý nefatální infarkt myokardu [MI]) o 34 % (p
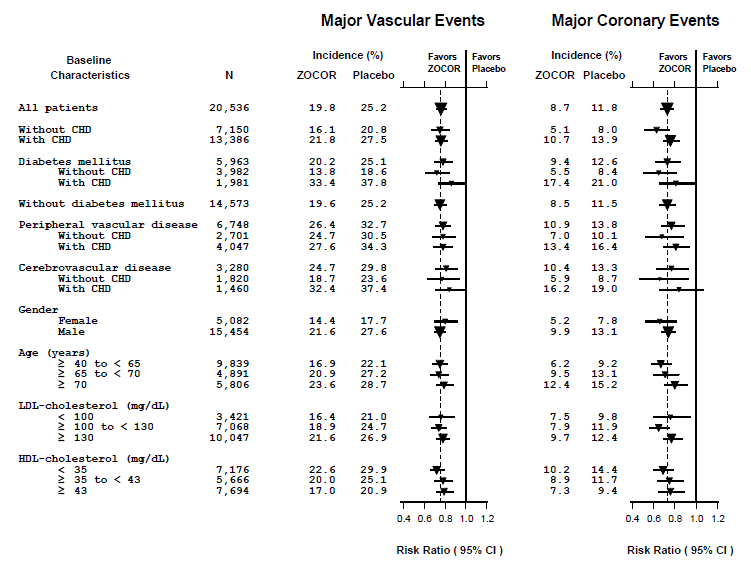
Heart Protection Study (HPS) byla velká, multicentrická, placebem kontrolovaná, dvojitě zaslepená studie s průměrnou dobou trvání 5 let prováděná u 20 536 pacientů (10 269 na ZOCOR 40 mg a 10 267 na placebu). Pacienti byli přidělováni k léčbě pomocí kovariátní adaptivní metody3, která zohledňovala rozložení 10 důležitých výchozích charakteristik již zařazených pacientů a minimalizovala nerovnováhu těchto charakteristik napříč skupinami. Pacienti měli průměrný věk 64 let (rozmezí 40–80 let), byli z 97 % bělošští a měli vysoké riziko rozvoje velké koronární příhody kvůli existující ICHS (65 %), diabetu (typ 2, 26 %; typ 1 , 3 %), anamnéza mrtvice nebo jiného cerebrovaskulárního onemocnění (16 %), onemocnění periferních cév (33 %) nebo hypertenze u mužů ≥ 65 let (6 %). Na začátku mělo 3 421 pacientů (17 %) hladiny LDL-C pod 100 mg/dl, z nichž 953 (5 %) mělo hladiny LDL-C pod 80 mg/dl; 7 068 pacientů (34 %) mělo hladiny mezi 100 a 130 mg/dl; a 10 047 pacientů (49 %) mělo hladiny vyšší než 130 mg/dl.
DR Taves, Minimization: nová metoda přiřazování pacientů do léčebných a kontrolních skupin. Clin. Pharmacol. Ther. 15 (1974), str. 443-453
Výsledky HPS ukázaly, že ZOCOR 40 mg/den významně snížil: celkovou a ICHS úmrtnost; nefatální IM, cévní mozková příhoda a revaskularizační procedury (koronární a nekoronární) (viz tabulka 4).
Byly definovány dva složené koncové body, aby bylo dosaženo dostatečného počtu příhod k posouzení snížení relativního rizika v celé řadě základních charakteristik (viz obrázek 1). Kompozit hlavních koronárních příhod (MCE) sestával z ICHS mortality a nefatálního IM (analyzováno podle času do první příhody; příhody mělo 898 pacientů léčených přípravkem ZOCOR 5 mg a příhody 1 212 pacientů užívajících placebo). Kompozit velkých cévních příhod (MVE) sestával z MCE, cévní mozkové příhody a revaskularizačních výkonů včetně koronárních, periferních a jiných nekoronárních výkonů (analyzováno podle doby do první příhody; příhody mělo 2 033 pacientů léčených přípravkem ZOCOR 10 mg a 2 585 pacientů na placebo mělo události). Významné snížení relativního rizika bylo pozorováno pro oba složené cílové parametry (27 % pro MCE a 24 % pro MVE, p
Obrázek 1 Účinky léčby přípravkem ZOCOR 5 mg na velké cévní příhody a velké koronární příhody u HPS
Angiografické studie
V Multicenter Anti-Atheroma Study byl hodnocen účinek simvastatinu na aterosklerózu pomocí kvantitativní koronarografie u hypercholesterolemických pacientů s ICHS. V této randomizované, dvojitě zaslepené, kontrolované studii byli pacienti léčeni simvastatinem 20 mg/den nebo placebem. Angiogramy byly hodnoceny na začátku, dva a čtyři roky. Cílové body souběžné primární studie byly průměrné změny na pacienta v minimálním a středním průměru lumen, což ukazuje na fokální a difuzní onemocnění, v daném pořadí. ZOCOR signifikantně zpomalil progresi lézí měřenou na angiogramu 4. roku oběma parametry a také změnou procenta stenózy průměru. Kromě toho simvastatin významně snížil podíl pacientů s novými lézemi a novými celkovými okluzemi.
Modifikace lipidových profilů
Primární hyperlipidémie (Fredricksonův typ lla a llb)
Bylo prokázáno, že ZOCOR je účinný při snižování celkového-C a LDL-C u heterozygotních familiárních a nefamiliárních forem hyperlipidemie a u smíšené hyperlipidemie. Maximální až téměř maximální odpovědi je obecně dosaženo během 4-6 týdnů a udržuje se během chronické terapie. ZOCOR významně snížil celkový-C, LDL-C, poměr celkový-C/HDL-C a poměr LDL-C/HDL-C; ZOCOR také snížil TG a zvýšil HDL-C (viz tabulka 5).
Hypertriglyceridémie (Fredricksonův typ LV)
Výsledky analýzy podskupin u 74 pacientů s hyperlipidémií typu lV ze 130 pacientů, dvojitě zaslepené, placebem kontrolované, 3-dobé zkřížené studie jsou uvedeny v tabulce 6.
Dysbetalipoproteinémie (Fredricksonův typ III)
Výsledky analýzy podskupin u 7 pacientů s hyperlipidemií typu III (dysbetalipoproteinemie) (apo E2/2) (VLDL-C/TG>0,25) ze 130 pacientů, dvojitě zaslepené, placebem kontrolované, 3dobé zkřížené studie jsou uvedeny v tabulce 7.
Homozygotní familiární hypercholesterolémie
V kontrolované klinické studii dostávalo 12 pacientů ve věku 15-39 let s homozygotní familiární hypercholesterolémií simvastatin 40 mg/den v jedné dávce nebo ve 3 dílčích dávkách nebo 80 mg/den ve 3 dílčích dávkách. U 11 pacientů se snížením LDL-C byly průměrné změny LDL-C pro dávky 40 a 80 mg 14 % (rozsah 8 % až 23 %, medián 12 %) a 30 % (rozmezí 14 % až 46 % , medián 29 %), resp. U jednoho pacienta došlo ke zvýšení LDL-C o 15 %. U dalšího pacienta s chybějící funkcí receptoru LDL-C došlo při dávce 80 mg ke snížení LDL-C o 41 %.
Endokrinní funkce
klinických studiích simvastatin nezhoršil adrenální rezervu ani významně nesnížil bazální plazmatickou koncentraci kortizolu. V klinických studiích se simvastatinem bylo pozorováno malé snížení bazální hodnoty testosteronu v plazmě u mužů oproti výchozím hodnotám, tento účinek byl rovněž pozorován u jiných statinů a sekvestrantu žlučových kyselin cholestyraminu. Nebyl žádný účinek na plazmatické hladiny gonadotropinu. V placebem kontrolované, 12týdenní studii nebyl zjištěn žádný významný účinek simvastatinu 80 mg na odpověď plazmatického testosteronu na lidský choriový gonadotropin. V další 24týdenní studii neměl simvastatin 20-40 mg žádný detekovatelný účinek na spermatogenezi. Ve studii 4S, kde bylo 4 444 pacientů randomizováno k simvastatinu 20-40 mg/den nebo placebu po střední dobu trvání 5,4 roku, se výskyt nežádoucích účinků mužského pohlaví v obou léčebných skupinách významně nelišil. Vzhledem k těmto faktorům je nepravděpodobné, že by malé změny plazmatického testosteronu byly klinicky významné. Účinky, pokud nějaké, na hypofýzně-gonadální osu u premenopauzálních žen nejsou známy.
Klinické studie u dospívajících
Ve dvojitě zaslepené, placebem kontrolované studii bylo 175 pacientů (99 dospívajících chlapců a 76 postmenarchálních dívek) ve věku 10-17 let (průměrný věk 14,1 let) s heterozygotní familiární hypercholesterolemií (HeFH) randomizováno k simvastatinu (n= 106) nebo placebo (n=67) po dobu 24 týdnů (základní studie). Zařazení do studie vyžadovalo výchozí hladinu LDL-C mezi 160 a 400 mg/dl a alespoň jednoho rodiče s hladinou LDL-C >189 mg/dl. Dávka simvastatinu (jednou denně večer) byla 10 mg po dobu prvních 8 týdnů, 20 mg po dobu druhých 8 týdnů a poté 40 mg. V 24týdenním prodloužení se 144 pacientů rozhodlo pokračovat v léčbě simvastatinem 40 mg nebo placebem.
ZOCOR 20 mg významně snížil plazmatické hladiny celkového-C, LDL-C a Apo B (viz tabulka 8). Výsledky z prodloužení po 48 týdnech byly srovnatelné s výsledky pozorovanými v základní studii.
Po 24 týdnech léčby byla průměrná dosažená hodnota LDL-C 124,9 mg/dl (rozmezí: 64,0289,0 mg/dl) ve skupině ZOCOR 40 mg ve srovnání s 207,8 mg/dl (rozmezí: 128,0-334,0 mg/dl) ve skupině s placebem.
Bezpečnost a účinnost dávek nad 40 mg denně nebyla u dětí s HeFH studována. Dlouhodobá účinnost léčby simvastatinem v dětství na snížení morbidity a mortality v dospělosti nebyla stanovena.
INFORMACE PRO PACIENTA
Pacienti by měli být poučeni, aby dodržovali doporučenou dietu v Národním programu Cholesterol Education Program (NCEP), pravidelný cvičební program a pravidelné testování lipidového panelu nalačno.
Pacienti by měli být poučeni o látkách, které by neměli užívat současně se simvastatinem [vidět KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Pacientům je také třeba doporučit, aby informovali ostatní zdravotnické pracovníky, kteří předepisují nový lék nebo zvyšují dávku stávajícího léku, že užívají ZOCOR.
Bolest svalů
Všichni pacienti zahajující léčbu přípravkem ZOCOR by měli být informováni o riziku myopatie, včetně rhabdomyolýzy, a měli by být poučeni, aby neprodleně hlásili jakoukoli nevysvětlitelnou svalovou bolest, citlivost nebo slabost, zvláště pokud jsou doprovázeny malátností nebo horečkou nebo pokud tyto svalové známky nebo příznaky přetrvávají i po přerušení léčby přípravkem ZOCOR. Pacienti užívající dávku 80 mg by měli být informováni, že riziko myopatie, včetně rhabdomyolýzy, se při použití dávky 80 mg zvyšuje. Riziko myopatie, včetně rhabdomyolýzy, vyskytující se při užívání přípravku ZOCOR 40 mg, se zvyšuje při užívání určitých typů léků nebo konzumaci grapefruitové šťávy. Pacienti by měli všechny léky na předpis i volně prodejné probrat se svým zdravotníkem.
Jaterní enzymy
Před zahájením léčby přípravkem ZOCOR 20 mg a poté, pokud je to klinicky indikováno, se doporučuje provést jaterní testy. Všichni pacienti léčení přípravkem ZOCOR by měli být poučeni, aby neprodleně hlásili jakékoli příznaky, které mohou naznačovat poškození jater, včetně únavy, anorexie, diskomfortu v pravé horní části břicha, tmavé moči nebo žloutenky.
Těhotenství
Ženám ve fertilním věku by mělo být doporučeno používat účinnou metodu antikoncepce k zabránění otěhotnění během používání přípravku ZOCOR. Diskutujte s pacientkami o budoucích těhotenských plánech a prodiskutujte, kdy přestat užívat ZOCOR 40 mg, pokud se snaží otěhotnět. Pacientky je třeba upozornit, že pokud otěhotní, měly by přestat užívat přípravek ZOCOR a zavolat svému lékaři.
Kojení
Kojící ženy by ZOCOR neměly používat. Pacientky, které mají poruchu lipidů a kojí, by měly být poučeny, aby prodiskutovaly možnosti se svým lékařem.
