Tricor 160mg, 200mg Fenofibrate Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Tricor a jak se používá?
Tricor je lék na předpis používaný k léčbě snížení příznaků cholesterolu a triglyceridů (mastných kyselin) v krvi. Tricor lze užívat samostatně nebo s jinými léky.
- Tricor patří do třídy léků zvaných Fibric Acid Agents.
- Není známo, zda je přípravek Tricor 200 mg bezpečný a účinný u dětí
Jaké jsou možné vedlejší účinky přípravku Tricor?
Tricor 200 mg může způsobit závažné nežádoucí účinky, včetně:
- ostrá bolest žaludku šířící se do zad nebo lopatky,
- ztráta chuti k jídlu,
- bolest žaludku jen po jídle,
- zežloutnutí kůže nebo očí (žloutenka),
- horečka,
- zimnice,
- slabost,
- bolest krku,
- vředy v ústech,
- neobvyklé modřiny nebo krvácení,
- bolest na hrudi,
- náhlý kašel,
- sípání,
- zrychlené dýchání,
- vykašlávání krve a
- otok, teplo nebo zarudnutí v paži nebo noze
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Tricor patří:
- rýma,
- kýchání a
- abnormální laboratorní testy
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Tricor. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
TRICOR (fenofibrátové tablety) je činidlo regulující lipidy dostupné jako tablety pro perorální podání. Jedna tableta obsahuje 54 mg nebo 160 mg fenofibrátu. Chemický název fenofibrátu je 1-methylethylester kyseliny 2-[4-(4-chlorbenzoyl)fenoxy]-2-methylpropanové s následujícím strukturním vzorcem:
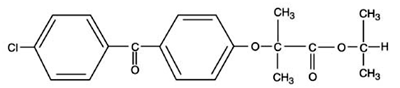
Empirický vzorec je C20H21O4Cl a molekulová hmotnost je 360,83; fenofibrát je nerozpustný ve vodě. Teplota tání je 79-82 °C. Fenofibrát je bílá pevná látka, která je za běžných podmínek stabilní.
Neaktivní ingredience
Každá tableta obsahuje koloidní oxid křemičitý, krospovidon, monohydrát laktózy, lecitin, mikrokrystalickou celulózu, polyvinylalkohol, povidon, laurylsulfát sodný, stearylfumarát sodný, mastek, oxid titaničitý a xanthanovou gumu. Jednotlivé 54mg tablety navíc obsahují D&C Yellow č. 10, FD&C Yellow č. 6, FD&C Blue č. 2.
INDIKACE
Primární hypercholesterolémie nebo smíšená dyslipidémie
TRICOR je indikován jako přídatná léčba k dietě ke snížení zvýšeného cholesterolu v lipoproteinech s nízkou hustotou (LDL-C), celkového cholesterolu (Total-C), triglyceridů a apolipoproteinu B (Apo B) a ke zvýšení cholesterolu v lipoproteinech s vysokou hustotou (HDL- C) u dospělých pacientů s primární hypercholesterolémií nebo smíšenou dyslipidémií.
Těžká hypertriglyceridémie
TRICOR 200 mg je také indikován jako přídatná léčba k dietě k léčbě dospělých pacientů s těžkou hypertriglyceridémií. Zlepšení kontroly glykémie u diabetických pacientů s chylomikronémií nalačno obvykle odstraní potřebu farmakologické intervence.
Výrazně zvýšené hladiny sérových triglyceridů (např. > 2 000 mg/dl) mohou zvýšit riziko rozvoje pankreatitidy. Vliv léčby fenofibrátem na snížení tohoto rizika nebyl dostatečně studován.
Důležitá omezení použití
Fenofibrát v dávce ekvivalentní 145 mg přípravku TRICOR neprokázal snížení morbidity a mortality na ischemickou chorobu srdeční ve velké, randomizované kontrolované studii u pacientů s diabetes mellitus 2. VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
DÁVKOVÁNÍ A PODÁVÁNÍ
Obecné úvahy
Před podáním přípravku TRICOR 160 mg by pacienti měli být nasazeni na vhodnou dietu snižující lipidy a během léčby přípravkem TRICOR by v této dietě měli pokračovat. Tablety TRICOR lze podávat bez ohledu na jídlo.
Počáteční léčba dyslipidémie je dietní terapie specifická pro typ lipoproteinové abnormality. Nadměrná tělesná hmotnost a nadměrný příjem alkoholu mohou být důležitými faktory hypertriglyceridémie a měly by být řešeny před jakoukoli farmakoterapií. Tělesné cvičení může být důležitým pomocným opatřením. Nemoci přispívající k hyperlipidémii, jako je hypotyreóza nebo diabetes mellitus, by měly být vyhledány a adekvátně léčeny. Estrogenová terapie, thiazidová diuretika a betablokátory jsou někdy spojeny s masivním zvýšením plazmatických triglyceridů, zejména u subjektů s familiární hypertriglyceridemií. V takových případech může přerušení podávání specifického etiologického činidla odstranit potřebu specifické medikamentózní terapie hypertriglyceridémie.
Hladiny lipidů by měly být pravidelně monitorovány a mělo by se zvážit snížení dávkování přípravku TRICOR, pokud hladiny lipidů významně klesnou pod cílový rozsah.
Léčba by měla být vysazena u pacientů, kteří nedosáhli adekvátní odpovědi po dvou měsících léčby maximální doporučenou dávkou 145 mg jednou denně.
Primární hypercholesterolémie nebo smíšená dyslipidémie
Počáteční dávka přípravku TRICOR 200 mg je 145 mg jednou denně.
Těžká hypertriglyceridémie
Počáteční dávka je 48 až 145 mg denně. Dávkování by mělo být individualizováno podle odpovědi pacienta a mělo by být v případě potřeby upraveno po opakovaném stanovení lipidů ve 4 až 8 týdenních intervalech. Maximální dávka je 145 mg jednou denně.
Porucha funkce ledvin
Léčba přípravkem TRICOR 200 mg by měla být zahájena dávkou 48 mg denně u pacientů s mírnou až středně těžkou poruchou funkce ledvin a měla by být zvýšena pouze po vyhodnocení účinků na funkci ledvin a hladiny lipidů při této dávce. U pacientů s těžkou poruchou funkce ledvin je třeba se vyhnout použití přípravku TRICOR (viz Použití u konkrétních populací a KLINICKÁ FARMAKOLOGIE ].
Geriatričtí pacienti
Výběr dávky pro starší osoby by měl být proveden na základě funkce ledvin [viz Použití u konkrétních populací ].
JAK DODÁVÁNO
Dávkové formy A Síly
- 48 mg žluté tablety s potiskem identifikačního kódu „FI“.
- 48 mg žluté tablety s potiskem loga „a“ a identifikačních písmen kódu „FI“.
- 145 mg bílé tablety s potiskem identifikačního kódu „FO“.
- 145 mg bílé tablety s potiskem loga „a“ a identifikačních písmen kódu „FO“.
Skladování A Manipulace
TRICOR® (fenofibrátové tablety) je k dispozici ve dvou silách:
48 mg
Žluté tablety s potiskem identifikačního kódu „FI“, dostupné v lahvičkách po 90 ( NDC 0074-3173-90).
Žluté tablety s potiskem loga „a“ a identifikačních písmen kódu „FI“, dostupné v lahvičkách po 90 ( NDC 0074-6122-90).
145 mg
Bílé tablety s potiskem identifikačního kódu „FO“, dostupné v lahvičkách po 90 ( NDC 0074-3189-90).
Bílé tablety s potiskem loga „a“ a identifikačních písmen kódu „FO“, dostupné v lahvičkách po 90 ( NDC 0074-6123-90).
Úložný prostor
Skladujte při teplotě 25 °C (77 °F); povoleny výchylky do 15-30°C (59-86°F).
[Viz USP Regulovaná pokojová teplota]. Udržujte mimo dosah dětí. Chraňte před vlhkostí.
Vyrobeno pro AbbVie Inc., North Chicago, IL 60064, USA společností Fournier Laboratories Ireland Limited, Anngrove, Carrigtwohill Co. Cork, Irsko. Revize: březen 2021
VEDLEJŠÍ EFEKTY
Následující závažné nežádoucí účinky jsou popsány níže a jinde v označení:
- Mortalita a nemocnost ischemické choroby srdeční [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hepatoxicita [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Pankreatitida [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hypersenzitivní reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Venotromboembolická nemoc [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Protože klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Nežádoucí účinky hlášené 2 % nebo více pacientů léčených fenofibrátem (a více než placebo) během dvojitě zaslepených, placebem kontrolovaných studií, bez ohledu na kauzalitu, jsou uvedeny v tabulce 1 níže. Nežádoucí účinky vedly k přerušení léčby u 5,0 % pacientů léčených fenofibrátem au 3,0 % pacientů léčených placebem. Nejčastějšími příhodami bylo zvýšení jaterních testů, které ve dvojitě zaslepených studiích způsobilo přerušení léčby fenofibrátem u 1,6 % pacientů.
V kontrolovaných studiích byla kopřivka pozorována u 1,1 % vs. 0 % a vyrážka u 1,4 % vs. 0,8 % pacientů s fenofibrátem a placebem.
Zvýšení jaterních enzymů
V souhrnné analýze 10 placebem kontrolovaných studií došlo ke zvýšení ALT na > 3násobek horní hranice normálu u 5,3 % pacientů užívajících fenofibrát v dávkách ekvivalentních 96 mg až 145 mg přípravku TRICOR denně oproti 1,1 % pacientů léčených placebem [vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. V 8týdenní studii byla incidence zvýšení ALT nebo AST ≥ 3násobku horní hranice normálu 13 % u pacientů užívajících dávky odpovídající 96 mg až 145 mg přípravku TRICOR denně a 0 % u pacientů užívajících dávky odpovídající 48 mg nebo méně TRICOR denně nebo placebo.
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během postregistračního použití fenofibrátu. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku: myalgie, rhabdomyolýza, pankreatitida, akutní selhání ledvin, svalové křeče, hepatitida, cirhóza, zvýšená celkový bilirubin, anémie, artralgie, pokles hemoglobinu, pokles hematokritu, pokles počtu bílých krvinek, astenie, těžce snížené hladiny HDL-cholesterolu a intersticiální plicní onemocnění. Fotosenzitivní reakce se objevily dny až měsíce po zahájení; v některých z těchto případů pacienti hlásili předchozí fotosenzitivní reakci na ketoprofen.
DROGOVÉ INTERAKCE
Kumarinové antikoagulanty
Při prodloužení PT/INR byla pozorována potenciace antikoagulačních účinků kumarinového typu.
Při podávání kumarinových antikoagulancií spolu s přípravkem TRICOR je třeba opatrnosti. Dávkování antikoagulancií by mělo být sníženo, aby se PT/INR udržely na požadované úrovni, aby se předešlo krvácivým komplikacím. Doporučuje se časté stanovení PT/INR, dokud nebude definitivně stanoveno, že se PT/INR stabilizoval [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Imunosupresiva
Imunosupresiva, jako je cyklosporin a takrolimus, mohou způsobit nefrotoxicitu se snížením clearance kreatininu a zvýšením sérového kreatininu, a protože vylučování ledvinami je primární cestou eliminace fibrátových léků včetně přípravku TRICOR, existuje riziko, že interakce povede ke zhoršení funkce ledvin. Je třeba pečlivě zvážit přínosy a rizika používání přípravku TRICOR (tablety fenofibrátu) s imunosupresivy a jinými potenciálně nefrotoxickými látkami a použít nejnižší účinnou dávku a monitorovat funkci ledvin.
Pryskyřice vázající žlučové kyseliny
Protože pryskyřice vázající žlučové kyseliny mohou vázat jiné léky podávané současně, pacienti by měli užívat TRICOR 200 mg alespoň 1 hodinu před nebo 4 až 6 hodin po pryskyřici vázající žlučové kyseliny, aby se zabránilo narušení její absorpce.
kolchicin
U fenofibrátů podávaných současně s kolchicinem byly hlášeny případy myopatie, včetně rhabdomyolýzy, a při předepisování fenofibrátu s kolchicinem je třeba postupovat opatrně.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Mortalita A Koronární Onemocnění Srdce
Účinek přípravku TRICOR 160 mg na morbiditu a mortalitu ischemické choroby srdeční a nekardiovaskulární mortalitu nebyl stanoven.
Studie Action to Control Cardiovascular Risk in Diabetes Lipid (ACCORD Lipid) byla randomizovaná placebem kontrolovaná studie s 5 518 pacienty s diabetes mellitus 2. typu na základní terapii statiny léčenými fenofibrátem. Průměrná doba sledování byla 4,7 roku. Kombinovaná léčba fenofibrátem a statinem prokázala nesignifikantní 8% snížení relativního rizika v primárním výsledku hlavních nežádoucích kardiovaskulárních příhod (MACE), což je kompozit nefatálního infarktu myokardu, nefatální cévní mozkové příhody a úmrtí na kardiovaskulární onemocnění (poměr rizik [ HR] 0,92, 95% CI 0,79-1,08) (p=0,32) ve srovnání s monoterapií statiny. V analýze podskupin podle pohlaví byl poměr rizik pro MACE u mužů léčených kombinovanou terapií oproti monoterapii statiny 0,82 (95% CI 0,69-0,99) a poměr rizik pro MACE u žen léčených kombinovanou terapií oproti monoterapii statiny byl 1,38 (95% CI 0,98-1,94) (interakce p=0,01). Klinický význam tohoto nálezu podskupiny není jasný.
Studie Fenofibrate Intervention and Event Lowering in Diabetes (FIELD) byla 5letá randomizovaná placebem kontrolovaná studie s 9 795 pacienty s diabetes mellitus 2. typu léčených fenofibrátem. Fenofibrát prokázal nevýznamné 11% relativní snížení primárního výsledku koronárních onemocnění srdce (poměr rizika [HR] 0,89, 95% CI 0,75-1,05, p=0,16) a významné 11% snížení sekundárního výsledku celkových příhody kardiovaskulárního onemocnění (HR 0,89 [0,80-0,99], p=0,04). U fenofibrátu došlo k nesignifikantnímu 11% (HR 1,11 [0,95, 1,29], p=0,18) a 19% (HR 1,19 [0,90, 1,57], p=0,22) zvýšení celkové a ICHS. ve srovnání s placebem.
Vzhledem k chemickým, farmakologickým a klinickým podobnostem mezi přípravkem TRICOR (tablety fenofibrátu), klofibrátem a gemfibrozilem se nežádoucí nálezy ve 4 velkých randomizovaných, placebem kontrolovaných klinických studiích s těmito dalšími fibrátovými léky mohou vztahovat také na přípravek TRICOR.
Coronary Drug Project, rozsáhlé studii pacientů po infarktu myokardu léčených klofibrátem po dobu 5 let, nebyl mezi skupinou s klofibrátem a skupinou s placebem žádný rozdíl v mortalitě. Mezi těmito dvěma skupinami však byl rozdíl v četnosti cholelitiázy a cholecystitidy vyžadující chirurgický zákrok (3,0 % vs. 1,8 %).
Ve studii provedené Světovou zdravotnickou organizací (WHO) bylo 5 000 subjektů bez známého onemocnění koronárních tepen léčeno placebem nebo klofibrátem po dobu 5 let a následně sledováni po dobu dalšího jednoho roku. Ve skupině s klofibrátem byla statisticky významná vyšší mortalita ze všech příčin upravená podle věku ve srovnání se skupinou s placebem (5,70 % vs. 3,96 %, p =
Helsinki Heart Study byla rozsáhlá (n=4081) studie mužů středního věku bez anamnézy ischemické choroby srdeční. Subjekty dostávaly buď placebo nebo gemfibrozil po dobu 5 let s 3,5letým otevřeným prodloužením. Celková mortalita byla numericky vyšší v randomizované skupině s gemfibrozilem, ale nedosáhla statistické významnosti (p = 0,19, 95% interval spolehlivosti pro relativní riziko G:P = 0,91-1,64). Ačkoli úmrtí na rakovinu měla vyšší trend ve skupině s gemfibrozilem (p = 0,11), rakovina (s výjimkou bazaliomu) byla diagnostikována se stejnou frekvencí v obou studijních skupinách. Vzhledem k omezené velikosti studie nebylo prokázáno, že by se relativní riziko úmrtí z jakékoli příčiny lišilo od toho, které bylo pozorováno v datech 9letého sledování ze studie Světové zdravotnické organizace (RR=1,29).
Sekundární preventivní složka Helsinské srdeční studie zahrnovala muže středního věku, kteří byli vyloučeni ze studie primární prevence kvůli známé nebo suspektní ischemické chorobě srdeční. Subjekty dostávaly gemfibrozil nebo placebo po dobu 5 let. Ačkoli srdeční úmrtí měla vyšší trend ve skupině s gemfibrozilem, nebylo to statisticky významné (poměr rizika 2,2, 95% interval spolehlivosti: 0,94-5,05). Četnost operací žlučníku nebyla mezi studijními skupinami statisticky významná, ale měla vyšší trend ve skupině s gemfibrozilem (1,9 % vs. 0,3 %, p = 0,07).
Hepatotoxicita
Po uvedení přípravku TRICOR na trh bylo hlášeno závažné poškození jater vyvolané léky (DILI), včetně transplantace jater a úmrtí. DILI byla hlášena během prvních několika týdnů léčby nebo po několika měsících léčby a v některých případech ustoupila po přerušení léčby přípravkem TRICOR 200 mg. Pacienti s DILI zaznamenali známky a příznaky včetně tmavé moči, abnormální stolice, žloutenky, malátnosti, bolesti břicha, myalgie, úbytku hmotnosti, svědění a nevolnosti. Mnoho pacientů mělo souběžné zvýšení celkového bilirubinu, sérové alanintransaminázy (ALT) a aspartáttransaminázy (AST). DILI byla charakterizována jako hepatocelulární, chronická aktivní a cholestatická hepatitida a cirhóza se vyskytla ve spojení s chronickou aktivní hepatitidou.
V klinických studiích byl fenofibrát v dávkách ekvivalentních 96 mg až 145 mg přípravku TRICOR 160 mg denně spojen se zvýšením AST nebo ALT v séru. Výskyt zvýšení transamináz může souviset s dávkou [viz NEŽÁDOUCÍ REAKCE ].
TRICOR 160 mg je kontraindikován u pacientů s aktivním onemocněním jater, včetně pacientů s primární biliární cirhózou a nevysvětlitelnými přetrvávajícími abnormalitami jaterních funkcí (viz KONTRAINDIKACE ]. Monitorujte jaterní funkce pacienta, včetně sérových ALT, AST a celkového bilirubinu, na začátku a pravidelně po dobu trvání léčby přípravkem TRICOR. Přerušte léčbu přípravkem TRICOR 200 mg, pokud se rozvinou známky nebo příznaky poškození jater nebo pokud přetrvávají zvýšené hladiny enzymů (ALT nebo AST > 3násobek horní hranice normálu nebo pokud je doprovázeno zvýšením bilirubinu). U těchto pacientů znovu nezačínejte přípravek TRICOR 160 mg, pokud neexistuje alternativní vysvětlení poškození jater.
Myopatie a rabdomyolýza
Fibráty zvyšují riziko myopatie a jsou spojovány s rhabdomyolýzou. Zdá se, že riziko závažné svalové toxicity je zvýšené u starších pacientů au pacientů s diabetem, renální insuficiencí nebo hypotyreózou.
Myopatie by měla být zvážena u každého pacienta s difuzními myalgiemi, svalovou citlivostí nebo slabostí a/nebo výrazným zvýšením hladin kreatinfosfokinázy (CPK).
Pacienti by měli být poučeni, aby okamžitě hlásili nevysvětlitelnou svalovou bolest, citlivost nebo slabost, zvláště pokud jsou doprovázeny malátností nebo horečkou. U pacientů, kteří uvádějí tyto příznaky, by měly být vyhodnoceny hladiny CPK a léčba přípravkem TRICOR 200 mg by měla být přerušena, pokud se objeví výrazně zvýšené hladiny CPK nebo je podezření na myopatii/myositidu nebo je diagnostikována.
Údaje z observačních studií naznačují, že riziko rhabdomyolýzy se zvyšuje, pokud jsou fibráty, zejména gemfibrozil, podávány současně se statinem. Kombinaci je třeba se vyhnout, pokud přínos z dalších změn hladin lipidů pravděpodobně nepřeváží zvýšené riziko této kombinace léků (viz KLINICKÁ FARMAKOLOGIE ].
fenofibrátů podávaných současně s kolchicinem byly hlášeny případy myopatie, včetně rhabdomyolýzy, a při předepisování fenofibrátu s kolchicinem je třeba postupovat opatrně (viz DROGOVÉ INTERAKCE ].
Sérového kreatininu
U pacientů užívajících fenofibrát bylo hlášeno zvýšení sérového kreatininu. Tato zvýšení mají tendenci se vracet na výchozí hodnoty po vysazení fenofibrátu. Klinický význam těchto pozorování není znám. Monitorujte funkci ledvin u pacientů s poruchou funkce ledvin, kteří užívají přípravek TRICOR. U pacientů užívajících přípravek TRICOR s rizikem renální insuficience, jako jsou starší pacienti a pacienti s diabetem, by se mělo zvážit také monitorování ledvin.
Cholelitiáza
Fenofibrát, stejně jako klofibrát a gemfibrozil, může zvýšit vylučování cholesterolu do žluči, což vede k cholelitiáze. Při podezření na cholelitiázu jsou indikovány studie žlučníku. Pokud se objeví žlučové kameny, léčba přípravkem TRICOR 160 mg by měla být přerušena.

Kumarinové antikoagulanty
Při podávání kumarinových antikoagulancií společně s přípravkem TRICOR 160 mg je třeba opatrnosti, protože zesiluje antikoagulační účinky kumarinového typu při prodloužení protrombinového času/mezinárodního normalizovaného poměru (PT/INR). K prevenci krvácivých komplikací se doporučuje časté sledování PT/INR a úprava dávky antikoagulancia, dokud se PT/INR nestabilizuje [viz DROGOVÉ INTERAKCE ].
Pankreatitida
Pankreatitida byla hlášena u pacientů užívajících fenofibrát, gemfibrozil a klofibrát. Tento výskyt může představovat selhání účinnosti u pacientů s těžkou hypertriglyceridémií, přímý účinek léku nebo sekundární jev zprostředkovaný kameny v žlučových cestách nebo tvorbou kalu s obstrukcí společného žlučovodu.
Hematologické změny
Po zahájení léčby fenofibrátem byl u pacientů pozorován mírný až střední pokles hemoglobinu, hematokritu a bílých krvinek. Tyto hladiny se však během dlouhodobého podávání stabilizují. U jedinců léčených fenofibrátem byly hlášeny trombocytopenie a agranulocytóza. Během prvních 12 měsíců podávání přípravku TRICOR se doporučuje pravidelné sledování počtu červených a bílých krvinek.
Hypersenzitivní reakce
Akutní přecitlivělost
Po uvedení fenofibrátu na trh byly hlášeny anafylaxe a angioedém. V některých případech byly reakce život ohrožující a vyžadovaly okamžitou léčbu. Pokud se u pacienta objeví známky nebo příznaky akutní hypersenzitivní reakce, doporučte mu, aby okamžitě vyhledal lékařskou pomoc a fenofibrát přerušil.
Zpožděná přecitlivělost
Po uvedení na trh byly hlášeny závažné kožní nežádoucí účinky (SCAR), včetně Stevens-Johnsonova syndromu, toxické epidermální nekrolýzy a lékové reakce s eozinofilií a systémovými příznaky (DRESS), objevující se dny až týdny po zahájení léčby fenofibrátem. Případy DRESS byly spojeny s kožními reakcemi (jako je vyrážka nebo exfoliativní dermatitida) a kombinací eozinofilie, horečky, postižení systémových orgánů (ledvin, jater nebo dýchacích cest). Při podezření na SCAR přerušte podávání fenofibrátu a odpovídajícím způsobem léčte pacienty.
Venotromboembolická nemoc
Ve studii FIELD byly plicní embolie (PE) a hluboká žilní trombóza (DVT) pozorovány ve vyšší míře ve skupině léčené fenofibrátem než ve skupině léčené placebem. Z 9 795 pacientů zařazených do FIELD bylo 4 900 ve skupině s placebem a 4 895 ve skupině s fenofibrátem. U DVT bylo 48 příhod (1 %) ve skupině s placebem a 67 (1 %) ve skupině s fenofibrátem (p = 0,074); au PE bylo 32 (0,7 %) příhod ve skupině s placebem a 53 (1 %) ve skupině s fenofibrátem (p = 0,022).
V Coronary Drug Project zaznamenala větší část skupiny užívající klofibráty definitivní nebo suspektní fatální nebo nefatální plicní embolii nebo tromboflebitidu než skupina s placebem (5,2 % vs. 3,3 % po pěti letech; p
Paradoxní pokles hladiny HDL cholesterolu
Po uvedení na trh a v klinických studiích byly hlášeny závažné poklesy hladin HDL cholesterolu (až o 2 mg/dl), ke kterým došlo u diabetických a nediabetických pacientů, kteří zahájili léčbu fibráty. Pokles HDL-C se odráží v poklesu apolipoproteinu A1. Bylo hlášeno, že k tomuto poklesu došlo během 2 týdnů až let po zahájení léčby fibráty. Hladiny HDL-C zůstávají snížené až do ukončení léčby fibráty; odpověď na vysazení fibrátové terapie je rychlá a trvalá. Klinický význam tohoto poklesu HDL-C není znám. Hladiny HDL-C se doporučuje kontrolovat během prvních měsíců po zahájení léčby fibráty. Pokud je zjištěna závažně snížená hladina HDL-C, léčba fibráty by měla být vysazena a hladina HDL-C monitorována, dokud se nevrátí na výchozí hodnotu, a léčba fibráty by neměla být znovu zahájena.
Neklinická toxikologie
Karcinogeneze a mutageneze a poškození plodnosti
fenofibrátem byly provedeny dvě dietní studie karcinogenity u potkanů. V první 24měsíční studii byl potkanům Wistar podáván fenofibrát v dávce 10, 45 a 200 mg/kg/den, což je přibližně 0,3, 1 a 6násobek maximální doporučené dávky pro člověka (MRHD) 300 mg fenofibrátu denně, což odpovídá 145 mg TRICOR 160 mg denně, na základě srovnání plochy povrchu těla. Při dávce 200 mg/kg/den (při 6násobku MRHD) byl výskyt jaterních karcinomů významně zvýšen u obou pohlaví. Statisticky významný nárůst karcinomů pankreatu byl pozorován u mužů při 1 a 6násobku MRHD; u mužů bylo pozorováno zvýšení pankreatických adenomů a benigních testikulárních intersticiálních buněčných nádorů na 6násobku MRHD. Ve druhé 24měsíční studii karcinogenity na potkanech u jiného kmene potkanů (Sprague-Dawley) vyvolaly dávky 10 a 60 mg/kg/den (0,3 a 2násobek MRHD) významné zvýšení výskytu pankreatických acinárních adenomů v obou pohlaví a zvýšení počtu nádorů testikulárních intersticiálních buněk u mužů na dvojnásobek MRHD.
Byla provedena 117týdenní studie karcinogenity na potkanech srovnávající tři léky: fenofibrát 10 a 60 mg/kg/den (0,3 a 2násobek MRHD, na základě srovnání plochy povrchu těla), klofibrát (400 mg/kg/den; 2krát dávka pro člověka) a gemfibrozil (250 mg/kg/den; 2násobek dávky pro člověka, vztaženo na mg/m² plochy povrchu). Fenofibrát zvýšil pankreatické acinární adenomy u obou pohlaví. Klofibrát zvýšil výskyt hepatocelulárního karcinomu a pankreatických acinárních adenomů u mužů a jaterních neoplastických uzlin u žen. Gemfibrozil zvýšil jaterní neoplastické uzliny u mužů a žen, zatímco všechny tři léky zvýšily výskyt nádorů testikulárních intersticiálních buněk u mužů.
Ve 21měsíční studii na myších CF-1 fenofibrát v dávkách 10, 45 a 200 mg/kg/den (přibližně 0,2, 1 a 3násobek MRHD, na základě srovnání plochy povrchu těla) významně zvýšil výskyt karcinomů jater u obou pohlaví na 3násobku MRHD. Ve druhé 18měsíční studii při dávkách 10, 60 a 200 mg/kg/den fenofibrát významně zvýšil jaterní karcinomy u samců myší a jaterní adenomy u myších samic na 3násobek MRHD.
Studie elektronové mikroskopie prokázaly peroxizomální proliferaci po podání fenofibrátu potkanům. Nebyla provedena adekvátní studie pro testování proliferace peroxisomů u lidí, ale změny v morfologii a počtu peroxisomů byly pozorovány u lidí po léčbě jinými členy třídy fibrátů, když byly biopsie jater porovnány před a po léčbě u stejného jedince.
Ukázalo se, že fenofibrát nemá mutagenní potenciál v následujících testech: Ames, myší lymfom, chromozomální aberace a neplánovaná syntéza DNA v primárních potkaních hepatocytech.
Ve studiích fertility byly potkanům podávány perorální dietní dávky fenofibrátu, samci dostávali 61 dní před pářením a samice 15 dní před pářením až do odstavení, což nemělo žádný nepříznivý účinek na plodnost při dávkách až 300 mg/kg/den (10krát vyšší než MRHD na základě srovnání plochy povrchu těla).
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
Omezené dostupné údaje o použití fenofibrátu u těhotných žen jsou nedostatečné pro stanovení rizika závažných vrozených vad, potratu nebo nepříznivých mateřských nebo fetálních rizik spojených s užíváním léků. V reprodukčních studiích na zvířatech nebyly pozorovány žádné známky embryo-fetální toxicity při perorálním podávání fenofibrátu potkanům a králíkům během organogeneze v dávkách nižších nebo ekvivalentních maximální doporučené klinické dávce 145 mg denně, na základě tělesného povrchu (mg/ m²). Nežádoucí účinky na reprodukci se objevily při vyšších dávkách v přítomnosti mateřské toxicity (viz Data ). TRICOR 200 mg by měl být během těhotenství podáván pouze v případě, že potenciální přínos ospravedlňuje potenciální riziko pro plod.
Odhadované základní riziko závažných vrozených vad a potratu pro indikovanou populaci není známo. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2–4 % a 15–20 %.
Data
Údaje o zvířatech
březích samic potkanů, kterým byly perorálně podávány dietní dávky 14, 127 a 361 mg/kg/den od 6. do 15. dne březosti během období organogeneze, nebyly pozorovány žádné nežádoucí vývojové nálezy při dávce 14 mg/kg/den (méně než klinická expozice při maximální doporučené dávce pro člověka [MRHD] 300 mg fenofibrátu denně, což odpovídá 145 mg přípravku TRICOR denně, na základě srovnání plochy povrchu těla). Zvýšené malformace skeletu plodu byly pozorovány při dávkách toxických pro matku (361 mg/kg/den, což odpovídá 12násobku klinické expozice při MRHD), které významně potlačily přírůstek tělesné hmotnosti matky.
březích králíků, kterým byly orální sondou podávány dávky 15, 150 a 300 mg/kg/den od 618. dne březosti během období organogeneze a ponechány porodit, nebyly pozorovány žádné nepříznivé vývojové nálezy při dávce 15 mg/kg/den (dávka, která přibližuje klinickou expozici při MRHD na základě srovnání plochy povrchu těla). Potracené vrhy byly pozorovány při dávkách toxických pro matku (≥ 150 mg/kg/den, což odpovídá ≥ 10násobku klinické expozice při MRHD), které potlačovaly přírůstek tělesné hmotnosti matky.
březích potkanů, kterým byly perorálně podávány dietní dávky 15, 75 a 300 mg/kg/den od 15. dne březosti do 21. dne laktace (odstavení), nebyly při dávce 15 mg/kg/den (méně než klinická expozice) pozorovány žádné nežádoucí účinky na vývoj na MRHD, na základě srovnání plochy povrchu těla, navzdory mateřské toxicitě (snížený přírůstek hmotnosti). Postimplantační ztráta byla pozorována při ≥ 75 mg/kg/den (≥ 2násobek klinické expozice při MRHD) za přítomnosti mateřské toxicity (snížený přírůstek hmotnosti). Snížené přežití mláďat bylo zaznamenáno při dávce 300 mg/kg/den (10násobek klinické expozice při MRHD), což bylo spojeno se sníženým přírůstkem tělesné hmotnosti matky/zanedbáváním matky.
Laktace
Shrnutí rizik
Nejsou dostupné informace o přítomnosti fenofibrátu v mateřském mléce, o účincích léku na kojené dítě nebo o účincích na produkci mléka. Fenofibrát je přítomen v mléce potkanů, a proto je pravděpodobně přítomen v lidském mléce. Vzhledem k možnosti závažných nežádoucích reakcí u kojených dětí, jako je narušení metabolismu lipidů u kojenců, ženy by neměly kojit během léčby přípravkem TRICOR 200 mg a po dobu 5 dnů po poslední dávce (viz KONTRAINDIKACE ].
Pediatrické použití
Bezpečnost a účinnost nebyla u dětských pacientů stanovena.
Geriatrické použití
Je známo, že kyselina fenofibrová je v podstatě vylučována ledvinami a riziko nežádoucích reakcí na tento lék může být vyšší u pacientů s poruchou funkce ledvin. Expozice kyseliny fenofibrové není ovlivněna věkem. Vzhledem k tomu, že starší pacienti mají vyšší výskyt poruchy funkce ledvin, měla by být dávka pro starší osoby zvolena na základě funkce ledvin (viz DÁVKOVÁNÍ A PODÁVÁNÍ a KLINICKÁ FARMAKOLOGIE ]. Starší pacienti s normální funkcí ledvin by neměli vyžadovat žádné úpravy dávkování. Zvažte sledování renálních funkcí u starších pacientů užívajících TRICOR.
Renální poškození
Podávání přípravku TRICOR 160 mg je třeba se vyvarovat pacientům s těžkou poruchou funkce ledvin (viz KONTRAINDIKACE ]. Snížení dávky je nutné u pacientů s mírnou až středně těžkou poruchou funkce ledvin (viz DÁVKOVÁNÍ A PODÁVÁNÍ a KLINICKÁ FARMAKOLOGIE ]. U pacientů s poruchou funkce ledvin se doporučuje monitorování funkce ledvin.
Poškození jater
Použití přípravku TRICOR 200 mg nebylo hodnoceno u subjektů s poruchou funkce jater (viz KONTRAINDIKACE a KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
Neexistuje žádná specifická léčba předávkování přípravkem TRICOR. V případě předávkování je indikována obecná podpůrná péče o pacienta, včetně sledování vitálních funkcí a sledování klinického stavu. Pokud je to indikováno, eliminace nevstřebaného léku by měla být dosažena zvracením nebo výplachem žaludku; je třeba dodržovat obvyklá opatření k udržení dýchacích cest. Vzhledem k tomu, že kyselina fenofibrová je vysoce vázána na plazmatické proteiny, neměla by být zvažována hemodialýza.
KONTRAINDIKACE
TRICOR 200 mg je kontraindikován u:
- pacientů s těžkou poruchou funkce ledvin, včetně těch, kteří dostávají dialýzu [viz KLINICKÁ FARMAKOLOGIE ].
- pacientů s aktivním onemocněním jater, včetně pacientů s primární biliární cirhózou a nevysvětlitelnými přetrvávajícími abnormalitami jaterních funkcí (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- pacienti s již existujícím onemocněním žlučníku [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- kojící matky [viz Použití u konkrétních populací ].
- pacienti se známou přecitlivělostí na fenofibrát nebo kyselinu fenofibrovou [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Aktivní složkou přípravku TRICOR je kyselina fenofibrová. Farmakologické účinky kyseliny fenofibrové u zvířat i lidí byly rozsáhle studovány prostřednictvím perorálního podávání fenofibrátu.
Lipidy modifikující účinky kyseliny fenofibrové pozorované v klinické praxi byly vysvětleny in vivo u transgenních myší a in vitro v kulturách lidských hepatocytů aktivací receptoru α aktivovaného peroxisomovým proliferátorem (PPARα). Prostřednictvím tohoto mechanismu fenofibrát zvyšuje lipolýzu a eliminaci částic bohatých na triglyceridy z plazmy aktivací lipoproteinové lipázy a snížením produkce apoproteinu C-III (inhibitor aktivity lipoproteinové lipázy).
Výsledný pokles TG vede ke změně velikosti a složení LDL z malých, hustých částic (které jsou považovány za aterogenní kvůli jejich náchylnosti k oxidaci) na velké vznášející se částice. Tyto větší částice mají větší afinitu k receptorům cholesterolu a jsou rychle katabolizovány. Aktivace PPARα také indukuje zvýšení syntézy apolipoproteinů AI, A-II a HDL-cholesterolu.
Fenofibrát také snižuje hladiny kyseliny močové v séru u hyperurikemických a normálních jedinců zvýšením vylučování kyseliny močové močí.
Farmakodynamika
Různé klinické studie prokázaly, že zvýšené hladiny celkového-C, LDL-C a apo B, LDL membránového komplexu, jsou spojeny s lidskou aterosklerózou. Podobně snížené hladiny HDL-C a jeho transportního komplexu, apolipoproteinu A (apo AI a apo AII) jsou spojeny s rozvojem aterosklerózy. Epidemiologické výzkumy prokázaly, že kardiovaskulární morbidita a mortalita se mění přímo s hladinou celkového-C, LDL-C a TG a nepřímo s hladinou HDL-C. Nezávislý účinek zvýšení HDL-C nebo snížení triglyceridů (TG) na riziko kardiovaskulární morbidity a mortality nebyl stanoven.
Kyselina fenofibrová, aktivní metabolit fenofibrátu, způsobuje u léčených pacientů snížení celkového cholesterolu, LDL cholesterolu, apolipoproteinu B, celkových triglyceridů a lipoproteinu bohatého na triglyceridy (VLDL). Kromě toho léčba fenofibrátem vede ke zvýšení lipoproteinu s vysokou hustotou (HDL) a apolipoproteinů apoAI a apoAII.
Farmakokinetika
Plazmatické koncentrace kyseliny fenofibrové po podání tří 48mg nebo jedné 145mg tablet jsou za podmínek po jídle ekvivalentní jedné 200mg mikronizované tobolce fenofibrátu.
Fenofibrát je proléčivo aktivní chemické skupiny kyseliny fenofibrové. Fenofibrát se přeměňuje hydrolýzou esteru v těle na kyselinu fenofibrovou, která je aktivní složkou měřitelnou v oběhu.
Vstřebávání
Absolutní biologickou dostupnost fenofibrátu nelze určit, protože sloučenina je prakticky nerozpustná ve vodném médiu vhodném pro injekci. Fenofibrát se však dobře vstřebává z gastrointestinálního traktu. Po perorálním podání zdravým dobrovolníkům se přibližně 60 % jednotlivé dávky radioaktivně značeného fenofibrátu objevilo v moči, primárně jako kyselina fenofibrová a její glukuronátový konjugát, a 25 % bylo vyloučeno stolicí. Maximální plazmatické hladiny kyseliny fenofibrové se objevují během 6 až 8 hodin po podání.
Expozice kyselině fenofibrové v plazmě, měřená pomocí Cmax a AUC, se významně neliší, když je jedna dávka 145 mg fenofibrátu podána nalačno nebo bez lačnění.
Rozdělení
Při opakovaném podávání fenofibrátu je rovnovážného stavu kyseliny fenofibrové dosaženo do 9 dnů. Plazmatické koncentrace kyseliny fenofibrové v ustáleném stavu jsou přibližně dvojnásobné než po jedné dávce. Vazba na sérové proteiny byla přibližně 99 % u normálních a hyperlipidemických subjektů.
Metabolismus
Po perorálním podání je fenofibrát rychle hydrolyzován esterázami na aktivní metabolit, kyselinu fenofibrovou; v plazmě není detekován žádný nezměněný fenofibrát.
Kyselina fenofibrová je primárně konjugována s kyselinou glukuronovou a poté je vylučována močí. Malé množství kyseliny fenofibrové je redukováno na karbonylové části na benzhydrolový metabolit, který je naopak konjugován s kyselinou glukuronovou a vylučován močí.
Údaje o metabolismu in vivo naznačují, že fenofibrát ani kyselina fenofibrová nepodléhají ve významné míře oxidativnímu metabolismu (např. cytochrom P450).
Odstranění
Po absorpci je fenofibrát vylučován převážně močí ve formě metabolitů, především kyseliny fenofibrové a glukuronidu kyseliny fenofibrové. Po podání radioaktivně značeného fenofibrátu se přibližně 60 % dávky objevilo v moči a 25 % bylo vyloučeno stolicí.
Kyselina fenofibrová je eliminována s poločasem 20 hodin, což umožňuje dávkování jednou denně.
Zvláštní populace
Geriatrie
U starších dobrovolníků ve věku 77 až 87 let byla perorální clearance kyseliny fenofibrové po jedné perorální dávce fenofibrátu 1,2 l/h, ve srovnání s 1,1 l/h u mladých dospělých. To naznačuje, že podobný dávkovací režim lze použít u starších osob s normální funkcí ledvin, aniž by se zvýšila akumulace léčiva nebo metabolitů [viz DÁVKOVÁNÍ A PODÁVÁNÍ a Použití u konkrétních populací ].
Pediatrie
Farmakokinetika přípravku TRICOR 160 mg nebyla u pediatrické populace studována.
Rod
U fenofibrátu nebyl pozorován žádný farmakokinetický rozdíl mezi muži a ženami.
Závod
Vliv rasy na farmakokinetiku fenofibrátu nebyl studován, avšak fenofibrát není metabolizován enzymy, o kterých je známo, že vykazují interetnickou variabilitu.
Renální poškození
Farmakokinetika kyseliny fenofibrové byla zkoumána u pacientů s mírnou, středně těžkou a těžkou poruchou funkce ledvin. Pacienti s těžkou poruchou funkce ledvin (odhadovaná rychlost glomerulární filtrace [eGFR] DÁVKOVÁNÍ A PODÁVÁNÍ ].
Poškození jater
pacientů s poruchou funkce jater nebyly provedeny žádné farmakokinetické studie.
Lékové interakce
Studie in vitro s použitím lidských jaterních mikrozomů ukazují, že fenofibrát a kyselina fenofibrová nejsou inhibitory izoforem cytochromu (CYP) P450 CYP3A4, CYP2D6, CYP2E1 nebo CYP1A2. Jsou to slabé inhibitory CYP2C8, CYP2C19 a CYP2A6 a mírné až středně silné inhibitory CYP2C9 v terapeutických koncentracích.
Tabulka 2 popisuje účinky současně podávaných léků na systémovou expozici kyselině fenofibrové. Tabulka 3 popisuje účinky současně podávaného fenofibrátu nebo kyseliny fenofibrové na jiná léčiva.
Klinické studie
Primární hypercholesterolémie (heterozygotní familiární a nefamiliární) a smíšená dyslipidémie
Účinky fenofibrátu v dávce ekvivalentní 145 mg TRICOR (tablety fenofibrátu) denně byly hodnoceny ze čtyř randomizovaných, placebem kontrolovaných, dvojitě zaslepených studií s paralelními skupinami zahrnující pacienty s následujícími průměrnými výchozími hodnotami lipidů: celková-C 306,9 mg/dl; LDL-C 213,8 mg/dl; HDL-C 52,3 mg/dl; a triglyceridy 191,0 mg/dl. Léčba přípravkem TRICOR 200 mg snížila LDL-C, Total-C a poměr LDL-C/HDL-C. Terapie TRICOR také snížila triglyceridy a zvýšila HDL-C (viz tabulka 4).
U podskupiny subjektů byla provedena měření apo B. Léčba přípravkem TRICOR 200 mg signifikantně snížila apo B od výchozí hodnoty k cílovému bodu ve srovnání s placebem (-25,1 % vs. 2,4 %, p
Těžká hypertriglyceridémie
Účinky fenofibrátu na sérové triglyceridy byly studovány ve dvou randomizovaných, dvojitě zaslepených, placebem kontrolovaných klinických studiích u 147 pacientů s hypertriglyceridémií. Pacienti byli léčeni po dobu osmi týdnů podle protokolů, které se lišily pouze tím, že jeden vstoupil u pacientů s výchozími hladinami TG 500 až 1500 mg/dl a druhý s hladinami TG 350 až 500 mg/dl. U pacientů s hypertriglyceridémií a normální cholesterolémií s hyperchylomikronémií nebo bez ní snížila léčba fenofibrátem v dávkách ekvivalentních TRICOR 145 mg denně primárně triglyceridy lipoproteinů o velmi nízké hustotě (VLDL) a VLDL cholesterol. Léčba pacientů se zvýšenými triglyceridy často vede ke zvýšení LDL-C (viz tabulka 5).
Účinek přípravku TRICOR 160 mg na kardiovaskulární morbiditu a mortalitu nebyl stanoven.
INFORMACE PRO PACIENTA
Pacienti by měli být informováni:
- potenciálních přínosů a rizik přípravku TRICOR.
- neužívat TRICOR, pokud je známá přecitlivělost na fenofibrát nebo kyselinu fenofibrovou.
- léků, které by se neměly užívat v kombinaci s přípravkem TRICOR.
- že pokud užívají kumarinová antikoagulancia, může TRICOR 160 mg zvýšit jejich antikoagulační účinek a může být nutné zvýšené sledování.
- během užívání přípravku TRICOR pokračovat v dodržování vhodné diety upravující lipidy.
- užívat TRICOR 160 mg jednou denně, bez ohledu na jídlo, v předepsané dávce, polykat každou tabletu celou.
- aby se vrátili do ordinace svého lékaře k běžnému sledování.
- informovat svého lékaře o všech lécích, doplňcích a bylinných přípravcích, které užívá, a o jakékoli změně svého zdravotního stavu. Pacienti by měli být také poučeni, aby informovali své lékaře, kteří jim předepisují nový lék, že užívají přípravek TRICOR.
- informovat svého lékaře o příznacích poškození jater (např. žloutenka, bolest břicha, nevolnost, malátnost, tmavá moč, abnormální stolice, pruritus); jakákoli svalová bolest, citlivost nebo slabost; nebo jakékoli jiné nové příznaky.
- nekojit během léčby přípravkem TRICOR a po dobu 5 dnů po poslední dávce.
