Léčba cholesterolu: Lipitor 10mg, 20mg, 40mg Atorvastatin Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Lipitor 40 mg a jak se používá?
Lipitor 10 mg je lék na předpis používaný ke snížení hladiny „špatného“ cholesterolu v krvi (lipoprotein s nízkou hustotou neboli LDL), ke zvýšení hladiny „dobrého“ cholesterolu (lipoprotein s vysokou hustotou nebo HDL) a ke snížení hladiny triglyceridů a k léčbě příznaků vysokého cholesterolu (hyperlipidémie) a ke snížení rizika mrtvice, srdečního infarktu nebo jiných srdečních komplikací. Lipitor 40 mg lze užívat samostatně nebo s jinými léky.
Lipitor 10 mg patří do třídy léků nazývaných látky snižující hladinu lipidů, statiny, inhibitory HMG-CoA reduktázy.
Není známo, zda je přípravek Lipitor 10 mg bezpečný a účinný u dětí mladších 10 let.
Jaké jsou možné vedlejší účinky přípravku Lipitor?
Lipitor 10 mg může způsobit závažné nežádoucí účinky, včetně:
- bolest nebo pálení při močení,
- bolest v horní části žaludku,
- slabost,
- cítit se unaveně,
- ztráta chuti k jídlu,
- tmavá moč,
- zežloutnutí kůže nebo očí (žloutenka),
- malé nebo žádné močení,
- otoky nohou nebo kotníků a
- dušnost
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Lipitor patří:
- bolest kloubů,
- ucpaný nos,
- bolest krku,
- průjem a
- bolest v rukou nebo nohou
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Lipitor. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
LIPITOR je syntetické činidlo snižující hladinu lipidů. Atorvastatin je inhibitor 3-hydroxy-3-methylglutaryl-koenzym A (HMG-CoA) reduktázy. Tento enzym katalyzuje přeměnu HMG-CoA na mevalonát, což je časný krok omezující andrate v biosyntéze cholesterolu.
Atorvastatin kalcium je [R-(R*, R*)]-2-(4-fluorfenyl)-β, 5-dihydroxy-5-(1-methylethyl)-3-fenyl-4-[(fenylamino)karbonyl]- 1Hpyrrol-1-heptanová kyselina, vápenatá sůl (2:1) trihydrát. Empirický vzorec vápníku atorvastatinu je (C33H34FN2O5)2Ca•3H2O a jeho molekulová hmotnost je 1209,42. Jeho strukturní vzorec je:
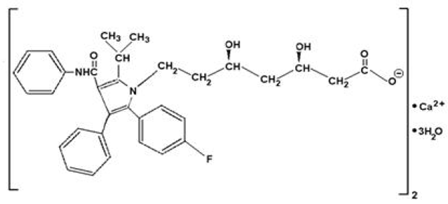
Atorvastatin kalcium je bílý až téměř bílý krystalický prášek, který je nerozpustný ve vodných roztocích o pH 4 a nižším. Vápník atorvastatinu je velmi málo rozpustný v destilované vodě, fosfátovém pufru o pH 7,4 a acetonitrilu; mírně rozpustný v ethanolu; a volně rozpustný v methanolu.
LIPITOR Tablety pro perorální podání obsahují 10, 20, 40 nebo 80 mg atorvastatinu a následující neaktivní složky: uhličitan vápenatý, USP; kandelilový vosk, FCC; sodná sůl kroskarmelózy, NF; hydroxypropylcelulóza, NF; monohydrát laktózy, NF; stearát hořečnatý, NF; mikrokrystalická celulóza, NF; Opadry White YS-1-7040 (hypromelóza, polyethylenglykol, mastek, oxid titaničitý); polysorbát 80, NF; simetikonová emulze.
INDIKACE
Léčba látkami ovlivňujícími lipidy by měla být pouze jednou složkou intervence s více rizikovými faktory u jedinců s významně zvýšeným rizikem aterosklerotického vaskulárního onemocnění v důsledku hypercholesterolémie. Medikamentózní terapie se doporučuje jako doplněk k dietě, pokud odpověď na dietu s omezením nasycených tuků a cholesterolu a jiných nefarmakologických opatření samotná byla nedostatečná. U pacientů s ICHS nebo s více rizikovými faktory pro ICHS lze LIPITOR 20 mg zahájit současně s dietou.
Prevence kardiovaskulárních onemocnění u dospělých
dospělých pacientů bez klinicky zjevné ischemické choroby srdeční, ale s více rizikovými faktory pro ICHS, jako je věk, kouření, hypertenze, nízký HDL-C nebo rodinná anamnéza časné ischemické choroby srdeční, je LIPITOR 10 mg indikován k:
- Snižte riziko infarktu myokardu
- Snižte riziko mrtvice
- Snížit riziko revaskularizačních výkonů a anginy pectoris
U dospělých pacientů s diabetem 2. typu a bez klinicky zjevné ischemické choroby srdeční, ale s více rizikovými faktory pro ICHS, jako je retinopatie, albuminurie, kouření nebo hypertenze, je LIPITOR indikován k:
- Snižte riziko infarktu myokardu
- Snižte riziko mrtvice
U dospělých pacientů s klinicky evidentním koronárním onemocněním srdce je LIPITOR 20 mg indikován k:
- Snížit riziko nefatálního infarktu myokardu
- Snižte riziko smrtelné a nefatální mozkové příhody
- Snížit riziko revaskularizačních výkonů
- Snížit riziko hospitalizace pro CHF
- Snižte riziko anginy pectoris
Hyperlipidémie
LIPITOR 20 mg je indikován:
- Jako doplněk diety ke snížení zvýšených hladin celkového-C, LDL-C, apo B a TG a ke zvýšení HDL-C u dospělých pacientů s primární hypercholesterolemií (heterozygotní familiární a nefamiliární) a smíšenou dyslipidemií (Fredrickson Typy IIa a IIb) ;
- Jako doplněk diety pro léčbu dospělých pacientů se zvýšenými hladinami TG v séru (Fredrickson typ IV);
- K léčbě dospělých pacientů s primární dysbetalipoproteinémií (Fredricksonův typ III), kteří adekvátně nereagují na dietu;
- Ke snížení celkového-C a LDL-C u pacientů s homozygotní familiární hypercholesterolemií (HoFH) jako doplněk k jiné léčbě snižující hladinu lipidů (např. LDL aferéza) nebo pokud taková léčba není dostupná;
- Jako doplněk diety ke snížení hladin celkového C, LDL-C a apo B u dětských pacientů ve věku 10 až 17 let s heterozygotní familiární hypercholesterolémií (HeFH), pokud jsou po adekvátní zkoušce dietní terapie zjištěny následující současnost, dárek:
- existuje pozitivní rodinná anamnéza předčasného kardiovaskulárního onemocnění popř
- u dětského pacienta jsou přítomny dva nebo více dalších rizikových faktorů KVO
Omezení použití
LIPITOR 40 mg nebyl studován u stavů, kdy hlavní lipoproteinovou abnormalitou je zvýšení chylomikronů (Fredrickson Typ I a V).
DÁVKOVÁNÍ A PODÁVÁNÍ
Hyperlipidémie a smíšená dyslipidémie
Doporučená počáteční dávka přípravku LIPITOR 10 mg je 10 nebo 20 mg jednou denně. Pacienti, kteří vyžadují velké snížení LDL-C (více než 45 %), mohou začít dávkou 40 mg jednou denně. Rozsah dávkování přípravku LIPITOR je 10 až 80 mg jednou denně. LIPITOR 10 mg lze podávat jako jednu dávku kdykoli během dne, s jídlem nebo bez jídla. Počáteční dávka a udržovací dávky přípravku LIPITOR by měly být individualizovány podle charakteristik pacienta, jako je cíl terapie a odpověď. Po zahájení a/nebo po titraci přípravku LIPITOR 10 mg je třeba během 2 až 4 týdnů analyzovat hladiny lipidů a podle toho upravit dávkování.
Heterozygotní familiární hypercholesterolémie u dětských pacientů (ve věku 10 až 17 let)
Doporučená počáteční dávka přípravku LIPITOR 10 mg je 10 mg/den; obvyklé rozmezí dávek je 10 až 20 mg perorálně jednou denně [viz Klinické studie ]. Dávky by měly být individualizovány podle doporučeného cíle terapie [viz INDIKACE A POUŽITÍ a KLINICKÁ FARMAKOLOGIE ]. Úpravy by měly být prováděny v intervalech 4 týdnů nebo déle.
Homozygotní familiární hypercholesterolémie
Dávkování přípravku LIPITOR 20 mg u pacientů s HoFH je 10 až 80 mg denně. LIPITOR 20 mg by se měl používat jako doplněk k jiné hypolipidemické léčbě (např. LDL aferéza) u těchto pacientů nebo pokud taková léčba není dostupná.
Souběžná terapie snižující hladinu lipidů
LIPITOR 20 mg lze použít s pryskyřicemi žlučových kyselin. Kombinace inhibitorů HMG-CoA reduktázy (statiny) a fibrátů by měla být obecně používána s opatrností (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a DROGOVÉ INTERAKCE ].
Dávkování U pacientů s poruchou ledvin
Onemocnění ledvin neovlivňuje plazmatické koncentrace ani snížení LDL-C přípravku LIPITOR; úprava dávkování u pacientů s renální dysfunkcí tedy není nutná [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
Dávkování u pacientů užívajících cyklosporin, klarithromycin, itrakonazol, lettermovir nebo některé inhibitory proteázy
pacientů užívajících cyklosporin nebo inhibitor proteázy HIV tipranavir plus ritonavir nebo inhibitor proteázy viru hepatitidy C (HCV) glecaprevir plus pibrentasvir nebo letermovir při současném podávání s cyklosporinem je třeba se vyhnout léčbě přípravkem LIPITOR 40 mg. U pacientů s HIV, kteří užívají lopinavir plus ritonavir, použijte nejnižší nezbytnou dávku přípravku LIPITOR. U pacientů užívajících klarithromycin, itrakonazol, elbasvir plus grazoprevir nebo u pacientů s HIV užívajících kombinaci saquinavir plus ritonavir, darunavir plus ritonavir, fosamprenavir, fosamprenavir plus ritonavir nebo letermovir by měla být léčba přípravkem LIPITOR omezena na 20 mg a je vhodné klinické posouzení doporučeno, aby bylo zajištěno použití nejnižší nutné dávky přípravku LIPITOR 20 mg. U pacientů užívajících inhibitor HIV proteázy by měla být léčba nelfinavirem s LIPITOREM 10 mg omezena na 40 mg (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a DROGOVÉ INTERAKCE ].
JAK DODÁVÁNO
Dávkové formy A Síly
Tablety LIPITOR jsou bílé eliptické, potahované a jsou dostupné ve čtyřech silách (viz tabulka 1).
Skladování A Manipulace
10 mg tablety (10 mg atorvastatinu): kódované „PD 155“ na jedné straně a „10“ na druhé straně.
NDC 0071-0155-23 lahví po 90 NDC 0071-0155-40 Blistry s 10 x 10 jednotkovými dávkami
20 mg tablety (20 mg atorvastatinu): kódované „PD 156“ na jedné straně a „20“ na druhé straně.
NDC 0071-0156-23 lahví po 90 NDC 0071-0156-40 Blistry s 10 x 10 jednotkovými dávkami
40 mg tablety (40 mg atorvastatinu): kódované „PD 157“ na jedné straně a „40“ na druhé straně.
NDC 0071-0157-23 lahví po 90 NDC 0071-0157-40 Blistry s 10 x 10 jednotkovými dávkami
80 mg tablety (80 mg atorvastatinu): kódované „PD 158“ na jedné straně a „80“ na druhé straně.
NDC 0071-0158-23 lahví po 90 NDC 0071-0158-73 lahve po 500 NDC 0071-0158-92 Blistry s 8 x 8 jednotkovými dávkami
Úložný prostor
Skladujte při kontrolované pokojové teplotě 20 – 25 °C (68 – 77 °F) [viz USP].
Distribuce: Parke-Davis, divize společnosti Pfizer Inc., NY, NY 10017. Revize: srpen 2021
VEDLEJŠÍ EFEKTY
Následující závažné nežádoucí účinky jsou podrobněji popsány v jiných částech štítku:
- Myopatie a rabdomyolýza [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Abnormality jaterních enzymů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie probíhají za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
databázi placebem kontrolované klinické studie LIPITOR zahrnující 16 066 pacientů (8 755 LIPITOR vs. 7 311 placebo; věkové rozmezí 10–93 let, 39 % žen, 91 % bělochů, 3 % černochů, 2 % Asiatů, 4 % ostatní) s mediánem trvání léčby 53 týdnů, 9,7 % pacientů na LIPITOR 10 mg a 9,5 % pacientů na placebu ukončilo léčbu kvůli nežádoucím účinkům bez ohledu na kauzalitu. Pět nejčastějších nežádoucích účinků u pacientů léčených přípravkem LIPITOR 20 mg, které vedly k přerušení léčby a vyskytovaly se častěji než placebo, byly: myalgie (0,7 %), průjem (0,5 %), nauzea (0,4 %), zvýšení alaninaminotransferázy (0,4 %) a zvýšení jaterních enzymů (0,4 %).
Nejčastěji hlášené nežádoucí účinky (incidence ≥ 2 % a vyšší než u placeba) bez ohledu na kauzalitu u pacientů léčených přípravkem LIPITOR v placebem kontrolovaných studiích (n=8755) byly: nazofaryngitida (8,3 %), artralgie (6,9 %), průjem ( 6,8 %), bolest v končetině (6,0 %) a infekce močových cest (5,7 %).
Tabulka 2 shrnuje frekvenci klinických nežádoucích účinků, bez ohledu na kauzalitu, hlášených u ≥ 2 % a ve vyšší míře než placebo u pacientů léčených přípravkem LIPITOR (n=8755), ze sedmnácti placebem kontrolovaných studií.
Další nežádoucí účinky hlášené v placebem kontrolovaných studiích zahrnují:
Tělo jako celek: malátnost, horečka; Zažívací ústrojí: břišní diskomfort, říhání, flatulence, hepatitida, cholestáza; Muskuloskeletální systém: muskuloskeletální bolest, svalová únava, bolest šíje, otoky kloubů; Metabolický a nutriční systém: zvýšení transamináz, abnormální jaterní testy, zvýšení alkalické fosfatázy v krvi, zvýšení kreatinfosfokinázy, hyperglykémie; Nervový systém: noční můra; Dýchací systém: epistaxe; Kůže a přílohy: kopřivka; Speciální smysly: rozmazané vidění, tinnitus; Urogenitální systém: bílé krvinky moč pozitivní.
Anglo-Scandinavian Cardiac Outcomes Trial (ASCOT)
V ASCOT [viz Klinické studie zahrnující 10 305 účastníků (věkové rozmezí 40–80 let, 19 % žen; 94,6 % bělochů, 2,6 % Afričanů, 1,5 % Jihoasijců, 1,3 % smíšených/jiných) léčených přípravkem LIPITOR 10 mg denně (n=5 168) nebo placebem (n =5 137) byl profil bezpečnosti a snášenlivosti ve skupině léčené přípravkem LIPITOR 10 mg srovnatelný s profilem skupiny léčené placebem během mediánu 3,3 let sledování.
Collaborative Atorvastatin Diabetes Study (CARDS)
V KARTÁCH [viz Klinické studie ] zahrnujících 2 838 subjektů (věkové rozmezí 39–77 let, 32 % žen; 94,3 % bělochů, 2,4 % Jihoasijců, 2,3 % Afro-Karibiku, 1,0 % ostatní) s diabetem 2. typu léčených LIPITOREM 10 mg denně (n=1 428) nebo placeba (n=1 410), nebyl žádný rozdíl v celkové frekvenci nežádoucích účinků nebo závažných nežádoucích účinků mezi léčebnými skupinami během střední doby sledování 3,9 roku. Nebyly hlášeny žádné případy rhabdomyolýzy.
Studie Treating To New Targets (TNT)
V TNT [viz Klinické studie zahrnující 10 001 subjektů (věkové rozmezí 29–78 let, 19 % žen; 94,1 % bělochů, 2,9 % černochů, 1,0 % Asiatů, 2,0 % ostatní) s klinicky evidentním ICHS léčených LIPITOREM 10 mg denně (n=5006) nebo LIPITOREM 80 mg denně (n=4995), došlo k závažnějším nežádoucím účinkům a přerušení léčby z důvodu nežádoucích účinků ve skupině s vysokou dávkou atorvastatinu (92, 1,8 %, 497, resp. 9,9 %) ve srovnání se skupinou s nízkou dávkou (69 , 1,4 %, 404, 8,1 %, v tomto pořadí) během mediánu sledování 4,9 let. Přetrvávající zvýšení transamináz (≥3 x ULN dvakrát během 4-10 dnů) se vyskytlo u 62 (1,3 %) jedinců s atorvastatinem 80 mg au devíti (0,2 %) jedinců s atorvastatinem 10 mg. Zvýšení CK (≥ 10 x ULN) bylo celkově nízké, ale bylo vyšší ve skupině léčené vysokou dávkou atorvastatinu (13, 0,3 %) ve srovnání se skupinou s nízkou dávkou atorvastatinu (6, 0,1 %).
Přírůstkové snížení koncových bodů prostřednictvím studie agresivního snižování lipidů (IDEAL)
V IDEÁLU [viz Klinické studie zahrnující 8 888 subjektů (věkové rozmezí 26–80 let, 19 % žen; 99,3 % bělochů, 0,4 % Asiatů, 0,3 % černochů, 0,04 % ostatní) léčených přípravkem LIPITOR 80 mg/den (n=4439) nebo simvastatinem 20–40 mg denně (n=4449), nebyl mezi léčebnými skupinami během mediánu sledování 4,8 roku žádný rozdíl v celkové frekvenci nežádoucích účinků nebo závažných nežádoucích účinků.
Prevence mrtvice agresivním snížením hladiny cholesterolu (SPARCL)
Ve studii SPARCL zahrnující 4 731 subjektů (věkové rozmezí 21–92 let, 40 % žen; 93,3 % bělochů, 3,0 % černochů, 0,6 % Asiatů, 3,1 % ostatní) bez klinicky zjevné ICHS, ale s mrtvicí nebo tranzitorní ischemickou atakou (TIA) v rámci v předchozích 6 měsících léčených přípravkem LIPITOR 80 mg (n=2365) nebo placebem (n=2366) po střední dobu sledování 4,9 let byla vyšší incidence přetrvávajících zvýšení jaterních transamináz (≥ 3 x ULN dvakrát během 4-10 dnů) ve skupině s atorvastatinem (0,9 %) ve srovnání s placebem (0,1 %). Zvýšení CK (>10 x ULN) bylo vzácné, ale bylo vyšší ve skupině s atorvastatinem (0,1 %) ve srovnání s placebem (0,0 %). Diabetes byl hlášen jako nežádoucí reakce u 144 subjektů (6,1 %) ve skupině s atorvastatinem a u 89 subjektů (3,8 %) ve skupině s placebem (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
post-hoc analýze LIPITOR 80 mg snížil výskyt ischemické cévní mozkové příhody (218/2365, 9,2 % oproti 274/2366, 11,6 %) a zvýšil výskyt hemoragické cévní mozkové příhody (55/2365, 2,3 % oproti 33/ 2366, 1,4 %) ve srovnání s placebem. Incidence fatální hemoragické cévní mozkové příhody byla mezi skupinami podobná (17 LIPITOR 40 mg vs. 18 placebo). Výskyt nefatálních hemoragických mrtvic byl významně vyšší ve skupině s atorvastatinem (38 nefatálních hemoragických mrtvic) ve srovnání se skupinou s placebem (16 nefatálních hemoragických mrtvic). Zdá se, že subjekty, které vstoupily do studie s hemoragickou mrtvicí, měly zvýšené riziko hemoragické mrtvice [7 (16 %) LIPITOR vs. 2 (4 %) placebo].
Mezi léčebnými skupinami nebyly žádné významné rozdíly z hlediska mortality ze všech příčin: 216 (9,1 %) ve skupině LIPITOR 80 mg/den vs. 211 (8,9 %) ve skupině s placebem. Podíl subjektů, u kterých došlo ke kardiovaskulární smrti, byl číselně nižší ve skupině s LIPITOREM 80 mg (3,3 %) než ve skupině s placebem (4,1 %). Podíl subjektů, u kterých došlo k nekardiovaskulární smrti, byl číselně vyšší ve skupině s LIPITOREM 80 mg (5,0 %) než ve skupině s placebem (4,0 %).
Nežádoucí účinky z klinických studií přípravku LIPITOR 20 mg u pediatrických pacientů
Ve 26týdenní kontrolované studii u chlapců a postmenarchálních dívek s HeFH (ve věku 10 let až 17 let) (n=140, 31 % ženy; 92 % bělochů, 1,6 % černochů, 1,6 % Asiatů, 4,8 % ostatní) byla bezpečnost a profil snášenlivosti LIPITORU 10 až 20 mg denně, jako doplněk k dietě ke snížení hladiny celkového cholesterolu, LDL-C a apo B, byl obecně podobný jako u placeba [viz Použití ve zvláštních populacích a Klinické studie ].
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během používání přípravku LIPITOR po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Nežádoucí účinky spojené s léčbou LIPITORem hlášené od uvedení na trh, které nejsou uvedeny výše, bez ohledu na posouzení kauzality, zahrnují následující: anafylaxe, angioneurotický edém, bulózní vyrážky (včetně erythema multiforme, Stevens-Johnsonova syndromu a toxické epidermální nekrolýzy), rhabdomyolýza myositida, únava, ruptura šlachy, fatální a nefatální jaterní selhání, závratě, deprese, periferní neuropatie, pankreatitida a intersticiální plicní onemocnění.
Vzácně byly hlášeny imunitně zprostředkované nekrotizující myopatie spojené s užíváním statinů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Po uvedení přípravku na trh byly vzácně hlášeny kognitivní poruchy (např. ztráta paměti, zapomnění, amnézie, poruchy paměti, zmatenost) spojené s užíváním statinů. Tyto kognitivní problémy byly hlášeny u všech statinů. Hlášení jsou obecně nezávažná a po vysazení statinu jsou reverzibilní, s proměnlivou dobou do nástupu příznaků (1 den až roky) a vymizení příznaků (medián 3 týdny).
DROGOVÉ INTERAKCE
Lékové interakce, které mohou zvýšit riziko myopatie a rabdomyolýzy s LIPITOR
LIPITOR je substrátem CYP3A4 a transportérů (např. OATP1B1/1B3, P-gp nebo BCRP). Plazmatické hladiny LIPITORu mohou být významně zvýšeny při současném podávání inhibitorů CYP3A4 a transportérů. Tabulka 3 obsahuje seznam léků, které mohou zvýšit expozici Lipitoru a mohou zvýšit riziko myopatie a rhabdomyolýzy, pokud jsou užívány současně, a pokyny pro jejich prevenci nebo léčbu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
Drogové interakce, které mohou snížit expozici LIPITOR
Tabulka 4 uvádí lékové interakce, které mohou snížit expozici přípravku LIPITOR 20 mg, a pokyny pro jejich prevenci nebo léčbu.
LIPITOR 20mg Účinky na jiné léky
Tabulka 5 uvádí účinek přípravku LIPITOR na jiné léky a pokyny pro jejich prevenci nebo léčbu.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Myopatie a rabdomyolýza
LIPITOR 10 mg může způsobit myopatii (bolest svalů, citlivost nebo slabost s kreatinkinázou (CK) nad desetinásobkem horní hranice normy) a rhabdomyolýzu (s nebo bez akutního selhání ledvin sekundárního k myoglobinurii). Vzácně došlo k úmrtí v důsledku rhabdomyolýzy při užívání statinů, včetně přípravku LIPITOR.
Rizikové faktory pro myopatii
Rizikové faktory pro myopatii zahrnují věk 65 let nebo více, nekontrolovanou hypotyreózu, poruchu funkce ledvin, současné užívání s některými jinými léky a vyšší dávkování přípravku LIPITOR (viz DROGOVÉ INTERAKCE ].
Kroky k prevenci nebo snížení rizika myopatie a rabdomyolýzy
Expozice LIPITORu může být zvýšena lékovými interakcemi v důsledku inhibice enzymu 3A4 cytochromu P450 (CYP3A4) a/nebo transportérů (např. protein rezistentní vůči rakovině prsu [BCRP], polypeptid transportující organické anionty [OATP1B1/OATP1B3] a P-glykoprotein [P -gp]), což vede ke zvýšenému riziku myopatie a rhabdomyolýzy. Současné užívání cyklosporinu, gemfibrozilu, tipranaviru plus ritonaviru nebo glecapreviru plus pibrentasvir s přípravkem LIPITOR se nedoporučuje. Úpravy dávkování LIPITOR 40 mg se doporučují u pacientů užívajících určitá antivirová, azolová antimykotika nebo makrolidová antibiotika [viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Případy myopatie/rhabdomyolýzy byly hlášeny při současném podávání atorvastatinu s lipidy upravujícími dávkami (>1 gram/den) niacinu, fibrátů, kolchicinu a ledipasviru plus sofosbuviru. Zvažte, zda přínos použití těchto přípravků převáží nad zvýšeným rizikem myopatie a rhabdomyolýzy (viz DROGOVÉ INTERAKCE ].
Současný příjem velkého množství, více než 1,2 litru denně, grapefruitové šťávy se nedoporučuje u pacientů užívajících LIPITOR (viz DROGOVÉ INTERAKCE ].
Pokud se objeví výrazně zvýšené hladiny CK nebo je diagnostikována nebo podezření na myopatii, přerušte léčbu přípravkem LIPITOR. Svalové příznaky a zvýšení CK mohou vymizet, pokud se LIPITOR vysadí. Dočasně přerušte podávání přípravku LIPITOR 40 mg u pacientů s akutním nebo závažným stavem s vysokým rizikem rozvoje renálního selhání sekundárního k rhabdomyolýze (např. sepse; šok; těžká hypovolémie; velký chirurgický zákrok; trauma; závažné metabolické, endokrinní nebo elektrolytové poruchy; nebo nekontrolovaná epilepsie) .
Informujte pacienty o riziku myopatie a rhabdomyolýzy při zahájení nebo zvýšení dávky přípravku LIPITOR. Poučte pacienty, aby neprodleně hlásili jakoukoli nevysvětlitelnou svalovou bolest, citlivost nebo slabost, zvláště pokud jsou doprovázeny malátností nebo horečkou.
Imunitně zprostředkovaná nekrotizující myopatie
Vzácně byly hlášeny případy imunitně zprostředkované nekrotizující myopatie (IMNM), autoimunitní myopatie, spojené s užíváním statinů. IMNM je charakterizována: proximální svalovou slabostí a zvýšenou sérovou kreatinkinázou, které přetrvávají i přes přerušení léčby statiny; pozitivní anti-HMG CoA reduktáza protilátka; svalová biopsie ukazující nekrotizující myopatii; a zlepšení pomocí imunosupresiv. Mohou být nezbytné další neuromuskulární a sérologické testy. Může být nutná léčba imunosupresivy. Před zahájením léčby jiným statinem pečlivě zvažte riziko IMNM. Pokud je léčba zahájena jiným statinem, sledujte známky a příznaky IMNM.
Jaterní dysfunkce
Statiny, stejně jako některé jiné terapie snižující hladinu lipidů, jsou spojovány s biochemickými abnormalitami jaterních funkcí. Přetrvávající zvýšení (>3násobek horní hranice normy [ULN] vyskytující se 2 nebo vícekrát) sérových transamináz se vyskytlo u 0,7 % pacientů, kteří dostávali LIPITOR v klinických studiích. Výskyt těchto abnormalit byl 0,2 %, 0,2 %, 0,6 % a 2,3 % pro 10, 20, 40 a 80 mg.
U jednoho pacienta v klinických studiích se vyvinula žloutenka. Zvýšení jaterních funkčních testů (LFT) u jiných pacientů nebylo spojeno se žloutenkou nebo jinými klinickými známkami nebo příznaky. Po snížení dávky, přerušení nebo vysazení léku se hladiny transamináz vrátily na úroveň před léčbou nebo se jim blížily bez následků. 18 z 30 pacientů s přetrvávajícím zvýšením LFT pokračovalo v léčbě sníženou dávkou přípravku LIPITOR.
Před zahájením léčby přípravkem LIPITOR 40 mg se doporučuje provést testy jaterních enzymů a zopakovat je, jak je klinicky indikováno. Po uvedení přípravku na trh byly vzácně hlášeny fatální a nefatální jaterní selhání u pacientů užívajících statiny, včetně atorvastatinu. Pokud se během léčby přípravkem LIPITOR 10 mg objeví závažné poškození jater s klinickými příznaky a/nebo hyperbilirubinémií nebo žloutenkou, okamžitě přerušte léčbu. Pokud alternativní etiologie není nalezena, nerestartujte LIPITOR.
LIPITOR 10 mg by měl být používán s opatrností u pacientů, kteří konzumují velké množství alkoholu a/nebo mají v anamnéze onemocnění jater. Aktivní onemocnění jater nebo nevysvětlitelné přetrvávající zvýšení transamináz jsou kontraindikací pro použití přípravku LIPITOR (viz KONTRAINDIKACE ].
Endokrinní funkce
U inhibitorů HMG-CoA reduktázy, včetně přípravku LIPITOR, bylo hlášeno zvýšení HbA1c a hladiny sérové glukózy nalačno.
Statiny interferují se syntézou cholesterolu a teoreticky by mohly otupit adrenální a/nebo gonadální produkci steroidů. Klinické studie prokázaly, že LIPITOR 20 mg nesnižuje bazální plazmatickou koncentraci kortizolu ani nenarušuje nadledvinovou rezervu. Účinky statinů na mužskou fertilitu nebyly studovány u dostatečného počtu pacientů. Účinky, pokud nějaké, na hypofýzně-gonadální osu u premenopauzálních žen nejsou známy. Opatrnosti je třeba, pokud je statin podáván současně s léky, které mohou snižovat hladiny nebo aktivitu endogenních steroidních hormonů, jako je ketokonazol, spironolakton a cimetidin.
CNS toxicita
Krvácení do mozku bylo pozorováno u psí feny léčené po dobu 3 měsíců dávkou 120 mg/kg/den. Krvácení do mozku a vakuolizace zrakového nervu byly pozorovány u další psí feny, která byla utracena v skomírajícím stavu po 11 týdnech eskalujících dávek až na 280 mg/kg/den. Dávka 120 mg/kg vedla k systémové expozici přibližně 16násobku plochy lidské plazmy pod křivkou (AUC, 0 – 24 hodin) na základě maximální dávky pro člověka 80 mg/den. Jedna tonická křeče byla pozorována u každého ze 2 samců psů (jeden léčen 10 mg/kg/den a jeden 120 mg/kg/den) ve 2leté studii. U myší po chronické léčbě po dobu až 2 let v dávkách až 400 mg/kg/den nebo u potkanů v dávkách až 100 mg/kg/den nebyly pozorovány žádné léze CNS. Tyto dávky byly 6 až 11násobek (myš) a 8 až 16násobek (potkan) lidské AUC (0 – 24) na základě maximální doporučené dávky pro člověka 80 mg/den.
CNS vaskulární léze, charakterizované perivaskulárním krvácením, edémem a mononukleární buněčnou infiltrací perivaskulárních prostorů, byly pozorovány u psů léčených jinými členy této třídy. Chemicky podobný lék v této třídě způsobil degeneraci zrakového nervu (Wallerova degenerace retinogenních vláken) u klinicky normálních psů způsobem závislým na dávce při dávce, která vyvolala hladiny léku v plazmě asi 30krát vyšší než průměrná hladina léku u lidí užívajících nejvyšší doporučená dávka.
Použití u pacientů s nedávnou mrtvicí nebo TIA
post-hoc analýze studie Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL), kde byl LIPITOR 80 mg vs. placebo podáván 4 731 pacientům bez ICHS, kteří měli mrtvici nebo TIA během předchozích 6 měsíců, byla vyšší incidence hemoragická cévní mozková příhoda byla pozorována ve skupině s LIPITOREM 80 mg ve srovnání s placebem (55, 2,3 % atorvastatin vs. 33, 1,4 % placebo; HR: 1,68, 95 % CI: 1,09, 2,59; p=0,0168). Incidence fatální hemoragické cévní mozkové příhody byla ve všech léčebných skupinách podobná (17 vs. 18 pro skupiny s atorvastatinem a placebo). Výskyt nefatálních hemoragických cévních mozkových příhod byl významně vyšší ve skupině s atorvastatinem (38, 1,6 %) ve srovnání se skupinou s placebem (16, 0,7 %).
Některé základní charakteristiky, včetně hemoragické a lakunární mrtvice při vstupu do studie, byly spojeny s vyšším výskytem hemoragické mrtvice ve skupině s atorvastatinem [viz NEŽÁDOUCÍ REAKCE ].
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( INFORMACE PRO PACIENTA ).
Pacienti užívající LIPITOR 10 mg by měli být upozorněni, že cholesterol je chronický stav a měli by dodržovat svou medikaci spolu s dietou doporučenou Národním programem Cholesterol Education Program (NCEP), pravidelným cvičebním programem a pravidelným testováním lipidového panelu nalačno. určit dosažení cíle.
Pacienti by měli být informováni o látkách, které by neměli užívat současně s atorvastatinem (viz UPOZORNĚNÍ A OPATŘENÍ ). Pacienti by měli být také poučeni, aby informovali ostatní zdravotnické pracovníky předepisující nový lék, že užívají LIPITOR.
Bolest svalů
Všichni pacienti zahajující léčbu přípravkem LIPITOR by měli být informováni o riziku myopatie a měli by být informováni, aby neprodleně hlásili jakoukoli nevysvětlitelnou svalovou bolest, citlivost nebo slabost, zvláště pokud jsou doprovázeny malátností nebo horečkou nebo pokud tyto svalové známky nebo příznaky přetrvávají i po vysazení přípravku LIPITOR. Riziko tohoto výskytu se zvyšuje při užívání určitých typů léků nebo při konzumaci většího množství (>1 litr) grapefruitové šťávy. Měli by projednat všechny léky, a to jak na předpis, tak na přepážku, se svým zdravotníkem.
Jaterní enzymy
Doporučuje se provést testy jaterních enzymů před zahájením léčby přípravkem LIPITOR 40 mg a pokud se objeví známky nebo příznaky poškození jater. Všichni pacienti léčení přípravkem LIPITOR by měli být poučeni, aby neprodleně hlásili jakékoli příznaky, které mohou naznačovat poškození jater, včetně únavy, anorexie, diskomfortu v pravé horní části břicha, tmavé moči nebo žloutenky.
Embryofetální toxicita
Informujte ženy o reprodukčním potenciálu rizika pro plod, aby během léčby používaly účinnou antikoncepci a informovaly svého poskytovatele zdravotní péče o známém nebo předpokládaném těhotenství [viz KONTRAINDIKACE a Použití u konkrétních populací ].
Laktace
Doporučte ženám, aby během léčby přípravkem LIPITOR nekojily [viz KONTRAINDIKACE a Použití u konkrétních populací ].
Označení tohoto produktu mohlo být aktualizováno. Nejnovější informace o předepisování naleznete na www.pfizer.com.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Ve 2leté studii karcinogenity u potkanů při dávkách 10, 30 a 100 mg/kg/den byly nalezeny 2 vzácné nádory ve svalu u samic s vysokou dávkou: u jedné se vyskytl rabdomyosarkom au druhé došlo k fibrosarkomu. Tato dávka představuje plazmatickou AUC (0 – 24) hodnotu přibližně 16násobku průměrné lidské plazmatické expozice léku po perorální dávce 80 mg.
Dvouletá studie karcinogenity u myší, kterým bylo podáváno 100, 200 nebo 400 mg/kg/den, vedla k významnému zvýšení jaterních adenomů u samců s vysokou dávkou a karcinomů jater u samic s vysokou dávkou. K těmto zjištěním došlo při hodnotách AUC (0 – 24) v plazmě přibližně 6násobku průměrné expozice léku v lidské plazmě po perorální dávce 80 mg.
In vitro nebyl atorvastatin mutagenní ani klastogenní v následujících testech s metabolickou aktivací a bez ní: Amesův test se Salmonella typhimurium a Escherichia coli, test HGPRT dopředné mutace v plicních buňkách čínského křečka a test chromozomálních aberací v plicních buňkách čínského křečka . Atorvastatin byl negativní v in vivo myším mikronukleovém testu.
samic potkanů neměl atorvastatin v dávkách až 225 mg/kg (56násobek expozice u člověka) nežádoucí účinky na fertilitu. Studie na samcích potkanů prováděné v dávkách až 175 mg/kg (15násobek expozice u člověka) neprokázaly žádné změny fertility. U 2 z 10 potkanů léčených atorvastatinem v dávce 100 mg/kg/den po dobu 3 měsíců (16násobek lidské AUC při dávce 80 mg) se vyskytla aplazie a aspermie; hmotnosti varlat byly významně nižší při 30 a 100 mg/kg a hmotnost nadvarlat byla nižší při 100 mg/kg. Samci potkanů, kterým byla podávána dávka 100 mg/kg/den po dobu 11 týdnů před pářením, měli sníženou pohyblivost spermií, koncentraci hlavičky spermatid a zvýšené abnormální spermie. Atorvastatin nezpůsobil žádné nežádoucí účinky na parametry spermatu nebo histopatologii reprodukčních orgánů u psů, kterým byly podávány dávky 10, 40 nebo 120 mg/kg po dobu dvou let.
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
LIPITOR 10 mg je kontraindikován pro použití u těhotných žen, protože bezpečnost u těhotných žen nebyla stanovena a neexistuje žádný zjevný přínos léků snižujících lipidy během těhotenství. Protože inhibitory HMG-CoA reduktázy snižují syntézu cholesterolu a možná i syntézu dalších biologicky aktivních látek odvozených od cholesterolu, může LIPITOR při podání těhotné ženě způsobit poškození plodu. LIPITOR 40 mg by měl být přerušen, jakmile je rozpoznáno těhotenství [viz KONTRAINDIKACE ]. Omezené publikované údaje o použití atorvastatinu jsou nedostatečné ke stanovení rizika závažných vrozených malformací nebo potratu spojeného s užíváním léků. V reprodukčních studiích na zvířatech u potkanů a králíků nebyla prokázána embryofetální toxicita nebo vrozené malformace při dávkách až 30krát, respektive 20krát, než je expozice u člověka při maximální doporučené dávce pro člověka (MRHD) 80 mg, na základě tělesné hmotnosti povrch (mg/m ). U potkanů, kterým byl atorvastatin podáván během březosti a laktace, byl pozorován snížený postnatální růst a vývoj v dávkách ≥ 6násobku MRHD (viz Data ).
Odhadované základní riziko závažných vrozených vad a potratu pro indikovanou populaci není známo. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 – 4 % a 15 – 20 %.
Data
Lidská data
Omezené publikované údaje o kalcium-atorvastatinu z observačních studií, metaanalýz a kazuistik neprokázaly zvýšené riziko závažných vrozených malformací nebo potratu. Vzácně byly hlášeny vrozené anomálie po intrauterinní expozici jiným inhibitorům HMGCoA reduktázy. V přehledu přibližně 100 prospektivně sledovaných těhotenství u žen vystavených simvastatinu nebo lovastatinu nepřesáhl výskyt vrozených anomálií, spontánních potratů a úmrtí plodu/mrtvě narozených dětí to, co by se dalo očekávat v běžné populaci. Počet případů je dostatečný k vyloučení ≥3 až 4násobného nárůstu vrozených anomálií oproti základnímu výskytu. U 89 % prospektivně sledovaných těhotenství byla medikamentózní léčba zahájena před těhotenstvím a byla přerušena v určitém okamžiku prvního trimestru, když bylo těhotenství identifikováno.
Údaje o zvířatech
Atorvastatin prochází placentou potkana a ve fetálních játrech dosahuje hladiny ekvivalentní hladině mateřské plazmy. Atorvastatin byl podáván březím potkanům a králíkům během organogeneze v perorálních dávkách až 300 mg/kg/den a 100 mg/kg/den, v daném pořadí. Atorvastatin nebyl teratogenní u potkanů v dávkách do 300 mg/kg/den nebo u králíků v dávkách do 100 mg/kg/den. Tyto dávky vedly k násobkům asi 30násobku (krysa) nebo 20násobku (králík) expozice člověka při MRHD na základě plochy povrchu (mg/m2). U potkanů vedla dávka toxická pro matku 300 mg/kg ke zvýšené postimplantační ztrátě a snížení tělesné hmotnosti plodu. Při dávkách toxických pro matku 50 a 100 mg/kg/den u králíků došlo ke zvýšené postimplantační ztrátě a při dávce 100 mg/kg/den došlo ke snížení tělesné hmotnosti plodu.
Ve studii u březích potkanů, kterým bylo podáváno 20, 100 nebo 225 mg/kg/den od 7. dne březosti až do 20. dne laktace (odstav), došlo u mláďat ke snížení přežití při narození, 4. postnatálním dni, odstavu a po odstavení. matek s dávkou 225 mg/kg/den, což je dávka, při které byla pozorována mateřská toxicita. Tělesná hmotnost mláďat byla snížena do 21. postnatálního dne při 100 mg/kg/den a do 91. postnatálního dne na 225 mg/kg/den. Vývoj mláďat byl opožděn (výkon rotarodu při 100 mg/kg/den a akustický úlek při 225 mg/kg/den; odchlípení boltců a otevření očí při 225 mg/kg/den). Tyto dávky odpovídají 6násobku (100 mg/kg) a 22násobku (225 mg/kg) lidské expozice při MRHD, na základě AUC.
Laktace
Shrnutí rizik
Užívání LIPITORU 40 mg je kontraindikováno během kojení [viz KONTRAINDIKACE ]. Nejsou dostupné informace o účincích léku na kojené dítě ani o účincích léku na tvorbu mléka. Není známo, zda je atorvastatin přítomen v lidském mléce, ale bylo prokázáno, že jiný lék z této třídy přechází do lidského mléka a atorvastatin je přítomen v mléce potkanů. Vzhledem k možnému výskytu závažných nežádoucích účinků u kojeného dítěte informujte ženy, že kojení se během léčby přípravkem LIPITOR nedoporučuje.
Ženy a muži reprodukčního potenciálu
Antikoncepce
LIPITOR může způsobit poškození plodu, když je podáván těhotné ženě. Informujte ženy o reprodukčním potenciálu, aby během léčby přípravkem LIPITOR používaly účinnou antikoncepci (viz Použití u konkrétních populací ].

Pediatrické použití
Heterozygotní familiární hypercholesterolémie (HeFH)
Bezpečnost a účinnost přípravku LIPITOR 20 mg byla stanovena u pediatrických pacientů ve věku 10 až 17 let s HeFH jako doplňkem diety ke snížení hladiny celkového cholesterolu, LDL-C a apo B, když po adekvátní zkoušce diety terapie, jsou přítomny:
- LDL-C ≥ 190 mg/dl, nebo
- LDL-C ≥ 160 mg/dl a
- pozitivní rodinná anamnéza FH nebo předčasná CVD u příbuzného prvního nebo druhého stupně, popř
- jsou přítomny dva nebo více dalších rizikových faktorů KVO.
Použití přípravku LIPITOR 20 mg pro tuto indikaci je podpořeno důkazy z [viz DÁVKOVÁNÍ A PODÁVÁNÍ , NEŽÁDOUCÍ REAKCE , KLINICKÁ FARMAKOLOGIE , a Klinické studie ]:
- Placebem kontrolovaná klinická studie trvající 6 měsíců u 187 chlapců a postmenarchálních dívek ve věku 10 až 17 let. Pacienti léčení 10 mg nebo 20 mg denně LIPITOR měli profil nežádoucích účinků obecně podobný profilu pacientů léčených placebem. V této omezené kontrolované studii nebyl zjištěn žádný významný účinek na růst nebo sexuální dospívání u chlapců nebo na délku menstruačního cyklu u dívek.
- Tříletá otevřená nekontrolovaná studie, která zahrnovala 163 pediatrických pacientů ve věku 10 až 15 let s HeFH, kteří byli titrováni k dosažení cílové hodnoty LDL-C
Informujte postmenarchální dívky o doporučeních antikoncepce, pokud je to pro pacientku vhodné [viz Použití u konkrétních populací ].
Dlouhodobá účinnost léčby přípravkem LIPITOR zahájená v dětství ke snížení morbidity a mortality v dospělosti nebyla stanovena.
Bezpečnost a účinnost přípravku LIPITOR 10 mg nebyla stanovena u pediatrických pacientů mladších 10 let s HeFH.
Homozygotní familiární hypercholesterolémie (HoFH)
Klinická účinnost přípravku LIPITOR 20 mg s dávkami až 80 mg/den po dobu 1 roku byla hodnocena v nekontrolované studii pacientů s HoFH zahrnující 8 dětských pacientů [viz Klinické studie ].
Geriatrické použití
39 828 pacientů, kteří dostávali LIPITOR 40 mg v klinických studiích, bylo 15 813 (40 %) ve věku ≥ 65 let a 2 800 (7 %) bylo ve věku ≥ 75 let. Mezi těmito subjekty a mladšími subjekty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti a další hlášené klinické zkušenosti neidentifikovaly rozdíly v odpovědích mezi staršími a mladšími pacienty, nelze však vyloučit větší citlivost některých starších dospělých. Vzhledem k tomu, že pokročilý věk (≥65 let) je predisponujícím faktorem pro myopatii, měl by být LIPITOR starším pacientům předepisován s opatrností.
Poškození jater
Lipitor je kontraindikován u pacientů s aktivním onemocněním jater, které může zahrnovat nevysvětlitelné přetrvávající zvýšení hladin jaterních transamináz (viz KONTRAINDIKACE a KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
Neexistuje žádná specifická léčba předávkování přípravkem LIPITOR. V případě předávkování je třeba pacienta léčit symptomaticky a podle potřeby zahájit podpůrná opatření. Vzhledem k rozsáhlé vazbě léčiva na plazmatické proteiny se neočekává, že by hemodialýza významně zvýšila clearance přípravku LIPITOR 20 mg.
KONTRAINDIKACE
- Aktivní onemocnění jater, které může zahrnovat nevysvětlitelné přetrvávající zvýšení hladin jaterních transamináz
- Přecitlivělost na jakoukoli složku tohoto léku
- Těhotenství [viz Použití u specifických populací].
- Kojení [viz Použití u specifických populací].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
LIPITOR 20 mg je selektivní, kompetitivní inhibitor HMG-CoA reduktázy, enzymu omezujícího rychlost, který přeměňuje 3-hydroxy-3-methylglutaryl-koenzym A na mevalonát, prekurzor sterolů, včetně cholesterolu. Na zvířecích modelech LIPITOR 40 mg snižuje plazmatické hladiny cholesterolu a lipoproteinů inhibicí HMG-CoA reduktázy a syntézy cholesterolu v játrech a zvýšením počtu jaterních LDL receptorů na buněčném povrchu, aby se zvýšilo vychytávání a katabolismus LDL; LIPITOR také snižuje produkci LDL a počet LDL částic.
Farmakodynamika
LIPITOR, stejně jako některé jeho metabolity, jsou farmakologicky aktivní u lidí. Játra jsou primárním místem účinku a hlavním místem syntézy cholesterolu a clearance LDL. Dávka léku, spíše než systémová koncentrace léku, lépe koreluje se snížením LDL-C. Individualizace dávkování léku by měla být založena na terapeutické odpovědi [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Farmakokinetika
Vstřebávání
LIPITOR se po perorálním podání rychle vstřebává; maximální plazmatické koncentrace se objeví během 1 až 2 hodin. Rozsah absorpce se zvyšuje úměrně s dávkou LIPITORU. Absolutní biologická dostupnost atorvastatinu (mateřský lék) je přibližně 14 % a systémová dostupnost inhibiční aktivity HMG-CoA reduktázy je přibližně 30 %. Nízká systémová dostupnost je připisována presystémové clearance v gastrointestinální sliznici a/nebo jaternímu first-pass metabolismu. Ačkoli jídlo snižuje rychlost a rozsah absorpce léku přibližně o 25 % a 9 %, jak bylo hodnoceno pomocí Cmax a AUC, snížení LDL-C je podobné, ať je LIPITOR 40 mg podáván s jídlem nebo bez jídla. Plazmatické koncentrace LIPITORU 20 mg jsou nižší (přibližně o 30 % pro Cmax a AUC) po večerním podání léku ve srovnání s ranním podáním. Snížení LDL-C je však stejné bez ohledu na denní dobu podávání léku [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Rozdělení
Průměrný distribuční objem přípravku LIPITOR 20 mg je přibližně 381 litrů. LIPITOR 20 mg se váže z ≥ 98 % na plazmatické bílkoviny. Poměr krev/plazma přibližně 0,25 ukazuje na špatnou penetraci léčiva do červených krvinek. Na základě pozorování u potkanů je pravděpodobné, že LIPITOR 10 mg bude vylučován do lidského mléka (viz KONTRAINDIKACE a Použití u konkrétních populací ].
Metabolismus
LIPITOR 20 mg je rozsáhle metabolizován na ortho- a parahydroxylované deriváty a různé beta-oxidační produkty. In vitro inhibice HMG-CoA reduktázy ortho- a parahydroxylovanými metabolity je ekvivalentní inhibici LIPITORU. Přibližně 70 % cirkulující inhibiční aktivity HMG-CoA reduktázy se připisuje aktivním metabolitům. Studie in vitro naznačují důležitost metabolismu LIPITOR 40 mg cytochromem P450 3A4, což je v souladu se zvýšenými plazmatickými koncentracemi LIPITOR 20 mg u lidí po současném podávání s erythromycinem, známým inhibitorem tohoto izozymu [viz DROGOVÉ INTERAKCE ]. U zvířat podléhá ortho-hydroxy metabolit další glukuronidaci.
Vylučování
LIPITOR 20 mg a jeho metabolity jsou eliminovány primárně žlučí po jaterním a/nebo extrahepatálním metabolismu; nicméně se nezdá, že by lék podstoupil enterohepatální recirkulaci. Průměrný poločas eliminace LIPITORu z plazmy u lidí je přibližně 14 hodin, ale poločas inhibiční aktivity na HMG-CoA reduktázu je 20 až 30 hodin díky příspěvku aktivních metabolitů. Po perorálním podání se v moči objeví méně než 2 % dávky přípravku LIPITOR.
Specifické populace
Geriatrický
Plazmatické koncentrace LIPITORu jsou vyšší (přibližně 40 % pro Cmax a 30 % pro AUC) u zdravých starších subjektů (věk ≥ 65 let) než u mladých dospělých. Klinické údaje naznačují větší stupeň snížení LDL při jakékoli dávce léku u starší populace pacientů ve srovnání s mladšími dospělými (viz Použití u konkrétních populací ].
Pediatrická
Zdánlivá perorální clearance atorvastatinu u pediatrických subjektů se jevila podobná clearance u dospělých, když byla alometricky škálována podle tělesné hmotnosti, protože tělesná hmotnost byla jedinou významnou kovariátou ve PK modelu populace s atorvastatinem s údaji zahrnujícími pediatrické pacienty s HeFH (ve věku 10 let až 17 let, n=29) v otevřené, 8týdenní studii.
Rod
Plazmatické koncentrace přípravku LIPITOR 40 mg u žen se liší od koncentrací u mužů (přibližně o 20 % vyšší pro Cmax a o 10 % nižší pro AUC); není však žádný klinicky významný rozdíl ve snížení LDL-C u LIPITORU 10 mg mezi muži a ženami.
Renální poškození
Onemocnění ledvin nemá žádný vliv na plazmatické koncentrace nebo snížení LDL-C přípravku LIPITOR; úprava dávky u pacientů s renální dysfunkcí tedy není nutná [viz DÁVKOVÁNÍ A PODÁVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Hemodialýza
I když nebyly provedeny studie u pacientů s terminálním onemocněním ledvin, neočekává se, že by hemodialýza významně zvýšila clearance přípravku LIPITOR 10 mg, protože léčivo se ve velké míře váže na plazmatické proteiny.
Poškození jater
pacientů s chronickým alkoholickým onemocněním jater jsou plazmatické koncentrace přípravku LIPITOR výrazně zvýšené. Cmax a AUC jsou každá 4krát vyšší u pacientů s Childs-Pugh A chorobou. Cmax a AUC jsou přibližně 16krát a 11krát zvýšené u pacientů s Childs-Pugh B chorobou (viz KONTRAINDIKACE ].
Studie lékových interakcí
Atorvastatin je substrátem jaterních transportérů, transportérů OATP1B1 a OATP1B3. Metabolity atorvastatinu jsou substráty OATP1B1. Atorvastatin je také identifikován jako substrát efluxního transportéru BCRP, který může omezovat střevní absorpci a biliární clearance atorvastatinu.
TABULKA 6: Účinek současně podávaných léků na farmakokinetiku atorvastatinu
TABULKA 7: Účinek atorvastatinu na farmakokinetiku současně podávaných léků
LIPITOR neměl žádný klinicky významný účinek na protrombinový čas, když byl podáván pacientům dlouhodobě léčeným warfarinem.
Klinické studie
Prevence kardiovaskulárních onemocnění
Anglo-Scandinavian Cardiac Outcomes Trial (ASCOT) byl hodnocen účinek přípravku LIPITOR 10 mg na fatální a nefatální ischemickou chorobu srdeční u 10 305 pacientů s hypertenzí ve věku 40–80 let (průměr 63 let), bez předchozího srdečního infarktu. infarktu a s hladinami TC ≤251 mg/dl (6,5 mmol/l). Kromě toho měli všichni pacienti alespoň 3 z následujících kardiovaskulárních rizikových faktorů: mužské pohlaví (81,1 %), věk >55 let (84,5 %), kouření (33,2 %), diabetes (24,3 %), ICHS v anamnéze v prvním stupně relativní (26 %), TC:HDL >6 (14,3 %), onemocnění periferních cév (5,1 %), hypertrofie levé komory (14,4 %), předchozí cerebrovaskulární příhoda (9,8 %), specifická abnormalita EKG (14,3 %), proteinurie /albuminurie (62,4 %). V této dvojitě zaslepené, placebem kontrolované studii byli pacienti léčeni antihypertenzní terapií (cílový TK
Účinek 10 mg/den přípravku LIPITOR na hladiny lipidů byl podobný jako v předchozích klinických studiích.
LIPITOR významně snížil četnost koronárních příhod [buď fatální ischemická choroba srdeční (46 příhod ve skupině s placebem vs. 40 příhod ve skupině LIPITOR 40 mg) nebo nefatální IM (108 příhod ve skupině s placebem vs. 60 příhod ve skupině LIPITOR 20 mg skupina)] s relativním snížením rizika o 36 % [(na základě incidence 1,9 % u LIPITOR 40 mg vs. 3,0 % u placeba), p=0,0005 (viz obrázek 1)]. Snížení rizika bylo konzistentní bez ohledu na věk, kouření, obezitu nebo přítomnost renální dysfunkce. Účinek přípravku LIPITOR byl pozorován bez ohledu na výchozí hladiny LDL. Vzhledem k malému počtu akcí byly výsledky u žen neprůkazné.
Obrázek 1: Účinek přípravku LIPITOR 10 mg/den na kumulativní výskyt nefatálního infarktu myokardu nebo úmrtí na koronární srdeční onemocnění (v ASCOT-LLA)
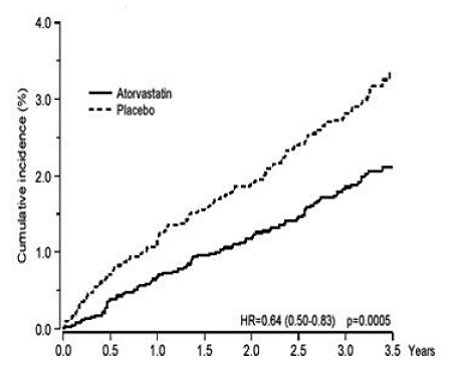
LIPITOR 40 mg také významně snížil relativní riziko revaskularizačních výkonů o 42 % (incidence 1,4 % pro LIPITOR 20 mg a 2,5 % pro placebo). Přestože snížení fatálních a nefatálních cévních mozkových příhod nedosáhlo předem definované hladiny významnosti (p=0,01), byl pozorován příznivý trend s 26% snížením relativního rizika (incidence 1,7 % pro LIPITOR a 2,3 % pro placebo) . Nebyl žádný významný rozdíl mezi léčebnými skupinami pro úmrtí z kardiovaskulárních příčin (p=0,51) nebo z nekardiovaskulárních příčin (p=0,17).
Collaborative Atorvastatin Diabetes Study (CARDS) byl hodnocen účinek přípravku LIPITOR na endpointy kardiovaskulárních onemocnění (CVD) u 2838 subjektů (94 % bílých, 68 % mužů) ve věku 40 – 75 let s diabetem 2. typu na základě kritérií WHO, bez předchozí anamnézy kardiovaskulárního onemocnění as LDL ≤ 160 mg/dl a TG ≤ 600 mg/dl. Kromě diabetu měli jedinci 1 nebo více z následujících rizikových faktorů: současné kouření (23 %), hypertenze (80 %), retinopatie (30 %) nebo mikroalbuminurie (9 %) nebo makroalbuminurie (3 %). Do studie nebyli zařazeni žádní pacienti na hemodialýze. V této multicentrické, placebem kontrolované, dvojitě zaslepené klinické studii byly subjekty náhodně rozděleny buď do LIPITORu 10 mg denně (1429) nebo placeba (1411) v poměru 1:1 a byly sledovány po střední dobu trvání 3,9 roku. Primárním cílovým parametrem byl výskyt kterékoli z hlavních kardiovaskulárních příhod: infarkt myokardu, akutní úmrtí na ICHS, nestabilní angina pectoris, koronární revaskularizace nebo cévní mozková příhoda. Primární analýzou byl čas do prvního výskytu primárního cílového bodu.
Základní charakteristiky subjektů byly: průměrný věk 62 let, průměrný HbA 7,7 %; medián LDL-C 120 mg/dl; medián TC 207 mg/dl; medián TG 151 mg/dl; medián HDL-C 52 mg/dl.
Účinek přípravku LIPITOR 10 mg/den na hladiny lipidů byl podobný jako v předchozích klinických studiích.
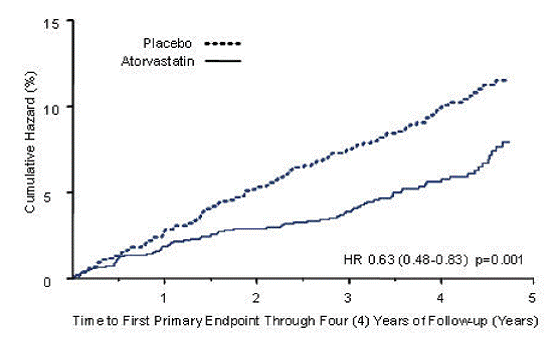
LIPITOR signifikantně snížil četnost velkých kardiovaskulárních příhod (primární koncové příhody) (83 příhod ve skupině LIPITOR vs. 127 příhod ve skupině s placebem) s relativním snížením rizika o 37 %, HR 0,63, 95% CI (0,48, 0,83) (p=0,001) (viz obrázek 2). Účinek přípravku LIPITOR byl pozorován bez ohledu na věk, pohlaví nebo výchozí hladiny lipidů.
LIPITOR 20 mg významně snížil riziko cévní mozkové příhody o 48 % (21 příhod ve skupině LIPITOR 10 mg oproti 39 příhodám ve skupině s placebem), HR 0,52, 95% CI (0,31, 0,89) (p=0,016) a snížil riziko MI o 42 % (38 příhod ve skupině LIPITOR vs. 64 příhod ve skupině s placebem), HR 0,58, 95,1 % CI (0,39, 0,86) (p=0,007). Nebyl žádný významný rozdíl mezi léčebnými skupinami pro anginu pectoris, revaskularizační výkony a akutní úmrtí na ICHS.
Ve skupině LIPITOR došlo k 61 úmrtím oproti 82 úmrtím ve skupině s placebem (HR 0,73, p=0,059).
Obrázek 2: Účinek LIPITORU 10 mg/den na čas do výskytu závažné kardiovaskulární příhody (infarkt myokardu, akutní ICHS, nestabilní angina pectoris, koronární revaskularizace nebo cévní mozková příhoda) u CARDS
Ve studii Treating to New Targets Study (TNT) byl hodnocen účinek přípravku LIPITOR 80 mg/den vs. LIPITOR 10 mg/den na snížení kardiovaskulárních příhod u 10 001 subjektů (94 % bílých, 81 % mužů, 38 % ≥65 let) s klinicky evidentním ischemickým onemocněním srdce, kteří dosáhli cílové hladiny LDL-C
Léčba přípravkem LIPITOR 80 mg/den významně snížila četnost MCVE (434 příhod ve skupině 80 mg/den vs. 548 příhod ve skupině 10 mg/den) s relativním snížením rizika o 22 %, HR 0,78, 95% CI (0,69, 0,89), p=0,0002 (viz obrázek 3 a tabulka 9). Celkové snížení rizika bylo konzistentní bez ohledu na věk (
Obrázek 3: Účinek přípravku LIPITOR 80 mg/den vs. 10 mg/den na čas do výskytu velkých kardiovaskulárních příhod (TNT)
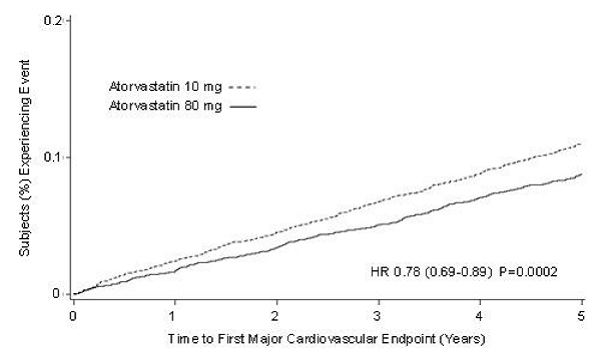
TABULKA 8: Přehled výsledků účinnosti v TNT
příhod, které zahrnovaly primární cílový ukazatel účinnosti, léčba přípravkem LIPITOR 80 mg/den významně snížila četnost nefatálního infarktu myokardu nesouvisejícího s výkonem a fatální a nefatální cévní mozkové příhody, nikoli však úmrtí na ICHS nebo resuscitovanou srdeční zástavu (tabulka 8). Z předem definovaných sekundárních cílových parametrů léčba přípravkem LIPITOR 80 mg/den významně snížila četnost koronární revaskularizace, anginy pectoris a hospitalizací pro srdeční selhání, nikoli však onemocnění periferních cév. Snížení četnosti CHF s hospitalizací bylo pozorováno pouze u 8 % pacientů s předchozí anamnézou CHF.
Nebyl žádný významný rozdíl mezi léčebnými skupinami z hlediska mortality ze všech příčin (tabulka 8). Podíl subjektů, u kterých došlo k kardiovaskulární smrti, včetně složek úmrtí na ICHS a fatální cévní mozkové příhody, byl číselně nižší ve skupině léčené přípravkem LIPITOR 80 mg než ve skupině léčené přípravkem LIPITOR 10 mg. Podíl subjektů, u kterých došlo k nekardiovaskulární smrti, byl číselně vyšší ve skupině léčené přípravkem LIPITOR 80 mg než ve skupině léčené přípravkem LIPITOR 10 mg.
Ve studii Incremental Decrease in Endpoints Through Aggressive Lipid Lowering Study (IDEAL) byla léčba přípravkem LIPITOR 80 mg/den srovnávána s léčbou simvastatinem 20 – 40 mg/den u 8 888 subjektů ve věku do 80 let s ICHS v anamnéze až posoudit, zda lze dosáhnout snížení KV rizika. Pacienti byli převážně muži (81 %), běloši (99 %) s průměrným věkem 61,7 let a průměrným LDL-C 121,5 mg/dl při randomizaci; 76 % bylo na léčbě statiny. V této prospektivní, randomizované, otevřené, zaslepené studii s koncovým bodem (PROBE) bez zaváděcího období byly subjekty sledovány po střední dobu trvání 4,8 roku. Průměrné hladiny LDL-C, TC, TG, HDL a non-HDL cholesterolu v týdnu 12 byly 78, 145, 115, 45 a 100 mg/dl během léčby 80 mg LIPITORU 40 mg a 105, 179, 142, 47 a 132 mg/dl během léčby 20 – 40 mg simvastatinu.
Mezi léčebnými skupinami nebyl žádný významný rozdíl pro primární cílový bod, četnost první velké koronární příhody (fatální ICHS, nefatální IM a resuscitovaná srdeční zástava): 411 (9,3 %) ve skupině s LIPITOREM 80 mg/den vs. 463 (10,4 %) ve skupině simvastatinem 20–40 mg/den, HR 0,89, 95% CI (0,78, 1,01), p=0,07.
Mezi léčebnými skupinami nebyly žádné významné rozdíly z hlediska mortality ze všech příčin: 366 (8,2 %) ve skupině LIPITOR 80 mg/den vs. 374 (8,4 %) ve skupině simvastatinem 20 – 40 mg/den. Podíl subjektů, u kterých došlo k CV nebo ne-KV úmrtí, byl podobný ve skupině s LIPITOREM 80 mg a ve skupině se simvastatinem 20 – 40 mg.
Hyperlipidémie a smíšená dyslipidémie
LIPITOR snižuje celkový-C, LDL-C, VLDL-C, apo B a TG a zvyšuje HDL-C u pacientů s hyperlipidémií (heterozygotní familiární a nefamiliární) a smíšenou dyslipidémií (Fredricksonův typ IIa a IIb). Terapeutická odpověď je pozorována během 2 týdnů a maximální odpovědi je obvykle dosaženo během 4 týdnů a udržuje se během chronické léčby.
LIPITOR je účinný u široké škály populací pacientů s hyperlipidémií, s hypertriglyceridemií i bez ní, u mužů a žen au starších osob.
Ve dvou multicentrických, placebem kontrolovaných studiích závislosti odpovědi na dávce u pacientů s hyperlipidémií, LIPITOR podávaný v jedné dávce po dobu 6 týdnů významně snížil celkový-C, LDL-C, apo B a TG. (Souhrnné výsledky jsou uvedeny v tabulce 9.)
TABULKA 9: Odpověď na dávku u pacientů s primární hyperlipidémií (upravená střední % změna oproti výchozí hodnotě)*
pacientů s Fredricksonovou hyperlipoproteinémií typu IIa a IIb shromážděných z 24 kontrolovaných studií byly střední (25. a 75. percentil) procentuální změny HDL-C oproti výchozí hodnotě pro LIPITOR 10, 20, 40 a 80 mg 6,4 (-1,4, 14), 8,7 (0, 17), 7,8 (0, 16) a 5,1 (-2,7, 15). Kromě toho analýza shromážděných dat prokázala konzistentní a významný pokles celkového cholesterolu, LDL-C, TG, celkového cholesterolu/HDL-C a LDLC/HDL-C.
Ve třech multicentrických, dvojitě zaslepených studiích u pacientů s hyperlipidémií byl LIPITOR srovnáván s jinými statiny. Po randomizaci byli pacienti léčeni po dobu 16 týdnů buď LIPITOREM 10 mg denně, nebo fixní dávkou srovnávací látky (tabulka 10).
TABULKA 10: Průměrná procentní změna oproti výchozí hodnotě v koncovém bodě (dvojitě zaslepené, randomizované, aktivně kontrolované studie)
Vliv na klinické výsledky rozdílů v účincích měnících lipidy mezi léčbami uvedenými v tabulce 10 není znám. Tabulka 10 neobsahuje údaje srovnávající účinky LIPITORU 10 mg a vyšších dávek lovastatinu, pravastatinu a simvastatinu. Léky srovnávané ve studiích shrnutých v tabulce nejsou nutně zaměnitelné.
Hypertriglyceridémie
Odpověď na LIPITOR u 64 pacientů s izolovanou hypertriglyceridémií (Fredrickson typ IV) léčených v několika klinických studiích je uvedena v tabulce níže (Tabulka 11). U pacientů léčených přípravkem LIPITOR byl medián (min, max) výchozí hladiny TG 565 (267 – 1502).
TABULKA 11: Kombinovaní pacienti s izolovaným zvýšeným TG: Medián (min, max) Procentuální změna od výchozí hodnoty
Dysbetalipoproteinémie
Výsledky otevřené zkřížené studie 16 pacientů (genotypy: 14 apo E2/E2 a 2 apo E3/E2) s dysbetalipoproteinémií (Fredrickson typ III) jsou uvedeny v tabulce níže (Tabulka 12).
TABULKA 12: Otevřená zkřížená studie u 16 pacientů s dysbetalipoproteinémií (Fredricksonův typ III)
Homozygotní familiární hypercholesterolémie
Ve studii bez souběžné kontrolní skupiny dostávalo 29 pacientů ve věku 6 až 37 let s HoFH maximální denní dávky 20 až 80 mg LIPITORU. Průměrné snížení LDL-C v této studii bylo 18 %. 25 pacientů se snížením LDL-C mělo průměrnou odpověď 20 % (rozmezí 7 % až 53 %, medián 24 %); zbývající 4 pacienti měli 7% až 24% zvýšení LDL-C. Pět z 29 pacientů mělo chybějící funkci LDL-receptoru. Z toho 2 pacienti měli také portakavální zkrat a neměli žádné významné snížení LDL-C. Zbývající 3 pacienti s negativními receptory měli průměrné snížení LDL-C o 22 %.
Heterozygotní familiární hypercholesterolémie u dětských pacientů
Ve dvojitě zaslepené, placebem kontrolované studii, po které následovala otevřená fáze, bylo 187 chlapců a postmenarchálních dívek ve věku 10 až 17 let (průměrný věk 14,1 let) s heterozygotní familiární hypercholesterolemií (HeFH) nebo těžkou hypercholesterolemií. randomizováni do skupiny LIPITOR (n=140) nebo placeba (n=47) po dobu 26 týdnů a poté všichni dostávali LIPITOR 40 mg po dobu 26 týdnů. Zařazení do studie vyžaduje 1) výchozí hladinu LDL-C ≥ 190 mg/dl nebo 2) výchozí hladinu LDL-C ≥ 160 mg/dl a pozitivní rodinnou anamnézu FH nebo dokumentované předčasné kardiovaskulární onemocnění prvního nebo druhého stupně relativní. Průměrná výchozí hodnota LDL-C byla 218,6 mg/dl (rozmezí: 138,5 – 385,0 mg/dl) ve skupině LIPITOR ve srovnání s 230,0 mg/dl (rozmezí: 160,0 – 324,5 mg/dl) ve skupině s placebem . Dávka přípravku LIPITOR (jednou denně) byla 10 mg po dobu prvních 4 týdnů a byla zvýšena na 20 mg, pokud hladina LDL-C byla > 130 mg/dl. Počet pacientů léčených přípravkem LIPITOR, kteří po 4. týdnu během dvojitě zaslepené fáze vyžadovali titraci na 20 mg, byl 78 (55,7 %).
LIPITOR 10 mg významně snížil plazmatické hladiny celkového-C, LDL-C, triglyceridů a apolipoproteinu B během 26týdenní dvojitě zaslepené fáze (viz tabulka 13).
TABULKA 13: Účinky LIPITORu měnící lipidy u dospívajících chlapců a dívek s heterozygotní familiární hypercholesterolémií nebo těžkou hypercholesterolémií (průměrná procentní změna od výchozí hodnoty na konci v populaci zamýšlené léčby)
Průměrná dosažená hodnota LDL-C byla 130,7 mg/dl (rozmezí: 70,0 – 242,0 mg/dl) ve skupině LIPITOR 10 mg ve srovnání s 228,5 mg/dl (rozmezí: 152,0 – 385,0 mg/dl) u placeba skupině během 26týdenní dvojitě zaslepené fáze.
Atorvastatin byl rovněž zkoumán v tříleté otevřené, nekontrolované studii, která zahrnovala 163 pacientů s HeFH ve věku 10 až 15 let (82 chlapců a 81 dívek). Všichni pacienti měli klinickou diagnózu HeFH potvrzenou genetickou analýzou (pokud již nebyla potvrzena rodinnou anamnézou). Přibližně 98 % byli běloši a méně než 1 % byli černoši nebo Asiaté. Průměrný LDL-C na začátku byl 232 mg/dl. Počáteční dávka atorvastatinu byla 10 mg jednou denně a dávky byly upraveny tak, aby bylo dosaženo cíle
Dlouhodobá účinnost léčby přípravkem LIPITOR 20 mg v dětství na snížení morbidity a mortality v dospělosti nebyla stanovena.
INFORMACE PRO PACIENTA
LIPITOR® tablety vápenaté soli atorvastatinu (LIP-ih-tore))
Přečtěte si informace pro pacienty, které jsou součástí přípravku LIPITOR 20 mg, než jej začnete užívat, a pokaždé, když dostanete náplň. Mohou se objevit nové informace. Tato příbalová informace nenahrazuje rozhovor s lékařem o vašem stavu nebo léčbě.
Máte-li jakékoli otázky týkající se přípravku LIPITOR, zeptejte se svého lékaře nebo lékárníka.
Co je LIPITOR?
LIPITOR je lék na předpis, který snižuje hladinu cholesterolu v krvi. Snižuje LDL-C („špatný“ cholesterol) a triglyceridy ve vaší krvi. Může také zvýšit váš HDL-C („dobrý“ cholesterol). LIPITOR je určen pro dospělé a děti od 10 let, jejichž cholesterol se dostatečně nesnižuje cvičením a nízkotučnou dietou.
LIPITOR může snížit riziko srdečního infarktu, mrtvice, určitých typů srdečních operací a bolesti na hrudi u pacientů, kteří mají srdeční onemocnění nebo rizikové faktory srdečního onemocnění, jako jsou:
- věk, kouření, vysoký krevní tlak, nízký HDL-C, srdeční onemocnění v rodině.
LIPITOR 20 mg může snížit riziko srdečního infarktu nebo mozkové mrtvice u pacientů s cukrovkou a rizikovými faktory, jako jsou:
- oční problémy, problémy s ledvinami, kouření nebo vysoký krevní tlak.
LIPITOR 40 mg začíná působit přibližně za 2 týdny.
Co je Cholesterol?
Cholesterol a triglyceridy jsou tuky, které se tvoří ve vašem těle. Nacházejí se také v potravinách. Pro dobré zdraví potřebujete trochu cholesterolu, ale příliš mnoho pro vás není dobré. Cholesterol a triglyceridy mohou ucpat vaše krevní cévy. Je zvláště důležité snížit hladinu cholesterolu, pokud máte onemocnění srdce, kouříte, máte cukrovku nebo vysoký krevní tlak, jste starší nebo pokud se srdeční onemocnění začíná ve vaší rodině brzy.
Kdo by neměl užívat LIPITOR 40 mg?
Neužívejte LIPITOR 10 mg, jestliže:
- jste těhotná nebo si myslíte, že byste mohla být těhotná, nebo těhotenství plánujete. LIPITOR může poškodit vaše nenarozené dítě. Pokud otěhotníte, přestaňte LIPITOR 40 mg užívat a ihned kontaktujte svého lékaře.
- kojím. LIPITOR 20 mg může přecházet do vašeho mateřského mléka a může poškodit vaše dítě.
- mít problémy s játry.
- jste alergičtí na LIPITOR nebo na kteroukoli jeho složku. Účinnou látkou je atorvastatin. Úplný seznam složek přípravku LIPITOR naleznete na konci této příbalové informace.
Dávkování přípravku LIPITOR 20 mg nebylo u dětí mladších 10 let stanoveno.
Než začnete LIPITOR
Informujte svého lékaře, pokud:
- máte svalové bolesti nebo slabost
- vypijte více než 2 sklenice alkoholu denně
- mít cukrovku
- mít problém se štítnou žlázou
- mít problémy s ledvinami
Některé léky by se neměly užívat s LIPITORem. Informujte svého lékaře o všech lécích, které užíváte, včetně léků na předpis i bez předpisu, vitamínů a bylinných doplňků. LIPITOR a některé další léky se mohou vzájemně ovlivňovat a způsobit závažné nežádoucí účinky. Zejména informujte svého lékaře, pokud užíváte léky na:
- váš imunitní systém
- cholesterolu
- infekce
- antikoncepce
- srdeční selhání
- HIV nebo AIDS
- virus hepatitidy C
- antivirotika
Znát všechny léky, které užíváte. Mějte jejich seznam u sebe, abyste jej mohli ukázat svému lékaři a lékárníkovi.
Jak mám užívat LIPITOR 40 mg?
- Užívejte LIPITOR 20 mg přesně podle pokynů svého lékaře. Bez porady se svým lékařem neměňte dávku ani neukončujte LIPITOR. Váš lékař může během léčby přípravkem LIPITOR provést krevní testy, aby zkontroloval hladinu cholesterolu. Vaše dávka přípravku LIPITOR může být změněna na základě těchto výsledků krevních testů.
- Užívejte LIPITOR každý den v kteroukoli denní dobu přibližně ve stejnou dobu každý den. LIPITOR 10 mg lze užívat s jídlem nebo bez jídla. Tablety LIPITOR před užitím nerozbíjejte.
- Před podáním přípravku LIPITOR by Váš lékař měl začít s nízkotučnou dietou. Zůstaňte na této nízkotučné dietě, když užíváte LIPITOR.
- Pokud vynecháte dávku přípravku LIPITOR, vezměte si ji, jakmile si vzpomenete. Neužívejte LIPITOR 10 mg, pokud od vynechání poslední dávky uplynulo více než 12 hodin. Počkejte a vezměte si další dávku v obvyklou dobu. Neužívejte 2 dávky přípravku LIPITOR 10 mg současně.
- Pokud užijete příliš mnoho přípravku LIPITOR nebo se předávkujete, okamžitě zavolejte svého lékaře nebo Poison Control Center. Nebo jděte na nejbližší pohotovost.
Čemu se mám vyvarovat při užívání LIPITOR 10 mg?
- Než začnete užívat jakékoli nové léky, poraďte se se svým lékařem. To zahrnuje léky na předpis i bez předpisu, vitamíny a bylinné doplňky. LIPITOR a některé další léky se mohou vzájemně ovlivňovat a způsobit závažné nežádoucí účinky.
- Neotěhotnět. Pokud otěhotníte, přestaňte přípravek LIPITOR ihned užívat a zavolejte svého lékaře.
Jaké jsou možné vedlejší účinky přípravku LIPITOR 10 mg?
LIPITOR může způsobit závažné nežádoucí účinky. Tyto nežádoucí účinky se vyskytly pouze u malého počtu lidí. Váš lékař vás na ně může sledovat. Tyto nežádoucí účinky obvykle vymizí, pokud je Vaše dávka snížena nebo je LIPITOR vysazen. Tyto závažné nežádoucí účinky zahrnují:
- Svalové problémy. LIPITOR 40 mg může způsobit vážné svalové problémy, které mohou vést k problémům s ledvinami, včetně selhání ledvin. Pokud spolu s přípravkem LIPITOR užíváte některé další léky, máte vyšší pravděpodobnost svalových problémů.
- Problémy s játry. Váš lékař by Vám měl udělat krevní testy, aby zkontroloval Vaše játra dříve, než začnete užívat přípravek LIPITOR 20 mg a pokud se u Vás během užívání přípravku LIPITOR objeví příznaky jaterních potíží. Okamžitě zavolejte svého lékaře, pokud máte následující příznaky jaterních problémů:
- cítit se unavený nebo slabý
- ztráta chuti k jídlu
- bolest v horní části břicha
- tmavě jantarově zbarvená moč
- zežloutnutí kůže nebo očního bělma
Okamžitě zavolejte svého lékaře, pokud máte:
- svalové problémy, jako je slabost, citlivost nebo bolest, ke kterým dochází bez dobrého důvodu, zvláště pokud máte také horečku nebo se cítíte unavenější než obvykle. To může být časným příznakem vzácného svalového problému.
- svalové problémy, které neustupují ani poté, co vám lékař doporučil přestat užívat LIPITOR. Váš lékař může provést další testy, aby diagnostikoval příčinu vašich svalových problémů.
- alergické reakce včetně otoků obličeje, rtů, jazyka a/nebo hrdla, které mohou způsobit potíže s dýcháním nebo polykáním, které mohou vyžadovat okamžitou léčbu.
- nevolnost a zvracení.
- vylučování hnědé nebo tmavě zbarvené moči.
- cítíte se unavenější než obvykle
- vaše kůže a oční bělmo zežloutnou.
- bolest břicha.
- alergické kožní reakce.
V klinických studiích pacienti hlásili následující časté nežádoucí účinky při užívání přípravku LIPITOR: průjem, žaludeční nevolnost, bolesti svalů a kloubů a změny v některých laboratorních krevních testech.
U přípravku LIPITOR byly hlášeny následující další nežádoucí účinky:
únava, problémy se šlachami, ztráta paměti a zmatenost.
Poraďte se se svým lékařem nebo lékárníkem, pokud máte nežádoucí účinky, které vás obtěžují nebo které nevymizí.
To nejsou všechny vedlejší účinky přípravku LIPITOR. Požádejte svého lékaře nebo lékárníka o úplný seznam.
Jak skladuji LIPITOR
- Skladujte LIPITOR při pokojové teplotě, 68 až 77 °F (20 až 25 °C).
- Neuchovávejte léky, které jsou zastaralé nebo které již nepotřebujete.
- Uchovávejte LIPITOR a všechny léky mimo dosah dětí. Ujistěte se, že pokud lék vyhodíte, je mimo dosah dětí.
Obecné informace o LIPITOR
Léky jsou někdy předepisovány na stavy, které nejsou uvedeny v příbalových informacích pro pacienty. Nepoužívejte LIPITOR 10 mg na stav, pro který nebyl předepsán. Nedávejte LIPITOR jiným lidem, i když mají stejný problém jako vy. Může jim to ublížit.
Tento leták shrnuje nejdůležitější informace o přípravku LIPITOR. Pokud chcete více informací, promluvte si se svým lékařem. Můžete požádat svého lékaře nebo lékárníka o informace o přípravku LIPITOR, který je určen pro zdravotníky. Nebo můžete přejít na webovou stránku LIPITOR na adrese www.lipitor.com.
Jaké jsou ingredience v LIPITORU?
Aktivní složka: atorvastatin vápníku
Neaktivní ingredience: uhličitan vápenatý, USP; kandelilový vosk, FCC; sodná sůl kroskarmelózy, NF; hydroxypropylcelulóza, NF; monohydrát laktózy, NF; stearát hořečnatý, NF; mikrokrystalická celulóza, NF; Opadry White YS-1-7040 (hypromelóza, polyethylenglykol, mastek, oxid titaničitý); polysorbát 80, NF; simetikonová emulze.
