Zanaflex 2mg, 4mg Tizanidine Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Zanaflex 2 mg a jak se používá?
Zanaflex 2 mg je lék na předpis používaný k léčbě příznaků svalové ztuhlosti (spasticity) spojených se stavy, jako je dětská mozková obrna nebo jiné neurologické poruchy. Zanaflex 2 mg lze užívat samostatně nebo s jinými léky.
Zanaflex 2 mg patří do třídy léků nazývaných centrální alfa-2-adrenergní agonista.
Není známo, zda je přípravek Zanaflex bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Zanaflex?
Zanaflex 2 mg může způsobit závažné nežádoucí účinky, včetně:
- nízký krevní tlak,
- abnormální jaterní testy,
- ospalost,
- halucinace,
- nadměrná ospalost,
- pomalý srdeční tep,
- suchá ústa,
- únava a
- slabost
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Zanaflex patří:
- suchá ústa,
- únava,
- slabost,
- únava,
- únava,
- závrať,
- Infekce močových cest,
- zácpa,
- abnormální jaterní testy,
- zvracení,
- porucha řeči,
- líné oko (tupozrakost),
- frekvence močení,
- příznaky chřipky,
- nekontrolované pohyby svalů,
- nervozita,
- bolest v krku a
- rýma
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Zanaflex. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
Zanaflex® (tizanidin hydrochlorid) je centrální alfa2-adrenergní agonista. Tizanidin HCl je bílý až téměř bílý jemný krystalický prášek, který je bez zápachu nebo se slabým charakteristickým zápachem. Tizanidin je mírně rozpustný ve vodě a methanolu; rozpustnost ve vodě klesá se zvyšujícím se pH. Jeho chemický název je 5-chlor-4-(2-imidazolin-2-ylamino)-2,1,3-benzothiadiazol monohydrochlorid. Molekulární vzorec tizanidinu je C9H8ClN5S-HCl, jeho molekulová hmotnost je 290,2 a jeho strukturní vzorec je:
Zanaflex 4mg Capsules® se dodávají jako 2, 4 a 6 mg tobolky pro perorální podání. Zanaflex Capsules® obsahují aktivní složku, tizanidin hydrochlorid (2,29 mg ekvivalent 2 mg báze tizanidinu, 4,58 mg ekvivalent 4 mg báze tizanidinu a 6,87 mg ekvivalent 6 mg báze tizanidinu) a neaktivní složky, hypromelózu, oxid křemičitý, cukrové kuličky, oxid titaničitý, želatinu a barviva.
Tablety Zanaflex® se dodávají jako 4 mg tablety pro perorální podání. Tablety Zanaflex® obsahují účinnou látku, tizanidin hydrochlorid (4,58 mg ekvivalent 4 mg tizanidinové báze) a neaktivní složky, koloidní oxid křemičitý, kyselinu stearovou, mikrokrystalickou celulózu a bezvodou laktózu.
INDIKACE
Zanaflex je indikován k léčbě spasticity. Vzhledem ke krátkému trvání terapeutického účinku by léčba Zanaflexem měla být vyhrazena pro ty denní aktivity a časy, kdy je nejdůležitější zmírnění spasticity (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
DÁVKOVÁNÍ A PODÁVÁNÍ
Informace o dávkování
Zanaflex 2 mg Capsules® nebo tablety Zanaflex® lze předepisovat s jídlem nebo bez jídla. Jakmile bylo zvoleno složení a bylo učiněno rozhodnutí užívat s jídlem nebo bez jídla, tento režim by neměl být měněn.
Potrava má komplexní účinky na farmakokinetiku tizanidinu, která se liší podle různých přípravků. Zanaflex Capsules a Zanaflex tablety jsou vzájemně bioekvivalentní nalačno (více než 3 hodiny po jídle), ale ne za podmínek nasycení (do 30 minut po jídle). Tyto farmakokinetické rozdíly mohou vést ke klinicky významným rozdílům při změně podávání tablety a tobolky a při změně podávání mezi stavem nasycení nebo nalačno. Tyto změny mohou mít za následek zvýšené nežádoucí účinky nebo zpožděný nebo rychlejší nástup aktivity, v závislosti na povaze změny. Z tohoto důvodu by měl být předepisující lékař důkladně obeznámen se změnami v kinetice souvisejícími s těmito různými stavy [viz KLINICKÁ FARMAKOLOGIE ].
Doporučená počáteční dávka je 2 mg. Protože účinek přípravku Zanaflex vrcholí přibližně za 1 až 2 hodiny po dávce a vymizí mezi 3 až 6 hodinami po dávce, lze léčbu podle potřeby opakovat v 6 až 8 hodinových intervalech, maximálně však do tří dávek za 24 hodin.
Dávkování může být postupně zvyšováno o 2 mg až 4 mg v každé dávce, s 1 až 4 dny mezi zvýšením dávky, dokud není dosaženo uspokojivého snížení svalového tonusu. Celková denní dávka by neměla překročit 36 mg. Jednotlivé dávky vyšší než 16 mg nebyly studovány.
Dávkování u pacientů s renálním poškozením
Zanaflex by měl být používán s opatrností u pacientů s renální insuficiencí (clearance kreatininu VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Dávkování u pacientů s poruchou jater
Zanaflex 4 mg by měl být používán s opatrností u pacientů s jakoukoli poruchou funkce jater. U těchto pacientů by během titrace měly být jednotlivé dávky sníženy. Pokud jsou nutné vyšší dávky, je třeba zvýšit jednotlivé dávky spíše než frekvenci dávkování. Sledování hladin aminotransferáz se doporučuje pro výchozí stav a 1 měsíc po dosažení maximální dávky nebo při podezření na poškození jater (viz Použití u konkrétních populací ].
Vysazení drog
Pokud je třeba léčbu přerušit, zejména u pacientů, kteří užívají vysoké dávky (20 mg až 36 mg denně) po dlouhou dobu (9 týdnů nebo déle) nebo kteří mohou být současně léčeni narkotiky, měla by se dávka snižovat pomalu ( 2 mg až 4 mg denně), aby se minimalizovalo riziko abstinenční a rebound hypertenze, tachykardie a hypertonie [viz Zneužívání drog a závislost ].
JAK DODÁVÁNO
Dávkové formy A Síly
Kapsle
mg: Světle modré neprůhledné tělo se světle modrým neprůhledným víčkem s vytištěným „2 MG“ na víčku 4 mg: Bílé neprůhledné tělo s modrým neprůhledným víčkem s vytištěným „4 MG“ na víčku 6 mg: Modré neprůhledné tělo s bílý pruh a modré neprůhledné víčko s vytištěným „6 MG“ na víčku
Tablety
4 mg bílé nepotahované tablety s půlicí rýhou na jedné straně a vyraženým „A594“ na druhé straně
Skladování A Manipulace
Kapsle Zanaflex®
Kapsle Zanaflex Capsules® (tizanidin hydrochlorid). jsou dostupné ve třech silách jako dvoudílné tvrdé želatinové tobolky obsahující tizanidinu hydrochloridum 2,29 mg, 4,58 mg a 6,87 mg, což odpovídá 2 mg, 4 mg a 6 mg báze tizanidinu.
2 mg tobolky mají světle modré neprůhledné tělo se světle modrým neprůhledným uzávěrem s vytištěným „2 MG“ na uzávěru: lahvičky se 150 tobolkami ( NDC 70515-602-15)
4 mg tobolky mají bílé neprůhledné tělo s modrým neprůhledným uzávěrem s vytištěným „4 MG“ na uzávěru: lahvičky se 150 tobolkami ( NDC 70515-604-15)
6mg tobolky mají modré neprůhledné tělo s bílým pruhem a modrý neprůhledný uzávěr s vytištěným „6 MG“ na tobolkách: lahvičky po 150 tobolkách ( NDC 70515-606-15)
Skladujte při teplotě 25 °C (77 °F); povoleny výchylky do 15 °C až 30 °C (59 °F až 86 °F) [viz USP řízená pokojová teplota ]. Dávkujte v nádobách s dětským bezpečnostním uzávěrem.
Tablety Zanaflex®
Tablety Zanaflex® (tizanidin hydrochlorid) jsou dostupné jako 4 mg bílé nepotahované tablety obsahující 4,58 mg tizanidinu hydrochloridu, což odpovídá 4 mg báze tizanidinu. Tablety mají na jedné straně půlicí rýhu a na druhé straně je vyraženo „A594“. Tablety se dodávají následovně: lahvičky po 150 tabletách (NDC 70515-594-15).
Skladujte při teplotě 25 °C (77 °F); povoleny výchylky do 15 °C až 30 °C (59 °F až 86 °F) [viz USP řízená pokojová teplota ].
Dávkujte v nádobách s dětským bezpečnostním uzávěrem.
Vyrobeno pro: Covis Pharma Zug, 6300 Švýcarsko. Upraveno: prosinec 2020
VEDLEJŠÍ EFEKTY
Následující nežádoucí účinky jsou popsány jinde v jiných částech informací o předepisování:
- Hypotenze [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Poranění jater [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Sedace [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Halucinóza / symptomy podobné psychotickým [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hypersenzitivní reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi rozdílných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v klinické praxi.
Byly provedeny tři dvojitě zaslepené, randomizované, placebem kontrolované klinické studie k vyhodnocení účinku tizanidinu na kontrolu spasticity. Dvě studie byly provedeny u pacientů s roztroušenou sklerózou a jedna u pacientů s poraněním míchy. Každá studie měla 13týdenní období aktivní léčby, které zahrnovalo 3týdenní titrační fázi na maximální tolerovanou dávku až 36 mg/den ve třech rozdělených dávkách, 9týdenní fázi plateau, kdy byla dávka tizanidinu udržována konstantní a Snižování dávky po 1 týdnu. Celkem 264 pacientů dostávalo tizanidin a 261 pacientů dostávalo placebo. Ve všech třech studiích se věk pacientů pohyboval od 15 do 69 let a 51,4 procenta byly ženy. Střední dávka během fáze plateau se pohybovala v rozmezí 20-28 mg/den.
Nejčastější nežádoucí účinky hlášené v placebem kontrolovaných klinických studiích s opakovanými dávkami zahrnujícími 264 pacientů se spasticitou byly sucho v ústech, ospalost/útlum, astenie (slabost, únava a/nebo únava) a závratě. Tři čtvrtiny pacientů hodnotily příhody jako mírné až středně závažné a jedna čtvrtina pacientů hodnotila příhody jako závažné. Zdálo se, že tyto události souvisejí s dávkou.
Tabulka 1 uvádí známky a příznaky, které byly hlášeny u více než 2 % pacientů ve třech placebem kontrolovaných studiích s opakovanými dávkami, kteří dostávali Zanaflex, kde frekvence ve skupině se Zanaflexem byla vyšší než ve skupině s placebem. Pro účely srovnání je také uvedena odpovídající frekvence příhody (na 100 pacientů) mezi pacienty léčenými placebem.
V jednodávkové, placebem kontrolované studii zahrnující 142 pacientů se spasticitou v důsledku roztroušené sklerózy (studie 1) [viz Klinické studie byli pacienti konkrétně dotázáni, zda se u nich objevil některý ze čtyř nejčastějších nežádoucích účinků: sucho v ústech, somnolence (ospalost), astenie (slabost, únava a/nebo únava) a závratě. Kromě toho byla pozorována hypotenze a bradykardie. Výskyt těchto reakcí je shrnut v tabulce 2. Jiné příhody byly obecně hlášeny v míře 2 % nebo méně.
Postmarketingové zkušenosti
Během používání přípravku Zanaflex po schválení byly zjištěny následující nežádoucí účinky. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Některé příhody, jako je somnolence, sucho v ústech, hypotenze, snížený krevní tlak, bradykardie, závratě, slabost nebo astenie, svalové křeče, halucinace, únava, abnormality jaterních testů a hepatotoxicita, byly pozorovány v postmarketingových a klinických studiích a jsou diskutovány v předchozích částech tohoto dokumentu.
Následující nežádoucí účinky byly identifikovány jako vyskytující se po uvedení přípravku Zanaflex na trh. Na základě poskytnutých informací o těchto reakcích nelze zcela vyloučit příčinnou souvislost se Zanaflexem. Události jsou uvedeny v pořadí podle klesající klinické významnosti; závažnost v postmarketingovém prostředí není hlášena.
- Stevens Johnsonův syndrom
- Anafylaktická reakce
- Exfoliativní dermatitida
- Ventrikulární tachykardie
- Hepatitida
- Křeč
- Deprese
- Artralgie
- Parestézie
- Vyrážka
- Třes
DROGOVÉ INTERAKCE
Fluvoxamin
Současné užívání fluvoxaminu a Zanaflexu 4 mg je kontraindikováno. Změny farmakokinetiky tizanidinu při podávání s fluvoxaminem vedly k významnému snížení krevního tlaku, zvýšené ospalosti a zvýšenému psychomotorickému poškození (viz KONTRAINDIKACE a KLINICKÁ FARMAKOLOGIE ].
Ciprofloxacin
Současné užívání ciprofloxacinu a Zanaflexu je kontraindikováno. Změny farmakokinetiky tizanidinu při podávání s ciprofloxacinem vedly k významnému snížení krevního tlaku, zvýšené ospalosti a zvýšenému psychomotorickému poškození (viz KONTRAINDIKACE a KLINICKÁ FARMAKOLOGIE ].
Jiné inhibitory CYP1A2 než fluvoxamin a ciprofloxacin
důvodu potenciálních lékových interakcí je současné užívání Zanaflexu s jinými inhibitory CYP1A2, jako je zileuton, fluorochinolony jiné než silné inhibitory CYP1A2 (které jsou kontraindikovány), antiarytmika (amiodaron, mexiletin, propafenon a verapamil), cimetidin, famotidin, perorální kontraceptiva acykloviru a tiklopidinu) je třeba se vyhnout. Pokud je jejich použití klinicky nezbytné, léčba by měla být zahájena dávkou 2 mg a zvyšována v krocích po 2-4 mg denně na základě odpovědi pacienta na léčbu. Pokud se objeví nežádoucí reakce, jako je hypotenze, bradykardie nebo nadměrná ospalost, snižte nebo přerušte léčbu Zanaflexem (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
Orální antikoncepce
Současné užívání přípravku Zanaflex 2 mg s perorálními kontraceptivy se nedoporučuje. Je-li však současné užívání klinicky nezbytné, začněte Zanaflex 4 mg jednou dávkou 2 mg a zvyšujte po 2-4 mg krocích denně na základě odpovědi pacienta na léčbu. Pokud se objeví nežádoucí reakce, jako je hypotenze, bradykardie nebo nadměrná ospalost, snižte nebo přerušte léčbu Zanaflexem (viz KLINICKÁ FARMAKOLOGIE ].
Alkohol
Alkohol zvyšuje celkové množství drogy v krevním řečišti po dávce Zanaflexu. To bylo spojeno se zvýšením nežádoucích účinků přípravku Zanaflex. Účinky Zanaflexu a alkoholu tlumící CNS jsou aditivní [viz KLINICKÁ FARMAKOLOGIE ].
Další látky tlumící CNS
Sedativní účinky přípravku Zanaflex s látkami tlumícími CNS (např. benzodiazepiny, opioidy, tricyklická antidepresiva) mohou být aditivní. Sledujte pacienty, kteří užívají Zanaflex 2 mg s jiným tlumičem CNS, na příznaky nadměrné sedace [viz KLINICKÁ FARMAKOLOGIE ].
a2-adrenergní agonisté
Protože hypotenzní účinky mohou být kumulativní, nedoporučuje se užívat Zanaflex 4 mg s jinými α2-adrenergními agonisty (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Zneužívání drog a závislost
Zneužívání
Potenciál zneužití nebyl hodnocen ve studiích na lidech. Potkani byli schopni rozlišit tizanidin od fyziologického roztoku ve standardním rozlišovacím paradigmatu po tréninku, ale nedokázali zobecnit účinky morfinu, kokainu, diazepamu nebo fenobarbitalu na tizanidin.
Závislost
Tizanidin je blízce příbuzný klonidinu, který je často zneužíván v kombinaci s narkotiky a je známo, že způsobuje příznaky rebound fenoménu po náhlém vysazení. Byly hlášeny tři případy rebound symptomů po náhlém vysazení tizanidinu. Kazuistiky naznačují, že tito pacienti také zneužívali narkotika. Abstinenční příznaky zahrnovaly hypertenzi, tachykardii, hypertonii, třes a úzkost. Abstinenční příznaky se častěji vyskytují v případech, kdy jsou užívány vysoké dávky, zejména po delší dobu, nebo při současném užívání narkotik. Pokud je třeba léčbu přerušit, dávka by měla být snižována pomalu, aby se minimalizovalo riziko abstinenčních příznaků (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Ukázalo se, že opice si tizanidin samy podávaly způsobem závislým na dávce a náhlé vysazení tizanidinu vyvolalo přechodné příznaky abstinenčního syndromu v dávkách > 35krát vyšší, než je maximální doporučená dávka pro člověka na základě mg/m². Tyto přechodné abstinenční příznaky (zvýšená lokomoce, záškuby těla a averzivní chování vůči pozorovateli) nebyly podáním naloxonu zvráceny.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Hypotenze
Tizanidin je α2-adrenergní agonista, který může vyvolat hypotenzi. V postmarketingovém prostředí byla hlášena synkopa. Pravděpodobnost významné hypotenze může být minimalizována titrací dávky a zaměřením pozornosti na známky a příznaky hypotenze před dalším zvýšením dávky. Navíc u pacientů, kteří se pohybují z polohy vleže na zádech do pevné vzpřímené polohy, může být zvýšené riziko hypotenze a ortostatických účinků.
Při použití Zanaflexu u pacientů, kteří dostávají souběžnou antihypertenzní léčbu, sledujte hypotenzi. Nedoporučuje se užívat Zanaflex 2 mg s jinými α2-adrenergními agonisty. Při současném podávání fluvoxaminu nebo ciprofloxacinu a jednotlivých dávkách 4 mg Zanaflexu byla hlášena klinicky významná hypotenze (pokles systolického i diastolického tlaku). Proto je současné užívání přípravku Zanaflex s fluvoxaminem nebo ciprofloxacinem, silnými inhibitory CYP1A2, kontraindikováno (viz KONTRAINDIKACE a DROGOVÉ INTERAKCE ].
Riziko poranění jater
Zanaflex může způsobit hepatocelulární poškození jater. Zanaflex 4 mg by měl být používán s opatrností u pacientů s jakoukoli poruchou funkce jater. Sledování hladin aminotransferáz se doporučuje pro výchozí stav a 1 měsíc po dosažení maximální dávky nebo při podezření na poškození jater (viz DÁVKOVÁNÍ A PODÁVÁNÍ a Použití u konkrétních populací ].
Sedace
Zanaflex může způsobit sedaci, která může narušit každodenní činnost. Ve studiích s více dávkami prevalence pacientů se sedací vrcholila po prvním týdnu titrace a poté zůstala stabilní po dobu udržovací fáze studie. Tlumící účinky Zanaflexu na CNS s alkoholem a jinými látkami tlumícími CNS (např. benzodiazepiny, opioidy, tricyklická antidepresiva) mohou být aditivní. Sledujte pacienty, kteří užívají Zanaflex 4 mg s jiným tlumičem CNS, na příznaky nadměrné sedace (viz DROGOVÉ INTERAKCE ].

Halucinóza/symptomy podobné psychotickým
Užívání přípravku Zanaflex 4 mg je spojováno s halucinacemi. Formované, zrakové halucinace nebo bludy byly hlášeny u 5 ze 170 pacientů (3 %) ve dvou kontrolovaných klinických studiích v Severní Americe. Většina pacientů si byla vědoma toho, že události byly neskutečné. U jednoho pacienta se v souvislosti s halucinacemi rozvinula psychóza. Jeden pacient z těchto 5 měl problémy po dobu nejméně 2 týdnů po vysazení tizanidinu. Zvažte vysazení přípravku Zanaflex u pacientů, u kterých se rozvinou halucinace.
Interakce s inhibitory CYP1A2
důvodu potenciálních lékových interakcí je Zanaflex 4 mg kontraindikován u pacientů užívajících silné inhibitory CYP1A2, jako je fluvoxamin nebo ciprofloxacin. Nežádoucí účinky, jako je hypotenze, bradykardie nebo nadměrná ospalost, se mohou objevit, pokud se Zanaflex užívá s jinými inhibitory CYP1A2, jako je zileuton, fluorochinolony jiné než ciprofloxacin (který je kontraindikován), antiarytmika (amiodaron, mexiletin, propafenon), cimetidin, famotidin antikoncepce, acyklovir a tiklopidin). Je třeba se vyhnout současnému užívání, pokud není klinicky zřejmá nutnost léčby Zanaflexem 2 mg. V takovém případě používejte opatrně [viz DROGOVÉ INTERAKCE a KLINICKÁ FARMAKOLOGIE ].
Hypersenzitivní reakce
Zanaflex může způsobit anafylaxi. Byly hlášeny známky a příznaky včetně zhoršení dýchání, kopřivky a angioedému hrdla a jazyka. Pacienti by měli být informováni o známkách a příznacích závažných alergických reakcí a poučeni, aby přerušili léčbu přípravkem Zanaflex a vyhledali okamžitou lékařskou péči, pokud se tyto známky a příznaky objeví (viz KONTRAINDIKACE ].
Zvýšené riziko nežádoucích reakcí u pacientů s poruchou funkce ledvin
Zanaflex by měl být používán s opatrností u pacientů s renální insuficiencí (clearance kreatininu DÁVKOVÁNÍ A PODÁVÁNÍ a Použití u konkrétních populací ].
Abstinenční nežádoucí účinky
Nežádoucí reakce z vysazení zahrnují rebound hypertenzi, tachykardii a hypertonii. Aby se minimalizovalo riziko těchto reakcí, zejména u pacientů, kteří užívali vysoké dávky (20 až 28 mg denně) po dlouhou dobu (9 týdnů nebo déle) nebo kteří mohou být současně léčeni narkotiky, měla by být dávka snížena pomalu (2 až 4 mg denně) [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze
Tizanidin byl podáván myším po dobu 78 týdnů v perorálních dávkách až 16 mg/kg/den, což je dvojnásobek maximální doporučené dávky pro člověka (MRHD) 36 mg/den na základě plochy povrchu těla (mg/m²). Tizanidin byl podáván potkanům po dobu 104 týdnů v perorálních dávkách až 9 mg/kg/den, což je 2,5násobek MRHD na základě mg/m². U žádného druhu nedošlo k nárůstu nádorů.
Mutageneze
Tizanidin byl negativní v testu in vitro (bakteriální reverzní mutace [Ames], savčí genová mutace a test chromozomálních aberací v savčích buňkách) a in vivo (mikronukleus kostní dřeně a cytogenetika).
Zhoršení Plodnosti
Perorální podávání tizanidinu potkanům před pářením a během páření a pokračování během časné březosti u samic vedlo ke snížení fertility u samců a samic potkanů v dávkách 30 a 10 mg/kg/den, v daném pořadí. Nebyl pozorován žádný účinek na fertilitu při dávkách 10 (muži) a 3 (ženy) mg/kg/den, což je přibližně 3násobek a podobně jako MRHD, v přepočtu na mg/m².
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
Adekvátní údaje o vývojovém riziku spojeném s užíváním přípravku Zanaflex 2 mg u těhotných žen nejsou k dispozici. Ve studiích na zvířatech vedlo podávání tizanidinu během těhotenství k vývojové toxicitě (embryofetální a postnatální úmrtnost potomstva a růstové deficity) v dávkách nižších než jsou klinicky používané dávky, které nebyly spojeny s toxicitou pro matku (viz Údaje o zvířatech ).
V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 % - 4 % a 15 % - 20 %. Základní riziko závažných vrozených vad a potratu u uvedené populace není známo.
Data
Údaje o zvířatech
Perorální podávání tizanidinu (0,3 až 100 mg/kg/den) březím krysám během období organogeneze vedlo k embryofetální a postnatální úmrtnosti potomků a snížení tělesné hmotnosti při dávkách 30 mg/kg/den a vyšších. Mateřská toxicita byla pozorována při nejvyšší testované dávce. Dávka bez účinku na embryofetální vývojovou toxicitu u potkanů (3 mg/kg/den) je podobná maximální doporučené dávce pro člověka (MRHD) 36 mg/den na základě plochy povrchu těla (mg/m²).
Perorální podávání tizanidinu (1 až 100 mg/kg/den) březím králíkům během období organogeneze vedlo k embryofetální a postnatální úmrtnosti potomků ve všech dávkách. Mateřská toxicita byla pozorována při nejvyšší testované dávce. Perorální podávání tizanidinu (10 a 30 mg/kg/den) během perinatálního období těhotenství (2-6 dní před porodem) vedlo ke zvýšené postnatální úmrtnosti potomků při obou dávkách. Dávka bez účinku na embryofetální vývojovou toxicitu u králíka nebyla identifikována. Nejnižší testovaná dávka (1 mg/kg/den) je nižší než MRHD na základě mg/m².
Ve studii pre- a postnatálního vývoje u potkanů vedlo perorální podávání tizanidinu (3 až 30 mg/kg/den) ke zvýšené postnatální úmrtnosti potomků. Dávka, která nemá žádný účinek na pre- a postnatální vývojovou toxicitu, nebyla identifikována. Nejnižší testovaná dávka (3 mg/kg/den) je podobná MRHD na základě mg/m².
Laktace
Shrnutí rizik
Neexistují žádné údaje o přítomnosti tizanidinu v mateřském mléce, účincích na kojené dítě nebo účincích na produkci mateřského mléka. Studie na zvířatech prokázaly přítomnost tizanidinu v mléce kojících zvířat.
Vývojové a zdravotní přínosy kojení by měly být zváženy spolu s klinickou potřebou matky Zanaflex 4 mg a veškerými potenciálními nežádoucími účinky na kojené dítě ze Zanaflexu nebo ze základního stavu matky.
Ženy a muži reprodukčního potenciálu
Neexistují žádné adekvátní a dobře kontrolované studie u lidí o účinku přípravku Zanaflex 4 mg na ženský nebo mužský reprodukční potenciál. Perorální podávání tizanidinu samcům a samicím potkanů vedlo k nežádoucím účinkům na fertilitu [viz Neklinická toxikologie ].
Pediatrické použití
Bezpečnost a účinnost u pediatrických pacientů nebyla stanovena.
Geriatrické použití
Je známo, že Zanaflex 2 mg je v podstatě vylučován ledvinami a riziko nežádoucích reakcí na tento lék může být vyšší u pacientů s poruchou funkce ledvin. Vzhledem k tomu, že u starších pacientů je pravděpodobnější snížená funkce ledvin, je třeba věnovat pozornost výběru dávky a může být užitečné sledovat funkci ledvin.
Klinické studie přípravku Zanaflex 2 mg nezahrnovaly dostatečný počet subjektů ve věku 65 let a více, aby bylo možné určit, zda reagují odlišně než mladší subjekty. Porovnání farmakokinetických údajů ve zkřížených studiích po podání jednorázové dávky 6 mg Zanaflexu 2 mg ukázalo, že mladší jedinci vylučovali lék čtyřikrát rychleji než starší jedinci. U starších pacientů s renální insuficiencí (clearance kreatininu
Porucha funkce ledvin
Je známo, že Zanaflex je v podstatě vylučován ledvinami a riziko nežádoucích reakcí na tento lék může být větší u pacientů s poruchou funkce ledvin. U pacientů s renální insuficiencí (clearance kreatininu DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
Porucha funkce jater
Vliv poruchy funkce jater na farmakokinetiku tizanidinu nebyl hodnocen. Vzhledem k tomu, že tizanidin je extenzivně metabolizován v játrech, lze očekávat, že poškození jater bude mít významný vliv na farmakokinetiku tizanidinu (viz DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , a KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
Přezkoumání databáze bezpečnostního dohledu odhalilo případy úmyslného a náhodného předávkování přípravkem Zanaflex. Některé z případů skončily úmrtím a mnoho z úmyslných předávkování se týkalo více léků včetně látek tlumících CNS. Klinické projevy předávkování tizanidinem byly v souladu s jeho známou farmakologií. Ve většině případů bylo pozorováno snížení citlivosti včetně letargie, somnolence, zmatenosti a kómatu. Je také pozorována snížená srdeční funkce, nejčastěji bradykardie a hypotenze. Dalším společným znakem předávkování tizanidinem je respirační deprese.
Pokud dojde k předávkování, měly by být provedeny základní kroky k zajištění adekvátnosti dýchacích cest a monitorování kardiovaskulárního a respiračního systému. Tizanidin je léčivo rozpustné v tucích, které je jen málo rozpustné ve vodě a methanolu. Proto není pravděpodobné, že by dialýza byla účinným způsobem odstranění léku z těla. Obecně symptomy odezní během jednoho až tří dnů po vysazení tizanidinu a podání vhodné terapie. Vzhledem k podobnému mechanismu účinku jsou příznaky a léčba předávkování tizanidinem podobné jako po předávkování klonidinem. Chcete-li získat nejnovější informace týkající se léčby předávkování, kontaktujte toxikologické centrum.
KONTRAINDIKACE
Zanaflex je kontraindikován u pacientů užívajících silné inhibitory CYP1A2, jako je fluvoxamin nebo ciprofloxacin (viz DROGOVÉ INTERAKCE ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Tizanidin je centrální agonista alfa-2-adrenergních receptorů a pravděpodobně snižuje spasticitu zvýšením presynaptické inhibice motorických neuronů. Účinky tizanidinu jsou největší na polysynaptické dráhy. Předpokládá se, že celkový účinek těchto akcí snižuje facilitaci spinálních motorických neuronů.
Farmakokinetika
Absorpce a distribuce
Po perorálním podání je tizanidin v podstatě zcela absorbován. Absolutní biologická dostupnost tizanidinu po perorálním podání je přibližně 40 % (CV = 24 %) v důsledku rozsáhlého metabolismu prvního průchodu játry. Tizanidin je po intravenózním podání zdravým dospělým dobrovolníkům extenzivně distribuován do celého těla se středním distribučním objemem v ustáleném stavu 2,4 l/kg (CV = 21 %). Tizanidin se přibližně z 30 % váže na plazmatické proteiny.
Rozdíly mezi Zanaflex 4 mg kapsle® a Zanaflex® tablety
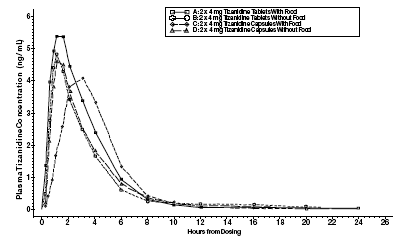
Zanaflex 2mg Capsules® a Zanaflex® tablety jsou vzájemně bioekvivalentní nalačno, ale ne za podmínek nasycení. Jedna dávka buď dvou 4mg tablet nebo dvou 4mg tobolek byla podána za podmínek jídla a nalačno v otevřené, čtyřdobé, randomizované zkřížené studii u 96 lidských dobrovolníků, z nichž 81 bylo vhodných pro statistickou analýzu. Po perorálním podání buď tablety nebo tobolky (na lačno) se maximální plazmatické koncentrace tizanidinu objevily 1,0 hodiny po podání s poločasem přibližně 2 hodiny. Když byly dvě 4mg tablety podány s jídlem, průměrná maximální plazmatická koncentrace se zvýšila přibližně o 30 % a střední doba dosažení maximální plazmatické koncentrace se zvýšila o 25 minut na 1 hodinu a 25 minut. Naproti tomu při podání dvou 4mg tobolek s jídlem se průměrná maximální plazmatická koncentrace snížila o 20 %, střední doba do dosažení maximální plazmatické koncentrace se zvýšila o 2 až 3 hodiny. V důsledku toho je průměrná Cmax pro tobolku při podání s jídlem přibližně 66 % Cmax pro tabletu při podání s jídlem. Jídlo také zvýšilo rozsah absorpce u tablet i tobolek. Nárůst s tabletou (~30 %) byl významně větší než s kapslí (~10 %). V důsledku toho, když byl každý podáván s jídlem, množství absorbované z kapsle bylo přibližně 80 % množství absorbovaného z tablety. Podání obsahu tobolky nasypané do jablečného pyré nebylo bioekvivalentní podání neporušené tobolky za podmínek nalačno. Podání obsahu tobolky v jablečném pyré vedlo k 15% – 20% zvýšení Cmax a AUC tizanidinu a 15minutovému snížení střední doby zpoždění a doby do dosažení maximální koncentrace ve srovnání s podáním neporušené tobolky nalačno.
Obrázek 1: Průměrná koncentrace tizanidinu vs. časové profily pro tablety a kapsle Zanaflex (2 x 4 mg) za podmínek nalačno a po jídle
Metabolismus A Vylučování
Tizanidin má lineární farmakokinetiku oproti dávkám studovaným v klinickém vývoji (1-20 mg). Tizanidin má biologický poločas přibližně 2,5 hodiny (CV=33 %). Přibližně 95 % podané dávky je metabolizováno. Primárním izoenzymem cytochromu P450 zapojeným do metabolismu tizanidinu je CYP1A2. Není známo, že by metabolity tizanidinu byly účinné; jejich poločasy se pohybují od 20 do 40 hodin.
Po jednorázovém a opakovaném perorálním podání 14C-tizanidinu bylo průměrně 60 % a 20 % celkové radioaktivity nalezeno v moči a ve stolici.
Specifické populace
Věkové efekty
Nebyla provedena žádná specifická farmakokinetická studie ke zkoumání účinků věku. Porovnání farmakokinetických údajů ve zkřížených studiích po podání jednorázové dávky 6 mg Zanaflexu 2 mg ukázalo, že mladší jedinci se vylučovali čtyřikrát rychleji než starší jedinci. Zanaflex 4 mg nebyl u dětí hodnocen [viz Použití u konkrétních populací ].
Poškození jater
Vliv poruchy funkce jater na farmakokinetiku tizanidinu nebyl hodnocen. Vzhledem k tomu, že tizanidin je extenzivně metabolizován v játrech, lze očekávat, že poškození jater bude mít významný vliv na farmakokinetiku tizanidinu. Zanaflex se u této populace pacientů nedoporučuje [viz Použití u konkrétních populací ].
Renální poškození
Clearance tizanidinu je snížena o více než 50 % u starších pacientů s renální insuficiencí (clearance kreatininu VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Gender Effects
Nebyla provedena žádná specifická farmakokinetická studie, která by zkoumala účinky na pohlaví. Retrospektivní analýza farmakokinetických údajů však po podání jednorázové a opakované dávky 4 mg Zanaflexu 2 mg ukázala, že pohlaví nemělo žádný vliv na farmakokinetiku tizanidinu.
Závodní efekty
Farmakokinetické rozdíly způsobené rasou nebyly studovány.
Lékové interakce
Inhibitory CYP1A2
Interakce mezi Zanaflexem a fluvoxaminem nebo ciprofloxacinem je s největší pravděpodobností způsobena inhibicí CYP1A2 fluvoxaminem nebo ciprofloxacinem. Účinek fluvoxaminu na farmakokinetiku jednorázové 4 mg dávky Zanaflexu byl studován u 10 zdravých subjektů. Cmax, AUC a poločas tizanidinu se zvýšily 12krát, 33krát a 3krát, v tomto pořadí. Účinek ciprofloxacinu na farmakokinetiku jednorázové dávky 4 mg přípravku Zanaflex 4 mg byl studován u 10 zdravých subjektů. Cmax a AUC tizanidinu se zvýšily 7krát, respektive 10krát [viz KONTRAINDIKACE ].
Ačkoli nebyly provedeny žádné klinické studie hodnotící účinky jiných inhibitorů CYP1A2 na tizanidin, jiné inhibitory CYP1A2, jako je zileuton, další fluorochinolony, antiarytmika (amiodaron, mexiletin, propafenon a verapamil), cimetidin, famotidin, perorální antikoncepce, acyklopidin, může také vést k podstatnému zvýšení koncentrací tizanidinu v krvi [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
In vitro studie izoenzymů cytochromu P450 s použitím lidských jaterních mikrozomů ukazují, že ani tizanidin, ani jeho hlavní metabolity pravděpodobně neovlivňují metabolismus jiných léčiv metabolizovaných izoenzymy cytochromu P450.
Orální antikoncepce
Nebyla provedena žádná specifická farmakokinetická studie ke zkoumání interakce mezi perorálními kontraceptivy a Zanaflexem. Retrospektivní analýza populačních farmakokinetických údajů po jednorázovém a opakovaném podání 4 mg Zanaflexu však ukázala, že ženy užívající současně perorální antikoncepci měly o 50 % nižší clearance tizanidinu ve srovnání s ženami, které perorální antikoncepci neužívaly (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
acetaminofen
Tizanidin zpozdil Tmax acetaminofenu o 16 minut. Acetaminofen neovlivnil farmakokinetiku tizanidinu.
Alkohol
Alkohol zvýšil AUC tizanidinu přibližně o 20 % a zároveň zvýšil jeho Cmax přibližně o 15 %. To bylo spojeno se zvýšením nežádoucích účinků tizanidinu. Účinky tizanidinu a alkoholu tlumící CNS jsou aditivní.
Klinické studie
Schopnost tizanidinu snižovat zvýšený svalový tonus spojený se spasticitou byla prokázána ve dvou adekvátních a dobře kontrolovaných studiích u pacientů s roztroušenou sklerózou nebo poraněním míchy (studie 1 a 2).
Studie s jednou dávkou u pacientů s roztroušenou sklerózou se spasticitou
Ve studii 1 byli pacienti s roztroušenou sklerózou randomizováni k podání jedné perorální dávky léku nebo placeba. Pacienti a hodnotitelé byli slepí vůči přidělení léčby a bylo vynaloženo úsilí na snížení pravděpodobnosti, že se hodnotitelé nepřímo dozvědí o přidělení léčby (např. neposkytovali přímou péči pacientům a měli zakázáno klást otázky o vedlejších účincích). Celkem 140 pacientů dostalo placebo, 8 mg nebo 16 mg Zanaflexu.
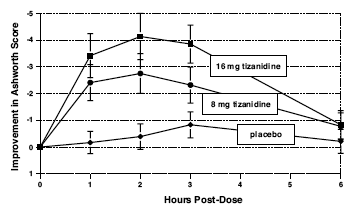
Odpověď byla hodnocena fyzikálním vyšetřením; svalový tonus byl hodnocen na 5bodové stupnici (Ashworthovo skóre), přičemž skóre 0 bylo použito k popisu normálního svalového tonusu. Skóre 1 indikovalo mírné spastické zachycení, zatímco skóre 2 značilo výraznější svalový odpor. Skóre 3 bylo použito k popisu značného zvýšení tónu, což ztěžovalo pasivní pohyb. Sval imobilizovaný spasticitou dostal skóre 4. Byly také shromážděny počty spasmů.
Hodnocení byla provedena 1, 2, 3 a 6 hodin po ošetření. Statisticky významné snížení Ashworthova skóre pro Zanaflex 2 mg ve srovnání s placebem bylo zjištěno 1, 2 a 3 hodiny po léčbě. Obrázek 2 níže ukazuje srovnání průměrné změny svalového tonusu od výchozí hodnoty, jak je měřeno pomocí Ashworthovy škály. Největší snížení svalového tonu bylo 1 až 2 hodiny po ošetření. 6 hodin po léčbě byl svalový tonus ve skupinách s 8 a 16 mg Zanaflexu 2 mg nerozeznatelný od svalového tonusu u pacientů léčených placebem. U daného pacienta korelovalo zlepšení svalového tonu s plazmatickou koncentrací. Plazmatické koncentrace byly u jednotlivých pacientů při dané dávce různé. Přestože dávka 16 mg vyvolala větší účinek, nežádoucí účinky včetně hypotenze byly častější a závažnější než ve skupině s dávkou 8 mg. Nebyly žádné rozdíly v počtu spasmů vyskytujících se v každé skupině.
Obrázek 2: Studie s jednou dávkou – průměrná změna svalového tonusu od výchozí hodnoty měřená pomocí Ashworthovy škály ± 95% interval spolehlivosti (negativní Ashworthovo skóre znamená zlepšení svalového tonusu oproti výchozí hodnotě)
Sedmitýdenní studie u pacientů s poraněním míchy se spasticitou
V 7týdenní studii (studie 2) bylo 118 pacientů se spasticitou sekundární k poranění míchy randomizováno buď k placebu, nebo k Zanaflexu. K zajištění integrity zaslepení byly použity podobné kroky jako v první studii.
Pacienti byli titrováni po dobu 3 týdnů až do maximální tolerované dávky nebo 36 mg denně podávaných ve třech nestejných dávkách (např. 10 mg podaných ráno a odpoledne a 16 mg podaných večer). Pacienti byli poté udržováni na své maximální tolerované dávce po dobu dalších 4 týdnů (tj. udržovací fáze). Během udržovací fáze byl svalový tonus hodnocen na Ashworthově stupnici během 2,5 hodiny po ranní nebo odpolední dávce. Počet denních křečí byl pacienty zaznamenáván denně.
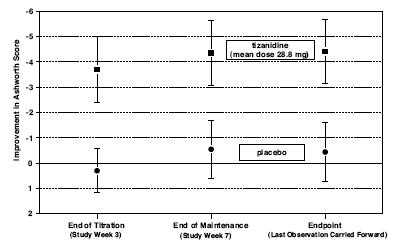
koncovém bodě (protokolem specifikovaný čas hodnocení výsledku) došlo ve skupině léčené přípravkem Zanaflex ve srovnání s placebem ke statisticky významnému snížení svalového tonu a frekvence spasmů. Snížení svalového tonu nebylo spojeno se snížením svalové síly (žádoucí výsledek), ale také nevedlo k žádné konzistentní výhodě pacientů léčených přípravkem Zanaflex na měření aktivit každodenního života. Obrázek 3 níže ukazuje srovnání průměrné změny svalového tonusu od výchozí hodnoty měřené pomocí Ashworthovy škály.
Obrázek 3: Sedmitýdenní studie – průměrná změna svalového tonusu 0,5 – 2,5 hodiny po podání měřená pomocí Ashworthovy škály ± 95% interval spolehlivosti (negativní Ashworthovo skóre znamená zlepšení svalového tonusu oproti výchozí hodnotě)
INFORMACE PRO PACIENTA
Závažné lékové interakce
Informujte pacienty, že by neměli užívat přípravek Zanaflex, pokud užívají fluvoxamin nebo ciprofloxacin kvůli zvýšenému riziku závažných nežádoucích účinků včetně závažného snížení krevního tlaku a sedace. Poučte pacienty, aby informovali své lékaře nebo lékárníky, když začnou nebo přestanou užívat jakýkoli lék kvůli rizikům spojeným s interakcí mezi Zanaflexem a jinými léky.
Dávkování Zanaflex
Řekněte pacientům, aby užívali přípravek Zanaflex 2 mg přesně podle předpisu (v souladu s jídlem nebo bez jídla) a neměnili tablety a tobolky. Informujte pacienty, že by neměli užívat více Zanaflexu 2 mg, než je předepsáno kvůli riziku nežádoucích účinků při jednotlivých dávkách vyšších než 8 mg nebo celkových denních dávkách vyšších než 36 mg. Řekněte pacientům, že by neměli náhle vysadit Zanaflex 4 mg, protože se může objevit rebound hypertenze a tachykardie.
Účinky Zanaflexu
Upozorněte pacienty, že u nich může dojít k hypotenzi, a aby byli opatrní při přechodu z polohy vleže nebo vsedě do polohy vestoje. Řekněte pacientům, že přípravek Zanaflex u nich může způsobit sedaci nebo ospalost, a měli by být opatrní při provádění činností, které vyžadují pozornost, jako je řízení vozidla nebo obsluha strojů. Řekněte pacientům, že sedace může být aditivní, pokud se Zanaflex 4 mg užívá spolu s léky (baklofen, benzodiazepiny) nebo látkami (např. alkohol), které působí jako tlumivé látky na CNS. Připomeňte pacientům, že pokud jsou závislí na své spasticitě, aby udrželi držení těla a rovnováhu při lokomoci, nebo kdykoli se spasticita využívá k dosažení zvýšené funkce, že přípravek Zanaflex snižuje spasticitu a je třeba používat opatrnost.
