Casodex 50mg Bicalutamide Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Casodex a jak se používá?
Casodex je lék na předpis používaný k léčbě příznaků rakoviny prostaty. Casodex 50 mg lze užívat samostatně nebo s jinými léky.
Casodex 50 mg patří do třídy léků nazývaných Antineoplastika, Antiandrogen; Inhibitor CYP3A4, střední.
Není známo, zda je Casodex bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Casodex?
Casodex může způsobit závažné nežádoucí účinky včetně:
- bolest nebo otok prsou,
- krev ve vaší moči,
- horečka,
- zimnice,
- náhlá bolest na hrudi nebo nepohodlí,
- sípání,
- suchý kašel,
- dušnost,
- bledá kůže,
- točení hlavy,
- rychlý srdeční tep,
- potíže se soustředěním,
- nevolnost,
- bolest v horní části žaludku,
- cítit se unaveně,
- ztráta chuti k jídlu,
- tmavá moč,
- stolice hliněné barvy,
- zežloutnutí kůže nebo očí (žloutenka),
- zvýšená žízeň,
- zvýšené močení,
- hlad,
- suchá ústa,
- ovocný zápach dechu,
- ospalost,
- suchá kůže,
- rozmazané vidění a
- ztráta váhy
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Casodex 50 mg patří:
- návaly horka,
- bolest v zádech,
- pánevní bolest,
- bolest břicha,
- otoky rukou, kotníků nebo nohou,
- zvýšené noční močení,
- slabost,
- závrať,
- nevolnost,
- průjem a
- zácpa
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Casodex. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
Tablety CASODEX® (bicalutamid) obsahují 50 mg bicalutamidu, nesteroidního inhibitoru androgenního receptoru bez jiné známé endokrinní aktivity. Chemický název je propanamid, N-[4kyano-3-(trifluormethyl)fenyl]-3-[(4-fluorfenyl)sulfonyl]-2-hydroxy-2-methyl-,(+-). Strukturní a empirické vzorce jsou:
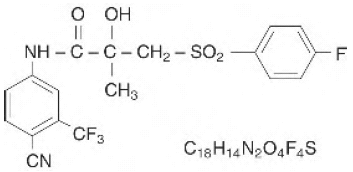
Bicalutamid má molekulovou hmotnost 430,37. pKa' je přibližně 12. Bicalutamid je jemný bílý až téměř bílý prášek, který je prakticky nerozpustný ve vodě při 37 °C (5 mg na 1000 ml), mírně rozpustný v chloroformu a absolutním ethanolu, mírně rozpustný v methanolu a rozpustný v acetonu a tetrahydrofuran.
CASODEX je racemát, jehož antiandrogenní aktivita je téměř výhradně vykazována R-enantiomerem bicalutamidu; S-enantiomer je v podstatě neaktivní.
Neaktivními složkami přípravku CASODEX 50 mg tablety jsou laktóza, magnesium-stearát, hypromelóza, polyethylenglykol, polyvidon, sodná sůl glykolátu škrobu a oxid titaničitý.
INDIKACE
Je indikován CASODEX 50 mg denně pro použití v kombinační terapii s analogem hormonu uvolňujícího luteinizační hormon (LHRH) pro léčbu stadia D2 metastatického karcinomu prostaty.
CASODEX 150 mg denně není schválen pro použití samostatně nebo s jinou léčbou [viz Klinické studie ].
DÁVKOVÁNÍ A PODÁVÁNÍ
Doporučená dávka a rozvrh
Doporučená dávka pro léčbu přípravkem CASODEX 50 mg v kombinaci s analogem LHRH je jedna 50 mg tableta jednou denně (ráno nebo večer), s jídlem nebo bez jídla. Doporučuje se užívat CASODEX 50 mg každý den ve stejnou dobu. Léčba přípravkem CASODEX by měla být zahájena současně s léčbou analogem LHRH. Pokud vynecháte dávku přípravku CASODEX 50 mg, vezměte si další dávku v naplánovanou dobu. Neužívejte vynechanou dávku a nezdvojnásobujte následující dávku.
Úprava dávkování při poškození ledvin
U pacientů s poruchou funkce ledvin není nutná žádná úprava dávkování (viz Použití u konkrétních populací ].
Úprava dávkování u jaterní insuficience
U pacientů s mírnou až středně těžkou poruchou funkce jater není nutná žádná úprava dávkování. U pacientů s těžkou poruchou funkce jater (n=4) sice došlo k 76% prodloužení poločasu aktivního enantiomeru bikalutamidu (5,9 a 10,4 dnů u normálních pacientů a 10,4 dnů u pacientů s poruchou funkce), není však nutná úprava dávkování. vidět Použití u konkrétních populací ].
JAK DODÁVÁNO
Dávkové formy A Síla
CASODEX® (bikalutamid) 50 mg tablety pro perorální podání.
Bílé potahované tablety (označené na jedné straně „CDX50“ a na druhé straně „logem CASODEX“) se dodávají v jednodávkových lahvičkách po 30 tabletách (0310-0705-30).
Skladování A Manipulace
Skladujte při kontrolované pokojové teplotě, 20°-25°C (68°-77°F).
Vyrobeno pro: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850. Revize: březen 2017.
VEDLEJŠÍ EFEKTY
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Zkušenosti z klinických studií
U pacientů s pokročilým karcinomem prostaty léčených přípravkem CASODEX 50 mg v kombinaci s analogem LHRH byly nejčastější nežádoucí reakcí návaly horka (53 %).
V multicentrické, dvojitě zaslepené, kontrolované klinické studii porovnávající CASODEX 50 mg jednou denně s flutamidem 250 mg třikrát denně, každý v kombinaci s analogem LHRH, byly následující nežádoucí účinky s incidencí 5 % nebo vyšší, bez ohledu na příčinné souvislosti, byly hlášeny.
Další nežádoucí účinky (větší nebo rovné 2 %, ale méně než 5 %) hlášené ve skupině léčené analogem CASODEX-LHRH jsou uvedeny níže podle tělesného systému a jsou seřazeny podle klesající frekvence v rámci každého tělesného systému bez ohledu na kauzalitu.
Tělo jako celek: novotvar; Bolest krku; Horečka; Zimnice; Sepse; Kýla; Cysta
Kardiovaskulární: Angina pectoris; městnavé srdeční selhání; infarkt myokardu; srdeční zástava; porucha koronárních tepen; Synkopa
Zažívací: Melena; Rektální krvácení; Suchá ústa; dysfagie; Gastrointestinální porucha; periodontální absces; Gastrointestinální karcinom
Metabolické a nutriční: Otok; BUN Zvýšeno; Zvýšený kreatinin; Dehydratace; Dna; Hypercholesterémie
Muskuloskeletální: myalgie; Křeče v nohou
Nervový: hypertonie; Zmatek; Spavost; Snížené libido; neuropatie; Nervozita
Respirační: plicní poruchy; Astma; Epistaxe; Sinusitida
Kůže a přílohy: Suchá kůže; alopecie; pruritus; herpes zoster; karcinom kůže; Kožní porucha
Speciální smysly: Specifikováno katarakta
Urogenitální: dysurie; Urinární naléhavost; hydronefróza; Porucha močových cest
Abnormální hodnoty laboratorních testů:
Laboratorní abnormality včetně: zvýšené AST, ALT, bilirubinu, BUN a kreatininu; a snížení hemoglobinu a počtu bílých krvinek, byly hlášeny jak u pacientů léčených analogem CASODEX-LHRH, tak u pacientů léčených analogem flutamidu-LHRH.
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během používání přípravku CASODEX po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Poruchy dýchání: Intersticiální plicní onemocnění (některé fatální) včetně intersticiální pneumonitidy a plicní fibrózy, nejčastěji v dávkách vyšších než 50 mg.
Poruchy kůže a podkoží: Fotosenzitivita
DROGOVÉ INTERAKCE
Klinické studie neprokázaly žádné lékové interakce mezi bikalutamidem a analogy LHRH (goserelin nebo leuprolid). Neexistují žádné důkazy o tom, že bikalutamid indukuje jaterní enzymy.
Studie in vitro ukázaly, že R-bikalutamid je inhibitorem CYP 3A4 s menšími inhibičními účinky na aktivitu CYP 2C9, 2C19 a 2D6. Klinické studie ukázaly, že při současném podávání přípravku CASODEX mohou být průměrné hladiny midazolamu (substrát CYP 3A4) zvýšeny 1,5krát (pro Cmax) a 1,9krát (pro AUC). Proto je třeba opatrnosti při současném podávání přípravku CASODEX 50 mg se substráty CYP 3A4.
Studie vazby na proteiny in vitro ukázaly, že bikalutamid může vytlačit kumarinová antikoagulancia z vazebných míst. U pacientů, kteří již užívají kumarinová antikoagulancia, u kterých je zahájena léčba přípravkem CASODEX 50 mg, je třeba pečlivě sledovat protrombinový čas a může být nutná úprava dávky antikoagulancia.
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Hepatitida
Po uvedení přípravku na trh byly v souvislosti s užíváním přípravku CASODEX hlášeny případy úmrtí nebo hospitalizace v důsledku těžkého poškození jater (jaterní selhání). Hepatotoxicita se v těchto hlášeních obecně objevila během prvních tří až čtyř měsíců léčby. V kontrolovaných klinických studiích se u přibližně 1 % pacientů s přípravkem CASODEX vyskytla hepatitida nebo výrazné zvýšení jaterních enzymů vedoucí k vysazení léku.
Hladiny sérových transamináz by měly být měřeny před zahájením léčby přípravkem CASODEX, v pravidelných intervalech během prvních čtyř měsíců léčby a poté pravidelně. Pokud se objeví klinické příznaky nebo příznaky naznačující dysfunkci jater (např. nevolnost, zvracení, bolest břicha, únava, anorexie, příznaky podobné chřipce, tmavá moč, žloutenka nebo citlivost pravého horního kvadrantu), sérové transaminázy, zejména sérová ALT, by měla být změřena okamžitě. Pokud má pacient kdykoli žloutenku nebo jeho ALT stoupne nad dvojnásobek horní hranice normálu, CASODEX by měl být okamžitě vysazen s pečlivým sledováním jaterních funkcí.
Gynekomastie A Bolest Prsů
V klinických studiích s přípravkem CASODEX 150 mg v monoterapii pro karcinom prostaty byla hlášena gynekomastie až u 38 % a bolest prsů u 39 % pacientů.
Glukózová tolerance
mužů užívajících agonisty LHRH bylo pozorováno snížení glukózové tolerance. To se může projevit jako diabetes nebo ztráta kontroly glykémie u pacientů s již existujícím diabetem. U pacientů užívajících CASODEX 50 mg v kombinaci s agonisty LHRH je proto třeba zvážit monitorování glukózy v krvi.
Laboratorní testy
Pravidelné hodnocení sérového prostatického specifického antigenu (PSA) může být užitečné při sledování pacientovy odpovědi. Pokud se hladiny PSA během léčby přípravkem CASODEX 50 mg zvýší, je třeba u pacienta vyšetřit klinickou progresi. U pacientů, kteří mají objektivní progresi onemocnění spolu se zvýšeným PSA, lze zvážit období bez léčby antiandrogeny, zatímco bude pokračovat analog LHRH.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( INFORMACE PRO PACIENTA ).
Dávka A Plán
Informujte pacienty, že léčba přípravkem CASODEX 50 mg a analogem LHRH by měla být zahájena současně a že by neměli přerušovat nebo přestat užívat tyto léky bez konzultace se svým poskytovatelem zdravotní péče [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Hepatitida
Informujte pacienty, že CASODEX může způsobit hepatitidu, která může mít za následek selhání jater a smrt. Informujte pacienty, že během léčby by měly být pravidelně sledovány jaterní testy a aby hlásili známky a příznaky hepatitidy (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Glukózová tolerance
Informujte pacienty, že během léčby agonisty LHRH byl hlášen diabetes nebo ztráta glykemické kontroly u pacientů s již existujícím diabetem. Proto je třeba zvážit monitorování glukózy v krvi u pacientů užívajících CASODEX v kombinaci s agonisty LHRH (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Spavost
Během léčby přípravkem CASODEX byla hlášena somnolence. Informujte pacienty, kteří mají tento příznak, aby byli opatrní při řízení nebo obsluze strojů (viz NEŽÁDOUCÍ REAKCE ].
Fotosenzitivita
Informujte pacienty, že během léčby přípravkem CASODEX byly hlášeny případy fotosenzitivity a že by se měli vyhýbat přímému vystavení nadměrnému slunečnímu záření nebo UV záření. Je třeba zvážit použití opalovacího krému [viz NEŽÁDOUCÍ REAKCE ].
Antikoncepce A Plodnost
Informujte pacienty mužského pohlaví s partnerkami s reprodukčním potenciálem, aby během léčby a 130 dnů po poslední dávce přípravku CASODEX 50 mg používali účinnou antikoncepci. Informujte pacienty mužského pohlaví, že CASODEX může narušit plodnost [viz Použití u konkrétních populací ].
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Dvouleté studie karcinogenity při perorálním podávání byly provedeny u samců i samic potkanů a myší v dávkách 5, 15 nebo 75 mg/kg/den bikalutamidu. Byly identifikovány různé účinky na nádorové cílové orgány a byly přičítány antiandrogenitě bikalutamidu, jmenovitě nádory testikulárních benigních intersticiálních (Leydigových) buněk u samců potkanů při všech úrovních dávek (plazmatická koncentrace v ustáleném stavu při dávce 5 mg/kg/den dávka je přibližně 0,7násobek lidské expozice při doporučené dávce) a děložní adenokarcinom u samic potkanů při 75 mg/kg/den (přibližně 1,5násobek expozice u člověka při doporučené dávce). U pacientů není prokázána hyperplazie Leydigových buněk; nádory dělohy nejsou pro indikovanou populaci pacientek relevantní.
Malé zvýšení výskytu hepatocelulárního karcinomu u myších samců, kterým bylo podáváno 75 mg/kg/den bikalutamidu (přibližně 4násobek expozice u člověka při doporučené dávce) a zvýšený výskyt benigních adenomů folikulárních buněk štítné žlázy u potkanů, kterým bylo podáváno 5 mg/kg /den (přibližně 0,7násobek lidské expozice při doporučené dávce) a více. Tyto neoplastické změny byly progresí nenádorových změn souvisejících s indukcí jaterních enzymů pozorovanými ve studiích toxicity na zvířatech. Po podání bikalutamidu u člověka nebyla pozorována indukce enzymů. Nebyly zjištěny žádné tumorigenní účinky naznačující genotoxickou karcinogenezi.
Komplexní baterie testů genotoxicity in vitro i in vivo (konverze genu pro kvasinky, Ames, E. coli, CHO/HGPRT, cytogenetické testy lidských lymfocytů, myší mikronukleus a cytogenetické testy kostní dřeně potkana) prokázaly, že bikalutamid nemá genotoxickou aktivitu .
toxikologických studiích s opakovanými dávkami byla u všech zkoumaných druhů pozorována atrofie semenotvorných kanálků varlat, což je předpokládaný třídní účinek antiandrogenů. V 6- a 12měsíční studii na potkanech byla pozorována atrofie varlat při přibližně dvojnásobku expozice u člověka při doporučené dávce. Ve 12měsíční studii na psech byl pozorován výskyt atrofie varlat při přibližně 7násobku expozice u člověka při doporučené dávce. U samců potkanů, kterým byla podávána dávka 250 mg/kg/den (přibližně dvojnásobek expozice u člověka při doporučené dávce), se prekoitální interval a doba do úspěšného páření prodloužily při prvním párování, ale po úspěšném páření nebyly pozorovány žádné účinky na fertilitu. Tyto účinky byly zvráceny 7 týdnů po ukončení 11týdenního období dávkování.
Samice potkanů, kterým byly podávány dávky 1, 10 a 250 mg/kg/den (méně než dvojnásobek expozice u člověka při doporučené dávce), měly zvýšenou nepravidelnost estrálního cyklu, ale neměly žádný vliv na fertilitu.
Ve studii peri- a postnatálního vývoje měly samice potkanů, kterým byly podávány dávky 10 mg/kg/den (přibližně 0,7násobek expozice u člověka při doporučené klinické dávce) a vyšší, sníženou míru březosti. Podávání bikalutamidu březím samicím vedlo k feminizaci mužských potomků vedoucí k hypospadii v dávkách 10 mg/kg/den (přibližně 0,7násobek expozice u člověka při doporučené dávce) a vyšších. Postižení mužští potomci byli také impotentní.
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
CASODEX je kontraindikován pro použití u těhotných žen, protože může způsobit poškození plodu. CASODEX 50 mg není indikován k použití u žen. Nejsou k dispozici žádné údaje o použití přípravku CASODEX 50 mg u těhotných žen. V reprodukčních studiích na zvířatech způsobilo perorální podání bikalutamidu březím potkanům během organogeneze abnormální vývoj reprodukčních orgánů u plodů mužského pohlaví při expozicích přibližně 0,7 až 2násobku expozice u člověka při doporučené dávce (viz Data ).
Data
Údaje o zvířatech
Ve studii embryo-fetálního vývoje u březích potkanů, kterým byly podávány dávky během období organogeneze od 6. do 15. dne březosti, se u samčích plodů snížila anogenitální vzdálenost při dávkách 10 mg/kg/den a vyšších (přibližně 0,7 až 2násobek expozice u člověka při doporučená dávka).
Ve studii prenatálního a postnatálního vývoje byly samičkám potkanů podávány dávky od 7. do 16. dne březosti a nechaly se vrhnout a vychovávat své potomstvo až do odstavení. . U samců potkanů, kteří dostávali dávky 10 mg/kg/den (přibližně 0,7násobek expozice u člověka při doporučené dávce) a vyšší, bylo pozorováno, že mají sníženou anogenitální vzdálenost.
Ve studii peri- a postnatálního vývoje byly samicím potkanů podávány dávky od 16. dne březosti do 22. dne laktace a nechaly se vrhnout a odchovat své potomky do odstavení. Přežití a hmotnost potomků během laktace byly sníženy u vrhů matek potkanů, kterým byly podávány dávky 250 mg/kg/den (přibližně dvojnásobek expozice u člověka při doporučené dávce). U samců potkanů, kteří dostávali dávky 10 mg/kg/den (přibližně 0,7násobek expozice u člověka při doporučené dávce) a vyšší, bylo pozorováno snížení anogenitální vzdálenosti, menší sekundární pohlavní orgány, kryptorchismus a hypospadie, což mělo za následek neschopnost se pářit. a oplodnit své partnerky. Potomstvo samic potkanů, které dostávaly dávky 10 mg/kg/den (přibližně 0,7násobek expozice u člověka při doporučené dávce) a vyšší, mělo sníženou míru březosti.
Laktace
Shrnutí rizik
CASODEX 50 mg není indikován k použití u těhotných žen. Nejsou dostupné žádné informace o přítomnosti bikalutamidu v mateřském mléce nebo o účincích na kojené dítě nebo na produkci mléka. Bicalutamid byl zjištěn v mléce potkanů.
Ženy a muži reprodukčního potenciálu
Antikoncepce
Muži
Antiandrogenní terapie může způsobit morfologické změny spermií [viz Neklinická toxikologie ]. Na základě zjištění v reprodukčních studiích na zvířatech a mechanismu jeho účinku doporučte mužským pacientům s partnerkami s reprodukčním potenciálem používat účinnou antikoncepci během léčby a po dobu 130 dnů po poslední dávce přípravku CASODEX (viz Těhotenství a KLINICKÁ FARMAKOLOGIE ].
Neplodnost
Muži

Na základě studií na zvířatech může CASODEX 50 mg vést k inhibici spermatogeneze a může narušit plodnost u samců s reprodukčním potenciálem. Dlouhodobé účinky přípravku CASODEX 50 mg na mužskou plodnost nebyly studovány [viz Neklinická toxikologie ].
Pediatrické použití
Bezpečnost a účinnost přípravku CASODEX 50 mg u pediatrických pacientů nebyla stanovena.
CASODEX (bikalutamid) tableta dispergovatelná v ústech byla studována v kombinaci s tabletou dispergovatelnou v ústech ARIMIDEX (anastrozol) v otevřené, nekomparativní, multicentrické studii, která hodnotila účinnost a bezpečnost tohoto kombinovaného režimu po dobu 12 měsíců při léčbě nezávislé na gonadotropinu předčasná puberta u chlapců s familiární předčasnou pubertou omezenou na muže, také známá jako testotoxikóza. Do studie byli zařazeni pacienti, kteří měli výchozí věk ≥ 2 roky a diagnózu testotoxikózy na základě klinických příznaků progresivní předčasné puberty, symetrického zvětšení varlat, pokročilého kostního věku, pubertálních hladin sérového testosteronu, prepubertálního vzoru sekrece gonadotropinu po GnRH stimulační test a absence jiných klinických a biochemických příčin nadbytku testosteronu. Třináct ze 14 zařazených pacientů dokončilo 12měsíční kombinovanou léčbu (jeden pacient byl ztracen ve sledování). Pokud se rozvinula centrální předčasná puberta (CPP), měl být přidán analog LHRH. Čtyři pacienti byli diagnostikováni s CPP během 12měsíční studie a dostávali léčbu analogem LHRH a 2 další pacienti byli diagnostikováni na konci 12 měsíců a následně dostávali léčbu. Průměrné ± SD charakteristiky na začátku byly následující: chronologický věk: 3,9±1,9 let; kostní věk 8,8±2,5; poměr kostní věk/chronologický věk: 2,06±0,51; rychlost růstu (cm/rok): 10,81±4,22; skóre směrodatné odchylky rychlosti růstu (SDS): 0,41±1,36.
Počáteční dávka přípravku CASODEX byla 12,5 mg. CASODEX byl titrován u každého pacienta, dokud rovnovážný stav R-bikalutamidu (aktivní izomer bikalutamidu) v plazmatické koncentraci nedosáhl 5-15 mcg/ml, což je rozmezí terapeutických koncentrací dosažených u dospělých s rakovinou prostaty po podání současného schválená dávka CASODEX 50 mg. Počáteční denní dávka anastrozolu byla 0,5 mg. Anastrozol byl nezávisle titrován u každé pacientky, dokud v ustáleném stavu nedosáhlo sérové koncentrace estradiolu
Primární analýza účinnosti studie měla posoudit změnu rychlosti růstu po 12 měsících léčby ve vztahu k rychlosti růstu během ≥6 měsíců před vstupem do studie. Rychlosti růstu před studií byly získány retrospektivně. Neexistoval žádný statistický důkaz, že by se rychlost růstu během léčby snížila. Během léčby CASODEX/ARIMIDEX se průměrná rychlost růstu (cm/rok) snížila o 1,6 cm/rok, 95% CI (-4,7 až 1,5) p=0,28; průměrná rychlost růstu SDS se snížila o 0,1 SD, 95% CI (–1,2 až 1,0) p=0,88. Tabulka 2 ukazuje popisná data pro rychlosti růstu pro celkovou populaci a pro podskupiny definované předchozí léčbou testotoxikózy ketokonazolem, spironolaktonem, anastrozolem nebo jinými inhibitory aromatázy v anamnéze.
Celkové koncentrace testosteronu se během 12 měsíců léčby zvýšily v průměru o 5 mmol/l z výchozích průměrných 10 mmol/l. Koncentrace estradiolu byly na nebo pod úrovní kvantifikace (9,81 pmol/l) u 11 z 12 pacientek po 12 měsících léčby. Šest z 12 pacientek zahájilo léčbu při koncentraci estradiolu pod úrovní kvantifikace.
Během studie nedošlo k žádným úmrtím, závažným nežádoucím účinkům nebo přerušení léčby kvůli nežádoucím účinkům. Ze 14 pacientů vystavených studijní léčbě se u 13 (92,9 %) vyskytl alespoň jeden nežádoucí účinek. Nejčastěji hlášenými nežádoucími účinky (>3 pacienti) byly gynekomastie (7/14, 50 %), centrální předčasná puberta (6/14, 43 %), zvracení (5/14, 36 %), bolest hlavy (3/14, 21 %), pyrexie (3/14, 21 %) a infekce horních cest dýchacích (3/14, 21 %). Nežádoucí reakce, které výzkumníci považovali za možná související s bikalutamidem, zahrnovaly gynekomastii (6/14, 43 %), centrální předčasnou pubertu (2/14, 14 %), citlivost prsů (2/14, 14 %), bolest prsou (1/14, 7 %), astenie (1/14, 7 %), zvýšená alaninaminotransferáza [ALT] (1/14, 7 %), zvýšená aspartátaminotransferáza [AST] (1/14, 7 %) a muskuloskeletální bolest na hrudi (1 /14, 7 %). Bolest hlavy byla jedinou nežádoucí reakcí, kterou výzkumníci považovali za možnou související s anastrozolem. U pacienta, u kterého došlo ke zvýšení ALT a AST, bylo toto zvýšení
Geriatrické použití
Ve dvou studiích u pacientů, kterým bylo podáváno 50 nebo 150 mg denně, nebyl prokázán žádný významný vztah mezi věkem a rovnovážnými hladinami celkového bikalutamidu nebo aktivního R-enantiomeru.
Poškození jater
CASODEX by měl být používán s opatrností u pacientů se středně těžkou až těžkou poruchou funkce jater. CASODEX je rozsáhle metabolizován v játrech. Omezené údaje u subjektů s těžkou poruchou funkce jater naznačují, že vylučování přípravku CASODEX může být zpožděno a mohlo by vést k další akumulaci. U pacientů s poruchou funkce jater na dlouhodobé léčbě je třeba zvážit pravidelné jaterní testy (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
U pacientů s mírným až středně závažným onemocněním jater nebyl ve srovnání se zdravými kontrolami zaznamenán žádný klinicky významný rozdíl ve farmakokinetice ani jednoho enantiomeru bikalutamidu. Poločas R-enantiomeru byl však zvýšen přibližně o 76 % (5,9 a 10,4 dne u normálních pacientů a 10,4 dne u pacientů s poruchou funkce) u pacientů se závažným onemocněním jater (n=4).
Renální poškození
Poškození ledvin (měřeno clearance kreatininu) nemělo žádný významný vliv na eliminaci celkového bikalutamidu nebo aktivního R-enantiomeru.
PŘEDÁVKOVAT
Byly provedeny dlouhodobé klinické studie s dávkami až 200 mg přípravku CASODEX 50 mg denně a tyto dávky byly dobře snášeny. Jednorázová dávka přípravku CASODEX 50 mg, která by měla za následek příznaky předávkování považované za život ohrožující, nebyla stanovena.
Neexistuje žádné specifické antidotum; léčba předávkování by měla být symptomatická.
Při léčbě předávkování přípravkem CASODEX 50 mg může být vyvoláno zvracení, pokud je pacient ve střehu. Je třeba mít na paměti, že v této populaci pacientů mohlo být užíváno více léků. Dialýza pravděpodobně nebude užitečná, protože CASODEX se silně váže na proteiny a je rozsáhle metabolizován. Je indikována obecná podpůrná péče, včetně častého sledování vitálních funkcí a pečlivého sledování pacienta.
KONTRAINDIKACE
Casodex je kontraindikován u:
Přecitlivělost
CASODEX 50 mg je kontraindikován u všech pacientů, u kterých se projevila hypersenzitivní reakce na léčivo nebo kteroukoli složku tablety. Byly hlášeny hypersenzitivní reakce včetně angioneurotického edému a kopřivky.
Ženy
CASODEX 50 mg nemá žádnou indikaci pro ženy a neměl by být v této populaci používán.
Těhotenství
CASODEX 50 mg může způsobit poškození plodu při podání těhotné ženě [viz Použití u konkrétních populací ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
CASODEX 50 mg je nesteroidní inhibitor androgenního receptoru. Kompetitivně inhibuje působení androgenů vazbou na cytosolové androgenní receptory v cílové tkáni. Je známo, že karcinom prostaty je citlivý na androgen a reaguje na léčbu, která působí proti účinku androgenu a/nebo odstraňuje zdroj androgenu.
Když je CASODEX 50 mg kombinován s terapií analogem LHRH, suprese sérového testosteronu vyvolaná analogem LHRH není ovlivněna. V klinických studiích s CASODEXem jako samostatným lékem na rakovinu prostaty však bylo zaznamenáno zvýšení sérového testosteronu a estradiolu.
U podskupiny pacientů, kteří byli léčeni přípravkem CASODEX a agonistou LHRH a kteří přerušili léčbu přípravkem CASODEX 50 mg z důvodu progresivního pokročilého karcinomu prostaty, může dojít ke snížení prostatického specifického antigenu (PSA) a/nebo ke klinickému zlepšení (fenomén vysazení antiandrogenů). pozorováno.
Farmakokinetika
Vstřebávání
Bicalutamid se po perorálním podání dobře vstřebává, ačkoli absolutní biologická dostupnost není známa. Současné podávání bikalutamidu s jídlem nemá žádný klinicky významný vliv na rychlost nebo rozsah absorpce.
Rozdělení
Bicalutamid je vysoce vázán na proteiny (96 %) [viz DROGOVÉ INTERAKCE ].
Metabolismus/eliminace
Bicalutamid podléhá stereospecifickému metabolismu. S (inaktivní) izomer je metabolizován primárně glukuronidací. R (aktivní) izomer také podléhá glukuronidaci, ale je převážně oxidován na neaktivní metabolit, po kterém následuje glukuronidace. Jak původní, tak metabolit glukuronidy jsou vylučovány močí a stolicí. S-enantiomer je rychle vylučován vzhledem k R-enantiomeru, přičemž R-enantiomer představuje asi 99 % celkových plazmatických hladin v ustáleném stavu.
Farmakokinetika aktivního enantiomeru přípravku CASODEX 50 mg u normálních mužů a pacientů s rakovinou prostaty je uvedena v tabulce 3.
Klinické studie
CASODEX 50 mg denně v kombinaci s LHRH-A
multicentrické, dvojitě zaslepené, kontrolované klinické studii bylo 813 pacientů s dříve neléčeným pokročilým karcinomem prostaty randomizováno k podávání přípravku CASODEX 50 mg jednou denně (404 pacientů) nebo flutamidu 250 mg (409 pacientů) třikrát denně, kombinace s analogy LHRH (buď implantát goserelin acetátu nebo depot leuprolid acetátu).
V analýze provedené po dosažení střední doby sledování 160 týdnů zemřelo 213 (52,7 %) pacientů léčených terapií analogem CASODEX-LHRH a 235 (57,5 %) pacientů léčených terapií analogem flutamid-LHRH. Mezi léčebnými skupinami nebyl žádný významný rozdíl v přežití (viz obrázek 1). Poměr rizik pro čas do smrti (přežití) byl 0,87 (95% interval spolehlivosti 0,72 až 1,05).
Obrázek 1 - Kaplan-Meierova pravděpodobnost úmrtí pro obě skupiny antiandrogenní léčby. 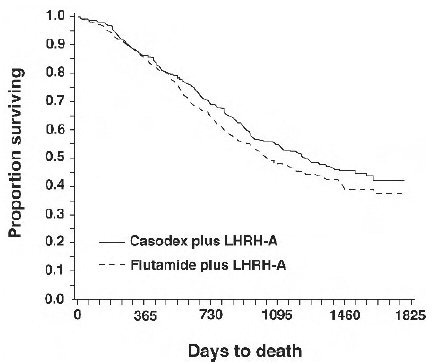
Mezi léčebnými skupinami nebyl žádný významný rozdíl v čase do objektivní progrese nádoru (viz obrázek 2). Objektivní progrese nádoru byla definována jako výskyt jakýchkoli kostních metastáz nebo zhoršení jakýchkoli existujících kostních metastáz na kostním skenu, které lze připsat metastatickému onemocnění, nebo zvýšení o 25 % nebo více jakýchkoli existujících měřitelných extraskeletálních metastáz. Poměr rizik pro čas do progrese přípravku CASODEX plus analog LHRH k riziku flutamidu plus analog LHRH byl 0,93 (95% interval spolehlivosti, 0,79 až 1,10).
Obrázek 2 - Kaplan-Meierova křivka pro čas do progrese pro obě skupiny s antiandrogenním působením. 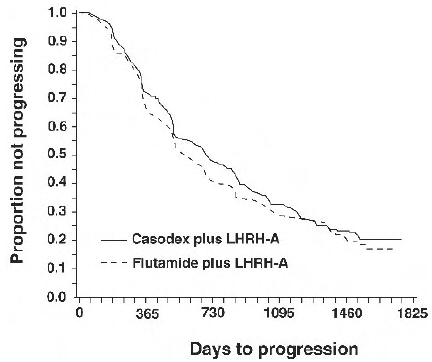
Kvalita života byla hodnocena pomocí dotazníků pro pacienty, kteří si sami podávali pacienty o bolesti, sociálním fungování, emoční pohodě, vitalitě, omezení aktivity, invaliditě na lůžku, celkovém zdraví, fyzické kapacitě, obecných symptomech a symptomech souvisejících s léčbou. Hodnocení dotazníků kvality života neukázalo konzistentní významné rozdíly mezi těmito dvěma léčebnými skupinami.
Bezpečnostní údaje z klinických studií s použitím přípravku CASODEX 150 mg
CASODEX 150 mg není schválen pro použití samostatně ani s jinou léčbou.
U pacientů s lokálně pokročilým (T3-4, NX, M0) nebo metastatickým (M1) karcinomem prostaty byly provedeny dvě totožné multicentrické, randomizované, otevřené studie srovnávající CASODEX 150 mg denně v monoterapii s kastrací.
Monoterapie – skupina M1
CASODEX 150 mg denně není schválen pro použití u pacientů s rakovinou prostaty M1. Na základě prozatímní analýzy dvou studií zaměřených na přežití doporučil Výbor pro sledování bezpečnosti dat přerušit léčbu přípravkem CASODEX u pacientů s M1, protože riziko úmrtí bylo 25 % (HR 1,25, 95% CI 0,87 až 1,81) a 31 % ( HR 1,31, 95% CI 0,97 až 1,77) vyšší ve skupině léčené přípravkem CASODEX 50 mg ve srovnání s kastrovanou skupinou.
Skupina Locally Advanced (T3-4, NX, M0).
CASODEX 150 mg denně není schválen pro použití u pacientů s lokálně pokročilým (T3-4, NX, M0) karcinomem prostaty. Po vysazení všech pacientů M1 pokračovaly studie s pacienty T3-4, NX, M0 až do dokončení studie. Ve větší studii (N=352) bylo riziko úmrtí o 25 % (HR 1,25, 95% CI 0,92 až 1,71) vyšší ve skupině CASODEX a v menší studii (N=140) bylo riziko úmrtí 36 % (HR 0,64, 95% CI, 0,39 až 1,03) nižší ve skupině CASODEX 50 mg.
Kromě dvou výše uvedených studií probíhají další tři klinické studie, které poskytují další bezpečnostní informace pro CASODEX 150 mg, což je dávka, která není schválena k použití. Jedná se o tři multicentrické, randomizované, dvojitě zaslepené, paralelní skupinové studie porovnávající CASODEX 150 mg denně v monoterapii (adjuvantní k předchozí léčbě nebo pod bdělým čekáním) s placebem, pro úmrtí nebo dobu do progrese onemocnění, v populaci 8113 pacientů s lokalizovaný nebo lokálně pokročilý karcinom prostaty.
CASODEX 150 mg denně není schválen pro použití jako terapie pro pacienty s lokalizovaným karcinomem prostaty, kteří jsou kandidáty bdělého čekání. Údaje z plánované analýzy podskupin dvou z těchto studií u 1627 pacientů s lokalizovaným karcinomem prostaty, kteří byli pod bedlivým čekáním, odhalila trend ke snížení přežití ve skupině CASODEX po střední době sledování 7,4 let. U pacientů léčených přípravkem CASODEX došlo k 294 (37,7 %) úmrtím oproti 279 (32,9 %) úmrtím u pacientů léčených placebem (lokalizovaná skupina s pozorným vyčkáváním) pro poměr rizika 1,16 (95% CI 0,99 až 1,37).
INFORMACE PRO PACIENTA
CASODEX® [cas–o–dex] (bikalutamid) Tableta
Přečtěte si tyto informace pro pacienta dříve, než začnete užívat CASODEX 50 mg a pokaždé, když dostanete náhradní náplň. Mohou se objevit nové informace. Tento leták nenahrazuje rozhovor s vaším poskytovatelem zdravotní péče o vašem zdravotním stavu nebo vaší léčbě.
Co je CASODEX 50 mg?
CASODEX je lék na předpis nazývaný inhibitor androgenního receptoru, který se používá v kombinaci s léky obsahujícími hormon uvolňující luteinizační hormon (LHRH) k léčbě metastatického karcinomu prostaty stadia D2.
CASODEX není určen k použití u žen.
Není známo, zda je CASODEX bezpečný a účinný u dětí.
Kdo by neměl užívat CASODEX 50 mg?
Neužívejte CASODEX 50 mg, jestliže:
- jsou žena.
- jste těhotná nebo můžete otěhotnět. CASODEX může poškodit vaše nenarozené dítě.
- jste alergičtí na kteroukoli složku přípravku CASODEX. Úplný seznam složek přípravku CASODEX naleznete na konci této příbalové informace. Okamžitě vyhledejte lékařskou pomoc, pokud se u Vás objeví některý z následujících příznaků alergické reakce: svědění, kopřivka (vyvýšené hrbolky), otok obličeje, rtů nebo jazyka, potíže s dýcháním nebo polykáním.
Co bych měl říci svému poskytovateli zdravotní péče před užitím přípravku CASODEX?
Než začnete užívat CASODEX 50 mg, informujte svého poskytovatele zdravotní péče o všech svých zdravotních potížích, včetně toho, zda:
- mít problémy s játry.
- vezměte si lék na ředění krve. Pokud si nejste jisti, zda váš lék ředí krev, zeptejte se svého poskytovatele zdravotní péče nebo lékárníka.
- máte cukrovku (u lidí užívajících CASODEX v kombinaci s LHRH léky byla hlášena špatná kontrola krevního cukru).
- máte partnerku, která je těhotná nebo by mohla otěhotnět. Během užívání přípravku CASODEX 50 mg a po dobu 130 dnů po ukončení léčby přípravkem CASODEX byste měla používat účinné antikoncepční metody. Poraďte se se svým lékařem, pokud máte nějaké otázky ohledně antikoncepce.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků. CASODEX 50 mg a jiné léky se mohou navzájem ovlivňovat a způsobit nežádoucí účinky. CASODEX může ovlivnit účinek jiných léků a jiné léky mohou ovlivnit účinek přípravku CASODEX 50 mg.
Znát léky, které užíváte. Mějte s sebou seznam svých léků, abyste je mohli ukázat poskytovatelům zdravotní péče, když dostanete nový lék.
Jak mám užívat CASODEX 50 mg?
- Užívejte CASODEX přesně tak, jak vám řekl váš poskytovatel zdravotní péče.
- Užívejte CASODEX každý den ve stejnou dobu.
- Vaše léčba přípravkem CASODEX 50 mg by měla začít ve stejnou dobu jako léčba přípravkem LHRH.
- Pokud vynecháte dávku, neužívejte další dávku, vezměte si další dávku v obvyklou dobu. Neužívejte 2 dávky současně.
- CASODEX 50 mg lze užívat s jídlem nebo bez jídla.
- Pokud užijete příliš mnoho přípravku CASODEX, zavolejte svého poskytovatele zdravotní péče nebo Poison Control Center nebo jděte ihned na pohotovost v nejbližší nemocnici.
- Nepřestávejte užívat CASODEX, pokud vám to neřekne váš poskytovatel zdravotní péče.
- Váš poskytovatel zdravotní péče může během užívání přípravku CASODEX provádět krevní testy.
- Vaše rakovina prostaty se může zhoršit při užívání přípravku CASODEX v kombinaci s léky LHRH.
Pravidelné sledování rakoviny prostaty u vašeho poskytovatele zdravotní péče je důležité, abyste zjistili, zda je vaše onemocnění horší.
Čemu se mám vyhnout při užívání přípravku CASODEX 50 mg?
Neřiďte, neobsluhujte stroje ani neprovádějte jiné nebezpečné činnosti, dokud nezjistíte, jak na vás CASODEX působí.
Někteří lidé měli při užívání přípravku CASODEX citlivost kůže na sluneční záření. Během léčby přípravkem CASODEX byste se měli vyhýbat slunečnímu záření nebo slunečním paprskům a soláriím a zvážit použití opalovacího krému.
Jaké jsou možné vedlejší účinky přípravku CASODEX 50 mg?
CASODEX může způsobit závažné nežádoucí účinky, včetně:
- Problémy s játry, včetně selhání jater, které může vyžadovat léčbu v nemocnici nebo které může vést k úmrtí. Váš poskytovatel zdravotní péče by měl před a během léčby přípravkem CASODEX provést krevní testy, aby zkontroloval funkci jater. Okamžitě informujte svého poskytovatele zdravotní péče, pokud se během léčby objeví některý z těchto příznaků jaterního problému:
- zežloutnutí kůže a očí (žloutenka)
- tmavá moč
- bolest v pravé horní části žaludku
- nevolnost
- zvracení
- únava
- ztráta chuti k jídlu
- zimnice
- horečka
- Potíže s dýcháním s kašlem nebo horečkou nebo bez nich. Někteří lidé užívající CASODEX 50 mg dostanou zánět plic nazývaný intersticiální plicní onemocnění.
- Alergická reakce. Příznaky alergické reakce zahrnují: svědění kůže, kopřivku (vyvýšené hrbolky), otok obličeje, rtů, jazyka, hrdla nebo potíže s polykáním.
- Zvětšení prsou (gynekomastie) a bolest prsou.
- U lidí, kteří užívají CASODEX 50 mg v kombinaci s LHRH léky, může dojít ke špatné kontrole krevního cukru. Váš poskytovatel zdravotní péče může během léčby přípravkem CASODEX 50 mg kontrolovat hladinu cukru v krvi.
Mezi nejčastější nežádoucí účinky přípravku CASODEX 50 mg patří:
- návaly horka nebo krátké období pocitu tepla a pocení
- bolest celého těla v zádech, pánvi, břiše
- pocit slabosti
- zácpa
- infekce
- nevolnost
- otoky kotníků, nohou nebo chodidel
- průjem
- krev ve vaší moči
- probouzení ze spánku k nočnímu močení
- snížení počtu červených krvinek (anémie)
- pocit závratě
Informujte svého poskytovatele zdravotní péče, pokud máte jakýkoli vedlejší účinek, který vás obtěžuje nebo který nezmizí.
Toto nejsou všechny možné vedlejší účinky přípravku CASODEX. Další informace získáte od svého poskytovatele zdravotní péče nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám uchovávat CASODEX?
Uchovávejte CASODEX při pokojové teplotě mezi 68 °F až 77 °F (20 °C až 25 °C).
Uchovávejte CASODEX 50 mg a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a efektivním používání přípravku CASODEX.
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v příbalové informaci pro pacienty. Nepoužívejte CASODEX pro stav, pro který nebyl předepsán. Nedávejte CASODEX 50 mg jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Tento leták s informacemi pro pacienty shrnuje nejdůležitější informace o přípravku CASODEX. Pokud byste chtěli více informací o CASODEX, promluvte si se svým poskytovatelem zdravotní péče. Můžete požádat svého poskytovatele zdravotní péče nebo lékárníka o informace o přípravku CASODEX, který je určen pro zdravotníky. Pro více informací navštivte www.CASODEX.com nebo volejte 1-800-236-9933.
Jaké jsou složky přípravku CASODEX 50 mg?
Aktivní složka: bicalutamid.
Neaktivní složky: laktóza, magnesium-stearát, hypromelóza, polyethylenglykol, polyvidon, sodná sůl glykolátu škrobu, oxid titaničitý.
Tyto informace pro pacienty byly schváleny americkým Úřadem pro kontrolu potravin a léčiv.
