Hydrea 500mg Hydroxyurea Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Hydrea 500 mg a jak se používá?
Hydrea (hydroxymočovina) je antineoplastické (protirakovinné) činidlo používané k léčbě melanomu, rezistentní chronické myelocytární leukémie a recidivujícího, metastatického nebo inoperabilního karcinomu vaječníků a primárních spinocelulárních (epidermoidních) karcinomů hlavy a krku. Hydrea je k dispozici v obecné formě.
Jaké jsou vedlejší účinky přípravku Hydrea?
Mezi běžné vedlejší účinky přípravku Hydrea patří:
- nevolnost,
- zvracení,
- žaludeční nevolnost,
- průjem,
- zácpa,
- kožní změny, jako je olupování nebo změna barvy,
- příznaky podobné chřipce,
- ztráta vlasů,
- vyrážka,
- bolest hlavy,
- závrať,
- ospalost, popř
- přibývání na váze.
Mezi závažné vedlejší účinky přípravku Hydrea patří:
- anémie,
- myelosuprese a
- leukémie.
POPIS
HYDREA (hydroxymočovinové kapsle, USP) je antimetabolit dostupný pro perorální použití jako kapsle obsahující 500 mg hydroxymočoviny. Mezi neaktivní složky patří kyselina citrónová, barviva (D&C Yellow č. 10, FD&C Blue č. 1, FD&C Red č. 40 a D&C Red č. 28), želatina, laktóza, stearát hořečnatý, fosforečnan sodný a oxid titaničitý.
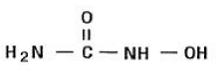
Hydroxymočovina je bílý až téměř bílý krystalický prášek. Je hygroskopický a snadno rozpustný ve vodě, ale prakticky nerozpustný v alkoholu. Empirický vzorec je CH4N2O2 a má molekulovou hmotnost 76,05. Jeho strukturní vzorec je:
INDIKACE
HYDREA 500 mg je indikován k léčbě:
- Rezistentní chronická myeloidní leukémie.
- Lokálně pokročilé spinocelulární karcinomy hlavy a krku (mimo rtu) v kombinaci s chemoradiací.
DÁVKOVÁNÍ A PODÁVÁNÍ
Informace o dávkování
HYDREA se používá samostatně nebo ve spojení s jinými protinádorovými látkami nebo radiační terapií k léčbě neoplastických onemocnění. Individualizujte léčbu na základě typu nádoru, stavu onemocnění, odpovědi na léčbu, rizikových faktorech pacienta a současných standardů klinické praxe.
Veškeré dávkování založte na skutečné nebo ideální hmotnosti pacienta, podle toho, která hodnota je nižší.
HYDREA je cytotoxický lék. Dodržujte příslušné speciální postupy pro manipulaci a likvidaci [viz REFERENCE ].
Kapsle HYDREA spolkněte celé. NEOTVÍREJTE, nelámejte ani nežvýkejte tobolky, protože HYDREA je cytotoxický lék.
Doporučuje se profylaktické podávání kyseliny listové [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Během léčby přípravkem HYDREA 500 mg sledujte krevní obraz alespoň jednou týdně. Před zahájením léčby přípravkem HYDREA je nutné upravit těžkou anémii.
Úpravy dávek pro toxicitu
Sledujte následující a podle toho snižte dávku nebo přerušte léčbu přípravkem HYDREA 500 mg:
- Myelosuprese [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Kožní vaskulitida [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zvažte úpravy dávky pro jiné toxicity.
Úpravy dávky pro poškození ledvin
Snižte dávku HYDREA o 50 % u pacientů s naměřenou clearance kreatininu nižší než 60 ml/min nebo s terminálním onemocněním ledvin (ESRD) [viz Použití u konkrétních populací a KLINICKÁ FARMAKOLOGIE ].
U těchto pacientů se doporučuje pečlivé sledování hematologických parametrů.
JAK DODÁVÁNO
Dávkové formy A Síly
Kapsle
500 mg neprůhledné zelené víčko a neprůhledné růžové tělo s potiskem „HYDREA“ a „830“.
Skladování A Manipulace
HYDREA® (hydroxymočovinové kapsle, USP) je dodáván jako 500 mg tobolky v HDPE lahvičkách s plastovým bezpečnostním šroubovacím uzávěrem. Každá lahvička obsahuje 100 kapslí.
Čepice je neprůhledná zelená a tělo je neprůhledné růžové. Tobolky jsou na obou částech potištěny černým inkoustem „HYDREA“ a „830“ ( NDC 0003-0830-50).
Úložný prostor
Skladujte při 20-25°C (68-77°F); povolené odchylky do 15°C-30°C (59°F-86°F) [viz USP Controlled Room Temperature]. Uchovávejte těsně uzavřené.
Manipulace A Likvidace
HYDREA 500 mg je cytotoxický lék. Dodržujte příslušné speciální postupy pro manipulaci a likvidaci [viz REFERENCE ].
Chcete-li snížit riziko kontaktu, doporučte pečovatelům, aby při manipulaci s HYDREA nebo lahvemi obsahujícími HYDREA nosili jednorázové rukavice. Při manipulaci s HYDREA si před a po kontaktu s lahvičkou nebo kapslemi umyjte ruce mýdlem a vodou. Neotevírejte tobolky HYDREA 500 mg. Vyvarujte se kontaktu s rozdrcenými nebo otevřenými tobolkami. Pokud dojde ke kontaktu s rozdrcenými nebo otevřenými tobolkami na kůži, postižené místo okamžitě a důkladně omyjte mýdlem a vodou. Pokud dojde ke kontaktu oka (očí) s rozdrcenými nebo otevřenými tobolkami, postižené místo by mělo být důkladně vyplachováno vodou nebo izotonickou oční vodou určenou k tomuto účelu po dobu nejméně 15 minut. Pokud se prášek z kapsle rozsype, okamžitě jej otřete vlhkým ručníkem na jedno použití a vyhoďte do uzavřené nádoby, např. plastového sáčku; stejně jako prázdné kapsle. Rozlité oblasti by měly být poté třikrát vyčištěny roztokem čisticího prostředku a následně čistou vodou. Udržujte lék mimo dosah dětí a domácích zvířat. Požádejte svého lékaře o pokyny, jak zlikvidovat prošlé tobolky.
REFERENCE
OSHA. http://www.osha.gov/SLTC/hazardousdrugs/index.html.
Vyrobeno pro: Bristol-Myers Squibb Company Princeton, New Jersey 08543 USA. Upraveno: prosinec 2020
VEDLEJŠÍ EFEKTY
Následující klinicky významné nežádoucí účinky jsou podrobně popsány v jiných částech označení:
- Myelosuprese [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Malignity [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Vaskulitická toxicita [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Rizika při současném užívání antiretrovirových léků [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Vyvolání radiace [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Makrocytóza [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Plicní toxicita [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Postmarketingové zkušenosti
Během používání přípravku HYDREA po schválení byly zjištěny následující nežádoucí účinky. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci.
- Poruchy reprodukčního systému a prsou: azoospermie a oligospermie
- Gastrointestinální poruchy: stomatitida, nevolnost, zvracení, průjem a zácpa
- Poruchy metabolismu a výživy: anorexie, syndrom rozpadu nádoru
- Poruchy kůže a podkoží: makulopapulózní vyrážka, kožní ulcerace, kožní lupus erythematodes, kožní změny podobné dermatomyositidě, periferní a obličejový erytém, hyperpigmentace, hyperpigmentace nehtů, atrofie kůže a nehtů, šupinatění, fialové papuly a alopecie
- Poruchy ledvin a močových cest: dysurie, zvýšení kyseliny sérové, dusíku močoviny v krvi (BUN) a hladiny kreatininu
- Poruchy nervového systému: bolest hlavy, závratě, ospalost, dezorientace, halucinace a křeče
- Celkové poruchy: horečka, zimnice, malátnost, edém a astenie
- Poruchy jater a žlučových cest: zvýšení jaterních enzymů, cholestáza a hepatitida
- Poruchy dýchání: difuzní plicní infiltráty, dušnost a plicní fibróza, intersticiální plicní onemocnění, pneumonitida, alveolitida, alergická alveolitida a kašel
- Poruchy imunity: systémový lupus erythematodes
- Přecitlivělost: Horečka vyvolaná léky (pyrexie) (>39°C, >102°F) vyžadující hospitalizaci byla hlášena současně s gastrointestinálními, plicními, muskuloskeletálními, hepatobiliárními, dermatologickými nebo kardiovaskulárními projevy. K nástupu obvykle došlo do 6 týdnů od zahájení a vymizel po vysazení hydroxymočoviny. Po opětovném podání se horečka znovu objevila obvykle do 24 hodin.
Nežádoucí účinky pozorované při kombinované léčbě hydroxyureou a ozařováním jsou podobné těm, které byly hlášeny při použití samotné hydroxyurey nebo radiační léčby. Mezi tyto účinky patří především útlum kostní dřeně (anémie a leukopenie), podráždění žaludku a mukositida. Téměř všichni pacienti, kteří dostávají adekvátní kúru kombinované léčby hydroxyureou a ozařováním, budou vykazovat souběžnou leukopenii. Útlum krevních destiček (
DROGOVÉ INTERAKCE
Zvýšená toxicita při současném užívání antiretrovirových léků
Pankreatitida
pacientů s infekcí HIV se během léčby hydroxyureou a didanosinem, se stavudinem nebo bez něj, vyskytla fatální a nefatální pankreatitida. Hydroxyurea není indikována k léčbě infekce HIV; pokud jsou však pacienti s infekcí HIV léčeni hydroxyureou, a zejména v kombinaci s didanosinem a/nebo stavudinem, doporučuje se pečlivé sledování známek a příznaků pankreatitidy. U pacientů, u kterých se rozvinou známky a příznaky pankreatitidy, trvale přerušte léčbu hydroxyureou.
Hepatotoxicita
Hepatotoxicita a jaterní selhání vedoucí k úmrtí byly hlášeny během postmarketingového sledování u pacientů s HIV infekcí léčených hydroxyureou a jinými antiretrovirovými léky. Fatální jaterní příhody byly hlášeny nejčastěji u pacientů léčených kombinací hydroxyurey, didanosinu a stavudinu. Vyhněte se této kombinaci.
Periferní neuropatie
Periferní neuropatie, která byla v některých případech závažná, byla hlášena u pacientů s infekcí HIV, kteří dostávali hydroxyureu v kombinaci s antiretrovirovými léky, včetně didanosinu, se stavudinem nebo bez něj.
Interference laboratorních testů
Interference s kyselinou močovou, močovinou nebo kyselinou mléčnou
Studie ukázaly, že existuje analytická interference hydroxymočoviny s enzymy (ureáza, urikáza a laktátdehydrogenáza) používanými při stanovení močoviny, kyseliny močové a kyseliny mléčné, což vede k falešně zvýšeným výsledkům těchto u pacientů léčených hydroxymočovinou.
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Myelosuprese
Hydroxymočovina způsobuje těžkou myelosupresi. Léčba hydroxyureou by neměla být zahájena, pokud je funkce kostní dřeně výrazně snížena. Může dojít k útlumu kostní dřeně a leukopenie je obecně jeho prvním a nejčastějším projevem. Trombocytopenie a anémie se vyskytují méně často a jsou zřídkakdy pozorovány bez předchozí leukopenie. Útlum kostní dřeně je pravděpodobnější u pacientů, kteří dříve podstoupili radioterapii nebo cytotoxická chemoterapeutika proti rakovině; u těchto pacientů používejte hydroxymočovinu opatrně.
Vyhodnoťte hematologický stav před a během léčby přípravkem HYDREA. Poskytněte podpůrnou péči a podle potřeby upravte dávku nebo přerušte léčbu přípravkem HYDREA. Zotavení z myelosuprese je obvykle rychlé, když je léčba přerušena.
Malignity
Hydroxymočovina je lidský karcinogen. U pacientů užívajících dlouhodobě hydroxyureu pro myeloproliferativní poruchy byla hlášena sekundární leukémie. Rakovina kůže byla také hlášena u pacientů dlouhodobě užívajících hydroxyureu. Doporučte ochranu před slunečním zářením a sledujte vývoj sekundárních malignit.
Embryo-fetální toxicita
Na základě mechanismu účinku a nálezů u zvířat může HYDREA 500 mg způsobit poškození plodu při podání těhotné ženě. Hydroxymočovina byla embryotoxická a teratogenní u potkanů a králíků v dávkách 0,8krát a 0,3krát, v daném pořadí, než je maximální doporučená denní dávka pro člověka na základě mg/m2. Informujte těhotné ženy o potenciálním riziku pro plod [viz Použití u konkrétních populací ].
Informujte ženy s reprodukčním potenciálem, aby během a po léčbě přípravkem HYDREA 500 mg užívaly účinnou antikoncepci po dobu nejméně 6 měsíců po léčbě. Informujte muže s reprodukčním potenciálem, aby používali účinnou antikoncepci během a po léčbě přípravkem HYDREA 500 mg po dobu nejméně 1 roku po léčbě (viz Použití u konkrétních populací ].
Vaskulitická toxicita
Během léčby hydroxyureou se u pacientů s myeloproliferativními poruchami vyskytly kožní vaskulitické toxicity, včetně vaskulitických ulcerací a gangrény. Tyto vaskulitické toxicity byly hlášeny nejčastěji u pacientů s anamnézou nebo v současné době léčených interferonem. Pokud se objeví kožní vaskulitické vředy, zahajte léčbu a přerušte léčbu přípravkem HYDREA.
Živé očkování
Vyhněte se použití živé vakcíny u pacientů užívajících HYDREA. Současné použití vakcíny HYDREA s živou virovou vakcínou může zesílit replikaci viru a/nebo může zvýšit nežádoucí reakci vakcíny, protože normální obranné mechanismy mohou být vakcínou HYDREA potlačeny. Očkování živými vakcínami u pacienta, který dostává HYDREA 500 mg, může vést k těžké infekci. Protilátková odpověď pacienta na vakcíny může být snížena. Zvažte konzultaci s odborníkem.
Rizika při současném užívání antiretrovirových léků
Pankreatitida, hepatotoxicita a periferní neuropatie se objevily, když byla hydroxyurea podávána současně s antiretrovirovými léky, včetně didanosinu a stavudinu (viz DROGOVÉ INTERAKCE ].
Vyvolání radiace
U pacientů, kteří byli v minulosti léčeni ozařováním, může dojít k exacerbaci postiradiačního erytému. Monitorujte kožní erytém u pacientů, kteří dříve podstoupili ozařování, a řešte symptomaticky.
Makrocytóza
HYDREA 500 mg může způsobit makrocytózu, která sama odezní a je často pozorována na začátku léčby. Morfologická změna připomíná perniciózní anémii, ale nesouvisí s nedostatkem vitaminu B12 nebo kyseliny listové. To může maskovat diagnózu perniciózní anémie. Doporučuje se profylaktické podávání kyseliny listové.
Plicní toxicita
pacientů léčených pro myeloproliferativní novotvar bylo hlášeno intersticiální onemocnění plic včetně plicní fibrózy, plicní infiltrace, pneumonitidy a alveolitidy/alergické alveolitidy (včetně fatálních případů). Často sledujte pacienty, u kterých se rozvine horečka, kašel, dušnost nebo jiné respirační symptomy, okamžitě je vyšetřujte a léčte. Vysaďte HYDREA 500 mg a řiďte se kortikosteroidy [viz NEŽÁDOUCÍ REAKCE ].
Interference laboratorních testů
Interference s testy na kyselinu močovou, močovinu nebo kyselinu mléčnou je možná, což vede k falešně zvýšeným výsledkům těchto u pacientů léčených hydroxymočovinou (viz DROGOVÉ INTERAKCE ].
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Konvenční dlouhodobé studie k hodnocení karcinogenního potenciálu hydroxymočoviny nebyly provedeny. Intraperitoneální podávání 125 až 250 mg/kg hydroxymočoviny (přibližně 0,6–1,2násobek maximální doporučené denní perorální dávky u lidí na bázi mg/m2) třikrát týdně po dobu 6 měsíců samicím potkanů zvýšilo výskyt nádorů mléčné žlázy u potkanů přežívajících na 18 let. měsíců ve srovnání s kontrolou. Hydroxymočovina je in vitro mutagenní pro bakterie, houby, prvoky a savčí buňky. Hydroxymočovina je klastogenní in vitro (buňky křečků, lidské lymfoblasty) a in vivo (test SCE na hlodavcích, mikronukleový test myší). Hydroxymočovina způsobuje transformaci buněk embrya hlodavců na tumorigenní fenotyp.
Hydroxymočovina podávaná samcům potkanů v dávce 60 mg/kg/den (asi 0,3násobek maximální doporučené denní dávky pro člověka na bázi mg/m2) vyvolala testikulární atrofii, snížila spermatogenezi a významně snížila jejich schopnost oplodnit samice.
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
HYDREA může způsobit poškození plodu na základě zjištění ze studií na zvířatech a mechanismu účinku léku [viz KLINICKÁ FARMAKOLOGIE ]. Neexistují žádné údaje o použití přípravku HYDREA u těhotných žen, které by informovaly o riziku souvisejícím s užíváním léků. V reprodukčních studiích na zvířatech vyvolalo podávání hydroxymočoviny březím krysám a králíkům během organogeneze embryotoxické a teratogenní účinky v dávkách 0,8krát a 0,3krát, v tomto pořadí, než je maximální doporučená denní dávka u člověka na základě mg/m2 (viz Data ). Informujte ženy o potenciálním riziku pro plod a o tom, aby se vyhnuly otěhotnění během léčby přípravkem HYDREA.
V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2–4 % a 15–20 %.
Data
Údaje o zvířatech
Hydroxymočovina byla prokázána jako silný teratogen na celé řadě zvířecích modelů, včetně myší, křečků, koček, miniaturních prasat, psů a opic v dávkách 1-násobku lidské dávky podávané na základě mg/m2. Hydroxymočovina je embryotoxická a způsobuje malformace plodu (částečně zkostnatělé lebeční kosti, absence očních důlků, hydrocefalie, bipartitní hrudní kosti, chybějící bederní obratle) v dávce 180 mg/kg/den (asi 0,8násobek maximální doporučené denní dávky u člověka na základě mg/m2) u potkanů a při 30 mg/kg/den (asi 0,3násobek maximální doporučené denní dávky pro člověka na základě mg/m2) u králíků. Embryotoxicita byla charakterizována sníženou životaschopností plodu, sníženou velikostí živého vrhu a opožděním vývoje. Hydroxymočovina prochází placentou. Jednotlivé dávky ≥375 mg/kg (asi 1,7násobek maximální doporučené denní dávky pro člověka na základě mg/m2) potkanům způsobily zpomalení růstu a zhoršenou schopnost učení.
Laktace
Shrnutí rizik
Hydroxymočovina se vylučuje do lidského mléka. Vzhledem k možnosti závažných nežádoucích účinků hydroxymočoviny u kojených dětí, včetně karcinogenity, přerušte kojení během léčby přípravkem HYDREA.
Ženy a muži reprodukčního potenciálu
Těhotenský test
Před zahájením léčby přípravkem HYDREA ověřte stav těhotenství u žen s reprodukčním potenciálem.
Antikoncepce
Ženy
HYDREA může způsobit poškození plodu při podávání těhotné ženě [viz Těhotenství ]. Informujte ženy s reprodukčním potenciálem, aby během léčby přípravkem HYDREA a po ní alespoň 6 měsíců po léčbě používaly účinnou antikoncepci. Doporučte ženám, aby okamžitě oznámily březost.
Muži
HYDREA 500 mg může poškodit spermie a tkáň varlat, což má za následek možné genetické abnormality. Muži se sexuálními partnerkami s reprodukčním potenciálem by měli používat účinnou antikoncepci během a po léčbě přípravkem HYDREA 500 mg po dobu nejméně 1 roku po léčbě (viz Neklinická toxikologie ].
Neplodnost
Muži
Na základě zjištění u zvířat a lidí může být samčí plodnost při léčbě přípravkem HYDREA ohrožena. U mužů byla pozorována azoospermie nebo oligospermie, někdy reverzibilní. Neformální pacienti o možnosti konzervace spermií před zahájením terapie [viz NEŽÁDOUCÍ REAKCE a Neklinická toxikologie ].
Pediatrické použití
Bezpečnost a účinnost u pediatrických pacientů nebyla stanovena.
Geriatrické použití
Starší pacienti mohou být citlivější na účinky hydroxymočoviny a mohou vyžadovat režim nižších dávek. Hydroxymočovina se vylučuje ledvinami a riziko nežádoucích reakcí na tento lék může být větší u pacientů s poruchou funkce ledvin. Protože u starších pacientů je pravděpodobnější, že budou mít sníženou funkci ledvin, je třeba věnovat pozornost výběru dávky a může být užitečné sledovat funkci ledvin [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Renální poškození
Expozice hydroxymočovině je vyšší u pacientů s clearance kreatininu nižší než 60 ml/min nebo u pacientů s terminálním onemocněním ledvin (ESRD). Při podávání přípravku HYDREA 500 mg těmto pacientům snižte dávkování a pečlivě sledujte hematologické parametry [viz DÁVKOVÁNÍ A PODÁVÁNÍ a KLINICKÁ FARMAKOLOGIE ].
Poškození jater
Neexistují žádné údaje, které by podporovaly konkrétní pokyny pro úpravu dávkování u pacientů s poruchou funkce jater. U těchto pacientů se doporučuje pečlivé sledování hematologických parametrů.
PŘEDÁVKOVAT
Akutní mukokutánní toxicita byla hlášena u pacientů užívajících hydroxymočovinu v dávkách několikanásobku terapeutické dávky. Byla také pozorována bolestivost, fialový erytém, edém na dlaních a chodidlech s následným olupováním rukou a nohou, závažná generalizovaná hyperpigmentace kůže a stomatitida.
KONTRAINDIKACE
HYDREA 500 mg je kontraindikován u pacientů, u kterých byla v minulosti prokázána přecitlivělost na hydroxymočovinu nebo kteroukoli jinou složku přípravku.
KLINICKÁ FARMAKOLOGIE
Mechanismus Akce
Přesný mechanismus, kterým hydroxymočovina vyvolává své antineoplastické účinky, nelze v současnosti popsat. Nicméně zprávy z různých studií na tkáňových kulturách u potkanů a lidí podporují hypotézu, že hydroxymočovina způsobuje okamžitou inhibici syntézy DNA tím, že působí jako inhibitor ribonukleotidreduktázy, aniž by interferovala se syntézou ribonukleové kyseliny nebo proteinu. Tato hypotéza vysvětluje, proč za určitých podmínek může hydroxymočovina vyvolat teratogenní účinky.
Pro zvýšenou účinnost současného použití terapie hydroxyureou s ozařováním na spinocelulární (epidermoidní) karcinomy hlavy a krku byly navrženy tři mechanismy účinku. Studie in vitro využívající buňky čínského křečka naznačují, že hydroxymočovina (1) je smrtelná pro normálně radiorezistentní buňky ve stádiu S a (2) zadržuje další buňky buněčného cyklu ve fázi G1 nebo pre-DNA syntézy, kde jsou nejvíce náchylné k účinky ozáření. Třetí mechanismus účinku byl teoretizován na základě in vitro studií buněk HeLa. Zdá se, že hydroxymočovina inhibicí syntézy DNA brání normálnímu procesu opravy buněk poškozených, ale nezabitých ozářením, čímž se snižuje jejich míra přežití; Syntézy RNA a proteinů neprokázaly žádné změny.
Farmakokinetika
Vstřebávání
Po perorálním podání HYDREA dosahuje hydroxymočovina maximální plazmatické koncentrace za 1 až 4 hodiny. Průměrné maximální plazmatické koncentrace a AUC se zvyšují více než proporcionálně se zvyšováním dávky.
Neexistují žádné údaje o vlivu potravy na absorpci hydroxymočoviny.
Rozdělení
Hydroxymočovina se distribuuje do celého těla s distribučním objemem, který se blíží celkové tělesné vodě.
Hydroxymočovina se koncentruje v leukocytech a erytrocytech.
Metabolismus
Až 60 % perorální dávky podléhá přeměně prostřednictvím saturovatelného jaterního metabolismu a menší cestou degradace ureázou nacházející se ve střevních bakteriích.
Vylučování
U pacientů se srpkovitou anémií byl průměrný kumulativní výtěžek hydroxymočoviny v moči asi 40 % podané dávky.
Specifické populace
Renální poškození
Vliv poruchy funkce ledvin na farmakokinetiku hydroxyurey byl hodnocen u dospělých pacientů se srpkovitou anémií a poruchou funkce ledvin. Pacienti s normální funkcí ledvin (clearance kreatininu [CrCl] >80 ml/min), mírnou (CrCl 50-80 ml/min), středně těžkou (CrCl = 30- 60 ml/min). Snižte dávku HYDREA 500 mg, pokud je podáván pacientům s clearance kreatininu DÁVKOVÁNÍ A PODÁVÁNÍ a Použití u konkrétních populací ].
INFORMACE PRO PACIENTA
- Existuje riziko myelosuprese. U pacientů užívajících HYDREA je třeba zdůraznit týdenní sledování krevního obrazu po celou dobu trvání léčby (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Informujte pacienty, aby okamžitě hlásili známky a příznaky infekce nebo krvácení.
- Informujte pacienty, že existuje riziko kožní vaskulitické toxicity a sekundárních malignit včetně leukémie a rakoviny kůže [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Informujte ženy o reprodukčním potenciálu potenciálního rizika pro plod a informujte svého poskytovatele zdravotní péče o známém nebo předpokládaném těhotenství. Informujte ženy a muže s reprodukčním potenciálem, aby používali antikoncepci během a po léčbě přípravkem HYDREA (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
- Informujte pacienty, aby informovali svého poskytovatele zdravotní péče, pokud dostali nebo plánují dostat očkování během užívání přípravku HYDREA 500 mg, protože to může vést k závažné infekci [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Doporučte ženám, aby během léčby přípravkem HYDREA přerušily kojení [viz Použití u konkrétních populací ].
- Pacienti s infekcí HIV by měli kontaktovat svého lékaře kvůli známkám a příznakům pankreatitidy, jaterních příhod a periferní neuropatie (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- U pacientů, kteří podstoupili předchozí ozařovací terapii, se může objevit erytém po ozáření [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Informujte pacienty o příznacích potenciální plicní toxicity a poučte je, aby vyhledali okamžitou lékařskou pomoc v případě horečky, kašle, dušnosti nebo jiných respiračních příznaků [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
