Zofran 4mg, 8mg Ondansetron Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Zofran a jak se používá?
Zofran 4 mg je lék na předpis používaný jako profylaxe a k léčbě příznaků nevolnosti a zvracení v důsledku některých léků nebo pooperačně. Zofran 8 mg lze užívat samostatně nebo s jinými léky.
Zofran patří do třídy léků nazývaných Antiemetika, selektivní antagonista 5-HT3.
Není známo, zda je přípravek Zofran 4 mg bezpečný a účinný u dětí mladších 1 měsíce.
Jaké jsou možné vedlejší účinky Zofranu?
Zofran může způsobit závažné nežádoucí účinky včetně:
- silná zácpa,
- bolest břicha,
- nadýmání,
- bolest hlavy s bolestí na hrudi a těžkými závratěmi,
- mdloby,
- rychlé nebo bušení srdce,
- zežloutnutí kůže nebo očí (žloutenka)
- rozmazané vidění,
- dočasná ztráta zraku,
- míchání,
- halucinace,
- horečka,
- rychlý srdeční tep,
- hyperaktivní reflexy,
- nevolnost,
- zvracení,
- průjem,
- ztráta koordinace a
- mdloba
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Zofran patří:
- průjem,
- zácpa,
- ospalost a
- pocit únavy
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky Zofranu. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
Léčivou látkou přípravku ZOFRAN 4 mg tablety a perorálního roztoku ZOFRAN je ondansetron hydrochlorid jako dihydrát, racemická forma ondansetronu a selektivní blokátor serotoninového 5-HT3 receptorového typu. Chemicky se jedná o (±) 1,2,3,9-tetrahydro-9-methyl-3-[(2-methyl-1H-imidazol-1-yl)methyl]-4H-karbazol-4-on, monohydrochlorid, dihydrát . Má následující strukturní vzorec:
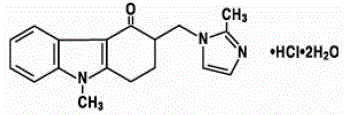
Empirický vzorec je C18H19N3O·HCl·2H2O, představující molekulovou hmotnost 365,9.
Dihydrát ondansetron hydrochloridu je bílý až téměř bílý prášek, který je rozpustný ve vodě a fyziologickém roztoku.
Účinnou látkou přípravku ZOFRAN 4 mg ODT perorálně se rozpadajících tablet je báze ondansetronu, racemická forma ondansetronu a selektivní blokátor serotoninového 5-HT3 receptorového typu. Chemicky se jedná o (±) 1,2,3,9tetrahydro-9-methyl-3-[(2-methyl-lH-imidazol-l-yl)methyl]-4H-karbazol-4-on. Má následující strukturní vzorec:
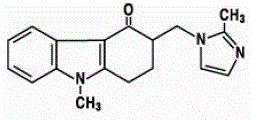
Empirický vzorec je C18H19N3O představující molekulovou hmotnost 293,4.
Jedna 4mg tableta ZOFRAN 8 mg pro perorální podání obsahuje dihydrát ondansetroni hydrochloridum odpovídající 4 mg ondansetronu. Jedna 8mg tableta ZOFRAN 8mg pro perorální podání obsahuje ondansetroni hydrochloridum dihydricum odpovídající 8 mg ondansetronu. Každá tableta také obsahuje neaktivní složky hypromelózu, žlutý oxid železitý (pouze 8mg tableta), laktózu, stearát hořečnatý, mikrokrystalickou celulózu, předbobtnalý škrob, triacetin a oxid titaničitý.
Každá 4mg ZOFRAN 8mg ODT perorálně se rozpadající tableta pro perorální podání obsahuje 4 mg ondansetronové báze. Každá 8mg ZOFRAN 4mg ODT perorálně se rozpadající tableta pro perorální podání obsahuje 8 mg ondansetronové báze. Každá tableta ZOFRAN ODT obsahuje také neaktivní složky aspartam, želatinu, mannitol, sodnou sůl methylparabenu, sodnou sůl propylparabenu a jahodovou příchuť. Tablety ZOFRAN ODT jsou lyofilizovaná, perorálně podávaná formulace ondansetronu, která se rozpadá na jazyku a nevyžaduje vodu k usnadnění rozpuštění nebo polykání.
Každých 5 ml perorálního roztoku ZOFRAN obsahuje 5 mg dihydrátu ondansetroni hydrochloridum, což odpovídá 4 mg ondansetronu. ZOFRAN 8 mg perorální roztok obsahuje neúčinné složky bezvodou kyselinu citronovou, čištěnou vodu, benzoát sodný, citrát sodný, sorbitol a jahodové aroma.
INDIKACE
ZOFRAN je indikován k prevenci nevolnosti a zvracení spojených s:
- vysoce emetogenní chemoterapie rakoviny, včetně cisplatiny v dávce vyšší nebo rovné 50 mg/m²
- počáteční a opakované cykly středně emetogenní chemoterapie rakoviny
- radioterapii u pacientů, kteří dostávají buď celkové ozáření těla, jednu frakci s vysokou dávkou do břicha nebo denní frakce do břicha
ZOFRAN je také indikován k prevenci pooperační nevolnosti a/nebo zvracení.
DÁVKOVÁNÍ A PODÁVÁNÍ
Dávkování
Doporučené dávkovací režimy pro dospělé a dětské pacienty jsou popsány v tabulce 1 a tabulce 2, v tomto pořadí. Odpovídající dávky tablet ZOFRAN, perorálně se rozpadajících tablet ZOFRAN ODT® a perorálního roztoku ZOFRAN lze používat zaměnitelně.
Dávkování Při Poškození jater
U pacientů s těžkou poruchou funkce jater (Childovo-Pughovo skóre 10 nebo vyšší) nepřekračujte celkovou denní dávku 8 mg (viz Použití u konkrétních populací , KLINICKÁ FARMAKOLOGIE ].
Pokyny pro podávání perorálních tablet ZOFRAN ODT
Nepokoušejte se protlačit tablety ZOFRAN ODT, které se rozpadají v ústech, skrz fólii. Suchýma rukama ODLOUPEJTE fólii na zadní straně 1 blistru a JEMNĚ vyjměte tabletu. OKAMŽITĚ umístěte tabletu ZOFRAN 4 mg ODT na jazyk, kde se během několika sekund rozpustí, a poté spolkněte se slinami. Podání tekutinou není nutné.
JAK DODÁVÁNO
Dávkové formy A Síly
tablety ZOFRAN jsou oválné potahované tablety s vyrytým „Zofran“ na jedné straně a jsou dostupné v následujících silách:
- 4 mg - bílá tableta s vyrytým „4“ na druhé straně.
- 8 mg - žlutá tableta s vyraženým „8“ na druhé straně.
ZOFRAN ODT tablety rozpadající se v ústech jsou bílé, kulaté a plankonvexní tablety dostupné v následujících silách:
- 4 mg – na jedné straně vyraženo „Z4“.
- 8 mg – na jedné straně vyraženo „Z8“.
ZOFRAN 4 mg perorální roztok 4 mg/5 ml, je čirá, bezbarvá až světle žlutá kapalina s charakteristickým jahodovým zápachem dostupná v 50ml lahvičce.
Skladování A Manipulace
Tablety ZOFRAN
4 mg (dihydrát ondansetron hydrochloridu, což odpovídá 4 mg ondansetronu), jsou bílé, oválné, potahované tablety s vyraženým „Zofran“ na jedné straně a „4“ na druhé straně v lahvičkách po 30 tabletách (NDC 0078-0675-15 ).
Skladujte při teplotě 2°C až 30°C (36°F až 86°F). Chraňte před světlem. Dávkujte v těsné, světlo odolné nádobě, jak je definováno v USP.
8 mg (dihydrát ondansetron hydrochloridu, což odpovídá 8 mg ondansetronu), jsou žluté, oválné, potahované tablety s vyrytým „Zofran“ na jedné straně a „8“ na druhé straně v lahvičkách po 30 tabletách (NDC 0078-0676-15 ).
Skladujte při teplotě 2°C až 30°C (36°F až 86°F). Chraňte před světlem. Dávkujte v těsné, světlo odolné nádobě, jak je definováno v USP.
ZOFRAN 8 mg ODT perorálně se rozpadající tablety
4 mg (jako 4 mg báze ondansetronu) jsou bílé, kulaté a plankonvexní tablety s vyraženým „Z4“ na jedné straně v jednodávkových baleních po 30 tabletách (NDC 0078-0679-19).
mg (jako 8 mg báze ondansetronu) jsou bílé, kulaté a plankonvexní tablety s vyraženým „Z8“ na jedné straně v jednodávkových baleních po 30 tabletách (NDC 0078-0680-19).
Skladujte při teplotě 2°C až 30°C (36°F až 86°F).
ZOFRAN 4 mg perorální roztok
čirá, bezbarvá až světle žlutá kapalina s charakteristickým jahodovým zápachem, obsahuje 5 mg dihydrátu ondansetron hydrochloridu, což odpovídá 4 mg ondansetronu na 5 ml v lahvičkách z jantarového skla o objemu 50 ml s dětskými bezpečnostními uzávěry (NDC 0078-0677-22) .
Skladujte ve svislé poloze při teplotě mezi 15 °C a 30 °C (59 °F a 86 °F). Chraňte před světlem. Lahve skladujte nastojato v kartonech.
Distribuce: Novartis Pharmaceuticals Corporation East Hanover, New Jersey 07936. Revize: duben 2021
VEDLEJŠÍ EFEKTY
Následující klinicky významné nežádoucí účinky jsou popsány jinde v označení:
- Hypersenzitivní reakce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Prodloužení QT [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- serotoninový syndrom [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Maskování progresivního ileu a distenze žaludku [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Následující nežádoucí účinky byly hlášeny v klinických studiích u pacientů léčených ondansetronem, účinnou látkou přípravku ZOFRAN. Příčinný vztah k léčbě přípravkem ZOFRAN byl v mnoha případech nejasný.
Prevence nevolnosti a zvracení vyvolané chemoterapií
Nejčastější nežádoucí účinky hlášené u více než nebo rovných 4 % z 300 dospělých, kteří dostávali jednu 24 mg dávku ZOFRAN 4 mg perorálně ve 2 studiích pro prevenci nevolnosti a zvracení spojených s vysoce emetogenní chemoterapií (cisplatina vyšší nebo rovna 50 mg /m²) byly: bolest hlavy (11 %) a průjem (4 %).
Nejčastější nežádoucí účinky hlášené ve 4 studiích u dospělých pro prevenci nevolnosti a zvracení spojených se středně emetogenní chemoterapií (především režimy na bázi cyklofosfamidu) jsou uvedeny v tabulce 3.
Méně časté nežádoucí reakce
Centrální nervový systém
Extrapyramidové reakce (méně než 1 % pacientů).
Jaterní
Hodnoty aspartáttransamináz (AST) a/nebo alanintransamináz (ALT) překročily dvojnásobek horní hranice normálu u přibližně 1 % až 2 % ze 723 pacientů, kteří dostávali ZOFRAN 8 mg a chemoterapii na bázi cyklofosfamidu v klinických studiích v USA. Zvýšení byla přechodná a nezdálo se, že by souvisela s dávkou nebo délkou léčby. Při opakované expozici se v některých cyklech vyskytlo podobné přechodné zvýšení hodnot transamináz, ale symptomatické onemocnění jater se nevyskytlo. Role chemoterapie rakoviny v těchto biochemických změnách je nejasná.
U pacientů s rakovinou, kteří dostávali souběžně léky, včetně potenciálně hepatotoxické cytotoxické chemoterapie a antibiotik, bylo hlášeno selhání jater a úmrtí. Etiologie jaterního selhání je nejasná.
Krycí
Vyrážka (přibližně 1 % pacientů).
Jiné (méně než 2 %)
Anafylaxe, bronchospasmus, tachykardie, angina pectoris, hypokalémie, elektrokardiografické změny, vaskulární okluzivní příhody a záchvaty typu grand mal. Kromě bronchospasmu a anafylaxe je vztah k přípravku ZOFRAN 4 mg nejasný.
Prevence radiace vyvolané nevolnosti a zvracení
Nejčastější nežádoucí účinky (vyšší nebo rovné 2 %) hlášené u pacientů užívajících ZOFRAN a souběžnou radioterapii byly podobné těm, které byly hlášeny u pacientů užívajících ZOFRAN a souběžnou chemoterapii a byly bolesti hlavy, zácpa a průjem.
Prevence pooperační nevolnosti a zvracení
Nejčastější nežádoucí účinky hlášené u dospělých ve studii (studiích) prevence pooperační nevolnosti a zvracení jsou uvedeny v tabulce 4. V těchto studiích pacienti dostávali souběžně několik perioperačních a pooperačních léků v obou léčebných skupinách.
Ve zkřížené studii s 25 subjekty byla bolest hlavy hlášena u 6 subjektů, kterým byla podávána perorální dezintegrační tableta ZOFRAN 8 mg ODT s vodou (24 %) ve srovnání se 2 subjekty, kterým byla podávána perorální dezintegrační tableta ZOFRAN 8 mg ODT bez vody (8 %).
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během užívání ondansetronu po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Kardiovaskulární
Arytmie (včetně ventrikulární a supraventrikulární tachykardie, předčasných komorových kontrakcí a fibrilace síní), bradykardie, elektrokardiografické změny (včetně srdeční blokády druhého stupně, prodloužení QT/QTc intervalu a deprese ST segmentu), palpitace a synkopy. Vzácně a převážně u intravenózního ondansetronu byly hlášeny přechodné změny EKG, včetně prodloužení QT intervalu.
Všeobecné
proplachování
Byly také hlášeny vzácné případy hypersenzitivních reakcí, někdy závažných (např. anafylaktické reakce, angioedém, bronchospasmus, dušnost, hypotenze, laryngeální edém, stridor). Laryngospasmus, šok a kardiopulmonální zástava se objevily během alergických reakcí u pacientů užívajících injekčně ondansetron.
Hepatobiliární
Abnormality jaterních enzymů.
Dolní dýchací
Škytavka.
Neurologie
Okulogyrická krize, objevující se samostatně, stejně jako s jinými dystonickými reakcemi.
Kůže
Urtikarie, Stevens-Johnsonův syndrom a toxická epidermální nekrolýza.
Oční poruchy
Byly hlášeny případy přechodné slepoty, převážně při intravenózním podání. Bylo hlášeno, že tyto případy přechodné slepoty odezněly během několika minut až 48 hodin.
DROGOVÉ INTERAKCE
Serotonergní léky
Serotoninový syndrom (včetně změněného duševního stavu, autonomní nestability a neuromuskulárních příznaků) byl popsán po současném užívání antagonistů 5-HT3 receptorů a dalších serotonergních léků, včetně SSRI a SNRI. Sledujte výskyt serotoninového syndromu. Pokud se objeví příznaky, přerušte ZOFRAN 4 mg a zahajte podpůrnou léčbu (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Léky ovlivňující enzymy cytochromu P-450
Nezdá se, že by ondansetron sám o sobě indukoval nebo inhiboval enzymový systém jater cytochrom P-450 metabolizující léčivo (viz KLINICKÁ FARMAKOLOGIE ]. Protože je ondansetron metabolizován jaterními enzymy metabolizujícími léčivo cytochromu P450 (CYP3A4, CYP2D6, CYP1A2), mohou induktory nebo inhibitory těchto enzymů měnit clearance a tím i poločas ondansetronu. U pacientů léčených silnými induktory CYP3A4 (tj. fenytoinem, karbamazepinem a rifampinem) byla clearance ondansetronu významně zvýšena a koncentrace ondansetronu v krvi byly sníženy. Na základě dostupných údajů se však u pacientů užívajících tyto léky nedoporučuje žádná úprava dávkování přípravku ZOFRAN 8 mg (viz KLINICKÁ FARMAKOLOGIE ].
tramadol
Ačkoli nebyly pozorovány žádné farmakokinetické lékové interakce mezi ondansetronem a tramadolem, údaje ze 2 malých studií naznačují, že při společném použití může ZOFRAN 8 mg zvýšit pacientem kontrolované podávání tramadolu. Při podávání ondansetronu s tramadolem pacienty sledujte, abyste zajistili adekvátní kontrolu bolesti.
Chemoterapie
Karmustin, etoposid a cisplatina neovlivňují farmakokinetiku ondansetronu.
Ve zkřížené studii u 76 pediatrických pacientů nezvyšoval intravenózní ondansetron systémové koncentrace vysokých dávek methotrexátu.
Alfentanil a atrakurium
ZOFRAN 4 mg nemění respirační tlumivé účinky vyvolané alfentanilem ani stupeň nervosvalové blokády způsobené atrakuriem. Interakce s celkovými nebo lokálními anestetiky nebyly studovány.
Zneužívání drog a závislost
Studie na zvířatech ukázaly, že ondansetron není diskriminován jako benzodiazepin, ani nenahrazuje benzodiazepiny ve studiích přímé závislosti.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Hypersenzitivní reakce
Hypersenzitivní reakce, včetně anafylaxe a bronchospasmu, byly hlášeny u pacientů, kteří vykazovali hypersenzitivitu na jiné selektivní antagonisty 5-HT3 receptoru. Pokud se objeví hypersenzitivní reakce, přerušte užívání ZOFRANu; léčit okamžitě podle standardní péče a sledovat, dokud známky a příznaky nevymizí [viz KONTRAINDIKACE ].
Prodloužení QT
pacientů užívajících ondansetron byly pozorovány změny na elektrokardiogramu (EKG), včetně prodloužení QT intervalu. Navíc byly u pacientů užívajících ZOFRAN hlášeny postmarketingové případy Torsade de Pointes. Vyhněte se ZOFRAN 8 mg u pacientů s vrozeným syndromem dlouhého QT intervalu. Monitorování EKG se doporučuje u pacientů s elektrolytovými abnormalitami (např. hypokalémie nebo hypomagnezémie), městnavým srdečním selháním, bradyarytmiemi nebo u pacientů užívajících jiné léčivé přípravky, které vedou k prodloužení QT (viz KLINICKÁ FARMAKOLOGIE ].
serotoninový syndrom
Vývoj serotoninového syndromu byl hlášen u samotných antagonistů 5-HT3 receptoru. Většina hlášení byla spojena se současným užíváním serotonergních léků (např. selektivních inhibitorů zpětného vychytávání serotoninu (SSRI), inhibitorů zpětného vychytávání serotoninu a norepinefrinu (SNRI), inhibitorů monoaminooxidázy, mirtazapinu, fentanylu, lithia, tramadolu a intravenózní methylenové modři). Některé z hlášených případů byly smrtelné. Byl také hlášen serotoninový syndrom vyskytující se při předávkování samotným přípravkem ZOFRAN 4 mg. Většina hlášení serotoninového syndromu souvisejícího s užíváním antagonisty 5-HT3 receptoru se objevila na jednotce poanesteziologické péče nebo v infuzním centru.
Příznaky spojené se serotoninovým syndromem mohou zahrnovat následující kombinaci příznaků a symptomů: změny duševního stavu (např. agitovanost, halucinace, delirium a kóma), autonomní nestabilita (např. tachykardie, labilní krevní tlak, závratě, pocení, návaly horka, hypertermie) neuromuskulární symptomy (např. třes, rigidita, myoklonus, hyperreflexie, nekoordinace), záchvaty, s gastrointestinálními symptomy nebo bez nich (např. nauzea, zvracení, průjem). Pacienti by měli být sledováni pro výskyt serotoninového syndromu, zvláště při současném užívání přípravku ZOFRAN 4 mg a jiných serotoninergních léků. Pokud se objeví příznaky serotoninového syndromu, přerušte léčbu přípravkem ZOFRAN a zahajte podpůrnou léčbu. Pacienti by měli být informováni o zvýšeném riziku serotoninového syndromu, zvláště pokud je ZOFRAN užíván současně s jinými serotonergními léky (viz DROGOVÉ INTERAKCE , PŘEDÁVKOVÁNÍ ].
Maskování Progresivního Ileu A Roztažení žaludku
Použití přípravku ZOFRAN u pacientů po operaci břicha nebo u pacientů s nevolností a zvracením vyvolaným chemoterapií může maskovat progresivní ileus a/nebo žaludeční distenzi. Sledujte sníženou aktivitu střev, zejména u pacientů s rizikovými faktory pro gastrointestinální obstrukci.
ZOFRAN 8 mg není lék, který stimuluje peristaltiku žaludku nebo střev. Neměl by se používat místo nazogastrického odsávání.
Fenylketonurie
Pacienti s fenylketonurií by měli být informováni, že tablety ZOFRAN ODT, které se rozpadají v ústech, obsahují fenylalanin (složka aspartamu). Jedna 4mg a 8mg tableta rozpadající se v ústech obsahuje méně než 0,03 mg fenylalaninu.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogenní účinky nebyly pozorovány ve dvouletých studiích na potkanech a myších s perorálními dávkami ondansetronu až 10 mg/kg denně a 30 mg/kg denně (přibližně 4násobek a 6násobek maximální doporučené perorální dávky 24 mg u člověka za den, na základě tělesného povrchu).
Ondansetron nebyl mutagenní ve standardních testech mutagenity.
Perorální podávání ondansetronu až do 15 mg/kg denně (přibližně 6násobek maximální doporučené perorální dávky pro člověka 24 mg denně, na základě plochy povrchu těla) neovlivnilo fertilitu ani celkovou reprodukční schopnost samců a samic potkanů.
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
Publikované epidemiologické studie o souvislosti mezi užíváním ondansetronu a závažnými vrozenými vadami uvádějí nekonzistentní nálezy a mají významná metodologická omezení, která vylučují závěry o bezpečnosti užívání ondansetronu v těhotenství (viz Data ). Dostupné postmarketingové údaje neidentifikovaly s lékem spojené riziko potratu nebo nepříznivých mateřských výsledků. Reprodukční studie na potkanech a králících neprokázaly známky poškození plodu, když byl ondansetron podáván během organogeneze v přibližně 6násobku a 24násobku maximální doporučené perorální dávky u člověka 24 mg/den na základě plochy povrchu těla (viz Data ).
Základní riziko závažných vrozených vad a potratu u uvedené populace není známo. Všechna těhotenství mají na pozadí riziko vrozených vad, potratů nebo jiných nepříznivých výsledků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratů u klinicky uznaných těhotenství 2 % až 4 % a 15 % až 20 %.
Data
Lidská data
Dostupné údaje o užívání ondansetronu u těhotných žen z několika publikovaných epidemiologických studií vylučují posouzení rizika nepříznivých následků plodu spojeného s užíváním léků kvůli důležitým metodologickým omezením, včetně nejistoty, zda ženy, které vyplnily předpis, skutečně užívaly lék, souběžné užívání jiných léků nebo léčebných postupů, zkreslení vzpomínek a dalších neupravených matoucích faktorů.
Expozice ondansetronu in utero nebyla v souhrnných analýzách spojena s celkovými hlavními vrozenými malformacemi. Jedna velká retrospektivní kohortová studie zkoumala 1970 žen, které dostávaly předpis na ondansetron během těhotenství, a neuváděla žádnou souvislost mezi expozicí ondansetronu a velkými vrozenými malformacemi, potratem, porodem mrtvého plodu, předčasným porodem, kojenci s nízkou porodní hmotností nebo malými dětmi na gestační věk.
Dvě velké retrospektivní kohortové studie a jedna případová kontrolní studie hodnotily expozici ondansetronu v prvním trimestru a riziko kardiovaskulárních defektů s nekonzistentními nálezy. Relativní rizika (RR) se pohybovala od 0,97 (95% CI 0,86 až 1,10) do 1,62 (95% CI 1,04, 2,54). Analýza podskupiny v jedné z kohortových studií pozorovala, že ondansetron byl specificky spojen s defekty srdečního septa (RR 2,05, 95% CI 1,19, 3,28); tato souvislost však nebyla potvrzena v jiných studiích.
Několik studií hodnotilo ondansetron a riziko rozštěpů dutiny ústní s nekonzistentními nálezy. Retrospektivní kohortová studie 1,8 milionu těhotenství v americké databázi Medicaid prokázala zvýšené riziko rozštěpů dutiny ústní u 88 467 těhotenství, u kterých byl perorální ondansetron předepisován v prvním trimestru (RR 1,24, 95% CI 1,03, 1,48), ale žádná taková souvislost nebyla hlášeno s intravenózním ondansetronem u 23 866 těhotenství (RR 0,95, 95% CI 0,63, 1,43). V podskupině žen, které dostávaly obě formy podání, byla RR 1,07 (95% CI 0,59, 1,93). Dvě případové a kontrolní studie využívající data z programů sledování vrozených vad uváděly konfliktní souvislosti mezi užíváním ondansetronu matkou a izolovaným rozštěpem patra (OR 1,6 [95% CI 1,1, 2,3] a 0,5 [95% CI 0,3, 1,0]). Není známo, zda k expozici ondansetronu in utero v případech rozštěpu patra došlo v době tvorby patra (patro se tvoří mezi 6. a 9. týdnem těhotenství).
Údaje o zvířatech
Ve studiích embryofetálního vývoje u potkanů a králíků dostávaly březí zvířata během období organogeneze perorální dávky ondansetronu až 15 mg/kg/den a 30 mg/kg/den. S výjimkou mírného snížení přírůstku tělesné hmotnosti matky u králíků nebyly pozorovány žádné významné účinky ondansetronu na matky nebo vývoj potomstva. Při dávkách 15 mg/kg/den u potkanů a 30 mg/kg/den u králíků byl expoziční limit pro matku přibližně 6 a 24krát vyšší než maximální doporučená perorální dávka u člověka 24 mg/den, v daném pořadí, na základě tělesného povrchu .
Ve studii prenatální a postnatální vývojové toxicity dostávaly březí krysy perorální dávky ondansetronu až 15 mg/kg/den od 17. dne březosti do 21. dne vrhu. S výjimkou mírného snížení přírůstku tělesné hmotnosti matky žádné účinky na březí krysy a pre- a postnatální vývoj jejich potomků, včetně reprodukční výkonnosti spářené generace F1. Při dávce 15 mg/kg/den u potkanů byla expoziční hranice pro matku přibližně 6násobkem maximální doporučené perorální dávky pro člověka 24 mg/den, na základě plochy povrchu těla.
Laktace
Shrnutí rizik
Není známo, zda je ondansetron přítomen v lidském mléce. Neexistují žádné údaje o účincích přípravku ZOFRAN 8 mg na kojené dítě nebo o účincích na tvorbu mléka. Bylo však prokázáno, že ondansetron je přítomen v mléce potkanů. Pokud je lék přítomen ve zvířecím mléce, je pravděpodobné, že lék bude přítomen v lidském mléce.
Vývojové a zdravotní přínosy kojení by měly být zváženy spolu s klinickou potřebou matky ZOFRAN 4 mg a případnými nežádoucími účinky na kojené dítě ze ZOFRANu nebo ze základního stavu matky.
Pediatrické použití
Bezpečnost a účinnost perorálně podávaného ZOFRANu byla stanovena u pediatrických pacientů ve věku 4 let a starších pro prevenci nauzey a zvracení spojených se středně emetogenní chemoterapií rakoviny. Použití přípravku ZOFRAN 4 mg u těchto věkových skupin je podpořeno důkazy z adekvátních a dobře kontrolovaných studií přípravku ZOFRAN u dospělých s dalšími údaji ze 3 otevřených, nekontrolovaných studií mimo USA u 182 dětských pacientů ve věku 4 až 18 let s rakovinou kteří dostávali různé režimy cisplatiny nebo noncisplatiny [viz DÁVKOVÁNÍ A PODÁVÁNÍ , Klinické studie ].
Další informace o použití ondansetronu u pediatrických pacientů lze nalézt v informacích o předepisování přípravku ZOFRAN Injection.
Bezpečnost a účinnost perorálně podávaného přípravku ZOFRAN 4 mg nebyla stanovena u pediatrických pacientů pro:
- prevence nevolnosti a zvracení spojených s vysoce emetogenní chemoterapií rakoviny
- prevence nevolnosti a zvracení spojených s radioterapií
- prevence pooperační nevolnosti a/nebo zvracení
Geriatrické použití
Z celkového počtu subjektů zařazených do pooperačních nevolností a zvracení vyvolaných chemoterapií a zvracením v USA a zahraničí, pro které byly provedeny analýzy podskupin, bylo 938 (19 %) ve věku 65 let a více.
Nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti mezi subjekty ve věku 65 let a staršími a mladšími subjekty. Snížení clearance a zvýšení eliminačního poločasu bylo pozorováno u pacientů starších 75 let ve srovnání s mladšími subjekty (viz KLINICKÁ FARMAKOLOGIE ]. V klinických studiích nebyl dostatečný počet pacientů starších 75 let a starších, aby bylo možné učinit závěry o bezpečnosti nebo účinnosti v této věkové skupině. Jiné hlášené klinické zkušenosti neidentifikovaly rozdíly v odpovědích mezi staršími a mladšími pacienty, ale nelze vyloučit větší citlivost některých starších jedinců. U starších pacientů není nutná úprava dávkování.
Poškození jater
U pacientů s mírnou nebo středně těžkou poruchou funkce jater není nutná žádná úprava dávkování.
U pacientů s těžkou poruchou funkce jater je clearance snížena a zdánlivý distribuční objem je zvýšený, což vede k významnému prodloužení poločasu ondansetronu. Proto nepřekračujte celkovou denní dávku 8 mg u pacientů s těžkou poruchou funkce jater (Child-Pugh skóre 10 nebo vyšší) (viz DÁVKOVÁNÍ A PODÁVÁNÍ , KLINICKÁ FARMAKOLOGIE ].
Renální poškození
pacientů s jakýmkoliv stupněm poškození ledvin (mírné, středně těžké nebo těžké) se nedoporučuje žádná úprava dávkování. Nejsou žádné zkušenosti po prvním dni podávání ondansetronu [viz KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
Pro předávkování ondansetronem neexistuje žádné specifické antidotum. Pacienti by měli být léčeni vhodnou podpůrnou terapií.
Kromě výše uvedených nežádoucích účinků byly v souvislosti s předávkováním ondansetronem popsány následující nežádoucí účinky: „Náhlá slepota“ (amauróza) trvající 2 až 3 minuty plus těžká zácpa se objevila u jednoho pacienta, kterému bylo podáno 72 mg ondansetronu intravenózně v jedné dávce. Hypotenze (a mdloba) se objevila u pacienta, který užíval 48 mg tablety ZOFRAN. Po infuzi 32 mg po dobu pouhých 4 minut byla pozorována vazovagální epizoda s přechodným srdečním blokem druhého stupně. Ve všech případech nežádoucí účinky zcela vymizely.
Po neúmyslném perorálním předávkování ondansetronem (přesahujícím odhadované požití 5 mg na kg) u malých dětí byly hlášeny dětské případy odpovídající serotoninovému syndromu. Hlášené příznaky zahrnovaly somnolenci, agitovanost, tachykardii, tachypnoe, hypertenzi, návaly horka, mydriázu, pocení, myoklonické pohyby, horizontální nystagmus, hyperreflexii a záchvaty. Pacienti vyžadovali podpůrnou péči, v některých případech včetně intubace, s úplným uzdravením bez následků během 1 až 2 dnů.
KONTRAINDIKACE
ZOFRAN je kontraindikován u pacientů:
- je známo, že má přecitlivělost (např. anafylaxe) na ondansetron nebo kteroukoli složku přípravku [viz NEŽÁDOUCÍ REAKCE ]
- při současném podávání apomorfinu kvůli riziku hluboké hypotenze a ztráty vědomí
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Ondansetron je selektivní antagonista 5-HT3 receptoru. I když mechanismus jeho účinku nebyl plně charakterizován, ondansetron není antagonistou dopaminových receptorů. Serotoninové receptory typu 5-HT3 jsou přítomny jak periferně na zakončeních vagových nervů, tak centrálně v chemoreceptorové spouštěcí zóně area postrema. Není jisté, zda je antiemetický účinek ondansetronu zprostředkován centrálně, periferně nebo na obou místech. Zdá se však, že cytotoxická chemoterapie je spojena s uvolňováním serotoninu z enterochromafínových buněk tenkého střeva. U lidí se vylučování kyseliny 5-hydroxyindoloctové (5-HIAA) močí zvyšuje po podání cisplatiny souběžně s nástupem zvracení. Uvolněný serotonin může stimulovat vagové aferenty přes 5-HT3 receptory a iniciovat zvracení.
Farmakodynamika
zdravých jedinců neměla jednorázová intravenózní dávka 0,15 mg/kg ondansetronu žádný účinek na motilitu jícnu, motilitu žaludku, nižší tlak v jícnovém svěrači nebo dobu průchodu tenkým střevem. Bylo prokázáno, že vícedenní podávání ondansetronu zpomaluje tranzit tlustým střevem u zdravých jedinců. Ondansetron nemá žádný vliv na plazmatické koncentrace prolaktinu.
Elektrofyziologie srdce
Prodloužení QTc intervalu bylo studováno ve dvojitě zaslepené, jednorázové intravenózní dávce, placebem a pozitivně kontrolované, zkřížené studii u 58 zdravých subjektů. Maximální průměrný (95% horní mez spolehlivosti) rozdíl v QTcF oproti placebu po korekci na výchozí hodnotu byl 19,5 (21,8) milisekund a 5,6 (7,4) milisekund po 15minutových intravenózních infuzích 32 mg a 8 mg injekce ondansetronu, v daném pořadí. Mezi koncentrací ondansetronu a ΔΔQTcF byl identifikován významný vztah expozice-odpověď. Při použití zjištěného vztahu expozice-odezva mělo 24 mg podaných intravenózní infuzí po dobu 15 minut průměrnou předpokládanou (95% horní predikční interval) ΔΔQTcF 14,0 (16,3) milisekund. Naproti tomu 16 mg podaných intravenózní infuzí po dobu 15 minut za použití stejného modelu mělo průměrnou předpokládanou (95% horní predikční interval) ΔΔQTcF 9,1 (11,2) milisekund. V této studii dávka 8 mg podávaná infuzí po dobu 15 minut neprodloužila QT interval v žádném klinicky významném rozsahu.
Farmakokinetika
Vstřebávání
Ondansetron se vstřebává z gastrointestinálního traktu a podléhá určitému metabolismu prvního průchodu játry. Průměrná biologická dostupnost u zdravých subjektů po podání jedné 8mg tablety je přibližně 56 %.
Systémová expozice ondansetronu se nezvyšuje úměrně dávce. Plocha pod křivkou (AUC) u 16mg tablety byla o 24 % větší, než se předpokládalo u 8mg tablety. To může odrážet určité snížení metabolismu prvního průchodu při vyšších perorálních dávkách.
Účinky jídla
Biologická dostupnost je také mírně zvýšena přítomností potravy.
Rozdělení
Vazba ondansetronu na plazmatické proteiny, měřená in vitro, byla 70 % až 76 % v rozmezí koncentrací 10 až 500 ng/ml. Cirkulující léčivo se také distribuuje do erytrocytů.
Odstranění
Metabolismus A Vylučování
Ondansetron je u lidí extenzivně metabolizován, přičemž přibližně 5 % radioaktivně značené dávky je nalezeno jako mateřská látka z moči. Metabolity jsou pozorovány v moči. Primární metabolickou cestou je hydroxylace na indolovém kruhu následovaná následnou glukuronidovou nebo sulfátovou konjugací.
Studie metabolismu in vitro ukázaly, že ondansetron je substrátem pro lidské jaterní enzymy cytochromu P-450, včetně CYP1A2, CYP2D6 a CYP3A4. Z hlediska celkového obratu ondansetronu hrál převládající roli CYP3A4. Vzhledem k množství metabolických enzymů schopných metabolizovat ondansetron je pravděpodobné, že inhibice nebo ztráta jednoho enzymu (např. genetická deficience CYP2D6) bude kompenzována jinými a může mít za následek malou změnu v celkové rychlosti eliminace ondansetronu.
Ačkoli některé nekonjugované metabolity mají farmakologickou aktivitu, nenacházejí se v plazmě v koncentracích, které pravděpodobně významně přispívají k biologické aktivitě ondansetronu.
Specifické populace
Věk: Geriatrická populace
Snížení clearance a zvýšení eliminačního poločasu je pozorováno u pacientů starších 75 let ve srovnání s mladšími subjekty (viz Použití u konkrétních populací ].
Sex
Rozdíly mezi pohlavími byly prokázány v dispozici ondansetronu podávaného v jedné dávce. Rozsah a rychlost absorpce jsou větší u žen než u mužů. Pomalejší clearance u žen, menší zdánlivý distribuční objem (upravený podle hmotnosti) a vyšší absolutní biologická dostupnost vedly k vyšším plazmatickým koncentracím ondansetronu. Tyto vyšší plazmatické koncentrace lze částečně vysvětlit rozdíly v tělesné hmotnosti mezi muži a ženami. Není známo, zda tyto rozdíly související s pohlavím byly klinicky významné. Podrobnější farmakokinetické informace jsou obsaženy v tabulkách 5 a 6.
Renální poškození
Nepředpokládá se, že by poškození ledvin významně ovlivnilo celkovou clearance ondansetronu, protože renální clearance představuje pouze 5 % celkové clearance. Průměrná plazmatická clearance ondansetronu však byla snížena asi o 50 % u pacientů s těžkou poruchou funkce ledvin (clearance kreatininu nižší než 30 ml/min). Snížení clearance bylo variabilní a nebylo konzistentní se zvýšením poločasu [viz Použití u konkrétních populací ].
Poškození jater
U pacientů s mírnou až středně závažnou poruchou funkce jater je clearance snížena 2krát a průměrný poločas je zvýšen na 11,6 hodin ve srovnání s 5,7 hodinami u zdravých jedinců. U pacientů s těžkou poruchou funkce jater (Childovo-Pughovo skóre 10 nebo vyšší) je clearance snížena 2krát až 3krát a zdánlivý distribuční objem je zvýšen s výsledným prodloužením poločasu na 20 hodin (viz DÁVKOVÁNÍ A PODÁVÁNÍ , Použití u konkrétních populací ].
Studie lékových interakcí
Induktory CYP 3A4
Eliminace ondansetronu může být ovlivněna induktory cytochromu P-450. Ve farmakokinetické studii 16 pacientů s epilepsií, kteří byli chronicky léčeni induktory CYP3A4, karbamazepinem nebo fenytoinem, bylo pozorováno snížení AUC, Cmax a t½ ondansetronu. To vedlo k významnému zvýšení clearance ondansetronu. Toto zvýšení se však nepovažuje za klinicky relevantní [viz DROGOVÉ INTERAKCE ].
Chemoterapeutická činidla
Karmustin, etoposid a cisplatina neovlivňují farmakokinetiku ondansetronu (viz DROGOVÉ INTERAKCE ].
Antacida
Současné podávání antacid nemění absorpci ondansetronu.
Klinické studie
Prevence nevolnosti a zvracení vyvolané chemoterapií
Vysoce emetogenní chemoterapie
Ve 2 randomizovaných, dvojitě zaslepených, monoterapeutických studiích byla jedna 24mg perorální dávka ZOFRANu lepší než relevantní historická kontrola placeba v prevenci nauzey a zvracení spojených s vysoce emetogenní chemoterapií rakoviny, včetně cisplatiny vyšší nebo rovné 50 mg/m². Podávání steroidů bylo z těchto klinických studií vyloučeno. Více než 90 % pacientů, kteří dostávali dávku cisplatiny vyšší nebo rovnou 50 mg/m² v historickém komparátoru s placebem, zaznamenalo zvracení bez antiemetické léčby.
První studie porovnávala perorální dávky ondansetronu 24 mg v jedné dávce, 8 mg každých 8 hodin ve 2 dávkách a 32 mg v jedné dávce u 357 dospělých pacientů s rakovinou, kteří dostávali chemoterapeutické režimy obsahující cisplatinu vyšší nebo rovnou 50 mg/m² . První nebo jedna dávka byla podána 30 minut před chemoterapií. Celkem dokončilo 66 % pacientů ve skupině s ondansetronem 24 mg jednou denně, 55 % ve skupině s ondansetronem 8 mg dvakrát denně a 55 % ve skupině s ondansetronem 32 mg jednou denně 24hodinové zkušební období s 0 epizodami zvracení a bez záchranné antiemetiky, primárním koncovým parametrem účinnosti. Ukázalo se, že každá ze 3 léčebných skupin je statisticky významně lepší než historická kontrola s placebem.
Ve stejné studii 56 % pacientů, kteří dostávali jednorázovou 24mg perorální dávku ondansetronu, nezaznamenalo během 24hodinového zkušebního období žádnou nevolnost, ve srovnání s 36 % pacientů ve skupině s perorálním ondansetronem 8 mg dvakrát denně ( P = 0,001) a 50 % ve skupině s perorálním ondansetronem 32 mg jednou denně. Dávkovací režimy ZOFRAN 8 mg dvakrát denně a 32 mg jednou denně se nedoporučují k prevenci nevolnosti a zvracení spojených s vysoce emetogenní chemoterapií (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Ve druhé studii byla potvrzena účinnost jedné 24mg perorální dávky přípravku ZOFRAN 4 mg pro prevenci nevolnosti a zvracení spojených s vysoce emetogenní chemoterapií rakoviny, včetně cisplatiny v dávce vyšší nebo rovné 50 mg/m².
Středně emetogenní chemoterapie
Randomizovaná, placebem kontrolovaná, dvojitě zaslepená studie byla provedena v USA u 67 pacientů, kteří dostávali režim chemoterapie na bázi cyklofosfamidu obsahující doxorubicin. První 8 mg dávka ZOFRANu 8 mg byla podána 30 minut před zahájením chemoterapie, následná dávka 8 hodin po první dávce, následovaná 8 mg ZOFRANu 8 mg dvakrát denně po dobu 2 dnů po ukončení chemoterapie. byl v prevenci zvracení významně účinnější než placebo. Odpověď na léčbu byla založena na celkovém počtu emetických epizod během 3denního zkušebního období. Výsledky této studie jsou shrnuty v tabulce 7.
Ve dvojitě zaslepené studii v USA u 336 pacientů užívajících režim chemoterapie na bázi cyklofosfamidu obsahující buď metotrexát nebo doxorubicin, byl ZOFRAN 8 mg podávaný dvakrát denně stejně účinný jako ZOFRAN 8 mg podávaný 3krát denně v prevenci nevolnosti a zvracení. ZOFRAN 8 mg třikrát denně není doporučeným režimem pro léčbu středně emetogenní chemoterapie (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Odpověď na léčbu byla založena na celkovém počtu emetických epizod během 3denního zkušebního období. Podrobnosti o studovaných dávkovacích režimech a výsledcích této studie viz Tabulka 8.
Přeléčení
V jednoramenných studiích bylo 148 pacientů léčených chemoterapií na bázi cyklofosfamidu přeléčeno ZOFRANem 8 mg třikrát denně během následné chemoterapie celkem 396 cyklů přeléčení. Žádné emetické epizody se nevyskytly ve 314 (79 %) opakovaných léčebných cyklů a pouze 1 až 2 emetické epizody se vyskytly ve 43 (11 %) opakovaných léčebných cyklech.
Pediatrické zkoušky
Byly provedeny tři otevřené, jednoramenné, non-US studie se 182 pediatrickými pacienty ve věku 4 až 18 let s rakovinou, kterým byly podávány různé režimy cisplatiny nebo noncisplatiny. Počáteční dávka injekčního přípravku ZOFRAN 4 mg se pohybovala v rozmezí od 0,04 do 0,87 mg na kg (celková dávka 2,16 mg až 12 mg), poté následovalo podávání perorálních dávek ZOFRANu 4 mg v rozmezí od 4 do 24 mg denně po dobu 3 dnů. V těchto studiích mělo 58 % ze 170 hodnotitelných pacientů kompletní odpověď (žádné emetické epizody) v den 1. Ve 2 studiích byla míra odpovědi na ZOFRAN 4 mg třikrát denně u pacientů mladších 12 let podobná jako u ZOFRANu 8 mg třikrát denně u pacientů ve věku 12 až 18 let. Prevence zvracení u těchto dětských pacientů byla v podstatě stejná jako u dospělých.
Nevolnost a zvracení vyvolané zářením
Celkové ozáření těla
randomizované, placebem kontrolované, dvojitě zaslepené studii u 20 pacientů bylo 8 mg ZOFRANu podaných 1,5 hodiny před každou frakcí radioterapie po dobu 4 dnů významně účinnější než placebo v prevenci zvracení vyvolaného celkovým ozářením těla. Celkové ozáření těla sestávalo z 11 frakcí (120 cGy na frakci) během 4 dnů, celkem 1 320 cGy. Pacienti dostávali 3 frakce po dobu 3 dnů, poté 2 frakce 4. den.
Jednorázová vysokodávková frakční radioterapie
aktivně kontrolované, dvojitě zaslepené studii u 105 pacientů léčených jednou vysokou dávkou radioterapie (800 až 1 000 cGy) o velikosti předního nebo zadního pole větší nebo rovné 80 cm² do břicha byl ZOFRAN 4 mg významně účinnější než metoklopramid s ohledem na úplnou kontrolu zvracení (0 emetických epizod). Pacienti dostali první dávku ZOFRANu (8 mg) nebo metoklopramidu (10 mg) 1 až 2 hodiny před radioterapií. Pokud byla radioterapie podávána ráno, bylo podáno 8 mg ZOFRAN 8 mg nebo 10 mg metoklopramidu pozdě odpoledne a opakováno před spaním. Pokud byla radioterapie podávána odpoledne, užívali pacienti 8 mg ZOFRANu 4 mg nebo 10 mg metoklopramidu pouze jednou před spaním. Pacienti pokračovali v dávkách perorální medikace třikrát denně po dobu 3 dnů.
Denní frakcionovaná radioterapie
aktivně kontrolované, dvojitě zaslepené studii u 135 pacientů, kteří dostávali 1 až 4týdenní cyklus frakcionované radioterapie (dávky 180 cGy) na poli o velikosti větší nebo rovné 100 cm² do břicha, byl ZOFRAN 4 mg významně účinnější než prochlorperazin, pokud jde o úplnou kontrolu zvracení (0 emetických epizod). Pacienti dostali první dávku ZOFRANu (8 mg) nebo prochlorperazinu (10 mg) 1 až 2 hodiny před první denní radioterapeutickou frakcí s následnými dávkami 8 mg přibližně každých 8 hodin každý den radioterapie.
Pooperační nevolnost a zvracení
Ve 2 placebem kontrolovaných, dvojitě zaslepených studiích (jedna provedená v USA a druhá mimo USA) u 865 žen podstupujících hospitalizační chirurgické zákroky byl ZOFRAN 16 mg v jedné dávce nebo placebo podán jednu hodinu před navozením celkové rovnováhy anestezie (barbiturát, opioid, oxid dusný, neuromuskulární blokáda a doplňkový isofluran nebo enfluran), tablety ZOFRAN byly v prevenci pooperační nevolnosti a zvracení významně účinnější než placebo.
U mužů nebyly provedeny žádné testy.
INFORMACE PRO PACIENTA
Prodloužení QT
Informujte pacienty, že ZOFRAN může způsobit závažné srdeční arytmie, jako je prodloužení QT intervalu. Poučte pacienty, aby okamžitě informovali svého poskytovatele zdravotní péče, pokud zaznamenají změnu srdeční frekvence, pokud se cítí závratě nebo pokud mají synkopální epizodu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Hypersenzitivní reakce
Informujte pacienty, že ZOFRAN 4 mg může způsobit hypersenzitivní reakce, některé tak závažné jako anafylaxe a bronchospasmus. Poučte pacienty, aby okamžitě hlásili jakékoli známky a příznaky reakcí z přecitlivělosti, včetně horečky, zimnice, vyrážky nebo problémů s dýcháním svému poskytovateli zdravotní péče [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Maskování Progresivního Ileu A Roztažení žaludku
Informujte pacienty po operaci břicha nebo pacienty s nevolností a zvracením vyvolaným chemoterapií, že ZOFRAN 4 mg může maskovat známky a příznaky obstrukce střev. Poučte pacienty, aby okamžitě hlásili jakékoli známky nebo příznaky související s potenciální obstrukcí střeva svému poskytovateli zdravotní péče [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Lékové interakce
- Poučte pacienta, aby užívání všech léků, zejména apomorfinu, hlásil svému poskytovateli zdravotní péče. Současné užívání apomorfinu a ZOFRANu může způsobit významný pokles krevního tlaku a ztrátu vědomí.
- Upozorněte pacienty na možnost serotoninového syndromu při současném užívání přípravku ZOFRAN 8 mg a jiné serotonergní látky, jako jsou léky k léčbě deprese a migrény. Informujte pacienty, aby okamžitě vyhledali lékařskou pomoc, pokud se objeví následující příznaky: změny duševního stavu, autonomní nestabilita, neuromuskulární příznaky s gastrointestinálními příznaky nebo bez nich [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Podávání ZOFRAN 4 mg ODT perorálně se rozpadajících tablet
Poučte pacienty, aby vyjímali tablety ZOFRAN 4 mg ODT z blistru až těsně před podáním dávky.
- Nepokoušejte se protlačit ZOFRAN 8mg ODT tablety rozpadající se v ústech přes fólii.
- Suchýma rukama odloupněte zadní fólii z 1 blistru a jemně vyjměte tabletu.
- Okamžitě položte tabletu ZOFRAN ODT na jazyk, kde se během několika sekund rozpustí, a poté spolkněte se slinami.
- Podání tekutinou není nutné.
- Snímatelné ilustrované nálepky jsou nalepeny na krabici produktu, která může být opatřena předpisem, aby bylo zajištěno správné použití a manipulace s produktem.
