Leukeran 2mg, 5mg Chlorambucil Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Leukeran 5 mg a jak se používá?
Leukeran 5 mg je lék na předpis používaný k léčbě příznaků chronické lymfatické (lymfocytární) leukémie a Hodgkinova lymfomu. Leukeran 5 mg lze užívat samostatně nebo s jinými léky.
Leukeran 5 mg patří do třídy léků nazývaných Antineoplastika, Alkylující.
Není známo, zda je Leukeran bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Leukeran?
Leukeran může způsobit závažné nežádoucí účinky, včetně:
- kopřivka,
- potíže s dýcháním,
- otok obličeje, rtů, jazyka nebo hrdla,
- záchvaty,
- neobvyklá hmota nebo hrudka,
- těžké zvracení nebo průjem,
- nový nebo zhoršující se kašel,
- snadná tvorba modřin,
- neobvyklé krvácení (nos, ústa, pochva nebo konečník),
- fialové nebo červené skvrny pod kůží,
- nevolnost,
- bolest v horní části žaludku,
- svědění,
- únava,
- ztráta chuti k jídlu,
- tmavá moč,
- stolice hliněné barvy,
- zežloutnutí kůže nebo očí (žloutenka),
- horečka,
- oteklé dásně,
- bolestivé vředy v ústech,
- bolest při polykání,
- kožní vředy,
- příznaky nachlazení nebo chřipky,
- kašel,
- potíže s dýcháním,
- bolest krku,
- bolest kůže a
- červená nebo fialová kožní vyrážka, která se šíří (zejména v obličeji nebo horní části těla) a způsobuje puchýře a olupování
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Leukeran patří:
- horečka,
- krvácení a
- příznaky chřipky
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Leukeran. Pro více informací se zeptejte svého lékaře nebo lékárníka.
VAROVÁNÍ
LEUKERAN (chlorambucil) může vážně potlačit funkci kostní dřeně. Chlorambucil je karcinogen u lidí. Chlorambucil je pravděpodobně u lidí mutagenní a teratogenní. Chlorambucil způsobuje lidskou neplodnost (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ).
POPIS
LEUKERAN (chlorambucil) byl poprvé syntetizován Everettem et al. Je to bifunkční alkylační činidlo typu dusíkatého yperitu, u kterého bylo zjištěno, že je účinné proti vybraným lidským neoplastickým onemocněním. Chlorambucil je chemicky známý jako kyselina 4-[bis(2-chlorethyl)amino]benzenbutanová a má následující strukturní vzorec:
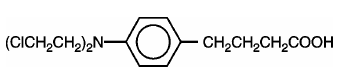
Chlorambucil hydrolyzuje ve vodě a má pKa 5,8.
LEUKERAN (chlorambucil) je dostupný ve formě tablet pro perorální podání. Jedna potahovaná tableta obsahuje 2 mg chlorambucilu a neaktivní složky koloidní oxid křemičitý, hypromelózu, laktózu (bezvodou), makrogol/PEG 400, mikrokrystalickou celulózu, červený oxid železitý, kyselinu stearovou, oxid titaničitý a žlutý oxid železitý.
INDIKACE
LEUKERAN (chlorambucil) je indikován k léčbě chronické lymfatické (lymfocytární) leukémie, maligních lymfomů včetně lymfosarkomu, obřího folikulárního lymfomu a Hodgkinovy choroby. Není léčebný u žádné z těchto poruch, ale může způsobit klinicky užitečnou paliaci.
DÁVKOVÁNÍ A PODÁVÁNÍ
Obvyklá perorální dávka je 0,1 až 0,2 mg/kg tělesné hmotnosti denně po dobu 3 až 6 týdnů podle potřeby. To obvykle činí 4 až 10 mg denně pro průměrného pacienta. Celá denní dávka může být podána najednou. Tyto dávky jsou určeny pro zahájení terapie nebo pro krátké léčebné cykly. Dávkování musí být pečlivě upraveno podle odpovědi pacienta a musí být sníženo, jakmile dojde k náhlému poklesu počtu bílých krvinek. Pacienti s Hodgkinovou chorobou obvykle vyžadují 0,2 mg/kg denně, zatímco pacienti s jinými lymfomy nebo chronickou lymfocytární leukémií obvykle vyžadují pouze 0,1 mg/kg denně. Pokud je přítomna lymfocytární infiltrace kostní dřeně nebo je-li kostní dřeň hypoplastická, neměla by denní dávka překročit 0,1 mg/kg (asi 6 mg pro průměrného pacienta).
Byly hlášeny alternativní režimy léčby chronické lymfocytární leukémie využívající přerušované, dvoutýdenní nebo jednou měsíčně pulzní dávky chlorambucilu. Intermitentní schémata chlorambucilu začínají počáteční jednorázovou dávkou 0,4 mg/kg. Dávky se obecně zvyšují o 0,1 mg/kg, dokud není pozorována kontrola lymfocytózy nebo toxicity. Následné dávky jsou upraveny tak, aby vyvolaly mírnou hematologickou toxicitu. Má se za to, že míra odezvy chronické lymfocytární leukémie na dvoutýdenní nebo jednou měsíční režim podávání chlorambucilu je podobná nebo lepší než dříve hlášená při každodenním podávání a že hematologická toxicita byla menší nebo stejná jako toxicita zjištěná ve studiích s denním podáváním chlorambucilu .
Radiační a cytotoxická léčiva činí kostní dřeň zranitelnější vůči poškození a chlorambucil by měl být používán se zvláštní opatrností do 4 týdnů po úplném průběhu radiační terapie nebo chemoterapie. Malé dávky paliativního záření na izolovaná ložiska vzdálená od kostní dřeně však obvykle nesníží počet neutrofilů a krevních destiček. V těchto případech může být chlorambucil podáván v obvyklé dávce.
současnosti se má za to, že krátké léčebné cykly jsou bezpečnější než kontinuální udržovací terapie, ačkoli obě metody byly účinné. Je třeba si uvědomit, že kontinuální terapie může u pacientů, kteří jsou skutečně v remisi a nepotřebují okamžitě další lék, vyvolat dojem „udržování“. Pokud se používá udržovací dávka, neměla by překročit 0,1 mg/kg denně a může být klidně až 0,03 mg/kg denně. Typická udržovací dávka je 2 mg až 4 mg denně nebo méně, v závislosti na stavu krevního obrazu. Může být proto žádoucí vysadit lék poté, co bylo dosaženo maximální kontroly, protože přerušovaná terapie znovu zahájená v době relapsu může být stejně účinná jako kontinuální léčba.
Měly by být použity postupy pro správnou manipulaci a likvidaci protirakovinných léků. Na toto téma bylo publikováno několik pokynů.1-4 Neexistuje obecná shoda, že všechny postupy doporučené v pokynech jsou nezbytné nebo vhodné.
Zvláštní populace
Poškození jater
Pacienti s poruchou funkce jater by měli být pečlivě sledováni z hlediska toxicity. Protože je chlorambucil primárně metabolizován v játrech, lze u pacientů s poruchou funkce jater při léčbě přípravkem LEUKERAN zvážit snížení dávky. U pacientů s poruchou funkce jater však nejsou k dispozici dostatečné údaje, aby bylo možné poskytnout konkrétní doporučení pro dávkování.
JAK DODÁVÁNO
LEUKERAN je dodáván jako hnědé, potahované, kulaté, bikonvexní tablety obsahující 2 mg chlorambucilu v lahvičkách z jantarového skla s dětským bezpečnostním uzávěrem. Na jedné straně je vyryto „GX EG3“ a na druhé straně je vyryto „L“.
Láhev 25 ( NDC 76388-635-25)
Uchovávejte v chladničce, 2° až 8°C (36° až 46°F).
REFERENCE
1. Upozornění NIOSH: Prevence profesní expozice protinádorovým a jiným nebezpečným lékům ve zdravotnických zařízeních. 2004. Ministerstvo zdravotnictví USA a sociálních služeb, Veřejné zdravotnictví, Centra pro kontrolu a prevenci nemocí, Národní institut pro bezpečnost a ochranu zdraví při práci, publikace DHHS (NIOSH) č. 2004-165.
2. Technická příručka OSHA, TED 1-0.15A, oddíl VI: Kapitola 2. Kontrola pracovní expozice nebezpečným drogám. OSHA, 1999. http://www.osha.gov/dts/osta/otm/otm_vi/otm_vi_2.html
3. Americká společnost lékárníků zdravotnického systému. Pokyny ASHP pro zacházení s nebezpečnými drogami. Am J Health-Syst Pharm. (2006) 63:1172-1193.
4. Polovich, M., White, JM, & Kelleher, LO (eds.) 2005. Pokyny a doporučení pro chemoterapii a bioterapii (2. vyd.) Pittsburgh, PA: Oncology Nursing Society.
Výrobce: Excella GmbH & Co. KG, Feucht, Německo. Revize: březen 2017
VEDLEJŠÍ EFEKTY
Chcete-li nahlásit PODEZŘELNÉ NEŽÁDOUCÍ REAKCE, kontaktujte společnost Aspen Global Inc. Bezplatně na čísle 1-855-800-8165 nebo FDA na čísle 1-800-FDA-1088 nebo www.fda.gov/medwatch.
Hematologické
Nejčastějším nežádoucím účinkem je útlum kostní dřeně, anémie, leukopenie, neutropenie, trombocytopenie nebo pancytopenie. Ačkoli často dochází k útlumu kostní dřeně, je obvykle reverzibilní, pokud je chlorambucil vysazen dostatečně brzy. Bylo však hlášeno nevratné selhání kostní dřeně.
Gastrointestinální
Gastrointestinální poruchy, jako je nauzea a zvracení, průjem a ulcerace v ústech, se vyskytují zřídka.
CNS
Jako vzácné nežádoucí účinky chlorambucilu byly hlášeny třes, svalové záškuby, myoklonie, zmatenost, neklid, ataxie, ochablé parézy a halucinace, které vymizí po vysazení léku. Vzácné, fokální a/nebo generalizované záchvaty byly hlášeny jak u dětí, tak u dospělých při terapeutických denních dávkách a pulzních dávkovacích režimech a při akutním předávkování (viz OPATŘENÍ : Všeobecné ).
Dermatologické
Alergické reakce, jako je kopřivka a angioneurotický edém, byly hlášeny po počáteční nebo následné dávce. Byla hlášena kožní hypersenzitivita (včetně vzácných hlášení kožní vyrážky progredující do erythema multiforme, toxické epidermální nekrolýzy a Stevens-Johnsonova syndromu) (viz VAROVÁNÍ ).
Smíšený
Mezi další hlášené nežádoucí účinky patří: plicní fibróza, hepatotoxicita a žloutenka, léková horečka, periferní neuropatie, intersticiální pneumonie, sterilní cystitida, neplodnost, leukémie a sekundární malignity (viz VAROVÁNÍ ).

DROGOVÉ INTERAKCE
Nejsou známy žádné lékové/lékové interakce s chlorambucilem.
VAROVÁNÍ
Vzhledem ke svým karcinogenním vlastnostem by chlorambucil neměl být podáván pacientům s jinými onemocněními než je chronická lymfatická leukémie nebo maligní lymfomy. Při použití chlorambucilu v terapii maligních a nemaligních onemocnění byly pozorovány křeče, neplodnost, leukémie a sekundární malignity.
Existuje mnoho zpráv o akutní leukémii vzniklé u pacientů s maligními i nemaligními onemocněními po léčbě chlorambucilem. V mnoha případech tito pacienti také dostávali jiná chemoterapeutická činidla nebo nějakou formu radiační terapie. Kvantifikace rizika chlorambucilové indukce leukémie nebo karcinomu u lidí není možná. Vyhodnocení publikovaných zpráv o rozvoji leukémie u pacientů, kteří dostávali chlorambucil (a jiná alkylační činidla) naznačuje, že riziko leukemogeneze se zvyšuje jak s chronickou léčbou, tak s velkými kumulativními dávkami. Ukázalo se však nemožné definovat kumulativní dávku, pod kterou neexistuje riziko indukce sekundární malignity. Potenciální přínosy léčby chlorambucilem musí být individuálně zváženy oproti možnému riziku indukce sekundární malignity.
Bylo prokázáno, že chlorambucil způsobuje poškození chromatid nebo chromozomů u lidí. U obou pohlaví užívajících chlorambucil byla pozorována reverzibilní i trvalá sterilita.
Při podávání chlorambucilu prepubertálním a pubertálním mužům byl dokumentován vysoký výskyt sterility. U dospělých mužů byla také pozorována prodloužená nebo trvalá azoospermie. Zatímco většina zpráv o gonadální dysfunkci sekundární k chlorambucilu se týkala mužů, indukce amenorey u žen alkylačními činidly je dobře zdokumentována a chlorambucil je schopen vyvolat amenoreu. Pitevní studie vaječníků u žen s maligním lymfomem léčených kombinovanou chemoterapií včetně chlorambucilu prokázaly různé stupně fibrózy, vaskulitidy a deplece primordiálních folikulů.
Byly hlášeny vzácné případy kožní vyrážky progredující do erythema multiforme, toxické epidermální nekrolýzy nebo Stevens-Johnsonova syndromu. Chlorambucil by měl být okamžitě přerušen u pacientů, u kterých se objeví kožní reakce.
Těhotenství
Kategorie těhotenství D
Chlorambucil může při podání těhotné ženě způsobit poškození plodu. Jednostranná ageneze ledvin byla pozorována u 2 potomků, jejichž matky dostávaly chlorambucil během prvního trimestru. U plodů potkanů, kterým byl podáván chlorambucil, byly nalezeny urogenitální malformace, včetně absence ledvin. Neexistují žádné adekvátní a dobře kontrolované studie u těhotných žen. Pokud je tento lék užíván během těhotenství nebo pokud pacientka otěhotní během užívání tohoto léku, pacientka by měla být informována o potenciálním riziku pro plod. Ženy ve fertilním věku by měly být poučeny, aby se vyhnuly otěhotnění.
OPATŘENÍ
Všeobecné
mnoha pacientů se během léčby rozvine pomalu progredující lymfopenie. Počet lymfocytů se po ukončení medikamentózní terapie obvykle rychle vrátí k normálním hodnotám. Většina pacientů má určitou neutropenii po třetím týdnu léčby a tato může trvat až 10 dní po poslední dávce. Následně se počet neutrofilů obvykle rychle vrátí k normálu. Zdá se, že těžká neutropenie souvisí s dávkováním a obvykle se vyskytuje pouze u pacientů, kteří dostali celkovou dávku 6,5 mg/kg nebo více v jednom cyklu terapie s kontinuálním dávkováním. Přibližně u jedné čtvrtiny všech pacientů, kteří dostávají kontinuální dávkovací schéma, au jedné třetiny těch, kteří dostávají tuto dávku během 8 týdnů nebo méně, lze očekávat rozvoj těžké neutropenie.
když není nutné vysadit chlorambucil při prvních známkách poklesu počtu neutrofilů, je třeba mít na paměti, že pokles může pokračovat ještě 10 dní po poslední dávce a že jakmile se celková dávka blíží 6,5 mg/kg, riziko nevratného poškození kostní dřeně. Pokud počet leukocytů nebo krevních destiček klesne pod normální hodnoty, dávka chlorambucilu by měla být snížena a léčba by měla být přerušena pro závažnější depresi.
Chlorambucil by měl ne být podávány v plných dávkách před 4 týdny po úplném průběhu radiační terapie nebo chemoterapie kvůli zranitelnosti kostní dřeně vůči poškození za těchto podmínek. Pokud je před zahájením léčby snížen počet leukocytů nebo krevních destiček v důsledku onemocnění kostní dřeně, léčba by měla být zahájena se sníženou dávkou.
Trvale nízký počet neutrofilů a krevních destiček nebo periferní lymfocytóza svědčí pro infiltraci kostní dřeně. Pokud je potvrzeno vyšetřením kostní dřeně, denní dávka chlorambucilu by neměla překročit 0,1 mg/kg. Chlorambucil se zdá být relativně prostý gastrointestinálních vedlejších účinků nebo jiných známek toxicity kromě účinku tlumícího kostní dřeň. U lidí mohou jednotlivé perorální dávky 20 mg nebo více vyvolat nevolnost a zvracení.
Děti s nefrotickým syndromem a pacienti užívající vysoké pulzní dávky chlorambucilu mohou mít zvýšené riziko záchvatů. Jako u každého potenciálně epileptogenního léku je třeba dbát opatrnosti při podávání chlorambucilu pacientům s anamnézou záchvatové poruchy nebo poranění hlavy nebo pacientům, kteří užívají jiné potenciálně epileptogenní léky.
Je třeba se vyhnout podávání živých vakcín pacientům s oslabenou imunitou.
Laboratorní testy
Pacienti musí být pečlivě sledováni, aby během léčby nedošlo k život ohrožujícímu poškození kostní dřeně. Týdenní vyšetření krve by mělo být prováděno za účelem stanovení hladin hemoglobinu, celkového a diferenciálního počtu leukocytů a kvantitativního počtu krevních destiček. Během prvních 3 až 6 týdnů léčby se také doporučuje měřit počet bílých krvinek 3 nebo 4 dny po každém z týdenních kompletních krevních obrazů. Galton et al navrhli, že u sledování pacientů je užitečné vykreslit krevní obraz do grafu ve stejnou dobu, kdy se zaznamenává tělesná hmotnost, teplota, velikost sleziny atd. Je považováno za nebezpečné nechat pacienta během léčby déle než 2 týdny bez hematologického a klinického vyšetření.
Karcinogeneze, mutageneze, zhoršení plodnosti
Vidět VAROVÁNÍ sekce pro informace o karcinogenezi, mutagenezi a poškození plodnosti.
Těhotenství
Teratogenní účinky
Kategorie těhotenství D
Vidět VAROVÁNÍ sekce.
Kojící matky
Není známo, zda se tento lék vylučuje do lidského mléka. Vzhledem k tomu, že mnoho léků se vylučuje do mateřského mléka a vzhledem k potenciálu závažných nežádoucích účinků chlorambucilu u kojených dětí, je třeba rozhodnout, zda přerušit kojení nebo přerušit podávání léku, přičemž je třeba vzít v úvahu důležitost léku pro matku.
Pediatrické použití
Bezpečnost a účinnost u pediatrických pacientů nebyla stanovena.
Geriatrické použití
Klinické studie chlorambucilu nezahrnovaly dostatečný počet subjektů ve věku 65 let a více, aby bylo možné určit, zda reagují odlišně od mladších subjektů. Jiné hlášené klinické zkušenosti nezjistily rozdíly v odpovědích mezi staršími a mladšími pacienty. Obecně by měl být výběr dávky pro staršího pacienta opatrný, obvykle začínající na spodní hranici dávkovacího rozmezí, což odráží vyšší frekvenci snížené funkce jater, ledvin nebo srdce a souběžného onemocnění nebo jiné lékové terapie.
Použití u pacientů s poruchou funkce ledvin
Vliv poruchy funkce ledvin na eliminaci chlorambucilu nebyl formálně studován. Renální eliminace nezměněného chlorambucilu a jeho hlavních aktivních metabolitů, kyseliny fenyloctové, yperitu, představuje méně než 1 % podané dávky. Navíc u 2 dialyzovaných pacientů na chlorambucilu nebyla nutná žádná úprava dávky. Proto se neočekává, že by porucha funkce ledvin významně ovlivnila eliminaci chlorambucilu.
Použití u pacientů s poruchou funkce jater
U pacientů s poruchou funkce jater nebyly provedeny žádné formální studie. Protože je chlorambucil primárně metabolizován v játrech, pacienti s poruchou funkce jater by měli být pečlivě sledováni z hlediska toxicity a u pacientů s poruchou funkce jater při léčbě přípravkem LEUKERAN lze zvážit snížení dávky (viz DÁVKOVÁNÍ A PODÁVÁNÍ ).
PŘEDÁVKOVAT
Hlavním nálezem neúmyslného předávkování chlorambucilem byla reverzibilní pancytopenie. Objevila se také neurologická toxicita od agitovaného chování a ataxie až po mnohočetné záchvaty grand mal. Protože není známo žádné antidotum, je třeba pečlivě sledovat krevní obraz a v případě potřeby zavést obecná podpůrná opatření spolu s vhodnými krevními transfuzemi. Chlorambucil není dialyzovatelný.
Perorální jednotlivé dávky LD50 u myší jsou 123 mg/kg. U potkanů jediná intraperitoneální dávka 12,5 mg/kg chlorambucilu vyvolává typické účinky dusíku a yperitu; mezi ně patří atrofie střevní sliznice a lymfoidních tkání, těžká lymfopenie, která dosáhne maxima za 4 dny, anémie a trombocytopenie. Po této dávce se zvířata začnou zotavovat do 3 dnů a vypadají normálně asi za týden, i když se kostní dřeň nemusí stát úplně normální po dobu asi 3 týdnů. Intraperitoneální dávka 18,5 mg/kg zabije asi 50 % krys s rozvojem křečí. Až 50 mg/kg bylo podáno perorálně krysám v jedné dávce s uzdravením. Taková dávka způsobuje bradykardii, nadměrné slinění, hematurii, křeče a respirační dysfunkci.
KONTRAINDIKACE
Chlorambucil by měl ne být použit u pacientů, jejichž onemocnění prokázalo předchozí rezistenci vůči látce. Pacientům, u kterých byla prokázána přecitlivělost na chlorambucil, by se lék neměl podávat. Mezi chlorambucilem a jinými alkylačními látkami může být zkřížená přecitlivělost (kožní vyrážka).
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Chlorambucil, derivát aromatického dusíkatého yperitu, je alkylační činidlo. Chlorambucil interferuje s replikací DNA a indukuje buněčnou apoptózu prostřednictvím akumulace cytosolického p53 a následné aktivace Bax, promotoru apoptózy.
Farmakokinetika
Ve studii 12 pacientů, kterým byly podávány jednotlivé perorální dávky 0,2 mg/kg LEUKERAN 5 mg, byla průměrná hodnota Cmax chlorambucilu v plazmě upravená na dávku (±SD) 492 ± 160 ng/ml, AUC byla 883 ± 329 ng.h/ml průměrný poločas eliminace (t½) byl 1,3 ± 0,5 hodiny a Tmax byl 0,83 ± 0,53 hodiny. U hlavního metabolitu, hořčice kyseliny fenyloctové (PAAM), byla průměrná plazmatická Cmax upravená na dávku (± SD) 306 ± 73 ng/ml, AUC byla 1204 ± 285 ng.h/ml, průměrný t½ byl 1,8 ± 0,4 hodiny a Tmax byl 1,9 ± 0,7 hodiny.
Po jednotlivých perorálních dávkách 0,6 až 1,2 mg/kg je maximálních plazmatických hladin chlorambucilu (Cmax) dosaženo během 1 hodiny a terminální eliminační poločas (t ) původního léčiva se odhaduje na 1,5 hodiny.
Vstřebávání
Chlorambucil se rychle a úplně (>70 %) vstřebává z gastrointestinálního traktu. V souladu s rychlou, předvídatelnou absorpcí chlorambucilu se ukázalo, že interindividuální variabilita v plazmatické farmakokinetice chlorambucilu je relativně malá po perorálním podání dávek mezi 15 a 70 mg (2násobná intra-pacientská variabilita a 2- až 4násobná variabilita mezi pacienty v AUC). Absorpce chlorambucilu je snížena, pokud se užívá po jídle. Ve studii s deseti pacienty příjem potravy zvýšil medián Tmax dvojnásobně a snížil hodnoty Cmax a AUC upravené na dávku o 55 %, resp. 20 %.
Rozdělení
Zdánlivý distribuční objem byl v průměru 0,31 l/kg po jedné perorální dávce 0,2 mg/kg chlorambucilu u 11 pacientů s rakovinou s chronickou lymfocytární leukémií.
Chlorambucil a jeho metabolity se ve velké míře vážou na plazmatické a tkáňové proteiny. In vitro se chlorambucil z 99 % váže na plazmatické proteiny, konkrétně na albumin. Hladiny chlorambucilu v mozkomíšním moku nebyly stanoveny.
Metabolismus
Chlorambucil je rozsáhle metabolizován v játrech primárně na hořčičnou kyselinu fenyloctovou, která má antineoplastickou aktivitu. Chlorambucil a jeho hlavní metabolit podléhají oxidační degradaci na monohydroxyderiváty a dihydroxyderiváty.
Vylučování
Po jedné dávce radioaktivně značeného chlorambucilu (14C) se přibližně 20 % až 60 % radioaktivity objeví v moči po 24 hodinách. Opět méně než 1 % radioaktivity v moči je ve formě chlorambucilu nebo yperitu kyseliny fenyloctové.
INFORMACE PRO PACIENTA
Pacienti by měli být informováni, že hlavní toxicita chlorambucilu souvisí s přecitlivělostí, horečkou, myelosupresí, hepatotoxicitou, neplodností, záchvaty, gastrointestinální toxicitou a sekundárními malignitami. Pacientům by nikdy nemělo být dovoleno užívat lék bez lékařského dohledu a měli by se poradit se svým lékařem, pokud se u nich objeví kožní vyrážka, krvácení, horečka, žloutenka, přetrvávající kašel, záchvaty, nevolnost, zvracení, amenorea nebo neobvyklé bulky/hmoty. Ženy ve fertilním věku by měly být poučeny, aby se vyhnuly otěhotnění.
