Léčba rakoviny: Nolvadex 10mg, 20mg Tamoxifen Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Nolvadex a jak se používá?
Nolvadex 10 mg je lék na předpis používaný k léčbě příznaků rakoviny prsu. Nolvadex lze užívat samostatně nebo s jinými léky.
Nolvadex 20 mg patří do třídy léků nazývaných antineoplastika, antagonisté estrogenových receptorů.
Není známo, zda je přípravek Nolvadex 20 mg bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Nolvadex 20 mg?
Nolvadex může způsobit závažné nežádoucí účinky, včetně:
- změny vidění,
- bolest očí,
- snadná tvorba modřin nebo krvácení,
- změny nálady,
- otoky kotníků nebo nohou a
- neobvyklá únava
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Nolvadex patří:
- návaly horka,
- proplachování,
- změny menstruačního cyklu,
- nevolnost,
- křeče v nohou,
- břišní křeče,
- bolest kostí,
- bolest svalů,
- kašel,
- otok,
- únava,
- řídnutí vlasů,
- bolest hlavy,
- deprese a
- ztráta sexuální schopnosti/zájmu (u mužů)
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky Nolvadexu. Pro více informací se zeptejte svého lékaře nebo lékárníka.
VAROVÁNÍ
Pro ženy s duktálním karcinomem in situ (DCIS) a ženy s vysokým rizikem rakoviny prsu: Závažné a život ohrožující příhody spojené s přípravkem NOLVADEX (tamoxifen citrát) v nastavení snížení rizika (ženy s vysokým rizikem rakoviny a ženy s DCIS) zahrnují malignity dělohy, mrtvici a plicní embolii. Incidence těchto příhod byla odhadnuta ze studie NSABP P-1 (viz KLINICKÁ FARMAKOLOGIE-Klinické studie – Snížení výskytu rakoviny prsu u vysoce rizikových žen ). Malignity dělohy se skládají jak z endometriálního adenokarcinomu (míra výskytu na 1 000 žen-roků 2,20 pro NOLVADEX (tamoxifen citrát) vs 0,71 pro placebo), tak z děložního sarkomu (míra výskytu na 1 000 žen-roků 0,17 pro NOLVADEX 0,17 pro NOLVADEX (tamoxifen citrát) placebo)*. U cévní mozkové příhody byla míra výskytu na 1 000 žen-roků 1,43 pro NOLVADEX (tamoxifen citrát) oproti 1,00 pro placebo**. U plicní embolie byla četnost výskytu na 1 000 žen-roků 0,75 pro NOLVADEX (tamoxifen citrát) oproti 0,25 pro placebo**.
Některé mrtvice, plicní embolie a zhoubné nádory dělohy byly smrtelné.
Poskytovatelé zdravotní péče by měli diskutovat o potenciálních přínosech oproti potenciálním rizikům těchto závažných příhod s ženami s vysokým rizikem rakoviny prsu a ženami s DCIS, které zvažují NOLVADEX (tamoxifen citrát), aby se snížilo riziko vzniku rakoviny prsu.
Výhody přípravku NOLVADEX (tamoxifen citrát) převažují nad jeho riziky u žen, u kterých již byla diagnostikována rakovina prsu.
REFERENCE
*Aktualizovaná data dlouhodobého sledování (medián délky sledování je 6,9 roku) ze studie NSABP P-1. Vidět VAROVÁNÍ: Účinky na rakovinu dělohy-endometria a sarkom dělohy .
**Viz tabulka 3 níže KLINICKÁ FARMAKOLOGIE-Klinické studie .
POPIS
NOLVADEX® (tamoxifen citrát) Tablety, nesteroidní antiestrogen, jsou určeny k perorálnímu podání. NOLVADEX (tamoxifen citrát) Tablety jsou dostupné jako:
10 mg tablety
Jedna tableta obsahuje 15,2 mg tamoxifeniumcitrátu, což odpovídá 10 mg tamoxifenu.
20 mg tablety
Jedna tableta obsahuje 30,4 mg tamoxifeniumcitrátu, což odpovídá 20 mg tamoxifenu.
Neaktivní složky: vápenatá sůl karboxymethylcelulózy, stearát hořečnatý, mannitol a škrob.
Chemicky je NOLVADEX (tamoxifen citrát) trans-izomer trifenylethylenového derivátu. Chemický název je (Z)2-[4-(1,2-difenyl-1-butenyl)fenoxy]-N,N-dimethylethanamin-2-hydroxy-1,2,3-propantrikarboxylát (1:1). Strukturní a empirické vzorce jsou:
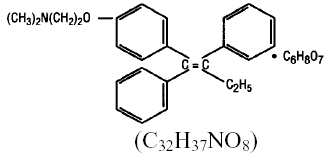
Tamoxifen citrát má molekulovou hmotnost 563,62, pKa' je 8,85, rovnovážná rozpustnost ve vodě při 37 °C je 0,5 mg/ml a v 0,02 N HC1 při 37 °C je 0,2 mg/ml.
INDIKACE
Metastatický karcinom prsu
NOLVADEX (tamoxifen citrát) je účinný při léčbě metastatického karcinomu prsu u žen a mužů. U premenopauzálních žen s metastatickým karcinomem prsu je NOLVADEX (tamoxifen citrát) alternativou k ooforektomii nebo ozáření vaječníků. Dostupné důkazy naznačují, že pacienti, jejichž nádory jsou pozitivní na estrogenové receptory, mají větší pravděpodobnost, že budou mít prospěch z léčby NOLVADEX (tamoxifen citrát).
Adjuvantní léčba rakoviny prsu
NOLVADEX (tamoxifen citrát) je indikován k léčbě rakoviny prsu s pozitivními uzlinami u žen po totální mastektomii nebo segmentální mastektomii, axilární disekci a ozáření prsu. V některých adjuvantních studiích NOLVADEX (tamoxifen citrát) byla většina dosavadního přínosu v podskupině se čtyřmi a více pozitivními axilárními uzlinami.
NOLVADEX (tamoxifen citrát) je indikován k léčbě rakoviny prsu s negativními axilárními uzlinami u žen po totální mastektomii nebo segmentální mastektomii, axilární disekci a ozáření prsu.
Hodnoty estrogenových a progesteronových receptorů mohou pomoci předpovědět, zda bude pravděpodobně přínosná adjuvantní léčba NOLVADEX (tamoxifen citrát).
NOLVADEX (tamoxifen citrát) snižuje výskyt kontralaterálního karcinomu prsu u pacientek, které dostávají adjuvantní léčbu NOLVADEX (tamoxifen citrát) pro karcinom prsu.
Duktální karcinom in situ (DCIS)
žen s DCIS je po operaci prsu a ozařování indikován NOLVADEX (tamoxifen citrát) ke snížení rizika invazivního karcinomu prsu (viz VAROVÁNÍ V KRABICE na začátku štítku). Rozhodnutí týkající se léčby přípravkem NOLVADEX (tamoxifen citrát) pro snížení výskytu rakoviny prsu by mělo být založeno na individuálním posouzení přínosů a rizik léčby přípravkem NOLVADEX (tamoxifen citrát).
Aktuální údaje z klinických studií podporují pětiletou adjuvantní léčbu NOLVADEX (tamoxifen citrát) u pacientek s rakovinou prsu.
Snížení výskytu rakoviny prsu u vysoce rizikových žen
NOLVADEX (tamoxifen citrát) je indikován ke snížení výskytu rakoviny prsu u žen s vysokým rizikem rakoviny prsu. Tento účinek byl prokázán ve studii s plánovanou dobou trvání 5 let s mediánem sledování 4,2 roku. Dvacet pět procent účastníků užívalo drogu po dobu 5 let. Dlouhodobější účinky nejsou známy. V této studii nebyl zjištěn žádný vliv tamoxifenu na celkovou mortalitu nebo mortalitu související s rakovinou prsu (viz VAROVÁNÍ V KRABICE na začátku štítku).
NOLVADEX (tamoxifen citrát) je indikován pouze pro vysoce rizikové ženy. „Vysoké riziko“ je definováno jako ženy ve věku alespoň 35 let s předpokládaným 5letým rizikem rakoviny prsu ≥ 1,67 % podle výpočtu Gail modelu.
Příklady kombinací faktorů předpovídajících 5leté riziko ≥ 1,67 % jsou:
Věk 35 nebo starší a kterýkoli z následujících faktorů:
- Jeden příbuzný prvního stupně s anamnézou rakoviny prsu, 2 nebo více benigních biopsií a biopsií prsu v anamnéze vykazující atypickou hyperplazii; nebo
- Alespoň 2 příbuzní prvního stupně s anamnézou rakoviny prsu a osobní anamnézou alespoň jedné biopsie prsu; nebo
- LCIS
Věk 40 let nebo starší a některá z následujících kombinací faktorů:
- Jeden příbuzný prvního stupně s anamnézou rakoviny prsu, 2 nebo více benigních biopsií, věk při prvním živém narození 25 nebo starší a věk při menarche 11 nebo mladší; nebo
- Nejméně 2 příbuzní prvního stupně s rakovinou prsu v anamnéze a věk při prvním narození živě 19 nebo mladší; nebo
- Jeden příbuzný prvního stupně s anamnézou rakoviny prsu a osobní anamnézou biopsie prsu vykazující atypickou hyperplazii.
Věk 45 nebo více let a některá z následujících kombinací faktorů:
- Nejméně 2 příbuzní prvního stupně s rakovinou prsu v anamnéze a věkem při prvním narození živě 24 nebo mladším; nebo
- Jeden příbuzný prvního stupně s anamnézou rakoviny prsu s osobní anamnézou benigní biopsie prsu, věk v menarche 11 nebo méně a věk při prvním živém narození 20 nebo více.
Věk 50 nebo více let a některá z následujících kombinací faktorů:
- Alespoň 2 příbuzní prvního stupně s anamnézou rakoviny prsu; nebo
- Anamnéza jedné biopsie prsu ukazující atypickou hyperplazii a věk při prvním živém narození 30 nebo více let a věk při menarche 11 nebo méně; nebo
- Anamnéza nejméně dvou biopsií prsu s anamnézou atypické hyperplazie a věk při prvním živém narození 30 nebo více let.
Věk 55 nebo více let a některá z následujících kombinací faktorů:
- Jeden příbuzný prvního stupně s anamnézou rakoviny prsu s osobní anamnézou benigní biopsie prsu a věkem při menarche 11 nebo méně; nebo
- Anamnéza alespoň 2 biopsií prsu s anamnézou atypické hyperplazie a věk prvního živého narození 20 nebo starší.
Věk 60 nebo starší a:
- 5leté předpokládané riziko rakoviny prsu ≥ 1,67 % podle výpočtu Gail modelu.
Pro ženy, jejichž rizikové faktory nejsou popsány ve výše uvedených příkladech, je Gailův model nezbytný k odhadu absolutního rizika rakoviny prsu. Zdravotníci mohou získat nástroj pro hodnocení rizik modelu Gail na čísle 1-800-544-2007.
Nejsou k dispozici dostatečné údaje týkající se účinku přípravku NOLVADEX (tamoxifen citrát) na výskyt rakoviny prsu u žen s dědičnými mutacemi (BRCA1, BRCA2), aby bylo možné učinit konkrétní doporučení ohledně účinnosti přípravku NOLVADEX (tamoxifen citrát) u těchto pacientek.
Po zhodnocení rizika rozvoje karcinomu prsu by mělo být rozhodnutí o léčbě přípravkem NOLVADEX (tamoxifen citrát) pro snížení výskytu karcinomu prsu založeno na individuálním posouzení přínosů a rizik léčby přípravkem NOLVADEX (tamoxifen citrát). Ve studii NSABP P-1 léčba NOLVADEX (tamoxifen citrát) snížila riziko rozvoje rakoviny prsu během následného období studie, ale neodstranila riziko rakoviny prsu (viz tabulka 3 v KLINICKÁ FARMAKOLOGIE ).
DÁVKOVÁNÍ A PODÁVÁNÍ
Pro pacientky s rakovinou prsu je doporučená denní dávka 20-40 mg. Dávky vyšší než 20 mg denně by měly být podávány v rozdělených dávkách (ráno a večer).
Ve třech studiích s adjuvans s jedinou látkou u žen byla jedna 10mg tableta NOLVADEX (tamoxifen citrát) podávána dvakrát (ECOG a NATO) nebo třikrát (Toronto) denně po dobu dvou let. V adjuvantní studii NSABP B-14 u žen s karcinomem prsu s negativními uzlinami byla podávána jedna 10mg tableta NOLVADEX (tamoxifen citrát) dvakrát denně po dobu nejméně 5 let. Výsledky studie B-14 naznačují, že pokračování léčby po pěti letech nepřináší další přínos (viz KLINICKÁ FARMAKOLOGIE ). V přehledu EBCTCG 1995 bylo snížení recidivy a mortality větší ve studiích, které užívaly tamoxifen po dobu asi 5 let, než ve studiích, které užívaly tamoxifen po kratší dobu terapie. Nic nenasvědčovalo tomu, že by dávky vyšší než 20 mg denně byly účinnější. Aktuální údaje z klinických studií podporují 5letou adjuvantní léčbu NOLVADEX (tamoxifen citrát) u pacientek s rakovinou prsu.
Duktální karcinom in situ (DCIS)
Doporučená dávka je NOLVADEX (tamoxifen citrát) 20 mg denně po dobu 5 let.
Snížení výskytu rakoviny prsu u vysoce rizikových žen
Doporučená dávka je NOLVADEX (tamoxifen citrát) 20 mg denně po dobu 5 let. Neexistují žádné údaje, které by podporovaly použití přípravku NOLVADEX (tamoxifen citrát) jinak než po dobu 5 let (viz KLINICKÁ FARMAKOLOGIE-Klinické studie – Snížení výskytu rakoviny prsu u vysoce rizikových žen ).
JAK DODÁVÁNO
10 mg tablety obsahující tamoxifen jako citrát v množství ekvivalentním 10 mg tamoxifenu (kulaté, bikonvexní, nepotahované, bílé tablety označené NOLVADEX (tamoxifen citrát) 600 s vyraženým na jedné straně a kamejí s vyraženým na druhé straně) se dodávají v lahvičkách po 60 tablety. NDC 0310-0600-60.
20 mg tablety obsahující tamoxifen jako citrát v množství ekvivalentním 20 mg tamoxifenu (kulaté, bikonvexní, nepotahované, bílé tablety označené NOLVADEX (tamoxifen citrát) 604 s vyraženým na jedné straně a kamejí s vyraženým na druhé straně) se dodávají v lahvičkách po 30 tablety. NDC 0310-0604-30.
Skladujte při kontrolované pokojové teplotě, 20-25 °C (68-77 °F) [viz USP]. Dávkujte v dobře uzavřené nádobě odolné proti světlu.
*Coumadin® je registrovaná ochranná známka společnosti Bristol-Myers Squibb Pharmaceuticals. Všechny ostatní ochranné známky jsou majetkem skupiny AstraZeneca, AstraZeneca Pharmaceuticals LP Wilmington, Delaware 19850-5437. Rev 09-27-05. Datum revize FDA: 3/9/2006
VEDLEJŠÍ EFEKTY
Nežádoucí reakce na NOLVADEX (tamoxifen citrát) jsou relativně mírné a zřídka natolik závažné, že vyžadují přerušení léčby u pacientek s rakovinou prsu.
Pokračující klinické studie vedly k dalším informacím, které lépe naznačují výskyt nežádoucích účinků u přípravku NOLVADEX (tamoxifen citrát) ve srovnání s placebem.
Metastatický karcinom prsu
Objevila se zvýšená bolest kostí a nádorů a také místní vzplanutí onemocnění, které jsou někdy spojeny s dobrou odpovědí nádoru. Pacienti se zvýšenou bolestí kostí mohou vyžadovat další analgetika. U pacientů s onemocněním měkkých tkání může dojít k náhlému nárůstu velikosti již existujících lézí, někdy spojeným s výrazným erytémem uvnitř a kolem lézí a/nebo rozvojem nových lézí. Když se vyskytnou, bolest kostí nebo vzplanutí onemocnění jsou pozorovány krátce po zahájení léčby přípravkem NOLVADEX (tamoxifen citrát) a obecně rychle odezní.
U pacientek léčených přípravkem NOLVADEX (tamoxifen citrát) pro metastatický karcinom prsu jsou nejčastější nežádoucí reakcí na přípravek NOLVADEX (tamoxifen citrát) návaly horka.
Další nežádoucí účinky, které jsou pozorovány zřídka, jsou hyperkalcémie, periferní edém, nechuť k jídlu, pruritus vulvae, deprese, závratě, točení hlavy, bolest hlavy, řídnutí vlasů a/nebo částečná ztráta vlasů a vaginální suchost.
Ženy před menopauzou
Následující tabulka shrnuje výskyt nežádoucích účinků hlášených s frekvencí 2 % nebo vyšší z klinických studií (Ingle, Pritchard, Buchanan), které porovnávaly léčbu přípravkem NOLVADEX (tamoxifen citrát) s ablací vaječníků u premenopauzálních pacientek s metastatickým karcinomem prsu.
Mužská rakovina prsu
NOLVADEX (tamoxifen citrát) je dobře snášen u mužů s rakovinou prsu. Zprávy z literatury a kazuistiky naznačují, že bezpečnostní profil přípravku NOLVADEX (tamoxifen citrát) u mužů je podobný jako u žen. Ztráta libida a impotence vedly k přerušení léčby tamoxifenem u mužských pacientů. Také u oligospermických samců léčených tamoxifenem byly zvýšené hladiny LH, FSH, testosteronu a estrogenu. Nebyly hlášeny žádné významné klinické změny.
Adjuvantní rakovina prsu
Ve studii NSABP B-14 byly ženy s karcinomem prsu s negativními axilárními uzlinami randomizovány k 5leté léčbě NOLVADEXem (tamoxifen citrát) 20 mg/den nebo placebem po primární operaci. Hlášené nežádoucí účinky jsou uvedeny v tabulce níže (průměrná doba sledování přibližně 6,8 let), které ukazují nežádoucí účinky častější u přípravku NOLVADEX (tamoxifen citrát) než u placeba. Výskyt návalů horka (64 % vs. 48 %), vaginálního výtoku (30 % vs. 15 %) a nepravidelné menstruace (25 % vs. 19 %) byl vyšší u přípravku NOLVADEX (tamoxifen citrát) ve srovnání s placebem. Všechny ostatní nežádoucí účinky se vyskytly s podobnou frekvencí ve 2 léčebných skupinách, s výjimkou trombotických příhod; vyšší incidence byla pozorována u pacientů léčených přípravkem NOLVADEX (tamoxifen citrát) (po dobu 5 let, 1,7 % vs. 0,4 %). Dva z pacientů léčených přípravkem NOLVADEX (tamoxifen citrát), kteří měli trombotické příhody, zemřeli.
Ve studii Eastern Cooperative Oncology Group (ECOG) adjuvantní rakoviny prsu byl ženám po mastektomii podáván NOLVADEX (tamoxifen citrát) nebo placebo po dobu 2 let. Ve srovnání s placebem vykazoval NOLVADEX (tamoxifen citrát) významně vyšší výskyt návalů horka (19 % vs. 8 % u placeba). Výskyt všech ostatních nežádoucích účinků byl podobný ve 2 léčebných skupinách s výjimkou trombocytopenie, kde incidence pro NOLVADEX (tamoxifen citrát) byla 10 % vs. 3 % pro placebo, pozorování hraniční statistické významnosti.
jiných adjuvantních studiích, Toronto a NOLVADEX (tamoxifen citrát) Adjuvant Trial Organization (NATO), ženy dostávaly buď NOLVADEX (tamoxifen citrát), nebo žádnou terapii. Ve studii v Torontu byly návaly horka pozorovány u 29 % pacientů pro NOLVADEX (tamoxifen citrát) oproti 1 % v neléčené skupině. Ve studii NATO byly návaly horka a vaginální krvácení hlášeny u 2,8 % a 2,0 % žen, v daném pořadí, pro NOLVADEX (tamoxifen citrát) oproti 0,2 % pro každou v neléčené skupině.
Anastrozolová adjuvantní studie – studie anastrozolu ve srovnání s NOLVADEX (tamoxifen citrát) pro adjuvantní léčbu časného karcinomu prsu (vidět KLINICKÁ FARMAKOLOGIE - Klinické studie).
Při střední době sledování 33 měsíců neprokázala kombinace anastrozolu a NOLVADEXu (tamoxifen citrát) žádný přínos z hlediska účinnosti ve srovnání s terapií NOLVADEX (tamoxifen citrát) podávanou samostatně u všech pacientek, stejně jako u subpopulace pozitivní na hormonální receptory. Tato léčebná větev byla ze studie vyřazena. Medián trvání adjuvantní léčby pro hodnocení bezpečnosti byl 59,8 měsíce a 59,6 měsíce u pacientek užívajících anastrozol 1 mg a NOLVADEX (tamoxifen citrát) 20 mg, v daném pořadí.
Nežádoucí účinky vyskytující se s incidencí alespoň 5 % v obou léčebných skupinách během léčby nebo do 14 dnů po ukončení léčby jsou uvedeny v následující tabulce.
Nežádoucí účinky vyskytující se s incidencí alespoň 5 % v kterékoli z léčebných skupin během léčby nebo do 14 dnů po ukončení léčby
Některé nežádoucí účinky a kombinace nežádoucích účinků byly prospektivně specifikovány pro analýzu na základě známých farmakologických vlastností a profilů vedlejších účinků těchto dvou léčiv (viz následující tabulka).
Počet (%) pacientů s předem specifikovanou nežádoucí příhodou ve studii s adjuvans anastrozolem1
U pacientů užívajících anastrozol došlo ke zvýšení poruch kloubů (včetně artritidy, artrózy a artralgie) ve srovnání s pacientkami užívajícími NOLVADEX (tamoxifen citrát). U pacientek užívajících anastrozol se zvýšila incidence všech zlomenin (konkrétně zlomenin páteře, kyčle a zápěstí) [315 (10 %)] ve srovnání s pacientkami užívajícími NOLVADEX (tamoxifen citrát) [209 (7 %)]. U pacientek užívajících anastrozol došlo ke snížení návalů horka, vaginálního krvácení, vaginálního výtoku, rakoviny endometria, žilních tromboembolických příhod a ischemických cerebrovaskulárních příhod ve srovnání s pacientkami užívajícími NOLVADEX (tamoxifen citrát).
pacientů užívajících NOLVADEX (tamoxifen citrát) došlo ke snížení hypercholesterolémie (108 [3,5 %]) ve srovnání s pacientkami užívajícími anastrozol (278 [9 %]). Angina pectoris byla hlášena u 71 [2,3 %] pacientek v rameni s anastrozolem a 51 [1,6 %] pacientek v rameni NOLVADEX (tamoxifen citrát); infarkt myokardu byl hlášen u 37 [1,2 %] pacientek v rameni s anastrozolem a u 34 [1,1 %] pacientek v rameni NOLVADEX (tamoxifen citrát).
Výsledky z adjuvantní studie kostní podstudie ve 12. a 24. měsíci prokázaly, že pacientky užívající anastrozol měly průměrný pokles jak v bederní páteři, tak v celkové minerální hustotě kyčle (BMD) ve srovnání s výchozí hodnotou. Pacienti, kteří dostávali NOLVADEX (tamoxifen citrát), měli průměrné zvýšení BMD bederní páteře a celkové kyčle ve srovnání s výchozí hodnotou.
Duktální karcinom in situ (DCIS)
Typ a frekvence nežádoucích účinků ve studii NSABP B-24 byly v souladu s těmi, které byly pozorovány v jiných adjuvantních studiích prováděných s NOLVADEX (tamoxifen citrát).
Snížení výskytu rakoviny prsu u vysoce rizikových žen
Ve studii NSABP P-1 Trial došlo ke zvýšení pěti závažných nežádoucích účinků ve skupině NOLVADEX (tamoxifen citrát): karcinom endometria (33 případů ve skupině NOLVADEX (tamoxifen citrát) vs. 14 ve skupině s placebem); plicní embolie (18 případů ve skupině NOLVADEX (tamoxifen citrát) vs. 6 ve skupině s placebem); hluboká žilní trombóza (30 případů ve skupině NOLVADEX (tamoxifen citrát) vs. 19 ve skupině s placebem); mrtvice (34 případů ve skupině NOLVADEX (tamoxifen citrát) vs. 24 ve skupině s placebem); vznik šedého zákalu (540 případů ve skupině NOLVADEX (tamoxifen citrát) oproti 483 ve skupině s placebem) a operace katarakty (101 případů ve skupině NOLVADEX (tamoxifen citrát) oproti 63 ve skupině s placebem) (viz. VAROVÁNÍ a tabulka 3 in KLINICKÁ FARMAKOLOGIE ).
Následující tabulka uvádí nežádoucí účinky pozorované u NSABP P-1 v léčebném rameni. Jsou uvedeny pouze nežádoucí účinky častější na NOLVADEX (tamoxifen citrát) než na placebu.
Ve studii NSABP P-1 ze studie ze zdravotních důvodů odstoupilo 15,0 % a 9,7 % účastníků užívajících NOLVADEX (tamoxifen citrát) a placebo. Níže jsou uvedeny zdravotní důvody pro ukončení léčby přípravkem NOLVADEX (tamoxifen citrát) a placeba: návaly horka (3,1 % vs. 1,5 %) a vaginální výtok (0,5 % vs. 0,1 %).
Ve studii NSABP P-1 8,7 % a 9,6 % účastníků užívajících NOLVADEX (tamoxifen citrát) a placebo léčbu ukončilo z nelékařských důvodů.
Ve studii NSABP P-1 se návaly horka jakékoli závažnosti vyskytly u 68 % žen na placebu a u 80 % žen na NOLVADEX (tamoxifen citrát). Závažné návaly horka se objevily u 28 % žen na placebu a u 45 % žen na NOLVADEX (tamoxifen citrát). Vaginální výtok se objevil u 35 % a 55 % žen užívajících placebo a NOLVADEX (tamoxifen citrát); a byla závažná u 4,5 %, resp. 12,3 %. Mezi léčebnými rameny nebyl žádný rozdíl ve výskytu vaginálního krvácení.
Pediatričtí pacienti – McCune-Albrightův syndrom
Průměrný objem dělohy se zvýšil po 6 měsících léčby a zdvojnásobil se na konci jednoleté studie. Nebyla prokázána příčinná souvislost; nicméně, protože u dospělých léčených přípravkem NOLVADEX byl zaznamenán zvýšený výskyt adenokarcinomu endometria a sarkomu dělohy (viz VAROVÁNÍ V KRABICE ), doporučuje se pokračující sledování pacientů s McCune-Albrightovou léčených přípravkem NOLVADEX (tamoxifen citrát) pro dlouhodobé účinky. Bezpečnost a účinnost přípravku NOLVADEX (tamoxifen citrát) u dívek ve věku od 2 do 10 let s McCune-Albrightovým syndromem a předčasnou pubertou nebyla studována déle než jeden rok léčby. Dlouhodobé účinky léčby přípravkem NOLVADEX (tamoxifen citrát) u dívek nebyly stanoveny.
Postmarketingové zkušenosti
Méně často hlášenými nežádoucími účinky jsou vaginální krvácení, vaginální výtok, menstruační nepravidelnosti, kožní vyrážka a bolesti hlavy. Obvykle nebyly dostatečně závažné, aby vyžadovaly snížení dávky nebo přerušení léčby. Při léčbě přípravkem NOLVADEX (tamoxifen citrát) byly hlášeny velmi vzácné zprávy o erythema multiforme, Stevens-Johnsonově syndromu, bulózním pemfigoidu, intersticiální pneumonitidě a vzácné zprávy o reakcích z přecitlivělosti včetně angioedému. V některých z těchto případů byla doba do nástupu delší než jeden rok. Vzácně může být zvýšení sérových hladin triglyceridů, v některých případech s pankreatitidou, spojeno s použitím přípravku NOLVADEX (tamoxifen citrát) (viz BEZPEČNOSTNÍ OPATŘENÍ- Interakce s lékovými/laboratorními testy sekce).
DROGOVÉ INTERAKCE
Při použití přípravku NOLVADEX (tamoxifen citrát) v kombinaci s antikoagulancii kumarinového typu může dojít k významnému zvýšení antikoagulačního účinku. Pokud takové současné podávání existuje, doporučuje se pečlivé sledování protrombinového času pacienta.
Ve studii NSABP P-1 nebyly ženy, které z jakéhokoli důvodu vyžadovaly antikoagulancia kumarinového typu, způsobilé k účasti ve studii (viz KONTRAINDIKACE ).
Při použití cytotoxických látek v kombinaci s přípravkem NOLVADEX (tamoxifen citrát) existuje zvýšené riziko tromboembolických příhod.
Tamoxifen snížil plazmatické koncentrace letrozolu o 37 %. Účinek tamoxifenu na metabolismus a vylučování jiných antineoplastických léků, jako je cyklofosfamid a další léky, které pro aktivaci vyžadují oxidázy se smíšenou funkcí, není znám. Bylo prokázáno, že plazmatické koncentrace tamoxifenu a N-desmethyltamoxifenu jsou sníženy při současném podávání s rifampinem nebo aminoglutethimidem. Indukce metabolismu zprostředkovaného CYP3A4 se považuje za mechanismus, kterým k těmto snížením dochází; jiné látky indukující CYP3A4 nebyly pro potvrzení tohoto účinku studovány.
Jeden pacient užívající NOLVADEX (tamoxifen citrát) se současným fenobarbitalem vykazoval sérovou hladinu tamoxifenu v ustáleném stavu nižší než u ostatních pacientů (tj. 26 ng/ml vs. průměrná hodnota 122 ng/ml). Klinický význam tohoto nálezu však není znám. Rifampin indukoval metabolismus tamoxifenu a významně snížil plazmatické koncentrace tamoxifenu u 10 pacientů. Aminoglutethimid snižuje plazmatické koncentrace tamoxifenu a N-desmethyltamoxifenu. Medroxyprogesteron snižuje plazmatické koncentrace N-desmethylu, ale ne tamoxifenu.
Bylo prokázáno, že současná léčba bromokriptinem zvyšuje sérový tamoxifen a N-desmethyltamoxifen.
Na základě klinických a farmakokinetických výsledků z adjuvantní studie s anastrozolem by NOLVADEX (tamoxifen citrát) neměl být podáván s anastrozolem (viz KLINICKÁ FARMAKOLOGIE - Lékové interakce sekce).
Interakce drog/laboratorní testování
Během postmarketingového sledování bylo u několika postmenopauzálních pacientek hlášeno zvýšení T4, které lze vysvětlit zvýšením globulinu vázajícího štítnou žlázu. Tato zvýšení nebyla doprovázena klinickou hypertyreózou.
U postmenopauzálních pacientek, kterým byl podáván NOLVADEX (tamoxifen citrát), byly vzácně pozorovány variace v karyopyknotickém indexu na vaginálních nátěrech a různé stupně estrogenního účinku na Pap nátěry.
Po uvedení přípravku NOLVADEX (tamoxifen citrát) na trh byly hlášeny vzácné případy hyperlipidemií. U pacientů s již existující hyperlipidemií může být indikováno pravidelné monitorování plazmatických triglyceridů a cholesterolu (viz NEŽÁDOUCÍ REAKCE – Postmarketingová zkušenost sekce).
VAROVÁNÍ
Účinky u pacientů s metastatickým karcinomem prsu
Stejně jako u jiné aditivní hormonální terapie (estrogeny a androgeny) byla u některých pacientek s rakovinou prsu s kostními metastázami během několika týdnů po zahájení léčby přípravkem NOLVADEX (tamoxifen citrát) hlášena hyperkalcémie. Pokud dojde k hyperkalcémii, je třeba přijmout vhodná opatření a pokud je závažná, je třeba přerušit podávání přípravku NOLVADEX (tamoxifen citrát).
Účinky na rakovinu dělohy a endometria a sarkom dělohy
souvislosti s léčbou NOLVADEX (tamoxifen citrát) byl hlášen zvýšený výskyt malignit dělohy. Základní mechanismus není znám, ale může souviset s estrogenním účinkem přípravku NOLVADEX (tamoxifen citrát). Většina děložních malignit pozorovaných ve spojení s NOLVADEX (tamoxifen citrát) je klasifikována jako adenokarcinom endometria. Byly však hlášeny i vzácné děložní sarkomy, včetně maligních smíšených mulleriánských tumorů (MMMT). Sarkom dělohy je obecně spojen s vyšším stadiu FIGO (III/IV) při diagnóze, horší prognózou a kratším přežitím. Byl hlášen výskyt sarkomu dělohy častěji u dlouhodobých uživatelek (≥ 2 roky) přípravku NOLVADEX (tamoxifen citrát) než u žen, které neužívaly. Některé z děložních malignit (karcinom endometria nebo sarkom dělohy) byly fatální.
Ve studii NSABP P-1 došlo mezi účastnicemi randomizovanými na NOLVADEX (tamoxifen citrát) ke statisticky významnému zvýšení výskytu rakoviny endometria (33 případů invazivní rakoviny endometria ve srovnání se 14 případy mezi účastnicemi randomizovanými na placebo (RR=2,48 , 95% CI: 1,27-4,92). 33 případů u účastníků užívajících NOLVADEX (tamoxifen citrát) bylo FIGO stadium I, včetně 20 IA, 12 IB a 1 IC endometriálních adenokarcinomů. U účastníků randomizovaných k placebu bylo 13 FIGO stadium I (8 IA a 5 IB) a 1 bylo stadium IV FIGO. Pět žen užívajících NOLVADEX (tamoxifen citrát) a 1 placebo dostávalo kromě chirurgického zákroku pooperační radiační terapii. Tento nárůst byl primárně pozorován u žen ve věku alespoň 50 let čas randomizace (26 případů invazivního karcinomu endometria ve srovnání se 6 případy mezi účastnicemi randomizovanými na placebo (RR=4,50, 95% CI: 1,78-13,16). Mezi ženami ve věku ≤ 49 let v době randomizace bylo 7 případů z i nvazivní karcinom endometria ve srovnání s 8 případy mezi účastnicemi randomizovanými na placebo (RR=0,94, 95% CI: 0,28-2,89). Pokud se vezme v úvahu věk v době diagnózy, vyskytly se 4 případy karcinomu endometria mezi účastnicemi ≤ 49 randomizovaných na NOLVADEX (tamoxifen citrát) ve srovnání se 2 mezi účastnicemi randomizovanými na placebo (RR=2,21, 95% CI: 0,4-12,0). U žen ≥ 50 let v době diagnózy bylo 29 případů mezi účastnicemi randomizovanými na NOLVADEX (tamoxifen citrát) ve srovnání s 12 mezi ženami na placebu (RR=2,5, 95% CI: 1,3-4,9). Poměry rizika byly v obou skupinách podobné, i když méně příhod se vyskytlo u mladších žen. Většina (29 z 33 případů ve skupině NOLVADEX (tamoxifen citrát)) karcinomů endometria byla diagnostikována u symptomatických žen, ačkoli 5 z 33 případů ve skupině NOLVADEX (tamoxifen citrát) se vyskytlo u asymptomatických žen. U žen užívajících NOLVADEX (tamoxifen citrát) se příhody objevily mezi 1 a 61 měsíci (průměr = 32 měsíců) od začátku léčby.
aktualizovaném přehledu dlouhodobých dat (medián délky celkového sledování je 6,9 roku, včetně zaslepeného sledování) u 8 306 žen s intaktní dělohou při randomizaci ve studii snížení rizika NSABP P-1 je výskyt obou adenokarcinomy a vzácné děložní sarkomy byly zvýšeny u žen užívajících NOLVADEX (tamoxifen citrát). Během zaslepeného sledování se vyskytlo 36 případů FIGO stádia I adenokarcinomu endometria (22 bylo FIGO stádium IA, 13 IB a 1 IC) u žen užívajících NOLVADEX (tamoxifen citrát) a 15 případů u žen dostávajících placebo [14 bylo FIGO stádium I (9 IA a 5 IB) a 1 případ byl FIGO stadium IV]. Z pacientek užívajících NOLVADEX (tamoxifen citrát), u kterých se rozvinul karcinom endometria, jedna s rakovinou stadia IA a 4 s rakovinou stadia IB podstoupila radiační terapii. Ve skupině s placebem jeden pacient s karcinomem FIGO stadia 1B dostával radiační terapii a pacient s karcinomem FIGO stadia IVB dostával chemoterapii a hormonální terapii. Během celkového sledování byl adenokarcinom endometria hlášen u 53 žen randomizovaných do NOLVADEX (tamoxifen citrát) (30 případů FIGO stadium IA, 20 bylo stadium IB, 1 bylo stadium IC a 2 byly stadium IIIC) a 17 žen randomizovaných do placebo (9 případů bylo FIGO stádium IA, 6 bylo stádium IB, 1 stádium IIIC a 1 stádium IVB) (výskyt na 1000 žen-roků 2,20 a 0,71, v tomto pořadí). Někteří pacienti podstoupili pooperační radiační terapii kromě chirurgického zákroku. Uterinní sarkomy byly hlášeny u 4 žen randomizovaných do NOLVADEX (tamoxifen citrát) (1 byla FIGO IA, 1 byla FIGO IB, 1 byla FIGO IIA a 1 byla FIGO IIIC) a jedné pacientky randomizované k placebu (FIGO 1A); incidence na 1000 žen-roků 0,17 a 0,04, v uvedeném pořadí. Z pacientů randomizovaných na NOLVADEX (tamoxifen citrát) byly případy FIGO IA a IB MMMT a sarkom; FIGO II byl MMMT; a FIGO III byl sarkom; a jeden pacient randomizovaný na placebo měl MMMT. Podobný zvýšený výskyt adenokarcinomu endometria a sarkomu dělohy byl pozorován u žen užívajících NOLVADEX (tamoxifen citrát) v pěti dalších klinických studiích NSABP.
Každá pacientka, která dostává nebo již dříve dostávala NOLVADEX (tamoxifen citrát), která hlásí abnormální vaginální krvácení, by měla být okamžitě vyšetřena. Pacientky, které dostávají nebo již dříve dostávaly NOLVADEX (tamoxifen citrát), by měly podstupovat každoroční gynekologické prohlídky a měly by neprodleně informovat své lékaře, pokud zaznamenají jakékoli abnormální gynekologické příznaky, např. nepravidelnosti menstruace, abnormální vaginální krvácení, změny vaginálního výtoku nebo bolesti pánve nebo tlak.
Ve studii P-1 nezměnil odběr endometria míru detekce karcinomu endometria ve srovnání s ženami, které nepodstoupily odběr endometria (0,6 % s odběrem, 0,5 % bez odběru) u žen s intaktní dělohou. Neexistují žádné údaje, které by naznačovaly, že rutinní odběr vzorků endometria u asymptomatických žen užívajících NOLVADEX (tamoxifen citrát) ke snížení výskytu rakoviny prsu by byl prospěšný.
Nezhoubné účinky na dělohu
souvislosti s léčbou NOLVADEX (tamoxifen citrát) byl hlášen zvýšený výskyt změn endometria včetně hyperplazie a polypů. Výskyt a vzorec tohoto zvýšení naznačují, že základní mechanismus souvisí s estrogenními vlastnostmi přípravku NOLVADEX (tamoxifen citrát).
Bylo hlášeno několik zpráv o endometrióze a děložních myomech u žen užívajících NOLVADEX (tamoxifen citrát). Základní mechanismus může být způsoben částečným estrogenním účinkem přípravku NOLVADEX (tamoxifen citrát). Ovariální cysty byly také pozorovány u malého počtu premenopauzálních pacientek s pokročilým karcinomem prsu, které byly léčeny přípravkem NOLVADEX (tamoxifen citrát).
Bylo hlášeno, že NOLVADEX (tamoxifen citrát) způsobuje menstruační nepravidelnosti nebo amenoreu.
Tromboembolické účinky NOLVADEX (tamoxifen citrát)
Existují důkazy o zvýšené incidenci tromboembolických příhod, včetně hluboké žilní trombózy a plicní embolie, během léčby přípravkem NOLVADEX (tamoxifen citrát). Když je NOLVADEX (tamoxifen citrát) podáván současně s chemoterapií, může dojít k dalšímu zvýšení výskytu tromboembolických účinků. Při léčbě rakoviny prsu je třeba pečlivě zvážit rizika a přínosy přípravku NOLVADEX (tamoxifen citrát) u žen s anamnézou tromboembolických příhod. V malé podstudii (N=81) studie NSABP P-1 se zdálo, že screening žen na faktor V Leiden a mutace protrombinu G20210A nemá žádný přínos jako prostředek k identifikaci těch, kteří nemusí být vhodnými kandidátkami na NOLVADEX (tamoxifen citrátová) terapie.
Údaje ze studie NSABP P-1 ukazují, že účastníci užívající NOLVADEX (tamoxifen citrát) bez anamnézy plicní embolie (PE) měli statisticky významný nárůst plicní embolie (18-NOLVADEX (tamoxifen citrát), 6-placebo, RR=3,01 95% CI: 1,15-9,27). Tři z plicních embolií, všechny v rameni NOLVADEX (tamoxifen citrát), byly fatální. Osmdesát sedm procent případů plicní embolie se při randomizaci vyskytlo u žen ve věku alespoň 50 let. U žen užívajících NOLVADEX (tamoxifen citrát) se příhody objevily mezi 2 a 60 měsíci (průměr = 27 měsíců) od začátku léčby.
Ve stejné populaci byl pozorován nestatisticky významný nárůst hluboké žilní trombózy (DVT) ve skupině NOLVADEX (tamoxifen citrát) (30-NOLVADEX (tamoxifen citrát), 19-placebo; RR=1,59, 95% CI: 0,86 -2,98). Stejné zvýšení relativního rizika bylo pozorováno u žen ≤ 49 au žen ≥ 50 let, i když u mladších žen se vyskytlo méně příhod. Ženy s tromboembolickými příhodami byly vystaveny riziku druhé související příhody (7 z 25 žen na placebu, 5 ze 48 žen na NOLVADEXu (tamoxifen citrát) a byly vystaveny riziku komplikací příhody a její léčby (0/25 na placebo, 4/48 na NOLVADEX (tamoxifen citrát)). U žen, které dostávaly NOLVADEX (tamoxifen citrát), došlo k příhodám hluboké žilní trombózy mezi 2 a 57 měsíci (průměr = 19 měsíců) od začátku léčby.
Mezi pacienty randomizovanými na NOLVADEX (tamoxifen citrát) (24-Placebo; 34-NOLVADEX (tamoxifen citrát) došlo ke statisticky nevýznamnému nárůstu cévní mozkové příhody; RR=1,42; 95% CI 0,82-2,51). Šest z 24 mrtvic ve skupině s placebem bylo považováno za hemoragické a 10 z 34 mrtvic ve skupině NOLVADEX (tamoxifen citrát) bylo kategorizováno jako hemoragické. Sedmnáct z 34 mozkových příhod ve skupině NOLVADEX (tamoxifen citrát) bylo považováno za okluzivní a 7 bylo považováno za neznámou etiologii. Čtrnáct z 24 mozkových příhod v rameni s placebem bylo hlášeno jako okluzivní a 4 neznámé etiologie. Mezi těmito mrtvicemi byly 3 mrtvice ve skupině s placebem a 4 mrtvice ve skupině NOLVADEX (tamoxifen citrát) fatální. Osmdesát osm procent mozkových příhod se vyskytlo u žen ve věku nejméně 50 let v době randomizace. U žen, které dostávaly NOLVADEX (tamoxifen citrát), se události vyskytly mezi 1 a 63 měsíci (průměr = 30 měsíců) od začátku léčby.
Účinky na játra: Rakovina jater
Ve švédské studii s použitím adjuvans NOLVADEX (tamoxifen citrát) 40 mg/den po dobu 2-5 let byly hlášeny 3 případy rakoviny jater ve skupině léčené přípravkem NOLVADEX (tamoxifen citrát) oproti 1 případu v pozorovací skupině (viz BEZPEČNOSTNÍ OPATŘENÍ- Karcinogeneze ). V jiných klinických studiích hodnotících NOLVADEX (tamoxifen citrát) nebyly dosud hlášeny žádné případy rakoviny jater.
Jeden případ rakoviny jater byl hlášen u NSABP P-1 u účastníka randomizovaného na NOLVADEX (tamoxifen citrát).
Účinky na játra: Nezhoubné účinky
NOLVADEX (tamoxifen citrát) byl spojován se změnami hladin jaterních enzymů a ve vzácných případech se spektrem závažnějších jaterních abnormalit včetně ztučnění jater, cholestázy, hepatitidy a jaterní nekrózy. Několik z těchto vážných případů zahrnovalo smrtelné případy. Ve většině hlášených případů je vztah k přípravku NOLVADEX (tamoxifen citrát) nejistý. Byly však hlášeny některé pozitivní opětovné výzvy a odvolání.
Ve studii NSABP P-1 bylo pozorováno několik změn jaterních funkcí stupně 3-4 (SGOT, SGPT, bilirubin, alkalická fosfatáza) (10 na placebu a 6 na NOLVADEX (tamoxifen citrát)). Sérové lipidy nebyly systematicky odebírány.
Jiné rakoviny
Po léčbě rakoviny prsu přípravkem NOLVADEX (tamoxifen citrát) v klinických studiích byla hlášena řada druhých primárních nádorů vyskytujících se na jiných místech než v endometriu. Údaje ze studií NSABP B-14 a P-1 neukazují žádné zvýšení jiných (neuterinních) rakovin u pacientek užívajících NOLVADEX (tamoxifen citrát). Zda je s přípravkem NOLVADEX (tamoxifen citrát) spojeno zvýšené riziko jiných (neuterinních) rakovin, je stále nejisté a nadále se hodnotí.
Účinky na oko
U pacientů užívajících NOLVADEX (tamoxifen citrát) byly hlášeny oční poruchy, včetně změn rohovky, snížení vnímání barevného vidění, trombóza retinálních žil a retinopatie. U pacientů užívajících NOLVADEX (tamoxifen citrát) byl hlášen zvýšený výskyt katarakty a potřeba operace katarakty.
Ve studii NSABP P-1 bylo zvýšené riziko hraniční významnosti rozvoje katarakty u žen bez katarakty na začátku (540-NOLVADEX (tamoxifen citrát); 483-placebo; RR=1,13, 95% CI: 1,00-1,28) pozorováno. Mezi těmito stejnými ženami byl NOLVADEX (tamoxifen citrát) spojen se zvýšeným rizikem operace katarakty (101-NOLVADEX (tamoxifen citrát); 63-placebo; RR=1,62, 95% CI 1,18-2,22) (viz tabulka 3 v KLINICKÁ FARMAKOLOGIE ). Mezi všemi ženami ve studii (s nebo bez katarakty na začátku) byl NOLVADEX (tamoxifen citrát) spojen se zvýšeným rizikem operace katarakty (201-NOLVADEX (tamoxifen citrát); 129-placebo; RR=1,58, 95% CI 1,26-1,97). Během studie nebylo vyžadováno oční vyšetření. Žádné jiné závěry týkající se očních příhod bez katarakty nelze učinit.
Kategorie těhotenství D
NOLVADEX (tamoxifen citrát) může způsobit poškození plodu, když je podáván těhotné ženě. Ženám by mělo být doporučeno, aby neotěhotněly během užívání přípravku NOLVADEX (tamoxifen citrát) nebo do 2 měsíců po ukončení léčby přípravkem NOLVADEX (tamoxifen citrát) a měly by používat bariérovou nebo nehormonální antikoncepční opatření, pokud jsou sexuálně aktivní. Tamoxifen nezpůsobuje neplodnost, a to ani v případě nepravidelnosti menstruace. Účinky na reprodukční funkce se očekávají od antiestrogenních vlastností léku. V reprodukčních studiích na potkanech při dávkách stejných nebo nižších než je dávka pro člověka byly pozorovány neteratogenní vývojové změny skeletu, které byly reverzibilní. Kromě toho ve studiích fertility u potkanů a v teratologických studiích u králíků s použitím dávek stejných nebo nižších než u lidí byl pozorován nižší výskyt implantace embrya a vyšší výskyt úmrtí plodu nebo zpomalení růstu in utero, s pomalejším chováním při učení některá krysí mláďata ve srovnání s historickými kontrolami. Některým březím kosmanům byla během organogeneze nebo v poslední polovině březosti podávána dávka 10 mg/kg/den (asi 2násobek denní maximální doporučené dávky pro člověka na základě mg/m²). Nebyly pozorovány žádné deformace, a přestože dávka byla dostatečně vysoká k ukončení březosti u některých zvířat, zvířata, která březost udržela, nevykazovala žádné známky teratogenních malformací.
Na modelech vývoje reprodukčního traktu plodu u hlodavců způsobil tamoxifen (v dávkách 0,002 až 2,4násobek denní maximální doporučené dávky pro člověka na základě mg/m²) změny u obou pohlaví, které jsou podobné těm, které způsobuje estradiol, ethynylestradiol a diethylstilbestrol. Ačkoli klinický význam těchto změn není znám, některé z těchto změn, zejména vaginální adenóza, jsou podobné těm, které byly pozorovány u mladých žen, které byly vystaveny diethylstilbestrolu in utero a které mají riziko 1 z 1000, že se u nich vyvine adenokarcinom z jasných buněk. pochva nebo děložní čípek. Dosud nebylo prokázáno, že by expozice tamoxifenu in utero u mladých žen způsobovala vaginální adenózu nebo adenokarcinom pochvy nebo děložního čípku z jasných buněk. Avšak pouze malý počet mladých žen byl vystaven tamoxifenu in utero a menší počet byl sledován dostatečně dlouho (do věku 15-20 let), aby se zjistilo, zda by se v důsledku této expozice mohla objevit vaginální nebo cervikální neoplazie.
Neexistují žádné adekvátní a dobře kontrolované studie tamoxifenu u těhotných žen. Existuje malý počet zpráv o vaginálním krvácení, spontánních potratech, vrozených vadách a úmrtích plodu u těhotných žen. Pokud je tento lék užíván během těhotenství nebo pacientka otěhotní během užívání tohoto léku nebo přibližně do dvou měsíců po ukončení léčby, měla by být informována o potenciálních rizicích pro plod, včetně potenciálního dlouhodobého rizika DES- jako syndrom.
Snížení výskytu rakoviny prsu u vysoce rizikových žen – kategorie D těhotenství
U sexuálně aktivních žen ve fertilním věku by měla být léčba NOLVADEX (tamoxifen citrát) zahájena během menstruace. U žen s menstruační nepravidelností stačí negativní B-HCG bezprostředně před zahájením léčby (viz. BEZPEČNOSTNÍ OPATŘENÍ-INFORMACE PRO PACIENTY - Snížení výskytu rakoviny prsu u vysoce rizikových žen ).
OPATŘENÍ
Všeobecné
Snížení počtu krevních destiček, obvykle na 50 000-100 000/mm³, zřídka nižší, bylo příležitostně hlášeno u pacientů užívajících NOLVADEX (tamoxifen citrát) pro rakovinu prsu. U pacientů s významnou trombocytopenií se vyskytly vzácné hemoragické epizody, ale není jisté, zda jsou tyto epizody způsobeny léčbou NOLVADEX (tamoxifen citrát). Byla pozorována leukopenie, někdy ve spojení s anémií a/nebo trombocytopenií. U pacientů užívajících NOLVADEX (tamoxifen citrát) byly vzácně hlášeny neutropenie a pancytopenie; to může být někdy vážné.
Ve studii NSABP P-1 zaznamenalo 6 žen užívajících NOLVADEX (tamoxifen citrát) a 2 ženy placebo pokles počtu krevních destiček stupně 3-4 (≤ 50 000/mm³).
Informace pro pacienty
Pacienti by měli být poučeni, aby si přečetli Průvodce léky dodávaný v souladu se zákonem při výdeji NOLVADEX 10mg. Kompletní text Průvodce léky je přetištěno na konci tohoto dokumentu.
Redukce invazivního karcinomu prsu a DCIS u žen s DCIS
Ženy s DCIS léčené lumpektomií a radiační terapií, které zvažují NOLVADEX (tamoxifen citrát) ke snížení výskytu druhé příhody rakoviny prsu, by měly posoudit rizika a přínosy léčby, protože léčba NOLVADEX (tamoxifen citrát) snížila výskyt invazivních prsů rakovina, ale nebylo prokázáno, že by ovlivnilo přežití (viz tabulka 1 v KLINICKÁ FARMAKOLOGIE ).
Snížení výskytu rakoviny prsu u vysoce rizikových žen
Ženy, které mají vysoké riziko rakoviny prsu, mohou zvážit užívání NOLVADEX (tamoxifen citrát) ke snížení výskytu rakoviny prsu. Zda se má za to, že přínosy léčby převažují nad riziky, závisí na osobní zdravotní anamnéze ženy a na tom, jak zvažuje přínosy a rizika. Léčba NOLVADEX (tamoxifen citrát) ke snížení výskytu rakoviny prsu proto nemusí být vhodná pro všechny ženy s vysokým rizikem rakoviny prsu. Ženy, které zvažují léčbu přípravkem NOLVADEX (tamoxifen citrát), by se měly před zahájením léčby pro snížení výskytu rakoviny prsu poradit se svým lékařem o posouzení potenciálních přínosů a rizik (viz tabulka 3 v KLINICKÁ FARMAKOLOGIE ). Ženy by měly pochopit, že NOLVADEX (tamoxifen citrát) snižuje výskyt rakoviny prsu, ale nemusí eliminovat riziko. NOLVADEX (tamoxifen citrát) snížil výskyt malých nádorů s pozitivními estrogenovými receptory, ale nezměnil výskyt nádorů s negativními estrogenovými receptory nebo větších nádorů. U žen s rakovinou prsu, které mají vysoké riziko rozvoje druhého karcinomu prsu, snížila léčba přípravkem NOLVADEX (tamoxifen citrát) po dobu asi 5 let roční výskyt druhého karcinomu prsu přibližně o 50 %.
Ženy, které jsou těhotné nebo plánují otěhotnět, by neměly užívat NOLVADEX (tamoxifen citrát), aby se snížilo riziko rakoviny prsu. Účinnou nehormonální antikoncepci musí používat všechny premenopauzální ženy užívající NOLVADEX (tamoxifen citrát) a přibližně dva měsíce po ukončení léčby, pokud jsou sexuálně aktivní. Tamoxifen nezpůsobuje neplodnost, a to ani v případě nepravidelnosti menstruace. U sexuálně aktivních žen ve fertilním věku by měla být léčba NOLVADEX (tamoxifen citrát) zahájena během menstruace. U žen s menstruační nepravidelností stačí negativní B-HCG bezprostředně před zahájením léčby (viz. VAROVÁNÍ-Těhotenství kategorie D ).
Byly provedeny dvě evropské studie tamoxifenu ke snížení rizika rakoviny prsu a neprokázaly žádný rozdíl v počtu případů rakoviny prsu mezi tamoxifenem a placebem. Tyto studie měly design studií, který se lišil od studie NSABP P-1, byly menší než NSABP P-1 a zahrnovaly ženy s nižším rizikem rakoviny prsu než ženy v P-1.
Monitorování během terapie NOLVADEX (tamoxifen citrát).
Ženy užívající nebo dříve užívající NOLVADEX (tamoxifen citrát) by měly být poučeny, aby vyhledaly okamžitou lékařskou pomoc kvůli novým bulkám v prsou, vaginálnímu krvácení, gynekologickým příznakům (menstruační nepravidelnosti, změny vaginálního výtoku nebo pánevní bolesti nebo tlaku), příznakům otoku nohou nebo citlivost, nevysvětlitelná dušnost nebo změny vidění. Ženy by měly informovat všechny poskytovatele péče, bez ohledu na důvod hodnocení, že užívají NOLVADEX (tamoxifen citrát).
Ženy užívající NOLVADEX (tamoxifen citrát) ke snížení výskytu rakoviny prsu by měly mít před zahájením léčby vyšetření prsu, mamograf a gynekologické vyšetření. Tyto studie by se měly během léčby v pravidelných intervalech opakovat v souladu se správnou lékařskou praxí. Ženy užívající NOLVADEX (tamoxifen citrát) jako adjuvantní léčbu rakoviny prsu by měly dodržovat stejné monitorovací postupy jako ženy užívající NOLVADEX (tamoxifen citrát), aby se snížil výskyt rakoviny prsu. Ženy, které užívají NOLVADEX (tamoxifen citrát) jako léčbu metastatického karcinomu prsu, by měly přezkoumat tento plán sledování se svým poskytovatelem péče a zvolit vhodné modality a harmonogram hodnocení.
Laboratorní testy
Je třeba pravidelně provádět kompletní krevní obraz, včetně počtu krevních destiček, a pravidelné testy jaterních funkcí.
Během studie ATAC bylo hlášeno zvýšení sérového cholesterolu u více pacientek užívajících anastrozol ve srovnání s pacientkami užívajícími NOLVADEX (tamoxifen citrát) (9 % oproti 3,5 %, v tomto pořadí).
Karcinogeneze
Konvenční studie karcinogeneze u potkanů v dávkách 5, 20 a 35 mg/kg/den (přibližně jeden, trojnásobek a sedminásobek denní maximální doporučené dávky pro člověka na bázi mg/m²) podávaných orální sondou po dobu až 2 let ) odhalilo významné zvýšení hepatocelulárního karcinomu ve všech dávkách. Výskyt těchto nádorů byl významně vyšší u potkanů, kterým bylo podáváno 20 nebo 35 mg/kg/den (69 %) ve srovnání s potkany, kterým bylo podáváno 5 mg/kg/den (14 %). V samostatné studii byl potkanům podáván tamoxifen v dávce 45 mg/kg/den (přibližně devítinásobek denní maximální doporučené dávky pro člověka na základě mg/m²); hepatocelulární neoplazie se projevila po 3 až 6 měsících.
Nádory vaječníků z granulózních buněk a nádory varlat z intersticiálních buněk byly pozorovány ve dvou samostatných studiích na myších. Myším byly podávány trans a racemické formy tamoxifenu po dobu 13 až 15 měsíců v dávkách 5, 20 a 50 mg/kg/den (přibližně poloviční, dvou a pětinásobek denní doporučené dávky pro člověka v mg/m² základ).
Mutageneze
V konvenční baterii in vivo a in vitro testů s pro- a eukaryotickými testovacími systémy se systémy metabolizujícími léky nebyl nalezen žádný genotoxický potenciál. Zvýšené hladiny aduktů DNA však byly pozorovány po značení 32P v DNA z jater potkana a kultivovaných lidských lymfocytů. Bylo také zjištěno, že tamoxifen zvyšuje hladiny tvorby mikrojader in vitro v lidské lymfoblastoidní buněčné linii (MCL-5). Na základě těchto zjištění je tamoxifen genotoxický pro hlodavce a lidské buňky MCL-5.
Zhoršení plodnosti
Tamoxifen způsobil zhoršení plodnosti a početí u samic potkanů v dávkách 0,04 mg/kg/den (asi 0,01násobek denní maximální doporučené dávky pro člověka na bázi mg/m²), když byl podáván dva týdny před pářením až do 7. dne březosti . Při této dávce se fertilita a reprodukční indexy výrazně snížily s celkovou mortalitou plodu. Fetální mortalita byla také zvýšena při dávkách 0,16 mg/kg/den (přibližně 0,03násobek denní maximální doporučené dávky pro člověka na základě mg/m²), když byly samicím potkanů podávány dávky od 7. do 17. dne březosti. Tamoxifen způsobil potrat, předčasný porod a smrt plodu u králíků, kterým byly podávány dávky rovné nebo vyšší než 0,125 mg/kg/den (asi 0,05násobek denní maximální doporučené dávky pro člověka na základě mg/m²). U potkanů ani u králíků nebyly zjištěny žádné teratogenní změny.
Kategorie těhotenství D
Vidět VAROVÁNÍ .
Kojící matky
Bylo hlášeno, že tamoxifen inhibuje laktaci. Dvě placebem kontrolované studie u více než 150 žen prokázaly, že tamoxifen významně inhibuje časnou tvorbu poporodního mléka. V obou studiích byl tamoxifen podáván do 24 hodin po porodu po dobu 5 až 18 dnů. Vliv tamoxifenu na zavedenou produkci mléka není znám.
Neexistují žádné údaje, které by řešily, zda se tamoxifen vylučuje do lidského mateřského mléka. Pokud je tamoxifen vylučován, nejsou k dispozici žádné údaje o účincích tamoxifenu v mateřském mléce na kojené dítě nebo kojená zvířata. Nicméně přímá neonatální expozice tamoxifenu myším a potkanům (ne prostřednictvím mateřského mléka) způsobila 1) léze reprodukčního traktu u samic hlodavců (podobné těm, které byly pozorovány u lidí po intrauterinní expozici diethylstilbestrolu) a 2) funkční defekty reprodukčního traktu u samců hlodavců, jako je atrofie varlat a zastavení spermatogeneze.
Není známo, zda se NOLVADEX (tamoxifen citrát) vylučuje do lidského mléka. Vzhledem k potenciálu závažných nežádoucích reakcí u kojených dětí z přípravku NOLVADEX (tamoxifen citrát), ženy užívající přípravek NOLVADEX (tamoxifen citrát) by neměly kojit.
Snížení výskytu rakoviny prsu u vysoce rizikových žen s DCIS
Není známo, zda se NOLVADEX (tamoxifen citrát) vylučuje do lidského mléka. Vzhledem k potenciálu závažných nežádoucích reakcí u kojených dětí z přípravku NOLVADEX (tamoxifen citrát), ženy užívající přípravek NOLVADEX (tamoxifen citrát) by neměly kojit.
Pediatrické použití
Bezpečnost a účinnost přípravku NOLVADEX (tamoxifen citrát) u dívek ve věku od 2 do 10 let s McCune-Albrightovým syndromem a předčasnou pubertou nebyla studována déle než jeden rok léčby. Dlouhodobé účinky léčby přípravkem NOLVADEX (tamoxifen citrát) pro dívky nebyly stanoveny. U dospělých léčených přípravkem NOLVADEX (tamoxifen citrát) byl zaznamenán zvýšený výskyt zhoubných nádorů dělohy, mrtvice a plicní embolie (viz VAROVÁNÍ V KRABICE , a KLINICKÁ FARMAKOLOGIE-Klinické studie-McCune-Albrightův syndrom pododdíl).
Geriatrické použití
Ve studii NSABP P-1 bylo procento žen ve věku alespoň 65 let 16 %. Ženy ve věku alespoň 70 let tvořily 6 % účastníků. Snížení výskytu rakoviny prsu bylo pozorováno u účastníků v každé z podskupin: Celkem 28 a 10 invazivních karcinomů prsu bylo pozorováno u účastníků ve věku 65 let a starších ve skupině s placebem a NOLVADEX (tamoxifen citrát), v tomto pořadí. Napříč všemi ostatními výsledky odrážejí výsledky v této podskupině výsledky pozorované u podskupiny žen ve věku alespoň 50 let. Nebyly pozorovány žádné celkové rozdíly v snášenlivosti mezi staršími a mladšími pacienty (viz KLINICKÁ FARMAKOLOGIE - Klinické studie - Snížení výskytu rakoviny prsu u vysoce rizikových žen sekce).
Ve studii NSABP B-24 bylo procento žen ve věku alespoň 65 let 23 %. Ženy ve věku alespoň 70 let tvořily 10 % účastníků. Celkem 14 a 12 invazivních karcinomů prsu bylo pozorováno u účastníků ve věku 65 let a starších ve skupině s placebem a NOLVADEX (tamoxifen citrát), v tomto pořadí. Tato podmnožina je příliš malá na to, aby bylo možné vyvodit jakékoli závěry o účinnosti. Ve všech ostatních sledovaných parametrech byly výsledky v této podskupině srovnatelné s výsledky mladších žen zařazených do této studie. Mezi staršími a mladšími pacienty nebyly pozorovány žádné celkové rozdíly v snášenlivosti.
PŘEDÁVKOVAT
Příznaky pozorované při nejvyšších dávkách po studiích ke stanovení LD50 u zvířat byly dýchací potíže a křeče.
Akutní předávkování u lidí nebylo hlášeno. Ve studii pacientů s pokročilým metastatickým karcinomem, která specificky stanovila maximální tolerovanou dávku NOLVADEXu (tamoxifen citrát) při hodnocení použití velmi vysokých dávek ke zvrácení multirezistence, byla zaznamenána akutní neurotoxicita projevující se třesem, hyperreflexií, nejistou chůzí a závratí. Tyto příznaky se objevily během 3-5 dnů po zahájení léčby přípravkem NOLVADEX (tamoxifen citrát) a vymizely během 2-5 dnů po ukončení léčby. Nebyla zaznamenána žádná trvalá neurologická toxicita. U jednoho pacienta se objevil záchvat několik dní poté, co byl NOLVADEX (tamoxifen citrát) vysazen a neurotoxické symptomy vymizely. Kauzální vztah záchvatu k léčbě NOLVADEX (tamoxifen citrát) není znám. Dávky podávané těmto pacientům byly všechny vyšší než nasycovací dávka 400 mg/m², po níž následovaly udržovací dávky 150 mg/m² NOLVADEXu (tamoxifen citrát) podávané dvakrát denně.
Ve stejné studii bylo zaznamenáno prodloužení QT intervalu na elektrokardiogramu, když byly pacientům podávány dávky vyšší než 250 mg/m² nasycovací dávka, po níž následovaly udržovací dávky 80 mg/m² NOLVADEXu (tamoxifen citrát) podávané dvakrát denně. U ženy s tělesným povrchem 1,5 m² byly minimální nasycovací a udržovací dávky, při kterých se objevily neurologické příznaky a změny QT, alespoň 6krát vyšší než maximální doporučená dávka.
Není známa žádná specifická léčba předávkování; léčba musí být symptomatická.
KONTRAINDIKACE
NOLVADEX (tamoxifen citrát) je kontraindikován u pacientů se známou přecitlivělostí na lék nebo na kteroukoli z jeho složek.
Snížení výskytu rakoviny prsu u vysoce rizikových žen a žen s DCIS
NOLVADEX (tamoxifen citrát) je kontraindikován u žen, které vyžadují souběžnou antikoagulační léčbu kumarinového typu nebo u žen s anamnézou hluboké žilní trombózy nebo plicní embolie.
KLINICKÁ FARMAKOLOGIE
NOLVADEX (tamoxifen citrát) je nesteroidní látka, která prokázala silné antiestrogenní vlastnosti v testovacích systémech na zvířatech. Antiestrogenní účinky mohou souviset s jeho schopností soutěžit s estrogenem o vazebná místa v cílových tkáních, jako je prsa. Tamoxifen inhibuje indukci karcinomu mléčné žlázy u krys indukovaného dimethylbenzanthracenem (DMBA) a způsobuje regresi již vzniklých nádorů indukovaných DMBA. V tomto modelu potkanů se zdá, že tamoxifen uplatňuje své protinádorové účinky vazbou na estrogenové receptory.
V cytosolech odvozených z lidských adenokarcinomů prsu tamoxifen soutěží s estradiolem o estrogenový receptorový protein.
Absorpce a distribuce
Po jednorázové perorální dávce 20 mg tamoxifenu došlo k průměrné maximální plazmatické koncentraci 40 ng/ml (rozmezí 35 až 45 ng/ml) přibližně 5 hodin po podání. Pokles plazmatických koncentrací tamoxifenu je dvoufázový s terminálním poločasem eliminace přibližně 5 až 7 dnů. Průměrná maximální plazmatická koncentrace N-desmethyltamoxifenu je 15 ng/ml (rozmezí 10 až 20 ng/ml). Chronické podávání 10 mg tamoxifenu dvakrát denně pacientům po dobu 3 měsíců vede k průměrným plazmatickým koncentracím v ustáleném stavu 120 ng/ml (rozmezí 67-183 ng/ml) pro tamoxifen a 336 ng/ml (rozmezí 148-654 ng/ ml) pro N-desmethyl tamoxifen. Průměrné plazmatické koncentrace tamoxifenu a N-desmethyltamoxifenu v ustáleném stavu po podávání 20 mg tamoxifenu jednou denně po dobu 3 měsíců jsou 122 ng/ml (rozmezí 71-183 ng/ml) a 353 ng/ml (rozmezí 152-706 ng /ml), resp. Po zahájení léčby je rovnovážných koncentrací tamoxifenu dosaženo přibližně za 4 týdny a ustálených koncentrací N-desmethyltamoxifenu je dosaženo přibližně za 8 týdnů, což naznačuje poločas přibližně 14 dnů pro tento metabolit. Ve zkřížené studii v ustáleném stavu s 10 mg tabletami NOLVADEX (tamoxifen citrát) podávanými dvakrát denně vs. 20 mg tabletou NOLVADEX (tamoxifen citrát) podávanými jednou denně byla tableta 20 mg NOLVADEX (tamoxifen citrát) bioekvivalentní mg tablety NOLVADEX (tamoxifen citrát).
Metabolismus
Tamoxifen je po perorálním podání značně metabolizován. N-desmethyltamoxifen je hlavním metabolitem nalezeným v plazmě pacientů. Biologická aktivita N-desmethyl tamoxifenu se zdá být podobná jako tamoxifen. 4-Hydroxytamoxifen a primární alkoholový derivát tamoxifenu s postranním řetězcem byly v plazmě identifikovány jako minoritní metabolity. Tamoxifen je substrátem cytochromu P-450 3A, 2C9 a 2D6 a inhibitorem P-glykoproteinu.
Vylučování
Studie u žen užívajících 20 mg 14C tamoxifenu ukázaly, že přibližně 65 % podané dávky bylo vyloučeno z těla po dobu 2 týdnů, přičemž primární cestou eliminace bylo vylučování stolicí. Lék je vylučován převážně jako polární konjugáty, přičemž nezměněné léčivo a nekonjugované metabolity tvoří méně než 30 % celkové fekální radioaktivity.
Zvláštní populace
Účinky věku, pohlaví a rasy na farmakokinetiku tamoxifenu nebyly stanoveny. Účinky snížené funkce jater na metabolismus a farmakokinetiku tamoxifenu nebyly stanoveny.
Pediatričtí pacienti
Farmakokinetika tamoxifenu a N-desmethyltamoxifenu byla charakterizována pomocí populační farmakokinetické analýzy s řídkými vzorky na pacienta získaných od 27 dětských pacientek ve věku 2 až 10 let zařazených do studie určené k hodnocení bezpečnosti, účinnosti a farmakokinetiky přípravku NOLVADEX (tamoxifen citrát) při léčbě McCune-Albrightova syndromu. Bohatá data ze dvou farmakokinetických studií tamoxifen citrátu, ve kterých studie dokončilo 59 postmenopauzálních žen s rakovinou prsu, byla zahrnuta do analýzy pro stanovení strukturálního farmakokinetického modelu tamoxifenu. Nejlépe odpovídal datům jednokomorový model.
pediatrických pacientů byla průměrná maximální plazmatická koncentrace v ustáleném stavu (Css, max) a AUC 187 ng/ml a 4110 ng h/ml, v daném pořadí, a Css, max se vyskytly přibližně 8 hodin po podání dávky. Clearance (CL/F) upravená podle tělesné hmotnosti u dětských pacientek byla přibližně 2,3krát vyšší než u pacientek s rakovinou prsu. V nejmladší kohortě dětských pacientek (2-6 let) byl CL/F 2,6krát vyšší; v nejstarší kohortě (7-10,9 let) byla CL/F přibližně 1,9krát vyšší. Expozice N-desmethyl tamoxifenu byla srovnatelná u pediatrických a dospělých pacientů. Bezpečnost a účinnost přípravku NOLVADEX (tamoxifen citrát) u dívek ve věku od 2 do 10 let s McCune-Albrightovým syndromem a předčasnou pubertou nebyla studována déle než jeden rok léčby. Dlouhodobé účinky léčby přípravkem NOLVADEX (tamoxifen citrát) u dívek nebyly stanoveny. dospělých léčených přípravkem NOLVADEX (tamoxifen citrát) byl zaznamenán zvýšený výskyt malignit dělohy, mrtvice a plicní embolie (viz VAROVÁNÍ V KRABICE ).
Lékové interakce
Studie in vitro ukázaly, že erythromycin, cyklosporin, nifedipin a diltiazem kompetitivně inhibovaly tvorbu N-desmethyltamoxifenu se zjevnou K1 20, 1, 45 a 30 uM, v daném pořadí. Klinický význam těchto studií in vitro není znám.
Tamoxifen při současném podávání těchto léků snížil plazmatickou koncentraci letrozolu o 37 %. Rifampin, induktor cytochromu P-450 3A4, snížil AUC tamoxifenu o 86 % a Cmax o 55 %. Aminoglutethimid snižuje plazmatické koncentrace tamoxifenu a N-desmethyltamoxifenu. Medroxyprogesteron snižuje plazmatické koncentrace N-desmethylu, ale ne tamoxifenu.
adjuvantní studii s anastrozolem snížilo současné podávání anastrozolu a NOLVADEXU (tamoxifen citrát) u pacientek s karcinomem prsu plazmatické koncentrace anastrozolu o 27 % ve srovnání s těmi, kterých bylo dosaženo se samotným anastrozolem; současné podávání však neovlivnilo farmakokinetiku tamoxifenu nebo N-desmethyltamoxifenu (viz BEZPEČNOSTNÍ OPATŘENÍ -DROGOVÉ INTERAKCE ). NOLVADEX (tamoxifen citrát) by neměl být podáván současně s anastrozolem.
Klinické studie
Metastatický karcinom prsu
Ženy před menopauzou (NOLVADEX (tamoxifen citrát) vs. ablace)
Tři prospektivní, randomizované studie (Ingle, Pritchard, Buchanan) porovnávaly NOLVADEX (tamoxifen citrát) s ovariální ablací (ooforektomie nebo ozáření vaječníků) u premenopauzálních žen s pokročilým karcinomem prsu. Přestože míra objektivní odpovědi, doba do selhání léčby a přežití byly u obou typů léčby podobné, omezený přírůstek pacientů zabránil prokázání ekvivalence. V souhrnné analýze údajů o přežití ze 3 studií byl poměr rizik pro úmrtí (NOLVADEX (tamoxifen citrát) / ablace vaječníků) 1,00 s oboustranným 95% intervalem spolehlivosti 0,73 až 1,37. U premenopauzálních žen užívajících NOLVADEX (tamoxifen citrát) byly pozorovány zvýšené sérové a plazmatické estrogeny, ale údaje z randomizovaných studií nenaznačují nežádoucí účinek tohoto zvýšení. Omezený počet premenopauzálních pacientek s progresí onemocnění během léčby přípravkem NOLVADEX (tamoxifen citrát) reagoval na následnou ovariální ablaci.
Mužská rakovina prsu
Publikované výsledky od 122 pacientů (119 hodnotitelných) a kazuistiky u 16 pacientů (13 hodnotitelných) léčených přípravkem NOLVADEX (tamoxifen citrát) ukázaly, že NOLVADEX (tamoxifen citrát) je účinný pro paliativní léčbu rakoviny prsu u mužů. Šedesát šest z těchto 132 hodnotitelných pacientů reagovalo na NOLVADEX (tamoxifen citrát), což představuje 50% míru objektivní odpovědi.
Adjuvantní rakovina prsu
Přehled
Skupina Early Breast Cancer Trialists' Collaborative Group (EBCTCG) provedla celosvětové přehledy systémové adjuvantní léčby časného karcinomu prsu v letech 1985, 1990 a znovu v roce 1995. V roce 1998 byly hlášeny výsledky za 10 let u 36 689 žen v 55 randomizovaných studiích adjuvans NOLVADEX (tamoxifen citrát) v dávkách 20-40 mg/den po dobu 1-5+ let. Dvacet pět procent pacientů dostalo zkušební léčbu po dobu 1 roku nebo méně, 52 % dostávalo 2 roky a 23 % dostávalo přibližně 5 let. 48 procent nádorů bylo pozitivních na estrogenový receptor (ER) (> 10 fmol/mg), 21 % bylo ER slabé (
žen s ER pozitivním nebo neznámým karcinomem prsu a pozitivními uzlinami, které dostaly asi 5 let léčby, bylo celkové přežití po 10 letech 61,4 % pro NOLVADEX (tamoxifen citrát) oproti 50,5 % pro kontrolu (logrank 2p
Účinek plánovaného trvání tamoxifenu lze popsat následovně. U žen s ER pozitivním nebo neznámým karcinomem prsu, které dostávaly 1 rok nebo méně, 2 roky nebo asi 5 let NOLVADEX (tamoxifen citrát), bylo proporcionální snížení mortality 12 %, 17 % a 26 % (trend významný při 2p
Přínos je méně jasný u žen s ER chudým karcinomem prsu, u kterých bylo proporcionální snížení recidivy 10 % (2p = 0,007) po všechny doby trvání dohromady, nebo 9 % (2p = 0,02), pokud jsou vyloučeny kontralaterální karcinomy prsu. Odpovídající snížení mortality bylo 6 % (NS). Účinky asi 5letého NOLVADEXu (tamoxifen citrát) na recidivu a mortalitu byly podobné bez ohledu na věk a souběžnou chemoterapii. Nic nenasvědčovalo tomu, že by dávky vyšší než 20 mg denně byly účinnější.
Anastrozol Adjuvant ATAC Trial – Studie Anastrozolu ve srovnání s NOLVADEX (tamoxifen citrát) pro adjuvantní léčbu časného karcinomu prsu – Adjuvantní studie s anastrozolem byla provedena u 9366 postmenopauzálních žen s operabilním karcinomem prsu, které byly randomizovány k adjuvantní léčbě buď anastrozolem 1 mg denně, NOLVADEX (tamoxifen citrát) 20 mg denně, nebo kombinací těchto dvou léčeb po dobu pěti let nebo do recidivy nemoci. Při střední době sledování 33 měsíců neprokázala kombinace anastrozolu a NOLVADEXu (tamoxifen citrát) žádný přínos z hlediska účinnosti ve srovnání se samotnou terapií NOLVADEX (tamoxifen citrát) u všech pacientek ani v subpopulaci pozitivní na hormonální receptory. Tato léčebná větev byla ze studie vyřazena. Prosím obrať se na KLINICKÁ FARMAKOLOGIE-Speciální populace-Drogové-lékové interakce , BEZPEČNOSTNÍ OPATŘENÍ-Laboratorní testy , BEZPEČNOSTNÍ OPATŘENÍ-Drogové interakce a NEŽÁDOUCÍ REAKCE sekce pro bezpečnostní informace z této zkoušky. Další informace o této studii naleznete v úplné informaci o předepisování přípravku ARIMIDEX® (anastrozol) 1 mg tablety.
Pacienti ve dvou větvích monoterapie studie ATAC byli léčeni po dobu mediánu 60 měsíců (5 let) a sledováni po dobu mediánu 68 měsíců. Přežití bez onemocnění v populaci intent-to-treat bylo statisticky významně zlepšeno [Hazard Ratio (HR) = 0,87, 95% CI: 0,78, 0,97, p=0,0127] v rameni s anastrazolem ve srovnání s ramenem NOLVADEX (tamoxifen citrát) .
Uzel pozitivní – individuální studie
Dvě studie (Hubay a NSABP B-09) prokázaly zlepšené přežití bez onemocnění po radikální nebo modifikované radikální mastektomii u postmenopauzálních žen nebo žen ve věku 50 let nebo starších s chirurgicky léčitelným karcinomem prsu s pozitivními axilárními uzlinami, když byl NOLVADEX (tamoxifen citrát) přidán k adjuvantní cytotoxické chemoterapii. Ve studii Hubay byl NOLVADEX (tamoxifen citrát) přidán k „nízkodávkovému“ CMF (cyklofosfamid, methotrexát a fluorouracil). Ve studii NSABP B-09 byl NOLVADEX (tamoxifen citrát) přidán k melfalanu [L-fenylalanin hořčice (P)] a fluorouracilu (F).
Ve studii Hubay měli větší šanci na prospěch pacientky s pozitivním (více než 3 fmol) estrogenovým receptorem. Ve studii NSABP B-09 u žen ve věku 50–59 let jasně profitovaly pouze ženy s hladinami estrogenových i progesteronových receptorů 10 fmol nebo vyšší, zatímco u žen s hladinami estrogenových i progesteronových receptorů byl nestatisticky významný trend k nežádoucímu účinku. méně než 10 fmol. U žen ve věku 60-70 let byl pozorován trend k příznivému účinku přípravku NOLVADEX (tamoxifen citrát) bez jakéhokoli jasného vztahu ke stavu estrogenových nebo progesteronových receptorů.
Tři prospektivní studie (ECOG-1178, Toronto, NATO) používající NOLVADEX (tamoxifen citrát) adjuvantně jako jediné činidlo prokázaly zlepšené přežití bez onemocnění po totální mastektomii a disekci axily u postmenopauzálních žen s pozitivními axilárními uzlinami ve srovnání s kontrolami s placebem/bez léčby . Studie NATO také prokázala celkový přínos pro přežití.
Negativní uzel – individuální studie
NSABP B-14, prospektivní, dvojitě zaslepená, randomizovaná studie srovnávala NOLVADEX (tamoxifen citrát) s placebem u žen s rakovinou prsu s negativními axilárními uzlinami, pozitivní na estrogenní receptory (≥ 10 fmol/mg cytosolového proteinu) (jako adjuvantní léčba po totální mastektomii a disekci axily nebo segmentální resekci
INFORMACE PRO PACIENTA
PRŮVODCE LÉČBAMI
NOLVADEX (tamoxifen citrát)® (NOLE-vah-dex) Tablety Generický název: tamoxifen (ta-MOX-I-fen)
Napsáno pro ženy, které používají NOLVADEX (tamoxifen citrát) ke snížení vysoké šance na získání rakoviny prsu nebo které mají duktální karcinom in situ (DCIS)
Tato příručka o medikaci pojednává pouze o použití přípravku NOLVADEX (tamoxifen citrát) ke snížení šance na získání rakoviny prsu u vysoce rizikových žen a u žen léčených pro DCIS.
Lidé užívající NOLVADEX (tamoxifen citrát) k léčbě rakovina prsu má jiné výhody a jiná rozhodnutí než vysoce rizikové ženy nebo ženy s duktálním karcinomem in situ (DCIS), které užívají NOLVADEX (tamoxifen citrát), aby se snížila šance na získání rakoviny prsu. Pokud již máte rakovinu prsu, promluvte si se svým lékařem o tom, jaké jsou přínosy léčby rakoviny prsu přípravkem NOLVADEX (tamoxifen citrát) v porovnání s riziky, která jsou popsána v tomto dokumentu.
Proč bych si měl přečíst tento průvodce léky?
Tato příručka obsahuje informace, které vám pomohou rozhodnout, zda užívat NOLVADEX (tamoxifen citrát), abyste snížili pravděpodobnost vzniku rakoviny prsu.
Vy a váš lékař byste si měli promluvit o tom, zda je možný přínos přípravku NOLVADEX (tamoxifen citrát) při snižování vysoké šance na získání rakoviny prsu větší než jeho možná rizika. Váš lékař má speciální počítačový program nebo ruční kalkulačku, aby zjistil, zda patříte do vysoce rizikové skupiny. Pokud máte DCIS a byli jste léčeni chirurgickým zákrokem a radiační terapií, může vám lékař předepsat NOLVADEX (tamoxifen citrát), aby snížil vaši šanci na invazivní (šíření) rakoviny prsu.
Před zahájením léčby přípravkem NOLVADEX (tamoxifen citrát) si pozorně přečtěte tuto příručku. Je důležité si přečíst informace, které získáte pokaždé, když dostanete další lék. Může být něco nového. Tato příručka vám neřekne vše o NOLVADEX (tamoxifen citrát) a ano ne místo toho si promluvte se svým lékařem.
Pouze vy a váš lékař můžete určit, zda je NOLVADEX (tamoxifen citrát) pro vás to pravé.
Jaké jsou nejdůležitější informace, které bych měl vědět o používání NOLVADEX (tamoxifen citrát) ke snížení šance na získání rakoviny prsu?
NOLVADEX (tamoxifen citrát) je lék na předpis, který je v některých ohledech jako estrogen (ženský hormon) a v jiných se liší. V prsu může NOLVADEX (tamoxifen citrát) blokovat účinky estrogenu. Protože to dělá, NOLVADEX (tamoxifen citrát) může blokovat růst rakoviny prsu, která potřebuje estrogen k růstu (rakoviny, které jsou pozitivní na estrogenové nebo progesteronové receptory).
NOLVADEX (tamoxifen citrát) může snížit pravděpodobnost vzniku rakoviny prsu u žen s vyšší než normální šancí na rakovinu prsu v příštích pěti letech (vysoce rizikové ženy) a žen s DCIS.
Vzhledem k tomu, že vysoce rizikové ženy dosud nemají rakovinu, je důležité pečlivě zvážit, zda možný přínos přípravku NOLVADEX (tamoxifen citrát) při snižování šance na získání rakoviny prsu je větší než jeho možná rizika.
Tato příručka o medikaci hodnotí rizika a přínosy používání NOLVADEX (tamoxifen citrát) ke snížení šance na získání rakoviny prsu u vysoce rizikových žen a žen s DCIS. Tento průvodce ano ne diskutovat o zvláštních výhodách a rozhodnutích pro lidi, kteří již mají rakovinu prsu.
Proč ženy a muži používají NOLVADEX (tamoxifen citrát)?
NOLVADEX (tamoxifen citrát) má více než jedno použití. NOLVADEX (tamoxifen citrát) se používá:
snížit šanci onemocnět rakovinou prsu u žen s vyšší než normální pravděpodobností, že onemocní rakovinou prsu v příštích 5 letech (vysoce rizikové ženy)
snížit šanci invazivní (šířící se) rakoviny prsu u žen, které podstoupily operaci a ozařování pro duktální karcinom in situ (DCIS). DCIS znamená, že rakovina je pouze uvnitř mlékovodů.
k léčbě rakoviny prsu u žen poté, co ukončily časnou léčbu. Včasná léčba může zahrnovat chirurgický zákrok, ozařování a chemoterapii. NOLVADEX (tamoxifen citrát) může zabránit šíření rakoviny do jiných částí těla. Může také snížit pravděpodobnost, že žena dostane novou rakovinu prsu. u žen a mužů,
k léčbě rakovina prsu, která se rozšířila do jiných částí těla (metastatická rakovina prsu).
Tato příručka hovoří pouze o použití NOLVADEX (tamoxifen citrát) ke snížení šance na získání rakoviny prsu (č. 1 a #2 výše).
Jaké jsou výhody přípravku NOLVADEX (tamoxifen citrát) ke snížení šance na získání rakoviny prsu u vysoce rizikových žen a u žen léčených pro DCIS?
Na to se podívala velká americká studie vysoce rizikové ženy porovnávali ty, kteří užívali NOLVADEX (tamoxifen citrát) po dobu 5 let s ostatními, kteří užívali pilulku bez NOLVADEX (tamoxifen citrát) (placebo). Vysoce rizikové ženy byly definovány jako ženy, u kterých je na základě speciálního počítačového programu 1,7% nebo vyšší pravděpodobnost, že v příštích 5 letech onemocní rakovinou prsu. V této studii:
- Z každých 1000 vysoce rizikových žen který si vzal placebo , každý rok asi 7 onemocnělo rakovinou prsu.
- Z každých 1000 vysoce rizikových žen kteří užívali NOLVADEX (tamoxifen citrát) , každý rok asi 4 onemocněli rakovinou prsu.
Studie ukázala, že vysoce rizikové ženy, které užívaly NOLVADEX (tamoxifen citrát), snížily své šance na získání rakoviny prsu o 44 %, ze 7 z 1 000 na 4 z 1 000.
Další americká studie zkoumala ženy s DCIS a porovnávali ty, kteří užívali NOLVADEX (tamoxifen citrát) po dobu 5 let s ostatními, kteří užívali placebo. V této studii:
- Z každých 1 000 žen s DCIS kteří užívali placebo každý rok asi 17 onemocnělo rakovinou prsu.
- Z každých 1 000 žen s DCIS kteří užívali NOLVADEX (tamoxifen citrát) , každý rok asi 10 onemocnělo rakovinou prsu.
Studie ukázala, že ženy s DCIS, které užívaly NOLVADEX (tamoxifen citrát), snížily své šance na získání invazivní (šířící se) rakoviny prsu v průměru o 43 %, ze 17 na 1 000 na 10 z 1 000.
Tyto studie neznamenají, že užívání přípravku NOLVADEX (tamoxifen citrát) sníží vaši osobní šanci na získání rakoviny prsu. Nevíme, jaké budou přínosy pro každou ženu, která užívá NOLVADEX (tamoxifen citrát), aby snížila své šance na získání rakoviny prsu.
Jaká jsou rizika přípravku NOLVADEX (tamoxifen citrát)?
Ve studiích popsaných v části „Jaké jsou přínosy přípravku NOLVADEX (tamoxifen citrát)?“ měly vysoce rizikové ženy, které užívaly přípravek NOLVADEX (tamoxifen citrát), určité vedlejší účinky ve vyšší míře než ty, které užívaly placebo.
Některé z těchto nežádoucích účinků mohou způsobit smrt.
V jedné studii u žen, které ještě měly dělohu
- každých 1 000 žen, které užívaly placebo, dostala každý rok 1 rakovinu endometria (rakovinu děložní sliznice) a žádná nedostala sarkom dělohy (rakovinu těla dělohy).
- Z každých 1 000 žen, které užívaly NOLVADEX (tamoxifen citrát), každý rok 2 dostaly rakovinu endometria a méně než 1 dostal sarkom dělohy.
Tyto výsledky ukazují, že v průměru u vysoce rizikových žen kteří ještě měli svou dělohu NOLVADEX (tamoxifen citrát) zdvojnásobil šanci na získání rakoviny endometria z 1 z 1 000 na 2 z 1 000 a zvýšil šanci na získání sarkomu dělohy. To neznamená, že užívání přípravku NOLVADEX (tamoxifen citrát) zdvojnásobí vaši osobní šanci na získání rakoviny endometria nebo zvýší vaši šanci na získání sarkomu dělohy. Nevíme, jaké bude toto riziko pro jednu ženu. Jiné riziko je u žen, které již nemají svou dělohu.
všech žen v této studii zvýšilo užívání přípravku NOLVADEX (tamoxifen citrát) riziko krevní sraženiny v plicích nebo žilách nebo mrtvice. V některých případech ženy na tyto následky zemřely.
NOLVADEX (tamoxifen citrát) zvýšil riziko vzniku katarakty (zákal oční čočky) nebo nutnosti operace katarakty. (Další podrobnosti o vedlejších účincích naleznete v části „Jaké jsou možné vedlejší účinky přípravku NOLVADEX (tamoxifen citrát)?
Co nevíme o užívání NOLVADEX (tamoxifen citrát) ke snížení šance na získání rakoviny prsu?
Nevíme
- jestliže NOLVADEX (tamoxifen citrát) snižuje pravděpodobnost vzniku rakoviny prsu u žen, které mají abnormální geny rakoviny prsu (BRCA1 a BRCA2)
- pokud užívání přípravku NOLVADEX (tamoxifen citrát) po dobu 5 let snižuje počet rakovin prsu, které žena dostane během svého života, nebo pokud pouze oddaluje některé druhy rakoviny prsu
- pokud NOLVADEX (tamoxifen citrát) pomáhá ženě žít déle
- účinky užívání přípravku NOLVADEX (tamoxifen citrát) s hormonální substituční terapií (HRT), antikoncepčními pilulkami nebo androgeny (mužské hormony)
- výhody užívání přípravku NOLVADEX (tamoxifen citrát), pokud je vám méně než 35 let
Probíhají studie, aby se dozvěděli více o dlouhodobých přínosech a rizicích používání NOLVADEX (tamoxifen citrát) ke snížení šance na získání rakoviny prsu.
Jaké jsou možné vedlejší účinky přípravku NOLVADEX (tamoxifen citrát)?
Nejčastějším vedlejším účinkem přípravku NOLVADEX (tamoxifen citrát) jsou návaly horka. Nejedná se o známku vážného problému.
Dalším nejčastějším vedlejším účinkem je vaginální výtok. Pokud je výtok krvavý, může to být známkou vážného problému. [Viz „Změny výstelky (endometria) nebo těla vaší dělohy“ níže.]
Méně časté, ale závažné nežádoucí účinky přípravku NOLVADEX (tamoxifen citrát) jsou uvedeny níže. Tyto mohou nastat kdykoli. Okamžitě zavolejte svého lékaře, pokud zaznamenáte jakékoli příznaky nežádoucích účinků uvedených níže:
- Změny výstelky (endometria) nebo těla vaší dělohy. Tyto změny mohou znamenat, že začínají vážné problémy, včetně rakoviny dělohy. Příznaky změn v děloze jsou:
- Vaginální krvácení nebo krvavý výtok, který může mít rezavou nebo hnědou barvu. Měli byste zavolat svého lékaře, i když se objeví pouze malé množství krvácení.
- Změna měsíčního krvácení, jako je množství nebo načasování krvácení nebo zvýšená srážlivost.
- Bolest nebo tlak v pánvi (pod pupíkem).
- Krevní sraženiny ve vašich žilách nebo plicích. Ty mohou způsobit vážné problémy, včetně smrti. Můžete dostat sraženiny až 2-3 měsíce poté, co přestanete užívat NOLVADEX (tamoxifen citrát). Příznaky krevních sraženin jsou:
- náhlá bolest na hrudi, dušnost, vykašlávání krve
- bolest, citlivost nebo otok jedné nebo obou nohou
- Mrtvice. Cévní mozková příhoda může způsobit vážné zdravotní problémy, včetně smrti. Příznaky mrtvice jsou:
- náhlá slabost, brnění nebo necitlivost v obličeji, paži nebo noze, zejména na jedné straně těla
- náhlý zmatek, potíže s mluvením nebo porozuměním
- náhlé potíže se viděním na jedno nebo obě oči
- náhlé potíže s chůzí, závratě, ztráta rovnováhy nebo koordinace
- náhlá silná bolest hlavy bez známé příčiny
- Katarakta nebo zvýšená šance na operaci šedého zákalu. Příznakem těchto problémů je pomalé rozostření vašeho vidění.
- Problémy s játry, včetně žloutenky. Příznaky problémů s játry zahrnují nedostatek chuti k jídlu a zežloutnutí kůže nebo očního bělma.
Toto nejsou všechny možné vedlejší účinky přípravku NOLVADEX (tamoxifen citrát). Úplný seznam získáte od svého lékaře nebo lékárníka.
Kdo by neměl užívat NOLVADEX (tamoxifen citrát)?
Neužívejte NOLVADEX (tamoxifen citrát) z jakéhokoli důvodu, pokud ano
- Jste těhotná nebo plánujete otěhotnět během užívání přípravku NOLVADEX (tamoxifen citrát) nebo během 2 měsíců po ukončení užívání přípravku NOLVADEX (tamoxifen citrát). NOLVADEX (tamoxifen citrát) může poškodit vaše nenarozené dítě. Vyčištění NOLVADEXU (tamoxifen citrát) z vašeho těla trvá asi 2 měsíce. Abyste se ujistili, že nejste těhotná, můžete začít užívat NOLVADEX (tamoxifen citrát), když máte menstruaci. Nebo si můžete udělat těhotenský test, abyste se ujistili, že nejste těhotná, než začnete.
- Kojíte. Nevíme, zda NOLVADEX (tamoxifen citrát) může procházet vaším mlékem a poškodit vaše dítě.
- Měli jste alergickou reakci na NOLVADEX (tamoxifen citrát) nebo tamoxifen (jiný název pro NOLVADEX (tamoxifen citrát)) nebo na kteroukoli z jeho neaktivních složek.
Pokud otěhotníte během užívání přípravku NOLVADEX (tamoxifen citrát), okamžitě jej přestaňte užívat a kontaktujte svého lékaře. NOLVADEX (tamoxifen citrát) může poškodit vaše nenarozené dítě. Neužívejte NOLVADEX (tamoxifen citrát), abyste snížili pravděpodobnost, že dostanete rakovinu prsu, pokud
- Měl jste někdy krevní sraženinu, která vyžadovala lékařské ošetření.
- Užíváte léky na ředění krve, jako je warfarin (také nazývaný Coumadin®*).
- Vaše schopnost pohybovat se je omezená po většinu hodin vašeho bdění.
- Hrozí vám krevní sraženiny. Váš lékař vám může říci, zda máte vysoké riziko krevních sraženin.
- Nemáte vyšší než normální pravděpodobnost, že onemocníte rakovinou prsu. Váš lékař vám může říci, zda jste vysoce riziková žena.
Jak mám užívat NOLVADEX (tamoxifen citrát)?
- Tabletu (tablety) spolkněte vcelku, zapijte vodou nebo jinou nealkoholickou tekutinou. Můžete užívat NOLVADEX (tamoxifen citrát) s jídlem nebo bez jídla. Vezměte si léky každý den. Může být snadněji zapamatovatelné, pokud jej budete užívat každý den ve stejnou dobu.
- Pokud zapomenete užít dávku, vezměte si ji, jakmile si vzpomenete, a pak užijte další dávku jako obvykle. Pokud je téměř čas na další dávku nebo si vzpomenete na další dávku, neužívejte tablety navíc, abyste nahradil vynechanou dávku.
- Užívejte NOLVADEX (tamoxifen citrát) po dobu 5 let, pokud vám lékař neřekne jinak.
Co bych se měl vyhnout při užívání NOLVADEX (tamoxifen citrát)?
- Neotěhotněte během užívání přípravku NOLVADEX (tamoxifen citrát) nebo po dobu 2 měsíců po ukončení. NOLVADEX (tamoxifen citrát) může zastavit fungování hormonálních antikoncepčních metod. Hormonální metody zahrnují antikoncepční pilulky, náplasti, injekce, kroužky a implantáty. Proto při užívání přípravku NOLVADEX (tamoxifen citrát), používat antikoncepční metody, které nepoužívají hormony, jako jsou kondomy, diafragmy se spermicidem nebo obyčejné IUD. Pokud otěhotníte, okamžitě přestaňte užívat NOLVADEX (tamoxifen citrát) a zavolejte svého lékaře.
- Nekojte. Nevíme, zda NOLVADEX (tamoxifen citrát) může procházet vaším mlékem a zda může poškodit dítě.
Co mám dělat, když užívám NOLVADEX (tamoxifen citrát)?
- Absolvujte pravidelné gynekologické prohlídky („ženské zkoušky“), vyšetření prsů a mamografii. Váš lékař vám řekne, jak často. Ty zkontrolují známky rakoviny prsu a rakoviny endometria (výstelky dělohy). Protože NOLVADEX (tamoxifen citrát) nezabraňuje všem rakovinám prsu a můžete dostat jiné typy rakoviny, potřebujete tyto testy, abyste co nejdříve našli rakovinu.
- Protože NOLVADEX (tamoxifen citrát) může způsobit vážné vedlejší účinky, věnujte svému tělu velkou pozornost. Příznaky, které byste měli hledat, jsou uvedeny v části „Jaké jsou možné vedlejší účinky přípravku NOLVADEX (tamoxifen citrát)?
- Řekněte všem lékařům, že vidíte, že užíváte NOLVADEX (tamoxifen citrát).
- Okamžitě informujte svého lékaře, pokud máte nějaké nové bulky v prsu.
Obecné informace o bezpečném a účinném používání přípravku NOLVADEX (tamoxifen citrát)
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Váš lékař předepsal NOLVADEX (tamoxifen citrát) pouze vám. Nedávejte ho jiným lidem, i když mají podobný stav, protože by jim to mohlo ublížit. Nepoužívejte jej na stav, pro který nebyl předepsán.
Tato příručka o medikaci je souhrn informací o přípravku NOLVADEX (tamoxifen citrát) pro ženy, které používají přípravek NOLVADEX (tamoxifen citrát) ke snížení vysoké šance na získání rakoviny prsu nebo které mají DCIS. Chcete-li více informací o přípravku NOLVADEX (tamoxifen citrát), zeptejte se svého lékaře nebo lékárníka. Mohou vám poskytnout informace o NOLVADEX (tamoxifen citrát), který je napsán pro zdravotníky. Pro více informací o NOLVADEX (tamoxifen citrát) nebo rakovině prsu navštivte www.NOLVADEX (tamoxifen citrát) .com nebo volejte 1-800-236-9933.
Složení: tamoxifen citrát, vápenatá sůl karboxymethylcelulózy, stearát hořečnatý, mannitol a škrob.
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv
