Actos 15mg, 30mg Pioglitazone Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Actos a jak se používá?
Actos 15 mg je lék na předpis používaný k léčbě příznaků diabetes mellitus 2. typu. Actos lze užívat samostatně nebo s jinými léky.
Actos je antidiabetikum, thiazolidindionový lék.
Není známo, zda je Actos 15 mg bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Actos 15 mg?
Actos může způsobit závažné nežádoucí účinky včetně:
- dušnost (zejména při ležení),
- neobvyklá únava,
- otok,
- rychlý nárůst hmotnosti,
- růžová nebo červená moč,
- bolestivé nebo obtížné močení,
- nové nebo zhoršující se nutkání močit,
- změny vidění a
- náhlá neobvyklá bolest ruky, paže nebo nohy
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Actos patří:
- bolest hlavy,
- bolesti svalů a
- příznaky nachlazení (ucpaný nos, bolest dutin, kýchání, bolest v krku)
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Toto nejsou všechny možné vedlejší účinky přípravku Actos. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
MĚNANÉ SRDEČNÍ SELHÁNÍ
- Thiazolidindiony, včetně ACTOS 15 mg, způsobují nebo zhoršují městnavé srdeční selhání u některých pacientů (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Po zahájení léčby přípravkem ACTOS 30 mg a po zvýšení dávky pečlivě sledujte pacienty s ohledem na známky a příznaky srdečního selhání (např. nadměrné, rychlé přibírání na váze, dušnost a/nebo edém). Pokud dojde k rozvoji srdečního selhání, mělo by být léčeno podle současných standardů péče a je třeba zvážit vysazení nebo snížení dávky přípravku ACTOS 15 mg.
- ACTOS se nedoporučuje u pacientů se symptomatickým srdečním selháním.
- Zahájení ACTOS u pacientů se zavedeným srdečním selháním třídy III nebo IV podle New York Heart Association (NYHA) je kontraindikováno (viz KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
POPIS
Tablety ACTOS jsou thiazolidindion a agonista gama receptoru aktivovaného peroxisomovým proliferátorem (PPAR), který obsahuje perorální antidiabetikum: pioglitazon.
Monohydrochlorid pioglitazonu [(±)-5-[[4-[2-(5-ethyl-2-pyridinyl)ethoxy]fenyl]methyl]-2,4-]thiazolidindionu obsahuje jeden asymetrický uhlík a sloučenina se syntetizuje a používá jako racemická směs. Dva enantiomery pioglitazonu se vzájemně přeměňují in vivo. Nebyly nalezeny žádné rozdíly ve farmakologické aktivitě mezi těmito dvěma enantiomery. Strukturní vzorec je následující:
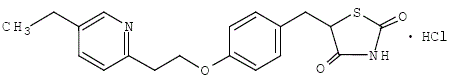
Pioglitazon hydrochlorid je bílý krystalický prášek bez zápachu, který má molekulární vzorec C19H20N2O3S•HCl a molekulovou hmotnost 392,90 daltonů. Je rozpustný v N,N-dimethylformamidu, těžce rozpustný v bezvodém ethanolu, velmi těžce rozpustný v acetonu a acetonitrilu, prakticky nerozpustný ve vodě a nerozpustný v etheru.
ACTOS je dostupný jako tableta pro perorální podání obsahující 15 mg, 30 mg nebo 45 mg pioglitazonu (jako báze) formulovaného s následujícími pomocnými látkami: laktos 30 mg monohydrát NF, hydroxypropylcelulóza NF, vápenatá sůl karboxymethylcelulózy NF a stearát hořečnatý NF.
INDIKACE
Monoterapie a kombinovaná terapie
ACTOS 30 mg je indikován jako doplněk k dietě a cvičení ke zlepšení kontroly glykémie u dospělých s diabetes mellitus 2. typu v různých klinických podmínkách (viz Klinické studie ].
Důležitá omezení použití
ACTOS 15 mg uplatňuje svůj antihyperglykemický účinek pouze v přítomnosti endogenního inzulínu. ACTOS 30 mg by se neměl používat k léčbě diabetu 1. typu nebo diabetické ketoacidózy, protože by v těchto podmínkách nebyl účinný.
Buďte opatrní u pacientů s onemocněním jater (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
DÁVKOVÁNÍ A PODÁVÁNÍ
Doporučení pro všechny pacienty
ACTOS 15 mg se má užívat jednou denně a lze jej užívat bez ohledu na jídlo.
Doporučená počáteční dávka pro pacienty bez městnavého srdečního selhání je 15 mg nebo 30 mg jednou denně.
Doporučená počáteční dávka pro pacienty s městnavým srdečním selháním (NYHA třída I nebo II) je 15 mg jednou denně.
Dávku lze titrovat v přírůstcích po 15 mg až na maximální dávku 45 mg jednou denně na základě glykemické odpovědi stanovené pomocí HbA1c.
Po zahájení léčby přípravkem ACTOS 30 mg nebo se zvýšením dávky pečlivě sledujte pacienty kvůli nežádoucím reakcím souvisejícím s retencí tekutin, jako je zvýšení tělesné hmotnosti, edém a známky a příznaky městnavého srdečního selhání (viz BOX VAROVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Před zahájením léčby přípravkem ACTOS by měly být provedeny jaterní testy (sérové alaninové a aspartátaminotransferázy, alkalická fosfatáza a celkový bilirubin). Rutinní pravidelné monitorování jaterních testů během léčby přípravkem ACTOS 30 mg se nedoporučuje u pacientů bez onemocnění jater. Pacienti, kteří mají abnormality jaterních testů před zahájením léčby ACTOS nebo kteří mají abnormální jaterní testy při užívání ACTOS, by měli být léčeni tak, jak je popsáno v části Upozornění a opatření [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
Současné užívání s inzulínovým sekretagogem nebo inzulínem
Pokud se hypoglykémie objeví u pacienta, kterému je současně podáván ACTOS 30 mg a sekretagog inzulinu (např. sulfonylurea), dávka sekretagogu inzulinu by měla být snížena.
Pokud se hypoglykémie objeví u pacienta, kterému byl současně podáván ACTOS 30 mg a inzulín, dávka inzulínu by měla být snížena o 10 % až 25 %. Další úpravy dávky inzulinu by měly být individualizovány na základě glykemické odpovědi.
Současné užívání se silnými inhibitory CYP2C8
Současné podávání ACTOS 30 mg a gemfibrozilu, silného inhibitoru CYP2C8, zvyšuje expozici pioglitazonu přibližně trojnásobně. Proto je maximální doporučená dávka ACTOS 15 mg denně, pokud se používá v kombinaci s gemfibrozilem nebo jinými silnými inhibitory CYP2C8 (viz DROGOVÉ INTERAKCE a KLINICKÁ FARMAKOLOGIE ].
JAK DODÁVÁNO
Dávkové formy A Síly
Kulatá tableta obsahuje pioglitazon takto:
- 15 mg: Bílá až téměř bílá, s vyraženým „ACTOS“ na jedné straně a „15“ na druhé
- 30 mg: Bílá až téměř bílá, s vyraženým „ACTOS“ na jedné straně a „30“ na druhé
- 45 mg: Bílá až téměř bílá, s vyraženým „ACTOS“ na jedné straně a „45“ na druhé
Skladování A Manipulace
ACTOS je k dispozici v 15 mg, 30 mg a 45 mg tabletách takto:
15 mg tableta : Bílé až téměř bílé, kulaté, konvexní tablety bez rýhy s „ACTOS“ na jedné straně a „15“ na druhé straně, dostupné v:
NDC 64764-151-04 Láhve po 30 NDC 64764-151-05 Láhve po 90 NDC 64764-151-06 Láhve po 500
30 mg tableta Bílé až téměř bílé, kulaté, ploché tablety bez rýhy s „ACTOS“ na jedné straně a „30“ na druhé straně, dostupné v:
NDC 64764-301-14 Láhve po 30 NDC 64764-301-15 Láhve po 90 NDC 64764-301-16 Láhve po 500
45 mg tableta : Bílé až téměř bílé, kulaté, ploché tablety bez rýhy s „ACTOS“ na jedné straně a „45“ na druhé straně, dostupné v:
NDC 64764-451-24 Láhve po 30 NDC 64764-451-25 Láhve po 90 NDC 64764-451-26 Láhve po 500
Úložný prostor
Skladujte při teplotě 25 °C (77 °F); povolené odchylky do 15-30°C (59-86°F) [viz USP Controlled Room Temperature]. Uchovávejte obal těsně uzavřený a chraňte před světlem, vlhkostí a vlhkostí.
Distribuce: Takeda Pharmaceuticals America, Inc. Deerfield, IL 60015. Revize: prosinec 2017
VEDLEJŠÍ EFEKTY
Následující závažné nežádoucí účinky jsou diskutovány jinde v označení:
- Městnavé srdeční selhání [viz BOX VAROVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Edém [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Zlomeniny [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Více než 8 500 pacientů s diabetem 2. typu bylo léčeno přípravkem ACTOS v randomizovaných, dvojitě zaslepených, kontrolovaných klinických studiích, včetně 2 605 pacientů s diabetem 2. typu a makrovaskulárním onemocněním léčených přípravkem ACTOS 30 mg v klinické studii PROactive. V těchto studiích bylo více než 6000 pacientů léčeno přípravkem ACTOS po dobu šesti měsíců nebo déle, více než 4500 pacientů bylo léčeno přípravkem ACTOS 15 mg po dobu jednoho roku nebo déle a více než 3000 pacientů bylo léčeno přípravkem ACTOS po dobu alespoň dvou let.
šesti shromážděných 16 až 26týdenních placebem kontrolovaných monoterapiích a 16 až 24týdenních studiích přídavné kombinované terapie byla incidence vysazení kvůli nežádoucím účinkům 4,5 % u pacientů léčených přípravkem ACTOS 30 mg a 5,8 % u srovnávacích léčených pacientů. Nejčastější nežádoucí příhody vedoucí k vysazení souvisely s nedostatečnou kontrolou glykémie, ačkoli výskyt těchto příhod byl nižší (1,5 %) u ACTOS 30 mg než u placeba (3,0 %).
Ve studii PROactive byla incidence vysazení z důvodu nežádoucích účinků 9,0 % u pacientů léčených přípravkem ACTOS 30 mg a 7,7 % u pacientů léčených placebem. Městnavé srdeční selhání bylo nejčastějším závažným nežádoucím účinkem vedoucím k vysazení, ke kterému došlo u 1,3 % pacientů léčených přípravkem ACTOS 30 mg a 0,6 % pacientů léčených placebem.
Časté nežádoucí příhody: 16 až 26týdenní monoterapeutické zkoušky
Souhrn výskytu a typu běžných nežádoucích účinků hlášených ve třech sdružených 16 až 26týdenních placebem kontrolovaných monoterapeutických studiích ACTOS je uveden v tabulce 1. Termíny, které jsou hlášeny, představují ty, které se vyskytly s incidencí > 5 % a častěji u pacientů léčených ACTOS 15 mg než u pacientů, kteří dostávali placebo. Žádná z těchto nežádoucích příhod nesouvisela s dávkou ACTOS.
Běžné nežádoucí příhody: Zkoušky přídavné kombinované terapie v délce 16 až 24 týdnů
Souhrn celkové incidence a typů běžných nežádoucích účinků hlášených ve studiích s přídavkem ACTOS k sulfonylmočovině je uveden v tabulce 2. Hlášené termíny představují ty, které se vyskytly s incidencí >5 % a častěji s nejvyšší testovanou dávku ACTOSu.
Souhrn celkové incidence a typů běžných nežádoucích účinků hlášených ve studiích s ACTOS 30 mg jako doplněk k metforminu je uveden v tabulce 3. Hlášené termíny představují ty, které se vyskytly s incidencí >5 % a častěji s nejvyšší testovaná dávka ACTOS.
Tabulka 4 shrnuje výskyt a typy běžných nežádoucích účinků hlášených ve studiích s přídavkem ACTOS k inzulínu. Pojmy, které jsou hlášeny, představují ty, které se vyskytly s výskytem > 5 % a častěji s nejvyšší testovanou dávkou ACTOS.
Souhrn celkové incidence a typů běžných nežádoucích účinků hlášených ve studii PROactive je uveden v tabulce 5. Uvedené termíny představují ty, které se vyskytly s incidencí > 5 % a častěji u pacientů léčených ACTOS než u pacientů, kteří dostávali placebo.
Městnavé srdeční selhání
Souhrn výskytu nežádoucích příhod souvisejících s městnavým srdečním selháním je uveden v tabulce 6 pro 16- až 24týdenní přídavnou léčbu ke sulfonylmočovině, pro 16 až 24týdenní přídavnou léčbu k inzulinovým studiím a pro 16 až 24týdenní přídavek ke studiím s metforminem. Žádná z událostí nebyla smrtelná.
Pacienti s diabetem 2. typu a městnavým srdečním selháním NYHA třídy II nebo časné třídy III byli randomizováni k 24týdenní dvojitě zaslepené léčbě buď ACTOS 30 mg v denních dávkách 30 mg až 45 mg (n=262) nebo glyburidem v denních dávkách 10 mg až 15 mg (n=256). Souhrn výskytu nežádoucích příhod souvisejících s městnavým srdečním selháním hlášených v této studii je uveden v tabulce 7.
Události městnavého srdečního selhání vedoucí k hospitalizaci, ke kterým došlo během studie PROactive, jsou shrnuty v tabulce 8.
Kardiovaskulární bezpečnost
Ve studii PROactive bylo 5 238 pacientů s diabetem 2. typu a makrovaskulárním onemocněním v anamnéze randomizováno k léčbě ACTOS (N=2605), nuceně titrované až na 45 mg denně nebo placebem (N=2633) navíc ke standardní péči. Téměř všichni pacienti (95 %) užívali kardiovaskulární medikaci (betablokátory, ACE inhibitory, blokátory receptorů angiotenzinu II, blokátory kalciových kanálů, nitráty, diuretika, aspirin, statiny a fibráty). Na začátku měli pacienti průměrný věk 62 let, průměrnou dobu trvání diabetu 9,5 roku a průměrný HbA1c 8,1 %. Průměrná doba sledování byla 34,5 měsíce. Primárním cílem této studie bylo prozkoumat účinek ACTOS na mortalitu a makrovaskulární morbiditu u pacientů s diabetes mellitus 2. typu, kteří byli ve vysokém riziku makrovaskulárních příhod. Primární proměnnou účinnosti byla doba do prvního výskytu jakékoli příhody v kardiovaskulárním kompozitním cílovém parametru, který zahrnoval mortalitu ze všech příčin, nefatální infarkt myokardu (MI) včetně tichého IM, cévní mozkovou příhodu, akutní koronární syndrom, srdeční intervenci včetně bypassu koronární tepny nebo perkutánní intervence, velká amputace nohy nad kotníkem a bypass nebo revaskularizace v noze. Celkem 514 (19,7 %) pacientů léčených přípravkem ACTOS 15 mg a 572 (21,7 %) pacientů léčených placebem zaznamenalo alespoň jednu příhodu z primárního složeného cílového parametru (poměr rizika 0,90; 95% interval spolehlivosti: 0,80, 1,02; p=0,10 ).
Ačkoli nebyl statisticky významný rozdíl mezi ACTOS a placebem v tříleté incidenci první příhody v tomto kompozitu, nedošlo u ACTOS ke zvýšení mortality nebo celkových makrovaskulárních příhod. Počet prvních výskytů a celkový počet jednotlivých příhod přispívajících k primárnímu složenému cílovému bodu je uveden v tabulce 9.
Přibývání na váze
Při užívání přípravku ACTOS 30 mg samostatně nebo v kombinaci s jinými antidiabetiky dochází k nárůstu hmotnosti v závislosti na dávce. Mechanismus nárůstu hmotnosti je nejasný, ale pravděpodobně zahrnuje kombinaci zadržování tekutin a hromadění tuku.
Tabulky 10 a 11 shrnují změny tělesné hmotnosti s ACTOS a placebem v 16 až 26týdenní randomizované, dvojitě zaslepené monoterapii a 16 až 24týdenní kombinované studii s přídavnou terapií a ve studii PROactive.
Otok
Edém vyvolaný užíváním ACTOS je reverzibilní, když je ACTOS vysazen. Edém obvykle nevyžaduje hospitalizaci, pokud není současně přítomno městnavé srdeční selhání. Souhrn frekvence a typů nežádoucích účinků otoku vyskytujících se v klinických studiích přípravku ACTOS 30 mg je uveden v tabulce 12.
Účinky na játra
databázi kontrolovaných klinických studií ACTOS nebyly dosud žádné důkazy o indukované hepatotoxicitě s ACTOS. Jedna randomizovaná, dvojitě zaslepená 3letá studie srovnávající ACTOS 15 mg s glyburidem jako doplněk k metforminu a inzulínové terapii byla speciálně navržena tak, aby vyhodnotila výskyt zvýšení sérové ALT na více než trojnásobek horní hranice referenčního rozmezí, měřeno každých osm týdnů během prvních 48 týdnů studie a poté každých 12 týdnů. Celkem u 3/1051 (0,3 %) pacientů léčených ACTOS a 9/1046 (0,9 %) pacientů léčených glyburidem se vyvinuly hodnoty ALT vyšší než trojnásobek horní hranice referenčního rozmezí. Žádný z pacientů léčených ACTOS v databázi kontrolovaných klinických studií ACTOS dosud neměl sérovou ALT vyšší než trojnásobek horní hranice referenčního rozmezí a odpovídající celkový bilirubin vyšší než dvojnásobek horní hranice referenčního rozmezí, a kombinace predikující potenciál pro závažné poškození jater vyvolané léky.
Hypoglykémie
V klinických studiích ACTOS 15 mg byly hlášeny nežádoucí účinky hypoglykémie na základě klinického posouzení zkoušejících a nevyžadovaly potvrzení testem glukózy z prstu.
V 16týdenní studii s přídavkem k léčbě sulfonylureou byla incidence hlášené hypoglykémie 3,7 % u ACTOS 30 mg a 0,5 % u placeba. V 16týdenní přídavné studii s inzulínem byla incidence hlášené hypoglykémie 7,9 % u ACTOS 15 mg, 15,4 % u ACTOS 30 mg a 4,8 % u placeba.
Incidence hlášené hypoglykémie byla vyšší u ACTOS 45 mg ve srovnání s ACTOS 30 mg jak ve 24týdenní studii s přídavkem k sulfonylmočovině (15,7 % vs. 13,4 %), tak ve 24týdenní studii s přídavkem k inzulínu (47,8 % oproti 43,5 %).
Tři pacienti v těchto čtyřech studiích byli hospitalizováni kvůli hypoglykémii. Všichni tři pacienti dostávali ACTOS 30 mg (0,9 %) v rámci 24týdenní přídavné léčby k inzulinové studii. Dalších 14 pacientů uvádělo těžkou hypoglykémii (definovanou jako způsobující značnou interferenci s obvyklými aktivitami pacienta), která nevyžadovala hospitalizaci. Tito pacienti dostávali ACTOS 45 mg v kombinaci se sulfonylureou (n=2) nebo ACTOS 30 mg nebo 45 mg v kombinaci s inzulínem (n=12).
Nádory močového měchýře
Nádory byly pozorovány v močovém měchýři samců potkanů ve dvouleté studii karcinogenity [viz Neklinická toxikologie ]. Během tříleté klinické studie PROactive byla u 14 pacientů z 2 605 (0,54 %) randomizovaných na ACTOS a u 5 z 2 633 (0,19 %) randomizovaných na placebo diagnostikována rakovina močového měchýře. Po vyloučení pacientů, u kterých byla expozice studovanému léku méně než jeden rok v době diagnózy rakoviny močového měchýře, bylo 6 (0,23 %) případů na ACTOS 15 mg a dva (0,08 %) případy na placebu. Po dokončení studie byla pozorována velká podskupina pacientů po dobu až 10 dalších let, s malou další expozicí ACTOS. Během 13 let PROaktivního i observačního sledování se výskyt rakoviny močového měchýře nelišil mezi pacienty randomizovanými k ACTOS nebo placebu (HR = 1,00; 95% CI: 0,59-1,72) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Laboratorní abnormality
Hematologické účinky
ACTOS 15 mg může způsobit snížení hemoglobinu a hematokritu. V placebem kontrolovaných monoterapeutických studiích se průměrné hodnoty hemoglobinu snížily o 2 % až 4 % u pacientů léčených přípravkem ACTOS ve srovnání s průměrnou změnou hemoglobinu o -1 % až +1 % u pacientů léčených placebem. Tyto změny se primárně vyskytly během prvních 4 až 12 týdnů léčby a poté zůstaly relativně konstantní. Tyto změny mohou souviset se zvýšeným objemem plazmy spojeným s léčbou ACTOS 30 mg a pravděpodobně nebudou spojeny s žádnými klinicky významnými hematologickými účinky.
Kreatinfosfokináza
Během protokolem specifikovaného měření sérové kreatinfosfokinázy (CPK) v klinických studiích ACTOS 15 mg bylo pozorováno izolované zvýšení CPK na více než 10násobek horní hranice referenčního rozmezí u devíti (0,2 %) pacientů léčených ACTOS (hodnoty 2150 až 11400 IU/l) a u pacientů neléčených žádným komparátorem. Šest z těchto devíti pacientů pokračovalo v podávání ACTOS 15 mg, u dvou pacientů bylo zaznamenáno zvýšení CPK v poslední den podávání a jeden pacient kvůli zvýšení přerušil ACTOS. Tato zvýšení odezněla bez zjevných klinických následků. Vztah těchto příhod k léčbě přípravkem ACTOS 30 mg není znám.
Postmarketingové zkušenosti
Následující nežádoucí účinky byly identifikovány během používání ACTOS po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není obecně možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
- Nový vznik nebo zhoršení diabetického makulárního edému se sníženou zrakovou ostrostí [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Fatální a nefatální selhání jater [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Postmarketingové zprávy o městnavém srdečním selhání byly hlášeny u pacientů léčených přípravkem ACTOS, a to jak s dříve známým srdečním onemocněním, tak bez něj a jak se současným podáváním inzulínu, tak bez něj.
V postmarketingových zkušenostech byly hlášeny neobvykle rychlé nárůsty hmotnosti a nárůsty přesahující to, co bylo obecně pozorováno v klinických studiích. Pacienti, u kterých se takové zvýšení objeví, by měli být vyšetřeni na hromadění tekutin a události související s objemem, jako je nadměrný edém a městnavé srdeční selhání (viz BOX VAROVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
DROGOVÉ INTERAKCE
Silné inhibitory CYP2C8
Inhibitor CYP2C8 (např. gemfibrozil) významně zvyšuje expozici (plocha pod křivkou sérové koncentrace-čas nebo AUC) a poločas (t½) pioglitazonu. Proto je maximální doporučená dávka ACTOS 15 mg denně, pokud se používá v kombinaci s gemfibrozilem nebo jinými silnými inhibitory CYP2C8 (viz DÁVKOVÁNÍ A PODÁVÁNÍ a KLINICKÁ FARMAKOLOGIE ].
Induktory CYP2C8
Induktor CYP2C8 (např. rifampin) může významně snížit expozici (AUC) pioglitazonu. Pokud je tedy induktor CYP2C8 zahájen nebo zastaven během léčby ACTOS 30 mg, mohou být nutné změny v léčbě diabetu na základě klinické odpovědi bez překročení maximální doporučené denní dávky 45 mg pro ACTOS [viz KLINICKÁ FARMAKOLOGIE ].
topiramát
Při současném podávání pioglitazonu a topiramátu bylo zaznamenáno snížení expozice pioglitazonu a jeho aktivních metabolitů (viz KLINICKÁ FARMAKOLOGIE ]. Klinický význam tohoto poklesu není znám; pokud se však ACTOS a topiramát užívají současně, sledujte pacienty kvůli adekvátní kontrole glykémie.
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Městnavé srdeční selhání
ACTOS 15 mg, stejně jako jiné thiazolidindiony, může způsobit retenci tekutin v závislosti na dávce, pokud se používá samostatně nebo v kombinaci s jinými antidiabetiky a je nejčastější, když se ACTOS 30 mg používá v kombinaci s inzulínem. Zadržování tekutin může vést nebo zhoršit městnavé srdeční selhání. U pacientů je třeba sledovat známky a příznaky městnavého srdečního selhání. Pokud se vyvine městnavé srdeční selhání, mělo by být řízeno podle současných standardů péče a je třeba zvážit přerušení nebo snížení dávky ACTOS (viz BOX VAROVÁNÍ , KONTRAINDIKACE , a NEŽÁDOUCÍ REAKCE ].
Hypoglykémie
Pacienti užívající ACTOS v kombinaci s inzulínem nebo jinými antidiabetiky (zejména sekretagogy inzulínu, jako jsou sulfonylmočoviny) mohou být ohroženi hypoglykémií. Ke snížení rizika hypoglykémie může být nezbytné snížení dávky souběžně podávané antidiabetické medikace (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Účinky na játra
Po uvedení přípravku na trh byly hlášeny fatální a nefatální jaterní selhání u pacientů užívajících ACTOS 15 mg, ačkoli tyto zprávy neobsahují dostatečné informace potřebné ke stanovení pravděpodobné příčiny. V databázi kontrolovaných klinických studií ACTOS 30 mg dosud nebyly žádné důkazy o hepatotoxicitě vyvolané léky [viz NEŽÁDOUCÍ REAKCE ].
Pacienti s diabetem 2. typu mohou trpět tukovým onemocněním jater nebo srdečním onemocněním s epizodickým městnavým srdečním selháním, které mohou oba způsobit abnormality jaterních testů, a mohou mít také jiné formy onemocnění jater, z nichž mnohé lze léčit nebo zvládat. Proto se před zahájením léčby přípravkem ACTOS doporučuje získání panelu jaterních testů (sérová alaninaminotransferáza [ALT], aspartátaminotransferáza [AST], alkalická fosfatáza a celkový bilirubin) a posouzení pacienta. U pacientů s abnormálními jaterními testy by měla být léčba přípravkem ACTOS 15 mg zahájena s opatrností.
Okamžitě změřte jaterní testy u pacientů, kteří hlásí příznaky, které mohou naznačovat poškození jater, včetně únavy, anorexie, diskomfortu v pravé horní části břicha, tmavé moči nebo žloutenky. V tomto klinickém kontextu, pokud se u pacienta zjistí abnormální jaterní testy (ALT vyšší než 3násobek horní hranice referenčního rozmezí), léčba přípravkem ACTOS 15 mg by měla být přerušena a měla by být provedena vyšetření ke stanovení pravděpodobné příčiny. ACTOS by u těchto pacientů neměl být znovu zahájen bez dalšího vysvětlení abnormalit jaterních testů.
Pacienti, kteří mají sérovou ALT vyšší než trojnásobek referenčního rozmezí s celkovým bilirubinem v séru vyšším než dvojnásobek referenčního rozmezí bez alternativní etiologie, jsou ohroženi závažným poškozením jater vyvolaným léky a neměli by znovu zahájit léčbu ACTOS. U pacientů s menším zvýšením sérové ALT nebo bilirubinu a s alternativní pravděpodobnou příčinou lze léčbu přípravkem ACTOS používat opatrně.
Nádory močového měchýře
Nádory byly pozorovány v močovém měchýři samců potkanů ve dvouleté studii karcinogenity [viz Neklinická toxikologie ]. Kromě toho během tříleté klinické studie PROactive byla u 14 pacientů z 2 605 (0,54 %) randomizovaných na ACTOS 15 mg au 5 z 2 633 (0,19 %) randomizovaných na placebo diagnostikována rakovina močového měchýře. Po vyloučení pacientů, u kterých byla expozice studovanému léku méně než jeden rok v době diagnózy rakoviny močového měchýře, bylo 6 (0,23 %) případů na ACTOS 30 mg a dva (0,08 %) případy na placebu. Po dokončení studie byla pozorována velká podskupina pacientů po dobu až 10 dalších let, s malou další expozicí ACTOS. Během 13 let PROaktivního i observačního sledování se výskyt karcinomu močového měchýře nelišil mezi pacienty randomizovanými k ACTOS 30 mg nebo placebu (HR = 1,00; [95% CI: 0,59-1,72]).
Nálezy týkající se rizika rakoviny močového měchýře u pacientů vystavených ACTOS se mezi observačními studiemi liší; někteří nezjistili zvýšené riziko rakoviny močového měchýře spojené s ACTOS 30 mg, zatímco jiní ano.
Velká prospektivní 10letá observační kohortová studie provedená ve Spojených státech nezjistila žádné statisticky významné zvýšení rizika rakoviny močového měchýře u diabetických pacientů, kteří kdy byli vystaveni ACTOS, ve srovnání s těmi, kteří nikdy nebyli vystaveni ACTOS (HR = 1,06 [95% CI 0,89-1,26 ]).
Retrospektivní kohortová studie provedená s údaji ze Spojeného království zjistila statisticky významnou souvislost mezi jakoukoli expozicí ACTOS a rakovinou močového měchýře (HR: 1,63; [95% CI: 1,22–2,19]).
Asociace mezi kumulativní dávkou nebo kumulativní délkou expozice ACTOS 15 mg a rakovinou močového měchýře nebyly v některých studiích včetně 10leté observační studie v USA detekovány, ale v jiných byly. Nekonzistentní zjištění a omezení obsažená v těchto a dalších studiích znemožňují přesvědčivé interpretace pozorovaných dat.
ACTOS může být spojen se zvýšením rizika nádorů močového měchýře. Nejsou k dispozici dostatečné údaje ke stanovení, zda je pioglitazon promotorem nádorů močového měchýře.
V důsledku toho by ACTOS neměl být používán u pacientů s aktivním karcinomem močového měchýře a u pacientů s předchozí anamnézou karcinomu močového měchýře by měly být zváženy přínosy kontroly glykémie oproti neznámým rizikům recidivy karcinomu u ACTOS.
Otok
V kontrolovaných klinických studiích byl edém hlášen častěji u pacientů léčených ACTOS 30 mg než u pacientů léčených placebem a je závislý na dávce (viz NEŽÁDOUCÍ REAKCE ]. Po uvedení přípravku na trh byly obdrženy zprávy o nově vzniklém nebo zhoršujícím se edému.
ACTOS 15 mg by měl být používán s opatrností u pacientů s edémem. Vzhledem k tomu, že thiazolidindiony, včetně ACTOS, mohou způsobit zadržování tekutin, což může zhoršit městnavé srdeční selhání nebo k němu vést, měl by být ACTOS 30 mg používán s opatrností u pacientů s rizikem městnavého srdečního selhání. Pacienti léčení přípravkem ACTOS by měli být sledováni na známky a příznaky městnavého srdečního selhání (viz BOX VAROVÁNÍ , Městnavé srdeční selhání a INFORMACE PRO PACIENTA ].
Zlomeniny
PROactive (Prospective Pioglitazone Clinical Trial in Macrovascular Events) bylo 5 238 pacientů s diabetem 2. typu a s makrovaskulárním onemocněním v anamnéze randomizováno k ACTOS (N=2605), titrovaným silou až do 45 mg denně nebo placebem (N=2633). kromě standardní péče. Během průměrné doby sledování 34,5 měsíce byla incidence zlomenin kostí u žen 5,1 % (44/870) u ACTOS 30 mg oproti 2,5 % (23/905) u placeba. Tento rozdíl byl zaznamenán po prvním roce léčby a přetrvával v průběhu studie. Většina zlomenin pozorovaných u pacientek byly nevertebrální zlomeniny včetně dolní končetiny a distální horní končetiny. U mužů léčených přípravkem ACTOS (1,7 %) oproti placebu (2,1 %) nebylo pozorováno žádné zvýšení výskytu zlomenin. Při péči o pacienty, zejména pacientky léčené přípravkem ACTOS, je třeba vzít v úvahu riziko zlomeniny a věnovat pozornost hodnocení a udržování zdraví kostí podle současných standardů péče.
Makulární edém
Makulární edém byl hlášen po uvedení přípravku na trh u diabetických pacientů, kteří užívali ACTOS nebo jiný thiazolidindion. Někteří pacienti měli rozmazané vidění nebo sníženou zrakovou ostrost, ale jiní byli diagnostikováni při rutinním oftalmologickém vyšetření.
Většina pacientů měla periferní edém v době, kdy byl diagnostikován makulární edém. U některých pacientů došlo po vysazení thiazolidindionu ke zlepšení makulárního edému.
Pacienti s diabetem by měli mít pravidelné oční prohlídky u oftalmologa podle současných standardů péče. Pacienti s diabetem, kteří hlásí jakékoli zrakové příznaky, by měli být okamžitě odesláni k oftalmologovi, bez ohledu na pacientovu základní léčbu nebo jiné fyzické nálezy [viz NEŽÁDOUCÍ REAKCE ].
Makrovaskulární výsledky
Nebyly provedeny žádné klinické studie prokazující přesvědčivé důkazy o snížení makrovaskulárního rizika u přípravku ACTOS.
Informace pro pacienty
Viz označení pacientů schválené FDA ( INFORMACE PRO PACIENTA ).
- Je důležité poučit pacienty, aby dodržovali dietní pokyny a aby si pravidelně nechali testovat glykémii a glykosylovaný hemoglobin. Během období stresu, jako je horečka, trauma, infekce nebo operace, se mohou požadavky na léky změnit a pacienti by měli být upozorněni, aby okamžitě vyhledali lékařskou pomoc.
- Pacienti, u kterých se během léčby přípravkem ACTOS objeví neobvykle rychlý nárůst hmotnosti nebo otoky nebo se u nich rozvine dušnost nebo jiné příznaky srdečního selhání, by měli tyto příznaky okamžitě hlásit lékaři.
- Řekněte pacientům, aby okamžitě přestali užívat ACTOS a okamžitě vyhledali lékařskou pomoc, pokud se objeví nevysvětlitelná nevolnost, zvracení, bolest břicha, únava, anorexie nebo tmavá moč, protože tyto příznaky mohou být způsobeny hepatotoxicitou.
- Informujte pacienty, aby okamžitě hlásili jakékoli známky makroskopické hematurie nebo jiné příznaky, jako je dysurie nebo nucení na močení, které se vyvinou nebo zvýší během léčby, protože mohou být způsobeny rakovinou močového měchýře.
- Řekněte pacientům, aby užívali ACTOS 15 mg jednou denně. ACTOS 15 mg lze užívat s jídlem nebo bez jídla. Pokud dojde k vynechání dávky jeden den, dávka by se následující den neměla zdvojnásobovat.
- Při použití kombinované terapie s inzulínem nebo jinými antidiabetiky je třeba pacientům a jejich rodinným příslušníkům vysvětlit rizika hypoglykémie, její příznaky a léčbu a stavy, které k jejímu rozvoji predisponují.
- Informujte pacientky, že léčba přípravkem ACTOS 30 mg, stejně jako jiné thiazolidindiony, může u některých premenopauzálních anovulačních žen vést k nechtěnému těhotenství kvůli jeho účinku na ovulaci [viz Použití u konkrétních populací ].
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Dvouletá studie karcinogenity byla provedena u samců a samic potkanů při perorálních dávkách až 63 mg/kg (přibližně 14násobek maximální doporučené perorální dávky pro člověka 45 mg na základě mg/m2). Nádory vyvolané léčivy nebyly pozorovány v žádném orgánu kromě močového měchýře samců potkanů. U samců potkanů při dávce 4 mg/kg/den a vyšší byly pozorovány benigní a/nebo maligní novotvary přechodných buněk (přibližně rovné maximální doporučené perorální dávce u člověka založené na mg/m2). Močové kameny s následným podrážděním a hyperplazií byly postulovány jako mechanismus pro nádory močového měchýře pozorované u samců potkanů. V roce 2009 byla dokončena dvouletá mechanická studie u samců potkanů využívající acidifikaci potravy ke snížení tvorby zubního kamene. Dietní acidifikace se snížila, ale nezrušila hyperplastické změny v močovém měchýři. Přítomnost kamenů exacerbovala hyperplastickou odpověď na pioglitazon, ale nebyla považována za primární příčinu hyperplastických změn.
Relevanci nálezů v močovém měchýři u samců potkanů pro člověka nelze vyloučit.
Dvouletá studie karcinogenity byla také provedena u samců a samic myší při perorálních dávkách až 100 mg/kg/den (přibližně 11násobek maximální doporučené perorální dávky u lidí na základě mg/m2). V žádném orgánu nebyly pozorovány žádné nádory vyvolané léky.
Pioglitazon hydrochlorid nebyl mutagenní v řadě studií genetické toxikologie, včetně Amesova bakteriálního testu, testu přímé genové mutace savčích buněk (CHO/HPRT a AS52/XPRT), cytogenetického testu in vitro využívajícího buňky CHL, neplánovaného testu syntézy DNA a in vivo mikronukleární test.
U samců a samic potkanů nebyly pozorovány žádné nežádoucí účinky na fertilitu při perorálních dávkách až 40 mg/kg pioglitazonu hydrochloridu denně před pářením a během březosti (přibližně devítinásobek maximální doporučené perorální dávky u lidí na základě mg/m2).
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
Omezené údaje o přípravku ACTOS u těhotných žen nejsou dostatečné pro stanovení rizika závažných vrozených vad nebo potratu spojeného s užíváním léků. Existují rizika pro matku a plod spojená se špatně kontrolovaným diabetem v těhotenství [viz Klinické úvahy ].
V reprodukčních studiích na zvířatech nebyly pozorovány žádné nežádoucí vývojové účinky, když byl pioglitazon podáván březím potkanům a králíkům během organogeneze v expozicích až 5- a 35násobku klinické dávky 45 mg, v daném pořadí, na základě tělesného povrchu [viz Data ].
Odhadované základní riziko závažných vrozených vad je 6-10 % u žen s pregestačním diabetem s HbA1c >7 a bylo hlášeno, že je až 20-25 % u žen s HbA1c >10. Odhadované základní riziko potratu pro indikovanou populaci není známo. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2–4 % a 15–20 %.
Klinické úvahy
Mateřské a/nebo embryo/fetální riziko spojené s onemocněním
Špatně kontrolovaný diabetes v těhotenství zvyšuje u matky riziko diabetické ketoacidózy, preeklampsie, spontánních potratů, předčasného porodu, mrtvého porodu a porodních komplikací. Špatně kontrolovaný diabetes zvyšuje u plodu riziko závažných vrozených vad, mrtvě narozených dětí a morbidity související s makrosomií.
Data
Údaje o zvířatech
Pioglitazon podávaný březím potkanům během organogeneze nezpůsobil nepříznivé vývojové účinky v dávce 20 mg/kg (~5násobek klinické dávky 45 mg), ale zpomalil porod a snížil embryofetální životaschopnost při dávkách 40 a 80 mg/kg nebo ≥ 9násobek klinické dávky 45 mg, podle plochy povrchu těla. U březích králíků, kterým byl během organogeneze podáván pioglitazon, nebyly pozorovány žádné nežádoucí účinky na vývoj při dávce 80 mg/kg (~35násobek klinické dávky 45 mg), ale snížená embryofetální životaschopnost při dávce 160 mg/kg nebo ~69násobek klinické dávky 45 mg dávka, podle tělesného povrchu. Když březí potkaní samy dostávaly pioglitazon během pozdní březosti a laktace, došlo u potomků při dávkách matek 10 mg/kg a vyšších nebo ≥2násobku klinické dávky 45 mg podle plochy tělesného povrchu k opožděnému postnatálnímu vývoji přisuzovanému snížené tělesné hmotnosti.
Laktace
Shrnutí rizik
Neexistují žádné informace týkající se přítomnosti pioglitazonu v mateřském mléce, účinků na kojené dítě nebo účinků na produkci mléka. Pioglitazon je přítomen v mléce potkanů; vzhledem k druhově specifickým rozdílům ve fyziologii laktace však údaje na zvířatech nemohou spolehlivě předpovědět hladiny léčiva v lidském mléce. Je třeba zvážit vývojové a zdravotní přínosy kojení spolu s klinickou potřebou matky ACTOS 15 mg a veškerými potenciálními nežádoucími účinky na kojené dítě z ACTOS 30 mg nebo ze základního stavu matky.
Ženy a muži reprodukčního potenciálu
Diskutujte o možnosti nechtěného těhotenství u premenopauzálních žen, protože léčba přípravkem ACTOS, stejně jako jiné thiazolidindiony, může u některých žen s anovulací vést k ovulaci.
Pediatrické použití
Bezpečnost a účinnost přípravku ACTOS u pediatrických pacientů nebyla stanovena.
ACTOS 15 mg se nedoporučuje používat u pediatrických pacientů na základě nežádoucích účinků pozorovaných u dospělých, včetně retence tekutin a městnavého srdečního selhání, zlomenin a nádorů močového měchýře (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Geriatrické použití
Celkem 92 pacientů (15,2 %) léčených přípravkem ACTOS ve třech spojených 16 až 26týdenních dvojitě zaslepených, placebem kontrolovaných studiích s monoterapií bylo ve věku ≥ 65 let a dva pacienti (0,3 %) byli ve věku ≥ 75 let. Ve dvou sdružených 16 až 24týdenních přídavných studiích se sulfonylmočovinou bylo 201 pacientů (18,7 %) léčených přípravkem ACTOS 30 mg ve věku ≥ 65 let a 19 (1,8 %) bylo ve věku ≥ 75 let. Ve dvou sdružených 16 až 24týdenních přídavných studiích k metforminu bylo 155 pacientů (15,5 %) léčených přípravkem ACTOS ve věku ≥ 65 let a 19 (1,9 %) bylo ve věku ≥ 75 let. Ve dvou sdružených 16 až 24týdenních přídavných studiích k inzulínu bylo 272 pacientů (25,4 %) léčených přípravkem ACTOS ve věku ≥ 65 let a 22 (2,1 %) bylo ve věku ≥ 75 let.
Ve studii PROactive bylo 1068 pacientů (41,0 %) léčených přípravkem ACTOS ve věku ≥ 65 let a 42 (1,6 %) bylo ve věku ≥ 75 let.
Ve farmakokinetických studiích s pioglitazonem nebyly pozorovány žádné významné rozdíly ve farmakokinetických parametrech mezi staršími a mladšími pacienty (viz KLINICKÁ FARMAKOLOGIE ].
Přestože klinické zkušenosti neidentifikovaly rozdíly v účinnosti a bezpečnosti mezi staršími (≥65 let) a mladšími pacienty, tyto závěry jsou omezeny malou velikostí vzorků u pacientů ve věku ≥75 let.
PŘEDÁVKOVAT
Během kontrolovaných klinických studií byl hlášen jeden případ předávkování přípravkem ACTOS 30 mg. Mužský pacient užíval 120 mg denně po dobu čtyř dnů, poté 180 mg denně po dobu sedmi dnů. Pacient v tomto období popíral jakékoli klinické příznaky.
V případě předávkování by měla být zahájena vhodná podpůrná léčba podle klinických známek a symptomů pacienta.
KONTRAINDIKACE
- Zahájení u pacientů s prokázaným srdečním selháním NYHA třídy III nebo IV [viz BOX VAROVÁNÍ ].
- Použití u pacientů se známou přecitlivělostí na pioglitazon nebo jakoukoli jinou složku přípravku ACTOS.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
ACTOS 15 mg je thiazolidindion, jehož mechanismus účinku závisí na přítomnosti inzulinu. ACTOS snižuje inzulínovou rezistenci na periferii a v játrech, což má za následek zvýšenou na inzulínu závislou likvidaci glukózy a sníženou produkci glukózy v játrech. Pioglitazon není sekretagog inzulinu. Pioglitazon je agonista receptoru gama aktivovaného peroxisomovým proliferátorem (PPARy). Receptory PPAR se nacházejí ve tkáních důležitých pro působení inzulínu, jako je tuková tkáň, kosterní sval a játra. Aktivace PPAR? nukleární receptory modulují transkripci řady genů reagujících na inzulín, které se účastní řízení metabolismu glukózy a lipidů.
Na zvířecích modelech diabetu pioglitazon snižuje hyperglykémii, hyperinzulinémii a hypertriglyceridémii charakteristickou pro stavy rezistentní na inzulín, jako je diabetes 2. typu. Metabolické změny vyvolané pioglitazonem vedou ke zvýšené citlivosti tkání závislých na inzulínu a jsou pozorovány na mnoha zvířecích modelech inzulínové rezistence.
Protože pioglitazon zesiluje účinky cirkulujícího inzulínu (snižováním inzulínové rezistence), nesnižuje hladinu glukózy v krvi u zvířecích modelů, které nemají endogenní inzulín.
Farmakodynamika
Klinické studie ukazují, že ACTOS 15 mg zlepšuje citlivost na inzulín u pacientů s rezistencí na inzulín. ACTOS zvyšuje buněčnou odezvu na inzulín, zvyšuje na inzulínu závislou likvidaci glukózy a zlepšuje citlivost jater na inzulín. U pacientů s diabetem 2. typu vede snížená inzulinová rezistence způsobená ACTOS k nižším plazmatickým koncentracím glukózy, nižším plazmatickým koncentracím inzulinu a nižším hodnotám HbA1c. V kontrolovaných klinických studiích měl ACTOS při použití v kombinaci se sulfonylureou, metforminem nebo inzulínem aditivní účinek na kontrolu glykémie (viz Klinické studie ].
Pacienti s lipidovými abnormalitami byli zařazeni do klinických studií s ACTOS. Celkově měli pacienti léčení ACTOS 15 mg průměrné snížení sérových triglyceridů, průměrné zvýšení HDL cholesterolu a žádné konzistentní průměrné změny LDL a celkového cholesterolu. Neexistují žádné přesvědčivé důkazy o makrovaskulárním přínosu přípravku ACTOS [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a NEŽÁDOUCÍ REAKCE ].
Ve 26týdenní, placebem kontrolované monoterapeutické studii s rozmezím dávek se průměrné sérové triglyceridy snížily ve skupinách s dávkou 15 mg, 30 mg a 45 mg ACTOS 15 mg ve srovnání s průměrným zvýšením ve skupině s placebem. Průměrný HDL cholesterol se zvýšil ve větší míře u pacientů léčených ACTOS 30 mg než u pacientů léčených placebem. U pacientů léčených přípravkem ACTOS ve srovnání s placebem nebyly žádné konzistentní rozdíly pro LDL a celkový cholesterol (viz tabulka 14).
Ve dvou dalších studiích monoterapie (16 týdnů a 24 týdnů) a ve studiích kombinované terapie se sulfonylureou (16 týdnů a 24 týdnů), metforminem (16 týdnů a 24 týdnů) nebo inzulinem (16 týdnů a 24 týdnů) byly výsledky obecně v souladu s výše uvedenými údaji.
Farmakokinetika
Po podávání ACTOS 15 mg jednou denně je ustálených sérových koncentrací jak pioglitazonu, tak jeho hlavních aktivních metabolitů, M-III (ketoderivát pioglitazonu) a M-IV (hydroxylový derivát pioglitazonu), dosaženo během sedmi dnů. V ustáleném stavu dosahují M-III a M-IV sérové koncentrace stejné nebo vyšší než koncentrace pioglitazonu. V ustáleném stavu u zdravých dobrovolníků i pacientů s diabetem 2. typu tvoří pioglitazon přibližně 30 % až 50 % maximálních celkových sérových koncentrací pioglitazonu (pioglitazon plus aktivní metabolity) a 20 % až 25 % celkové AUC.
Cmax, AUC a minimální sérové koncentrace (Cmin) pro pioglitazon a M-III a M-IV se zvyšovaly úměrně s podávanými dávkami 15 mg a 30 mg denně.
Vstřebávání
Po perorálním podání pioglitazonu byla Tmax pioglitazonu do dvou hodin. Jídlo prodlužuje Tmax na tři až čtyři hodiny, ale nemění rozsah absorpce (AUC).
Rozdělení
Průměrný zdánlivý distribuční objem (Vd/F) pioglitazonu po jednorázovém podání je 0,63 ± 0,41 (průměr ± SD) l/kg tělesné hmotnosti. Pioglitazon se v lidském séru rozsáhle váže na proteiny (>99 %), především na sérový albumin. Pioglitazon se také váže na jiné sérové proteiny, ale s nižší afinitou. M-III a M-IV jsou také značně vázány (>98 %) na sérový albumin.
Metabolismus
Pioglitazon je rozsáhle metabolizován hydroxylací a oxidací; metabolity se také částečně přeměňují na glukuronidové nebo sulfátové konjugáty. Metabolity M-III a M-IV jsou hlavními cirkulujícími aktivními metabolity u lidí.
Údaje in vitro ukazují, že na metabolismu pioglitazonu se podílí více izoforem CYP, které zahrnují CYP2C8 a v menší míře CYP3A4 s dodatečným přispěním řady dalších izoforem, včetně převážně extrahepatálního CYP1A1. In vivo studie pioglitazonu v kombinaci s gemfibrozilem, silným inhibitorem CYP2C8, ukázala, že pioglitazon je substrátem CYP2C8 (viz DÁVKOVÁNÍ A PODÁVÁNÍ a DROGOVÉ INTERAKCE ]. Poměry 6β-hydroxykortizol/kortizol v moči měřené u pacientů léčených přípravkem ACTOS 30 mg ukázaly, že pioglitazon není silným induktorem enzymu CYP3A4.
Vylučování A Eliminace
Po perorálním podání se přibližně 15 % až 30 % dávky pioglitazonu objeví v moči. Renální eliminace pioglitazonu je zanedbatelná a léčivo je vylučováno primárně jako metabolity a jejich konjugáty. Předpokládá se, že většina perorální dávky je vylučována do žluči buď nezměněná, nebo jako metabolity a vyloučena stolicí.
Průměrný sérový poločas (t1/2) pioglitazonu a jeho metabolitů (M-III a M-IV) je v rozmezí od 3 do 7 hodin a 16 až 24 hodin. Pioglitazon má zdánlivou clearance, CL/F, vypočítanou na pět až sedm l/hod.
Renální poškození
Poločas eliminace pioglitazonu, M-III a M-IV v séru zůstává nezměněn u pacientů se středně těžkou (clearance kreatininu [CLcr] 30 až 50 ml/min) a těžkou (CLcr
Poškození jater
Ve srovnání se zdravými kontrolami mají jedinci s poruchou funkce jater (Child-Turcotte-Pugh stupeň B/C) přibližně 45% snížení pioglitazonu a průměrnou Cmax celkového pioglitazonu (pioglitazon, M-III a M-IV), ale žádnou změnu střední hodnoty AUC. U pacientů s poruchou funkce jater proto není nutná žádná úprava dávkování.
Existují postmarketingové zprávy o selhání jater u ACTOS a klinické studie obecně vyloučily pacienty se sérovou ALT > 2,5násobkem horní hranice referenčního rozmezí. Buďte opatrní u pacientů s onemocněním jater (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Geriatričtí pacienti
U zdravých starších subjektů se Cmax pioglitazonu významně nelišila, ale hodnoty AUC byly přibližně o 21 % vyšší než hodnoty dosažené u mladších subjektů. Průměrný t1/2 pioglitazonu byl také prodloužen u starších subjektů (přibližně deset hodin) ve srovnání s mladšími subjekty (přibližně sedm hodin). Tyto změny nebyly takového rozsahu, který by byl považován za klinicky významný.
Pediatričtí pacienti
Bezpečnost a účinnost pioglitazonu u pediatrických pacientů nebyla stanovena. ACTOS 15 mg se nedoporučuje používat u pediatrických pacientů [viz Použití u konkrétních populací ].
Rod
Průměrné hodnoty Cmax a AUC pioglitazonu byly u žen ve srovnání s muži zvýšeny o 20 % až 60 %. V kontrolovaných klinických studiích bylo snížení HbA1c oproti výchozí hodnotě obecně větší u žen než u mužů (průměrný průměrný rozdíl v HbA1c 0,5 %). Vzhledem k tomu, že léčba by měla být pro každého pacienta individuální, aby bylo dosaženo kontroly glykémie, nedoporučuje se žádná úprava dávky pouze na základě pohlaví.
Etnická příslušnost
Farmakokinetické údaje mezi různými etnickými skupinami nejsou k dispozici.
Lékové interakce
Toxikologie zvířat a/nebo farmakologie
Zvětšení srdce bylo pozorováno u myší (100 mg/kg), potkanů (4 mg/kg a více) a psů (3 mg/kg), kterým byl perorálně podáván pioglitazon hydrochlorid (přibližně 11, 1 a 2násobek maximální doporučené dávky u lidí. dávka pro myši, potkany a psy, v daném pořadí, na základě mg/m2). V jednoleté studii na potkanech došlo při perorální dávce 160 mg/kg/den (přibližně 35násobek maximální doporučené perorální dávky u lidí na mg/m2) k časnému úmrtí souvisejícímu s lékem v důsledku zjevné srdeční dysfunkce. Zvětšení srdce bylo pozorováno ve 13týdenní studii u opic při perorálních dávkách 8,9 mg/kg a vyšších (přibližně čtyřnásobek maximální doporučené perorální dávky u lidí na základě mg/m2), ale nikoli v 52týdenní studii při perorálních dávkách až 32 mg/kg (přibližně 13násobek maximální doporučené perorální dávky u člověka na základě mg/m2).
Klinické studie
Monoterapie
Byly provedeny tři randomizované, dvojitě zaslepené, placebem kontrolované studie s trváním od 16 do 26 týdnů k vyhodnocení použití ACTOS jako monoterapie u pacientů s diabetem 2. typu. Tyto studie zkoumaly ACTOS 15 mg v dávkách až 45 mg nebo placebo jednou denně u celkem 865 pacientů.
Ve 26týdenní monoterapeutické studii s rozmezím dávek bylo 408 pacientů s diabetem 2. typu randomizováno k podávání 7,5 mg, 15 mg, 30 mg nebo 45 mg ACTOS nebo placeba jednou denně. Léčba jakýmkoli předchozím antidiabetikem byla přerušena osm týdnů před dvojitě zaslepeným obdobím. Léčba 15 mg, 30 mg a 45 mg ACTOS 30 mg vedlo ke statisticky významnému zlepšení HbA1c a plazmatické glukózy nalačno (FPG) v koncovém bodě ve srovnání s placebem (viz obrázek 1, tabulka 17).
Obrázek 1 ukazuje časový průběh změn HbA1c v této 26týdenní studii.
Obrázek 1. Průměrná změna od výchozí hodnoty pro HbA1c v 26týdenní placebem kontrolované studii rozmezí dávek (pozorované hodnoty)
Ve 24týdenní placebem kontrolované monoterapeutické studii bylo 260 pacientů s diabetem 2. typu randomizováno do jedné ze dvou léčebných skupin s nucenou titrací ACTOS nebo do placebové skupiny s falešnou titrací. Léčba jakýmkoli předchozím antidiabetikem byla ukončena šest týdnů před dvojitě zaslepeným obdobím. V jedné léčebné skupině ACTOS 15 mg pacienti dostávali počáteční dávku 7,5 mg jednou denně. Po čtyřech týdnech byla dávka zvýšena na 15 mg jednou denně a po dalších čtyřech týdnech byla dávka zvýšena na 30 mg jednou denně po zbytek studie (16 týdnů). Ve druhé léčebné skupině ACTOS pacienti dostávali počáteční dávku 15 mg jednou denně a titrovali ji na 30 mg jednou denně a 45 mg jednou denně podobným způsobem. Léčba přípravkem ACTOS 15 mg, jak je popsána, přinesla statisticky významná zlepšení HbA1c a FPG na konci ve srovnání s placebem (viz tabulka 18).
16týdenní monoterapeutické studii bylo 197 pacientů s diabetem 2. typu randomizováno k léčbě 30 mg ACTOS nebo placeba jednou denně. Léčba jakýmkoli předchozím antidiabetikem byla ukončena šest týdnů před dvojitě zaslepeným obdobím. Léčba 30 mg ACTOS přinesla statisticky významné zlepšení HbA1c a FPG v koncovém bodě ve srovnání s placebem (viz tabulka 19).
Kombinovaná terapie
Byly provedeny tři 16týdenní, randomizované, dvojitě zaslepené, placebem kontrolované klinické studie k vyhodnocení účinků ACTOS (15 mg a/nebo 30 mg) na glykemickou kontrolu u pacientů s diabetem 2. typu, kteří byli nedostatečně kontrolováni (HbA1c ≥8 %) navzdory současné léčbě sulfonylureou, metforminem nebo inzulínem. Kromě toho byly provedeny tři 24týdenní randomizované, dvojitě zaslepené klinické studie s cílem vyhodnotit účinky ACTOS 30 mg vs. ACTOS 45 mg na kontrolu glykémie u pacientů s diabetem 2. typu, kteří byli nedostatečně kontrolováni (HbA1c ≥ 8 %) navzdory současné léčba sulfonylureou, metforminem nebo inzulínem. Předchozí léčba diabetu mohla být monoterapie nebo kombinovaná terapie.
Doplněk ke sulfonylmočovině zkoušek
Byly provedeny dvě klinické studie s ACTOS v kombinaci se sulfonylmočovinou. Obě studie zahrnovaly pacienty s diabetem 2. typu na jakékoli dávce sulfonylmočoviny, buď samotné nebo v kombinaci s jiným antidiabetikem. Všechna ostatní antidiabetika byla vysazena alespoň tři týdny před zahájením studijní léčby.
V první studii bylo randomizováno 560 pacientů, kteří dostávali 15 mg nebo 30 mg ACTOS 30 mg nebo placebo jednou denně po dobu 16 týdnů navíc k jejich současnému režimu sulfonylmočoviny. Léčba přípravkem ACTOS jako přídavkem k sulfonylmočovině přinesla statisticky významná zlepšení HbA1c a FPG v koncovém bodě ve srovnání s přídavkem placeba k sulfonylmočovině (viz tabulka 20).
Ve druhé studii bylo randomizováno 702 pacientů, kteří dostávali 30 mg nebo 45 mg ACTOS jednou denně po dobu 24 týdnů navíc k jejich současnému režimu sulfonylmočoviny. Průměrné snížení HbA1c od výchozí hodnoty ve 24. týdnu bylo 1,6 % pro dávku 30 mg a 1,7 % pro dávku 45 mg (viz Tabulka 21). Průměrné snížení FPG od výchozí hodnoty v týdnu 24 bylo 52 mg/dl pro dávku 30 mg a 56 mg/dl pro dávku 45 mg.
Terapeutický účinek přípravku ACTOS v kombinaci se sulfonylureou byl pozorován u pacientů bez ohledu na dávku sulfonylurey.
Doplněk ke zkušebním testům metforminu
Byly provedeny dvě klinické studie s ACTOS 30 mg v kombinaci s metforminem. Obě studie zahrnovaly pacienty s diabetem 2. typu na jakékoli dávce metforminu, buď samostatně, nebo v kombinaci s jiným antidiabetikem. Všechna ostatní antidiabetika byla vysazena alespoň tři týdny před zahájením studijní léčby.
první studii bylo randomizováno 328 pacientů, kteří dostávali buď 30 mg ACTOS nebo placebo jednou denně po dobu 16 týdnů navíc ke svému současnému režimu s metforminem. Léčba přípravkem ACTOS 30 mg jako doplňkem k metforminu vedlo ke statisticky významnému zlepšení HbA1c a FPG v koncovém bodě ve srovnání s přidáním placeba k metforminu (viz tabulka 22).
Ve druhé studii bylo 827 pacientů randomizováno k podávání buď 30 mg nebo 45 mg ACTOS 30 mg jednou denně po dobu 24 týdnů navíc k jejich současnému režimu s metforminem. Průměrné snížení HbA1c od výchozí hodnoty ve 24. týdnu bylo 0,8 % pro dávku 30 mg a 1,0 % pro dávku 45 mg (viz Tabulka 23). Průměrné snížení FPG od výchozí hodnoty v týdnu 24 bylo 38 mg/dl pro dávku 30 mg a 51 mg/dl pro dávku 45 mg.
Terapeutický účinek přípravku ACTOS v kombinaci s metforminem byl pozorován u pacientů bez ohledu na dávku metforminu.
Doplněk k inzulinovým studiím
Byly provedeny dvě klinické studie s ACTOS 15 mg v kombinaci s inzulínem. Obě studie zahrnovaly pacienty s diabetem 2. typu na inzulínu, buď samostatně, nebo v kombinaci s jiným antidiabetikem. Všechna ostatní antidiabetika byla vysazena před zahájením studijní léčby. V první studii bylo randomizováno 566 pacientů, kteří dostávali buď 15 mg nebo 30 mg ACTOS 15 mg nebo placebo jednou denně po dobu 16 týdnů navíc k inzulinovému režimu. Léčba přípravkem ACTOS 30 mg jako doplňkem k inzulinu vedlo ke statisticky významnému zlepšení HbA1c a FPG v koncovém bodě ve srovnání s placebem doplňkem k inzulinu (viz tabulka 24). Průměrná denní dávka inzulínu na začátku v každé léčebné skupině byla přibližně 70 jednotek. U většiny pacientů (celkově 75 %, 86 % léčeno placebem, 77 % léčeno přípravkem ACTOS 15 mg a 61 % léčeno přípravkem ACTOS 30 mg) nedošlo k žádné změně v denní dávce inzulinu od výchozí hodnoty do poslední návštěvy studie. Průměrná změna od výchozí hodnoty v denní dávce inzulínu (včetně pacientů bez úprav dávky inzulínu) byla -3 jednotky u pacientů léčených ACTOS 15 mg, -8 jednotek u pacientů léčených ACTOS 30 mg a -1 jednotka u pacientů léčených placebem.
Ve druhé studii bylo 690 pacientů, kteří dostávali medián inzulinu v průměru 60 jednotek denně, randomizováno tak, aby dostávali buď 30 mg nebo 45 mg ACTOS jednou denně po dobu 24 týdnů navíc ke svému současnému inzulínovému režimu. Průměrné snížení HbA1c od výchozí hodnoty ve 24. týdnu bylo 1,2 % pro dávku 30 mg a 1,5 % pro dávku 45 mg. Průměrné snížení FPG od výchozí hodnoty v týdnu 24 bylo 32 mg/dl pro dávku 30 mg a 46 mg/dl pro dávku 45 mg (viz tabulka 25). Průměrná denní dávka inzulínu na začátku v obou léčebných skupinách byla přibližně 70 jednotek. U většiny pacientů (celkově 55 %, 58 % léčených přípravkem ACTOS 30 mg a 52 % léčených přípravkem ACTOS 45 mg) nedošlo k žádné změně v denní dávce inzulinu od výchozí hodnoty do poslední návštěvy studie. Průměrná změna denní dávky inzulínu od výchozí hodnoty (včetně pacientů bez úprav dávky inzulínu) byla -5 jednotek u pacientů léčených ACTOS 30 mg a -8 jednotek u pacientů léčených ACTOS 45 mg.
Terapeutický účinek ACTOS v kombinaci s inzulínem byl pozorován u pacientů bez ohledu na dávku inzulínu.
INFORMACE PRO PACIENTA
ACTOS (ak-TOS) (pioglitazon) Tablety
Předtím, než začnete užívat ACTOS 15 mg, a pokaždé, když dostanete náhradní náplň, si pozorně přečtěte tento Návod k použití. Mohou se objevit nové informace. Tyto informace nenahrazují rozhovor s lékařem o vašem zdravotním stavu nebo léčbě. Máte-li jakékoli otázky týkající se přípravku ACTOS, zeptejte se svého lékaře nebo lékárníka.
Jaké jsou nejdůležitější informace, které bych měl vědět o ACTOS?
ACTOS může způsobit závažné nežádoucí účinky, včetně nového nebo horšího srdečního selhání.
- ACTOS 15 mg může způsobit, že vaše tělo zadržuje nadbytečné tekutiny (retence tekutin), což vede k otokům (edému) a zvýšení tělesné hmotnosti. Nadbytečná tělesná tekutina může zhoršit některé srdeční problémy nebo vést k srdečnímu selhání. Srdeční selhání znamená, že vaše srdce nečerpá krev dostatečně dobře
- Neužívejte ACTOS, pokud trpíte závažným srdečním selháním
- Pokud trpíte srdečním selháním s příznaky (jako je dušnost nebo otok), i když tyto příznaky nejsou závažné, ACTOS pro vás nemusí být to pravé
Okamžitě zavolejte svého lékaře, pokud máte některý z následujících stavů:
- otoky nebo zadržování tekutin, zejména kotníků nebo nohou
- dušnost nebo potíže s dýcháním, zvláště když ležíte
- neobvykle rychlý nárůst hmotnosti
- neobvyklá únava
ACTOS může mít další závažné vedlejší účinky. Viz "Jaké jsou možné vedlejší účinky přípravku ACTOS?"
Co je ACTOS?
ACTOS 15 mg je lék na předpis používaný s dietou a cvičením ke zlepšení kontroly krevního cukru (glukózy) u dospělých s diabetem 2. typu. ACTOS je lék na cukrovku nazývaný pioglitazon, který lze užívat samostatně nebo s jinými léky na cukrovku.
Není známo, zda je ACTOS bezpečný a účinný u dětí mladších 18 let. ACTOS se nedoporučuje používat u dětí.
ACTOS není určen pro lidi s diabetem 1. typu.
ACTOS 30 mg není určen pro osoby s diabetickou ketoacidózou (zvýšené ketony v krvi nebo moči).
Kdo by neměl užívat ACTOS?
Viz "Jaké jsou nejdůležitější informace, které bych měl vědět o ACTOS 15 mg?"
Neužívejte ACTOS 15 mg, pokud:
- mají těžké srdeční selhání
- jsou alergičtí na kteroukoli složku přípravku ACTOS. Úplný seznam složek v ACTOS najdete na konci této Příručky pro léky
Pokud máte některý z těchto stavů, poraďte se se svým lékařem, než začnete ACTOS užívat.
Co mám říct svému lékaři, než začnu užívat ACTOS 30 mg?
Před užitím přípravku ACTOS informujte svého lékaře, pokud:
- mít srdeční selhání
- máte diabetes typu 1 (“juvenilní”) nebo měli diabetickou ketoacidózu
- máte typ diabetického očního onemocnění, které způsobuje otok zadní části oka (makulární edém)
- mít problémy s játry
- máte nebo jste měli rakovinu močového měchýře
- jste těhotná nebo plánujete otěhotnět. Není známo, zda ACTOS 15 mg může poškodit vaše nenarozené dítě. Pokud jste těhotná nebo plánujete otěhotnět, poraďte se se svým lékařem o nejlepším způsobu kontroly hladiny glukózy v krvi během těhotenství
- jsou premenopauzální ženou (před „změnou života“), která nemá menstruaci pravidelně nebo vůbec. ACTOS 30 mg může zvýšit vaši šanci na otěhotnění. Poraďte se se svým lékařem o možnostech antikoncepce během užívání přípravku ACTOS. Okamžitě informujte svého lékaře, pokud během užívání přípravku ACTOS otěhotníte
- kojíte nebo plánujete kojit. Není známo, zda ACTOS přechází do vašeho mléka a zda může poškodit vaše dítě. Poraďte se se svým lékařem o nejlepším způsobu kontroly hladiny glukózy v krvi během kojení
Informujte svého lékaře o všech lécích, které užíváte včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků.
ACTOS 30 mg a některé vaše další léky se mohou vzájemně ovlivňovat. Možná budete muset změnit dávku přípravku ACTOS 15 mg nebo některých jiných léků.
Znát léky, které užíváte. Uchovávejte si seznam svých léků a ukažte jej svému lékaři a lékárníkovi, než začnete užívat nový lék. Řeknou vám, zda je v pořádku užívat ACTOS 15 mg s jinými léky.
Jak mám užívat ACTOS 15 mg?
- Užívejte ACTOS 15 mg přesně podle pokynů svého lékaře
- Váš lékař Vám může změnit dávku přípravku ACTOS. Neměňte dávku přípravku ACTOS, pokud vám to neřekne lékař
- ACTOS lze předepisovat samostatně nebo s jinými léky na diabetes. To bude záviset na tom, jak dobře je kontrolována hladina cukru v krvi
- Užívejte ACTOS 15 mg jednou denně, s jídlem nebo bez jídla
- Pokud vynecháte dávku přípravku ACTOS 15 mg, vezměte si další dávku podle předpisu, pokud lékař neurčí jinak. Neužívejte dvě dávky najednou následující den
- Jestliže užijete příliš mnoho přípravku ACTOS, zavolejte svého lékaře nebo jděte ihned na pohotovost v nejbližší nemocnici
- Pokud je vaše tělo ve stresu, jako je horečka, infekce, nehoda nebo chirurgický zákrok, může být nutné změnit dávku vašich léků na cukrovku. Okamžitě zavolejte svému lékaři
- Během užívání přípravku ACTOS dodržujte dietu a cvičební programy a pravidelně si kontrolujte hladinu cukru v krvi
- Váš lékař by měl provést určité krevní testy předtím, než začnete a během užívání přípravku ACTOS
- Váš lékař by měl také provést vyšetření hemoglobinu A1C, aby zkontroloval, jak dobře je hladina cukru v krvi kontrolována přípravkem ACTOS
- Váš lékař by měl během užívání přípravku ACTOS pravidelně kontrolovat vaše oči
Jaké jsou možné vedlejší účinky přípravku ACTOS?
ACTOS může způsobit závažné nežádoucí účinky včetně:
- Viz "Jaké jsou nejdůležitější informace, které bych měl vědět o ACTOS?"
- nízká hladina cukru v krvi (hypoglykémie). To se může stát, pokud vynecháte jídlo, pokud užíváte také jiný lék, který snižuje hladinu cukru v krvi, nebo pokud máte určité zdravotní problémy. Točení hlavy, závratě, třes nebo hlad se mohou objevit, pokud je vaše hladina cukru v krvi příliš nízká. Pokud jsou pro vás problémem nízké hladiny cukru v krvi, zavolejte svého lékaře
- problémy s játry. Okamžitě zavolejte svého lékaře, pokud máte:
- nevolnost nebo zvracení
- bolest břicha
- neobvyklá nebo nevysvětlitelná únava
- ztráta chuti k jídlu
- tmavá moč
- zežloutnutí kůže nebo očního bělma
- rakovina močového měchýře. Při užívání přípravku ACTOS může být zvýšená pravděpodobnost vzniku rakoviny močového měchýře. Neužívejte ACTOS 15 mg, pokud se léčíte na rakovinu močového měchýře. Okamžitě informujte svého lékaře, pokud máte některý z následujících příznaků rakoviny močového měchýře:
- krev nebo červené zbarvení moči
- zvýšená potřeba močit
- bolest při močení
- zlomené kosti (zlomeniny). Obvykle do ruky, paže nebo nohy u žen. Poraďte se se svým lékařem, jak si udržet zdravé kosti.
- diabetické oční onemocnění s otokem v zadní části oka (makulární edém). Okamžitě informujte svého lékaře, pokud máte nějaké změny ve vašem vidění. Váš lékař by měl vaše oči pravidelně kontrolovat
- uvolnění vajíčka z vaječníku u ženy (ovulace) vedoucí k těhotenství. K ovulaci může dojít, když premenopauzální ženy, které nemají pravidelnou měsíční menstruaci, užívají ACTOS. To může zvýšit vaši šanci na otěhotnění
- příznaky podobné nachlazení (infekce horních cest dýchacích)
- bolest hlavy
- sinusová infekce
- bolest svalů
- bolest krku
Mezi nejčastější vedlejší účinky ACTOS patří:
Informujte svého lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny vedlejší účinky přípravku ACTOS. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám uchovávat ACTOS 15 mg?
- Uchovávejte ACTOS 15 mg při 68 °F až 77 °F (20 °C až 25 °C). ACTOS uchovávejte v původním obalu a chraňte před světlem
- Uchovávejte lahvičku ACTOS pevně uzavřenou a tablety udržujte v suchu
- Uchovávejte ACTOS a všechny léky mimo dosah dětí
Obecné informace o bezpečném a efektivním používání ACTOS
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Nepoužívejte ACTOS pro stav, pro který nebyl předepsán. Nepodávejte ACTOS jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Tento průvodce léky shrnuje nejdůležitější informace o ACTOS. Pokud chcete více informací, promluvte si se svým lékařem. Můžete požádat svého lékaře nebo lékárníka o informace o přípravku ACTOS, který je určen pro zdravotnické pracovníky. Pro více informací navštivte www.actos.com nebo volejte 1-877-825-3327.
Jaké složky obsahuje ACTOS 15 mg?
Aktivní složka: pioglitazon Neaktivní složky: laktos 15 mg monohydrát, hydroxypropylcelulóza, vápenatá sůl karboxymethylcelulózy a stearát hořečnatý
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv.
