Precose 25mg, 50mg Acarbose Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Precose 50 mg a jak se používá?
Precose (tablety s akarbózou) je perorální inhibitor alfa-glukosidázy používaný k léčbě diabetu 2. Precose 50 mg se někdy používá v kombinaci s inzulínem nebo jinými léky na cukrovku, které užíváte ústy. Precose 25 mg je k dispozici v obecné formě.
Jaké jsou vedlejší účinky přípravku Precose 25 mg?
Mezi běžné vedlejší účinky přípravku Precose patří:
- průjem,
- plyn,
- nadýmání,
- podrážděný žaludek, popř
- bolest žaludku v prvních několika týdnech léčby, protože se vaše tělo přizpůsobuje tomuto léku, ale obvykle se časem zlepší.
Mezi další nežádoucí účinky přípravku Precose 50 mg patří kožní vyrážka nebo svědění. Informujte svého lékaře, pokud máte vzácné, ale velmi závažné nežádoucí účinky přípravku Precose 25 mg, včetně:
- neobvyklá únava,
- přetrvávající nevolnost nebo zvracení,
- silná bolest žaludku nebo břicha,
- rektální krvácení,
- žloutnutí očí nebo kůže, popř
- tmavá moč.
POPIS
PRECOSE® (akarbózové tablety) je perorální inhibitor alfa-glukosidázy pro použití při léčbě diabetes mellitus 2. typu. Akarbóza je oligosacharid, který se získává z fermentačních procesů mikroorganismu Actinoplanes utahensis a je chemicky známý jako O-4,6-dideoxy4-[[(1S,4R,5S,6S)-4,5,6-trihydroxy- 3-(hydroxymethyl)-2-cyklohexen-1-yl]amino]a-D-glukopyranosyl-(1 -> 4)-0-a-D-glukopyranosyl-(1->4)-D-glukóza. Je to bílý až téměř bílý prášek s molekulovou hmotností 645,6. Akarbóza je rozpustná ve vodě a má pKa 5,1. Jeho empirický vzorec je C25H43NO18 a jeho chemická struktura je následující:
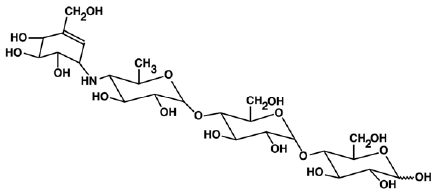
PRECOSE 50 mg je k dispozici jako 25 mg, 50 mg a 100 mg tablety pro perorální podání. Neaktivní složky jsou škrob, mikrokrystalická celulóza, stearát hořečnatý a koloidní oxid křemičitý.
INDIKACE
PRECOSE je indikován jako doplněk diety a cvičení ke zlepšení kontroly glykémie u dospělých s diabetes mellitus 2. typu.
DÁVKOVÁNÍ A PODÁVÁNÍ
Neexistuje žádný pevný dávkovací režim pro léčbu diabetes mellitus přípravkem PRECOSE nebo jiným farmakologickým prostředkem. Dávkování PRECOSE 25 mg musí být individualizováno na základě účinnosti i snášenlivosti, přičemž nesmí být překročena maximální doporučená dávka 100 mg třikrát denně PRECOSE by se měla užívat třikrát denně na začátku (s prvním soustem) každého hlavního jídla.
Přípravek PRECOSE by měl být zahájen nízkou dávkou s postupným zvyšováním dávky, jak je popsáno níže, aby se snížily gastrointestinální nežádoucí účinky a aby bylo možné určit minimální dávku potřebnou pro adekvátní kontrolu glykémie pacienta. Pokud není dodržena předepsaná dieta, mohou se zesílit střevní nežádoucí účinky. Pokud se i přes dodržování předepsané diabetické diety rozvinou silně znepokojující příznaky, je třeba se poradit s lékařem a dávku dočasně nebo trvale snížit.
Během zahájení léčby a titrace dávky (viz níže) lze ke stanovení terapeutické odpovědi na PRECOSE a identifikaci minimální účinné dávky pro pacienta použít jednu hodinu postprandiální plazmatické glukózy. Poté by měl být glykosylovaný hemoglobin měřen v intervalech přibližně tří měsíců. Terapeutickým cílem by mělo být snížení postprandiální hladiny glukózy v plazmě a hladiny glykosylovaného hemoglobinu na normální nebo blízko normálu použitím nejnižší účinné dávky PRECOSE, buď jako monoterapie, nebo v kombinaci se sulfonylmočovinami, inzulínem nebo metforminem.
Počáteční dávkování
Doporučená počáteční dávka PRECOSE 25 mg je 25 mg podávaná perorálně třikrát denně na začátku (s prvním soustem) každého hlavního jídla. Někteří pacienti však mohou mít prospěch z pozvolnější titrace dávky, aby se minimalizovaly gastrointestinální nežádoucí účinky. Toho lze dosáhnout zahájením léčby dávkou 25 mg jednou denně a následným zvýšením frekvence podávání k dosažení 25 mg třikrát denně
Udržovací dávkování
Jakmile je dosaženo dávkovacího režimu 25 mg třikrát denně, dávka PRECOSE 50 mg by měla být upravována ve 4–8 týdenních intervalech na základě jedné hodiny postprandiální hladiny glukózy nebo glykosylovaného hemoglobinu a podle tolerance. Dávku lze zvýšit z 25 mg třikrát denně na 50 mg třikrát denně Někteří pacienti mohou mít prospěch z dalšího zvýšení dávky na 100 mg třikrát denně. Udržovací dávka se pohybuje od 50 mg třikrát denně do 100 mg třikrát denně. Protože však u pacientů s nízkou tělesnou hmotností může být zvýšená riziko zvýšených sérových transamináz, pouze u pacientů s tělesnou hmotností > 60 kg je třeba zvážit titraci dávky nad 50 mg třikrát denně (viz OPATŘENÍ ). Pokud není pozorováno další snížení postprandiálních hladin glukózy nebo glykosylovaného hemoglobinu při titraci na 100 mg třikrát denně, je třeba zvážit snížení dávky. Jakmile je stanovena účinná a tolerovaná dávka, měla by být udržována.
Maximální dávkování
Maximální doporučená dávka pro pacienty ≤ 60 kg je 50 mg třikrát denně Maximální doporučená dávka pro pacienty s hmotností > 60 kg je 100 mg třikrát denně
Pacienti, kteří dostávají sulfonylmočovinu nebo inzulín
Deriváty sulfonylmočoviny nebo inzulín mohou způsobit hypoglykémii. PRECOSE podávaný v kombinaci se sulfonylmočovinou nebo inzulínem způsobí další snížení hladiny glukózy v krvi a může zvýšit možnost hypoglykémie. Pokud dojde k hypoglykémii, měla by být provedena vhodná úprava dávkování těchto látek.
JAK DODÁVÁNO
PRECOSE je k dispozici jako 25 mg, 50 mg nebo 100 mg kulaté tablety bez rýhy. Každá síla tablety má bílou až žlutou barvu. 25mg tableta je označena nápisem „PRECOSE“ na jedné straně a „25“ na druhé straně. 50mg tableta je označena nápisem „PRECOSE“ a „50“ na stejné straně. 100mg tableta je na stejné straně kódována slovy „PRECOSE“ a „100“. PRECOSE je k dispozici v lahvičkách o síle 100 a 50 mg v jednotkových baleních po 100.
Uchovávejte při teplotě do 25°C (77°F). Chraňte před vlhkostí. U lahví udržujte nádobu těsně uzavřenou.
Bayer HealthCare Pharmaceuticals Inc. Wayne, NJ 07470. Vyrobeno v Německu. 11/11
VEDLEJŠÍ EFEKTY
Zažívací trakt
Gastrointestinální příznaky jsou nejčastější reakce na PRECOSE. V placebem kontrolovaných studiích v USA byla incidence bolestí břicha, průjmu a plynatosti 19 %, 31 % a 74 % u 1255 pacientů léčených přípravkem PRECOSE 50–300 mg třikrát denně, zatímco odpovídající incidence byla 9 %, 12 %. a 29 % u 999 pacientů léčených placebem.
jednoleté bezpečnostní studii, během níž si pacienti vedli deníky o gastrointestinálních příznacích, měly bolesti břicha a průjem tendenci se v průběhu času vracet na úroveň před léčbou a frekvence a intenzita plynatosti měly tendenci časem slábnout. Zvýšené symptomy gastrointestinálního traktu u pacientů léčených PRECOSE 50 mg jsou projevem mechanismu účinku PRECOSE a souvisí s přítomností nestrávených sacharidů v dolním GI traktu.
Pokud není dodržena předepsaná dieta, mohou se zesílit střevní nežádoucí účinky. Pokud se i přes dodržování předepsané diabetické diety rozvinou silně znepokojující příznaky, je třeba se poradit s lékařem a dávku dočasně nebo trvale snížit.
Zvýšené hladiny sérových transamináz
Vidět OPATŘENÍ .
Jiné abnormální laboratorní nálezy
Malé snížení hematokritu se objevilo častěji u pacientů léčených PRECOSE než u pacientů léčených placebem, ale nebylo spojeno se snížením hemoglobinu. Nízké hladiny vápníku v séru a nízké hladiny vitaminu B6 v plazmě byly spojeny s léčbou PRECOSE 50 mg, ale předpokládá se, že jsou buď falešné, nebo nemají žádný klinický význam.
Postmarketingové zprávy o nežádoucích událostech
Mezi další nežádoucí účinky hlášené z celosvětové postmarketingové zkušenosti patří fulminantní hepatitida s fatálním koncem, hypersenzitivní kožní reakce (například vyrážka, erytém, exantém a kopřivka), edém, ileus/subileus, žloutenka a/nebo hepatitida a související poškození jater, trombocytopenie a pneumatóza cystoides inneris (viz OPATŘENÍ ).
Pneumatosis Cystoides Intestinalis
Po uvedení přípravku na trh byly vzácně hlášeny pneumatosis cystoides inneris spojené s užíváním inhibitorů alfa-glukosidázy, včetně přípravku Precose. Pneumatosis cystoides inneris se může projevovat příznaky průjmu, výtoku hlenu, krvácením z konečníku a zácpou. Komplikacemi mohou být pneumoperitoneum, volvulus, střevní obstrukce, intususcepce, střevní krvácení a střevní perforace. Při podezření na pneumatosis cystoides inneris přerušte léčbu přípravkem Precose 25 mg a proveďte příslušné diagnostické zobrazení.
DROGOVÉ INTERAKCE
Některé léky mají tendenci vyvolat hyperglykémii a mohou vést ke ztrátě kontroly hladiny glukózy v krvi. Mezi tyto léky patří thiazidy a další diuretika, kortikosteroidy, fenothiaziny, produkty štítné žlázy, estrogeny, perorální antikoncepce, fenytoin, kyselina nikotinová, sympatomimetika, léky blokující vápníkové kanály a isoniazid. Pokud jsou takové léky podávány pacientovi, který dostává PRECOSE 25 mg, pacient by měl být pečlivě sledován kvůli ztrátě kontroly hladiny glukózy v krvi. Pokud jsou takové léky vysazeny pacientům užívajícím PRECOSE 50 mg v kombinaci se sulfonylmočovinami nebo inzulínem, pacienti by měli být pečlivě sledováni z hlediska jakýchkoli známek hypoglykémie.
Pacienti užívající deriváty sulfonylmočoviny nebo inzulín: Látky obsahující sulfonylmočovinu nebo inzulín mohou způsobit hypoglykémii. PRECOSE 25 mg podávaný v kombinaci se sulfonylureou nebo inzulinem může způsobit další snížení hladiny glukózy v krvi a může zvýšit možnost hypoglykémie. Pokud dojde k hypoglykémii, měla by být provedena vhodná úprava dávkování těchto látek. Velmi vzácně byly hlášeny jednotlivé případy hypoglykemického šoku u pacientů léčených přípravkem PRECOSE v kombinaci se sulfonylmočovinami a/nebo inzulínem.
Střevní adsorbenty (například živočišné uhlí) a přípravky trávicích enzymů obsahující enzymy štěpící uhlohydráty (například amyláza, pankreatin) mohou snížit účinek PRECOSE a neměly by se užívat současně.
Bylo prokázáno, že PRECOSE 25 mg mění biologickou dostupnost digoxinu, když jsou podávány současně, což může vyžadovat úpravu dávky digoxinu. (Vidět KLINICKÁ FARMAKOLOGIE , Lékové interakce .)
VAROVÁNÍ
Nebyly poskytnuty žádné informace
OPATŘENÍ
Všeobecné
Makrovaskulární výsledky
Nebyly provedeny žádné klinické studie, které by prokázaly přesvědčivé důkazy o snížení makrovaskulárního rizika přípravkem PRECOSE 25 mg nebo jakýmkoli jiným antidiabetikem.
Hypoglykémie
Vzhledem ke svému mechanismu účinku by přípravek PRECOSE podávaný samostatně neměl způsobit hypoglykémii nalačno nebo po jídle. Deriváty sulfonylmočoviny nebo inzulín mohou způsobit hypoglykémii. Protože PRECOSE 50 mg podávaný v kombinaci se sulfonylureou nebo inzulínem způsobí další snížení hladiny glukózy v krvi, může zvýšit možnost hypoglykémie. K hypoglykémii nedochází u pacientů užívajících samotný metformin za obvyklých okolností použití a u pacientů, kdy byla k léčbě metforminem přidána dávka PRECOSE 50 mg, nebyla pozorována zvýšená incidence hypoglykémie.
Orální glukóza (dextróza), jejíž vstřebávání není přípravkem PRECOSE inhibováno, by měla být použita místo sacharózy (třtinového cukru) při léčbě mírné až středně těžké hypoglykémie. Sacharóza, jejíž hydrolýzu na glukózu a fruktózu inhibuje PRECOSE, je nevhodná pro rychlou korekci hypoglykémie. Těžká hypoglykémie může vyžadovat použití buď intravenózní infuze glukózy nebo injekce glukagonu.
Zvýšené hladiny sérových transamináz
dlouhodobých studiích (až 12 měsíců a včetně dávek PRECOSE 25 mg až 300 mg třikrát denně) provedených ve Spojených státech amerických bylo v souvislosti s léčbou zjištěno zvýšení sérových transamináz (AST a/nebo ALT) nad horní hranici normálu (ULN). ), vyšší než 1,8krát ULN a více než 3krát ULN se vyskytly u 14 %, 6 %, respektive 3 % pacientů léčených PRECOSE ve srovnání se 7 %, 2 % a 1 %, v tomto pořadí, pacientů léčených placebem. Ačkoli tyto rozdíly mezi léčbami byly statisticky významné, tato zvýšení byla asymptomatická, reverzibilní, častější u žen a obecně nebyla spojena s jinými známkami jaterní dysfunkce. Navíc se zdálo, že tato zvýšení sérových transamináz souvisí s dávkou. Ve studiích v USA zahrnujících dávky PRECOSE 50 mg až do maximální schválené dávky 100 mg třikrát denně byla zvýšení AST a/nebo ALT na jakékoli úrovni závažnosti v souvislosti s léčbou podobná mezi pacienty léčenými PRECOSE a pacienty léčenými placebem (p ≥ 0,496) .
Za přibližně 3 miliony pacientoroků mezinárodních postmarketingových zkušeností s přípravkem PRECOSE 50 mg bylo hlášeno 62 případů zvýšení sérových transamináz > 500 IU/l (29 z nich bylo spojeno se žloutenkou). 41 z těchto 62 pacientů dostávalo léčbu 100 mg třikrát denně nebo vyšší a 33 ze 45 pacientů, u kterých byla hlášena hmotnost, vážilo
Ztráta kontroly nad krevní glukózou
Když jsou diabetici vystaveni stresu, jako je horečka, trauma, infekce nebo chirurgický zákrok, může dojít k dočasné ztrátě kontroly hladiny glukózy v krvi. V takové době může být nutná dočasná inzulinová terapie.
Laboratorní testy
Terapeutická odpověď na PRECOSE by měla být monitorována pravidelnými testy glukózy v krvi. Měření hladin glykosylovaného hemoglobinu se doporučuje pro monitorování dlouhodobé kontroly glykémie.
PRECOSE 25 mg, zejména v dávkách přesahujících 50 mg třikrát denně, může způsobit zvýšení sérových transamináz a ve vzácných případech hyperbilirubinémii. Doporučuje se kontrolovat hladiny sérových transamináz každé 3 měsíce během prvního roku léčby přípravkem PRECOSE a poté pravidelně. Pokud jsou pozorovány zvýšené transaminázy, může být indikováno snížení dávkování nebo vysazení léčby, zvláště pokud zvýšení přetrvávají.
Renální poškození
Plazmatické koncentrace PRECOSE u dobrovolníků s poruchou funkce ledvin byly úměrně zvýšeny vzhledem ke stupni renální dysfunkce. Dlouhodobé klinické studie u diabetických pacientů s významnou renální dysfunkcí (sérový kreatinin > 2,0 mg/dl) nebyly provedeny. Léčba těchto pacientů přípravkem PRECOSE 50 mg se proto nedoporučuje.
Karcinogeneze, mutageneze a poškození plodnosti
S akarbózou bylo provedeno osm studií karcinogenity. Šest studií bylo provedeno na potkanech (dva kmeny, Sprague-Dawley a Wistar) a dvě studie byly provedeny na křečcích.
první studii na potkanech dostávali potkani Sprague-Dawley akarbózu v krmivu ve vysokých dávkách (až přibližně 500 mg/kg tělesné hmotnosti) po dobu 104 týdnů. Léčba akarbózou vedla k významnému zvýšení incidence renálních tumorů (adenomů a adenokarcinomů) a benigních tumorů z Leydigových buněk. Tato studie byla opakována s podobným výsledkem. Další studie byly provedeny k oddělení přímých karcinogenních účinků akarbózy od nepřímých účinků vyplývajících z podvýživy uhlohydrátů vyvolané velkými dávkami akarbózy použitými ve studiích. V jedné studii na potkanech Sprague-Dawley byla akarbóza smíchána s krmivem, ale nedostatku sacharidů bylo zabráněno přidáním glukózy do stravy.

Ve 26měsíční studii na krysách Sprague-Dawley byla akarbóza podávána denně postprandiální sondou, aby se zabránilo farmakologickým účinkům léku. V obou těchto studiích se zvýšený výskyt renálních nádorů zjištěný v původních studiích nevyskytl. Akarbóza byla také podávána v potravě a postprandiální sondou ve dvou samostatných studiích na potkanech Wistar. V žádné z těchto studií na potkanech Wistar nebyl zjištěn zvýšený výskyt nádorů ledvin. Ve dvou studiích krmení křečků, se suplementací glukózy a bez ní, také nebyly žádné důkazy o karcinogenitě.
Akarbóza neindukovala žádné poškození DNA in vitro v testu chromozomální aberace CHO, testu bakteriální mutageneze (Ames) nebo testu vazby DNA. In vivo nebylo zjištěno žádné poškození DNA v dominantním letálním testu u myších samců nebo v mikronukleovém testu myší.
Studie fertility provedené u potkanů po perorálním podání neprokázaly žádný nežádoucí účinek na fertilitu nebo na celkovou schopnost reprodukce.
Těhotenství
Teratogenní účinky: Těhotenství kategorie B.
Bezpečnost přípravku PRECOSE u těhotných žen nebyla stanovena. Reprodukční studie byly provedeny na potkanech v dávkách až 480 mg/kg (což odpovídá 9násobku expozice u lidí, na základě hladiny léku v krvi) a neodhalily žádné známky poškození plodnosti nebo poškození plodu v důsledku akarbózy. U králíků mohl být za mírný nárůst počtu embryonálních ztrát zodpovědný snížený přírůstek tělesné hmotnosti matky, pravděpodobně důsledek farmakodynamické aktivity vysokých dávek akarbózy ve střevech. Avšak králíci, kterým bylo podáváno 160 mg/kg akarbózy (což odpovídá 10násobku dávky u člověka, na základě tělesného povrchu), nevykazovali žádné známky embryotoxicity a nebyly žádné známky teratogenity v dávce 32násobku dávky u člověka (na základě tělesného povrchu plocha povrchu). Neexistují však žádné adekvátní a dobře kontrolované studie přípravku PRECOSE 25 mg u těhotných žen. Vzhledem k tomu, že reprodukční studie na zvířatech ne vždy předpovídají lidskou odpověď, měl by být tento lék používán během těhotenství pouze tehdy, je-li to nezbytně nutné. Vzhledem k tomu, že současné informace silně naznačují, že abnormální hladiny glukózy v krvi během těhotenství jsou spojeny s vyšším výskytem vrozených anomálií a také se zvýšenou novorozeneckou morbiditou a úmrtností, většina odborníků doporučuje používat během těhotenství inzulín k udržení hladiny glukózy v krvi co nejblíže normálu. .
Kojící matky
Po podání radioaktivně značené akarbózy bylo zjištěno malé množství radioaktivity v mléce kojících potkanů. Není známo, zda se tento lék vylučuje do lidského mléka. Vzhledem k tomu, že mnoho léků se vylučuje do mateřského mléka, PRECOSE 25 mg by neměl být podáván kojícím ženám.
Pediatrické použití
Bezpečnost a účinnost přípravku PRECOSE 25 mg u pediatrických pacientů nebyla stanovena.
Geriatrické použití
Z celkového počtu subjektů v klinických studiích PRECOSE 25 mg ve Spojených státech bylo 27 % ve věku 65 let a více, zatímco 4 % bylo ve věku 75 a více let. Mezi těmito subjekty a mladšími subjekty nebyly pozorovány žádné celkové rozdíly v bezpečnosti a účinnosti. Průměrná plocha pod křivkou v ustáleném stavu (AUC) a maximální koncentrace akarbózy byly přibližně 1,5krát vyšší u starších osob ve srovnání s mladými dobrovolníky; tyto rozdíly však nebyly statisticky významné.
PŘEDÁVKOVAT
Na rozdíl od derivátů sulfonylmočoviny nebo inzulinu nevede předávkování přípravkem PRECOSE k hypoglykémii. Předávkování může mít za následek přechodné zvýšení plynatosti, průjem a břišní diskomfort, které brzy odezní. V případě předávkování by pacientovi neměly být po dobu následujících 4–6 hodin podávány nápoje nebo jídla obsahující sacharidy (polysacharidy, oligosacharidy a disacharidy).
KONTRAINDIKACE
PRECOSE 25 mg je kontraindikován u pacientů se známou přecitlivělostí na lék. Precose 25 mg je kontraindikován u pacientů s diabetickou ketoacidózou nebo cirhózou. PRECOSE 25 mg je také kontraindikován u pacientů se zánětlivým onemocněním střev, ulcerací tlustého střeva, částečnou střevní obstrukcí nebo u pacientů s predispozicí k neprůchodnosti střev. Navíc je PRECOSE kontraindikován u pacientů, kteří mají chronická střevní onemocnění spojená s výraznými poruchami trávení nebo vstřebávání a u pacientů, kteří mají stavy, které se mohou zhoršit v důsledku zvýšené tvorby plynu ve střevě.
KLINICKÁ FARMAKOLOGIE
Akarbóza je komplexní oligosacharid, který zpomaluje trávení přijatých sacharidů, což má za následek menší nárůst koncentrace glukózy v krvi po jídle. V důsledku snížení plazmatické glukózy snižuje PRECOSE hladiny glykosylovaného hemoglobinu u pacientů s diabetes mellitus 2. typu. Systémová neenzymatická glykosylace proteinů, jak se odráží v hladinách glykosylovaného hemoglobinu, je funkcí průměrné koncentrace glukózy v krvi v průběhu času.
Mechanismus působení
Na rozdíl od sulfonylmočovin, PRECOSE 50 mg nezvyšuje sekreci inzulínu. Antihyperglykemický účinek akarbózy je výsledkem kompetitivní, reverzibilní inhibice pankreatické alfa-amylázy a enzymů střevní alfa-glukosidhydrolázy vázané na membránu. Pankreatická alfa-amyláza hydrolyzuje komplexní škroby na oligosacharidy v lumen tenkého střeva, zatímco střevní alfa-glukosidázy vázané na membránu hydrolyzují oligosacharidy, trisacharidy a disacharidy na glukózu a další monosacharidy v kartáčovém lemu tenkého střeva. U diabetických pacientů vede tato inhibice enzymu ke zpožděné absorpci glukózy a ke snížení postprandiální hyperglykémie.
Protože jeho mechanismus účinku je odlišný, účinek přípravku PRECOSE na zvýšení kontroly glykémie je aditivní k účinku derivátů sulfonylmočoviny, inzulínu nebo metforminu, pokud se používají v kombinaci. PRECOSE 50 mg navíc snižuje inzulinotropní a hmotnost zvyšující účinky sulfonylmočovin.
Akarbóza nemá žádnou inhibiční aktivitu vůči laktáze, a proto se neočekává, že by indukovala intoleranci laktózy.
Farmakokinetika
Vstřebávání
Ve studii na 6 zdravých mužích byla absorbována méně než 2 % perorální dávky akarbózy jako aktivní léčivo, zatímco přibližně 35 % celkové radioaktivity z perorální dávky značené 14C bylo absorbováno. Průměrně 51 % perorální dávky bylo vyloučeno stolicí jako neabsorbovaná radioaktivita související s léčivem během 96 hodin po požití. Protože akarbóza působí lokálně v gastrointestinálním traktu, je tato nízká systémová biologická dostupnost mateřské sloučeniny terapeuticky žádoucí. Po perorálním podání akarbózy značené 14C zdravým dobrovolníkům bylo maximálních plazmatických koncentrací radioaktivity dosaženo 14–24 hodin po podání, zatímco maximálních plazmatických koncentrací aktivního léčiva bylo dosaženo přibližně za 1 hodinu. Zpožděná absorpce radioaktivity související s akarbózou odráží absorpci metabolitů, které mohou být tvořeny střevními bakteriemi nebo střevní enzymatickou hydrolýzou.
Metabolismus
Akarbóza je metabolizována výhradně v gastrointestinálním traktu, především střevními bakteriemi, ale také trávicími enzymy. Část těchto metabolitů (přibližně 34 % dávky) byla absorbována a následně vyloučena močí. Nejméně 13 metabolitů bylo separováno chromatograficky ze vzorků moči. Hlavní metabolity byly identifikovány jako deriváty 4-methylpyrogalolu (tj. sulfátové, methylové a glukuronidové konjugáty). Jeden metabolit (vzniklý odštěpením molekuly glukózy z akarbózy) má také inhibiční aktivitu vůči alfa-glukosidáze. Tento metabolit spolu s mateřskou sloučeninou získaný z moči tvoří méně než 2 % celkové podané dávky.
Vylučování
Frakce akarbózy, která je absorbována jako intaktní léčivo, je téměř úplně vyloučena ledvinami. Když byla akarbóza podána intravenózně, 89 % dávky bylo nalezeno v moči jako aktivní léčivo během 48 hodin. Naproti tomu méně než 2 % perorální dávky bylo nalezeno v moči jako aktivní léčivo (tj. mateřská sloučenina a aktivní metabolit). To je v souladu s nízkou biologickou dostupností původního léčiva. Plazmatický eliminační poločas aktivity akarbózy je u zdravých dobrovolníků přibližně 2 hodiny. V důsledku toho nedochází k akumulaci léku při perorálním podávání třikrát denně (tid).
Zvláštní populace
Průměrná plocha pod křivkou v ustáleném stavu (AUC) a maximální koncentrace akarbózy byly přibližně 1,5krát vyšší u starších osob ve srovnání s mladými dobrovolníky; tyto rozdíly však nebyly statisticky významné. Pacienti s těžkou poruchou funkce ledvin (Clcr
Lékové interakce
Studie na zdravých dobrovolnících ukázaly, že PRECOSE nemá žádný vliv na farmakokinetiku ani farmakodynamiku nifedipinu, propranololu nebo ranitidinu. PRECOSE neinterferuje s absorpcí nebo dispozicí sulfonylurea glyburidu u diabetických pacientů. PRECOSE může ovlivnit biologickou dostupnost digoxinu a může vyžadovat úpravu dávky digoxinu o 16 % (90% interval spolehlivosti: 8–23 %), snížení průměrné Cmax digoxinu o 26 % (90% interval spolehlivosti: 16–34 %) a snížení průměrného minima koncentrace digoxinu o 9 % (90% hranice spolehlivosti: 19% pokles na 2% nárůst). (Vidět OPATŘENÍ: DROGOVÉ INTERAKCE .)
Množství metforminu absorbovaného během užívání přípravku PRECOSE bylo bioekvivalentní množství absorbovaného při užívání placeba, jak ukazují hodnoty AUC v plazmě. Maximální plazmatická hladina metforminu však byla snížena přibližně o 20 % při užívání přípravku PRECOSE v důsledku mírného zpoždění v absorpci metforminu. Mezi PRECOSE a metforminem je malá, pokud vůbec nějaká klinicky významná interakce.
Klinické testy
Klinické zkušenosti ze studií stanovení dávek u pacientů s diabetes mellitus 2. typu pouze na dietní léčbě
Výsledky ze šesti kontrolovaných monoterapeutických studií PRECOSE s fixní dávkou v léčbě diabetes mellitus 2. typu, které zahrnovaly 769 pacientů léčených PRECOSE, byly zkombinovány a vážený průměr rozdílu oproti placebu v průměrné změně oproti výchozí hodnotě v glykosylovaném hemoglobinu ( HbA1c) byl vypočten pro každou úroveň dávky, jak je uvedeno níže:
Ačkoli studie používaly maximální dávku 200 nebo 300 mg třikrát denně, maximální doporučená dávka pro pacienty 60 kg je 100 mg třikrát denně
Výsledky z těchto šesti monoterapií s fixní dávkou byly také zkombinovány, aby se získal vážený průměr rozdílu oproti placebu v průměrné změně od výchozí hodnoty pro hladiny glukózy v plazmě jednu hodinu po jídle, jak ukazuje následující obrázek:
Obrázek 1 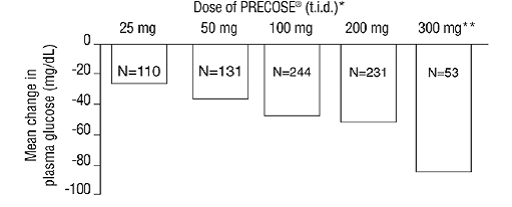
* PRECOSE 50 mg se statisticky významně lišila od placeba ve všech dávkách s ohledem na účinek na plazmatickou glukózu jednu hodinu po jídle. **Režim 300 mg tid PRECOSE 50 mg byl lepší než nižší dávky, ale nebyly žádné statisticky významné rozdíly mezi 50 a 200 mg tid
Klinické zkušenosti u pacientů s diabetes mellitus 2. typu na monoterapii nebo v kombinaci se sulfonylmočovinou, metforminem nebo inzulínem
PRECOSE byl studován jako monoterapie a jako kombinovaná terapie k léčbě sulfonylureou, metforminem nebo inzulinem. Účinky léčby na hladiny HbA1c a jednu hodinu postprandiální hladiny glukózy jsou shrnuty pro čtyři placebem kontrolované, dvojitě zaslepené, randomizované studie provedené ve Spojených státech v tabulkách 2 a 3, v tomto pořadí. Rozdíly v léčbě odečtené od placeba, které jsou shrnuty níže, byly statisticky významné pro obě proměnné ve všech těchto studiích.
Studie 1 (n=109) zahrnovala pacienty na základní léčbě pouze dietou. Průměrný účinek přidání PRECOSE k dietní terapii byla změna HbA1c o -0,78 % a zlepšení glykémie za hodinu po jídle o -74,4 mg/dl.
Ve studii 2 (n=137) byla průměrným účinkem přidání PRECOSE 25 mg k maximální léčbě sulfonylureou změna HbA1c o -0,54 % a zlepšení glykémie po hodině po jídle o -33,5 mg/dl.
Ve studii 3 (n=147) byla průměrným účinkem přidání PRECOSE 50 mg k maximální léčbě metforminem změna HbA1c o -0,65 % a zlepšení glykémie za hodinu po jídle o -34,3 mg/dl.
Studie 4 (n=145) prokázala, že přípravek PRECOSE přidaný k pacientům na základní léčbě inzulinem vedl k průměrné změně HbA1c o -0,69 % a ke zlepšení glykémie po hodině po jídle o -36,0 mg/dl.
V Kanadě byla provedena jednoletá studie PRECOSE jako monoterapie nebo v kombinaci s léčbou sulfonylureou, metforminem nebo inzulinem, ve které bylo do primární analýzy účinnosti zahrnuto 316 pacientů (obrázek 2). Ve skupinách s dietou, sulfonylureou a metforminem byl průměrný pokles HbA1c způsobený přidáním PRECOSE 50 mg statisticky významný po šesti měsících a tento účinek byl trvalý po jednom roce. U pacientů léčených PRECOSE na inzulínu došlo ke statisticky významnému snížení HbA1c po šesti měsících a trendu ke snížení po jednom roce.
Obrázek 2 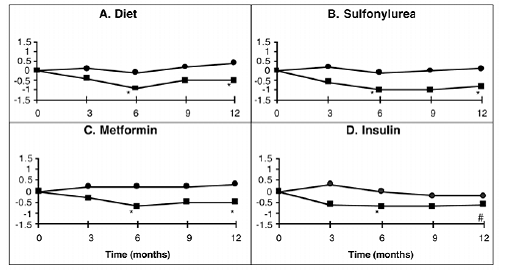
Obrázek 2: Účinky PRECOSE (III) a placeba (III) na průměrnou změnu hladin HbA1c od výchozích hodnot během jednoleté studie u pacientů s diabetes mellitus 2. typu při použití v kombinaci s: (A) samotnou dietou; (B) sulfonylmočovina; (C) metformin; nebo (D) inzulín. Byly testovány rozdíly v léčbě po 6 a 12 měsících: * p
INFORMACE PRO PACIENTA
Pacientům by mělo být řečeno, aby užívali PRECOSE 50 mg perorálně třikrát denně na začátku (s prvním soustem) každého hlavního jídla. Je důležité, aby pacienti i nadále dodržovali dietní pokyny, pravidelný cvičební program a pravidelné testování moči a/nebo glukózy v krvi.
PRECOSE sám o sobě nezpůsobuje hypoglykémii ani při podávání pacientům nalačno. Sulfonylmočovinové léky a inzulín však mohou snížit hladinu cukru v krvi natolik, že způsobí příznaky nebo někdy život ohrožující hypoglykémii. Protože PRECOSE podávaný v kombinaci se sulfonylmočovinou nebo inzulínem způsobí další snížení hladiny cukru v krvi, může zvýšit hypoglykemický potenciál těchto látek. K hypoglykémii nedochází u pacientů užívajících samotný metformin za obvyklých okolností použití a nebyl pozorován žádný zvýšený výskyt hypoglykémie u pacientů, když byl k léčbě metforminem přidán PRECOSE. Pacienti a odpovědní rodinní příslušníci by měli dobře rozumět riziku hypoglykémie, jejím příznakům a léčbě a stavům, které k jejímu rozvoji predisponují. Vzhledem k tomu, že přípravek PRECOSE 50 mg zabraňuje rozkladu stolního cukru, pacienti by měli mít snadno dostupný zdroj glukózy (dextróza, D-glukóza) k léčbě příznaků nízké hladiny cukru v krvi, pokud užívají přípravek PRECOSE v kombinaci se sulfonylureou nebo inzulínem.
Pokud se u přípravku PRECOSE vyskytnou nežádoucí účinky, obvykle se vyvinou během prvních několika týdnů léčby. Nejčastěji se jedná o mírné až středně závažné gastrointestinální účinky, jako je plynatost, průjem nebo břišní diskomfort, a obecně se frekvence a intenzita s časem snižují.
