Amaryl 1mg, 2mg, 4mg Glimepiride Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Amaryl 1 mg a jak se používá?
Amaryl 4 mg je lék na předpis používaný k léčbě příznaků diabetes mellitus 2. typu. Amaryl 4 mg lze užívat samostatně nebo s jinými léky.
Amaryl 2 mg patří do skupiny léků nazývaných antidiabetika, sulfonylmočoviny.
Není známo, zda je přípravek Amaryl bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Amaryl?
Amaryl může způsobit závažné nežádoucí účinky včetně:
- bledá nebo zažloutlá kůže,
- tmavě zbarvená moč,
- zmatek,
- slabost a
- horečka
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Amaryl patří:
- bolest hlavy,
- závrať,
- slabost,
- nevolnost a
- nízká hladina cukru v krvi
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku Amaryl. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
AMARYL je perorální sulfonylmočovina, která obsahuje účinnou látku glimepirid. Chemicky je glimepirid identifikován jako 1-[[p-[2-(3-ethyl-4-methyl-2-oxo-3-pyrrolin-1-karboxamido)ethyl]fenyl]sulfonyl]-3-(trans-4- methylcyklohexyl)močovina (C24H34N4O5S) s molekulovou hmotností 490,62. Glimepirid je bílý až nažloutle bílý krystalický prášek bez zápachu až prakticky bez zápachu a je prakticky nerozpustný ve vodě. Strukturní vzorec je:
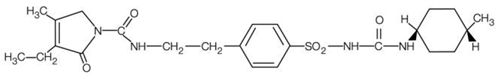
Tablety AMARYL obsahují účinnou látku glimepirid a následující neúčinné složky: laktózu (vodou), sodnou sůl karboxymethylškrobu, povidon, mikrokrystalickou celulózu a magnesium-stearát. Kromě toho tablety AMARYL 1 mg obsahují červený oxid železitý, tablety AMARYL 2 mg obsahují žlutý oxid železitý a hliníkové jezero FD&C Blue #2 a tablety AMARYL 4 mg obsahují hliníkové jezero FD&C Blue #2.
INDIKACE
AMARYL 2 mg je indikován jako doplněk k dietě a cvičení ke zlepšení kontroly glykémie u dospělých s diabetes mellitus 2. Klinické studie ].
Důležitá omezení použití
AMARYL by se neměl používat k léčbě diabetes mellitus 1. typu nebo diabetické ketoacidózy, protože by v těchto podmínkách nebyl účinný.
DÁVKOVÁNÍ A PODÁVÁNÍ
Doporučené dávkování
AMARYL 1 mg se má podávat se snídaní nebo prvním hlavním jídlem dne.
Doporučená počáteční dávka přípravku AMARYL je 1 mg nebo 2 mg jednou denně. Pacienti se zvýšeným rizikem hypoglykémie (např. starší pacienti nebo pacienti s poruchou funkce ledvin) by měli začít s 1 mg jednou denně (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití ve specifických populacích ].
Po dosažení denní dávky 2 mg lze další zvýšení dávky provést po 1 mg nebo 2 mg na základě glykemické odpovědi pacienta. Ke zvýšení titrace by nemělo docházet častěji než každé 1-2 týdny. U pacientů se zvýšeným rizikem hypoglykémie se doporučuje konzervativní titrační schéma [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití ve specifických populacích ].
Maximální doporučená dávka je 8 mg jednou denně.
Pacienti, kteří jsou převedeni na AMARYL 1 mg ze sulfonylmočovin s delším poločasem rozpadu (např. chlorpropamid), mohou mít překrývající se účinek léku po dobu 1-2 týdnů a měli by být náležitě monitorováni kvůli hypoglykémii.
Při současném podávání kolesevelamu s glimepiridem je snížena maximální plazmatická koncentrace a celková expozice glimepiridu. Proto by měl být AMARYL 2 mg podán alespoň 4 hodiny před kolesevelamem.
JAK DODÁVÁNO
Dávkové formy A Síly
AMARYL 4 mg je formulován jako tablety:
- 1 mg (růžový, plochý, podlouhlý se zářezy na dvou půlicích, s potiskem „AMA RYL“ na jedné straně)
- 2 mg (zelený, plochý, podlouhlý se zářezy na dvou půlicích, s potiskem „AMA RYL“ na jedné straně)
- 4 mg (modrý, plochý, podlouhlý se zářezy na dvou půlicích, s potiskem „AMA RYL“ na jedné straně)
Skladování A Manipulace
AMARYL tablety jsou dostupné v následujících silách a velikostech balení:
1 mg (růžová, plochá, podlouhlá se zářezy na dvou půlicích, s potiskem „AMA RYL“ na jedné straně) v lahvích po 100 ( NDC 0039-0221-10)
2 mg (zelená, plochá, podlouhlá se zářezy na dvou půlicích, s potiskem „AMA RYL“ na jedné straně) v lahvích po 100 ( NDC 0039-0222-10)
4 mg (modrá, plochá, podlouhlá se zářezy na dvou půlicích, s potiskem „AMA RYL“ na jedné straně) v lahvích po 100 ( NDC 0039-0223-10)
Skladujte při teplotě 25 °C (77 °F); povoleny výchylky do 20 - 25 °C (68 - 77 °F) (viz USP řízená pokojová teplota ).
Dávkujte v dobře uzavřených nádobách s bezpečnostními uzávěry.
sanofi-aventis US LLC, Bridgewater, NJ 08807, SPOLEČNOST SANOFI. Upraveno prosinec 2016
VEDLEJŠÍ EFEKTY
Následující závažné nežádoucí účinky jsou podrobněji popsány níže a jinde v označení:
- Hypoglykémie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hemolytická anémie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
V klinických studiích byly nejčastějšími nežádoucími účinky přípravku AMARYL 4 mg hypoglykémie, závratě, astenie, bolest hlavy a nauzea.
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Přibližně 2 800 pacientů s diabetem 2. typu bylo léčeno přípravkem AMARYL 4 mg v kontrolovaných klinických studiích. V těchto studiích bylo přibližně 1 700 pacientů léčeno přípravkem AMARYL po dobu alespoň 1 roku.
Tabulka 1 shrnuje nežádoucí příhody, jiné než hypoglykémie, které byly hlášeny v 11 sdružených placebem kontrolovaných studiích, ať už byly nebo nebyly považovány za možná či pravděpodobně související se studovanou medikací. Délka léčby se pohybovala od 13 týdnů do 12 měsíců. Pojmy, které jsou uvedeny, představují ty, které se vyskytly s incidencí ≥ 5 % u pacientů léčených AMARYLem a častěji než u pacientů, kteří dostávali placebo.
Hypoglykémie
V randomizované, dvojitě zaslepené, placebem kontrolované monoterapeutické studii trvající 14 týdnů podstoupili pacienti, kteří již byli léčeni sulfonylureou, 3týdenní vymývací období, poté byli randomizováni k AMARYLu 1 mg, 4 mg, 8 mg nebo placebu. Pacienti randomizovaní na AMARYL 4 mg nebo 8 mg podstoupili nucenou titraci z počáteční dávky 1 mg na tyto konečné dávky, jak je tolerováno (viz Klinické studie ]. Celková incidence možné hypoglykémie (definovaná přítomností alespoň jednoho příznaku, o kterém se výzkumník domníval, že by mohl souviset s hypoglykémií; současné měření glukózy nebylo vyžadováno) byla 4 % pro AMARYL 1 mg, 17 % pro AMARYL 4 mg, 16 % pro AMARYL 8 mg a 0 % pro placebo. Všechny tyto události byly léčeny samostatně.
V randomizované, dvojitě zaslepené, placebem kontrolované monoterapeutické studii trvající 22 týdnů dostávali pacienti počáteční dávku buď 1 mg AMARYLu nebo placebo denně. Dávka AMARYL 2 mg byla titrována na cílovou plazmatickou hladinu glukózy nalačno 90-150 mg/dl. Konečné denní dávky přípravku AMARYL 2 mg byly 1, 2, 3, 4, 6 nebo 8 mg (viz Klinické studie ]. Celková incidence možné hypoglykémie (jak je definována výše pro 14týdenní studii) pro AMARYL vs. placebo byla 19,7 % vs. 3,2 %. Všechny tyto události byly léčeny samostatně.
Přibývání na váze: AMARYL, stejně jako všechny deriváty sulfonylmočoviny, může způsobit nárůst hmotnosti [viz Klinické studie ].
Alergické reakce: klinických studiích se alergické reakce, jako je pruritus, erytém, kopřivka a morbiliformní nebo makulopapulární erupce, vyskytly u méně než 1 % pacientů léčených přípravkem AMARYL. Tyto mohou vymizet i přes pokračující léčbu přípravkem AMARYL. Existují postmarketingové zprávy o závažnějších alergických reakcích (např. dušnost, hypotenze, šok) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Laboratorní testy
Zvýšená sérová alaninaminotransferáza (ALT): V 11 sdružených placebem kontrolovaných studiích s přípravkem AMARYL se u 1,9 % pacientů léčených přípravkem AMARYL a u 0,8 % pacientů léčených placebem vyvinula sérová ALT vyšší než dvojnásobek horní hranice referenčního rozmezí.
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během používání přípravku AMARYL po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
- Závažné hypersenzitivní reakce, včetně anafylaxe, angioedému a Stevens-Johnsonova syndromu (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hemolytická anémie u pacientů s deficitem G6PD a bez něj [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Porucha funkce jater (např. s cholestázou a žloutenkou), stejně jako hepatitida, která může přejít v selhání jater.
- Porphyria cutanea tarda, fotosenzitivní reakce a alergická vaskulitida
- Leukopenie, agranulocytóza, aplastická anémie a pancytopenie
- Trombocytopenie (včetně závažných případů s počtem krevních destiček nižším než 10 000/μl) a trombocytopenická purpura
- Reakce jaterní porfyrie a reakce podobné disulfiramu
- Hyponatrémie a syndrom nepřiměřené sekrece antidiuretického hormonu (SIADH), nejčastěji u pacientů, kteří užívají jiné léky nebo kteří mají zdravotní stavy, o nichž je známo, že způsobují hyponatrémii nebo zvyšují uvolňování antidiuretického hormonu
- Dysgeuzie
- Alopecie
DROGOVÉ INTERAKCE
Léky ovlivňující metabolismus glukózy
Řada léků ovlivňuje metabolismus glukózy a může vyžadovat úpravu dávky přípravku AMARYL 4 mg a zvláště pečlivé sledování hypoglykémie nebo zhoršení kontroly glykémie.
Následují příklady léků, které mohou zvýšit účinek sulfonylmočovin na snížení hladiny glukózy včetně AMARYL 2 mg, čímž se zvýší náchylnost k hypoglykémii a/nebo její intenzita: perorální antidiabetika, pramlintid acetát, inzulín, inhibitory angiotenzin konvertujícího enzymu (ACE), Antagonisté H2 receptoru, fibráty, propoxyfen, pentoxifylin, analogy somatostatinu, anabolické steroidy a androgeny, cyklofosfamid, fenyramidol, guanetidin, flukonazol, sulfinpyrazon, tetracykliny, klarithromycin, disopyramid, chinolony, jako jsou chinolony a léky, které jsou vysoce vázané na proteiny, nesteroidní protizánětlivé léky, salicyláty, sulfonamidy, chloramfenikol, kumariny, probenecid a inhibitory monoaminooxidázy. Když jsou tyto léky podávány pacientovi užívajícímu AMARYL, pečlivě sledujte pacienta, zda nedochází k hypoglykémii. Když jsou tyto léky vysazeny u pacienta užívajícího AMARYL 2 mg, pečlivě sledujte pacienta, zda se nezhorší kontrola glykémie.
Níže jsou uvedeny příklady léků, které mohou snižovat účinek sulfonylmočovin včetně AMARYLu, což vede ke zhoršení glykemické kontroly: danazol, glukagon, somatropin, inhibitory proteázy, atypické antipsychotické léky (např. olanzapin a klozapin), barbituráty, diazoxid, laxativa rifampin, thiazidy a další diuretika, kortikosteroidy, fenothiaziny, hormony štítné žlázy, estrogeny, perorální antikoncepce, fenytoin, kyselina nikotinová, sympatomimetika (např. epinefrin, albuterol, terbutalin) a isoniazid. Pokud jsou tyto léky podávány pacientovi, který dostává AMARYL 2 mg, pečlivě sledujte pacienta, zda se nezhorší kontrola glykémie. Když jsou tyto léky vysazeny u pacienta užívajícího AMARYL 2 mg, pečlivě sledujte pacienta kvůli hypoglykémii.
Beta-blokátory, klonidin a reserpin mohou vést buď k zesílení nebo oslabení účinku přípravku AMARYL na snížení hladiny glukózy.
Akutní i chronický příjem alkoholu může nepředvídatelným způsobem zesílit nebo oslabit účinek přípravku AMARYL 1 mg na snížení glukózy.
U pacientů užívajících sympatolytika, jako jsou beta-blokátory, klonidin, guanetidin a reserpin, mohou být příznaky hypoglykémie sníženy nebo zcela chybět.
mikonazol
Byla hlášena potenciální interakce mezi perorálním mikonazolem a deriváty sulfonylmočoviny vedoucí k těžké hypoglykémii. Není známo, zda k této interakci dochází také u jiných lékových forem mikonazolu.
Cytochrom P450 2C9 Interakce
Může existovat interakce mezi glimepiridem a inhibitory (např. flukonazol) a induktory (např. rifampin) cytochromu P450 2C9. Flukonazol může inhibovat metabolismus glimepiridu a způsobit zvýšení plazmatických koncentrací glimepiridu, což může vést k hypoglykémii. Rifampin může indukovat metabolismus glimepiridu a způsobit snížení plazmatických koncentrací glimepiridu, což může vést ke zhoršení kontroly glykémie.
Současné podávání Colesevelamu
Colesevelam může snížit maximální plazmatickou koncentraci a celkovou expozici glimepiridu, pokud jsou tyto dva podávány současně. Absorpce však není snížena, když je glimepirid podáván 4 hodiny před kolesevelamem. Proto by měl být AMARYL podán alespoň 4 hodiny před kolesevelamem.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Hypoglykémie
Všechny sulfonylmočoviny, včetně AMARYL, mohou způsobit těžkou hypoglykémii [viz NEŽÁDOUCÍ REAKCE ]. Schopnost pacienta soustředit se a reagovat může být v důsledku hypoglykémie narušena. Tyto poruchy mohou představovat riziko v situacích, kdy jsou tyto schopnosti obzvláště důležité, jako je řízení nebo obsluha jiných strojů. Těžká hypoglykémie může vést k bezvědomí nebo křečím a může mít za následek dočasné nebo trvalé poškození mozkových funkcí nebo smrt.
Pacienti musí být edukováni, aby rozpoznali a zvládli hypoglykémii. Buďte opatrní při zahajování a zvyšování dávek přípravku AMARYL 2 mg u pacientů, kteří mohou být predisponováni k hypoglykémii (např. starší pacienti, pacienti s poruchou funkce ledvin, pacienti užívající jiné antidiabetické léky). Oslabení nebo podvyživení pacienti a pacienti s poruchou nadledvin, hypofýzy nebo jater jsou zvláště citliví na hypoglykemický účinek léků snižujících hladinu glukózy. Hypoglykémie se také pravděpodobněji objeví, když je kalorický příjem nedostatečný, po těžkém nebo dlouhodobém cvičení nebo při požití alkoholu.
Časné varovné příznaky hypoglykémie mohou být odlišné nebo méně výrazné u pacientů s autonomní neuropatií, starších osob a u pacientů užívajících beta-adrenergní blokátory nebo jiná sympatolytika. Tyto situace mohou vést k těžké hypoglykémii dříve, než si pacient hypoglykémii uvědomí.
Hypersenzitivní reakce
Po uvedení přípravku na trh byly u pacientů léčených přípravkem AMARYL hlášeny reakce přecitlivělosti, včetně závažných reakcí, jako je anafylaxe, angioedém a Stevens-Johnsonův syndrom. Je-li podezření na reakci přecitlivělosti, okamžitě přerušte léčbu přípravkem AMARYL, zjistěte další možné příčiny reakce a nasaďte alternativní léčbu diabetu.
Hemolytická anémie
Deriváty sulfonylmočoviny mohou způsobit hemolytickou anémii u pacientů s deficitem glukózo-6-fosfátdehydrogenázy (G6PD). Vzhledem k tomu, že AMARYL 4 mg je sulfonylmočovina, buďte opatrní u pacientů s nedostatkem G6PD a zvažte použití alternativy bez sulfonylmočoviny. Existují také postmarketingové zprávy o hemolytické anémii u pacientů užívajících AMARYL 1 mg, kteří neměli známou deficienci G6PD (viz NEŽÁDOUCÍ REAKCE ].
Zvýšené riziko kardiovaskulární úmrtnosti u derivátů sulfonylmočoviny
Bylo hlášeno, že podávání perorálních hypoglykemických léků je spojeno se zvýšenou kardiovaskulární mortalitou ve srovnání s léčbou samotnou dietou nebo dietou plus inzulín. Toto varování je založeno na studii provedené University Group Diabetes Program (UGDP), což je dlouhodobá prospektivní klinická studie navržená pro hodnocení účinnosti léků snižujících hladinu glukózy v prevenci nebo oddálení vaskulárních komplikací u pacientů s nezávislými na inzulínu. cukrovka. Studie se zúčastnilo 823 pacientů, kteří byli náhodně rozděleni do jedné ze čtyř léčebných skupin. UGDP uvedlo, že pacienti léčení po dobu 5 až 8 let dietou plus fixní dávkou tolbutamidu (1,5 gramu denně) měli míru kardiovaskulární mortality přibližně 2-½krát. u pacientů léčených pouze dietou. Nebylo pozorováno signifikantní zvýšení celkové mortality, ale užívání tolbutamidu bylo přerušeno na základě zvýšení kardiovaskulární mortality, čímž byla omezena možnost studie prokázat zvýšení celkové mortality. Navzdory sporům ohledně interpretace těchto výsledků poskytují výsledky studie UGDP adekvátní základ pro toto varování. Pacient by měl být informován o možných rizicích a výhodách přípravku AMARYL 4 mg ao alternativních způsobech léčby. Ačkoli byl do této studie zahrnut pouze jeden lék ze skupiny sulfonylmočovin (tolbutamid), z hlediska bezpečnosti je rozumné zvážit, že toto varování se může vztahovat také na jiná perorální hypoglykemická léčiva v této třídě, vzhledem k jejich blízké podobnosti v režimu působení a chemická struktura.
Makrovaskulární výsledky
Neexistují žádné klinické studie, které by prokázaly přesvědčivé důkazy o snížení makrovaskulárního rizika u přípravku AMARYL nebo jiného antidiabetika.
Neklinická toxikologie
Karcinogeneze, mutageneze a zhoršování plodnosti
Studie na potkanech v dávkách až 5000 částic na milion (ppm) v kompletním krmivu (přibližně 340násobek maximální doporučené dávky pro člověka, na základě plochy povrchu) po dobu 30 měsíců neprokázaly žádné známky karcinogeneze. U myší vedlo podávání glimepiridu po dobu 24 měsíců ke zvýšení tvorby benigního pankreatického adenomu, který byl závislý na dávce a byl považován za výsledek chronické pankreatické stimulace. Žádná tvorba adenomu u myší nebyla pozorována při dávce 320 ppm v kompletním krmivu nebo 46-54 mg/kg tělesné hmotnosti/den. To je asi 35násobek maximální doporučené dávky u člověka 8 mg jednou denně podle plochy povrchu.
Glimepirid nebyl mutagenní v řadě studií mutagenity in vitro a in vivo (Amesův test, mutace somatických buněk, chromozomální aberace, neplánovaná syntéza DNA a mikronukleový test u myší).
U zvířat vystavených dávce až 2 500 mg/kg tělesné hmotnosti (> 1 700násobek maximální doporučené dávky pro člověka na základě plochy povrchu) neměl glimepirid žádný účinek na fertilitu myších samců. Glimepirid neměl žádný vliv na fertilitu samců a samic potkanů, kterým byla podávána dávka až do 4 000 mg/kg tělesné hmotnosti (přibližně 4 000násobek maximální doporučené dávky pro člověka na základě plochy povrchu).
Použití u konkrétních populací
Těhotenství
Kategorie těhotenství C
Neexistují žádné adekvátní a dobře kontrolované studie s přípravkem AMARYL 2 mg u těhotných žen. Ve studiích na zvířatech nedošlo ke zvýšení vrozených anomálií, ale ke zvýšení úmrtnosti plodu došlo u potkanů a králíků při dávkách glimepiridu 50násobku (potkani) a 0,1násobku (králíci) maximální doporučené dávky pro člověka (na základě plochy povrchu těla). Předpokládá se, že tato fetotoxicita, pozorovaná pouze u dávek vyvolávajících mateřskou hypoglykémii, přímo souvisí s farmakologickým (hypoglykemickým) účinkem glimepiridu a byla obdobně zaznamenána u jiných derivátů sulfonylmočoviny. AMARYL by měl být užíván během těhotenství pouze tehdy, pokud potenciální přínos ospravedlňuje potenciální riziko pro plod. Protože údaje naznačují, že abnormální hladina glukózy v krvi během těhotenství je spojena s vyšším výskytem vrozených abnormalit, léčba diabetu během těhotenství by měla udržovat hladinu glukózy v krvi co nejblíže normálu.
Neteratogenní účinky
novorozenců narozených matkám užívajícím sulfonylmočovinu v době porodu byla hlášena dlouhodobá těžká hypoglykémie (4 až 10 dnů).
Kojící matky
Není známo, zda se AMARYL 1 mg vylučuje do mateřského mléka. Během prenatálních a postnatálních studií u potkanů byly významné koncentrace glimepiridu přítomny v mateřském mléce a séru mláďat. U potomků potkanů vystavených vysokým hladinám glimepiridu během březosti a laktace se v postnatálním období vyvinuly kosterní deformity sestávající ze zkrácení, ztluštění a ohnutí pažní kosti. Bylo zjištěno, že tyto kosterní deformace jsou výsledkem ošetřování matek vystavených glimepiridu. Na základě těchto údajů na zvířatech a možnosti hypoglykémie u kojeného dítěte by se mělo rozhodnout, zda přerušit kojení nebo přerušit léčbu přípravkem AMARYL 2 mg, přičemž je třeba vzít v úvahu význam přípravku AMARYL pro matku.
Pediatrické použití
Farmakokinetika, účinnost a bezpečnost přípravku AMARYL 4 mg byla hodnocena u pediatrických pacientů s diabetem 2. typu, jak je popsáno níže. AMARYL 4 mg se nedoporučuje u pediatrických pacientů kvůli jeho nežádoucím účinkům na tělesnou hmotnost a hypoglykémii.
Farmakokinetika jednorázové dávky 1 mg přípravku AMARYL byla hodnocena u 30 pacientů s diabetem 2. typu (muži = 7; ženy = 23) ve věku 10 až 17 let. Průměrné (± SD) AUC (339±203 ng·hod/ml), Cmax (102±48 ng/ml) a t½ (3,1±1,7 hodiny) pro glimepirid byly srovnatelné s historickými údaji od dospělých (AUC(0-poslední ) 315±96 ng·hod/ml, Cmax 103±34 ng/ml a t½ 5,3±4,1 hodiny).
Bezpečnost a účinnost přípravku AMARYL u pediatrických pacientů byla hodnocena v jednoduše zaslepené 24týdenní studii, která randomizovala 272 pacientů (ve věku 8-17 let) s diabetem 2. typu na AMARYL (n=135) nebo metformin (n=137 ). Zúčastnit se mohli jak dosud neléčení pacienti (ti, kteří byli léčeni pouze dietou a cvičením po dobu alespoň 2 týdnů před randomizací), tak dříve léčení pacienti (ti, kteří byli dříve léčeni nebo jsou v současnosti léčeni jinými perorálními antidiabetiky po dobu alespoň 3 měsíců). Pacienti, kteří v době vstupu do studie dostávali perorální antidiabetika, přerušili tyto léky před randomizací bez vymývacího období. AMARYL byl zahájen v dávce 1 mg a poté titrován až na 2, 4 nebo 8 mg (průměrná poslední dávka 4 mg) do 12. týdne s cílem samostatně monitorovat glykémii z prstu nalačno
Po 24 týdnech byl celkový průměrný léčebný rozdíl v HbA1c mezi přípravkem AMARYL 4 mg a metforminem 0,2 %, ve prospěch metforminu (95% interval spolehlivosti -0,3 % až +0,6 %). Na základě těchto výsledků studie nesplnila svůj primární cíl prokázat podobné snížení HbA1c u přípravku AMARYL 4 mg ve srovnání s metforminem.
Profil nežádoucích účinků u pediatrických pacientů léčených přípravkem AMARYL 2 mg byl podobný jako u dospělých (viz NEŽÁDOUCÍ REAKCE ].
Hypoglykemické příhody dokumentované hodnotami glukózy v krvi
Geriatrické použití
klinických studiích přípravku AMARYL 2 mg bylo 1 053 z 3 491 pacientů (30 %) ve věku > 65 let. Mezi těmito pacienty a mladšími pacienty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti, nelze však vyloučit větší citlivost některých starších jedinců.
Nebyly žádné významné rozdíly ve farmakokinetice glimepiridu mezi pacienty s diabetem 2. typu ≤ 65 let (n=49) a pacienty > 65 let (n=42) [viz KLINICKÁ FARMAKOLOGIE ].
Glimepirid je v podstatě vylučován ledvinami. U starších pacientů je větší pravděpodobnost poškození ledvin. Kromě toho může být u starších lidí obtížné rozpoznat hypoglykémii [viz DÁVKOVÁNÍ A PODÁVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Buďte opatrní při zahájení léčby přípravkem AMARYL a zvyšování dávky přípravku AMARYL 1 mg u této populace pacientů.
Renální poškození
Aby se minimalizovalo riziko hypoglykémie, je doporučená počáteční dávka přípravku AMARYL 1 mg denně pro všechny pacienty s diabetem 2. typu a poruchou funkce ledvin (viz DÁVKOVÁNÍ A PODÁVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Studie s titrací více dávek byla provedena u 16 pacientů s diabetem 2. typu a poruchou funkce ledvin s použitím dávek v rozmezí od 1 mg do 8 mg denně po dobu 3 měsíců. Základní clearance kreatininu se pohybovala v rozmezí 10-60 ml/min. Farmakokinetika přípravku AMARYL byla hodnocena ve studii titrace více dávek a výsledky byly v souladu s výsledky pozorovanými u pacientů zařazených do studie s jednorázovou dávkou. V obou studiích se relativní celková clearance přípravku AMARYL zvýšila při poruše funkce ledvin. Obě studie také prokázaly, že eliminace dvou hlavních metabolitů byla snížena u pacientů s poruchou funkce ledvin [viz KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
Předávkování přípravkem AMARYL 2 mg, stejně jako jinými deriváty sulfonylmočoviny, může vyvolat těžkou hypoglykémii. Mírné epizody hypoglykémie lze léčit perorální glukózou. Těžké hypoglykemické reakce představují lékařské pohotovosti vyžadující okamžitou léčbu. Těžkou hypoglykémii s komatem, záchvaty nebo neurologickým poškozením lze léčit glukagonem nebo intravenózní glukózou. Pokračující sledování a další příjem sacharidů může být nezbytný, protože hypoglykémie se může opakovat po zjevném klinickém zotavení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
KONTRAINDIKACE
AMARYL je kontraindikován u pacientů s anamnézou hypersenzitivní reakce na:
- Glimepirid nebo kterákoli ze složek přípravku [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Sulfonamidové deriváty: U pacientů, u kterých se vyvinula alergická reakce na sulfonamidové deriváty, se může rozvinout alergická reakce na AMARYL. AMARYL 4 mg nepoužívejte u pacientů, kteří mají v anamnéze alergickou reakci na sulfonamidové deriváty.
Hlášené reakce přecitlivělosti zahrnují kožní erupce se svěděním nebo bez něj, stejně jako závažnější reakce (např. anafylaxe, angioedém, Stevens-Johnsonův syndrom, dušnost) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a NEŽÁDOUCÍ REAKCE ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Glimepirid primárně snižuje hladinu glukózy v krvi stimulací uvolňování inzulínu z pankreatických beta buněk. Deriváty sulfonylmočoviny se vážou na sulfonylmočovinový receptor v plazmatické membráně pankreatických beta-buněk, což vede k uzavření ATP-senzitivního draslíkového kanálu, čímž se stimuluje uvolňování inzulínu.
Farmakodynamika
U zdravých jedinců byla doba k dosažení maximálního účinku (minimální koncentrace glukózy v krvi) přibližně 2-3 hodiny po jednorázové perorální dávce přípravku AMARYL. Účinky AMARYLu na HbA1c, plazmatickou glukózu nalačno a glukózu po jídle byly hodnoceny v klinických studiích (viz Klinické studie ].
Farmakokinetika
Vstřebávání
Studie s jednorázovými perorálními dávkami glimepiridu u zdravých subjektů as opakovanými perorálními dávkami u pacientů s diabetem 2. typu ukázaly maximální koncentrace léčiva (Cmax) 2 až 3 hodiny po podání dávky. Když byl glimepirid podáván s jídlem, průměrná Cmax a AUC (plocha pod křivkou) byly sníženy o 8 % a 9 %.
Glimepirid se po opakovaném podání nehromadí v séru. Farmakokinetika glimepiridu se mezi zdravými subjekty a pacienty s diabetem 2. typu neliší. Clearance glimepiridu po perorálním podání se nemění v rozmezí dávek 1 mg až 8 mg, což ukazuje na lineární farmakokinetiku.
U zdravých jedinců byla intraindividuální variabilita farmakokinetických parametrů glimepiridu 15-23 % a interindividuální variabilita 24-29 %.
Rozdělení
Po intravenózním podání zdravým subjektům byl distribuční objem (Vd) 8,8 l (113 ml/kg) a celková tělesná clearance (CL) byla 47,8 ml/min. Vazba na proteiny byla vyšší než 99,5 %.
Metabolismus
Glimepirid je po intravenózní nebo perorální dávce zcela metabolizován oxidativní biotransformací. Hlavními metabolity jsou cyklohexylhydroxymethylderivát (M1) a karboxylový derivát (M2). Cytochrom P450 2C9 se účastní biotransformace glimepiridu na M1. M1 je dále metabolizován na M2 jedním nebo několika cytosolickými enzymy. M2 je neaktivní. U zvířat má M1 asi jednu třetinu farmakologické aktivity glimepiridu, ale není jasné, zda M1 vede ke klinicky významným účinkům na hladinu glukózy v krvi u lidí.
Vylučování
Když byl 14C-glimepirid perorálně podán 3 zdravým mužům, přibližně 60 % celkové radioaktivity bylo nalezeno v moči během 7 dnů. M1 a M2 představovaly 80-90 % radioaktivity zachycené v moči. Poměr M1 k M2 v moči byl přibližně 3:2 u dvou subjektů a 4:1 u jednoho subjektu. Přibližně 40 % celkové radioaktivity bylo nalezeno ve stolici. M1 a M2 představovaly asi 70 % (poměr M1 k M2 byl 1:3) radioaktivity získané ve stolici. Z moči nebo stolice nebylo získáno žádné původní léčivo. Po intravenózním podání u pacientů nebylo pozorováno žádné významné vylučování glimepiridu nebo jeho metabolitu M1 žlučí.
Geriatričtí pacienti
Srovnání farmakokinetiky glimepiridu u pacientů s diabetem 2. typu ≤ 65 let a pacientů starších 65 let bylo hodnoceno ve studii s opakovanými dávkami s AMARYLem 6 mg denně. Mezi těmito dvěma věkovými skupinami nebyly žádné významné rozdíly ve farmakokinetice glimepiridu. Průměrná AUC v rovnovážném stavu u starších pacientů byla přibližně o 13 % nižší než u mladších pacientů; průměrná clearance upravená podle hmotnosti u starších pacientů byla přibližně o 11 % vyšší než u mladších pacientů.
Rod
Nebyly žádné rozdíly mezi muži a ženami ve farmakokinetice glimepiridu, když byla provedena úprava o rozdíly v tělesné hmotnosti.
Závod
Nebyly provedeny žádné studie hodnotící účinky rasy na farmakokinetiku glimepiridu, ale v placebem kontrolovaných studiích s AMARYL 2 mg u pacientů s diabetem 2. typu bylo snížení HbA srovnatelné u bělochů (n = 536), černochů (n = 63). a Hispánci (n = 63).
Renální poškození
Jednodávková otevřená studie AMARYL 3 mg byla podávána pacientům s mírnou, středně těžkou a těžkou renální insuficiencí odhadovanou podle clearance kreatininu (CLcr): Skupina I sestávala z 5 pacientů s mírnou poruchou funkce ledvin (CLcr > 50 ml/min ), skupinu II tvořili 3 pacienti se středně těžkou poruchou funkce ledvin (CLcr = 20-50 ml/min) a skupinu III tvořilo 7 pacientů s těžkou poruchou funkce ledvin (CLcr
Poškození jater
Není známo, zda má porucha funkce jater vliv na farmakokinetiku přípravku AMARYL 1 mg, protože farmakokinetika přípravku AMARYL 1 mg nebyla u pacientů s poruchou funkce jater dostatečně hodnocena.
Obézní pacienti
Farmakokinetika glimepiridu a jeho metabolitů byla měřena ve studii s jednorázovou dávkou zahrnující 28 pacientů s diabetem 2. typu, kteří měli buď normální tělesnou hmotnost, nebo byli morbidně obézní. Zatímco tmax, clearance a distribuční objem glimepiridu u morbidně obézních pacientů byly podobné jako u pacientů s normální hmotností, morbidně obézní měli nižší Cmax a AUC než pacienti s normální tělesnou hmotností. Průměrné hodnoty Cmax, AUC0-24, AUC0-∞ glimepiridu u normálních vs. morbidně obézních pacientů byly 547 ± 218 ng/ml vs. 410 ± 124 ng/ml, 3210 ± 1030 hodin·ng/ml vs. 282 hodin·ng/ml a 4000 ± 1320 hodin·ng/ml vs. 3280 ± 1360 hodin·ng/ml, v daném pořadí.
Lékové interakce
Aspirin: randomizované, dvojitě zaslepené, dvoudobé, zkřížené studii bylo zdravým subjektům podáváno buď placebo nebo aspirin 1 gram třikrát denně po celkovou dobu léčby 5 dnů. V den 4 každého studijního období byla podána jedna 1 mg dávka přípravku AMARYL 4 mg. Dávky AMARYL 4 mg byly odděleny 14denním vymývacím obdobím. Současné podávání aspirinu a AMARYLU 4 mg vedlo k 34% snížení průměrné AUC glimepiridu a 4% snížení průměrné Cmax glimepiridu.
Colesevelam: Současné podávání kolesevelamu a glimepiridu vedlo ke snížení AUC0-∞ glimepiridu o 18 % a Cmax o 8 %. Když byl glimepirid podáván 4 hodiny před kolesevelamem, nedošlo k žádné významné změně AUC0-∞ glimepiridu a Cmax, -6 % a 3 %, v tomto pořadí [viz DÁVKOVÁNÍ A PODÁVÁNÍ a DROGOVÉ INTERAKCE ].
Cimetidin a ranitidin: randomizované, otevřené, 3-cestné zkřížené studii dostali zdraví jedinci buď jednu 4 mg dávku samotného AMARYLU, AMARYL s ranitidinem (150 mg dvakrát denně po dobu 4 dnů; AMARYL 2 mg byl podáván 3. den) nebo AMARYL 2 mg s cimetidinem (800 mg denně po dobu 4 dnů; AMARYL byl podáván 3. den). Současné podávání cimetidinu nebo ranitidinu s jednorázovou perorální dávkou 4 mg přípravku AMARYL 4 mg významně nezměnilo absorpci a likvidaci glimepiridu.
Propranolol: randomizované, dvojitě zaslepené, dvoudobé, zkřížené studii bylo zdravým subjektům podáváno buď placebo nebo propranolol 40 mg třikrát denně po celkovou dobu léčby 5 dnů. V den 4 nebo každé období studie byla podána jedna 2 mg dávka přípravku AMARYL 4 mg. Dávky AMARYL 4 mg byly odděleny 14denním vymývacím obdobím. Současné podávání propranololu a AMARYLU 1 mg významně zvýšilo Cmax glimepiridu, AUC a T½ o 23 %, 22 % a 15 % a snížilo CL/f glimepiridu o 18 %. Získávání M1 a M2 z moči se nezměnilo.
Warfarin: otevřené, dvoucestné, zkřížené studii dostávali zdraví jedinci 4 mg přípravku AMARYL 2 mg denně po dobu 10 dnů. Jednotlivé 25mg dávky warfarinu byly podávány 6 dní před zahájením podávání AMARYLu a 4. den podávání AMARYLu. Současné podávání přípravku AMARYL nezměnilo farmakokinetiku enantiomerů R- a S-warfarinu. Nebyly pozorovány žádné změny ve vazbě warfarinu na plazmatické proteiny. AMARYL 1 mg vedl ke statisticky významnému snížení farmakodynamické odpovědi na warfarin. Snížení průměrné plochy pod křivkou protrombinového času (PT) a maximálních hodnot PT během léčby přípravkem AMARYL bylo 3,3 % a 9,9 %, a je nepravděpodobné, že by byly klinicky relevantní.
Klinické studie
Monoterapie
Celkem 304 pacientů s diabetem 2. typu již léčených sulfonylureou se zúčastnilo 14týdenní, multicentrické, randomizované, dvojitě zaslepené, placebem kontrolované studie hodnotící bezpečnost a účinnost monoterapie přípravkem AMARYL 1 mg. Pacienti přerušili léčbu sulfonylureou a poté vstoupili do 3týdenního období vymývacího období s placebem, po kterém následovala randomizace do 1 ze 4 léčebných skupin: placebo (n=74), AMARYL 1 mg (n=78), AMARYL 4 mg (n=76) a AMARYL 8 mg (n=76). Všichni pacienti randomizovaní na AMARYL 4 mg začali 1 mg denně. Pacienti randomizovaní k AMARYL 4 mg nebo 8 mg měli zaslepenou, nucenou titraci dávky AMARYL 2 mg v týdenních intervalech, nejprve na 4 mg a poté na 8 mg, pokud byla dávka tolerována, dokud nebylo dosaženo randomizované dávky. Pacienti randomizovaní k dávce 4 mg dosáhli přidělené dávky v týdnu 2. Pacienti randomizovaní k dávce 8 mg dosáhli přidělené dávky v týdnu 3. Jakmile bylo dosaženo úrovně randomizované dávky, pacienti měli být na této dávce udržováni až do 14. týdne. Přibližně 66 % pacientů léčených placebem dokončilo studii ve srovnání s 81 % pacientů léčených glimepiridem 1 mg a 92 % pacientů léčených glimepiridem 4 mg nebo 8 mg. Ve srovnání s placebem poskytla léčba přípravkem AMARYL 1 mg, 4 mg a 8 mg denně statisticky významné zlepšení HbA1c ve srovnání s placebem (tabulka 3).
Celkem 249 pacientů, kteří dosud nebyli léčeni nebo kteří v minulosti dostávali omezenou léčbu antidiabetiky, bylo randomizováno k 22týdenní léčbě buď AMARYL (n=123) nebo placebem (n=126) v multicentrickém, randomizovaném , dvojitě zaslepená, placebem kontrolovaná studie s titrací dávky. Počáteční dávka přípravku AMARYL byla 1 mg denně a byla titrována směrem nahoru nebo dolů ve 2týdenních intervalech na cílovou FPG 90-150 mg/dl. Hladiny glukózy v krvi pro FPG i PPG byly analyzovány v laboratoři. Po 10 týdnech úpravy dávky byli pacienti udržováni na své optimální dávce (1, 2, 3, 4, 6 nebo 8 mg) po zbývajících 12 týdnů studie. Léčba přípravkem AMARYL 2 mg poskytla statisticky významné zlepšení HbA1c a FPG ve srovnání s placebem (tabulka 4).
INFORMACE PRO PACIENTA
Informujte pacienty o důležitosti dodržování dietních pokynů, pravidelného cvičebního programu a pravidelného měření hladiny glukózy v krvi.
Informujte pacienty o potenciálních vedlejších účincích přípravku AMARYL 1 mg včetně hypoglykémie a přírůstku hmotnosti.
Vysvětlete příznaky a léčbu hypoglykémie a také stavy, které k hypoglykémii predisponují. Pacienti by měli být informováni, že schopnost koncentrace a reakce může být narušena v důsledku hypoglykémie. To může představovat riziko v situacích, kdy jsou tyto schopnosti obzvláště důležité, jako je řízení nebo obsluha jiných strojů.
Pacientky s diabetem by měly být poučeny, aby informovaly svého poskytovatele zdravotní péče, pokud jsou těhotné, zvažují těhotenství, kojí nebo zvažují kojení.
