Glucovance 400/2.50mg, 500/5mg Metformin Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Glucovance 2,50 mg a jak se používá?
Glucovance 400 mg je lék na předpis používaný k léčbě příznaků diabetu mellitu 2. Glucovance lze užívat samostatně nebo s jinými léky.
Glucovance patří do třídy léků nazývaných antidiabetika, sulfonylmočoviny/biguanidy.
Není známo, zda je přípravek Glucovance 2,50 mg bezpečný a účinný u dětí.
Jaké jsou možné nežádoucí účinky přípravku Glucovance 400 mg?
Glucovance může způsobit závažné nežádoucí účinky, včetně:
- kopřivka,
- potíže s dýcháním,
- otok obličeje, rtů, jazyka nebo hrdla,
- otok,
- rychlý nárůst hmotnosti,
- dušnost,
- extrémní slabost,
- rozmazané vidění,
- pocení,
- potíže s mluvením,
- třes,
- bolest břicha,
- zmatek,
- záchvaty,
- neobvyklá bolest svalů,
- potíže s dýcháním,
- bolest břicha,
- zvracení,
- nepravidelná srdeční frekvence,
- závrať,
- cítit zimu,
- slabost a
- únava
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Glucovance patří:
- nízká hladina cukru v krvi,
- nevolnost,
- průjem,
- podrážděný žaludek a
- bolest hlavy
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Glucovance. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
Tablety GLUCOVANCE® (Glyburid a Metformin HCl) obsahují 2 perorální antihyperglykemická léčiva používaná při léčbě diabetu 2. typu, glyburid a metformin hydrochlorid.
Glyburid je perorální antihyperglykemický lék ze třídy sulfonylmočoviny. Chemický název glyburidu je 1-[[p-[2-(5-chlor-o-anisamido)ethyl]fenyl]sulfonyl]-3-cyklohexylmočovina. Glyburid je bílá až téměř bílá krystalická sloučenina s molekulovým vzorcem C23H28ClN3O5S a molekulovou hmotností 494,01. Glyburid použitý v GLUCOVANCE 5mg má distribuci velikosti částic 25 % hodnoty podsítnosti ne větší než 6 μm, 50 % hodnoty podsítnosti ne větší než 7 až 10 μm a 75 % hodnoty podsítnosti ne větší než 21 μm. Strukturní vzorec je uveden níže.
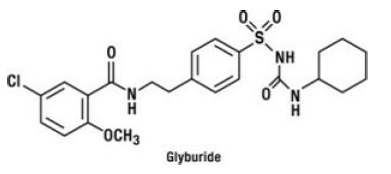
Metformin hydrochlorid je perorální antihyperglykemické léčivo používané při léčbě diabetu 2. Metformin hydrochlorid (N,N-dimethylimidodikarbonimidic diamid monohydrochlorid) není chemicky ani farmakologicky příbuzný sulfonylmočovině, thiazolidindionům nebo inhibitorům α-glukosidázy. Je to bílá až téměř bílá krystalická sloučenina s molekulovým vzorcem C4H12ClN5 (monohydrochlorid) a molekulovou hmotností 165,63. Metformin hydrochlorid je volně rozpustný ve vodě a je prakticky nerozpustný v acetonu, etheru a chloroformu. pKa metforminu je 12,4. pH 1% vodného roztoku hydrochloridu metforminu je 6,68. Strukturní vzorec je následující:
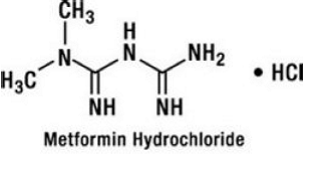
GLUCOVANCE 500 mg je k dispozici pro perorální podání v tabletách obsahujících 1,25 mg glyburidu s 250 mg metformin hydrochloridu, 2,5 mg glyburidu s 500 mg metformin hydrochloridu a 5 mg glyburidu s 500 mg metformin hydrochloridu. Kromě toho každá tableta obsahuje následující neaktivní složky: mikrokrystalickou celulózu, povidon, sodnou sůl kroskarmelózy a stearát hořečnatý. Tablety jsou potaženy filmem, který zajišťuje barevné odlišení.
INDIKACE
Tablety GLUCOVANCE (Glyburid a Metformin HCl) jsou indikovány jako doplněk k dietě a cvičení ke zlepšení kontroly glykémie u dospělých s diabetes mellitus 2. typu.
DÁVKOVÁNÍ A PODÁVÁNÍ
Obecné úvahy
Dávkování přípravku GLUCOVANCE musí být individualizováno na základě účinnosti i snášenlivosti, přičemž nesmí být překročena maximální doporučená denní dávka 20 mg glyburidu/2000 mg metforminu. GLUCOVANCE by se měla podávat s jídlem a měla by být zahájena nízkou dávkou s postupným zvyšováním dávky, jak je popsáno níže, aby se předešlo hypoglykémii (z velké části způsobené glyburidem), snížily se nežádoucí účinky na GI (z velké části kvůli metforminu) a umožnilo se stanovení minimální účinná dávka pro adekvátní kontrolu hladiny glukózy v krvi u jednotlivého pacienta.
Při počáteční léčbě a během titrace dávky by mělo být použito vhodné monitorování hladiny glukózy v krvi ke stanovení terapeutické odpovědi na GLUCOVANCE 2,50 mg a ke stanovení minimální účinné dávky pro pacienta. Poté by měl být HbA1c měřen v přibližně 3měsíčních intervalech, aby se zhodnotila účinnost terapie. Terapeutickým cílem u všech pacientů s diabetem 2. typu je snížení FPG, PPG a HbA1c na normální nebo co nejblíže normálu. V ideálním případě by odpověď na terapii měla být hodnocena pomocí HbA (glykosylovaný hemoglobin), který je lepším indikátorem dlouhodobé kontroly glykémie než samotný FPG.
Nebyly provedeny žádné studie specificky zkoumající bezpečnost a účinnost přechodu na léčbu přípravkem GLUCOVANCE 400 mg u pacientů užívajících současně glyburid (nebo jinou sulfonylmočovinu) plus metformin. U těchto pacientů se mohou vyskytnout změny v kontrole glykémie, s možnou hyperglykémií nebo hypoglykémií. Jakákoli změna v léčbě diabetu 2. typu by měla být prováděna s opatrností a vhodným sledováním.
GLUCOVANCE u pacientů s nedostatečnou kontrolou glykémie při dietě a cvičení
Doporučená počáteční dávka: 1,25 mg/250 mg jednou nebo dvakrát denně s jídlem.
pacientů s diabetem 2. typu, jejichž hyperglykémii nelze uspokojivě zvládnout pouze dietou a cvičením, je doporučená počáteční dávka přípravku GLUCOVANCE 400 mg 1,25 mg/250 mg jednou denně s jídlem. Jako počáteční léčbu u pacientů s výchozí hodnotou HbA1c > 9 % nebo FPG > 200 mg/dl lze použít úvodní dávku GLUCOVANCE 1,25 mg/250 mg dvakrát denně s ranním a večerním jídlem. Dávkování by se mělo zvyšovat o 1,25 mg/250 mg denně každé 2 týdny až do minimální účinné dávky nutné k dosažení adekvátní kontroly hladiny glukózy v krvi. V klinických studiích s přípravkem GLUCOVANCE jako počáteční léčbou nebyly žádné zkušenosti s celkovými denními dávkami > 10 mg/2000 mg denně. GLUCOVANCE 5 mg/500 mg by se neměl používat jako úvodní léčba kvůli zvýšenému riziku hypoglykémie.
GLUCOVANCE 500 mg Použití u pacientů s nedostatečnou kontrolou glykémie na sulfonylmočovině a/nebo metforminu
Doporučená počáteční dávka: 2,5 mg/500 mg nebo 5 mg/500 mg dvakrát denně s jídlem.
pacientů, u kterých není adekvátně kontrolována léčba samotným glyburidem (nebo jinou sulfonylureou) nebo metforminem, je doporučená počáteční dávka přípravku GLUCOVANCE 2,5 mg/500 mg nebo 5 mg/500 mg dvakrát denně s ranním a večerním jídlem. Aby se předešlo hypoglykémii, počáteční dávka přípravku GLUCOVANCE 2,50 mg by neměla překročit již užívané denní dávky glyburidu nebo metforminu. Denní dávka by měla být titrována v přírůstcích ne více než 5 mg/500 mg až do minimální účinné dávky k dosažení adekvátní kontroly hladiny glukózy v krvi nebo na maximální dávku 20 mg/2000 mg denně.
pacientů, kteří byli dříve léčeni kombinovanou terapií glyburidem (nebo jinou sulfonylureou) plus metforminem, by v případě přechodu na GLUCOVANCE neměla zahajovací dávka překročit denní dávku glyburidu (nebo ekvivalentní dávku jiné sulfonylmočoviny) a metforminu, kterou již užívají. Pacienti by měli být po takovém přechodu pečlivě sledováni, zda se u nich nevyskytují známky a příznaky hypoglykémie a dávka přípravku GLUCOVANCE by měla být titrována, jak je popsáno výše, aby se dosáhlo adekvátní kontroly hladiny glukózy v krvi.
Přidání thiazolidindionů k terapii GLUCOVANCE
pacientek, které nejsou dostatečně kontrolovány přípravkem GLUCOVANCE, lze k léčbě přípravkem GLUCOVANCE 400 mg přidat thiazolidindion. Když je k léčbě přípravkem GLUCOVANCE přidán thiazolidindion, lze pokračovat v současné dávce přípravku GLUCOVANCE 500 mg a zahájit léčbu thiazolidindionem v doporučené počáteční dávce. U pacientů, kteří potřebují další kontrolu glykémie, lze dávku thiazolidindionu zvýšit na základě doporučeného titračního schématu. Zvýšená kontrola glykémie dosažitelná s přípravkem GLUCOVANCE plus thiazolidindion může zvýšit možnost hypoglykémie v kteroukoli denní dobu. U pacientů, u kterých se rozvine hypoglykémie při užívání přípravku GLUCOVANCE 5 mg a thiazolidindionu, je třeba zvážit snížení dávky glyburidové složky přípravku GLUCOVANCE. Jak je klinicky odůvodněno, je třeba zvážit také úpravu dávkování ostatních složek antidiabetického režimu.
Pacienti, kteří dostávají Colesevelam
Při současném podávání kolesevelamu s glyburidem se snižuje maximální plazmatická koncentrace a celková expozice glyburidu. Proto by měl být GLUCOVANCE podáván alespoň 4 hodiny před kolesevelamem.
Specifické populace pacientů
GLUCOVANCE se nedoporučuje užívat během těhotenství. Počáteční a udržovací dávkování přípravku GLUCOVANCE by mělo být u pacientek v pokročilém věku konzervativní, vzhledem k možnosti snížené funkce ledvin u této populace. Jakákoli úprava dávkování vyžaduje pečlivé posouzení funkce ledvin. Obecně se u starších, oslabených a podvyživených pacientů nemá titrovat maximální dávka přípravku GLUCOVANCE, aby se zabránilo riziku hypoglykémie. Monitorování renálních funkcí je nezbytné jako pomoc při prevenci laktátové acidózy spojené s metforminem, zejména u starších pacientů. (Vidět VAROVÁNÍ .)
JAK DODÁVÁNO
Tablety GLUCOVANCE® (Glyburid a Metformin HCl).
GLUCOVANCE 1,25 mg/250 mg tableta je světle žlutá, bikonvexní, potahovaná tableta ve tvaru tobolky se zkosenými hranami s „ BMS “ vyraženo na jedné straně a “ 6072 “ vyraženo na opačné straně.
GLUCOVANCE 2,5 mg/500 mg tableta je světle oranžová, bikonvexní, potahovaná tableta ve tvaru tobolky se zkosenými hranami s „ BMS “ vyraženo na jedné straně a “ 6073 “ vyraženo na opačné straně.
GLUCOVANCE 5 mg/500 mg tableta je žlutá, bikonvexní, potahovaná tableta ve tvaru tobolky se zkosenými hranami s „ BMS “ vyraženo na jedné straně a “ 6074 “ vyraženo na opačné straně.
Úložný prostor
Skladujte při teplotě do 25°C (77°F). [Vidět USP řízená pokojová teplota .]
Dávkujte v nádobách odolných vůči světlu.
Distribuce: Bristol-Myers Squibb Company, Princeton, NJ 08543 USA 1158884A7. Rev října 2013
VEDLEJŠÍ EFEKTY
GLUCOVANCE
Ve dvojitě zaslepených klinických studiích zahrnujících GLUCOVANCE 2,50 mg jako úvodní terapii nebo jako terapii druhé linie dostávalo celkem 642 pacientů GLUCOVANCE 2,50 mg, 312 dostávalo terapii metforminem, 324 dostávalo terapii glyburidem a 161 dostávalo placebo. Procento pacientů hlásících příhody a typy nežádoucích příhod hlášených v klinických studiích s přípravkem GLUCOVANCE (všechny síly) jako úvodní terapie a terapie druhé linie je uvedeno v tabulce 6.
V kontrolované klinické studii rosiglitazonu versus placebo u pacientů léčených přípravkem GLUCOVANCE (n=365) dostávalo 181 pacientů přípravek GLUCOVANCE 5 mg s rosiglitazonem a 184 pacientů dostávalo přípravek GLUCOVANCE s placebem.
Edém byl hlášen u 7,7 % (14/181) pacientů léčených rosiglitazonem ve srovnání s 2,2 % (4/184) pacientů léčených placebem. U pacientů léčených rosiglitazonem byl pozorován průměrný nárůst hmotnosti o 3 kg.
U pacientů léčených tabletami glyburidu byly velmi vzácně hlášeny reakce podobné disulfiramu.
Hypoglykémie
kontrolovaných klinických studiích s GLUCOVANCE 5 mg nebyly žádné hypoglykemické epizody vyžadující lékařskou intervenci a/nebo farmakologickou léčbu; všechny události byly řízeny pacienty. Výskyt hlášených příznaků hypoglykémie (jako jsou závratě, třes, pocení a hlad) v počáteční terapeutické studii s přípravkem GLUCOVANCE 2,50 mg je shrnut v tabulce 7. Četnost příznaků hypoglykémie u pacientů léčených přípravkem GLUCOVANCE 1,25 mg/250 mg byla nejvyšší u pacientů s výchozí hodnotou HbA1c 8 %. U pacientů s výchozí hodnotou HbA1c mezi 8 % a 11 % léčených přípravkem GLUCOVANCE 2,5 mg/500 mg jako úvodní terapií byla frekvence hypoglykemických příznaků 30 % až 35 %. Jako terapie druhé linie u pacientů nedostatečně kontrolovaných samotnou sulfonylmočovinou mělo přibližně 6,8 % všech pacientů léčených přípravkem GLUCOVANCE 2,50 mg hypoglykemické příznaky. Když byl rosiglitazon přidán k léčbě přípravkem GLUCOVANCE 2,50 mg, 22 % pacientů hlásilo 1 nebo více naměřených hodnot glykémie z prstu ≤ 50 mg/dl ve srovnání s 3,3 % pacientů léčených placebem. Všechny hypoglykemické příhody byly pacienty zvládnuty a pouze 1 pacient přerušil léčbu pro hypoglykémii. (Vidět OPATŘENÍ : Všeobecné : Přidání thiazolidindionů k terapii GLUCOVANCE .)
Gastrointestinální reakce
Incidence gastrointestinálních (GI) nežádoucích účinků (průjem, nauzea/zvracení a bolest břicha) ve studii počáteční terapie je shrnuta v tabulce 7. Ve všech studiích GLUCOVANCE 500 mg byly GI příznaky nejčastějšími nežádoucími účinky u GLUCOVANCE 400 mg a byly častější při vyšších dávkách.
V kontrolovaných studiích přerušilo léčbu přípravkem GLUCOVANCE 500 mg z důvodu gastrointestinálních nežádoucích účinků
V postmarketingových zprávách se může vzácně objevit cholestatická žloutenka a hepatitida, které mohou progredovat do selhání jater; Pokud k tomu dojde, GLUCOVANCE 5 mg by měla být přerušena.
DROGOVÉ INTERAKCE
GLUCOVANCE
Některé léky mají tendenci vyvolat hyperglykémii a mohou vést ke ztrátě kontroly hladiny glukózy v krvi. Mezi tyto léky patří thiazidy a další diuretika, kortikosteroidy, fenothiaziny, produkty štítné žlázy, estrogeny, perorální antikoncepce, fenytoin, kyselina nikotinová, sympatomimetika, léky blokující vápníkový kanál a isoniazid. Pokud jsou takové léky podávány pacientovi užívajícímu GLUCOVANCE 400 mg, pacient by měl být pečlivě sledován, zda nedochází ke ztrátě kontroly hladiny glukózy v krvi. Když jsou takové léky vysazeny u pacienta užívajícího GLUCOVANCE, pacient by měl být pečlivě sledován kvůli hypoglykémii. Metformin se jen zanedbatelně váže na plazmatické proteiny, a proto je méně pravděpodobné, že bude interagovat s léky vysoce vázanými na proteiny, jako jsou salicyláty, sulfonamidy, chloramfenikol a probenecid, ve srovnání se sulfonylmočovinami, které se ve velké míře vážou na sérové proteiny.
Glyburide
Hypoglykemické působení sulfonylmočovin může být zesíleno některými léky, včetně nesteroidních protizánětlivých látek a dalších léků, které se vysoce váží na proteiny, salicyláty, sulfonamidy, chloramfenikol, probenecid, kumariny, inhibitory monoaminooxidázy a beta-adrenergní blokátory. Jsou-li takové léky podávány pacientovi užívajícímu přípravek GLUCOVANCE, pacient by měl být pečlivě sledován kvůli hypoglykémii. Když jsou takové léky vysazeny u pacienta užívajícího GLUCOVANCE 2,50 mg, pacient by měl být pečlivě sledován, zda nedochází ke ztrátě kontroly hladiny glukózy v krvi.
U pacientů užívajících glyburid současně s bosentanem bylo pozorováno zvýšené riziko zvýšení jaterních enzymů. Proto je současné podávání přípravku GLUCOVANCE a bosentanu kontraindikováno.
Byla hlášena možná interakce mezi glyburidem a ciprofloxacinem, fluorochinolonovým antibiotikem, vedoucí k zesílení hypoglykemického účinku glyburidu. Mechanismus této interakce není znám.
Byla hlášena potenciální interakce mezi perorálním mikonazolem a perorálními hypoglykemickými látkami vedoucí k těžké hypoglykémii. Není známo, zda k této interakci dochází také u intravenózních, topických nebo vaginálních přípravků mikonazolu.
Colesevelam: Současné podávání kolesevelamu a glyburidu vedlo ke snížení AUC glyburidu o 32 % a Cmax o 47 %. Snížení AUC a Cmax glyburidu bylo 20 % a 15 %, když byl podán 1 hodinu před, a významně se nezměnilo (-7 %, resp. 4 %), když byl podán 4 hodiny před kolesevelamem.
Metformin hydrochlorid
furosemid
Studie lékových interakcí metforminu a furosemidu s jednorázovou dávkou u zdravých subjektů prokázala, že farmakokinetické parametry obou sloučenin byly ovlivněny společným podáváním. Furosemid zvýšil Cmax metforminu v plazmě a krvi o 22 % a AUC v krvi o 15 %, aniž by došlo k významné změně renální clearance metforminu. Při podávání s metforminem byly Cmax furosemidu o 31 % a AUC o 12 % menší než při podávání samotného a terminální poločas se snížil o 32 %, aniž by došlo k významné změně renální clearance furosemidu. Nejsou dostupné žádné informace o interakci metforminu a furosemidu při současném chronickém podávání.
nifedipin
Studie lékových interakcí metforminu a nifedipinu s jednorázovou dávkou u normálních zdravých dobrovolníků prokázala, že současné podávání nifedipinu zvýšilo Cmax a AUC metforminu v plazmě o 20 % a AUC o 9 % a zvýšilo množství vylučované močí. Tmax a poločas nebyly ovlivněny. Zdá se, že nifedipin zvyšuje absorpci metforminu. Metformin měl minimální účinky na nifedipin.
Kationtové léky
Kationtové léky (např. amilorid, digoxin, morfin, prokainamid, chinidin, chinin, ranitidin, triamteren, trimethoprim nebo vankomycin), které jsou eliminovány renální tubulární sekrecí, mají teoreticky potenciál pro interakci s metforminem tím, že soutěží o běžné renální tubulární transportní systémy. Taková interakce mezi metforminem a perorálně podávaným cimetidinem byla pozorována u normálních zdravých dobrovolníků ve studiích lékových interakcí metforminu a cimetidinu s jednorázovou i opakovanou dávkou, s 60% zvýšením maximálních koncentrací metforminu v plazmě a v plné krvi a 40% zvýšení v plazmě a AUC metforminu v plné krvi. Ve studii s jednorázovou dávkou nedošlo ke změně eliminačního poločasu. Metformin neměl žádný vliv na farmakokinetiku cimetidinu. Přestože tyto interakce zůstávají teoretické (s výjimkou cimetidinu), u pacientů, kteří užívají kationtové léky, které jsou vylučovány proximálním renálním tubulárním sekrečním systémem, se doporučuje pečlivé sledování pacienta a úprava dávky přípravku GLUCOVANCE a/nebo interferujícího léku.
jiný
zdravých dobrovolníků nebyla farmakokinetika metforminu a propranololu a metforminu a ibuprofenu při současném podávání ve studiích interakce jedné dávky ovlivněna.
VAROVÁNÍ
Metformin hydrochlorid
Laktátová acidóza
Laktátová acidóza je vzácná, ale závažná metabolická komplikace, která se může objevit v důsledku akumulace metforminu během léčby tabletami GLUCOVANCE (Glyburide and Metformin HCl); když k němu dojde, je přibližně v 50 % případů fatální. Laktátová acidóza se také může objevit v souvislosti s řadou patofyziologických stavů, včetně diabetes mellitus, a kdykoli dojde k významné hypoperfuzi tkání a hypoxémii. Laktátová acidóza je charakterizována zvýšenou hladinou laktátu v krvi (> 5 mmol/l), sníženým pH krve, poruchami elektrolytů se zvýšenou aniontovou mezerou a zvýšeným poměrem laktát/pyruvát. Pokud je metformin implikován jako příčina laktátové acidózy, jsou obecně zjištěny hladiny metforminu v plazmě > 5 μg/ml.
Hlášená incidence laktátové acidózy u pacientů užívajících metformin-hydrochlorid je velmi nízká (přibližně 0,03 případů/1000 pacientoroků, s přibližně 0,015 fatálními případy/1000 pacientoroků). U více než 20 000 pacientoroků expozice metforminu v klinických studiích nebyly hlášeny žádné případy laktátové acidózy. Hlášené případy se vyskytly především u diabetických pacientů s významnou renální insuficiencí, včetně vnitřního renálního onemocnění a renální hypoperfuze, často v souvislosti s četnými souběžnými lékařskými/chirurgickými problémy a četnými souběžnými léky. Pacienti s městnavým srdečním selháním vyžadujícím farmakologickou léčbu, zejména pacienti s nestabilním nebo akutním městnavým srdečním selháním, u kterých existuje riziko hypoperfuze a hypoxémie, mají zvýšené riziko laktátové acidózy. Riziko laktátové acidózy se zvyšuje se stupněm renální dysfunkce a věkem pacienta. Riziko laktátové acidózy může být proto významně sníženo pravidelným sledováním renálních funkcí u pacientů užívajících metformin a používáním minimální účinné dávky metforminu. Zejména léčba starších pacientů by měla být doprovázena pečlivým sledováním funkce ledvin. Léčba přípravkem GLUCOVANCE 2,50 mg by neměla být zahájena u pacientů ve věku ≥ 80 let, pokud měření clearance kreatininu neprokáže, že funkce ledvin není snížena, protože tito pacienti jsou náchylnější k rozvoji laktátové acidózy. Kromě toho by GLUCOVANCE měla být okamžitě vysazena v případě jakéhokoli stavu spojeného s hypoxémií, dehydratací nebo sepsí. Vzhledem k tomu, že zhoršená funkce jater může významně omezit schopnost odstraňovat laktát, je třeba se GLUCOVANCE obecně vyhnout pacientkám s klinickými nebo laboratorními známkami jaterního onemocnění. Pacienti by měli být varováni před nadměrným příjmem alkoholu, ať už akutním nebo chronickým, při užívání přípravku GLUCOVANCE 2,50 mg, protože alkohol zesiluje účinky metformin-hydrochloridu na metabolismus laktátu. Kromě toho by měla být léčba přípravkem GLUCOVANCE 5 mg dočasně přerušena před jakoukoli intravaskulární radiokontrastní studií a před jakýmkoli chirurgickým zákrokem (viz také BEZPEČNOSTNÍ OPATŘENÍ).
Nástup laktátové acidózy je často nenápadný a doprovázený pouze nespecifickými příznaky, jako je malátnost, myalgie, respirační potíže, zvyšující se somnolence a nespecifické břišní potíže. Může být spojena hypotermie, hypotenze a rezistentní bradyarytmie s výraznější acidózou. Pacient a lékař pacienta si musí být vědomi možné důležitosti takových příznaků a pacient by měl být poučen, aby v případě jejich výskytu okamžitě informoval lékaře (viz také BEZPEČNOSTNÍ OPATŘENÍ). Přípravek GLUCOVANCE 500 mg by měl být vysazen, dokud se situace nevyjasní. Užitečné mohou být sérové elektrolyty, ketony, glukóza v krvi a pokud je to indikováno, pH krve, hladiny laktátu a dokonce hladiny metforminu v krvi. Jakmile je pacient stabilizován na jakékoli úrovni dávky GLUCOVANCE, je nepravděpodobné, že by gastrointestinální symptomy, které jsou běžné při zahájení léčby metforminem, souvisely s lékem. Pozdější výskyt gastrointestinálních příznaků může být způsoben laktátovou acidózou nebo jiným závažným onemocněním.
Hladiny laktátu v žilní plazmě nalačno nad horní hranicí normy, ale méně než 5 mmol/l u pacientů užívajících GLUCOVANCE nemusí nutně znamenat blížící se laktátovou acidózu a mohou být vysvětlitelné jinými mechanismy, jako je špatně kontrolovaný diabetes nebo obezita, intenzivní fyzická aktivita, nebo technické problémy při dostatečné manipulaci. (Viz také BEZPEČNOSTNÍ OPATŘENÍ.)
U každého diabetického pacienta s metabolickou acidózou bez známek ketoacidózy (ketonurie a ketonémie) by mělo být podezření na laktátovou acidózu.
Laktátová acidóza je lékařská pohotovost, která musí být léčena v nemocničním prostředí. U pacientky s laktátovou acidózou, která užívá GLUCOVANCE 500 mg, je třeba okamžitě vysadit přípravek a neprodleně zahájit obecná podpůrná opatření. Protože je metformin hydrochlorid dialyzovatelný (s clearance až 170 ml/min za dobrých hemodynamických podmínek), doporučuje se rychlá hemodialýza ke korekci acidózy a odstranění nahromaděného metforminu. Taková léčba často vede k rychlému zvrácení symptomů a uzdravení. (Viz také KONTRAINDIKACE a BEZPEČNOSTNÍ OPATŘENÍ.)
ZVLÁŠTNÍ UPOZORNĚNÍ NA ZVÝŠENÉ RIZIKO KARDIOVASKULÁRNÍ ÚMRTNOSTI
Bylo hlášeno, že podávání perorálních hypoglykemických léků je spojeno se zvýšenou kardiovaskulární mortalitou ve srovnání s léčbou samotnou dietou nebo dietou plus inzulín. Toto varování je založeno na studii provedené University Group Diabetes Program (UGDP), což je dlouhodobá prospektivní klinická studie navržená k vyhodnocení účinnosti léků snižujících hladinu glukózy v prevenci nebo oddálení vaskulárních komplikací u pacientů s diabetem nezávislým na inzulínu. Studie se zúčastnilo 823 pacientů, kteří byli náhodně rozděleni do 1 ze 4 léčebných skupin (Diabetes 19 (Suppl. 2):747-830, 1970).
UGDP uvádí, že pacienti léčení po dobu 5 až 8 let dietou plus fixní dávkou tolbutamidu (1,5 g denně) měli míru kardiovaskulární mortality přibližně 2½krát vyšší než u pacientů léčených samotnou dietou. Nebylo pozorováno signifikantní zvýšení celkové mortality, ale užívání tolbutamidu bylo přerušeno na základě zvýšení kardiovaskulární mortality, čímž byla omezena možnost studie prokázat zvýšení celkové mortality. Navzdory sporům ohledně interpretace těchto výsledků poskytují zjištění studie UGDP adekvátní základ pro toto varování. Pacient by měl být informován o možných rizicích a přínosech glyburidu a alternativních způsobech léčby.
Ačkoli do této studie byl zahrnut pouze 1 lék ze skupiny sulfonylmočovin (tolbutamid), z hlediska bezpečnosti je rozumné zvážit, že toto varování se může vztahovat také na jiná hypoglykemická léčiva v této třídě, vzhledem k jejich blízké podobnosti ve způsobu účinku a chemickou strukturu.
OPATŘENÍ
Všeobecné
Makrovaskulární výsledky
Nebyly provedeny žádné klinické studie prokazující nezvratné důkazy o snížení makrovaskulárního rizika s přípravkem GLUCOVANCE 5 mg nebo jiným antidiabetikem.
GLUCOVANCE
Hypoglykémie
GLUCOVANCE 400 mg může vyvolat hypoglykémii nebo hypoglykemické příznaky, proto je důležitý správný výběr pacienta, dávkování a pokyny, aby se předešlo potenciálním hypoglykemickým epizodám. Riziko hypoglykémie se zvyšuje při nedostatečném kalorickém příjmu, když namáhavé cvičení není kompenzováno suplementací kalorií nebo při současném užívání s jinými látkami snižujícími hladinu glukózy nebo etanolem. Renální nebo jaterní insuficience může způsobit zvýšené hladiny léčiva jak glyburidu, tak metformin hydrochloridu a jaterní insuficience může také snížit glukoneogenní kapacitu, což obojí zvyšuje riziko hypoglykemických reakcí. K hypoglykemickým účinkům jsou zvláště náchylní starší, oslabení nebo podvyživení pacienti a pacienti s nedostatečností nadledvin nebo hypofýzy nebo intoxikací alkoholem. Hypoglykémie může být obtížné rozpoznat u starších osob a lidí, kteří užívají beta-adrenergní blokátory.
Glyburide
Hemolytická anémie
Léčba pacientů s deficitem glukózo-6-fosfátdehydrogenázy (G6PD) sulfonylmočovinou může vést k hemolytické anémii. Protože GLUCOVANCE 400 mg patří do třídy derivátů sulfonylmočoviny, je třeba opatrnosti u pacientů s nedostatkem G6PD a je třeba zvážit alternativu bez sulfonylmočoviny. V postmarketingových hlášeních byla také hlášena hemolytická anémie u pacientů, u kterých nebyl znám nedostatek G6PD.
Metformin hydrochlorid
Monitorování funkce ledvin
Je známo, že metformin je v podstatě vylučován ledvinami a riziko akumulace metforminu a laktátové acidózy se zvyšuje se stupněm poruchy funkce ledvin. Pacienti s hladinami sérového kreatininu nad horní hranicí normálu pro jejich věk by tedy neměli dostávat GLUCOVANCE. U pacientů v pokročilém věku by měla být GLUCOVANCE 400 mg pečlivě titrována, aby se stanovila minimální dávka pro adekvátní glykemický účinek, protože stárnutí je spojeno se sníženou funkcí ledvin. U starších pacientů, zejména u pacientů ve věku ≥ 80 let, by měla být pravidelně sledována funkce ledvin a obecně by GLUCOVANCE 2,50 mg neměla být titrována na maximální dávku (viz VAROVÁNÍ a DÁVKOVÁNÍ A PODÁVÁNÍ ). Před zahájením léčby přípravkem GLUCOVANCE 2,50 mg a poté alespoň jednou ročně by měla být vyšetřena a ověřena funkce ledvin jako normální. U pacientů, u kterých se očekává rozvoj renální dysfunkce, by měla být renální funkce vyšetřována častěji a GLUCOVANCE vysadit, pokud je přítomna porucha funkce ledvin.
Užívání souběžných léků, které mohou ovlivnit funkci ledvin nebo dispozice metforminu
Souběžně podávané léky, které mohou ovlivnit funkci ledvin nebo vést k významným hemodynamickým změnám nebo mohou interferovat s vylučováním metforminu, jako jsou kationtová léčiva, která jsou eliminována renální tubulární sekrecí (viz DROGOVÉ INTERAKCE ), je třeba používat opatrně.
Radiologické studie zahrnující použití intravaskulárních jodovaných kontrastních látek (například intravenózní urogram, intravenózní cholangiografie, angiografie a skenování počítačovou tomografií (CT) s intravaskulárními kontrastními látkami)
Intravaskulární kontrastní studie s jodovanými materiály mohou vést k akutní změně funkce ledvin a byly spojeny s laktátovou acidózou u pacientů užívajících metformin (viz KONTRAINDIKACE ). Proto u pacientů, u kterých je plánována jakákoli taková studie, by měla být léčba přípravkem GLUCOVANCE 400 mg dočasně vysazena v době nebo před výkonem a vysazena na 48 hodin po výkonu a znovu nasazena až po přehodnocení funkce ledvin a zjištění, že je normální.
Hypoxické stavy
Kardiovaskulární kolaps (šok) z jakékoli příčiny, akutní městnavé srdeční selhání, akutní infarkt myokardu a další stavy charakterizované hypoxémií byly spojeny s laktátovou acidózou a mohou také způsobit prerenální azotemii. Pokud se takové příhody vyskytnou u pacientek léčených přípravkem GLUCOVANCE 2,50 mg, musí být přípravek okamžitě vysazen.
Chirurgické postupy
Léčba přípravkem GLUCOVANCE 400 mg by měla být dočasně přerušena při jakémkoli chirurgickém zákroku (kromě menších zákroků, které nejsou spojeny s omezeným příjmem potravy a tekutin) a neměla by být znovu zahájena, dokud pacientka neobnovila perorální příjem a funkce ledvin nebyla vyhodnocena jako normální.
Příjem alkoholu
Je známo, že alkohol zesiluje účinek metforminu na metabolismus laktátu. Pacienti by proto měli být během léčby přípravkem GLUCOVANCE varováni před nadměrným příjmem alkoholu, akutním nebo chronickým. Alkohol může díky svému vlivu na glukoneogenní kapacitu jater také zvyšovat riziko hypoglykémie.
Porucha funkce jater
Vzhledem k tomu, že zhoršená funkce jater byla spojena s některými případy laktátové acidózy, neměly by se GLUCOVANCE 500 mg obecně vyhýbat pacientkám s klinickým nebo laboratorním průkazem onemocnění jater.
Hladiny vitaminu B12
kontrolovaných klinických studiích s metforminem v trvání 29 týdnů bylo u přibližně 7 % pacientů pozorováno snížení na podnormální hladiny dříve normálního sérového vitaminu B12, bez klinických projevů. Takový pokles, pravděpodobně v důsledku interference s absorpcí B12 z komplexu B12-vnitřní faktor, je však velmi zřídka spojen s anémií a zdá se, že je rychle reverzibilní po přerušení podávání metforminu nebo vitaminu B. U pacientů užívajících metformin se doporučuje každoroční měření hematologických parametrů a jakékoli zjevné abnormality by měly být náležitě vyšetřeny a ošetřeny (viz OPATŘENÍ : Laboratorní testy ).
Zdá se, že někteří jedinci (ti s nedostatečným příjmem nebo vstřebáváním vitaminu B12 nebo vápníku) jsou náchylní k rozvoji subnormálních hladin vitaminu B12. U těchto pacientů může být užitečné rutinní měření sérového vitaminu B12 ve 2–3letých intervalech.
Změna klinického stavu pacientů s dříve kontrolovaným diabetem 2. typu
Pacient s diabetem 2. typu dříve dobře kontrolovaný metforminem, u kterého se rozvinou laboratorní abnormality nebo klinické onemocnění (zejména vágní a špatně definované onemocnění), by měl být neprodleně vyšetřen na známky ketoacidózy nebo laktátové acidózy. Hodnocení by mělo zahrnovat sérové elektrolyty a ketony, glukózu v krvi a, je-li to indikováno, pH krve, hladiny laktátu, pyruvátu a metforminu. Pokud dojde k acidóze kterékoli formy, GLUCOVANCE musí být okamžitě ukončena a musí být zahájena další vhodná nápravná opatření (viz také VAROVÁNÍ ).
Přidání thiazolidindionů k terapii GLUCOVANCE 500 mg
Hypoglykémie
Pacienti užívající GLUCOVANCE 2,50 mg v kombinaci s thiazolidindionem mohou být vystaveni riziku hypoglykémie.
Přibývání na váze
Po přidání rosiglitazonu ke GLUCOVANCE 5 mg bylo pozorováno zvýšení tělesné hmotnosti, podobné tomu, které bylo hlášeno pro léčbu samotným thiazolidindionem.
Účinky na játra
Pokud se thiazolidindion používá v kombinaci s přípravkem GLUCOVANCE 2,50 mg, je třeba provádět pravidelné monitorování jaterních testů v souladu s doporučeními pro thiazolidindion.
Informace pro pacienty
GLUCOVANCE
Pacienti by měli být informováni o možných rizicích a přínosech přípravku GLUCOVANCE 500 mg a alternativních způsobech léčby. Měli by být také informováni o důležitosti dodržování dietetických pokynů; pravidelný cvičební program; a pravidelné testování krevní glukózy, glykosylovaného hemoglobinu, renálních funkcí a hematologických parametrů.
Pacientům by měla být vysvětlena rizika laktátové acidózy spojená s léčbou metforminem, její příznaky a stavy, které predisponují k jejímu rozvoji, jak je uvedeno v částech VAROVÁNÍ a BEZPEČNOSTNÍ OPATŘENÍ. Pacientky je třeba upozornit, aby okamžitě přerušily léčbu přípravkem GLUCOVANCE a neprodleně informovaly svého praktického lékaře, pokud se objeví nevysvětlitelná hyperventilace, myalgie, malátnost, neobvyklá somnolence nebo jiné nespecifické příznaky. Jakmile je pacient stabilizován na jakékoli dávkové hladině GLUCOVANCE, je nepravděpodobné, že by gastrointestinální příznaky, které jsou běžné při zahájení léčby metforminem, souvisely s lékem. Pozdější výskyt gastrointestinálních příznaků může být způsoben laktátovou acidózou nebo jiným závažným onemocněním.
Pacientům a odpovědným rodinným příslušníkům by měla být vysvětlena rizika hypoglykémie, její příznaky a léčba a stavy, které k jejímu rozvoji predisponují.
Pacienti by měli být poučeni, aby během léčby přípravkem GLUCOVANCE neměli nadměrný příjem alkoholu, ať už akutní nebo chronický. (Vidět INFORMACE O PACIENTU vytištěny níže.)
Laboratorní testy
Ke sledování terapeutické odpovědi by měla být prováděna periodická měření glykémie nalačno (FBG) a HbA1c.
Počáteční a pravidelné monitorování hematologických parametrů (např. hemoglobin/hematokrit a indexy červených krvinek) a renální funkce (sérový kreatinin) by mělo být prováděno alespoň jednou ročně. Zatímco megaloblastická anémie byla při léčbě metforminem pozorována vzácně, v případě podezření na ni je třeba vyloučit nedostatek vitaminu B12.
Karcinogeneze, mutageneze, zhoršení plodnosti
S kombinovanými přípravky v GLUCOVANCE nebyly provedeny žádné studie na zvířatech. Následující údaje jsou založeny na zjištěních ze studií provedených s jednotlivými produkty.
Glyburide
Studie na potkanech se samotným glyburidem v dávkách až 300 mg/kg/den (přibližně 145násobek maximální doporučené denní [MRHD] dávky pro člověka 20 mg pro glyburidovou složku přípravku GLUCOVANCE 5 mg na základě srovnání plochy povrchu těla) po dobu 18 měsíců odhalily žádné karcinogenní účinky. Ve dvouleté studii onkogenity glyburidu u myší nebyly prokázány nádory související s léčbou.
Neexistoval žádný důkaz o mutagenním potenciálu samotného glyburidu v následujících in vitro testech: mikrosomový test Salmonella (Amesův test) a test poškození DNA/alkalická eluce.
Metformin hydrochlorid
Dlouhodobé studie kancerogenity byly provedeny se samotným metforminem u potkanů (doba podávání 104 týdnů) a myší (doba podávání 91 týdnů) v dávkách až 900 mg/kg/den a 1500 mg/kg/den včetně. Obě tyto dávky jsou přibližně čtyřnásobkem dávky MRHD 2000 mg metforminové složky přípravku GLUCOVANCE 400 mg na základě srovnání plochy povrchu těla. U myších samců ani samic nebyly nalezeny žádné důkazy o karcinogenitě samotného metforminu. Podobně nebyl u samců potkanů pozorován žádný tumorogenní potenciál u samotného metforminu. U samic potkanů léčených samotným metforminem v dávce 900 mg/kg/den však byla zvýšená incidence benigních stromálních děložních polypů.
V následujících testech in vitro nebyl prokázán mutagenní potenciál samotného metforminu: Amesův test (S. typhimurium), test genových mutací (buňky myšího lymfomu) nebo test chromozomálních aberací (lidské lymfocyty). Výsledky in vivo mikronukleárního testu na myších byly také negativní.
Fertilita samců nebo samic potkanů nebyla ovlivněna samotným metforminem při podávání v dávkách až 600 mg/kg/den, což je přibližně trojnásobek dávky MRHD metforminové složky přípravku GLUCOVANCE 400 mg na základě srovnání plochy povrchu těla.
Těhotenství
Teratogenní účinky
Těhotenství kategorie B
Nedávné informace silně naznačují, že abnormální hladiny glukózy v krvi během těhotenství jsou spojeny s vyšším výskytem vrozených abnormalit. Většina odborníků doporučuje používat během těhotenství inzulín, aby se hladina glukózy v krvi co nejvíce přiblížila normálu. Vzhledem k tomu, že reprodukční studie na zvířatech ne vždy předpovídají lidskou odpověď, neměl by být GLUCOVANCE 400 mg během těhotenství podáván, pokud to není nezbytně nutné. (Viz. níže.)

Neexistují žádné adekvátní a dobře kontrolované studie u těhotných žen s přípravkem GLUCOVANCE nebo jeho jednotlivými složkami. S kombinovanými přípravky v GLUCOVANCE nebyly provedeny žádné studie na zvířatech. Následující údaje jsou založeny na zjištěních ze studií provedených s jednotlivými produkty.
Glyburide
Reprodukční studie byly provedeny na potkanech a králících v dávkách až 500násobku dávky MRHD 20 mg glyburidové složky přípravku GLUCOVANCE 500 mg na základě srovnání plochy povrchu těla a neodhalily žádné známky poškození plodnosti nebo poškození plodu v důsledku glyburidu.
Metformin hydrochlorid
Samotný metformin nebyl teratogenní u potkanů ani králíků v dávkách až 600 mg/kg/den. To představuje expozici přibližně 2 a 6násobku dávky MRHD 2000 mg metforminové složky přípravku GLUCOVANCE 500 mg na základě srovnání plochy povrchu těla u potkanů a králíků, v daném pořadí. Stanovení fetálních koncentrací prokázalo částečnou placentární bariéru vůči metforminu.
Neteratogenní účinky
novorozenců narozených matkám, které v době porodu užívaly sulfonylmočovinu, byla hlášena dlouhodobá těžká hypoglykémie (4–10 dní). To bylo hlášeno častěji při užívání látek s prodlouženým poločasem. Nedoporučuje se užívat GLUCOVANCE 400 mg během těhotenství. Pokud je však užíván, měla by být léčba přípravkem GLUCOVANCE ukončena nejméně 2 týdny před očekávaným datem porodu. (Vidět Těhotenství : Teratogenní účinky : Těhotenství kategorie B .)
Kojící matky
Ačkoli není známo, zda je glyburid vylučován do mateřského mléka, je známo, že některé deriváty sulfonylmočoviny jsou vylučovány do mateřského mléka. Studie na kojících potkanech ukazují, že metformin je vylučován do mléka a dosahuje hladin srovnatelných s hladinami v plazmě. Podobné studie nebyly provedeny u kojících matek. Vzhledem k tomu, že u kojených dětí může existovat možnost hypoglykémie, je třeba rozhodnout, zda přerušit kojení nebo přerušit GLUCOVANCE, a to s ohledem na důležitost léku pro matku. Pokud je GLUCOVANCE vysazena a pokud samotná dieta nestačí ke kontrole hladiny glukózy v krvi, je třeba zvážit léčbu inzulínem.
Pediatrické použití
Bezpečnost a účinnost přípravku GLUCOVANCE 500 mg byla hodnocena v aktivně kontrolované, dvojitě zaslepené, 26týdenní randomizované studii zahrnující celkem 167 pediatrických pacientů (ve věku od 9 do 16 let) s diabetem 2. typu. Nebylo statisticky prokázáno, že by GLUCOVANCE 500 mg byl lepší než metformin nebo glyburid, pokud jde o snížení HbA1c oproti výchozí hodnotě (viz tabulka 5). V této studii nebyly s přípravkem GLUCOVANCE 2,50 mg spojeny žádné neočekávané bezpečnostní nálezy.
Geriatrické použití
642 pacientů, kteří dostávali GLUCOVANCE ve dvojitě zaslepených klinických studiích, bylo 23,8 % ve věku 65 let a více, zatímco 2,8 % bylo ve věku 75 let a více. Z 1302 pacientů, kteří dostávali GLUCOVANCE 500 mg v otevřených klinických studiích, bylo 20,7 % ve věku 65 let a více, zatímco 2,5 % bylo ve věku 75 let a více. Mezi těmito pacienty a mladšími pacienty nebyly pozorovány žádné celkové rozdíly v účinnosti nebo bezpečnosti a další hlášené klinické zkušenosti neidentifikovaly rozdíly v odpovědi mezi staršími a mladšími pacienty, nelze však vyloučit větší citlivost některých starších jedinců.
Je známo, že metformin hydrochlorid je v podstatě vylučován ledvinami, a protože riziko závažných nežádoucích účinků léku je větší u pacientů s poruchou funkce ledvin, měl by být přípravek GLUCOVANCE 500 mg používán pouze u pacientů s normální funkcí ledvin (viz KONTRAINDIKACE , VAROVÁNÍ , a KLINICKÁ FARMAKOLOGIE : Farmakokinetika ). Vzhledem k tomu, že stárnutí je spojeno se sníženou funkcí ledvin, měl by být GLUCOVANCE 5 mg používán s přibývajícím věkem opatrně. Při volbě dávky je třeba dbát opatrnosti a měla by být založena na pečlivém a pravidelném sledování funkce ledvin. Obecně se u starších pacientů nemá titrovat maximální dávka GLUCOVANCE (viz také VAROVÁNÍ a DÁVKOVÁNÍ A PODÁVÁNÍ ).
PŘEDÁVKOVAT
Glyburide
Předávkování deriváty sulfonylmočoviny, včetně tablet glyburidu, může způsobit hypoglykémii. Mírné hypoglykemické symptomy bez ztráty vědomí nebo neurologických nálezů by měly být léčeny agresivně perorální glukózou a úpravou dávkování léku a/nebo způsobu stravování. Pečlivé sledování by mělo pokračovat, dokud se lékař neujistí, že pacient je mimo nebezpečí. Těžké hypoglykemické reakce s kómatem, záchvaty nebo jiným neurologickým poškozením se vyskytují zřídka, ale představují lékařské pohotovosti vyžadující okamžitou hospitalizaci. Pokud je diagnostikováno nebo existuje podezření na hypoglykemické kóma, pacientovi by měla být podána rychlá intravenózní injekce koncentrovaného (50%) roztoku glukózy. Poté by měla následovat kontinuální infuze zředěnějšího (10%) roztoku glukózy rychlostí, která udrží hladinu glukózy v krvi nad 100 mg/dl. Pacienti by měli být pečlivě sledováni po dobu minimálně 24 až 48 hodin, protože hypoglykémie se může po zjevném klinickém zotavení znovu objevit.
Metformin hydrochlorid
Došlo k předávkování metformin-hydrochloridem, včetně požití množství > 50 g. Hypoglykémie byla hlášena přibližně v 10 % případů, ale nebyla prokázána žádná příčinná souvislost s metformin-hydrochloridem. Laktátová acidóza byla hlášena přibližně u 32 % případů předávkování metforminem (viz VAROVÁNÍ ). Metformin je za dobrých hemodynamických podmínek dialyzovatelný s clearance až 170 ml/min. Proto může být hemodialýza užitečná pro odstranění nahromaděného léku od pacientů, u kterých existuje podezření na předávkování metforminem.
KONTRAINDIKACE
GLUCOVANCE 2,50 mg je kontraindikován u pacientů s:
Přípravek GLUCOVANCE 500 mg by měl být dočasně přerušen u pacientů podstupujících radiologické studie zahrnující intravaskulární podání jodovaných kontrastních látek, protože použití takových přípravků může vést k akutní změně funkce ledvin. (Viz také OPATŘENÍ .)
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
GLUCOVANCE kombinuje glyburid a metformin hydrochlorid, 2 antihyperglykemická činidla s komplementárními mechanismy účinku, ke zlepšení kontroly glykémie u pacientů s diabetem 2. typu.
Zdá se, že glyburid akutně snižuje hladinu glukózy v krvi stimulací uvolňování inzulínu ze slinivky břišní, což je účinek závislý na fungujících beta buňkách v pankreatických ostrůvcích. Mechanismus, kterým glyburid snižuje hladinu glukózy v krvi při dlouhodobém podávání, nebyl jasně stanoven. Při chronickém podávání u pacientů s diabetem 2. typu přetrvává účinek snižující hladinu glukózy v krvi navzdory postupnému poklesu sekreční odpovědi inzulínu na lék. Extrapankreatické účinky se mohou podílet na mechanismu účinku perorálních sulfonylmočovinových hypoglykemických léků.
Metformin hydrochlorid je antihyperglykemické činidlo, které zlepšuje glukózovou toleranci u pacientů s diabetem 2. typu, snižuje bazální i postprandiální plazmatickou glukózu. Metformin hydrochlorid snižuje produkci glukózy v játrech, snižuje střevní absorpci glukózy a zlepšuje citlivost na inzulín zvýšením periferního vychytávání a využití glukózy.
Farmakokinetika
Absorpce a biologická dostupnost
GLUCOVANCE
Ve studiích biologické dostupnosti přípravku GLUCOVANCE 2,5 mg/500 mg a 5 mg/500 mg byla průměrná plocha pod křivkou plazmatické koncentrace v závislosti na čase (AUC) pro glyburidovou složku o 18 %, respektive o 7 %, větší než u Micronase® značka glyburidu podávaná společně s metforminem. Glyburidová složka přípravku GLUCOVANCE proto není bioekvivalentní s Micronase®. Metforminová složka přípravku GLUCOVANCE 400 mg je bioekvivalentní metforminu podávanému společně s glyburidem.
Po podání jedné tablety GLUCOVANCE 5 mg/500 mg s 20% roztokem glukózy nebo 20% roztokem glukózy s jídlem nebyl žádný účinek jídla na Cmax a relativně malý vliv jídla na AUC glyburidu komponent. Tmax pro glyburidovou složku byla zkrácena ze 7,5 hodiny na 2,75 hodiny s jídlem ve srovnání se stejnou silou tablety podávané nalačno s 20% roztokem glukózy. Klinický význam dřívějšího Tmax pro glyburid po jídle není znám. Vliv potravy na farmakokinetiku metforminové složky byl neurčitý.
Glyburide
Studie s jednorázovou dávkou s tabletami Micronase® u normálních subjektů prokazují významnou absorpci glyburidu během 1 hodiny, maximální hladiny léčiva přibližně za 4 hodiny a nízké, ale detekovatelné hladiny za 24 hodin. Průměrné sérové hladiny glyburidu, vyjádřené plochami pod křivkou sérové koncentrace-čas, se zvyšují úměrně odpovídajícím zvýšením dávky. Bioekvivalence mezi přípravkem GLUCOVANCE 500 mg a jednosložkovými přípravky obsahujícími glyburid nebyla stanovena.
Metformin hydrochlorid
Absolutní biologická dostupnost 500 mg tablety metformin hydrochloridu podané nalačno je přibližně 50 % až 60 %. Studie používající jednotlivé perorální dávky metforminu ve formě tablet 500 mg a 1500 mg a 850 mg až 2550 mg naznačují, že neexistuje proporcionalita dávky se zvyšujícími se dávkami, což je způsobeno spíše sníženou absorpcí než změnou eliminace. Jídlo snižuje rozsah a mírně zpomaluje absorpci metforminu, jak ukazuje přibližně o 40 % nižší maximální koncentrace a o 25 % nižší AUC v plazmě a 35minutové prodloužení doby do dosažení maximální plazmatické koncentrace po podání jedné dávky 850 mg tabletu metforminu s jídlem ve srovnání se stejnou silou tablety podávané nalačno. Klinický význam těchto poklesů není znám.
Rozdělení
Glyburide
Léčiva obsahující sulfonylmočovinu se ve velké míře vážou na sérové proteiny. Vytěsnění z vazebných míst pro proteiny jinými léky může vést ke zvýšenému hypoglykemickému účinku. In vitro je vazba na proteiny vykazovaná glyburidem převážně neiontová, zatímco u jiných sulfonylmočovin (chlorpropamid, tolbutamid, tolazamid) je převážně iontová. Kyselá léčiva, jako je fenylbutazon, warfarin a salicyláty, vytěsňují iontově vázající sulfonylmočoviny ze sérových proteinů v mnohem větší míře než neiontově vázající glyburid. Nebylo prokázáno, že by tento rozdíl ve vazbě na proteiny vedl k menšímu počtu interakcí lék-lék s tabletami glyburidu v klinickém použití.
Metformin hydrochlorid
Zdánlivý distribuční objem (V/F) metforminu po jednotlivých perorálních dávkách 850 mg byl v průměru 654±358 l. Metformin se jen zanedbatelně váže na plazmatické proteiny. Metformin se rozděluje do erytrocytů, s největší pravděpodobností jako funkce času. Při obvyklých klinických dávkách a dávkovacích schématech metforminu je ustálených plazmatických koncentrací metforminu dosaženo během 24 až 48 hodin a jsou obecně
Metabolismus A Eliminace
Glyburide
Pokles glyburidu v séru normálních zdravých jedinců je dvoufázový; terminální poločas je asi 10 hodin. Hlavním metabolitem glyburidu je 4-trans-hydroxyderivát. Vyskytuje se také druhý metabolit, 3-cis-hydroxyderivát. Tyto metabolity pravděpodobně nepřispívají k žádnému významnému hypoglykemickému účinku u lidí, protože jsou u králíků pouze slabě aktivní (1/400 a 1/40 jako aktivní, respektive jako glyburid). Glyburid je vylučován jako metabolity žlučí a močí, přibližně 50 % každou cestou. Tato duální vylučovací cesta je kvalitativně odlišná od ostatních sulfonylmočovin, které se vylučují primárně močí.
Metformin hydrochlorid
Studie s intravenózní jednorázovou dávkou u zdravých jedinců prokázaly, že metformin je vylučován v nezměněné podobě močí a nepodléhá jaternímu metabolismu (u lidí nebyly identifikovány žádné metabolity) ani žlučové exkreci. Renální clearance (viz tabulka 1) je přibližně 3,5krát vyšší než clearance kreatininu, což ukazuje, že tubulární sekrece je hlavní cestou eliminace metforminu. Po perorálním podání je přibližně 90 % absorbovaného léčiva eliminováno ledvinami během prvních 24 hodin, s poločasem plazmatické eliminace přibližně 6,2 hodin. V krvi je eliminační poločas přibližně 17,6 hodin, což naznačuje, že erytrocytární hmota může být distribučním kompartmentem.
Zvláštní populace
Pacienti s diabetem 2. typu
Studie s více dávkami glyburidu u pacientů s diabetem 2. typu prokazují křivky závislosti koncentrace léku na čase podobné studiím s jednou dávkou, což ukazuje, že nedochází k hromadění léku v tkáňových zásobách.
Za přítomnosti normální funkce ledvin nejsou žádné rozdíly mezi farmakokinetikou metforminu po jednorázové nebo opakované dávce mezi pacienty s diabetem 2. typu a normálními jedinci (viz tabulka 1), ani nedochází k žádné akumulaci metforminu v žádné skupině při obvyklém klinickém dávkách.
Jaterní nedostatečnost
U pacientů s jaterní insuficiencí pro glyburid nebo metformin nebyly provedeny žádné farmakokinetické studie.
Renální insuficience
Nejsou dostupné žádné informace o farmakokinetice glyburidu u pacientů s renální insuficiencí.
U pacientů se sníženou funkcí ledvin (na základě clearance kreatininu) je plazmatický a krevní poločas metforminu prodloužen a renální clearance je snížena úměrně poklesu clearance kreatininu (viz tabulka 1; také viz. VAROVÁNÍ ).
Geriatrie
Neexistují žádné informace o farmakokinetice glyburidu u starších pacientů.
Omezené údaje z kontrolovaných farmakokinetických studií metforminu u zdravých starších subjektů naznačují, že celková plazmatická clearance je snížena, poločas je prodloužen a Cmax je zvýšena ve srovnání se zdravými mladými subjekty. Z těchto údajů se zdá, že změna farmakokinetiky metforminu s věkem je primárně způsobena změnou funkce ledvin (viz tabulka 1). Léčba metforminem by neměla být zahájena u pacientů ve věku ≥ 80 let, pokud měření clearance kreatininu neprokáže, že funkce ledvin není snížena.
Pediatrie
Po podání jedné perorální tablety GLUCOPHAGE® (metformin hydrochlorid) 500 mg s jídlem se geometrický průměr Cmax a AUC metforminu lišil
Po podání jedné perorální tablety GLUCOVANCE s jídlem se geometrický průměr C a AUC glyburidu normalizovaný na dávku u pediatrických pacientů s diabetem 2. typu (11-16 let, n=28, průměrná tělesná hmotnost 97 kg) lišil
Rod
Neexistují žádné informace o vlivu pohlaví na farmakokinetiku glyburidu.
Farmakokinetické parametry metforminu se významně nelišily u subjektů s diabetem 2. typu nebo bez něj, když byly analyzovány podle pohlaví (muži = 19, ženy = 16). Podobně v kontrolovaných klinických studiích u pacientů s diabetem 2. typu byl antihyperglykemický účinek metforminu srovnatelný u mužů a žen.
Závod
Nejsou dostupné žádné informace o rasových rozdílech ve farmakokinetice glyburidu.
Nebyly provedeny žádné studie farmakokinetických parametrů metforminu podle rasy. V kontrolovaných klinických studiích metforminu u pacientů s diabetem 2. typu byl antihyperglykemický účinek srovnatelný u bělochů (n=249), černochů (n=51) a Hispánců (n=24).
Klinické studie
Pacienti s nedostatečnou kontrolou glykémie při samotné dietě a cvičení
Ve 20týdenní, dvojitě zaslepené, multicentrické klinické studii v USA bylo celkem 806 dosud neléčených pacientů s diabetem 2. typu, jejichž hyperglykémie nebyla dostatečně kontrolována pouze dietou a cvičením (výchozí hodnota plazmatické glukózy nalačno [FPG]
Léčba přípravkem GLUCOVANCE vedla k významně většímu snížení HbA a postprandiální plazmatické glukózy (PPG) ve srovnání s glyburidem, metforminem nebo placebem. Také léčba GLUCOVANCE vedla k většímu snížení FPG ve srovnání s glyburidem, metforminem nebo placebem, ale rozdíly mezi glyburidem a metforminem nedosáhly statistické významnosti.
Změny v lipidovém profilu související s léčbou přípravkem GLUCOVANCE 2,50 mg byly podobné těm, které byly pozorovány u glyburidu, metforminu a placeba.
Dvojitě zaslepená, placebem kontrolovaná studie popsaná výše omezila zařazení na pacienty s HbA1c
Pacienti s nedostatečnou glykemickou kontrolou na samotné sulfonyluree
16týdenní, dvojitě zaslepené, aktivně kontrolované klinické studii v USA bylo celkem 639 pacientů s diabetem 2. typu, který nebyl dostatečně kontrolován (průměrná výchozí hodnota HbA1c 9,5 %, průměrná výchozí hodnota FPG 213 mg/dl), zatímco byli léčeni alespoň jedna polovina maximální dávky sulfonylmočoviny (např. glyburid 10 mg, glipizid 20 mg) byla randomizována k podávání glyburidu (fixní dávka, 20 mg), metforminu (500 mg), GLUCOVANCE 2,5 mg/500 mg nebo GLUCOVANCE 5 mg /500 mg. Dávky metforminu a GLUCOVANCE byly titrovány na maximálně 4 tablety denně podle potřeby k dosažení FPG
Po 16 týdnech nedošlo k žádné významné změně průměrné hodnoty HbA u pacientů randomizovaných k léčbě glyburidem nebo metforminem. Léčba přípravkem GLUCOVANCE 2,50 mg v dávkách až 20 mg/2000 mg denně vedla k významnému snížení HbA, FPG a PPG oproti výchozí hodnotě ve srovnání se samotným glyburidem nebo metforminem.
Přidání thiazolidindionů k terapii GLUCOVANCE 400 mg
Ve 24týdenní, dvojitě zaslepené, multicentrické klinické studii v USA byli pacienti s diabetem 2. typu nedostatečně kontrolovaným současnou perorální antihyperglykemickou léčbou (buď monoterapie nebo kombinovaná léčba) nejprve převedeni na otevřenou léčbu GLUCOVANCE 2,5 mg/500 mg tablety a titrováni do maximální denní dávky 10 mg/2000 mg. Celkem 365 pacientů s nedostatečnou kontrolou (HbA1c > 7,0 % a ≤ 10 %) po 10 až 12 týdnech denní dávky GLUCOVANCE 500 mg alespoň 7,5 mg/1 500 mg bylo randomizováno k doplňkové léčbě rosiglitazonem 4 mg nebo placebem jednou denně . Po 8 týdnech byla dávka rosiglitazonu zvýšena na maximum 8 mg denně podle potřeby k dosažení cílové průměrné denní glukózy 126 mg/dl nebo HbA1c
U pacientů, kteří nedosáhli adekvátní glykemické kontroly na GLUCOVANCE 400 mg, vedlo přidání rosiglitazonu ve srovnání s placebem k významnému snížení HbA a FPG.
INFORMACE PRO PACIENTA
GLUCOVANCE® (glyburid a metformin HCl) tablety
VAROVÁNÍ: U malého počtu lidí, kteří užívali metformin-hydrochlorid, se vyvinul závažný stav nazývaný laktátová acidóza. K prevenci laktátové acidózy jsou potřeba správně fungující ledviny. Většina lidí s problémy s ledvinami by GLUCOVANCE neměla užívat. (Viz otázky č. 9-13.)
Q1. Proč musím užívat GLUCOVANCE 5 mg?
Váš lékař Vám předepsal GLUCOVANCE 500 mg k léčbě diabetu 2. typu. Toto je také známé jako noninsulin-dependentní diabetes mellitus.
Q2. Co je diabetes 2. typu?
Lidé s diabetem nejsou schopni vytvářet dostatek inzulínu a/nebo normálně reagovat na inzulín, který jejich tělo vytváří. Když k tomu dojde, cukr (glukóza) se hromadí v krvi. To může vést k vážným zdravotním problémům, včetně poškození ledvin, amputací a slepoty. Diabetes je také úzce spojen se srdečními chorobami. Hlavním cílem léčby cukrovky je snížit hladinu cukru v krvi na normální úroveň.
Q3. Proč je důležité kontrolovat diabetes 2. typu?
Hlavním cílem léčby cukrovky je snížit hladinu cukru v krvi na normální úroveň. Studie ukázaly, že dobrá kontrola hladiny cukru v krvi může zabránit nebo oddálit komplikace, jako je srdeční onemocnění, onemocnění ledvin nebo slepota.
Q4. Jak je diabetes 2. typu obvykle kontrolován?
Vysoká hladina cukru v krvi může být snížena dietou a cvičením, řadou perorálních léků a injekcí inzulínu. Než začnete užívat GLUCOVANCE 2,50 mg, měli byste se nejprve pokusit kontrolovat cukrovku cvičením a snížením hmotnosti. I když užíváte GLUCOVANCE, stále byste měla cvičit a dodržovat dietu doporučenou pro Váš diabetes.
Q5. Účinkuje GLUCOVANCE 400 mg odlišně od jiných léků na kontrolu hladiny glukózy?
Ano. GLUCOVANCE 400 mg kombinuje 2 léky snižující hladinu glukózy, glyburid a metformin. Tyto 2 léky spolupracují na zlepšení různých metabolických defektů nalezených u diabetu 2. typu. Glyburid snižuje hladinu cukru v krvi především tím, že způsobuje uvolnění většího množství vlastního inzulínu v těle a metformin snižuje hladinu cukru v krvi částečně tím, že pomáhá tělu efektivněji využívat váš vlastní inzulín. Společně vám účinně pomáhají dosáhnout lepší kontroly glukózy.
Q6. Co se stane, když mám hladinu cukru v krvi stále příliš vysokou?
Pokud není možné dostatečně snížit hladinu cukru v krvi přípravkem GLUCOVANCE, může Vám lékař předepsat injekční inzulín nebo přijmout jiná opatření ke kontrole Vaší cukrovky.
Q7. Může GLUCOVANCE 400 mg způsobit nežádoucí účinky?
GLUCOVANCE 2,50 mg, stejně jako všechny léky na snížení hladiny cukru v krvi, může u některých pacientů způsobit nežádoucí účinky. Většina těchto nežádoucích účinků je nezávažná. Existují však také závažné, ale vzácné nežádoucí účinky související s GLUCOVANCE (viz Q9-Q13).
Q8. Jaké jsou nejčastější nežádoucí účinky přípravku GLUCOVANCE 500 mg?
Nejběžnější vedlejší účinky přípravku GLUCOVANCE 5 mg jsou obvykle mírné, jako je průjem, nevolnost a žaludeční nevolnost. Pokud se tyto nežádoucí účinky objeví, obvykle se objeví během prvních několika týdnů léčby. Užívání přípravku GLUCOVANCE s jídlem může pomoci snížit tyto nežádoucí účinky.
Méně často se mohou objevit příznaky hypoglykémie (nízká hladina cukru v krvi), jako je točení hlavy, závratě, třes nebo hlad. Riziko hypoglykemických příznaků se zvyšuje, když se vynechávají jídla, konzumuje se příliš mnoho alkoholu nebo dochází k těžkému cvičení bez dostatku jídla. Dodržování rad svého lékaře vám může pomoci se těmto příznakům vyhnout.
Q9. Existují nějaké závažné nežádoucí účinky, které může GLUCOVANCE způsobit?
lidí, kteří mají stav známý jako nedostatek glukózo-6-fosfátdehydrogenázy (G6PD) a kteří užívají GLUCOVANCE, se může rozvinout hemolytická anémie (rychlý rozpad červených krvinek). Deficit G6PD se obvykle vyskytuje v rodinách. Informujte svého lékaře, pokud vám nebo některým členům vaší rodiny byl diagnostikován nedostatek G6PD, než začnete přípravek GLUCOVANCE užívat.
GLUCOVANCE zřídka způsobuje závažné nežádoucí účinky. Nejzávažnější nežádoucí účinek, který může GLUCOVANCE 2,50 mg způsobit, se nazývá laktátová acidóza.
Q10. Co je to laktátové acidos a může se mi to stát?
Laktátová acidóza je způsobena hromaděním kyseliny mléčné v krvi. Laktátová acidóza spojená s metforminem je vzácná a vyskytla se většinou u lidí, jejichž ledviny nefungovaly normálně. Laktátová acidóza byla hlášena asi u 1 z 33 000 pacientů užívajících metformin v průběhu jednoho roku. I když vzácně, pokud se laktátová acidóza objeví, může být až v polovině případů smrtelná.
Je také důležité, aby Vaše játra pracovala normálně, když užíváte GLUCOVANCE. Vaše játra pomáhají odstraňovat kyselinu mléčnou z vašeho krevního oběhu.
Váš lékař bude sledovat vaši cukrovku a může vám čas od času provádět krevní testy, aby se ujistil, že vaše ledviny a játra fungují normálně.
Neexistují žádné důkazy, že GLUCOVANCE poškozuje ledviny nebo játra.
Q11. Existují další rizikové faktory pro laktátovou acidózu?
Riziko vzniku laktátové acidózy při užívání přípravku GLUCOVANCE 400 mg je velmi nízké, pokud jsou Vaše ledviny a játra zdravé. Některé faktory však mohou zvýšit vaše riziko, protože mohou ovlivnit funkci ledvin a jater. Své riziko byste měli probrat se svým lékařem.
GLUCOVANCE 400 mg byste neměli užívat, pokud:
- Máte chronické problémy s ledvinami nebo játry
- Máte městnavé srdeční selhání, které je léčeno léky, např. digoxinem (Lanoxin®) nebo furosemidem (Lasix®)
- Nadměrně pijete alkohol (neustále nebo krátkodobé „nadměrné“ pití)
- Jste vážně dehydratovaný (ztratili jste velké množství tělesných tekutin)
- Budete mít určité rentgenové procedury s injekčními kontrastními látkami
- Chystáte se na operaci
- Rozvine se u vás vážný stav, jako je srdeční infarkt, závažná infekce nebo mrtvice
- Je vám ≥ 80 let a NEBYLI jste vyšetřeni na funkci ledvin
Q12. Jaké jsou příznaky laktátové acidózy?
Některé z příznaků zahrnují: pocit velké slabosti, únavy nebo nepohodlí; neobvyklá bolest svalů; potíže s dýcháním; neobvyklé nebo neočekávané žaludeční potíže; cítit zimu; pocit závratě nebo točení hlavy; nebo se náhle rozvine pomalý nebo nepravidelný srdeční tep.
Pokud zaznamenáte tyto příznaky nebo pokud se váš zdravotní stav náhle změní, přestaňte tablety GLUCOVANCE užívat a ihned kontaktujte svého lékaře. Laktátová acidóza je lékařská pohotovost, která musí být léčena v nemocnici.
Q13. Co potřebuje můj lékař vědět, aby snížil riziko laktátové acidózy?
Informujte svého lékaře, pokud máte onemocnění, které má za následek těžké zvracení, průjem a/nebo horečku, nebo pokud je váš příjem tekutin výrazně omezen. Tyto situace mohou vést k těžké dehydrataci a může být nutné dočasně přerušit užívání přípravku GLUCOVANCE 400 mg.
Měli byste informovat svého lékaře, pokud se chystáte podstoupit jakýkoli chirurgický zákrok nebo specializované rentgenové postupy, které vyžadují injekci kontrastních látek. V takových případech bude nutné dočasně přerušit léčbu přípravkem GLUCOVANCE 2,50 mg.
Q14. Mohu užívat GLUCOVANCE 500 mg s jinými léky?
Připomeňte svému lékaři, že užíváte GLUCOVANCE 2,50 mg, když je předepsán jakýkoli nový lék nebo dojde ke změně v užívání již předepsaného léku. GLUCOVANCE 400 mg může ovlivňovat způsob, jakým některé léky účinkují, a některé léky mohou interferovat s účinkem GLUCOVANCE.
Neužívejte přípravek GLUCOVANCE, pokud užíváte bosentan používaný k léčbě plicní arteriální hypertenze (PAH), což je vysoký krevní tlak v cévách plic.
Q15. Co když otěhotním během užívání GLUCOVANCE 400 mg?
Informujte svého lékaře, pokud plánujete otěhotnět nebo jste otěhotněla. Stejně jako u jiných perorálních léků na kontrolu glukózy byste neměla užívat GLUCOVANCE během těhotenství.
Obvykle vám lékař předepíše inzulín, když jste těhotná. Stejně jako u všech léků byste měli se svým lékařem probrat užívání přípravku GLUCOVANCE 5 mg, pokud kojíte dítě.
Q16. Jak se GLUCOVANCE užívá?
Váš lékař Vám řekne, kolik tablet GLUCOVANCE máte užívat a jak často. To by mělo být také vytištěno na štítku vašeho předpisu. Pravděpodobně začnete s nízkou dávkou přípravku GLUCOVANCE 400 mg a vaše dávka se bude postupně zvyšovat, dokud nebude hladina cukru v krvi pod kontrolou.
Q17. Kde mohu získat více informací o GLUCOVANCE 400 mg?
Tato příbalová informace je souhrnem nejdůležitějších informací o přípravku GLUCOVANCE. Máte-li jakékoli dotazy nebo problémy, poraďte se o cukrovce 2. typu a také o GLUCOVANCE a jejích vedlejších účincích se svým lékařem nebo jiným poskytovatelem zdravotní péče. Existuje také leták (příbalový leták) napsaný pro zdravotníky, který vám může dát váš lékárník přečíst.
