Prandin 0.5mg, 1mg, 2mg Repaglinide Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Prandin 2 mg a jak se používá?
Prandin 1 mg je lék na předpis používaný k léčbě příznaků diabetes mellitus 2. Prandin lze užívat samostatně nebo s jinými léky.
Prandin patří do třídy léků nazývaných antidiabetika, deriváty maglitinidů.
Není známo, zda je přípravek Prandin 1 mg bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Prandin?
Prandin může způsobit závažné nežádoucí účinky, včetně:
- kopřivka,
- potíže s dýcháním,
- otok obličeje, rtů, jazyka nebo hrdla,
- silná bolest v horní části žaludku šířící se do zad,
- nevolnost,
- zvracení,
- rychlý srdeční tep,
- bledá nebo zažloutlá kůže,
- tmavě zbarvená moč,
- horečka,
- zmatek,
- slabost,
- bolest krku,
- pálení ve tvých očích,
- bolest kůže a
- následovaná červenou nebo fialovou kožní vyrážkou, která se šíří (zejména v obličeji nebo horní části těla) a způsobuje puchýře a olupování
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Prandin patří:
- nízká hladina cukru v krvi,
- nevolnost,
- průjem,
- bolest hlavy,
- bolesti zad,
- bolesti kloubů a
- příznaky nachlazení (ucpaný nos, kýchání, bolest v krku)
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Prandin. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
PRANDIN (repaglinid) je perorální lék snižující hladinu glukózy v krvi ze třídy glinidů. Repaglinid, kyselina S(+)2-ethoxy-4(2((3-methyl-1-(2-(1piperidinyl)fenyl)-butyl)amino)-2-oxoethyl)benzoová, chemicky nesouvisí s perorálně podávaným sulfonylmočovinovým inzulínem sekretagogy.
Strukturní vzorec repaglinidu

Repaglinid je bílý až téměř bílý prášek s molekulovým vzorcem C27H36N2O4 a molekulovou hmotností 452,6. Tablety PRANDIN obsahují 0,5 mg, 1 mg nebo 2 mg repaglinidu. Kromě toho každá tableta obsahuje následující neaktivní složky: hydrogenfosforečnan vápenatý (bezvodý), mikrokrystalická celulóza, kukuřičný škrob, polakrilin draselný, povidon, glycerol (85 %), magnesium-stearát, meglumin a poloxamer. Tablety 1 mg a 2 mg obsahují jako barviva oxidy železa (žlutý a červený).
INDIKACE
PRANDIN je indikován jako doplněk diety a cvičení ke zlepšení kontroly glykémie u dospělých s diabetes mellitus 2. typu.
Omezení používání
PRANDIN by neměli užívat pacienti s diabetes mellitus 1. typu nebo k léčbě diabetické ketoacidózy.
DÁVKOVÁNÍ A PODÁVÁNÍ
Doporučené dávkování a podávání
Doporučená počáteční dávka pro pacienty s HbA1c nižším než 8 % je 0,5 mg perorálně před každým jídlem. U pacientů, jejichž HbA1c je 8 % nebo vyšší, je počáteční dávka 1 nebo 2 mg perorálně před každým jídlem.
Doporučené rozmezí dávek je 0,5 mg až 4 mg před jídlem, s maximální denní dávkou 16 mg. Pacientova dávka by měla být zdvojnásobena až na 4 mg s každým jídlem, dokud není dosaženo uspokojivé kontroly glykémie. K posouzení odpovědi po každé úpravě dávky by měl uplynout alespoň jeden týden.
Poučte pacienty, aby užívali PRANDIN do 30 minut před jídlem. PRANDIN 2 mg lze podávat 2, 3 nebo 4krát denně v reakci na změny ve stravovacím režimu pacienta.
pacientů, kteří vynechávají jídlo, poučte pacienty, aby vynechali plánovanou dávku přípravku PRANDIN 1 mg, aby se snížilo riziko hypoglykémie. U pacientů, kteří mají hypoglykémii, by měla být dávka přípravku PRANDIN 1 mg snížena [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Pacienti s těžkým poškozením ledvin
U pacientů s těžkou poruchou funkce ledvin (CrCl = 20 až 40 ml/min) zahajte PRANDIN 0,5 mg perorálně před každým jídlem. V případě potřeby dávku postupně titrujte, abyste dosáhli kontroly glykémie.
Modifikace dávky pro lékové interakce
U pacientů užívajících současně silné inhibitory CYP3A4 nebo CYP2C8 nebo silné induktory CYP3A4 nebo CYP2C8 se doporučuje úprava dávkování (viz DROGOVÉ INTERAKCE , KLINICKÁ FARMAKOLOGIE ].
Současné užívání s gemfibrozilem je kontraindikováno [viz KONTRAINDIKACE ].
Vyhněte se současnému užívání přípravku PRANDIN 2 mg s klopidogrelem. Pokud se současnému užívání nelze vyhnout, začněte PRANDIN na 0,5 mg před každým jídlem a nepřekračujte celkovou denní dávku 4 mg [viz DROGOVÉ INTERAKCE , KLINICKÁ FARMAKOLOGIE ].
Nepřekračujte celkovou denní dávku 6 mg PRANDIN 2 mg u pacientů užívajících cyklosporin (viz DROGOVÉ INTERAKCE , KLINICKÁ FARMAKOLOGIE ].
JAK DODÁVÁNO
Dávkové formy A Síly
- mg tablety (žluté, kulaté, bikonvexní tablety s vyraženým „745“ na jedné straně a „C“ na druhé straně)
- 2 mg tablety (růžové, kulaté, bikonvexní tablety, s vyraženým „747“ na jedné straně a „C“ na druhé straně)
PRANDIN (repaglinid) tablety, 1 mg , jsou dodávány jako žluté, kulaté, bikonvexní tablety s vyraženým „745“ na jedné straně a „C“ na druhé straně. Jsou k dispozici následovně:
Láhve po 100 NDC 60846-882-01
PRANDIN (repaglinid) tablety, 2 mg , jsou dodávány jako růžové, kulaté, bikonvexní tablety s vyraženým „747“ na jedné straně a „C“ na druhé straně. Jsou k dispozici následovně:
Láhve po 100 NDC 60846-884-01
Skladujte při 20° až 25°C (68° až 77°F) [viz USP Regulovaná pokojová teplota]. Chraňte před vlhkostí. Uchovávejte lahve těsně uzavřené.
Dávkujte v těsných nádobách s bezpečnostními uzávěry.
Distribuuje: Amneal Specialty, divize společnosti Amneal Pharmaceuticals LLC Bridgewater, NJ 08807. Revize: březen 2019
VEDLEJŠÍ EFEKTY
Následující závažná nežádoucí reakce je také popsána jinde v označení:
Hypoglykémie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných plánů, míra nežádoucích účinků hlášená v jedné klinické studii nemusí být snadno srovnávána s mírou hlášenou v jiné klinické studii a nemusí odrážet míru skutečně pozorovanou v klinické praxi.
Během klinických studií byl přípravek PRANDIN 1 mg podán 2931 jedincům. Přibližně 1500 těchto jedinců s diabetem 2. typu bylo léčeno po dobu alespoň 3 měsíců, 1000 po dobu alespoň 6 měsíců a 800 po dobu alespoň 1 roku. Většina těchto jedinců (1228) dostávala PRANDIN v jedné z pěti jednoletých, aktivně kontrolovaných studií. Během jednoho roku bylo 13 % pacientů s přípravkem PRANDIN 1 mg vysazeno z důvodu nežádoucích účinků. Nejčastějšími nežádoucími účinky vedoucími k vysazení byly hyperglykémie, hypoglykémie a související příznaky.
Tabulka 1 uvádí časté nežádoucí účinky u pacientů s přípravkem PRANDIN ve srovnání s placebem ve studiích trvajících 12 až 24 týdnů.
Hypoglykémie
V klinických studiích s přípravkem PRANDIN 1 mg je hypoglykémie nejčastěji pozorovaným nežádoucím účinkem. Mírná nebo středně závažná hypoglykémie se vyskytla u 31 % pacientů léčených přípravkem PRANDIN 1 mg a u 7 % pacientů léčených placebem (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Hypoglykémie byla hlášena u 16 % z 1228 pacientů s přípravkem PRANDIN, 20 % ze 417 pacientů s glyburidem a 19 % z 81 pacientů s glipizidem v jednoročních kontrolovaných studiích. Z pacientů léčených přípravkem PRANDIN se symptomatickou hypoglykémií se u žádného nerozvinulo kóma ani nevyžadovalo hospitalizaci.
Ve 24týdenní placebem kontrolované studii měli pacienti, kteří dosud nebyli léčeni perorálními hypoglykemickými látkami, a pacienti s HbA1c nižším než 8 % na začátku, vyšší frekvenci hypoglykémie.
Přibývání na váze
Když byli pacienti dříve léčení perorálními hypoglykemiky převedeni na přípravek PRANDIN, nedošlo k žádnému průměrnému nárůstu tělesné hmotnosti. Průměrný přírůstek hmotnosti u pacientů léčených přípravkem PRANDIN 0,5 mg a dříve neléčených deriváty sulfonylurey byl 3,3 %.
Kardiovaskulární příhody
Výskyt celkových závažných kardiovaskulárních nežádoucích příhod, včetně ischemie, byl v kontrolovaných srovnávacích klinických studiích vyšší u přípravku PRANDIN (51/1228 nebo 4 %) než u léků na bázi sulfonylmočoviny (13/498 nebo 3 %).
Sedm kontrolovaných klinických studií zahrnovalo kombinovanou léčbu PRANDIN s NPH-inzulínem (n=431), samotnými inzulínovými přípravky (n=388) nebo jinými kombinacemi (sulfonylmočovina plus NPH-inzulín nebo PRANDIN 1 mg plus metformin) (n=120). Vyskytlo se šest závažných nežádoucích příhod ischemie myokardu u pacientů léčených přípravkem PRANDIN 0,5 mg plus NPH-inzulín ze dvou studií a jedna příhoda u pacientů užívajících pouze inzulínové přípravky z jiné studie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Kombinovaná léčba s thiazolidindiony
Hypoglykémie
Během 24týdenních klinických studií kombinované terapie PRANDIN-rosiglitazon nebo PRANDIN-pioglitazon (celkem 250 pacientů v kombinované terapii) se hypoglykémie (glykémie
Periferní edém a srdeční selhání
Periferní edém byl hlášen u 12 z 250 (4,8 %) pacientů s kombinovanou léčbou PRANDIN-thiazolidindion a u 3 ze 124 (2,4 %) pacientů s monoterapií thiazolidindionem, přičemž v těchto studiích nebyl hlášen žádný případ pro monoterapii PRANDIN. U 2 z 250 pacientů (0,8 %) léčených PRANDIN-thiazolidindionem byly hlášeny epizody edému s městnavým srdečním selháním. Oba pacienti měli v anamnéze onemocnění koronárních tepen a zotavili se po léčbě diuretiky. Nebyly hlášeny žádné srovnatelné případy ve skupinách s monoterapií.
Přibývání na váze
Průměrné zvýšení hmotnosti spojené s kombinovanou léčbou PRANDINem a pioglitazonem bylo 5,5 kg, 0,3 kg a 2,0 kg. Průměrné zvýšení hmotnosti spojené s kombinovanou léčbou PRANDINem a rosiglitazonem bylo 4,5 kg, 1,3 kg a 3,3 kg.
Méně časté nežádoucí příhody (
Méně časté nežádoucí klinické nebo laboratorní příhody pozorované v klinických studiích zahrnovaly zvýšené jaterní enzymy, trombocytopenii, leukopenii a anafylaktoidní reakce.
Postmarketingové zkušenosti
Následující další nežádoucí účinky byly identifikovány během postregistračního používání přípravku PRANDIN. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není obecně možné spolehlivě odhadnout jejich frekvenci nebo kauzální vztah k expozici léku.
- Alopecie
- Hemolytická anémie
- Pankreatitida
- Stevens-Johnsonův syndrom
- Těžká jaterní dysfunkce včetně žloutenky a hepatitidy
DROGOVÉ INTERAKCE
Klinicky důležité lékové interakce s PRANDINem
Tabulka 3 obsahuje seznam léků s klinicky významnými lékovými interakcemi při současném podávání s přípravkem PRANDIN 1 mg a pokyny pro jejich prevenci nebo léčbu.
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Hypoglykémie
Všechny glinidy, včetně PRANDIN 0,5 mg, mohou způsobit hypoglykémii [viz NEŽÁDOUCÍ REAKCE ]. Těžká hypoglykémie může způsobit záchvaty, může být život ohrožující nebo způsobit smrt. Hypoglykémie může zhoršit schopnost koncentrace a reakční dobu; to může vystavit jednotlivce a další osoby riziku v situacích, kdy jsou tyto schopnosti důležité (např. řízení nebo obsluha jiných strojů).
Hypoglykémie se může objevit náhle a příznaky se mohou u každého jedince lišit a u stejného jedince se v průběhu času měnit. Symptomatické povědomí o hypoglykémii může být méně výrazné u pacientů s dlouhodobým diabetem, u pacientů s diabetickým nervovým onemocněním, u pacientů užívajících léky blokující sympatický nervový systém (např. betablokátory) [viz DROGOVÉ INTERAKCE ] nebo u pacientů, u kterých se opakují hypoglykémie.
Mezi faktory, které mohou zvýšit riziko hypoglykémie, patří změny ve stravovacím režimu (např. obsah makroživin), změny v úrovni fyzické aktivity, změny souběžně podávaných léků [viz DROGOVÉ INTERAKCE ] a při současném užívání s jinými antidiabetiky. Pacienti s poruchou funkce ledvin nebo jater mohou mít vyšší riziko hypoglykémie (viz Použití u konkrétních populací ].
Pacienti by měli podávat PRANDIN 0,5 mg před jídlem a měli by být poučeni, aby při vynechání jídla dávku PRANDINu vynechali. U pacientů, kteří mají hypoglykémii, by měla být dávka přípravku PRANDIN snížena (viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Pacienti a ošetřovatelé musí být poučeni, aby rozpoznali a zvládli hypoglykémii. Vlastní monitorování hladiny glukózy v krvi hraje zásadní roli v prevenci a zvládání hypoglykémie. U pacientů s vyšším rizikem hypoglykémie a pacientů, kteří mají snížené symptomatické povědomí o hypoglykémii, se doporučuje zvýšená frekvence monitorování hladiny glukózy v krvi.
Závažné kardiovaskulární nežádoucí účinky při současném užívání s NPH-inzulínem
sedmi kontrolovaných studiích se vyskytlo šest závažných nežádoucích příhod ischemie myokardu u pacientů léčených přípravkem PRANDIN 0,5 mg plus NPH-inzulín ze dvou studií a jedna příhoda u pacientů užívajících pouze inzulínové přípravky z jiné studie [viz NEŽÁDOUCÍ REAKCE ]. PANDIN není indikován pro použití v kombinaci s NPH-inzulinem.
Makrovaskulární výsledky
Nebyly provedeny žádné klinické studie prokazující nezvratné důkazy o snížení makrovaskulárního rizika přípravkem PRANDIN.

Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Ve 104týdenní studii karcinogenity u potkanů v dávkách až 120 mg/kg/den, což je přibližně 60násobek klinické expozice na základě mg/m2, byl u samců potkanů zvýšený výskyt benigních adenomů štítné žlázy a jater. U samic potkanů nebyl nalezen žádný důkaz karcinogenity. Vyšší výskyt nádorů štítné žlázy a jater u samců potkanů nebyl pozorován při nižších dávkách 30 mg/kg/den a 60 mg/kg/den (což je více než 15, resp. 30násobek klinických expozic na mg/m2 základ). Ve 104týdenní studii karcinogenity u myší v dávkách až 500 mg/kg/den nebyl u myší nalezen žádný důkaz karcinogenity (což je přibližně 125násobek klinické expozice na základě mg/m2).
Repaglinid nebyl genotoxický v řadě studií in vivo a in vitro: Bakteriální mutageneze (Amesův test), in vitro test přímé buněčné mutace v buňkách V79 (HGPRT), in vitro test chromozomální aberace v lidských lymfocytech, neplánovaná a replikující se syntéza DNA v krysích játrech a in vivo myších a krysích mikronukleárních testech.
Ve studii fertility u potkanů byl repaglinid podáván samcům a samicím potkanů v dávkách až 300 a 80 mg/kg/den, v daném pořadí. Nebyly pozorovány žádné nežádoucí účinky na fertilitu (což je více než 40násobek klinické expozice na základě mg/m2).
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
Omezené údaje o použití přípravku PRANDIN a repaglinidu u těhotných žen nejsou dostatečné k tomu, aby informovaly o riziku závažných vrozených vad nebo potratu souvisejícím s užíváním léku. Existují rizika pro matku a plod spojená se špatně kontrolovaným diabetem v těhotenství [viz Klinické úvahy ].
Ve studiích na zvířatech (potkani a králíci) nebyl repaglidin prokázán teratogenní. Embryotoxicita, abnormální vývoj končetin u potkaního plodu byl pozorován u potkaních samic vystavených vysokým dávkám v poslední fázi březosti.
Odhadované základní riziko závažných vrozených vad je 6 % až 10 % u žen s pregestačním diabetem s HbA1c >7 a bylo hlášeno, že je až 20 % až 25 % u žen s HbA1c >10. Odhadované základní riziko potratu pro indikovanou populaci není známo. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 % až 4 % a 15 % až 20 %.
Klinické úvahy
Mateřské a/nebo embryo/fetální riziko spojené s onemocněním
Špatně kontrolovaný diabetes v těhotenství zvyšuje u matky riziko diabetické ketoacidózy, preeklampsie, spontánních potratů, předčasného porodu, mrtvého porodu a porodních komplikací. Špatně kontrolovaný diabetes zvyšuje u plodu riziko závažných vrozených vad, mrtvě narozených dětí a morbidity související s makrosomií.
Data
Lidská data
Adekvátní údaje o vývojových rizicích spojených s užíváním přípravku PRANDIN 2 mg u těhotných žen nejsou k dispozici.
Údaje o zvířatech
Repaglinid nebyl teratogenní u potkanů nebo králíků v dávkách 40násobku (potkani) a přibližně 0,8násobku (králík) klinické expozice (na základě mg/m2) během těhotenství. U potomků potkaních samic vystavených repaglinidu při 15násobku klinické expozice na bázi mg/m2 během 17. až 22. dne březosti a během laktace se v postnatálním období vyvinuly neteratogenní deformity skeletu sestávající ze zkrácení, ztluštění a ohnutí humeru. Tento účinek nebyl pozorován při dávkách až 2,5násobku klinické expozice (na základě mg/m2) v 1. až 22. den těhotenství nebo při vyšších dávkách podaných během 1. až 16. dne těhotenství.
Laktace
Shrnutí rizik
Neexistují žádné informace týkající se přítomnosti PRANDIN 0,5 mg v mateřském mléce, účinků na kojené dítě nebo účinků na produkci mléka. Repaglinid byl detekován v mléce potkanů, i když kvůli druhově specifickým rozdílům ve fyziologii laktace nemusí údaje na zvířatech spolehlivě předpovědět hladiny léčiva v lidském mléce. Rozvoj a zdravotní přínosy kojení by měly být zváženy spolu s klinickou potřebou matky užívat přípravek PRANDIN a veškerými potenciálními nežádoucími účinky přípravku PRANDIN nebo základních mateřských onemocnění na kojené dítě.
Klinické úvahy
Ačkoli není známo, zda se repaglinid vylučuje do mateřského mléka, je známo, že některé perorální přípravky se vylučují touto cestou. Vzhledem k tomu, že u kojených dětí může existovat možnost hypoglykémie, a vzhledem k účinkům na kojící zvířata, je třeba rozhodnout, zda má být přípravek PRANDIN přerušen u kojících matek, nebo zda by matky měly přerušit kojení. Pokud je léčba přípravkem PRANDIN přerušena a pokud samotná dieta nestačí ke kontrole hladiny glukózy v krvi, je třeba zvážit léčbu inzulínem.
Data
V reprodukčních studiích u potkanů byly v mateřském mléce samic zjištěny měřitelné hladiny repaglinidu a u mláďat byly pozorovány snížené hladiny glukózy v krvi. Studie zkřížené pěstounské péče ukázaly, že kosterní změny [viz Těhotenství ] mohla být indukována u kontrolních mláďat kojených léčenými samicemi, i když k tomu došlo v menší míře než u mláďat léčených in utero.
Pediatrické použití
Bezpečnost a účinnost nebyla u dětských pacientů stanovena.
Geriatrické použití
klinických studiích trvajících 24 týdnů nebo déle bylo 415 pacientů starších 65 let a žádný pacient nebyl starší než 75 let. V jednoročních, aktivně kontrolovaných studiích nebyly pozorovány žádné rozdíly v účinnosti nebo nežádoucích účincích mezi těmito subjekty a osobami mladšími 65 let. U starších subjektů nedošlo ke zvýšení frekvence nebo závažnosti hypoglykémie, ale větší citlivost některých starších jedinců na Terapii PRANDIN 0,5 mg nelze vyloučit.
Renální poškození
Farmakokinetické studie repaglinidu byly provedeny u pacientů s mírnou až středně těžkou poruchou funkce ledvin (CrCl = 40 až 80 ml/min) a těžkou poruchou funkce ledvin (CrCl = 20 až 40 ml/min). U pacientů s mírnou až středně těžkou poruchou funkce ledvin není nutná úprava úvodní dávky. Pacienti s těžkou poruchou funkce ledvin by však měli zahájit léčbu přípravkem PRANDIN dávkou 0,5 mg a pečlivě titrovat (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Studie nebyly prováděny u pacientů s clearance kreatininu pod 20 ml/min nebo u pacientů s renálním selháním vyžadujícím hemodialýzu.
Poškození jater
Studie s jednorázovou dávkou byla provedena u 12 pacientů s chronickým onemocněním jater. Pacienti se středně těžkou až těžkou poruchou jaterních funkcí měli vyšší a delší sérové koncentrace. Proto by měl být PRANDIN 0,5 mg používán s opatrností u pacientů s poruchou funkce jater. Aby bylo možné plně posoudit odpověď, mohou být nutné delší intervaly mezi úpravami dávky.
PŘEDÁVKOVAT
Mohou se objevit závažné hypoglykemické reakce s kómatem, záchvaty nebo jiným neurologickým poškozením, které představují naléhavou lékařskou pomoc vyžadující okamžitou hospitalizaci. Hypoglykemické symptomy bez ztráty vědomí nebo neurologických nálezů by měly být léčeny agresivně perorální glukózou a úpravou dávkování léku a/nebo způsobu stravování. Pečlivé sledování může pokračovat, dokud se lékař neujistí, že pacient je mimo nebezpečí. Pacienti by měli být pečlivě sledováni po dobu minimálně 24 až 48 hodin, protože hypoglykémie se může po zjevném klinickém zotavení znovu objevit. Neexistují žádné důkazy o tom, že PRANDIN je dialyzovatelný pomocí hemodialýzy.
KONTRAINDIKACE
PRANDIN je kontraindikován u pacientů s:
- Současné užívání gemfibrozilu [viz DROGOVÉ INTERAKCE ]
- Známá přecitlivělost na repaglinid nebo jiné neaktivní složky
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Repaglinid snižuje hladinu glukózy v krvi stimulací uvolňování inzulinu ze slinivky břišní. Toto působení je závislé na fungujících beta (ß) buňkách v ostrůvcích pankreatu. Uvolňování inzulínu je závislé na glukóze a snižuje se při nízkých koncentracích glukózy.
Repaglinid uzavírá ATP-dependentní draslíkové kanály v membráně ß-buněk vazbou na charakteristická místa. Tato blokáda draslíkových kanálů depolarizuje ß-buňku, což vede k otevření vápníkových kanálů. Výsledný zvýšený přísun vápníku indukuje sekreci inzulínu. Mechanismus iontových kanálů je vysoce tkáňově selektivní s nízkou afinitou k srdečnímu a kosternímu svalu.
Farmakodynamika
Čtyřtýdenní, dvojitě zaslepená, placebem kontrolovaná studie závislosti odpovědi na dávce byla provedena u 138 pacientů s diabetem 2. typu s použitím dávek v rozmezí od 0,25 (není schválená dávka) do 4 mg užívaných s každým ze tří jídel. Léčba přípravkem PRANDIN vedla ke snížení glukózy úměrnému dávce v celém rozsahu dávek. Plazmatické hladiny inzulínu se po jídle zvýšily a před dalším jídlem se vrátily k výchozí hodnotě. Většina účinku na snížení hladiny glukózy v krvi nalačno byla prokázána během 1 až 2 týdnů.
Ve dvojitě zaslepené, placebem kontrolované, 3měsíční studii titrace dávky byly dávky PRANDIN 0,5 mg nebo placeba u každého pacienta týdně zvyšovány z 0,25 mg (neschválená dávka) přes 0,5, 1 a 2 mg na maximum 4 mg, dokud nebylo dosaženo hladiny glukózy v plazmě nalačno (FPG)
Dávkování přípravku PRANDIN 0,5 mg ve vztahu k uvolňování inzulínu souvisejícím s jídlem bylo studováno ve třech studiích zahrnujících 58 pacientů. Glykemická kontrola byla udržována během období, kdy se jídlo a způsob dávkování měnily (2, 3 nebo 4 jídla denně; před jídlem x 2, 3 nebo 4) ve srovnání s obdobím 3 běžných jídel a 3 dávek denně ( před jídlem x 3). Účinek na snížení hladiny glukózy v krvi se nelišil, když byl PRANDIN 0,5 mg podán na začátku jídla, 15 minut před jídlem nebo 30 minut před jídlem.
Farmakokinetika
Farmakokinetické parametry repaglinidu získané ze zkřížené studie s jednorázovou dávkou u zdravých subjektů a z vícedávkové paralelní studie proporcionality (0,5, 1, 2 a 4 mg) u pacientů s diabetem 2. typu jsou shrnuty v tabulkách 5 a 6. Tyto údaje ukazují, že repaglinid se neakumuloval v séru. Clearance perorálního repaglinidu se v rozmezí dávek 0,5 až 4 mg nezměnila, což ukazuje na lineární vztah mezi dávkou a plazmatickými hladinami léčiva.
Vstřebávání
Po perorálním podání je repaglinid zcela absorbován z gastrointestinálního traktu. Po jednorázovém a opakovaném perorálním podání zdravým subjektům nebo pacientům se maximální plazmatické hladiny léčiva (Cmax) objeví během 1 hodiny (Tmax). Repaglinid je vylučován z krevního oběhu s poločasem přibližně 1 hodina. Průměrná absolutní biologická dostupnost je 56 %. Když byl repaglinid podáván s jídlem, průměrná Tmax se nezměnila, ale průměrná Cmax a AUC (plocha pod křivkou čas/plazmatická koncentrace) byly sníženy o 20 % a 12,4 %.
Rozdělení
Po intravenózním (IV) podání u zdravých subjektů byl distribuční objem v ustáleném stavu (Vss) 31 l a celková tělesná clearance (CL) byla 38 l/h. Vazba na protein a vazba na lidský sérový albumin byla vyšší než 98 %.
Metabolismus A Eliminace
Repaglinid je kompletně metabolizován oxidativní biotransformací a přímou konjugací s kyselinou glukuronovou po intravenózní nebo perorální dávce. Hlavními metabolity jsou oxidovaná dikarboxylová kyselina (M2), aromatický amin (M1) a acylglukuronid (M7). Bylo prokázáno, že enzymový systém cytochromu P-450, konkrétně 2C8 a 3A4, se účastní N-dealkylace repaglinidu na M2 a další oxidace na M1. Metabolity nepřispívají k účinku repaglinidu na snížení glukózy. Během 96 hodin po podání 14C-repaglinidu jako jednorázové perorální dávky bylo přibližně 90 % radioaktivně značené látky nalezeno ve stolici a přibližně 8 % v moči. Pouze 0,1 % dávky se vyloučí močí jako mateřská látka. Hlavní metabolit (M2) představoval 60 % podané dávky. Méně než 2 % původního léčiva bylo nalezeno ve stolici. Repaglinid se zdá být substrátem pro aktivní transportér vychytávání v játrech (organický aniontový transportní protein OATP1B1).
Variabilita expozice
AUC repaglinidu po opakovaných dávkách 0,25 až 4 mg s každým jídlem se mění v širokém rozmezí. Intraindividuální a interindividuální variační koeficienty byly 36 % a 69 %. AUC v rozmezí terapeutických dávek zahrnovala 69 až 1005 ng/ml*h, ale expozice AUC až 5417 ng/ml*h byla dosažena ve studiích s eskalací dávky bez zjevných nepříznivých následků.
Specifické populace
Geriatrický
Zdraví dobrovolníci byli léčeni režimem 2 mg PRANDIN 0,5 mg užívaným před každým ze 3 jídel. Mezi skupinou pacientů Použití u konkrétních populací ].
Rod
Srovnání farmakokinetiky u mužů a žen ukázalo, že AUC v rozmezí dávek 0,5 mg až 4 mg je o 15 % až 70 % vyšší u žen s diabetem 2. typu. Tento rozdíl se neodrazil ve frekvenci hypoglykemických epizod (muži: 16 %; ženy: 17 %) nebo jiných nežádoucích příhod.
Závod
Nebyly provedeny žádné farmakokinetické studie k posouzení účinků rasy, ale v jednoleté studii v USA u pacientů s diabetem 2. typu byl účinek na snížení hladiny glukózy v krvi srovnatelný mezi bělochy (n=297) a Afroameričany (n= 33). V americké studii závislosti odpovědi na dávce nebyl zjištěn žádný zjevný rozdíl v expozici (AUC) mezi bělochy (n=74) a Hispánci (n=33).
Renální poškození
Farmakokinetika repaglinidu po jednorázové dávce a v ustáleném stavu byla srovnávána mezi pacienty s diabetem 2. typu a normální funkcí ledvin (CrCl > 80 ml/min), mírnou až středně těžkou poruchou funkce ledvin (CrCl = 40 až 80 ml/min) a těžkou porucha funkce ledvin (CrCl = 20 až 40 ml/min). AUC i Cmax repaglinidu byly podobné u pacientů s normální a mírnou až středně těžkou poruchou funkce ledvin (průměrné hodnoty 56,7 ng/ml*h vs. 57,2 ng/ml*h a 37,5 ng/ml vs 37,7 ng/ml, v tomto pořadí.) s vážně sníženou funkcí ledvin měli zvýšené průměrné hodnoty AUC a Cmax (98,0 ng/ml*h a 50,7 ng/ml, v daném pořadí), ale tato studie ukázala pouze slabou korelaci mezi hladinami repaglinidu a clearance kreatininu.
Poškození jater
Byla provedena otevřená studie s jednorázovou dávkou u 12 zdravých subjektů a 12 pacientů s chronickým jaterním onemocněním (CLD) klasifikovaným podle Child-Pughovy stupnice a clearance kofeinu. Pacienti se středně těžkou až těžkou poruchou jaterních funkcí měli vyšší a delší sérové koncentrace celkového i nevázaného repaglinidu než zdraví jedinci (AUChealthy: 91,6 ng/ml*h; pacienti s AUCCLD: 368,9 ng/ml*h; Cmax, zdraví: 46,7 ng/ml, Cmax, pacienti s CLD: 105,4 ng/ml). AUC statisticky korelovala s clearance kofeinu. Mezi skupinami pacientů nebyl pozorován žádný rozdíl v glukózových profilech.
Lékové interakce
Studie lékových interakcí provedené u zdravých dobrovolníků ukazují, že PRANDIN 0,5 mg neměl žádný klinicky významný účinek na farmakokinetické vlastnosti digoxinu, theofylinu nebo warfarinu. Současné podávání cimetidinu s přípravkem PRANDIN 1 mg významně nezměnilo absorpci a likvidaci repaglinidu.
Kromě toho byly následující léky studovány u zdravých dobrovolníků se současným podáváním přípravku PRANDIN.
Klinické studie
Monoterapeutické zkoušky
Dvojitě zaslepená, placebem kontrolovaná studie byla provedena u 362 pacientů léčených po dobu 24 týdnů. HbA1c u skupin léčených PRANDINem (kombinované skupiny 1 a 4 mg) se na konci studie snížilo ve srovnání se skupinou léčenou placebem u dosud neléčených pacientů a u pacientů dříve léčených perorálními hypoglykemiky o 2,1 % a 1,7 %, respektive. V této studii s fixní dávkou vykázali pacienti, kteří dosud nebyli léčeni perorálními hypoglykemickými léky, a pacienti s HbA1c nižším než 8 % na začátku, větší snížení hladiny glukózy v krvi.
Kombinované zkoušky
PRANDIN v kombinaci s metforminem
Přípravek PRANDIN byl studován v kombinaci s metforminem u 83 pacientů, u kterých nebylo dosaženo uspokojivé kontroly cvičením, dietou a samotným metforminem. Dávka PRANDIN 2 mg byla titrována po dobu 4 až 8 týdnů, poté následovalo 3měsíční udržovací období. Kombinovaná léčba přípravkem PRANDIN 1 mg a metforminem vedla ke statisticky významnému zlepšení HbA1c a plazmatické glukózy nalačno (FPG) ve srovnání s přípravkem PRANDIN 2 mg nebo monoterapií metforminem (tabulka 8). V této studii, kde byla dávka metforminu udržována konstantní, kombinovaná terapie PRANDINem a metforminem vykazovala účinky šetřící dávku s ohledem na PRANDIN. Zlepšení HbA1c a FPG u kombinované skupiny bylo dosaženo při nižší denní dávce 0,5 mg PRANDINu než ve skupině s monoterapií PRANDIN (tabulka 8).
PRANDIN 1 mg v kombinaci s pioglitazonem
Režim kombinované léčby PRANDINem a pioglitazonem (N=123) byl srovnáván se samotným PRANDINem (N=61) a samotným pioglitazonem (N=62) ve 24týdenní studii, do které bylo zařazeno 246 pacientů dříve léčených sulfonylureou nebo metforminem v monoterapii (HbA1c > 7,0 %). Dávka PRANDIN 1 mg byla titrována během prvních 12 týdnů, po kterých následovalo 12týdenní udržovací období. Kombinovaná léčba vedla ke statisticky významnému zlepšení HbA1c a FPG ve srovnání s monoterapií (obrázek 1). Změny FPG (mg/dl) a HbA1c (%) oproti výchozí hodnotě u pacientů, kteří dokončili léčbu, byly: -39,8 mg/dl a -0,1 % pro PRANDIN, -35,3 mg/dl a -0,1 % pro pioglitazon a -92,4 mg/ dl a -1,9 % pro kombinaci. V této studii, kde byla dávka pioglitazonu udržována konstantní, vykazovala skupina s kombinovanou terapií účinky šetřící dávku s ohledem na PRANDIN (viz obrázek 1 legenda). Zlepšení HbA1c a FPG ve skupině s kombinovanou léčbou bylo dosaženo při nižší denní dávce přípravku PRANDIN než ve skupině s monoterapií PRANDIN.
Obrázek 1: PRANDIN v kombinaci s pioglitazonem: hodnoty HbA1c
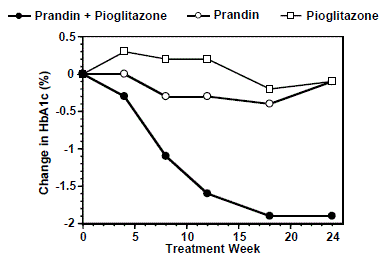
LEGENDA
Hodnoty HbA1c podle týdne studie u pacientů, kteří dokončili studii (kombinace, N = 101; PRANDIN 1 mg, N = 35, pioglitazon, N = 26). Jedinci s FPG nad 270 mg/dl byli ze studie vyřazeni.
Dávka pioglitazonu: fixní na 30 mg/den; PRANDIN 1 mg medián konečné dávky: 6 mg/den pro kombinaci a 10 mg/den pro monoterapii.
PRANDIN v kombinaci s rosiglitazonem
Režim kombinované léčby přípravkem PRANDIN a rosiglitazonem byl srovnáván s monoterapií buď samotným oběma látkami ve 24týdenní studii, do které bylo zařazeno 252 pacientů dříve léčených sulfonylureou nebo metforminem (HbA1c > 7,0 %). Kombinovaná léčba vedla ke statisticky významnému zlepšení HbA1c a FPG ve srovnání s monoterapií (tabulka 9 níže). Glykemické účinky kombinované terapie byly dávkově šetřící jak s ohledem na celkovou denní dávku PRANDIN 1 mg, tak celkovou denní dávku rosiglitazonu (viz tabulka 9 Legend). Zlepšení HbA1c a FPG ve skupině s kombinovanou terapií bylo dosaženo nižší denní dávkou PRANDIN 1 mg a rosiglitazonu ve srovnání s příslušnými skupinami s monoterapií.
INFORMACE PRO PACIENTA
Hypoglykémie
Informujte pacienty, že PRANDIN 2 mg může způsobit hypoglykémii, a poučte pacienty a jejich ošetřovatele o postupech samoléčby včetně monitorování glukózy a zvládání hypoglykémie. Informujte pacienty, že jejich schopnost koncentrace a reakce může být narušena v důsledku hypoglykémie. U pacientů s vyšším rizikem hypoglykémie a pacientů, kteří mají snížené symptomatické povědomí o hypoglykémii, se doporučuje zvýšená frekvence monitorování glukózy v krvi (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Správa
Poučte pacienty, aby užívali PRANDIN 0,5 mg během 30 minut před jídlem. Poučte pacienty, aby při vynechání jídla vynechali svou dávku PRANDINU [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Lékové interakce
Diskutujte o potenciálních lékových interakcích s pacienty a informujte je o potenciálních lékových interakcích s PRANDINem [viz DROGOVÉ INTERAKCE ].
