Clarinex 5mg Desloratadine Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
CLARINEX® (desloratadin) Tablety
POPIS
CLARINEX (desloratadin) Tablety jsou světle modré, kulaté, potahované tablety obsahující 5 mg desloratadinu, antihistaminika, k perorálnímu podání. CLARINEX 5 mg tablety také obsahují následující pomocné látky: dihydrát hydrogenfosforečnanu vápenatého USP, mikrokrystalická celulóza NF, kukuřičný škrob NF, mastek USP, karnaubský vosk NF, bílý vosk NF, potahový materiál skládající se z monohydrátu laktózy, hypromelózy, oxidu titaničitého, polyethylenglykolu a Hliníkové jezero FD&C Blue #2.
CLARINEX perorální roztok je čirá oranžově zbarvená kapalina obsahující 0,5 mg/1 ml desloratadinu. Perorální roztok obsahuje následující neaktivní složky: propylenglykol USP, roztok sorbitolu USP, kyselina citronová (bezvodá) USP, dihydrát citrátu sodného USP, benzoát sodný NF, edetát disodný USP, čištěná voda USP. Dále obsahuje krystalový cukr, přírodní a umělé aroma do žvýkaček a barvivo FDC Yellow #6.
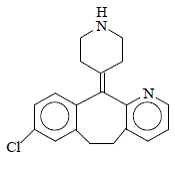
Desloratadin je bílý až téměř bílý prášek, který je mírně rozpustný ve vodě, ale velmi dobře rozpustný v ethanolu a propylenglykolu. Má empirický vzorec: C19H19ClN2 a molekulovou hmotnost 310,8. Chemický název je 8-chlor-6,11-dihydro-11-(4-piperdinyliden)-5H-benzo[5,6]cyklohepta[1,2-b]pyridin a má následující strukturu:
INDIKACE
Sezónní alergická rýma
CLARINEX® je indikován k úlevě od nosních a mimonosních příznaků sezónní alergické rýmy u pacientů ve věku 2 let a starších.
Celoroční alergická rýma
CLARINEX je indikován k úlevě od nosních a mimonosních příznaků celoroční alergické rýmy u pacientů ve věku 6 měsíců a starších.
Chronická idiopatická kopřivka
CLARINEX 5 mg je indikován k symptomatické úlevě od svědění, snížení počtu a velikosti kopřivky u pacientů s chronickou idiopatickou kopřivkou ve věku 6 měsíců a starších.
DÁVKOVÁNÍ A PODÁVÁNÍ
Ačkoli může být na trhu dostupná tabletová formulace desloratadinu, která se rozkládá v ústech, tablety CLARINEX® RediTabs® již nejsou na trhu.
CLARINEX 5 mg tablety, perorální roztok nebo tablety RediTabs lze užívat bez ohledu na jídlo. Umístěte tablety CLARINEX (desloratadin) RediTabs na jazyk a nechte je před polknutím rozpadnout. Rozpad tablety probíhá rychle. Podávejte s vodou nebo bez vody. Užijte tabletu ihned po otevření blistru.
Dávka přípravku CLARINEX perorální roztok odpovídající věku by měla být podávána komerčně dostupným odměrným kapátkem nebo injekční stříkačkou, která je kalibrována na dodání 2 ml a 2,5 ml (½ čajové lžičky).
Dospělí a dospívající ve věku 12 let a více
Doporučená dávka přípravku CLARINEX Tablets nebo CLARINEX RediTabs Tablets je jedna 5mg tableta jednou denně. Doporučená dávka perorálního roztoku CLARINEX jsou 2 čajové lžičky (5 mg v 10 ml) jednou denně.
Děti od 6 do 11 let
Doporučená dávka perorálního roztoku CLARINEX je 1 čajová lžička (2,5 mg v 5 ml) jednou denně. Doporučená dávka přípravku CLARINEX RediTabs Tablets je jedna 2,5mg tableta jednou denně.
Děti od 12 měsíců do 5 let
Doporučená dávka přípravku CLARINEX 5 mg perorální roztok je ½ čajové lžičky (1,25 mg ve 2,5 ml) jednou denně.
Děti 6 až 11 měsíců věku
Doporučená dávka perorálního roztoku CLARINEX je 2 ml (1 mg) jednou denně.
Dospělí S Poškozením jater nebo ledvin
U dospělých pacientů s poruchou funkce jater nebo ledvin se na základě farmakokinetických údajů doporučuje úvodní dávka jedna 5mg tableta každý druhý den. Doporučené dávkování pro děti s poruchou funkce jater nebo ledvin nelze stanovit kvůli nedostatku údajů [viz KLINICKÁ FARMAKOLOGIE ].
JAK DODÁVÁNO
Dávkové formy A Síly
Tablety CLARINEX jsou světle modré potahované tablety s vyraženým „C5“ obsahující 5 mg desloratadinu. CLARINEX perorální roztok je čirá oranžově zbarvená kapalina obsahující 0,5 mg desloratadinu/1 ml.
Skladování A Manipulace
CLARINEX 5 mg tablety: Vyražené „C5“, světle modré, potahované tablety, které jsou baleny v plastových lahvích z vysokohustotního polyethylenu po 100 ( NDC 0085-1264-01).
CLARINEX 5 mg perorální roztok: Čirá oranžově zbarvená kapalina obsahující 0,5 mg/1 ml desloratadinu v 16-uncové lahvičce z jantarového skla ( NDC 0085-1334-01) a láhev z jantarového skla o objemu 4 unce ( NDC 0085-1334-02).
Úložný prostor
Tablety CLAINEX: Chraňte jednotkové balení a nemocniční balení jednotkové dávky před nadměrnou vlhkostí. Skladujte při teplotě 25 °C (77 °F); povoleny výchylky do 15-30°C (59-86°F) [viz USP řízená pokojová teplota ]. Citlivé na teplo. Vyhněte se expozici při nebo nad 30 °C (86 °F).
CLARINEX perorální roztok: Skladujte při teplotě 25 °C (77 °F); povoleny výchylky do 15-30°C (59-86°F) [viz USP řízená pokojová teplota ]. Chraňte před světlem.
Vyrobeno pro: Merck Sharp & Dohme Corp., dceřiná společnost MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Revize: březen 2019
VEDLEJŠÍ EFEKTY
Následující nežádoucí účinky jsou podrobněji popsány v jiných částech štítku:
- Hypersenzitivní reakce. [Vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v klinické praxi.
Dospělí A Dospívající
Alergická rýma
V placebem kontrolovaných studiích s opakovanými dávkami dostávalo 2 834 pacientů ve věku 12 let nebo starších CLARINEX tablety v dávkách 2,5 mg až 20 mg denně, z nichž 1 655 pacientů dostávalo doporučenou denní dávku 5 mg. U pacientů, kteří dostávali 5 mg denně, byl výskyt nežádoucích účinků podobný u pacientů užívajících přípravek CLARINEX 5 mg a pacientů užívajících placebo. Procento pacientů, kteří předčasně ukončili léčbu kvůli nežádoucím účinkům, bylo 2,4 % ve skupině s přípravkem CLARINEX 5 mg a 2,6 % ve skupině s placebem. V těchto studiích se u pacientů užívajících desloratadin nevyskytly žádné závažné nežádoucí účinky. Všechny nežádoucí příhody, které byly hlášeny u více než 2 % pacientů, kteří dostávali doporučenou denní dávku 5 mg tablety CLARINEX (5 mg jednou denně), a které byly častější u tablet CLARINEX než u placeba, jsou uvedeny v tabulce 1.
Frekvence a rozsah laboratorních a elektrokardiografických abnormalit byly podobné u pacientů léčených přípravkem CLARINEX a placebem.
Nebyly zjištěny žádné rozdíly v nežádoucích účincích u podskupin pacientů definovaných podle pohlaví, věku nebo rasy.
Chronická idiopatická kopřivka
V placebem kontrolovaných studiích s opakovanými dávkami chronické idiopatické kopřivky dostávalo 211 pacientů ve věku 12 let nebo starších přípravek CLARINEX 5 mg tablety a 205 placebo. Nežádoucí příhody, které byly hlášeny u více než 2 % pacientů, kteří dostávali CLARINEX 5 mg tablety a které byly častější u přípravku CLARINEX 5 mg než u placeba, byly (četnost pro CLARINEX 5 mg a placebo): bolest hlavy (14 %, 13 %) , nevolnost (5 %, 2 %), únava (5 %, 1 %), závratě (4 %, 3 %), faryngitida (3 %, 2 %), dyspepsie (3 %, 1 %) a myalgie (3 %, 1 %).
Pediatrie
Dvě stě čtyřicet šest pediatrických subjektů ve věku 6 měsíců až 11 let dostávalo CLARINEX perorální roztok po dobu 15 dnů ve třech placebem kontrolovaných klinických studiích. Pediatričtí jedinci ve věku 6 až 11 let dostávali 2,5 mg jednou denně, jedinci ve věku 1 až 5 let dostávali 1,25 mg jednou denně a jedinci ve věku 6 až 11 měsíců dostávali 1,0 mg jednou denně.
U subjektů ve věku 6 až 11 let nebyly hlášeny žádné jednotlivé nežádoucí účinky u 2 nebo více procent subjektů.
U subjektů ve věku 2 až 5 let byly nežádoucími účinky hlášenými u přípravku CLARINEX a placeba u nejméně 2 procent subjektů užívajících perorální roztok CLARINEX 5 mg a s frekvencí vyšší než u placeba horečka (5,5 %, 5,4 %), infekce močových cest (3,6 %, 0 %) a plané neštovice (3,6 %, 0 %).
subjektů ve věku 12 až 23 měsíců byly nežádoucí příhody hlášené u přípravku CLARINEX 5 mg a placeba u nejméně 2 procent subjektů užívajících perorální roztok CLARINEX a s frekvencí vyšší než u placeba byly horečka (16,9 %, 12,9 %), průjem ( 15,4 %, 11,3 %), infekce horních cest dýchacích (10,8 %, 9,7 %), kašel (10,8 %, 6,5 %), zvýšená chuť k jídlu (3,1 %, 1,6 %), emoční labilita (3,1 %, 0 %), epistaxe ( 3,1 %, 0 %), parazitární infekce (3,1 %, 0 %), faryngitida (3,1 %, 0 %), makulopapulární vyrážka (3,1 %, 0 %).
subjektů ve věku 6 měsíců až 11 měsíců byly nežádoucí účinky hlášené u přípravku CLARINEX 5 mg a placeba u nejméně 2 procent subjektů užívajících perorální roztok CLARINEX 5 mg a s frekvencí vyšší než u placeba byly infekce horních cest dýchacích (21,2 %, 12,9 %), průjem (19,7 %, 8,1 %), horečka (12,1 %, 1,6 %), podrážděnost (12,1 %, 11,3 %), kašel (10,6 %, 9,7 %), somnolence (9,1 %, 8,1 %), bronchitida (6,1 %, 0 %), zánět středního ucha (6,1 %, 1,6 %), zvracení (6,1 %, 3,2 %), anorexie (4,5 %, 1,6 %), faryngitida (4,5 %, 1,6 %), nespavost (4,5 %, 0 %), rinorea (4,5 %, 3,2 %), erytém (3,0 %, 1,6 %) a nauzea (3,0 %, 0 %).
Nebyly zjištěny žádné klinicky významné změny v žádném elektrokardiografickém parametru, včetně QTc intervalu. Pouze jeden z 246 pediatrických subjektů užívajících CLARINEX 5 mg perorální roztok v klinických studiích přerušil léčbu z důvodu nežádoucí příhody.
Postmarketingové zkušenosti
Protože nežádoucí příhody jsou hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich četnost nebo stanovit příčinnou souvislost s expozicí drogám. Během uvedení desloratadinu na trh byly hlášeny následující spontánní nežádoucí účinky:
Srdeční poruchy: tachykardie, bušení srdce
Respirační, hrudní a mediastinální poruchy: dušnost
Poruchy kůže a podkoží: vyrážka, svědění
Poruchy nervového systému: psychomotorická hyperaktivita, poruchy hybnosti (včetně dystonie, tiků a extrapyramidových příznaků), záchvaty (hlášené u pacientů se známými záchvatovými poruchami i bez nich)
Poruchy imunitního systému: hypersenzitivní reakce (jako je kopřivka, edém a anafylaxe)
Vyšetřování: zvýšené jaterní enzymy včetně bilirubinu
Poruchy jater a žlučových cest: hepatitida
Poruchy metabolismu a výživy: zvýšená chuť k jídlu
DROGOVÉ INTERAKCE
Inhibitory cytochromu P450 3A4
kontrolovaných klinických studiích vedlo současné podávání desloratadinu s ketokonazolem, erythromycinem nebo azithromycinem ke zvýšení plazmatických koncentrací desloratadinu a 3-hydroxydesloratadinu, ale v bezpečnostním profilu desloratadinu nebyly žádné klinicky významné změny. [Vidět KLINICKÁ FARMAKOLOGIE ]
Fluoxetin
V kontrolovaných klinických studiích vedlo současné podávání desloratadinu s fluoxetinem, selektivním inhibitorem zpětného vychytávání serotoninu (SSRI), ke zvýšení plazmatických koncentrací desloratadinu a 3-hydroxydesloratadinu, ale v bezpečnostním profilu desloratadinu nebyly žádné klinicky významné změny. [Vidět KLINICKÁ FARMAKOLOGIE ]
Cimetidin
V kontrolovaných klinických studiích vedlo současné podávání desloratadinu s cimetidinem, antagonistou histaminových H2-receptorů, ke zvýšeným plazmatickým koncentracím desloratadinu a 3-hydroxydesloratadinu, ale nebyly pozorovány žádné klinicky významné změny v bezpečnostním profilu desloratadinu. [Vidět KLINICKÁ FARMAKOLOGIE ]
Zneužívání drog a závislost
Neexistují žádné informace, které by naznačovaly, že se u CLARINEX Tablets vyskytuje zneužívání nebo závislost.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Hypersenzitivní reakce
Po podání desloratadinu byly hlášeny hypersenzitivní reakce včetně vyrážky, svědění, kopřivky, edému, dušnosti a anafylaxe. Pokud se taková reakce objeví, je třeba léčbu přípravkem CLARINEX 5 mg ukončit a zvážit alternativní léčbu. [Vidět NEŽÁDOUCÍ REAKCE ]
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( INFORMACE PRO PACIENTA ).
Informace pro pacienty
- Pacienti by měli být poučeni, aby používali přípravek CLARINEX 5 mg podle pokynů.
- Vzhledem k tomu, že jídlo nemá žádný vliv na biologickou dostupnost, pacienti mohou být poučeni, že CLARINEX 5 mg tablety, perorální roztok nebo tablety RediTabs mohou být užívány bez ohledu na jídlo.
- Pacienty je třeba upozornit, aby nezvyšovali dávku ani frekvenci dávkování, protože studie neprokázaly zvýšenou účinnost při vyšších dávkách a může se objevit ospalost.
- Fenylketonurika: Tablety CLARINEX RediTabs obsahují fenylalanin.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Studie karcinogenity
Karcinogenní potenciál desloratadinu byl hodnocen pomocí studie s loratadinem na potkanech a studie s desloratadinem na myších. Ve 2leté studii na potkanech byl loratadin podáván v potravě v dávkách až 25 mg/kg/den (odhadované expozice desloratadinu a metabolitu desloratadinu byly přibližně 30krát vyšší než AUC u lidí při doporučené denní perorální dávce). Významně vyšší výskyt hepatocelulárních nádorů (kombinovaných adenomů a karcinomů) byl pozorován u mužů, kterým bylo podáváno 10 mg/kg/den loratadinu a u mužů a žen, kterým byl podáván loratadin v dávce 25 mg/kg/den. Odhadované expozice desloratadinu a metabolitu desloratadinu u potkanů, kterým bylo podáváno 10 mg/kg loratadinu, byly přibližně 7krát vyšší než AUC u lidí při doporučené denní perorální dávce. Klinický význam těchto nálezů při dlouhodobém užívání desloratadinu není znám.
Ve dvouleté dietní studii na myších samci a samice, kterým bylo podáváno až 16 mg/kg/den desloratadinu a 32 mg/kg/den desloratadin, nevykázali významné zvýšení výskytu žádných nádorů. Odhadovaná expozice desloratadinu a metabolitu desloratadinu u myší při těchto dávkách byla 12 a 27krát vyšší než AUC u lidí při doporučené denní perorální dávce.
Studie genotoxicity
Ve studiích genotoxicity s desloratadinem nebyl prokázán genotoxický potenciál v testu reverzních mutací (test bakteriální mutagenity savčích mikrozomů Salmonella/E. coli) nebo ve 2 testech na chromozomální aberace (test klastogenicity lymfocytů z periferní krve a test na mikronukleus kostní dřeně u myší ).
Zhoršení Plodnosti
Při dávkách desloratadinu až 24 mg/kg/den nebyl u potkaních samic žádný vliv na plodnost (odhadované expozice desloratadinu a metabolitu desloratadinu byly přibližně 130krát vyšší než AUC u lidí při doporučené denní perorální dávce). Specifický pokles plodnosti u samců, prokázaný sníženou mírou početí samic, sníženým počtem a pohyblivostí spermií a histopatologickými testikulárními změnami, se objevil při perorální dávce desloratadinu 12 mg/kg u potkanů (odhadované expozice desloratadinu a metabolitu desloratadinu byly přibližně 45krát vyšší než AUC u lidí při doporučené denní perorální dávce). Desloratadin neměl žádný vliv na fertilitu u potkanů při perorální dávce 3 mg/kg/den (odhadované expozice desloratadinu a metabolitu desloratadinu byly přibližně 8krát vyšší než AUC u lidí při doporučené denní perorální dávce).
Použití u konkrétních populací
Těhotenství
Kategorie těhotenství C
Neexistují žádné adekvátní a dobře kontrolované studie u těhotných žen. Vzhledem k tomu, že reprodukční studie na zvířatech ne vždy předpovídají lidskou odpověď, měl by být desloratadin během těhotenství podáván pouze tehdy, je-li to nezbytně nutné.
Desloratadin nebyl teratogenní u potkanů a králíků při přibližně 210násobku a 230násobku plochy pod křivkou koncentrace-čas (AUC) u lidí při doporučené denní perorální dávce. Zvýšení preimplantačních ztrát a snížený počet implantací a plodů však bylo zaznamenáno v samostatné studii u samic potkanů při přibližně 120násobku AUC u lidí při doporučené denní perorální dávce. Snížená tělesná hmotnost a pomalý vzpřimovací reflex byly hlášeny u mláďat přibližně 50krát nebo více než AUC u lidí při doporučené denní perorální dávce. Desloratadin neměl žádný vliv na vývoj mláďat při přibližně 7násobku AUC u lidí při doporučené denní perorální dávce. Srovnání AUC se týkalo expozice desloratadinu u králíků a součtu expozic desloratadinu a jeho metabolitů u potkanů. [Vidět Neklinická toxikologie ]
Kojící matky
Desloratadin přechází do mateřského mléka; proto by se mělo rozhodnout, zda přerušit kojení nebo přerušit léčbu desloratadinem, přičemž je třeba vzít v úvahu přínos léku pro kojící matku a možné riziko pro dítě.
Pediatrické použití
Doporučená dávka přípravku CLARINEX 5 mg perorální roztok u pediatrické populace je založena na porovnání plazmatické koncentrace přípravku CLARINEX 5 mg u dospělých a pediatrických subjektů ve zkřížených studiích. Bezpečnost přípravku CLARINEX perorální roztok byla stanovena u 246 pediatrických pacientů ve věku od 6 měsíců do 11 let ve třech placebem kontrolovaných klinických studiích. Protože průběh sezónní a celoroční alergické rýmy a chronické idiopatické kopřivky a účinky přípravku CLARINEX jsou u pediatrické a dospělé populace dostatečně podobné, umožňuje extrapolaci z údajů o účinnosti u dospělých na dětské pacienty. Účinnost přípravku CLARINEX 5 mg perorální roztok u těchto věkových skupin je podpořena důkazy z adekvátních a dobře kontrolovaných studií přípravku CLARINEX 5 mg tablety u dospělých. Bezpečnost a účinnost přípravku CLARINEX 5 mg tablety nebo CLARINEX 5 mg perorální roztok nebyla prokázána u pediatrických pacientů mladších 6 měsíců. [Vidět KLINICKÁ FARMAKOLOGIE ]
Tableta CLARINEX RediTabs 2,5 mg nebyla u pediatrických pacientů hodnocena. U dospělých byla stanovena bioekvivalence přípravku CLARINEX 5 mg RediTabs Tablet a dříve prodávaného přípravku RediTabs Tablet. Ve spojení s popsanými studiemi pro stanovení dávky v pediatrii farmakokinetické údaje pro CLARINEX 5 mg RediTabs podporují použití síly dávky 2,5 mg u pediatrických pacientů ve věku 6 až 11 let.
Geriatrické použití
Klinické studie desloratadinu nezahrnovaly dostatečný počet subjektů ve věku 65 let a více, aby bylo možné určit, zda reagují odlišně od mladších subjektů. Jiné hlášené klinické zkušenosti nezjistily rozdíly mezi staršími a mladšími pacienty. Obecně by měl být výběr dávky pro staršího pacienta opatrný, odrážející vyšší frekvenci snížené funkce jater, ledvin nebo srdce a souběžného onemocnění nebo jiné lékové terapie. [Vidět KLINICKÁ FARMAKOLOGIE ]
Renální poškození
U pacientů s poruchou funkce ledvin se doporučuje úprava dávkování [viz DÁVKOVÁNÍ A PODÁVÁNÍ a KLINICKÁ FARMAKOLOGIE ].
Poškození jater
pacientů s poruchou funkce jater se doporučuje úprava dávkování [viz DÁVKOVÁNÍ A PODÁVÁNÍ a KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
V případě předávkování zvažte standardní opatření k odstranění nevstřebaného léku. Doporučuje se symptomatická a podpůrná léčba. Desloratadin a 3-hydroxydesloratadin nejsou eliminovány hemodialýzou.
Informace týkající se akutního předávkování jsou omezeny na zkušenosti z hlášení nežádoucích účinků po uvedení přípravku na trh az klinických studií provedených během vývoje přípravku CLARINEX 5 mg. Ve studii s rozmezím dávek byla při dávkách 10 mg a 20 mg/den hlášena somnolence.
V jiné studii nebyly hlášeny žádné klinicky relevantní nežádoucí účinky u normálních dobrovolníků mužského a ženského pohlaví, kterým byly podávány jednotlivé denní dávky přípravku CLARINEX 45 mg po dobu 10 dnů (viz KLINICKÁ FARMAKOLOGIE ].

letalitě došlo u potkanů při perorálních dávkách 250 mg/kg nebo vyšších (odhadované expozice desloratadinu a metabolitu desloratadinu byly přibližně 120krát vyšší než AUC u lidí při doporučené denní perorální dávce). Perorální střední letální dávka u myší byla 353 mg/kg (odhadované expozice desloratadinu byly přibližně 290krát vyšší než denní perorální dávka u člověka na základě mg/m²). Při perorálních dávkách do 250 mg/kg u opic nedošlo k žádnému úmrtí (odhadované expozice desloratadinu byly přibližně 810krát vyšší než denní perorální dávka u člověka na základě mg/m²).
KONTRAINDIKACE
CLARINEX 5 mg tablety, RediTabs a perorální roztok jsou kontraindikovány u pacientů, kteří jsou přecitlivělí na tento lék nebo na kteroukoli jeho složku nebo na loratadin [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a NEŽÁDOUCÍ REAKCE ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Desloratadin je dlouhodobě působící tricyklický antagonista histaminu se selektivním antagonistickým účinkem na H1-receptor. Údaje o vazbě na receptor ukazují, že při koncentraci 2-3 ng/ml (7 nanomolární) vykazuje desloratadin významnou interakci s lidským histaminovým H1-receptorem. Desloratadin inhiboval uvolňování histaminu z lidských žírných buněk in vitro. Výsledky studie distribuce radioaktivně značené tkáně u potkanů a studie vazby radioligandu na H1-receptor na morčatech ukázaly, že desloratadin neprochází snadno hematoencefalickou bariérou. Klinický význam tohoto nálezu není znám.
Farmakodynamika
Wheal A Flare
Studie kožních pupínků na lidském histaminu po jednorázové a opakované dávce 5 mg desloratadinu ukázaly, že lék vykazuje antihistaminový účinek do 1 hodiny; tato činnost může trvat až 24 hodin. Ve skupině s desloratadinem 5 mg během 28denního léčebného období nebyly prokázány histaminem indukované tachyfylaxe kožních pupínků. Klinický význam kožních testů na histaminové pupínky není znám.
Účinky na QTc
Jednorázové denní dávky 45 mg byly podávány normálním mužským a ženským dobrovolníkům po dobu 10 dnů. Všechny EKG získané v této studii byly manuálně načteny zaslepeným způsobem kardiologem. U subjektů léčených přípravkem CLARINEX došlo ke zvýšení průměrné srdeční frekvence o 9,2 tepů za minutu ve srovnání s placebem. QT interval byl korigován na srdeční frekvenci (QTc) jak metodou Bazett, tak metodou Fridericia. Při použití QTc (Bazett) došlo k průměrnému zvýšení o 8,1 ms u subjektů léčených přípravkem CLARINEX ve srovnání s placebem. Při použití QTc (Fridericia) došlo k průměrnému zvýšení o 0,4 ms u subjektů léčených přípravkem CLARINEX ve srovnání s placebem. Nebyly hlášeny žádné klinicky relevantní nežádoucí účinky.
Farmakokinetika
Vstřebávání
Po perorálním podání 5mg tablety desloratadinu jednou denně po dobu 10 dnů normálním zdravým dobrovolníkům došlo k průměrné době dosažení maximálních plazmatických koncentrací (Tmax) přibližně 3 hodiny po dávce a průměrné maximální plazmatické koncentrace v ustáleném stavu (Cmax) a AUC Bylo pozorováno 4 ng/ml a 56,9 ng.h/ml. Jídlo ani grapefruitový džus neměly vliv na biologickou dostupnost (Cmax a AUC) desloratadinu.
Farmakokinetický profil přípravku CLARINEX perorální roztok byl hodnocen ve třícestné zkřížené studii u 30 dospělých dobrovolníků. Jedna dávka 10 ml perorálního roztoku CLARINEX obsahující 5 mg desloratadinu byla bioekvivalentní jedné dávce 5 mg tablety CLARINEX. Jídlo nemělo žádný vliv na biologickou dostupnost (AUC a Cmax) přípravku CLARINEX 5 mg perorální roztok.
Farmakokinetický profil přípravku CLARINEX 5 mg RediTabs tablety byl hodnocen ve třícestné zkřížené studii u 24 dospělých dobrovolníků. Jedna tableta CLARINEX RediTabs obsahující 5 mg desloratadinu byla bioekvivalentní jedné tabletě CLARINEX RediTabs s obsahem 5 mg (původní složení) pro desloratadin i 3-hydroxydesloratadin. Jídlo a voda neměly žádný vliv na biologickou dostupnost (AUC a Cmax) tablet CLARINEX RediTabs.
Rozdělení
Desloratadin a 3-hydroxydesloratadin se váží na plazmatické proteiny přibližně z 82 % až 87 % a 85 % až 89 %. Vazba desloratadinu a 3-hydroxydesloratadinu na proteiny se u subjektů s poruchou funkce ledvin nezměnila.
Metabolismus
Desloratadin (hlavní metabolit loratadinu) je rozsáhle metabolizován na 3-hydroxydesloratadin, aktivní metabolit, který je následně glukuronidován. Enzym (enzymy) odpovědný za tvorbu 3-hydroxydesloratadinu nebyl identifikován. Údaje z klinických studií naznačují, že podskupina obecné populace má sníženou schopnost tvořit 3-hydroxydesloratadin a jsou pomalými metabolizátory desloratadinu. Ve farmakokinetických studiích (n=3748) bylo přibližně 6 % subjektů pomalými metabolizátory desloratadinu (definováno jako subjekt s poměrem AUC 3-hydroxydesloratadinu k desloratadinu nižším než 0,1 nebo subjekt s poločasem desloratadinu přesahujícím 50 hodin ). Tyto farmakokinetické studie zahrnovaly subjekty ve věku od 2 do 70 let, včetně 977 subjektů ve věku 2 až 5 let, 1575 subjektů ve věku 6 až 11 let a 1196 subjektů ve věku 12 až 70 let. Mezi věkovými skupinami nebyl žádný rozdíl v prevalenci pomalých metabolizátorů. Frekvence pomalých metabolizátorů byla vyšší u černochů (17 %, n=988) ve srovnání s bělochy (2 %, n=1 462) a Hispánci (2 %, n=1 063). Střední expozice (AUC) desloratadinu u pomalých metabolizátorů byla přibližně 6krát vyšší než u jedinců, kteří nejsou pomalými metabolizátory. Subjekty, které jsou pomalými metabolizátory desloratadinu, nelze prospektivně identifikovat a po podání doporučené dávky desloratadinu budou vystaveni vyšším hladinám desloratadinu. Do vícedávkových klinických studií bezpečnosti, kde byl identifikován status metabolizátorů, bylo zařazeno celkem 94 pomalých a 123 normálních metabolizátorů, kteří byli léčeni perorálním roztokem CLARINEX po dobu 15-35 dnů. V těchto studiích nebyly pozorovány žádné celkové rozdíly v bezpečnosti mezi pomalými a normálními metabolizátory. Ačkoli to nebylo v těchto studiích pozorováno, nelze vyloučit zvýšené riziko nežádoucích účinků souvisejících s expozicí u pacientů, kteří jsou pomalí metabolizátoři.
Odstranění
Průměrný plazmatický eliminační poločas desloratadinu byl přibližně 27 hodin. Hodnoty Cmax a AUC se po jednotlivých perorálních dávkách mezi 5 a 20 mg zvýšily úměrně dávce. Stupeň akumulace po 14 dnech podávání byl v souladu s poločasem a frekvencí dávkování. Studie lidské hmotnostní bilance dokumentovala výtěžnost přibližně 87 % dávky 14C-desloratadinu, která byla rovnoměrně distribuována v moči a stolici jako metabolické produkty. Analýza plazmatického 3-hydroxydesloratadinu ukázala podobné hodnoty Tmax a poločasu ve srovnání s desloratadinem.
Zvláštní populace
Geriatrické předměty
starších subjektů (≥65 let; n=17) po podání více dávek přípravku CLARINEX 5 mg tablety byly průměrné hodnoty Cmax a AUC desloratadinu o 20 % vyšší než u mladších subjektů (
Pediatrické předměty
subjektů ve věku 6 až 11 let vedla jednorázová dávka 5 ml perorálního roztoku CLARINEX obsahující 2,5 mg desloratadinu k plazmatickým koncentracím desloratadinu podobným koncentracím dosaženým u dospělých, kterým byla podána jedna 5mg tableta CLARINEX. U jedinců ve věku 2 až 5 let vedla jedna dávka 2,5 ml perorálního roztoku CLARINEX obsahující 1,25 mg desloratadinu k plazmatickým koncentracím desloratadinu podobným koncentracím dosaženým u dospělých, kterým byla podána jedna 5mg tableta CLARINEX. Cmax a AUC metabolitu (3-hydroxydesloratadinu) však byly 1,27 a 1,61krát vyšší pro 5mg dávku perorálního roztoku podávanou dospělým ve srovnání s Cmax a AUC získanými u dětí ve věku 2 až 11 let, které dostávaly 1,25- 2,5 mg CLARINEX perorální roztok.
Jednotlivá dávka buď 2,5 ml nebo 1,25 ml CLARINEX 5 mg perorálního roztoku obsahujícího 1,25 mg nebo 0,625 mg desloratadinu, v daném pořadí, byla podána subjektům ve věku 6 až 11 měsíců a ve věku 12 až 23 měsíců. Výsledky populační farmakokinetické analýzy ukázaly, že dávka 1 mg pro subjekty ve věku 6 až 11 měsíců a 1,25 mg pro subjekty ve věku 12 až 23 měsíců je nutná k dosažení plazmatických koncentrací desloratadinu podobných těm, kterých je dosaženo u dospělých po podání jedné mg dávky perorálního roztoku CLARINEX.
Tableta CLARINEX 5 mg RediTabs 2,5 mg nebyla u pediatrických pacientů hodnocena. U dospělých byla stanovena bioekvivalence přípravku CLARINEX 5 mg RediTabs Tablet a původního přípravku CLARINEX 5 mg RediTabs Tablets. Ve spojení s popsanými studiemi zaměřenými na stanovení dávky v pediatrii farmakokinetické údaje pro CLARINEX 5 mg RediTabs tablety podporují použití síly dávky 2,5 mg u pediatrických pacientů ve věku 6 až 11 let.
Renally Impaired
Farmakokinetika desloratadinu po jednorázové dávce 7,5 mg byla charakterizována u pacientů s mírnou (n=7; clearance kreatininu 51-69 ml/min/1,73 m²), střední (n=6; clearance kreatininu 34-43 ml/min/1,73 m² ) a závažným (n=6; clearance kreatininu 5-29 ml/min/1,73 m²) poruchou funkce ledvin nebo pacienty závislými na hemodialýze (n=6). U pacientů s mírnou a středně těžkou poruchou funkce ledvin se střední hodnoty Cmax a AUC zvýšily přibližně 1,2krát a 1,9krát, v tomto pořadí, ve srovnání s jedinci s normální funkcí ledvin. U pacientů s těžkou poruchou funkce ledvin nebo u pacientů závislých na hemodialýze se hodnoty Cmax a AUC zvýšily přibližně 1,7krát a 2,5krát. Byly pozorovány minimální změny v koncentracích 3-hydroxydesloratadinu. Desloratadin a 3-hydroxydesloratadin byly špatně odstraněny hemodialýzou. Vazba desloratadinu a 3-hydroxydesloratadinu na plazmatické proteiny se poruchou funkce ledvin nezměnila. U pacientů s poruchou funkce ledvin se doporučuje úprava dávkování [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Jaterně postižený
Farmakokinetika desloratadinu byla charakterizována po jednorázové perorální dávce u pacientů s mírnou (n=4), středně těžkou (n=4) a těžkou (n=4) poruchou funkce jater definovanou Child-Pughovou klasifikací jaterních funkcí a 8 jedinců s normální funkce jater. Pacienti s poruchou funkce jater, bez ohledu na závažnost, měli přibližně 2,4násobné zvýšení AUC ve srovnání s normálními subjekty. Zjevná perorální clearance desloratadinu u pacientů s mírnou, středně těžkou a těžkou poruchou funkce jater byla 37 %, 36 % a 28 % ve srovnání s normálními subjekty. U pacientů s poruchou funkce jater bylo pozorováno prodloužení průměrného poločasu eliminace desloratadinu. U 3-hydroxydesloratadinu se průměrné hodnoty Cmax a AUC u pacientů s poruchou funkce jater statisticky významně nelišily od jedinců s normální funkcí jater. U pacientů s poruchou funkce jater se doporučuje úprava dávkování [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Rod
Ženy léčené po dobu 14 dnů přípravkem CLARINEX 5 mg tablety měly o 10 % a 3 % vyšší hodnoty Cmax a AUC desloratadinu ve srovnání s muži. Hodnoty Cmax a AUC 3-hydroxydesloratadinu byly také zvýšeny o 45 % a 48 % u žen ve srovnání s muži. Tyto zjevné rozdíly však pravděpodobně nebudou klinicky relevantní, a proto se nedoporučuje žádná úprava dávkování.
Závod
Po 14 dnech léčby tabletami CLARINEX byly hodnoty Cmax a AUC desloratadinu o 18 % a 32 % vyšší u černochů ve srovnání s bělochy. U 3-hydroxydesloratadinu došlo k odpovídajícímu 10% snížení hodnot Cmax a AUC u černochů ve srovnání s bělochy. Tyto rozdíly pravděpodobně nebudou klinicky relevantní, a proto se nedoporučuje žádná úprava dávkování.
Lékové interakce
Ve dvou kontrolovaných zkřížených klinických farmakologických studiích u zdravých dobrovolníků mužů (n=12 v každé studii) a žen (n=12 v každé studii) byl desloratadin 7,5 mg (1,5násobek denní dávky) jednou denně podáván společně s erythromycinem 500 mg každých 8 hodin nebo ketokonazol 200 mg každých 12 hodin po dobu 10 dnů. Ve třech samostatných kontrolovaných klinických farmakologických studiích s paralelními skupinami byl desloratadin v klinické dávce 5 mg podáván současně s azithromycinem 500 mg a následně 250 mg jednou denně po dobu 4 dnů (n=18) nebo s fluoxetinem 20 mg jednou denně po dobu 7 dnů po 23denním období před léčbou fluoxetinem (n=18) nebo cimetidinem 600 mg každých 12 hodin po dobu 14 dnů (n=18) za podmínek ustáleného stavu normálním zdravým dobrovolníkům mužů a žen. Přestože byly pozorovány zvýšené plazmatické koncentrace (Cmax a AUC0-24 hodin) desloratadinu a 3-hydroxydesloratadinu (viz tabulka 2), nebyly zjištěny žádné klinicky relevantní změny v bezpečnostním profilu desloratadinu, jak bylo hodnoceno elektrokardiografickými parametry (včetně korigovaného QT intervalu), klinické laboratorní testy, vitální funkce a nežádoucí účinky.
Studie toxikologie zvířat a/nebo farmakologie reprodukční toxikologie
Desloratadin nebyl teratogenní u potkanů v dávkách do 48 mg/kg/den (odhadované expozice desloratadinu a metabolitu desloratadinu byly přibližně 210krát vyšší než AUC u lidí při doporučené denní perorální dávce) nebo u králíků v dávkách do 60 mg/kg/ den (odhadované expozice desloratadinu byly přibližně 230krát vyšší než AUC u lidí při doporučené denní perorální dávce). V samostatné studii bylo u samic potkanů při dávce 24 mg/kg zaznamenáno zvýšení preimplantačních ztrát a snížený počet implantací a plodů (odhadované expozice desloratadinu a metabolitu desloratadinu byly přibližně 120krát vyšší než AUC u lidí při doporučeném denním perorálním podávání dávka). Snížená tělesná hmotnost a pomalý vzpřimovací reflex byly hlášeny u mláďat při dávkách 9 mg/kg/den nebo vyšších (odhadované expozice desloratadinu a metabolitu desloratadinu byly přibližně 50krát nebo vyšší než AUC u lidí při doporučené denní perorální dávce). Desloratadin neměl žádný vliv na vývoj mláďat při perorální dávce 3 mg/kg/den (odhadované expozice desloratadinu a metabolitu desloratadinu byly přibližně 7krát vyšší než AUC u lidí při doporučené denní perorální dávce).
Klinické studie
Sezónní alergická rýma
Klinická účinnost a bezpečnost tablet CLARINEX byla hodnocena u více než 2300 pacientů ve věku 12 až 75 let se sezónní alergickou rýmou. Celkem 1838 pacientů dostávalo 2,5 až 20 mg/den přípravku CLARINEX ve 4 dvojitě zaslepených, randomizovaných, placebem kontrolovaných klinických studiích trvajících 2 až 4 týdny provedených ve Spojených státech. Výsledky těchto studií prokázaly účinnost a bezpečnost přípravku CLARINEX 5 mg při léčbě dospělých a dospívajících pacientů se sezónní alergickou rýmou. Ve studii s rozmezím dávek byl studován přípravek CLARINEX 2,5 až 20 mg/den. Dávky 5, 7,5, 10 a 20 mg/den byly lepší než placebo; a žádný další přínos nebyl pozorován u dávek nad 5,0 mg. Ve stejné studii bylo pozorováno zvýšení výskytu somnolence při dávkách 10 mg/den a 20 mg/den (5,2 % a 7,6 %) ve srovnání s placebem (2,3 %).
Ve dvou 4týdenních studiích s 924 pacienty (ve věku 15 až 75 let) se sezónní alergickou rýmou a souběžným astmatem zlepšil přípravek CLARINEX 5 mg tablety 5 mg jednou denně příznaky rýmy, aniž by došlo ke snížení funkce plic. To podporuje bezpečnost podávání přípravku CLARINEX 5 mg tablety dospělým pacientům se sezónní alergickou rýmou s mírným až středně těžkým astmatem.
Tablety CLARINEX 5 mg jednou denně významně snížily celkové skóre příznaků (součet individuálních skóre nosních a mimonosních příznaků) u pacientů se sezónní alergickou rýmou. Viz tabulka 3.
Nebyly zjištěny žádné významné rozdíly v účinnosti přípravku CLARINEX 5 mg tablety 5 mg mezi podskupinami pacientů definovaných pohlavím, věkem nebo rasou.
Celoroční alergická rýma
Klinická účinnost a bezpečnost přípravku CLARINEX tablety 5 mg byla hodnocena u více než 1300 pacientů ve věku 12 až 80 let s celoroční alergickou rýmou. Celkem 685 pacientů dostávalo 5 mg/den přípravku CLARINEX 5 mg ve dvou dvojitě zaslepených, randomizovaných, placebem kontrolovaných klinických studiích trvajících 4 týdny, provedených ve Spojených státech a na mezinárodní úrovni. V jedné z těchto studií bylo prokázáno, že přípravek CLARINEX 5 mg tablety 5 mg jednou denně významně snižuje celkové skóre symptomů u pacientů s celoroční alergickou rýmou (tabulka 4).
Chronická idiopatická kopřivka
Účinnost a bezpečnost přípravku CLARINEX 5 mg tablety 5 mg jednou denně byla studována u 416 pacientů s chronickou idiopatickou kopřivkou ve věku 12 až 84 let, z nichž 211 dostávalo CLARINEX. Ve dvou dvojitě zaslepených, placebem kontrolovaných, randomizovaných klinických studiích trvajících šest týdnů, v předem stanoveném týdenním primárním vyhodnocení primárního časového bodu, CLARINEX tablety významně snížily závažnost svědění ve srovnání s placebem (tabulka 5). Byly také vyhodnoceny sekundární cílové parametry a během prvního týdne léčby CLARINEX 5 mg tablety 5 mg snížily sekundární cílové parametry, „Počet úlů“ a „Velikost největšího úlu“ ve srovnání s placebem.
Klinická bezpečnost přípravku CLARINEX perorální roztok byla dokumentována ve třech, 15denních, dvojitě zaslepených, placebem kontrolovaných studiích bezpečnosti u pediatrických subjektů s dokumentovanou anamnézou alergické rýmy, chronické idiopatické kopřivky nebo subjektů, kteří byli kandidáty antihistaminické léčby. V první studii bylo 2,5 mg perorálního roztoku CLARINEX podáno 60 pediatrickým subjektům ve věku 6 až 11 let. Druhá studie hodnotila 1,25 mg perorálního roztoku CLARINEX podávaného 55 pediatrickým subjektům ve věku 2 až 5 let. Ve třetí studii bylo 65 dětským pacientům ve věku 12 až 23 měsíců podáno 1,25 mg perorálního roztoku CLARINEX 5 mg a 66 pediatrickým subjektům ve věku 6 až 11 měsíců 1,0 mg perorálního roztoku CLARINEX. Výsledky těchto studií prokázaly bezpečnost přípravku CLARINEX 5 mg perorální roztok u pediatrických pacientů ve věku 6 měsíců až 11 let.
INFORMACE PRO PACIENTA
CLARINEX® (CLA-RI-NEX) (desloratadin) tablety, RediTabs® a perorální roztok
Přečtěte si informace pro pacienty, které jsou dodávány s CLARINEX®, než jej začnete užívat, a pokaždé, když dostanete náplň. Mohou se objevit nové informace. Tato příbalová informace je souhrnem informací pro pacienty. Další informace vám může poskytnout váš lékař nebo lékárník. Tato příbalová informace nenahrazuje rozhovor s lékařem o vašem zdravotním stavu nebo léčbě.
Co je CLARINEX 5 mg?
CLARINEX je léčivý přípravek na předpis, který obsahuje léčivou látku desloratadin (antihistaminikum).
CLAINEX se používá k pomoci kontrolovat příznaky:
- sezónní alergická rýma (kýchání, ucpaný nos, rýma a svědění nosu) u osob ve věku 2 let a starších.
- celoroční alergická rýma (kýchání, ucpaný nos, rýma a svědění nosu) u osob ve věku 6 měsíců a starších.
- chronická idiopatická kopřivka (dlouhodobé svědění) a ke snížení počtu a velikosti kopřivky u lidí ve věku 6 měsíců a starších.
CLARINEX není určen pro děti mladší 6 měsíců.
Kdo by neměl užívat CLARINEX?
Neužívejte přípravek Clarinex 5 mg, jestliže:
- jste alergičtí na desloratadin nebo na kteroukoli složku přípravku CLARINEX tablety, CLARINEX RediTabs® nebo perorální roztok CLARINEX. Kompletní seznam složek naleznete na konci tohoto letáku.
- jsou alergičtí na loratadin (Alavert, Claritin).
Před užitím tohoto léku se poraďte se svým lékařem, pokud máte nějaké otázky, zda tento lék užívat či nikoli.
Co mám říci svému lékaři, než začnu užívat CLARINEX 5 mg?
Před užitím přípravku CLAINEX 5 mg informujte svého lékaře, pokud:
- máte problémy s játry nebo ledvinami.
- mít jiné zdravotní potíže.
- jste těhotná nebo plánujete otěhotnět. Není známo, zda CLARINEX 5 mg poškodí vaše nenarozené dítě. Poraďte se se svým lékařem, pokud jste těhotná nebo plánujete otěhotnět.
- kojíte nebo plánujete kojit. CLAINEX 5 mg může přecházet do mateřského mléka. Pokud užíváte CLARINEX, poraďte se se svým lékařem o nejlepším způsobu krmení dítěte.
Informujte svého lékaře o všech lécích, které užíváte, včetně léků na předpis i bez předpisu, vitamínů a bylinných doplňků. CLARINEX 5 mg může ovlivnit účinek jiných léků a jiné léky mohou ovlivnit účinek přípravku CLARINEX 5 mg. Zejména informujte svého lékaře, pokud užíváte:
- ketokonazol (Nizoral)
- erythromycin (Ery-tab, Eryc, PCE)
- azithromycin (Zithromax, Zmax)
- antihistaminika
- fluoxetin (Prozac)
- cimetidin (Tagamet)
Znát léky, které užíváte. Uchovávejte si seznam svých léků a ukažte jej svému lékaři a lékárníkovi, když dostanete nový lék.
Jak mám užívat CLARINEX?
- Užívejte CLARINEX 5 mg přesně podle pokynů svého lékaře.
- Neměňte dávku přípravku CLARINEX 5 mg ani jej neužívejte častěji, než je předepsáno.
- CLARINEX 5 mg lze užívat s jídlem nebo bez jídla.
- Umístěte tabletu CLARINEX RediTabs na jazyk a před spolknutím ji nechte rozpustit. CLARINEX 5 mg RediTabs lze užívat s vodou nebo bez vody. Užijte tabletu CLARINEX 5 mg RediTabs ihned po otevření blistru.
- Užívejte CLARINEX perorální roztok pomocí odměrného kapátka nebo perorální stříkačky, která může odměřit 2 ml nebo 2,5 ml. Požádejte svého lékárníka o kapátko nebo injekční stříkačku, pokud je nemáte.
- Jestliže jste užil(a) příliš mnoho přípravku CLARINEX, zavolejte svého lékaře nebo okamžitě vyhledejte lékařskou pomoc.
Jaké jsou možné vedlejší účinky přípravku CLARINEX Tablets?
CLARINEX 5 mg může způsobit závažné nežádoucí účinky, včetně:
- Alergické reakce. Přestaňte užívat CLARINEX 5 mg a ihned zavolejte svého lékaře nebo vyhledejte pohotovostní pomoc, pokud máte některý z těchto příznaků:
- vyrážka
- svědění
- kopřivka
- otok vašich rtů, jazyka, obličeje a hrdla
- dušnost nebo potíže s dýcháním
Mezi nejčastější nežádoucí účinky přípravku CLARINEX u dospělých a dětí ve věku 12 let a starších s alergickou rýmou patří:
- bolest krku
- suchá ústa
- bolest svalů
- únava
- ospalost
- menstruační bolesti
Pokud užijete více přípravku CLARINEX, než Vám předepsal lékař, může se objevit zvýšená ospalost nebo únava.
Informujte svého lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku CLARINEX. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám uchovávat CLARINEX 5 mg?
- Ukládat Tablety CLAINEX mezi 59 °F až 86 °F (15 °C až 30 °C).
- Tablety CLAINEX jsou citlivé na teplo. Neuchovávejte při teplotě nad 86°F (30°C).
- Chránit CLARINEX 5 mg tablety od vlhkosti.
- Ukládat CLARINEX 5 mg perorální roztok mezi 59 °F až 86 °F (15 °C až 30 °C). Chraňte CLARINEX 5 mg perorální roztok před světlem.
Držet Tablety CLARINEX, tablety RediTabs , a Orální roztok a všechny léky mimo dosah dětí.
Obecné informace o CLARINEX
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v příbalové informaci pro pacienty. Nepoužívejte CLARINEX 5 mg na stav, pro který nebyl předepsán. Nedávejte CLARINEX 5 mg jiným lidem, i když mají stejný stav jako vy. Může jim to ublížit.
Tento leták s informacemi pro pacienty shrnuje nejdůležitější informace o přípravku CLARINEX. Pokud chcete více informací, promluvte si se svým lékařem. Můžete požádat svého lékárníka nebo lékaře o informace o přípravku CLARINEX, který je určen pro zdravotníky.
Pro více informací přejděte na www.CLARINEX.com
Jaké jsou složky přípravku CLARINEX 5 mg?
Aktivní složka: desloratadin
Pacienti s fenylketonurií: Tablety CLARINEX RediTabs obsahují fenylalanin.
Neaktivní složky v CLARINEX 5 mg tablety: dihydrát hydrogenfosforečnanu vápenatého USP, mikrokrystalická celulóza NF, kukuřičný škrob NF, mastek USP, karnaubský vosk NF, bílý vosk NF, potahový materiál skládající se z monohydrátu laktózy, hypromelózy, oxidu titaničitého, polyethylenglykolu a Aluminium Lake FD&C Blue #2.
Neaktivní složky v CLARINEX 5 mg perorální roztok: propylenglykol USP, roztok sorbitolu USP, kyselina citronová (bezvodá) USP, dihydrát citrátu sodného USP, benzoát sodný NF, edetát disodný USP, čištěná voda USP. Dále obsahuje krystalový cukr, přírodní a umělé aroma do žvýkaček a barvivo FDC Yellow #6.
