Rhinocort 100mcg Budesonide Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Rhinocort Aqua a jak se používá?
Rhinocort Aqua (budesonid) nosní sprej je steroid používaný k léčbě nosních příznaků, jako je kongesce, kýchání a rýma způsobená sezónními nebo celoročními alergiemi. Nosní sprej Rhinocort Aqua se také používá k tomu, aby se nosní polypy po chirurgickém odstranění nevrátily.
Jaké jsou vedlejší účinky Rhinocort 100mcg Aqua?
Mezi běžné vedlejší účinky nosního spreje Rhinocort Aqua patří:
- suchost nebo podráždění nosu/krku,
- bolest krku,
- kašel,
- kýchání,
- krvácení z nosu,
- nepříjemná chuť/zápach,
- boláky nebo bílé skvrny uvnitř nebo kolem nosu, nebo
- bolest, otok, pálení, svědění nebo podráždění kolem nosu.
Informujte svého lékaře, pokud máte vzácné, ale závažné nežádoucí účinky nosního spreje Rhinocort Aqua, včetně:
- ztráta chuti nebo čichu, popř
- bolest nebo vředy v nose.
POPIS
Budesonid, aktivní složka RHINOCORT AQUA (budesonid) nosního spreje, je protizánětlivý syntetický kortikosteroid.
Chemicky se označuje jako (RS)-11-beta,16-alfa,17,21-tetrahydroxypregna-l,4-dien-3,20-dion cyklický 16,17-acetal s butyraldehydem.
Budesonid je poskytován jako směs dvou epimerů (22R a 22S).
Empirický vzorec budesonidu je C25H34O6 a jeho molekulová hmotnost je 430,5.
Jeho strukturní vzorec je:
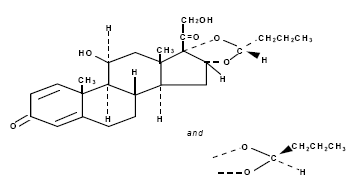
Budesonid je bílý až téměř bílý prášek bez zápachu, který je prakticky nerozpustný ve vodě a v heptanu, těžce rozpustný v ethanolu a snadno rozpustný v chloroformu.
Jeho rozdělovací koeficient mezi oktanol a vodu při pH 5 je 1,6 x 103.
RHINOCORT AQUA (budesonid) nosní sprej je neparfemovaný sprejový přípravek s manuální pumpou s odměřenou dávkou obsahující mikronizovanou suspenzi budesonidu ve vodném médiu. V tomto médiu jsou obsaženy mikrokrystalická celulóza a sodná sůl karboxymethylcelulózy, bezvodá dextróza, polysorbát 80, edetát disodný, sorbát draselný a čištěná voda; pro úpravu pH na cílovou hodnotu 4,5 se přidá kyselina chlorovodíková.
RHINOCORT 100 mcg AQUA nosní sprej dodává 32 mcg budesonidu na jeden vstřik.
Každá lahvička nosního spreje RHINOCORT 100 mcg AQUA (budesonid) 32 mcg obsahuje 120 odměřených vstřiků po prvním prostříknutí.
Před prvním použitím je třeba nádobou jemně zatřepat a pumpu naplnit osminásobným stisknutím. Při každodenním používání není nutné čerpadlo znovu naplňovat. Pokud se dva po sobě jdoucí dny nepoužívá, znovu nastříkejte jedním střikem nebo dokud se neobjeví jemný sprej. Pokud se nepoužívá déle než 14 dní, opláchněte aplikátor a znovu nastříkejte dvěma střiky nebo dokud se neobjeví jemný sprej.
INDIKACE
Léčba sezónní nebo celoroční alergické rýmy
RHINOCORT AQUA (budesonid) nosní sprej je indikován k léčbě nosních příznaků sezónní nebo celoroční alergické rýmy u dospělých a dětí ve věku od šesti let.
DÁVKOVÁNÍ A PODÁVÁNÍ
Doporučená počáteční dávka pro dospělé a děti ve věku 6 let a starší je 64 mcg denně podávaných jako jeden sprej na nosní dírku RHINOCORT AQUA (budesonid) nosní sprej 32 mcg jednou denně. Někteří pacienti, kteří nedosáhnou kontroly symptomů při doporučené počáteční dávce, mohou mít prospěch ze zvýšené dávky. Maximální doporučená dávka pro dospělé (12 let a starší) je 256 mcg denně podávaných jako čtyři vstřiky do nosní dírky jednou denně nosního spreje RHINOCORT AQUA (budesonid) 32 mcg a maximální doporučená dávka pro pediatrické pacienty (6 až
Vždy je žádoucí titrovat jednotlivého pacienta na minimální účinnou dávku, aby se snížila možnost vedlejších účinků. Zlepšení nosních příznaků lze u pacientů zaznamenat do 10 hodin od prvního použití nosního spreje RHINOCORT 100 mcg AQUA (budesonid), klinické zlepšení však obvykle trvá 1–2 dny s maximálním přínosem přibližně za 2 týdny. Když bylo dosaženo maximálního přínosu a symptomy byly pod kontrolou, snížení dávky může být účinné pro udržení kontroly symptomů alergické rinitidy u pacientů, kteří byli zpočátku kontrolováni vyššími dávkami.
Před prvním použitím je třeba nádobou jemně zatřepat a pumpu naplnit osminásobným stisknutím. Při každodenním používání není nutné čerpadlo znovu naplňovat. Pokud se dva po sobě jdoucí dny nepoužívá, znovu nastříkejte jedním střikem nebo dokud se neobjeví jemný sprej. Pokud se nepoužívá déle než 14 dní, opláchněte aplikátor a znovu nastříkejte dvěma střiky nebo dokud se neobjeví jemný sprej. Před každým použitím nádobu jemně protřepejte.
Ilustrovaný Návod k použití pro pacienta doprovázet každé balení nosního spreje RHINOCORT AQUA (budesonid) 32 mcg.
JAK DODÁVÁNO
Dávkové formy a síly
RHINOCORT AQUA (budesonid) nosní sprej je nosní sprejová suspenze. Každý střik dodá 32 mcg budesonidu. Každá lahvička nosního spreje RHINOCORT 100 mcg AQUA (budesonid) 32 mcg obsahuje 120 odměřených vstřiků po prvním prostříknutí.
RHINOCORT 100 mcg AQUA (budesonid) nosní sprej 32 mcg je k dispozici v lahvičce z jantarového skla s dávkovací pumpičkou ve spreji a zeleným ochranným uzávěrem. RHINOCORT 100 mcg AQUA (budesonid) nosní sprej 32 mcg ( NDC 0186-1070-08) poskytuje 120 dávkovaných postřiků po počátečním naplnění; čistá hmotnost náplně 8,6 g. Lahvička nosního spreje RHINOCORT 100 mcg AQUA (budesonid) 32 mcg byla naplněna přebytkem, aby se přizpůsobila aktivaci. Lahvička by měla být zlikvidována po 120 nástřikech po prvním nastříknutí, protože množství budesonidu dodané na nástřik poté může být podstatně menší než dávka na etiketě. Každý sprej dodá pacientovi 32 mcg budesonidu.
RHINOCORT 100 mcg AQUA (budesonid) nosní sprej by měl být skladován při kontrolované pokojové teplotě, 20 až 25 °C (68 až 77 °F) s ventilem nahoře. Chraňte před mrazem. Chraňte před světlem. Před použitím jemně protřepejte. Nestříkejte do očí.
Distribuce: AstraZeneca LP, Wilmington, DE 19850. Revize: 12/2010
VEDLEJŠÍ EFEKTY
Systémové a intranazální užívání kortikosteroidů může mít za následek následující:
- Epistaxe, infekce Candida albicans, perforace nosní přepážky a zhoršené hojení ran [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Hypersenzitivita včetně anafylaxe [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Imunosuprese [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Hyperkorticismus a suprese nadledvin [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Růstový efekt [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití ve specifických populacích ].
- Glaukom a šedý zákal [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Výskyt běžných nežádoucích účinků v tabulce 1 je založen na dvou kontrolovaných klinických studiích v USA a pěti mimo USA u 1 526 pacientů se sezónní nebo celoroční rýmou u dospělých a dětí ≥ 6 let léčených nosním sprejem RHINOCORT AQUA (budesonid) v dávkách až 400 mcg jednou denně po dobu 3-6 týdnů. Tato populace zahrnovala 745 žen a 781 mužů s průměrným věkem 31 let (rozmezí 6-85 let, 349 bylo 6
Podobný profil nežádoucích účinků byl pozorován v podskupině pediatrických pacientů ve věku 6 až 12 let. Tito pacienti jsou uvedeni v tabulce 1.
Dvě až tři procenta (2-3 %) pacientů v klinických studiích ukončila léčbu kvůli nežádoucím účinkům. Během kontrolovaných klinických studií s nosním sprejem RHINOCORT AQUA (budesonid) nebyly hlášeny systémové nežádoucí účinky kortikosteroidů.
Pokud jsou překročeny doporučené dávky nebo pokud jsou jednotlivci zvláště citliví, mohou se objevit příznaky hyperkorticismu, tj. Gushingův syndrom, a suprese nadledvin.
Post-marketingové zkušenosti
Následující nežádoucí účinky byly hlášeny během poregistračního použití nosního spreje RHINOCORT AQUA (budesonid). Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Poruchy imunitního systému: okamžité a opožděné hypersenzitivní reakce (včetně anafylaktické reakce, kopřivky, vyrážky, dermatitidy, angioedému a pruritu), [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KONTRAINDIKACE ]
Oční poruchy: glaukom, zvýšený nitrooční tlak, šedý zákal [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Respirační, hrudní a mediastinální poruchy: perforace nosní přepážky, anosmie, poruchy hltanu (podráždění krku, bolest v krku, oteklé hrdlo, pálení v krku a svědění v krku) a sípání
Srdeční poruchy: bušení srdce
Poruchy svalové a kosterní soustavy a pojivové tkáně: potlačení růstu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ]
DROGOVÉ INTERAKCE
Inhibitory cytochromu P450 3A4
Hlavní cestou metabolismu kortikosteroidů, včetně budesonidu, je izoenzym 3A4 (CYP3A4) cytochromu P450 (CYP). Po perorálním podání ketokonazolu, silného inhibitoru CYP3A4, se průměrná plazmatická koncentrace perorálně podaného budesonidu zvýšila. Současné podávání CYP3A4 může inhibovat metabolismus budesonidu a zvýšit systémovou expozici budesonidu. Při zvažování současného podávání nosního spreje RHINOCORT AQUA (budesonid) s dlouhodobým ketokonazolem a jinými známými silnými inhibitory CYP3A4 (např. ritonavir, atazanavir klarithromycin, indinavir itrakonazol, nefazodon nelfinavir-sachinavir, telithromycin) je třeba opatrnosti. VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Místní nosní účinky
Epistaxe
V klinických studiích trvajících 3 až 52 týdnů byla epistaxe pozorována častěji u pacientů léčených nosním sprejem RHINOCORT 100 mcg AQUA (budesonid) než u pacientů, kteří dostávali placebo (viz NEŽÁDOUCÍ REAKCE ].
Candida infekce
klinických studiích s budesonidem podávaným intranazálně došlo k rozvoji lokalizovaných infekcí nosu a hltanu způsobených Candida albicans. Když se taková infekce rozvine, může vyžadovat léčbu vhodnou lokální nebo systémovou terapií a přerušení léčby nosním sprejem RHINOCORT AQUA (budesonid). Pacienti, kteří používají nosní sprej RHINOCORT AQUA (budesonid) po dobu několika měsíců nebo déle, by měli být pravidelně vyšetřováni na přítomnost infekce Candida nebo jiných známek nežádoucích účinků na nosní sliznici.
Perforace nosní přepážky
Po intranazální aplikaci kortikosteroidů, včetně budesonidu, byly hlášeny případy perforace nosní přepážky (viz NEŽÁDOUCÍ REAKCE ].
Zhoršené hojení ran
Vzhledem k inhibičnímu účinku kortikosteroidů na hojení ran by pacienti, kteří nedávno prodělali vředy na nosní přepážce, nosní operaci nebo nosní trauma, neměli používat nosní kortikosteroidy, dokud nedojde k zahojení.
Hypersenzitivní reakce včetně anafylaxe
Mohou se objevit hypersenzitivní reakce včetně anafylaktické reakce, kopřivky, vyrážky, dermatitidy, angioedému a pruritu (viz KONTRAINDIKACE a NEŽÁDOUCÍ REAKCE, zkušenosti po uvedení na trh ].
Imunosuprese
Pacienti, kteří užívají léky, které potlačují imunitní systém, jsou náchylnější k infekcím než zdraví jedinci. Například plané neštovice a spalničky mohou mít u vnímavých dětí nebo dospělých užívajících kortikosteroidy závažnější nebo dokonce smrtelný průběh. U takových dětí nebo dospělých, kteří neměli tato onemocnění nebo nebyli řádně imunizováni, je třeba věnovat zvláštní pozornost tomu, aby se zabránilo expozici. Není známo, jak dávka, cesta a délka podávání kortikosteroidů ovlivňují riziko rozvoje diseminované infekce. Není také znám podíl základního onemocnění a/nebo předchozí léčby kortikosteroidy na riziku. Při expozici planým neštovicím může být indikována léčba imunoglobulinem proti varicella zoster (VZIG) nebo kombinovaným intravenózním imunoglobulinem (WIG). Při expozici spalničkám může být indikována profylaxe sdruženým intramuskulárním imunoglobulinem (IG). (Vidět příslušné příbalové informace pro kompletní informace o předepisování VZIG a IG ). Pokud se objeví plané neštovice, lze zvážit léčbu antivirotiky.
Klinický průběh infekce planými neštovicemi nebo spalničkami u pacientů užívajících intranazální nebo inhalační kortikosteroidy nebyl studován. Přestože nejsou k dispozici žádné údaje o intranazálních kortikosteroidech, klinická studie zkoumala imunitní odpověď na vakcínu proti planým neštovicím u pacientů s astmatem ve věku 12 měsíců až 8 let, kteří byli léčeni inhalační suspenzí budesonidu.
Otevřená, nerandomizovaná klinická studie zkoumala imunitní odpověď na vakcínu proti planým neštovicím u 243 pacientů s astmatem ve věku 12 měsíců až 8 let, kteří byli léčeni inhalační suspenzí budesonidu v dávce 0,25 mg až 1 mg denně (n=151) nebo nekortikosteroidní léčbou astmatu (n=92) (tj. betai-agonisté, antagonisté leukotrienového receptoru nebo kromony). Procento pacientů, u kterých se vyvinul titr séroprotektivních protilátek ≥ 5,0 (hodnota gpELISA) v reakci na očkování, bylo podobné u pacientů léčených inhalační suspenzí budesonidu (85 %) ve srovnání s pacienty léčenými nekortikosteroidní léčbou astmatu (90 %). U žádného pacienta léčeného inhalační suspenzí budesonidu se v důsledku očkování nerozvinuly plané neštovice.
Kortikosteroidy by měly být používány s opatrností, pokud vůbec, u pacientů s aktivní nebo klidovou infekcí tuberkulózy, neléčenými plísňovými, bakteriálními, systémovými virovými nebo parazitárními infekcemi; nebo oční herpes simplex.
Účinky na osu hypotalamus-hypofýza-nadledviny
Hyperkorticismus a suprese nadledvin: Pokud jsou intranazální steroidy použity ve vyšších než doporučených dávkách nebo u citlivých jedinců v doporučených dávkách, mohou se objevit systémové kortikosteroidní účinky, jako je hyperkorticismus a suprese nadledvin. Pokud k takovým změnám dojde, dávkování RHINOCORT 100 mcg AQUA (budesonid) nosní sprej by mělo být pomalu vysazeno v souladu s přijatými postupy pro ukončení léčby perorálními kortikosteroidy.
Nahrazení systémového kortikosteroidu lokálním kortikosteroidem může být doprovázeno známkami adrenální insuficience a navíc se u některých pacientů mohou objevit příznaky vysazení kortikosteroidů, např. bolesti kloubů a/nebo svalů, únava, slabost, nauzea, zvracení, hypotenze, malátnost a deprese. Pacienti, kteří byli dříve dlouhodobě léčeni systémovými kortikosteroidy, by měli být při přechodu na topické kortikosteroidy pomalu vysazováni a měli by být pečlivě sledováni pro akutní adrenální insuficienci v reakci na stres. U těch pacientů, kteří mají astma nebo jiné klinické stavy vyžadující dlouhodobou systémovou léčbu kortikosteroidy, může příliš rychlý pokles systémových kortikosteroidů způsobit závažnou exacerbaci jejich symptomů.
Interakce se silnými inhibitory cytochromu P450 3A4
Při zvažování současného podávání nosního spreje RHINOCORT AQUA s ketokonazolem a jinými známými silnými inhibitory CYP3A4 (např. ritonavir, atazanavir, klarithromycin, indinavir, itrakonazol, nefazodon, nelfinavir, saquinavir, telithromycin) je třeba opatrnosti, protože nežádoucí účinky související s toritromycinem může dojít k systémové expozici budesonidu [viz DROGOVÉ INTERAKCE, KLINICKÁ FARMAKOLOGIE ].
Vliv na růst
Intranazální kortikosteroidy, včetně budesonidu, mohou při podávání pediatrickým pacientům způsobit snížení rychlosti růstu. Pravidelně sledujte růst dětských pacientů, kteří jsou dlouhodobě léčeni nosním sprejem RHINOCORT 100 mcg AQUA (budesonid). Chcete-li minimalizovat systémové účinky intranazálních kortikosteroidů, včetně nosního spreje RHINOCORT AQUA (budesonid), titrujte dávku každého pacienta na nejnižší dávku, která účinně kontroluje jeho příznaky [viz Použití u specifických populací, pediatrické použití ].
Glaukom a katarakta
Po intranazální aplikaci kortikosteroidů včetně budesonidu byly hlášeny glaukom, zvýšený nitrooční tlak a katarakta. Proto je u pacientů se změnou vidění nebo s anamnézou zvýšeného nitroočního tlaku, glaukomu a/nebo šedého zákalu nutné pečlivé sledování (viz NEŽÁDOUCÍ REAKCE ].
Informace pro pacienty
[Vidět Označení pacientů schválené FDA ]
Pacienti léčení nosním sprejem RHINOCORT 100 mcg AQUA (budesonid) by měli obdržet následující informace a pokyny. Tyto informace mají pacientovi pomoci při bezpečném a účinném užívání léku. Nejedná se o odhalení všech možných nepříznivých nebo zamýšlených účinků. Pro správné použití nosního spreje RHINOCORT 100 mcg AQUA (budesonid) a pro dosažení maximálního zlepšení by si pacient měl přečíst a dodržovat přiložené označení pacienta schválené FDA.
Místní nosní účinky
Pacienty je třeba upozornit, že u některých pacientů se v nose a hltanu objevila epistaxe a lokalizované infekce Candida albicans. Pokud se rozvine kandidóza, je třeba ji léčit vhodnou lokální nebo systémovou terapií a přerušit léčbu nosním sprejem RHINOCORT 100mcg AQUA (budesonid). Kromě toho jsou nosní kortikosteroidy spojeny s perforací nosní přepážky a zhoršeným hojením ran. Pacienti, kteří nedávno prodělali nosní vředy, operaci nosu nebo nosní trauma, by neměli používat nosní sprej RHINOCORT AQUA (budesonid), dokud nedojde k hojení (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Hypersenzitivita včetně anafylaxe
Pacienti by měli být informováni, že při použití nosního spreje RHINOCORT AQUA (budesonid) byly hlášeny hypersenzitivní reakce včetně anafylaktické reakce, kopřivky, vyrážky, dermatitidy, angioedému a svědění. Přestat
RHINOCORT AQUA (budesonid) nosní sprej, pokud se takové reakce objeví [viz KONTRAINDIKACE, VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a NEŽÁDOUCÍ REAKCE ].
Imunosuprese
Pacienti, kteří jsou na imunosupresivních dávkách kortikosteroidů, by měli být varováni, aby se vyvarovali kontaktu s planými neštovicemi nebo spalničkami, a pokud jsou vystaveni, měli by se neprodleně poradit se svým lékařem. Pacienti by měli být informováni o možném zhoršení stávající tuberkulózy, plísňových, bakteriálních, virových nebo parazitárních infekcí nebo očního herpes simplex (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Snížená rychlost růstu
Pacienti by měli být upozorněni, že intranazální kortikosteroidy, včetně budesonidu, mohou způsobit snížení rychlosti růstu při podávání pediatrickým pacientům. Lékaři by měli pozorně sledovat růst dětí a dospívajících užívajících kortikosteroidy jakoukoli cestou [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Glaukom a katarakta
Pacienti by měli být upozorněni, že dlouhodobé užívání intranazálních kortikosteroidů, včetně budesonidu, může zvýšit riziko některých očních problémů (katarakta a glaukom). Pacienti by měli informovat svého poskytovatele zdravotní péče, pokud je při používání nosního spreje RHINOCORT AQUA (budesonid) zaznamenána změna vidění [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Používejte denně
Pacienti by měli používat nosní sprej RHINOCORT 100 mcg AQUA (budesonid) v pravidelných intervalech, protože jeho účinnost závisí na jeho pravidelném užívání. Pacienti mohou zaznamenat zlepšení nosních příznaků do 10 hodin od prvního použití nosního spreje RHINOCORT AQUA (budesonid). Maximálního přínosu může být dosaženo až přibližně 2 týdny po zahájení léčby [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Pacienti by měli užívat léky podle pokynů a neměli by překročit předepsané dávkování. Pacient by měl kontaktovat lékaře, pokud se příznaky po dvou týdnech nezlepší nebo pokud se stav zhorší. Pacienti, u kterých se při užívání tohoto léku opakují epizody epistaxe (krvácení z nosu) nebo nepohodlí v nosní přepážce, by měli kontaktovat svého lékaře. Pro správné použití nosního spreje RHINOCORT AQUA (budesonid) a pro dosažení maximálního zlepšení by si pacient měl pečlivě přečíst a dodržovat přiložené informace pro pacienta. Nepoužívejte RHINOCORT 100 mcg AQUA (budesonid) nosní sprej po použití uvedeného počtu vstřiků (nezahrnuje základní nátěr) nebo po uplynutí doby použitelnosti uvedené na krabičce nebo štítku lahvičky.
Jak používat RHINOCORT 100mcg AQUA (budesonid) nosní sprej
Pacienti by měli být pečlivě poučeni o použití tohoto léku, aby bylo zajištěno optimální podání dávky [viz INFORMACE PRO PACIENTA ].
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Ve 104týdenní perorální studii na potkanech Sprague-Dawley bylo pozorováno statisticky významné zvýšení výskytu gliomů u samců potkanů, kteří dostávali perorální dávku budesonidu 50 mcg/kg/den (přibližně dvojnásobek maximální doporučené denní intranazální dávky dospělí a děti na základě mcg/m2). U samců potkanů při perorálních dávkách do 25 mcg/kg (přibližně se rovná maximální doporučené denní intranazální dávce u dospělých a dětí na základě mcg/m2 a u samic potkanů při perorálních dávkách do 50 mcg/kg nebyla pozorována žádná tumorigenicita přibližně dvojnásobek maximální doporučené denní intranazální dávky u dospělých a dětí na základě mcg/m2). Ve dvou dalších dvouletých studiích u samců potkanů Fischer a Sprague-Dawley nezpůsobil budesonid žádné gliomy při perorální dávce 50 mcg/kg (přibližně dvojnásobek maximální doporučené denní intranazální dávky u dospělých a dětí na základě mcg/m2). U samců potkanů Sprague-Dawley však budesonid způsobil statisticky významný nárůst výskytu hepatocelulárních nádorů při perorální dávce 50 mcg/kg (přibližně dvojnásobek maximální doporučené denní intranazální dávky u dospělých a dětí na základě mcg/m2 ). Souběžné referenční kortikosteroidy (prednisolon a triamcinolon acetonid) v těchto dvou studiích vykazovaly podobné nálezy.
Při perorálním podávání budesonidu myším po dobu 91 týdnů v dávkách až 200 mcg/kg/den (přibližně 3násobek maximální doporučené denní intranazální dávky u dospělých a dětí na základě mcg/m2) nebyl prokázán žádný karcinogenní účinek. .
Budesonid nebyl mutagenní ani klastogenní v šesti různých testovacích systémech: Ames Salmonella/mikrozomový destičkový test, myší mikronukleový test, myší lymfomový test, test chromozomových aberací v lidských lymfocytech, pohlavně vázaný recesivní letální test u Drosophila melanogaster a analýza opravy DNA u potkana kultury hepatocytů.
U potkanů neměl budesonid žádný vliv na fertilitu při subkutánních dávkách až do 80 mcg/kg (přibližně 3násobek maximální doporučené denní intranazální dávky u dospělých na základě mcg/m2).
Při subkutánní dávce 20 mcg/kg/den (méně než maximální doporučená denní intranazální dávka u dospělých na základě mcg/m2) se snižuje přírůstek tělesné hmotnosti matky, prenatální životaschopnost a životaschopnost mláďat při narození a během laktace byly pozorovány. Žádné takové účinky nebyly zaznamenány při 5 mcg/kg (méně než maximální doporučená denní intranazální dávka u dospělých na základě mcg/m2).
Použití u konkrétních populací
Těhotenství
Teratogenní účinky: Těhotenství Kategorie B. Vliv budesonidu na výsledky těhotenství u člověka byl hodnocen prostřednictvím hodnocení registrů narození spojených s užíváním inhalačního budesonidu (tj. PULMICORT TURBUHALER) a intranazálně podávaného budesonidu (tj. RHINOCORT 100 mcg AQUA (budesonid) nosní sprej) u matek. Výsledky z populačních prospektivních kohortových epidemiologických studií, které přezkoumávají údaje ze tří švédských registrů pokrývajících přibližně 99 % těhotenství v letech 1995-2001 (tj. Švédský lékařský registr narození; Registr vrozených malformací; Registr dětských kardiologických vad) nenaznačují žádné zvýšené riziko celkového vrozené malformace z použití inhalačního nebo intranazálního budesonidu během časného těhotenství.
Vrozené malformace byly studovány u 2 014 kojenců narozených matkám, které uváděly užívání inhalačního budesonidu k léčbě astmatu v časném těhotenství (obvykle 10–12 týdnů po poslední menstruaci), což je období, kdy dochází k většině hlavních orgánových malformací.1 Míra celkových vrozených malformací byla podobná ve srovnání s běžnou populací (3,8 % vs. 3,5 %). Počet narozených dětí s orofaciálními rozštěpy a srdečními vadami byl podobný očekávanému počtu v běžné populaci (4 děti vs. 3,3 a 18 dětí vs. 17-18, v tomto pořadí). V následné studii, která zvýšila celkový počet kojenců na 2 534, se míra celkových vrozených malformací u kojenců, jejichž matky byly vystaveny inhalačnímu budesonidu během časného těhotenství, nelišila od míry u všech novorozenců ve stejném období (3,6 % ).2 Třetí studie ze Švédského lékařského registru porodů s 2 968 těhotenstvími vystavenými inhalačnímu budesonidu, z nichž většinu představovaly expozice v prvním trimestru, uváděla gestační věk, porodní hmotnost, porodní délku, mrtvě narozené děti a vícečetné porody podobné u exponovaných dětí ve srovnání s neexponovaní kojenci.3
Vrozené malformace byly studovány u 2 113 dětí narozených matkám, které uváděly použití intranazálního budesonidu v časném těhotenství. Míra celkových vrozených vad byla podobná ve srovnání s mírou běžné populace (4,5 % vs. 3,5 %). Upravený poměr šancí (OR) byl 1,06 (95% CI 0,86-1,31). Počet narozených dětí s orofaciálním rozštěpem byl podobný očekávanému počtu v běžné populaci (3 děti vs. 3). Počet narozených dětí se srdeční vadou převýšil očekávaný počet v běžné populaci (28 dětí vs. 17,8). Systémová expozice z intranazálního budesonidu je 6krát nižší než z inhalačního budesonidu a spojení srdečních defektů nebylo pozorováno s vyšší expozicí budesonidu.
Navzdory nálezům na zvířatech by se zdálo, že možnost poškození plodu je malá, pokud je lék užíván během těhotenství. Nicméně, protože studie na lidech nemohou vyloučit možnost poškození, nosní sprej RHINOCORT AQUA (budesonid) by měl být během těhotenství používán pouze tehdy, je-li to nezbytně nutné.
Budesonid způsobil ztrátu plodu, snížení hmotnosti mláďat a kosterní abnormality při subkutánní dávce u králíků, která byla přibližně 2krát vyšší než maximální doporučená denní intranazální dávka u dospělých na základě mcg/m2, a při subkutánní dávce u potkanů, která byla přibližně 16krát vyšší než maximální doporučená denní intranazální dávka u dospělých na základě mcg/m2. U potkanů nebyly pozorovány žádné teratogenní nebo embryocidní účinky, když byl budesonid podáván inhalačně v dávkách až přibližně 8násobku maximální doporučené denní intranazální dávky u dospělých na základě mcg/m2.
Zkušenosti s perorálními kortikosteroidy od jejich zavedení do farmakologie na rozdíl od fyziologických dávek naznačují, že hlodavci jsou náchylnější k teratogenním účinkům kortikosteroidů než lidé.
Neteratogenní účinky: Hypoadrenalismus se může objevit u kojenců narozených matkám užívajícím kortikosteroidy během těhotenství. Takové děti by měly být pečlivě sledovány.
Kojící matky
Budesonid se vylučuje do lidského mléka. Údaje s budesonidem podávaným prostřednictvím inhalátoru suchého prášku naznačují, že celková denní perorální dávka budesonidu dostupná v mateřském mléce pro kojence je přibližně 0,3 % až 1 % dávky inhalované matkou (viz KLINICKÁ FARMAKOLOGIE, Farmakokinetika, Speciální populace, Ošetřovatelství ]. U kojících žen nebyly provedeny žádné studie specificky s nosním sprejem RHINOCORT 100 mcg AQUA; dá se však očekávat, že dávka budesonidu dostupná pro kojence v mateřském mléce, jako procento mateřské dávky, bude podobná. RHINOCORT AQUA (budesonid) nosní sprej by měl být používán u kojících žen pouze tehdy, je-li to klinicky vhodné. Předepisující lékaři by měli zvážit známé přínosy kojení pro matku a dítě oproti potenciálním rizikům minimální expozice budesonidu u kojence. Úvahy o dávkování zahrnují předepisování nebo titraci na nejnižší klinicky účinnou dávku a použití nosního spreje RHINOCORT 100 mcg AQUA (budesonid) bezprostředně po kojení, aby se maximalizoval časový interval mezi dávkováním a kojením, aby se minimalizovala expozice kojence.
Pediatrické použití
Bezpečnost a účinnost u pediatrických pacientů mladších 6 let nebyla stanovena.
Kontrolované klinické studie ukázaly, že intranazální kortikosteroidy mohou způsobit snížení rychlosti růstu u pediatrických pacientů. Tento účinek byl pozorován při absenci laboratorních důkazů suprese osy hypotalamus-hypofýza-nadledviny (HPA), což naznačuje, že rychlost růstu je citlivějším indikátorem systémové expozice kortikosteroidům u pediatrických pacientů než některé běžně používané testy funkce osy HPA . Dlouhodobé účinky tohoto snížení rychlosti růstu spojené s intranazálními kortikosteroidy, včetně dopadu na konečnou výšku v dospělosti, nejsou známy. Potenciál „catch-up“ růstu po přerušení léčby intranazálními kortikosteroidy nebyl dostatečně studován.
Růst dětských pacientů, kteří dostávají intranazální kortikosteroidy, včetně RHINOCORT 100 mcg AQUA (budesonid) nosního spreje, by měl být rutinně monitorován (např. pomocí stadiometrie). Potenciální růstové účinky prodloužené léčby by měly být zváženy se získanými klinickými přínosy a riziky a přínosy spojenými s alternativními terapiemi. Aby se minimalizovaly systémové účinky intranazálních kortikosteroidů, včetně nosního spreje RHINOCORT AQUA (budesonid), měl by být každý pacient titrován na nejnižší dávku, která účinně kontroluje jeho příznaky.
Jednoletá placebem kontrolovaná klinická růstová studie byla provedena u 229 pediatrických pacientů (ve věku 4 až 8 let) s cílem posoudit účinek nosního spreje RHINOCORT AQUA (budesonid) (jednotlivá denní dávka 64 mcg, doporučená počáteční dávka pro děti ve věku 6 let a starší) na rychlost růstu. Z populace 141 pacientů užívajících nosní sprej RHINOCORT 100 mcg AQUA (budesonid) a 67 pacientů užívajících placebo byl bodový odhad rychlosti růstu u nosního spreje RHINOCORT AQUA (budesonid) o 0,25 cm/rok nižší než u placeba (95% interval spolehlivosti v rozmezí od 0,59 cm/rok nižší než u placeba do 0,08 cm/rok vyšší než u placeba).
Ve studii s astmatickými dětmi ve věku 5-12 let měli ti, kteří byli léčeni budesonidem podávaným prostřednictvím suchého práškového inhalátoru 200 mcg dvakrát denně (n=311), snížení růstu o 1,1 centimetru (0,433 palce) ve srovnání s těmi, kteří dostávali placebo ( n=418) na konci jednoho roku; rozdíl mezi těmito dvěma léčebnými skupinami se během tří let dodatečné léčby dále nezvětšil. Na konci čtyř let měly děti léčené inhalátorem suchého prášku budesonid a děti léčené placebem podobnou rychlost růstu. Závěry vyvozené z této studie mohou být zkresleny nerovnoměrným používáním kortikosteroidů v léčebných skupinách a zahrnutím údajů od pacientů, kteří v průběhu studie dosáhli puberty.
Systémové účinky inhalačních kortikosteroidů souvisí se systémovou expozicí těmto lékům. Farmakokinetické studie prokázaly, že u dospělých i dětí se očekává, že systémová expozice budesonidu při nejvyšších doporučených dávkách nosního spreje RHINOCORT AQUA (budesonid) nebude vyšší než expozice při nejnižších doporučených dávkách prostřednictvím inhalátoru suchého prášku. Proto se očekává, že systémové účinky (osa HPA a růst) budesonidu dodávaného z nosního spreje RHINOCORT AQUA (budesonid) nebudou větší než ty, které jsou uváděny pro inhalovaný budesonid při podávání prostřednictvím inhalátoru suchého prášku.
Potenciál nosního spreje RHINOCORT 100 mcg AQUA (budesonid) způsobit potlačení růstu u citlivých pacientů nebo při podávání v dávkách vyšších než 64 mcg denně. Doporučený rozsah dávkování u pacientů ve věku 6 až 11 let je 64 až 128 mcg denně (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Geriatrické použití
2 461 pacientů v klinických studiích nosního spreje RHINOCORT 100 mcg AQUA (budesonid) bylo 5 % ve věku 60 let a více. Mezi těmito subjekty a mladšími subjekty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti, s výjimkou četnosti hlášení nežádoucích účinků epistaxe, která se zvyšovala s věkem. Další hlášené klinické zkušenosti dále neidentifikovaly žádné další rozdíly v odpovědích mezi staršími a mladšími pacienty, ale nelze vyloučit větší citlivost některých starších jedinců.
Poškození jater
Formální farmakokinetické studie s nosním sprejem RHINOCORT 100 mcg AQUA (budesonid) nebyly provedeny u pacientů s poruchou funkce jater. Protože je však budesonid vylučován převážně jaterním metabolismem, může poškození jaterních funkcí vést k akumulaci budesonidu v plazmě. Pacienti s onemocněním jater by proto měli být pečlivě sledováni.
PŘEDÁVKOVAT
Akutní předávkování touto lékovou formou je nepravděpodobné, protože jedna 120 lahvička s rozprašovačem RHINOCORT 100 mcg AQUA (budesonid) nosní sprej 32 mcg obsahuje pouze přibližně 5,4 mg budesonidu. Chronické předávkování může vést ke známkám/příznakům hyperkorticismu (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
KONTRAINDIKACE
RHINOCORT AQUA (budesonid) nosní sprej je kontraindikován u pacientů s přecitlivělostí na některou z jeho složek [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Budesonid je protizánětlivý kortikosteroid, který vykazuje silnou glukokortikoidní aktivitu a slabou mineralokortikoidní aktivitu. Ve standardních in vitro a zvířecích modelech má budesonid přibližně 200krát vyšší afinitu ke glukokortikoidnímu receptoru a 1000krát vyšší topickou protizánětlivou účinnost než kortizol (test ušního edému krysího krotonového oleje). Jako měřítko systémové aktivity je budesonid 40krát účinnější než kortizol při subkutánním podání a 25krát účinnější při perorálním podání v testu involuce brzlíku u potkana. Klinický význam tohoto není znám.
Aktivita RHINOCORT 100mcg AQUA nosní sprej je způsobena mateřským lékem budesonidem. Ve studiích afinity ke glukokortikoidnímu receptoru byla forma 22R dvakrát tak aktivní než epimer 22S. Studie in vitro ukázaly, že tyto dvě formy budesonidu se vzájemně nekonvertují.
Přesný mechanismus působení kortikosteroidů na zánět u sezónní a celoroční alergické rýmy není dobře znám. Zánět je důležitou složkou v patogenezi sezónní a celoroční alergické rýmy. Kortikosteroidy mají širokou škálu inhibičních aktivit proti více typům buněk (např. žírné buňky, eozinofily, neutrofily, makrofágy a lymfocyty) a mediátorům (např. histamin, eikosanoidy, leukotrieny a cytokiny), které se podílejí na alergických a nealergických reakcích zánět. Tyto protizánětlivé účinky kortikosteroidů mohou přispívat k jejich účinnosti u sezónní a celoroční alergické rýmy.
Farmakodynamika
Třítýdenní klinická studie u sezónní rýmy, srovnávající nosní inhalátor RHINOCORT 100 mcg, perorálně podaný budesonid a placebo u 98 pacientů s alergickou rýmou způsobenou pylem břízy, prokázala, že terapeutický účinek nosního inhalátoru RHINOCORT lze přičíst lokálním účinkům budesonid.

Efekty osy HPA
Účinky nosního spreje RHINOCORT 100 mcg AQUA (budesonid) na funkci nadledvin byly hodnoceny v několika klinických studiích. Ve čtyřtýdenní klinické studii 61 dospělých pacientů, kteří dostávali 256 mcg denně nosního spreje RHINOCORT AQUA (budesonid), neprokázalo žádné významné rozdíly v hladinách kortizolu v plazmě měřených před a 60 minut po intramuskulárním kosyntropinu od pacientů, kteří dostávali placebo. Nebyly žádné konzistentní rozdíly v 24hodinovém měření kortizolu v moči u pacientů, kteří dostávali až 400 mcg denně. Podobné výsledky byly pozorovány ve studii se 150 dětmi a dospívajícími ve věku 6 až 17 let s celoroční rýmou, kteří byli léčeni 256 mcg denně po dobu až 12 měsíců.
Po léčbě doporučenou maximální denní dávkou nosního spreje RHINOCORT AQUA (budesonid) (256 mcg) po dobu sedmi dnů došlo k malému, ale statisticky významnému poklesu plochy pod křivkou plazmatického kortizolu v průběhu 24 hodin (AUC0-24h ) u zdravých dospělých dobrovolníků.
Potlačení 24hodinového vylučování kortizolu močí v závislosti na dávce bylo pozorováno po podání nosního spreje RHINOCORT AQUA (budesonid) v dávkách od 100 do 800 mcg denně po dobu až čtyř dnů u 78 zdravých dospělých dobrovolníků. Klinický význam těchto výsledků není znám.
Farmakokinetika
Vstřebávání
Po intranazálním podání jedné dávky nosního spreje RHINOCORT AQUA (budesonid) (128 mcg) se průměrná maximální plazmatická koncentrace přibližně 0,3 nmol/l objeví asi 0,5 hodiny po podání dávky. Ve srovnání s intravenózní dávkou se přibližně 34 % podané intranazální dávky dostane do systémové cirkulace, z nichž většina je absorbována nosní sliznicí. Zatímco budesonid se dobře vstřebává z GI traktu, perorální biologická dostupnost budesonidu je nízká (~10 %) především kvůli rozsáhlému metabolismu prvního průchodu játry.
Rozdělení
Distribuční objem budesonidu byl přibližně 2-3 l/kg. Na plazmatické proteiny se vázal z 85–90 %. Distribuční objem pro 22R epimer je téměř dvojnásobný než pro 22S epimer. Vazba na bílkoviny byla konstantní v koncentračním rozsahu (1-100 nmol/l) dosaženém a překračujícím doporučené dávky RHINOCORT 100 mcg AQUA nosní sprej. Budesonid vykazoval malou nebo žádnou vazbu na globulin vázající kortikosteroidy. Budesonid se rychle ekvilibroval s červenými krvinkami způsobem nezávislým na koncentraci s poměrem krev/plazma asi 0,8.
Metabolismus
Studie in vitro s homogenáty lidských jater prokázaly, že budesonid je rychle a rozsáhle metabolizován. Byly izolovány dva hlavní metabolity tvořené biotransformací katalyzovanou izoenzymem 3A4 (CYP3A4) cytochromem P450 (CYP) a identifikovány jako 16α-hydroxyprednisolon a 6p-hydroxybudesonid. Kortikosteroidní aktivita každého z těchto dvou metabolitů je menší než 1 % aktivity mateřské sloučeniny. Nebyl detekován žádný kvalitativní rozdíl mezi metabolickými vzory in vitro a in vivo. V preparátech lidských plic a séra byla pozorována zanedbatelná metabolická inaktivace.
Vylučování/Eliminace
Forma 22R budesonidu byla přednostně vylučována játry se systémovou clearance 1,4 l/min oproti 1,0 l/min u formy 22S. Terminální poločas, 2 až 3 hodiny, byl stejný pro oba epimery a byl nezávislý na dávce. Budesonid byl vylučován močí a stolicí ve formě metabolitů. Přibližně 2/3 intranazální radioaktivně značené dávky byly zachyceny v moči a zbytek ve stolici. V moči nebyl detekován žádný nezměněný budesonid.
Specifické populace
Geriatrický
Farmakokinetika RHINOCORT 100 mcg AQUA (budesonid) nosní sprej u geriatrických pacientů nebyla specificky studována.
Pediatrická
Po podání nosního spreje RHINOCORT 100 mcg AQUA (budesonid) byla doba k dosažení maximálních koncentrací léčiva a plazmatický poločas podobné u dětí au dospělých. Děti měly plazmatické koncentrace přibližně dvojnásobné než u dospělých, především kvůli rozdílům v hmotnosti mezi dětmi a dospělými.
Rod
Nebyla provedena žádná specifická farmakokinetická studie k hodnocení vlivu pohlaví na farmakokinetiku budesonidu. Avšak po podání 400 mcg nosního spreje RHINOCORT 100 mcg AQUA (budesonid) 7 mužským a 8 ženským dobrovolníkům ve farmakokinetické studii nebyly zjištěny žádné velké rozdíly ve farmakokinetických parametrech mezi pohlavími.
Závod
Nebyla provedena žádná specifická studie k hodnocení vlivu rasy na farmakokinetiku budesonidu.
Kojící matky
Dispozice budesonidu při orální inhalaci z inhalátoru suchého prášku v dávkách 200 nebo 400 mcg dvakrát denně po dobu alespoň 3 měsíců byla studována u osmi kojících žen s astmatem od 1 do 6 měsíců po porodu. Systémová expozice budesonidu u těchto žen se zdá být srovnatelná se systémovou expozicí u nekojících žen s astmatem z jiných studií. Mateřské mléko získané během osmi hodin po podání dávky odhalilo, že maximální koncentrace budesonidu pro dávky 400 a 800 mcg byla 0,39 a 0,78 nmol/l a nastala do 45 minut po podání. Odhadovaná perorální denní dávka budesonidu z mateřského mléka kojenci byla přibližně 0,007 a 0,014 mcg/kg/den pro dva dávkové režimy použité v této studii, což představuje přibližně 0,3 % až 1 % dávky inhalované matkou. Hladiny budesonidu ve vzorcích plazmy získaných od pěti kojenců asi 90 minut po kojení (a asi 140 minut po podání léku matce) byly pod kvantifikovatelnými hladinami ( Použití u specifických populací, kojících matek ].
Renální nebo jaterní poškození
Farmakokinetika budesonidu nebyla u pacientů s poruchou funkce ledvin zkoumána. Snížená funkce jater může ovlivnit vylučování kortikosteroidů. Farmakokinetika budesonidu byla ovlivněna zhoršenou funkcí jater, o čemž svědčí dvojnásobná systémová dostupnost po perorálním požití. Význam tohoto zjištění pro intranazálně podávaný budesonid nebyl stanoven.
Lékové interakce
Inhibitory enzymů cytochromu P450
ketokonazol: Ketokonazol, silný inhibitor cytochromu P450 (CYP), izoenzym 3A4 (CYP3A4), hlavní metabolický enzym pro kortikosteroidy, zvýšil plazmatické hladiny perorálně podaného budesonidu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a DROGOVÉ INTERAKCE ].
Cimetidin: V doporučených dávkách měl cimetidin, nespecifický inhibitor enzymů CYP, mírný, ale klinicky nevýznamný účinek na farmakokinetiku perorálně podaného budesonidu.
Toxikologie zvířat a/nebo farmakologie
Budesonid byl teratogenní a embryocidní u králíků a potkanů. Budesonid způsobil ztrátu plodu, snížení hmotnosti mláďat a kosterní abnormality při subkutánní dávce 25 mcg/kg u králíků (přibližně dvojnásobek maximální doporučené denní intranazální dávky u dospělých na bázi mcg/m2) a při subkutánní dávce 500 mcg /kg u potkanů (přibližně 16násobek maximální doporučené denní intranazální dávky u dospělých na základě mcg/m2). Při podávání budesonidu v inhalačních dávkách až 250 mcg/kg (přibližně 8násobek maximální doporučené denní intranazální dávky u dospělých na základě mcg/m2) nebyly u potkanů pozorovány žádné teratogenní nebo embryocidní účinky.
Klinické studie
Terapeutická účinnost nosního spreje RHINOCORT AQUA (budesonid) byla hodnocena v placebem kontrolovaných klinických studiích sezónní a celoroční alergické rýmy trvajících 3-6 týdnů.
Počet pacientů léčených budesonidem v těchto studiích byl 90 mužů a 51 žen ve věku 6-12 let a 691 mužů a 694 žen ve věku 12 let a více. Pacienti byli převážně kavkazští.
Celkově výsledky těchto klinických studií ukázaly, že RHINOCORT AQUA (budesonid) nosní sprej podávaný jednou denně poskytuje statisticky významné snížení závažnosti nosních příznaků sezónní a celoroční alergické rýmy včetně rýmy, kýchání a ucpaného nosu.
Zlepšení nosních příznaků lze zaznamenat u pacientů do 10 hodin od prvního použití nosního spreje RHINOCORT 100 mcg AQUA (budesonid). Tato doba do nástupu je podpořena studií jednotky expozice prostředí u pacientů se sezónní alergickou rýmou, která prokázala, že RHINOCORT 100 mcg AQUA (budesonid) nosní sprej vedl ke statisticky významnému zlepšení nosních příznaků ve srovnání s placebem o 10 hodin. Další podporu přináší klinická studie pacientů s celoroční alergickou rýmou, která prokázala statisticky významné zlepšení nosních příznaků jak pro RHINOCORT AQUA (budesonid) nosní sprej, tak pro aktivní komparátor (mometason furoát) ve srovnání s placebem o 8 hodin. Nástup byl také hodnocen v této studii s maximální rychlostí nasálního inspiračního průtoku a tento koncový bod neprokázal účinnost ani pro jednu aktivní léčbu. Ačkoli v těchto studiích bylo zaznamenáno statisticky významné zlepšení nosních příznaků ve srovnání s placebem během 8–10 hodin, přibližně jedna polovina až dvě třetiny konečného klinického zlepšení s nosním sprejem RHINOCORT 100 mcg AQUA (budesonid) nastává během prvních 1–2 dnů, a maximálního přínosu nemusí být dosaženo dříve než přibližně 2 týdny po zahájení léčby.
REFERENCE
Kallen B, Rydhstroem H, Aberg A. Vrozené malformace po použití inhalačního budesonidu v časném těhotenství. Obstet Gynecol 1999; 93:392-395.
2 Ericson A, Kallen B. Užívání léků během těhotenství: jedinečná švédská registrační metoda, kterou lze zlepšit. Švédská agentura pro léčivé přípravky 1999; 1:8-11.
3 Norjavaara E, Gerhardsson de Verdier M. Normální výsledky těhotenství v populační studii zahrnující 2968 těhotných žen vystavených budesonidu. J Allergy Clin Immunol 2003;! 11:736-742.
INFORMACE PRO PACIENTA
RHINOCORT 100 mcg AQUA (budesonid) ® (RINE-o-cort AH-kwa) (budesonid) Nosní sprej
Pouze pro použití do nosu
Přečtěte si informace pro pacienty dodávané s nosním sprejem RHINOCORT 100 mcg AQUA (budesonid) dříve, než jej začnete používat, a pokaždé, když dostanete náplň. Mohou se objevit nové informace. Tyto informace nenahrazují rozhovor s poskytovatelem zdravotní péče o vašem zdravotním stavu nebo léčbě. Máte-li otázky týkající se nosního spreje RHINOCORT AQUA (budesonid), zeptejte se svého poskytovatele zdravotní péče nebo lékárníka.
Co je RHINOCORT 100mcg AQUA (budesonid) nosní sprej?
RHINOCORT AQUA (budesonid) nosní sprej je lék na předpis používaný k léčbě sezónních a celoročních příznaků alergie u dospělých a dětí ve věku 6 let a starších.
RHINOCORT AQUA nosní sprej obsahuje budesonid, což je umělý (syntetický) kortikosteroid. Intranazální kortikosteroidy jsou přirozené hormony nacházející se v těle, které snižují otoky nosní sliznice. Když si RHINOCORT 100mcg AQUA (budesonid) nosní sprej nastříkáte do nosu, pomůže to snížit nosní příznaky alergické rýmy (zánět nosní sliznice), jako je ucpaný nos, rýma, svědění a kýchání.
Bezpečnost a účinnost RHINOCORT 100 mcg AQUA (budesonid) nosní sprej nebyla prokázána u dětí mladších 6 let.
Kdo by neměl používat nosní sprej RHINOCORT AQUA (budesonid)?
Nepoužívejte RHINOCORT 100 mcg AQUA (budesonid) nosní sprej:
- jestliže jste alergický(á) na budesonid nebo na kteroukoli složku přípravku RHINOCORT AQUA nosní sprej. Na konci této příbalové informace naleznete úplný seznam složek nosního spreje RHINOCORT AQUA (budesonid).
Co bych měl říci svému poskytovateli zdravotní péče před použitím nosního spreje RHINOCORT 100 mcg AQUA (budesonid)?
Před použitím nosního spreje RHINOCORT AQUA (budesonide) informujte svého poskytovatele zdravotní péče nebo lékárníka, pokud:
- byli v poslední době kolem kohokoli s planými neštovicemi nebo spalničkami
- mít problémy s játry
- máte nějaké neléčené infekce
- jste někdy měli infekci zvanou tuberkulóza
- mít oční infekci
- jste nedávno podstoupil(a) operaci nebo poranění nosu
- mít jiné zdravotní potíže
- jste těhotná nebo plánujete otěhotnět. Není známo, zda RHINOCORT 100 mcg AQUA (budesonid) nosní sprej poškodí vaše nenarozené dítě. Poraďte se se svým lékařem, pokud jste těhotná nebo plánujete otěhotnět.
- kojíte nebo plánujete kojit. RHINOCORT 100 mcg AQUA (budesonid) nosní sprej může přecházet do vašeho mateřského mléka. Poraďte se se svým lékařem o nejlepším způsobu krmení dítěte, pokud užíváte nosní sprej RHINOCORT AQUA (budesonid).
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis i bez předpisu, vitamínů a bylinných doplňků.
RHINOCORT AQUA (budesonid) nosní sprej může ovlivnit účinek jiných léků a jiné léky mohou ovlivnit účinek nosního spreje RHINOCORT 100 mcg AQUA (budesonid).
Znát léky, které užíváte. Mějte s sebou seznam svých léků, abyste je mohli ukázat svému poskytovateli zdravotní péče a lékárníkovi, když dostanete nový lék.
Jak mám používat RHINOCORT 100 mcg AQUA (budesonid) nosní sprej?
- RHINOCORT 100 mcg AQUA (budesonid) nosní sprej je určen pouze pro použití do nosu. Nestříkejte jej do očí nebo úst.
- Používejte nosní sprej RHINOCORT AQUA (budesonid) přesně tak, jak vám řekl váš poskytovatel zdravotní péče.
- Je velmi důležité, abyste nosní sprej RHINOCORT AQUA (budesonid) používali pravidelně. Nepřestávejte používat nosní sprej RHINOCORT AQUA (budesonid) ani neměňte dávku, aniž byste si promluvili se svým poskytovatelem zdravotní péče, i když se cítíte lépe.
- Poraďte se se svým poskytovatelem zdravotní péče, pokud se vaše příznaky nezlepší po užívání nosního spreje RHINOCORT AQUA (budesonid) po dobu 2 týdnů nebo pokud se vaše příznaky zhorší.
- Dospělý by měl pomoci malému dítěti používat tento lék.
- Kompletní informace o tom, jak používat nosní sprej RHINOCORT AQUA (budesonid), naleznete v návodu k použití na konci této příbalové informace.
Jaké jsou možné vedlejší účinky nosního spreje RHINOCORT AQUA (budesonid)?
RHINOCORT 100 mcg AQUA (budesonid) nosní sprej může způsobit závažné nežádoucí účinky, včetně:
- otvor v chrupavce uvnitř nosu (perforace nosní přepážky). Informujte svého poskytovatele zdravotní péče, pokud máte při dýchání pískání z nosu.
- pomalé hojení ran. Neměli byste používat RHINOCORT 100 mcg AQUA (budesonid) nosní sprej, dokud se váš nos nezahojí, pokud vás bolí nos, pokud jste podstoupili operaci nosu nebo pokud byl váš nos zraněn.
- plísňová infekce ve vašem nosu.
- alergické reakce. Informujte svého poskytovatele zdravotní péče nebo okamžitě vyhledejte lékařskou pomoc, pokud máte:
- kožní vyrážka, zarudnutí nebo otok
- silné svědění
- otok obličeje, úst a jazyka
- problémy s imunitním systémem, které mohou zvýšit vaše riziko infekcí. Je pravděpodobnější, že dostanete infekce, pokud užíváte léky, které oslabují schopnost vašeho těla bojovat s infekcemi. Při používání nosního spreje RHINOCORT AQUA (budesonid) se vyhněte kontaktu s lidmi, kteří mají nakažlivé nemoci, jako jsou plané neštovice nebo spalničky. Příznaky infekce mohou zahrnovat horečku, bolest, bolesti, zimnici, pocit únavy, nevolnost a zvracení.
- nedostatek adrenalinu, Adrenální insuficience je stav, kdy nadledvinky nevytvářejí dostatek steroidních hormonů. Příznaky adrenální insuficience mohou zahrnovat únavu, slabost, nevolnost, zvracení a nízký krevní tlak.
- zpomalený nebo opožděný růst u dětí. RHINOCORT 100mcg AQUA (budesonid) nosní sprej by měl být pravidelně kontrolován růstem dítěte.
- oční problémy, jako je glaukom a šedý zákal. Informujte svého poskytovatele zdravotní péče, pokud máte změnu vidění nebo máte v anamnéze zvýšený nitrooční tlak, glaukom a/nebo šedý zákal.
Zavolejte svého poskytovatele zdravotní péče nebo okamžitě vyhledejte lékařskou pomoc, pokud máte příznaky některého z výše uvedených závažných nežádoucích účinků.
Mezi nejčastější vedlejší účinky RHINOCORT 100mcg AQUA (budesonid) nosní sprej patří:
- krvácení z nosu
- bolest krku
- dýchací potíže, jako je sípání nebo tlak na hrudi
- kašel
- podráždění vašeho nosu
Informujte svého poskytovatele zdravotní péče, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo nezmizí.
To nejsou všechny možné vedlejší účinky nosního spreje RHINOCORT 100mcg AQUA (budesonid). Další informace získáte od svého poskytovatele zdravotní péče nebo lékárníka.
Zavolejte svého poskytovatele zdravotní péče a požádejte o radu ohledně vedlejších účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088 nebo www.fda.gov/medwatch.
Nežádoucí účinky můžete hlásit společnosti AstraZeneca na čísle 1-800-236-9933.
Co bych měl vědět o alergické rýmě?
„Rýma“ znamená zánět nosní sliznice. Někdy se tomu říká „senná rýma“. Alergická rýma může být způsobena alergií na pyl, zvířecí srst, roztoče z domácího prachu a spóry plísní. Pokud máte alergickou rýmu, váš nos se ucpe, teče a svědí. Můžete také hodně kýchat. Můžete mít červené, svědivé, slzící oči; svědění v krku; nebo ucpané, svědící uši.
RHINOCORT AQUA (budesonid) nosní sprej pomáhá zmírnit vaše nosní příznaky.
Pokud máte také svědivé, slzící oči, měli byste to oznámit svému poskytovateli zdravotní péče. On nebo ona může předepsat další léky k léčbě těchto příznaků.
Jak mám uchovávat nosní sprej RHINOCORT AQUA (budesonid)?
- RHINOCORT AQUA (budesonid) nosní sprej skladujte při teplotě 20 °C až 25 °C.
- Chraňte před mrazem RHINOCORT AQUA (budesonid) nosní sprej.
- Chraňte RHINOCORT 100mcg AQUA (budesonid) nosní sprej před světlem.
- Nepoužívejte RHINOCORT 100 mcg AQUA (budesonid) nosní sprej po použití uvedeného počtu vstřiků (nezahrnuje základní nátěr) nebo po uplynutí doby použitelnosti uvedené na krabičce nebo štítku lahvičky.
- Ponechejte si zelené ochranné víčko na nosním spreji RHINOCORT AQUA (budesonid), když jej nepoužíváte. (Prosím podívej se Před použitím na zadní straně ).
- Uchovávejte RHINOCORT 100mcg AQUA (budesonid) nosní sprej a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a účinném používání nosního spreje RHINOCORT AQUA (budesonid):
Nepoužívejte RHINOCORT 100 mcg AQUA (budesonid) nosní sprej na stav, pro který nebyl předepsán. Nedávejte RHINOCORT AQUA (budesonid) nosní sprej jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Tento leták s informacemi pro pacienty shrnuje nejdůležitější informace o nosním spreji RHINOCORT 100 mcg AQUA (budesonid). Pokud chcete další informace, promluvte si se svým poskytovatelem zdravotní péče. Můžete požádat svého lékárníka nebo poskytovatele zdravotní péče o informace o nosním spreji RHINOCORT 100 mcg AQUA (budesonid), který je napsán pro zdravotníky.
Další informace najdete na www.astrazeneca-us.com nebo zavolejte společnosti AstraZeneca na číslo 1-800-236-9933.
Jaké jsou složky nosního spreje RHINOCORT AQUA (budesonid)?
Aktivní složka: budesonid
Neaktivní složky: Mikrokrystalická celulóza a sodná sůl karboxymethylcelulózy, bezvodá dextróza, polysorbát 80, edetát disodný, sorbát draselný a čištěná voda a kyselina chlorovodíková.
Návod k použití pro pacienta
Pouze pro použití do nosu. Nestříkejte do očí nebo úst.
Před použitím nosního spreje RHINOCORT 100 mcg AQUA (budesonid) si pozorně přečtěte návod k použití pro pacienta. Máte-li jakékoli dotazy, zeptejte se svého poskytovatele zdravotní péče
Obrázek A 
Jak nastříkat nosní sprej RHINOCORT AQUA (budesonid).
Před použitím nosního spreje RHINOCORT AQUA (budesonid) musí být lahvička naplněna. Pro základní aplikaci nosního spreje RHINOCORT 100 mcg AQUA (budesonid):
1. Zatažením sejměte zelené ochranné víčko z jednotky nosního spreje.
2. Před každým použitím lahvičku několik sekund jemně protřepejte.
3. Pevně držte lahvičku, jak je znázorněno na obrázku B, ukazováčkem a prostředníkem na obou stranách stříkací špičky a palcem pod lahvičkou.
Obrázek B 
4. Aktivujte pumpu rychlým a pevným zatlačením na bílý límec, přičemž palcem držíte dno lahvičky.
5. Před prvním použitím nosního spreje RHINOCORT AQUA (budesonid) jemně protřepejte lahvičku. Pumpu je třeba naplnit 8x zatlačením na bílý límec. Čerpadlo je nyní připraveno k použití. Při každodenním používání není nutné čerpadlo znovu plnit. Pokud se nepoužije 2 dny po sobě, znovu nastříkejte 1 stříknutím nebo dokud se neobjeví jemný střik. Pokud se nepoužívá déle než 14 dní, opláchněte stříkací koncovku pumpy pomocí kroků čištění uvedených na konci tohoto letáku. Po vyčištění znovu nastříkejte 2 střiky nebo dokud se neobjeví jemný sprej.
Každá lahvička nosního spreje RHINOCORT AQUA (budesonid) obsahuje dostatek léku, abyste mohli stříknout lék z lahvičky 120krát po naplnění lahvičky.
Po 120 vstřikech byste neměli používat lahvičku nosního spreje RHINOCORT 100 mcg AQUA (budesonid). Další nástřiky po 120 nemusí obsahovat správné množství léku. Měli byste sledovat počet vstřiků, které použijete z každé lahvičky nosního spreje RHINOCORT 100 mcg AQUA, a vyhoďte veškerý zbývající lék, který může v lahvičce zůstat. Doplňujte si předpis měsíčně.
Jak používat RHINOCORT 100 mcg AQUA (budesonid) nosní sprej
Při každodenním používání nosního spreje RHINOCORT AQUA (budesonid) dodržujte tyto pokyny:
Obrázek C 
4. Vložte sprej do nosní dírky (hrot by neměl zasahovat daleko do nosu). Uzavřete druhou nosní dírku prstem a předkloňte hlavu mírně dopředu, aby sprej směřoval k zadní části nosu (viz Obrázek D ).
Obrázek D 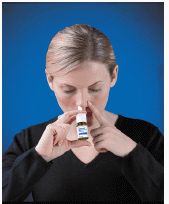
5. Pro každý nástřik aktivujte pumpu rychlým a pevným zatlačením na bílý límec, přičemž palcem držte dno lahvičky. Dýchejte jemně dovnitř nosní dírkou.
6. Po vstříknutí do nosní dírky zakloňte na několik sekund hlavu dozadu (viz Obrázek E ).
Obrázek E 
7. Pokud je potřeba druhý vstřik do stejné nosní dírky, opakujte kroky 3 až 6.
8. Opakujte kroky 3 až 7 pro druhou nosní dírku.
9. Vyhněte se smrkání po dobu 15 minut po použití nosního spreje RHINOCORT 100 mcg AQUA (budesonid).
10. Otřete stříkací hrot čistou utěrkou (viz Obrázek F ) a nasaďte zelené ochranné víčko. Láhev skladujte ve svislé poloze.
Obrázek F 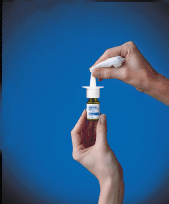
Jak čistit RHINOCORT 100mcg AQUA (budesonide) nosní sprej
Obrázek G 
Zelený ochranný uzávěr a stříkací hrot pravidelně oplachujte. Udělat toto:
Pro další informace o nosním spreji RHINOCORT 100 mcg AQUA (budesonide) ® volejte Informační centrum AstraZeneca, pondělí až pátek, 8:00 - 18:00 ET, kromě svátků na tel. 1-800-236-9933.
