Flonase Nasal Spray 50mcg Fluticasone Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Flonase a jak se používá?
Flonase je lék na předpis používaný k léčbě příznaků alergické rýmy (kýchání, rýma a svědění nebo slzení očí) a nosních polypů. Flonázu lze užívat samostatně nebo s jinými léky.
Flonase patří do třídy léků nazývaných kortikosteroidy, intranazální, imunosupresiva, PHD.
Není známo, zda je Flonase bezpečný a účinný u dětí mladších 4 let.
Jaké jsou možné vedlejší účinky Flonase?
Flonase může způsobit závažné nežádoucí účinky, včetně:
- těžké nebo pokračující krvácení z nosu,
- hlučné dýchání,
- rýma,
- krusta kolem vašich nosních dírek,
- zarudnutí, vředy nebo bílé skvrny v ústech nebo krku,
- horečka,
- zimnice,
- bolesti těla,
- rozmazané vidění,
- bolest očí,
- vidět halo kolem světel,
- rány, které se nezahojí,
- zhoršující se únava,
- svalová slabost,
- točení hlavy,
- nevolnost a
- zvracení
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky Flonase patří:
- drobné krvácení z nosu,
- pálení nebo svědění v nose,
- vředy nebo bílé skvrny uvnitř nebo kolem nosu,
- kašel,
- potíže s dýcháním,
- bolest hlavy,
- bolesti zad,
- bolest dutin,
- bolest krku,
- horečka,
- nevolnost a
- zvracení
POPIS
Aktivní složkou FLONASE nosního spreje 50 mcg je flutikason propionát, kortikosteroid s chemickým názvem S-(fluormethyl) 6α,9-difluor-11β,17-dihydroxy-16α-methyl-3oxoandrosta-1,4-dien-17β-karbothioát , 17-propionát a následující chemická struktura:
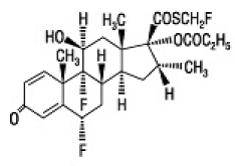
Flutikason propionát je bílý prášek s molekulovou hmotností 500,6 a empirický vzorec je C25H31F3O5S. Je prakticky nerozpustný ve vodě, snadno rozpustný v dimethylsulfoxidu a dimethylformamidu a těžce rozpustný v methanolu a 95% ethanolu.
FLONASE nosní sprej, 50 mcg je vodná suspenze mikrojemného flutikason propionátu k topickému podání na nosní sliznici pomocí dávkovací, atomizační sprejové pumpy. FLONASE nosní sprej 50 mcg také obsahuje mikrokrystalickou celulózu a sodnou sůl karboxymethylcelulózy, dextrózu, 0,02 % hmotn. benzalkoniumchloridu, polysorbát 80 a 0,25 % hmotn. fenylethylalkoholu a má pH mezi 5 a 7.
Po počátečním aktivaci se při každé aktivaci uvolní 50 mcg flutikason propionátu ve 100 mg přípravku přes nosní adaptér.
INDIKACE
FLONASE® nosní sprej je indikován k léčbě nosních příznaků celoroční nealergické rinitidy u dospělých a dětských pacientů ve věku 4 let a starších.
DÁVKOVÁNÍ A PODÁVÁNÍ
Nosní sprej FLONASE podávejte pouze intranazální cestou. Před prvním použitím nebo po období nepoužívání (1 týden nebo déle) naplňte nosní sprej FLONASE tak, že obsah dobře protřepete a vypustíte 6 střiků do vzduchu pryč z obličeje. Před každým použitím nosní sprej FLONASE jemně protřepejte.
Pacienti by měli nosní sprej FLONASE používat v pravidelných intervalech, protože jeho účinnost závisí na jeho pravidelném používání. Maximální účinek může trvat několik dní a jednotliví pacienti zaznamenají různou dobu do nástupu a různou míru zmírnění symptomů.
Dospělí
Doporučená počáteční dávka u dospělých jsou 2 vstřiky (50 mcg flutikason propionátu každý) do každé nosní dírky jednou denně (celková denní dávka 200 mcg). Účinná je také stejná celková denní dávka, 1 vstřik do každé nosní dírky podávaný dvakrát denně (např. v 8:00 a 20:00). Po několika prvních dnech mohou být pacienti schopni snížit svou dávku na 1 vstřik do každé nosní dírky jednou denně pro udržovací léčbu.
Maximální celkové denní dávky by neměly překročit 2 vstřiky do každé nosní dírky (celková dávka, 200 mcg/den). Neexistuje žádný důkaz, že překročení doporučené dávky je účinnější.
Dospívající a děti (ve věku 4 let a starší)
Doporučená počáteční dávka u dospívajících a dětí ve věku 4 let a starších je 1 vstřik do každé nosní dírky jednou denně (celková denní dávka, 100 mcg). Pacienti, kteří adekvátně nereagují na 1 vstřik do každé nosní dírky, mohou použít 2 vstřiky do každé nosní dírky jednou denně (celková denní dávka, 200 mcg). Jakmile je dosaženo adekvátní kontroly, dávka by měla být snížena na 1 vstřik do každé nosní dírky jednou denně.
Maximální celková denní dávka by neměla překročit 2 vstřiky do každé nosní dírky (200 mcg/den). Neexistuje žádný důkaz, že překročení doporučené dávky je účinnější.
JAK DODÁVÁNO
Dávkové formy A Síly
FLONASE nosní sprej je nosní sprejová suspenze. Každý 100mg sprej dodává 50 mcg flutikason propionátu.
Skladování A Manipulace
FLONASE Nosní sprej, 50 mcg se dodává v lahvičce z hnědého skla vybavené bílou dávkovací atomizační pumpou, bílým nosním adaptérem a zeleným protiprachovým krytem v krabičce po 1 ( NDC 0173-0453-01) se schválením FDA Označení pacienta (vidět Návod k použití pro pacienta pro správnou aktivaci zařízení ). Každá láhev obsahuje čistou hmotnost náplně 16 g a poskytne 120 aktivací. Každá aktivace dodá 50 mcg flutikason propionátu ve 100 mg přípravku přes nosní adaptér. Správné množství léku v každém stříknutí nelze zaručit po 120 střikech, i když lahvička není zcela prázdná. Láhev by měla být zlikvidována, když byl použit uvedený počet aktivací.
Skladujte při teplotě 4° až 30°C (39° až 86°F).
GlaxoSmithKline Research Triangle Park, NC 27709. Revize: leden 2015
VEDLEJŠÍ EFEKTY
Systémové a lokální užívání kortikosteroidů může mít za následek následující:
- Epistaxe, nosní ulcerace, infekce Candida albicans, perforace nosní přepážky a zhoršené hojení ran (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Šedý zákal a zelený zákal [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Imunosuprese [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hyperkorticismus a suprese nadledvin [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Vliv na růst [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
V kontrolovaných klinických studiích v USA bylo více než 3 300 subjektů s alergickou a nealergickou rýmou léčeno intranazálním flutikason propionátem. Obecně byly nežádoucí účinky v klinických studiích primárně spojeny s podrážděním nosních sliznic a nežádoucí účinky byly hlášeny s přibližně stejnou frekvencí u subjektů léčených placebem. Méně než 2 % subjektů v klinických studiích ukončilo léčbu kvůli nežádoucím reakcím; tato míra byla podobná pro vehikulum, placebo a aktivní komparátory.
Údaje o bezpečnosti popsané níže jsou založeny na 7 placebem kontrolovaných klinických studiích u subjektů s alergickou rýmou. Těchto 7 studií zahrnovalo 536 subjektů (57 dívek a 108 chlapců ve věku 4 až 11 let, 137 žen a 234 dospívajících a dospělých mužů) léčených přípravkem FLONASE 200 mcg jednou denně po dobu 2 až 4 týdnů a 2 placebem kontrolované klinické studie, které zahrnovaly 246 subjektů (119 žen a 127 dospívajících a dospělých mužů) léčených FLONASE 200 mcg jednou denně po dobu 6 měsíců (tabulka 1). V tabulce 1 jsou také zahrnuty nežádoucí účinky ze 2 studií, ve kterých bylo 167 dětí (45 dívek a 122 chlapců ve věku 4 až 11 let) léčeno FLONASE 100 mcg jednou denně po dobu 2 až 4 týdnů.
Další nežádoucí účinky u přípravku FLONASE nosní sprej 50 mcg pozorované s incidencí menší nebo rovnou 3 %, ale vyšší nebo rovnou 1 % a častější než u placeba zahrnovaly: krev v nosním hlenu, rýmu, bolest břicha, průjem, horečku, příznaky podobné chřipce, bolesti, závratě a bronchitida.
Postmarketingové zkušenosti
Kromě nežádoucích účinků hlášených z klinických studií byly během poregistračního použití intranazálního flutikason-propionátu zjištěny následující nežádoucí účinky. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku. Tyto příhody byly vybrány pro zahrnutí buď na základě jejich závažnosti, četnosti hlášení nebo kauzální souvislosti s flutikason propionátem nebo kombinací těchto faktorů.
Obecné poruchy a podmínky v místě podání
Hypersenzitivní reakce, včetně angioedému, kožní vyrážky, edému obličeje a jazyka, pruritus, kopřivka, bronchospasmus, sípání, dušnost a anafylaxe/anafylaktoidní reakce, které byly ve vzácných případech závažné.
Poruchy ucha a labyrintu
Změna nebo ztráta chuti a/nebo čichu a vzácně perforace nosní přepážky, nosní vřed, bolest v krku, podráždění a sucho v krku, kašel, chrapot a změny hlasu.
Oční poruchy
Suchost a podráždění, konjunktivitida, rozmazané vidění, glaukom, zvýšený nitrooční tlak a šedý zákal.
U intranazálních kortikosteroidů, včetně FLONASE, byly hlášeny případy suprese růstu (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
DROGOVÉ INTERAKCE
Inhibitory cytochromu P450 3A4
Flutikason propionát je substrátem CYP3A4. Použití silných inhibitorů CYP3A4 (např. ritonavir, atazanavir, klarithromycin, indinavir, itrakonazol, nefazodon, nelfinavir, saquinavir, ketokonazol, telitromycin, konivaptan, lopinavir, nefazodon, vorikonazol) s doporučeným FLONASE steroidem, ne nakortikálním systémem. může nastat.
ritonavir
Studie lékových interakcí s vodným nosním sprejem flutikason-propionátem u zdravých jedinců ukázala, že ritonavir (silný inhibitor CYP3A4) může významně zvýšit plazmatickou expozici flutikason-propionátu, což má za následek významně snížené koncentrace kortizolu v séru [viz KLINICKÁ FARMAKOLOGIE ]. Během postmarketingového používání byly hlášeny klinicky významné lékové interakce u pacientů užívajících flutikason propionát, včetně FLONASE, s ritonavirem, což mělo za následek systémové kortikosteroidní účinky včetně Cushingova syndromu a suprese nadledvin.
ketokonazol
Současné podávání perorálně inhalovaného flutikason propionátu (1 000 mcg) a ketokonazolu (200 mg jednou denně) vedlo k 1,9násobnému zvýšení plazmatické expozice flutikason propionátu a 45% snížení plochy pod křivkou kortizolu v plazmě (AUC), ale nemělo žádný účinek na vylučování kortizolu močí.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Místní nosní účinky
Epistaxe
klinických studiích trvajících 2 až 26 týdnů byla epistaxe pozorována častěji u subjektů léčených nosním sprejem FLONASE než u těch, kteří dostávali placebo (viz NEŽÁDOUCÍ REAKCE ].
Nosní ulcerace
Postmarketingové případy nosní ulcerace byly hlášeny u pacientů léčených FLONASE nosním sprejem (viz NEŽÁDOUCÍ REAKCE ].
Candida infekce
V klinických studiích s flutikason-propionátem podávaným intranazálně došlo k rozvoji lokalizovaných infekcí nosu a hltanu způsobených Candida albicans. Když se taková infekce rozvine, může vyžadovat léčbu vhodnou lokální terapií a vysazení nosního spreje FLONASE. Pacienti, kteří používají nosní sprej FLONASE po několik měsíců nebo déle, by měli být pravidelně vyšetřováni na přítomnost infekce Candida nebo jiných známek nežádoucích účinků na nosní sliznici.
Perforace nosní přepážky
Postmarketingové případy perforace nosní přepážky byly hlášeny u pacientů léčených nosním sprejem FLONASE (viz NEŽÁDOUCÍ REAKCE ].
Zhoršené hojení ran
Vzhledem k inhibičnímu účinku kortikosteroidů na hojení ran by se pacienti, kteří nedávno prodělali nosní vředy, nosní operaci nebo nosní trauma, měli vyhnout používání nosního spreje FLONASE, dokud nedojde k zahojení.
Glaukom a šedý zákal
Použití intranazálních a inhalačních kortikosteroidů může vést k rozvoji glaukomu a/nebo katarakty. Proto je u pacientů se změnou vidění nebo s anamnézou zvýšeného nitroočního tlaku, glaukomu a/nebo katarakty nutné pečlivé sledování.
Hypersenzitivní reakce včetně anafylaxe
Po podání FLONASE nosního spreje byly hlášeny hypersenzitivní reakce (např. anafylaxe, angioedém, kopřivka, kontaktní dermatitida a vyrážka). Ukončete FLONASE
Nosní sprej, pokud se takové reakce objeví [viz KONTRAINDIKACE ]. Vzácně se po podání FLONASE nosního spreje mohou objevit okamžité hypersenzitivní reakce.
Imunosuprese
Osoby, které užívají léky, které potlačují imunitní systém, jsou náchylnější k infekcím než zdraví jedinci. Například plané neštovice a spalničky mohou mít u vnímavých dětí nebo dospělých užívajících kortikosteroidy závažnější nebo dokonce smrtelný průběh. U takových dětí nebo dospělých, kteří neměli tato onemocnění nebo nebyli řádně imunizováni, je třeba věnovat zvláštní pozornost tomu, aby se zabránilo expozici. Není známo, jak dávka, cesta a délka podávání kortikosteroidů ovlivňují riziko rozvoje diseminované infekce. Není také znám podíl základního onemocnění a/nebo předchozí léčby kortikosteroidy na riziku. Pokud je pacient vystaven planým neštovicím, může být indikována profylaxe imunoglobulinem proti varicella zoster (VZIG). Pokud je pacient vystaven spalničkám, může být indikována profylaxe sdruženým intramuskulárním imunoglobulinem (IG). (Vidět kompletní informace o předepisování pro VZIG a IG. Pokud se plané neštovice rozvinou, lze zvážit léčbu antivirotiky.
Intranasální kortikosteroidy by měly být používány s opatrností, pokud vůbec, u pacientů s aktivní nebo klidovou tuberkulózní infekcí dýchacích cest; systémové plísňové, bakteriální, virové nebo parazitární infekce; nebo oční herpes simplex.
Hyperkorticismus a útlum nadledvin
Pokud jsou intranazální kortikosteroidy použity ve vyšších než doporučených dávkách nebo u citlivých jedinců v doporučených dávkách, mohou se objevit systémové účinky kortikosteroidů, jako je hyperkorticismus a adrenální suprese. Pokud k takovým změnám dojde, dávkování přípravku FLONASE nosní sprej by mělo být pomalu vysazeno v souladu s přijatými postupy pro ukončení léčby perorálními kortikosteroidy.
Nahrazení systémového kortikosteroidu lokálním kortikosteroidem může být doprovázeno známkami adrenální insuficience. Navíc se u některých pacientů mohou objevit příznaky vysazení kortikosteroidů (např. bolest kloubů a/nebo svalů, malátnost, deprese). Pacienti, kteří byli dříve dlouhodobě léčeni systémovými kortikosteroidy a převedeni na topické kortikosteroidy, by měli být pečlivě sledováni, zda nedochází k akutní adrenální insuficienci v reakci na stres. U pacientů, kteří mají astma nebo jiné klinické stavy vyžadující dlouhodobou systémovou léčbu kortikosteroidy, může rychlé snížení dávek systémových kortikosteroidů způsobit závažnou exacerbaci jejich příznaků.
Lékové interakce se silnými inhibitory cytochromu P450 3A4
Použití silných inhibitorů cytochromu P450 3A4 (CYP3A4) (např. ritonavir, atazanavir, klarithromycin, indinavir, itrakonazol, nefazodon, nelfinavir, saquinavir, ketokonazol, telithromycin, conivaptan, lopinavir, nefazodon s nefazodonem) mohou se objevit zvýšené systémové nežádoucí účinky kortikosteroidů [viz DROGOVÉ INTERAKCE , KLINICKÁ FARMAKOLOGIE ].
Vliv Na Růst
Intranazální kortikosteroidy mohou způsobit snížení rychlosti růstu při podávání dětským pacientům (viz Použití ve specifických populacích ]. Pravidelně sledujte růst dětských pacientů užívajících nosní sprej FLONASE. Aby se minimalizovaly systémové účinky intranazálních kortikosteroidů, včetně nosního spreje FLONASE, titrujte dávku každého pacienta na nejnižší dávku, která účinně kontroluje jeho příznaky [viz DÁVKOVÁNÍ A PODÁVÁNÍ , Použití u konkrétních populací ].
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( INFORMACE PRO PACIENTA a návod k použití ).
Místní nosní účinky
Informujte pacienty, že léčba FLONASE nosním sprejem 50 mcg může vést k nežádoucím reakcím, které zahrnují epistaxi a nosní ulceraci. Při léčbě nosním sprejem FLONASE se také může objevit kandidová infekce. Kromě toho je nosní sprej FLONASE 50 mcg spojován s perforací nosní přepážky a zhoršeným hojením ran. Pacienti, kteří v nedávné době prodělali nosní vředy, operaci nosu nebo poranění nosu, by neměli používat FLONASE nosní sprej 50 mcg, dokud nedojde k zahojení (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Glaukom a katarakta
Informujte pacienty, že glaukom a šedý zákal jsou spojeny s nazálním a inhalačním kortikosteroidem. Informujte pacienty, aby informovali své poskytovatele zdravotní péče, pokud je při používání nosního spreje FLONASE zaznamenána změna vidění [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Hypersenzitivní reakce, včetně anafylaxe
Informujte pacienty, že po podání FLONASE nosního spreje se mohou objevit hypersenzitivní reakce, včetně anafylaxe, angioedému, kopřivky, kontaktní dermatitidy a vyrážky. Pokud se takové reakce objeví, pacienti by měli přerušit používání nosního spreje FLONASE (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Imunosuprese
Varujte pacienty, kteří jsou na imunosupresivních dávkách kortikosteroidů, aby se vyhnuli kontaktu s planými neštovicemi nebo spalničkami, a pokud jsou vystaveni, neprodleně se poraďte se svým poskytovatelem zdravotní péče. Informujte pacienty o možném zhoršení stávající tuberkulózy; plísňové, bakteriální, virové nebo parazitární infekce; nebo oční herpes simplex [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Snížená rychlost růstu
Upozorněte rodiče, že FLONASE nosní sprej 50 mcg může způsobit snížení rychlosti růstu při podávání dětským pacientům. Lékaři by měli pozorně sledovat růst dětí a dospívajících užívajících kortikosteroidy jakoukoli cestou [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , Pediatrické použití ].
Pro dosažení nejlepšího účinku používejte denně
Informujte pacienty, že by měli pravidelně používat nosní sprej FLONASE 50 mcg. FLONASE nosní sprej 50 mcg, stejně jako ostatní kortikosteroidy, nemá okamžitý účinek na příznaky rýmy. Maximálního přínosu může být dosaženo až za několik dní. Pacienti by neměli zvyšovat předepsanou dávku, ale měli by kontaktovat svého poskytovatele zdravotní péče, pokud se příznaky nezlepší nebo pokud se stav zhorší.
Udržujte sprej mimo oči a ústa
Informujte pacienty, aby si nestříkali nosní sprej FLONASE do očí a úst.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Flutikason propionát neprokázal žádný tumorigenní potenciál u myší při perorálních dávkách až do 1 000 mcg/kg (přibližně 20násobek MRHDID u dospělých a přibližně 10násobek MRHDID u dětí na základě mcg/m²) po dobu 78 týdnů nebo u potkanů při inhalačních dávkách vyšších na 57 mcg/kg (přibližně dvojnásobek MRHDID u dospělých a přibližně ekvivalentní MRHDID u dětí na základě mcg/m²) po dobu 104 týdnů.
Flutikason propionát neindukoval genovou mutaci v prokaryotických nebo eukaryotických buňkách in vitro. U kultivovaných lidských periferních lymfocytů in vitro nebo v mikronukleárním testu na myších nebyl pozorován žádný významný klastogenní účinek.
U samců a samic potkanů nebyly pozorovány žádné známky poškození fertility při subkutánních dávkách až 50 mcg/kg (přibližně dvojnásobek MRHDID u dospělých na základě mcg/m²). Hmotnost prostaty byla významně snížena při subkutánní dávce 50 mcg/kg.
Klinické studie
Celoroční nealergická rýma
Byly provedeny tři randomizované, dvojitě zaslepené, paralelní skupiny, vehikulem kontrolované placebem kontrolované studie u 1 191 subjektů, aby se zjistilo pravidelné používání nosního spreje FLONASE 50 mcg u subjektů s celoroční nealergickou rýmou. Tyto studie hodnotily celkové skóre nosních příznaků hodnocené subjektem (TNSS), které zahrnovalo nosní obstrukci, postnazální kapání, výtok z nosu u subjektů léčených po dobu 28 dnů dvojitě zaslepené terapie a v 1 ze 3 studií po dobu 6 měsíců otevřené léčby. Dvě z těchto studií prokázaly, že subjekty léčené nosním sprejem FLONASE (100 mcg dvakrát denně) vykazovaly statisticky významné snížení TNSS ve srovnání s subjekty léčenými vehikulem.
Použití u konkrétních populací
Těhotenství
Teratogenní účinky
Kategorie těhotenství C. Neexistují žádné adekvátní a dobře kontrolované studie s nosním sprejem FLONASE u těhotných žen. Bylo prokázáno, že kortikosteroidy jsou teratogenní u laboratorních zvířat, pokud jsou podávány systémově v relativně nízkých dávkách. Vzhledem k tomu, že reprodukční studie na zvířatech ne vždy předpovídají lidskou odpověď, měl by být FLONASE nosní sprej používán během těhotenství pouze v případě, že potenciální přínos ospravedlňuje potenciální riziko pro plod. Ženám by mělo být doporučeno, aby kontaktovaly svého lékaře, pokud otěhotní během užívání FLONASE nosního spreje.
Myši a potkani v dávkách flutikasonpropionátu přibližně 1 a 4násobku maximální doporučené lidské denní intranazální dávky (MRHDID) pro dospělé (na základě mg/m² při subkutánních dávkách matky 45 a 100 mcg/kg/den, v tomto pořadí) vykazovaly fetální toxicitu charakteristickou pro silné kortikosteroidní sloučeniny, včetně retardace růstu embryí, omfalokély, rozštěpu patra a retardované lebeční osifikace. U potkanů nebyla pozorována žádná teratogenita při dávkách až 3krát vyšších než MRHDID (na základě mg/m² při inhalačních dávkách matky až do 68,7 mcg/kg/den).
králíků bylo pozorováno snížení hmotnosti plodu a rozštěp patra při dávce flutikason-propionátu přibližně 0,3násobku MRHDID pro dospělé (na základě mg/m² při subkutánní dávce 4 mcg/kg/den pro matku). Nebyly však hlášeny žádné teratogenní účinky při dávkách flutikason-propionátu až do přibližně 20násobku MRHDID pro dospělé (na základě mg/m² při perorální dávce až 300 mcg/kg/den pro matku). V této studii nebyl v plazmě detekován žádný flutikason propionát, což je v souladu se zjištěnou nízkou biologickou dostupností po perorálním podání (viz KLINICKÁ FARMAKOLOGIE ].
Flutikason propionát po subkutánním podání myším a potkanům a perorálním podání králíkům prošel placentou.
Zkušenosti s perorálními kortikosteroidy od jejich zavedení do farmakologie, na rozdíl od fyziologických dávek, naznačují, že hlodavci jsou náchylnější k teratogenním účinkům kortikosteroidů než lidé. Kromě toho, protože během těhotenství dochází k přirozenému zvýšení produkce kortikosteroidů, bude většina žen vyžadovat nižší dávku exogenních kortikosteroidů a mnoho z nich nebude během těhotenství potřebovat léčbu kortikosteroidy.
Neteratogenní účinky
Hypoadrenalismus se může objevit u kojenců narozených matkám užívajícím kortikosteroidy během těhotenství. Takoví kojenci by měli být pečlivě sledováni.
Kojící matky
Není známo, zda se flutikason-propionát vylučuje do lidského mateřského mléka. V lidském mléce však byly zjištěny i jiné kortikosteroidy. Subkutánní podání tritiovaného flutikason-propionátu potkanům v laktaci v dávce přibližně 0,4násobku MRHDID pro dospělé na základě mg/m² vedlo k měřitelné radioaktivitě v mléce.
Vzhledem k tomu, že neexistují žádné údaje z kontrolovaných studií o použití intranazálního nosního spreje FLONASE 50 mcg kojícími matkami, je třeba postupovat opatrně, když je FLONASE nosní sprej 50 mcg podáván kojící ženě.
Pediatrické použití
Bezpečnost a účinnost nosního spreje FLONASE u dětí ve věku 4 let a starších byla stanovena (viz NEŽÁDOUCÍ REAKCE , KLINICKÁ FARMAKOLOGIE ]. Šest set padesát (650) subjektů ve věku 4 až 11 let a 440 subjektů ve věku 12 až 17 let bylo studováno v amerických klinických studiích s nosním sprejem flutikason propionát. Bezpečnost a účinnost přípravku FLONASE nosní sprej 50 mcg u dětí mladších 4 let nebyla stanovena.
Účinky na růst
Kontrolované klinické studie ukázaly, že intranazální kortikosteroidy mohou při podávání dětským pacientům způsobit snížení rychlosti růstu. Tento účinek byl pozorován při absenci laboratorních důkazů suprese osy hypotalamus-hypofýza-nadledviny (HPA), což naznačuje, že rychlost růstu je citlivějším indikátorem systémové expozice kortikosteroidům u pediatrických pacientů než některé běžně používané testy funkce osy HPA. Dlouhodobé účinky tohoto snížení rychlosti růstu spojené s intranazálními kortikosteroidy, včetně dopadu na konečnou výšku v dospělosti, nejsou známy. Potenciál „catch-up“ růstu po přerušení léčby intranazálními kortikosteroidy nebyl dostatečně studován. Růst dětských pacientů užívajících intranazální kortikosteroidy, včetně nosního spreje FLONASE, by měl být rutinně monitorován (např. pomocí stadiometrie). Potenciální růstové účinky prodloužené léčby by měly být zváženy oproti získaným klinickým přínosům a rizikům spojeným s alternativní terapií. Aby se minimalizovaly systémové účinky intranazálních kortikosteroidů, včetně nosního spreje FLONASE, měla by být dávka každého pacienta titrována na nejnižší dávku, která účinně kontroluje jeho/její symptomy.
Jednoletá placebem kontrolovaná studie byla provedena u 150 pediatrických pacientů (ve věku 3 až 9 let) s cílem posoudit účinek nosního spreje FLONASE (jednorázová denní dávka 200 mcg) na rychlost růstu. Z primární populace, která dostávala FLONASE nosní sprej (n = 56) a placebo (n = 52), byl bodový odhad rychlosti růstu s FLONASE nosním sprejem 50 mcg o 0,14 cm/rok nižší než u placeba (95% CI: -0,54, 0,27 cm /rok). Ve srovnání s placebem tedy nebyl zaznamenán žádný statisticky významný účinek na růst. Nebyly pozorovány žádné známky klinicky relevantních změn ve funkci osy HPA nebo kostní minerální denzitě, jak bylo hodnoceno 12hodinovým vylučováním kortizolu močí a rentgenovou absorbometrií s duální energií.
Potenciál FLONASE nosního spreje 50 mcg způsobit supresi růstu u citlivých pacientů nebo při podávání vyšších než doporučených dávek nelze vyloučit.
Geriatrické použití
Omezený počet subjektů ve věku 65 let a starších (n = 129) nebo 75 let a starších (n = 11) byl v klinických studiích léčen nosním sprejem FLONASE. Zatímco počet subjektů je příliš malý na to, aby umožnil samostatnou analýzu účinnosti a bezpečnosti, nežádoucí účinky hlášené v této populaci byly podobné těm, které uváděli mladší pacienti. Obecně by měl být výběr dávky pro staršího pacienta opatrný, obvykle začínající na spodní hranici dávkovacího rozmezí, což odráží vyšší frekvenci snížené funkce jater, ledvin nebo srdce a souběžného onemocnění nebo jiné lékové terapie.
Poškození jater
Formální farmakokinetické studie s nosním sprejem FLONASE 50 mcg nebyly provedeny u subjektů s poruchou funkce jater. Vzhledem k tomu, že flutikason-propionát je vylučován převážně jaterním metabolismem, může poškození jaterních funkcí vést k akumulaci flutikason-propionátu v plazmě. Pacienti s onemocněním jater by proto měli být pečlivě sledováni.

Renální poškození
Formální farmakokinetické studie s nosním sprejem FLONASE nebyly provedeny u subjektů s poruchou funkce ledvin.
PŘEDÁVKOVAT
Chronické předávkování může vést ke známkám/příznakům hyperkorticismu (viz OPATŘENÍ ). Intranazální podávání 2 mg (10násobek doporučené dávky) flutikason-propionátu dvakrát denně po dobu 7 dnů zdravým lidským dobrovolníkům bylo dobře tolerováno. Jednorázové perorální dávky až do 16 mg byly studovány na lidských dobrovolnících bez hlášených akutních toxických účinků. Opakované perorální dávky do 80 mg denně po dobu 10 dnů u dobrovolníků a opakované perorální dávky do 10 mg denně po dobu 14 dnů u pacientů byly dobře tolerovány. Nežádoucí účinky byly mírné nebo střední závažnosti a výskyt byl podobný v aktivní skupině a ve skupině léčené placebem. Akutní předávkování touto lékovou formou je nepravděpodobné, protože 1 lahvička FLONASE (flutikason propionát) nosního spreje obsahuje přibližně 8 mg flutikason propionátu.
Orální a subkutánní střední letální dávky u myší a potkanů byly > 1 000 mg/kg (> 20 000 a > 41 000násobek maximální doporučené denní intranazální dávky u dospělých a > 10 000 a > 20 000násobek maximální doporučené denní intranazální dávky dávka u dětí na základě mg/m2).
KONTRAINDIKACE
FLONASE (flutikason propionát) nosní sprej je kontraindikován u pacientů s přecitlivělostí na kteroukoli z jeho složek.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Flutikason propionát je syntetický trifluorovaný kortikosteroid s protizánětlivým účinkem. In vitro bylo prokázáno, že flutikason propionát vykazuje vazebnou afinitu k lidskému glukokortikoidovému receptoru, která je 18krát větší než u dexamethasonu, téměř dvakrát větší než u beklomethason-17-monopropionátu (BMP), aktivního metabolitu beklomethasondipropionátu, a více než 3krát vyšší budesonidu. Údaje z McKenzieho vazokonstrikčního testu u člověka jsou v souladu s těmito výsledky. Klinický význam těchto nálezů není znám.
Přesný mechanismus, kterým flutikason-propionát ovlivňuje příznaky rinitidy, není znám. Bylo prokázáno, že kortikosteroidy mají širokou škálu účinků na různé typy buněk (např. žírné buňky, eozinofily, neutrofily, makrofágy, lymfocyty) a mediátory (např. histamin, eikosanoidy, leukotrieny, cytokiny), které se účastní zánětu. V 7 studiích u dospělých snížil FLONASE nosní sprej eozinofily v nosní sliznici u 66 % pacientů (35 % u placeba) a bazofily u 39 % pacientů (28 % u placeba). Přímý vztah těchto nálezů k dlouhodobému zmírnění symptomů není znám.
Farmakodynamika
Efekt osy HPA
Byly hodnoceny potenciální systémové účinky nosního spreje FLONASE 50 mcg na osu HPA. FLONASE nosní sprej 50 mcg podávaný jako 200 mcg jednou denně nebo 400 mcg dvakrát denně byl srovnáván s placebem nebo perorálním prednisonem 7,5 nebo 15 mg podávaným ráno. Nosní sprej FLONASE v žádné dávce po dobu 4 týdnů neovlivnil odpověď nadledvin na 6hodinovou stimulaci kosyntropinem, zatímco obě dávky perorálního prednisonu významně snížily odpověď na kosyntropin.
Elektrofyziologie srdce
Studie specificky navržená pro hodnocení účinku FLONASE na QT interval nebyla provedena.
Farmakokinetika
Aktivita FLONASE nosního spreje 50 mcg je způsobena původním léčivem, flutikason propionátem. Vzhledem k nízké biologické dostupnosti při intranazálním podání byla většina farmakokinetických údajů získána jinými způsoby podání.
Vstřebávání
Nepřímé výpočty ukazují, že flutikason propionát podávaný intranazální cestou má absolutní biologickou dostupnost v průměru nižší než 2 %. Studie používající perorální dávkování značeného a neznačeného léčiva prokázaly, že perorální systémová biologická dostupnost flutikason propionátu je zanedbatelná (
Rozdělení
Po intravenózním podání byla počáteční fáze dispozice flutikason-propionátu rychlá a konzistentní s jeho vysokou rozpustností v lipidech a vazbou na tkáně. Distribuční objem byl v průměru 4,2 l/kg.
Procento flutikason-propionátu navázaného na lidské plazmatické proteiny bylo v průměru 99 %. Flutikason propionát se slabě a reverzibilně váže na erytrocyty a není významně vázán na lidský transkortin.
Odstranění
Po intravenózním podání vykazoval flutikason propionát polyexponenciální kinetiku a měl terminální eliminační poločas přibližně 7,8 hodin. Celková krevní clearance flutikason-propionátu je vysoká (průměr: 1 093 ml/min), přičemž renální clearance představuje méně než 0,02 % celkové.
Metabolismus: Jediným cirkulujícím metabolitem detekovaným u člověka je derivát 17β-karboxylové kyseliny flutikason propionátu, který se tvoří cestou CYP3A4. Tento metabolit měl nižší afinitu (přibližně 1/2 000) než původní léčivo pro glukokortikoidní receptor lidského plicního cytosolu in vitro a zanedbatelnou farmakologickou aktivitu ve studiích na zvířatech. Jiné metabolity detekované in vitro pomocí kultivovaných lidských hepatomových buněk nebyly u člověka detekovány.
Vylučování: Méně než 5 % radioaktivně značené perorální dávky se vyloučilo močí jako metabolity, zbytek se vyloučil stolicí jako původní léčivo a metabolity.
Zvláštní populace
Flutikason propionát nosní sprej nebyl studován u žádné zvláštní populace a nebyly získány žádné farmakokinetické údaje specifické pro pohlaví.
Lékové interakce
Inhibitory cytochromu P450 3A4: Ritonavir: Flutikason propionát je substrátem CYP3A4. Současné podávání flutikason-propionátu a silného inhibitoru CYP3A4, ritonaviru, se na základě vícedávkové zkřížené studie lékových interakcí u 18 zdravých subjektů nedoporučuje. Flutikason propionát vodný nosní sprej (200 mcg jednou denně) byl podáván po dobu 7 dnů společně s ritonavirem (100 mg dvakrát denně). Plazmatické koncentrace flutikason propionátu po samotném vodném nosním spreji flutikason propionátu byly u většiny subjektů nedetekovatelné (
ketokonazol: Současné podávání perorálně inhalovaného flutikason propionátu (1 000 mcg) a ketokonazolu (200 mg jednou denně) vedlo k 1,9násobnému zvýšení plazmatické expozice flutikason propionátu a 45% snížení AUC kortizolu v plazmě, ale nemělo žádný vliv na vylučování kortizolu močí.
Erythromycin: Ve studii lékových interakcí s více dávkami neovlivnilo současné podávání perorálně inhalovaného flutikason-propionátu (500 mcg dvakrát denně) a erythromycinu (333 mg 3krát denně) farmakokinetiku flutikason-propionátu.
INFORMACE PRO PACIENTA
FLONASE® [flow'naz] (flutikason propionát) nosní sprej, 50 mcg
Přečtěte si informace pro pacienty, které jsou dodávány s nosním sprejem FLONASE, než jej začnete používat, a pokaždé, když dostanete náplň. Mohou se objevit nové informace. Tyto informace pro pacienta nenahrazují rozhovor s vaším poskytovatelem zdravotní péče o vašem zdravotním stavu nebo léčbě.
Co je FLONASE nosní sprej?
FLONASE nosní sprej 50 mcg je lék na předpis používaný k léčbě nealergických nosních příznaků, jako je rýma, ucpaný nos, kýchání a svědění nosu u dospělých a dětí ve věku 4 let a starších.
Není známo, zda je FLONASE nosní sprej 50 mcg bezpečný a účinný u dětí mladších 4 let.
Kdo by neměl užívat FLONASE nosní sprej 50 mcg?
Nepoužívejte FLONASE nosní sprej 50 mcg, pokud jste alergičtí na flutikason propionát nebo na kteroukoli složku nosního spreje FLONASE. Viz "Jaké jsou složky v nosním spreji FLONASE 50 mcg?" níže pro úplný seznam ingrediencí.
Co bych měl říci svému poskytovateli zdravotní péče před použitím FLONASE nosního spreje 50 mcg?
Informujte svého poskytovatele zdravotní péče o všech svých zdravotních stavech, včetně toho, zda:
- máte nebo jste měli vředy v nose, operaci nosu nebo poranění nosu.
- máte oční problémy, jako je šedý zákal nebo glaukom.
- mít problém s imunitním systémem.
- jste alergičtí na některou ze složek nosního spreje FLONASE, na jiné léky nebo potravinářské produkty. Vidět "Jaké jsou složky nosního spreje FLONASE?" níže pro úplný seznam ingrediencí.
- máte jakýkoli typ virové, bakteriální nebo plísňové infekce.
- jsou vystaveni planým neštovicím nebo spalničkám.
- mít jiné zdravotní potíže.
- jste těhotná nebo těhotenství plánujete. Není známo, zda FLONASE nosní sprej může poškodit vaše nenarozené dítě.
- kojíte nebo plánujete kojit. Není známo, zda FLONASE nosní sprej 50 mcg přechází do vašeho mateřského mléka a zda může poškodit vaše dítě.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků. FLONASE nosní sprej a některé další léky se mohou vzájemně ovlivňovat. To může způsobit závažné nežádoucí účinky. Zejména informujte svého poskytovatele zdravotní péče, pokud užíváte antimykotika nebo léky proti HIV.
Znát léky, které užíváte. Uchovávejte si jejich seznam, abyste je mohli ukázat svému poskytovateli zdravotní péče a lékárníkovi, když dostanete nový lék.
Jak mám používat nosní sprej FLONASE?
Přečtěte si podrobné pokyny pro použití nosního spreje FLONASE na konci této informace pro pacienta.
- FLONASE nosní sprej je určen pouze pro použití do nosu. Nestříkejte jej do očí nebo úst.
- Děti by měly nosní sprej FLONASE používat s pomocí dospělé osoby podle pokynů poskytovatele zdravotní péče o dítě.
- Používejte FLONASE nosní sprej 50 mcg přesně tak, jak vám řekl váš poskytovatel zdravotní péče. Nepoužívejte FLONASE nosní sprej častěji, než je předepsáno.
- FLONASE nosní sprej může trvat několik dní při pravidelném používání, aby se příznaky rýmy zlepšily. Pokud se vaše příznaky nezlepší nebo se zhorší, zavolejte svého poskytovatele zdravotní péče.
- Nejlepších výsledků dosáhnete, pokud budete nosní sprej FLONASE používat pravidelně každý den, aniž byste vynechali dávku. Poté, co se začnete cítit lépe, může váš poskytovatel zdravotní péče snížit dávku. Ne přestaňte používat FLONASE nosní sprej 50 mcg, pokud vám to neřekne váš poskytovatel zdravotní péče.
Jaké jsou možné vedlejší účinky přípravku FLONASE nosní sprej 50 mcg?
FLONASE nosní sprej 50 mcg může způsobit závažné nežádoucí účinky, včetně:
- problémy s nosem. Problémy s nosem mohou zahrnovat:
- krvácení z nosu.
- boláky (vředy) v nose.
- určitá plísňová infekce ve vašem nosu, ústech a/nebo krku (drozd).
- díra v chrupavce vašeho nosu (perforace nosní přepážky). Příznaky perforace nosní přepážky mohou zahrnovat:
- krusta v nose
- krvácení z nosu
- rýma
- pískání při dýchání
- pomalé hojení ran. Neměli byste používat FLONASE nosní sprej, dokud se váš nos nezahojí, pokud máte vřed v nose, podstoupili jste operaci nosu nebo pokud byl váš nos zraněn.
- oční problémy včetně glaukomu a šedého zákalu. Během používání nosního spreje FLONASE byste měli podstupovat pravidelné oční prohlídky.
- závažné alergické reakce. Zavolejte svého poskytovatele zdravotní péče nebo vyhledejte pohotovostní lékařskou péči, pokud se u vás objeví některý z následujících příznaků závažné alergické reakce:
- vyrážka
- kopřivka
- otok obličeje, úst a jazyka
- dýchací problémy
- oslabený imunitní systém a zvýšená pravděpodobnost infekce (imunosuprese). Užívání léků, které oslabují váš imunitní systém, zvyšuje pravděpodobnost vzniku infekcí a může zhoršit některé infekce. Tyto infekce mohou zahrnovat tuberkulózu (TB), oční infekce herpes simplex a infekce způsobené houbami, bakteriemi, viry a parazity. Při používání nosního spreje FLONASE se vyhněte kontaktu s lidmi, kteří mají nakažlivé onemocnění, jako jsou plané neštovice nebo spalničky. Pokud přijdete do kontaktu s někým, kdo má plané neštovice nebo spalničky, okamžitě kontaktujte svého poskytovatele zdravotní péče. Příznaky infekce mohou zahrnovat:
- horečka
- cítit se unaveně
- bolest
- nevolnost
- bolesti
- zvracení
- zimnice
- snížené hladiny steroidních hormonů (nedostatečnost nadledvin). K nedostatečnosti nadledvin dochází, když vaše nadledvinky nevytvářejí dostatek steroidních hormonů. To se může stát, když přestanete užívat perorální kortikosteroidy (jako je prednison) a začnete užívat lék obsahující inhalační steroid (jako je nosní sprej FLONASE). Příznaky adrenální insuficience mohou zahrnovat:
- cítit se unaveně
- nedostatek energie
- slabost
- nevolnost a zvracení
- nízký krevní tlak
- zpomalený růst u dětí. Růst dítěte by měl být často kontrolován.
Mezi nejčastější vedlejší účinky přípravku FLONASE nosní sprej 50 mcg patří:
- bolest hlavy
- nevolnost a zvracení
- bolest krku
- potíže s dýcháním
- krvácení z nosu
- kašel
- pálení nebo svědění nosu
Informujte svého poskytovatele zdravotní péče o jakémkoli nežádoucím účinku, který vás obtěžuje nebo nezmizí.
To nejsou všechny vedlejší účinky nosního spreje FLONASE. Požádejte svého poskytovatele zdravotní péče nebo lékárníka o další informace.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám uchovávat FLONASE nosní sprej 50 mcg?
- Skladujte FLONASE mezi 39°F a 86°F (4°C a 30°C).
Uchovávejte FLONASE nosní sprej 50 mcg a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a účinném používání nosního spreje FLONASE.
Léky jsou někdy předepisovány pro účely, které nejsou uvedeny v příbalové informaci pro pacienty. Nepoužívejte FLONASE nosní sprej pro stav, pro který nebyl předepsán. Nedávejte svůj nosní sprej FLONASE jiným lidem, i když mají stejný stav jako vy. Může jim to ublížit.
Tento leták s informacemi pro pacienty shrnuje nejdůležitější informace o nosním spreji FLONASE. Pokud chcete další informace, promluvte si se svým poskytovatelem zdravotní péče. Můžete požádat svého lékárníka nebo poskytovatele zdravotní péče o informace o nosním spreji FLONASE, který byl napsán pro zdravotnické pracovníky.
Další informace o nosním spreji FLONASE získáte na telefonním čísle 1-888-825-5249.
Jaké jsou složky FLONASE nosního spreje 50 mcg?
Účinná látka: flutikason propionát.
Neaktivní složky: mikrokrystalická celulóza, sodná sůl karboxymethylcelulózy, dextróza, 0,02 % w/w benzalkoniumchlorid, polysorbát 80 a 0,25 % w/w fenylethylalkohol.
Návod k použití
FLONASE® [flow'naz] (flutikason propionát) nosní sprej, 50 mcg
FLONASE nosní sprej 50 mcg je určen pouze pro použití do nosu.
Než začnete používat nosní sprej FLONASE, přečtěte si tyto informace.
Části vašeho nosního spreje FLONASE (Viz obrázek A)
Obrázek A 
Váš FLONASE nosní sprej 50 mcg musí být prostříknut před prvním použitím a pokud jste jej nepoužívali týden nebo déle.
Jak nastříkat nosní sprej FLONASE
- Jemně zatřeste lahvičkou a poté sejměte protiprachový kryt (viz obrázek B).
Obrázek B 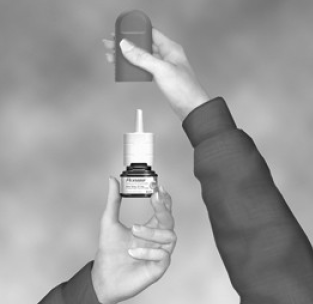
- Držte lahvičku podle obrázku (viz obrázek C) tak, aby nosní aplikátor směřoval od vás a ukazováček a prostředník na obou stranách nosního aplikátoru a palec pod lahvičkou.
- Stiskněte a uvolněte 6krát, dokud se neobjeví jemný sprej (viz obrázek C). Čerpadlo je nyní připraveno k použití.
Obrázek C 
Použití nosního spreje FLONASE:
Krok 1 . Vysmrkejte se, abyste si pročistili nosní dírky.
Krok 2 . Uzavřete 1 nosní dírku. Mírně předkloňte hlavu a držte lahvičku ve vzpřímené poloze a opatrně zasuňte nosní aplikátor do druhé nosní dírky (viz obrázek D).
Obrázek D 
Krok 3 Začněte se nadechovat nosem a při vdechování 1x pevně a rychle zatlačte na aplikátor, aby se sprej uvolnil. Chcete-li získat celou dávku, použijte ke stříkání ukazováček a prostředníček a přitom podepřete dno lahvičky palcem. Vyhněte se stříkání do očí. Jemně se nadechněte nosní dírkou (viz obrázek E).
Obrázek E 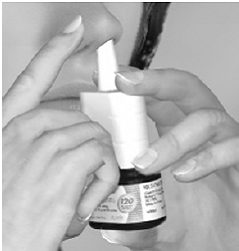
Krok 4 . Vydechněte ústy.
Krok 5 . Je-li vyžadováno druhé vstříknutí do této nosní dírky, opakujte kroky 2 až 4.
Krok 6 . Opakujte kroky 2 až 5 v druhé nosní dírce.
Krok 7 . Otřete nosní aplikátor čistou utěrkou a nasaďte protiprachový kryt (viz obrázek F).
Obrázek F 
Nepoužívejte tuto lahvičku na více, než je uvedený počet vstřiků, i když lahvička není zcela prázdná. Než láhev vyhodíte, měli byste si promluvit se svým poskytovatelem zdravotní péče, abyste zjistili, zda je potřeba doplnit. Neužívejte další dávky ani nepřestávejte užívat FLONASE nosní sprej 50 mcg, aniž byste se poradili se svým poskytovatelem zdravotní péče.
Čištění nosního spreje FLONASE:
Váš nosní sprej by měl být čištěn alespoň jednou týdně.
1. Odstraňte protiprachový kryt a poté jemným tahem nahoru uvolněte nosní aplikátor.
2. Omyjte aplikátor a protiprachový kryt pod teplou vodou z vodovodu. Nechte uschnout při pokojové teplotě.
3. Nasaďte aplikátor a protiprachový kryt zpět na lahvičku.
4. Pokud dojde k ucpání nosního aplikátoru, lze jej vyjmout a nechat namočit v teplé vodě. Opláchněte nosní aplikátor studenou vodou z vodovodu. Osušte nosní aplikátor a umístěte jej zpět na lahvičku. Nepokoušejte se odblokovat nosní aplikátor vložením špendlíku nebo jiného ostrého předmětu.
Uchovávání nosního spreje FLONASE:
- Skladujte FLONASE nosní sprej 50 mcg mezi 39 °F a 86 °F (4 °C a 30 °C).
- Nepoužívejte nosní sprej FLONASE po datu uvedeném jako „EXP“ na štítku nebo krabici.
