Léčba diabetu: Glucophage 500mg, 850mg, 1000mg Metformin Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Glucophage a jak se používá?
Glucophage je lék na předpis používaný k léčbě ke zlepšení kontroly hladiny cukru v krvi u dospělých s diabetes mellitus 2. typu. Glucophage lze užívat samostatně nebo s jinými léky.
Glucophage 850 mg patří do skupiny léků nazývaných antidiabetika.
Není známo, zda je Glucophage bezpečný a účinný u dětí mladších 10 let.
Jaké jsou možné vedlejší účinky Glucophage?
- neobvyklá bolest svalů,
- cítit zimu,
- potíže s dýcháním,
- pocit závratě nebo točení hlavy,
- únava,
- slabost,
- bolest břicha,
- zvracení a
- pomalý nebo nepravidelný srdeční tep
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky Glucophage patří:
- nízká hladina cukru v krvi,
- nevolnost,
- podrážděný žaludek a
- průjem
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Glucophage. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
MLÉČNÁ ACIDÓZA
Postmarketingové případy laktátové acidózy spojené s metforminem vedly k úmrtí, hypotermii, hypotenzi a rezistentním bradyarytmiím. Nástup laktátové acidózy související s metforminem je často nenápadný, doprovázený pouze nespecifickými příznaky, jako je malátnost, myalgie, respirační tíseň, ospalost a bolest břicha. Laktátová acidóza spojená s metforminem byla charakterizována zvýšenými hladinami laktátu v krvi (>5 mmol/litr), acidózou aniontové mezery (bez známek ketonurie nebo ketonémie), zvýšeným poměrem laktát/pyruvát; a plazmatické hladiny metforminu obecně > 5 mcg/ml (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ).
Rizikové faktory pro laktátovou acidózu spojenou s metforminem zahrnují poškození ledvin, současné užívání určitých léků (např. inhibitory karboanhydrázy, jako je topiramát), věk 65 let nebo více, radiologické vyšetření s kontrastem, chirurgický zákrok a další postupy, hypoxické stavy (např. akutní městnavé srdeční selhání), nadměrný příjem alkoholu a poškození jater.
Jsou uvedeny kroky ke snížení rizika a zvládnutí laktátové acidózy spojené s metforminem u těchto vysoce rizikových skupin (viz DÁVKOVÁNÍ A PODÁVÁNÍ, KONTRAINDIKACE, VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ).
Pokud je podezření na laktátovou acidózu spojenou s metforminem, okamžitě přerušte léčbu přípravkem GLUCOPHAGE nebo GLUCOPHAGE XR a zaveďte obecná podpůrná opatření v nemocničním prostředí. Doporučuje se rychlá hemodialýza (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ).
POPIS
GLUCOPHAGE/GLUCOPHAGE 500 mg XR obsahuje antihyperglykemikum metformin, což je biguanid, ve formě monohydrochloridu. Chemický název hydrochloridu metforminu je hydrochlorid N,N-dimethylimidodikarbonimidového diamidu. Strukturní vzorec je uveden níže:
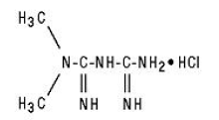
Metformin hydrochlorid je bílá až téměř bílá krystalická sloučenina s molekulovým vzorcem C4H11N5 • HCl a molekulovou hmotností 165,63. Je volně rozpustný ve vodě a je prakticky nerozpustný v acetonu, etheru a chloroformu. pKa metforminu je 12,4. pH 1% vodného roztoku hydrochloridu metforminu je 6,68.
Tablety GLUCOPHAGE obsahují 500 mg, 850 mg nebo 1 000 mg metformin hydrochloridu, což odpovídá 389,93 mg, 662,88 mg, 779,86 mg metforminové báze. Každá tableta obsahuje neaktivní složky povidon a magnesium-stearát. Kromě toho potah pro 500 mg a 850 mg tablety obsahuje hypromelózu a potah pro 1000 mg tablety obsahuje hypromelózu a polyethylenglykol.
GLUCOPHAGE 500 mg XR obsahuje 500 mg nebo 750 mg metformin hydrochloridu, což odpovídá 389,93 mg, resp. 584,90 mg metforminové báze.
Tablety GLUCOPHAGE XR 500 mg obsahují neaktivní složky hypromelózu, mikrokrystalickou celulózu, sodnou sůl karboxymethylcelulózy a stearát hořečnatý.
Tablety GLUCOPHAGE 850 mg XR 750 mg obsahují neaktivní složky hypromelózu, sodnou sůl karboxymethylcelulózy, stearát hořečnatý a červený pigment oxidu železa.
INDIKACE
GLUCOPHAGE 850 mg je indikován jako doplněk diety a cvičení ke zlepšení kontroly glykémie u dospělých a dětských pacientů ve věku 10 let a starších s diabetes mellitus 2. typu.
GLUCOPHAGE XR je indikován jako doplněk diety a cvičení ke zlepšení kontroly glykémie u dospělých s diabetes mellitus 2. typu.
DÁVKOVÁNÍ A PODÁVÁNÍ
Dávkování pro dospělé
Glukofág
- Doporučená počáteční dávka přípravku GLUCOPHAGE 850 mg je 500 mg perorálně dvakrát denně nebo 850 mg jednou denně s jídlem.
- Zvyšujte dávku o 500 mg týdně nebo 850 mg každé 2 týdny na základě kontroly glykémie a snášenlivosti až do maximální dávky 2550 mg denně, podávané v rozdělených dávkách.
- Dávky nad 2000 mg mohou být lépe snášeny podávané 3krát denně s jídlem.
Glucophage XR
- Tablety GLUCOPHAGE XR spolkněte celé a nikdy je nedrťte, nekrájejte ani nežvýkejte.
- Doporučená počáteční dávka přípravku GLUCOPHAGE XR je 500 mg perorálně jednou denně s večerním jídlem.
- Dávku zvyšujte po 500 mg týdně na základě kontroly glykémie a snášenlivosti až na maximálně 2000 mg jednou denně s večerním jídlem.
- Pokud není dosaženo kontroly glykémie pomocí GLUCOPHAGE XR 2000 mg jednou denně, zvažte zkušební verzi GLUCOPHAGE 850 mg XR 1000 mg dvakrát denně. Pokud jsou nutné vyšší dávky, přejděte na GLUCOPHAGE 500 mg v celkových denních dávkách až 2550 mg podávaných v rozdělených denních dávkách, jak je popsáno výše.
- Pacienti užívající GLUCOPHAGE 1000 mg mohou být převedeni na GLUCOPHAGE 850 mg XR jednou denně ve stejné celkové denní dávce až do 2000 mg jednou denně.
Pediatrické dávkování pro Glucophage
- Doporučená počáteční dávka přípravku GLUCOPHAGE 850 mg pro pediatrické pacienty ve věku 10 let a starší je 500 mg perorálně dvakrát denně, podávaná s jídlem.
- Dávkování zvyšujte o 500 mg týdně na základě kontroly glykémie a snášenlivosti až na maximum 2000 mg denně, podávaných v rozdělených dávkách dvakrát denně.
Doporučení pro použití při poškození ledvin
- Před zahájením léčby GLUCOPHAGE/GLUCOPHAGE 500 mg XR a poté v pravidelných intervalech vyhodnoťte funkci ledvin.
- GLUCOPHAGE/GLUCOPHAGE 500 mg XR je kontraindikován u pacientů s odhadovanou rychlostí glomerulární filtrace (eGFR) pod 30 ml/min/1,73 m2.
- Zahájení GLUCOPHAGE/GLUCOPHAGE 850 mg XR u pacientů s eGFR mezi 30 – 45 ml/min/1,73 m2 se nedoporučuje.
- U pacientů užívajících GLUCOPHAGE/GLUCOPHAGE 1000 mg XR, jejichž eGFR později klesne pod 45 ml/min/1,73 m2, zhodnoťte přínos a riziko pokračování léčby.
- Pokud eGFR pacienta později klesne pod 30 ml/min/1,73 m2, přerušte podávání GLUCOPHAGE/GLUCOPHAGE 1000 mg XR [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Ukončení pro jodované kontrastní zobrazovací postupy
Přerušte GLUCOPHAGE/GLUCOPHAGE XR v době nebo před vyšetřením jodovaným kontrastem u pacientů s eGFR mezi 30 a 60 ml/min/1,73 m2; u pacientů s onemocněním jater, alkoholismem nebo srdečním selháním v anamnéze; nebo u pacientů, kterým bude podáván intraarteriální jodovaný kontrast. Znovu vyhodnoťte eGFR 48 hodin po zobrazovacím postupu; restartujte GLUCOPHAGE/GLUCOPHAGE XR, pokud je funkce ledvin stabilní.
JAK DODÁVÁNO
Dávkové formy A Síly
GLUCOPHAGE 850 mg je dostupný jako:
- Tablety: 500 mg kulaté, bílé až téměř bílé potahované tablety s vyraženým „BMS 6060“ po obvodu na jedné straně a „500“ vyraženým přes lícní stranu druhé strany.
- Tablety: 850 mg kulaté, bílé až téměř bílé potahované tablety s vyraženým „BMS 6070“ po obvodu na jedné straně a „850“ vyraženým přes lícní stranu druhé strany.
- Tablety: 1000 mg bílé, oválné, bikonvexní, potahované s „BMS 6071“ s vyraženým na jedné straně a „1000“ s vyraženým na opačné straně as půlící rýhou na obou stranách.
GLUCOPHAGE XR je k dispozici jako:
- Tablety s prodlouženým uvolňováním: 500 mg bílé až téměř bílé, bikonvexní ve tvaru tobolky, s vyraženým „BMS 6063“ na jedné straně a „500“ na druhé straně.
- Tablety s prodlouženým uvolňováním: 750 mg světle červené a mohou mít skvrnitý vzhled, ve tvaru tobolky, bikonvexní, s vyraženým „BMS 6064“ na jedné straně a „750“ na druhé straně.
Skladování A Manipulace
Úložný prostor
Skladujte při 20°–25°C (68°–77°F); povoleny výchylky do 15°–30°C (59°–86°F). [Viz USP Regulovaná pokojová teplota.]
Dávkujte v nádobách odolných vůči světlu.
Distribuce: Bristol-Myers Squibb Company Princeton, NJ 08543 USA. Revize: květen 2018.
VEDLEJŠÍ EFEKTY
Následující nežádoucí účinky jsou také diskutovány jinde v označení:
- Laktátová acidóza [viz BOX VAROVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Nedostatek vitaminu B12 [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hypoglykémie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Glukofág
V americké klinické studii GLUCOPHAGE 850 mg u pacientů s diabetes mellitus 2. typu dostávalo celkem 141 pacientů GLUCOPHAGE 1000 mg až 2550 mg denně. Nežádoucí účinky hlášené u více než 5 % pacientů léčených přípravkem GLUCOPHAGE 500 mg, které byly častější než u pacientů léčených placebem, jsou uvedeny v tabulce 1.
Průjem vedl k vysazení GLUCOPHAGE 500 mg u 6 % pacientů. Kromě toho byly následující nežádoucí účinky hlášeny u ≥ 1 % až ≤ 5 % pacientů léčených přípravkem GLUCOPHAGE a byly častěji hlášeny u přípravku GLUCOPHAGE než u placeba: abnormální stolice, hypoglykémie, myalgie, závratě, dušnost, porucha nehtů, vyrážka, zvýšené pocení, chuť porucha, nepohodlí na hrudi, zimnice, chřipkový syndrom, návaly horka, bušení srdce.
V klinických studiích GLUCOPHAGE 500 mg trvajících 29 týdnů bylo u přibližně 7 % pacientů pozorováno snížení na podnormální hladiny dříve normálních sérových hladin vitaminu B12.
Pediatričtí pacienti
klinických studiích s GLUCOPHAGE u pediatrických pacientů s diabetes mellitus 2. typu byl profil nežádoucích účinků podobný jako u dospělých.
Glucopage XR
V placebem kontrolovaných studiích byl 781 pacientům podáván GLUCOPHAGE 1000 mg XR. Nežádoucí účinky hlášené u více než 5 % pacientů s GLUCOPHAGE 850 mg XR a které byly častější u pacientů léčených GLUCOPHAGE XR než u pacientů léčených placebem, jsou uvedeny v tabulce 2.
Průjem vedl k vysazení GLUCOPHAGE XR u 0,6 % pacientů. Kromě toho byly následující nežádoucí účinky hlášeny u ≥1,0 % až ≤5,0 % pacientů s GLUCOPHAGE XR a byly častěji hlášeny u GLUCOPHAGE XR než u placeba: bolest břicha, zácpa, distenzivní břicho, dyspepsie/pálení žáhy, plynatost, závratě, bolest hlavy, horní respirační infekce, poruchy chuti.
Postmarketingové zkušenosti
Během postregistračního užívání metforminu byly zjištěny následující nežádoucí účinky. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Po uvedení metforminu na trh bylo hlášeno cholestatické, hepatocelulární a smíšené hepatocelulární poškození jater.
DROGOVÉ INTERAKCE
Tabulka 3 uvádí klinicky významné lékové interakce s GLUCOPHAGE/GLUCOPHAGE XR.
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Laktátová acidóza
Po uvedení přípravku na trh se vyskytly případy laktátové acidózy spojené s metforminem, včetně fatálních případů. Tyto případy měly nenápadný začátek a byly doprovázeny nespecifickými příznaky, jako je malátnost, myalgie, bolesti břicha, dýchací potíže nebo zvýšená somnolence; při těžké acidóze se však objevila hypotenze a rezistentní bradyarytmie. Laktátová acidóza spojená s metforminem byla charakterizována zvýšenými koncentracemi laktátu v krvi (>5 mmol/l), acidózou aniontové mezery (bez známek ketonurie nebo ketonémie) a zvýšeným poměrem laktát:pyruvát; plazmatické hladiny metforminu byly obecně >5 mcg/ml. Metformin snižuje vychytávání laktátu játry, což zvyšuje hladiny laktátu v krvi, což může zvýšit riziko laktátové acidózy, zejména u rizikových pacientů.
Pokud je podezření na laktátovou acidózu spojenou s metforminem, je třeba okamžitě zahájit obecná podpůrná opatření v nemocničním prostředí spolu s okamžitým přerušením léčby přípravkem GLUCOPHAGE/GLUCOPHAGE 500 mg XR. U pacientů léčených přípravkem GLUCOPHAGE/GLUCOPHAGE XR s diagnózou nebo silným podezřením na laktátovou acidózu se doporučuje rychlá hemodialýza ke korekci acidózy a odstranění nahromaděného metforminu (metformin hydrochlorid je za dobrých hemodynamických podmínek dialyzovatelný s clearance až 170 ml/min). Hemodialýza často vedla ke zvrácení příznaků a uzdravení.
Poučte pacienty a jejich rodiny o příznacích laktátové acidózy, a pokud se tyto příznaky objeví, poučte je, aby GLUCOPHAGE/GLUCOPHAGE 1000mg XR přestali užívat a oznámili tyto příznaky svému poskytovateli zdravotní péče.
Pro každý ze známých a možných rizikových faktorů laktátové acidózy související s metforminem jsou níže uvedena doporučení pro snížení rizika a léčbu laktátové acidózy související s metforminem:
- Porucha funkce ledvin – Případy laktátové acidózy spojené s metforminem po uvedení na trh se primárně vyskytovaly u pacientů s významnou poruchou funkce ledvin.
Riziko akumulace metforminu a laktátové acidózy související s metforminem se zvyšuje se závažností poškození ledvin, protože metformin je v podstatě vylučován ledvinami. Klinická doporučení založená na renální funkci pacienta zahrnují [viz DÁVKOVÁNÍ A PODÁVÁNÍ , KLINICKÁ FARMAKOLOGIE ]:
- Před zahájením XR GLUCOPHAGE/GLUCOPHAGE 850 mg zjistěte odhadovanou rychlost glomerulární filtrace (eGFR).
- GLUCOPHAGE/GLUCOPHAGE XR je kontraindikován u pacientů s eGFR nižším než 30 ml/min/1,73 m2 [viz KONTRAINDIKACE ].
- Zahájení GLUCOPHAGE/GLUCOPHAGE XR se nedoporučuje u pacientů s eGFR mezi 30-45 ml/min/1,73 m2.
- Získejte eGFR alespoň jednou ročně u všech pacientů užívajících GLUCOPHAGE/GLUCOPHAGE 1000 mg XR. U pacientů s rizikem rozvoje poruchy funkce ledvin (např. u starších osob) by měla být funkce ledvin hodnocena častěji.
- pacientů užívajících GLUCOPHAGE/GLUCOPHAGE 500 mg XR, jejichž eGFR klesne pod 45 ml/min/1,73 m2, zhodnoťte přínos a riziko pokračování léčby.
- Lékové interakce — Současné užívání přípravku GLUCOPHAGE/GLUCOPHAGE XR se specifickými léky může zvýšit riziko laktátové acidózy spojené s metforminem: ty, které zhoršují funkci ledvin, vedou k významným hemodynamickým změnám, interferují s acidobazickou rovnováhou nebo zvyšují akumulaci metforminu. Zvažte častější sledování pacientů.
- Věk 65 let a více — Riziko laktátové acidózy spojené s metforminem se zvyšuje s věkem pacienta, protože starší pacienti mají větší pravděpodobnost poškození jater, ledvin nebo srdce než mladší pacienti. U starších pacientů hodnotit funkci ledvin častěji.
- Radiologické studie s kontrastem — Podání intravaskulárních jodovaných kontrastních látek u pacientů léčených metforminem vedlo k akutnímu poklesu renálních funkcí a výskytu laktátové acidózy. Zastavte GLUCOPHAGE/GLUCOPHAGE XR v době vyšetření jodovaným kontrastem nebo před ním u pacientů s eGFR mezi 30 a 60 ml/min/1,73 m2; u pacientů s poruchou funkce jater, alkoholismem nebo srdečním selháním v anamnéze; nebo u pacientů, kterým bude podáván intraarteriální jodovaný kontrast. Znovu vyhodnoťte eGFR 48 hodin po zobrazovacím postupu a restartujte GLUCOPHAGE/GLUCOPHAGE XR, pokud je funkce ledvin stabilní.
- Chirurgie a jiné výkony — Odepření jídla a tekutin během chirurgických nebo jiných výkonů může zvýšit riziko objemové deplece, hypotenze a poškození ledvin. GLUCOPHAGE/GLUCOPHAGE XR by měl být dočasně přerušen, pokud mají pacienti omezený příjem potravy a tekutin.
- Hypoxické stavy — Několik postmarketingových případů laktátové acidózy spojené s metforminem se vyskytlo na pozadí akutního městnavého srdečního selhání (zejména když bylo doprovázeno hypoperfuzí a hypoxémií). Kardiovaskulární kolaps (šok), akutní infarkt myokardu, sepse a další stavy spojené s hypoxémií byly spojeny s laktátovou acidózou a mohou způsobit prerenální azotemii. Pokud k takové příhodě dojde, přerušte podávání přípravku GLUCOPHAGE/GLUCOPHAGE 1000 mg XR.
- Nadměrný příjem alkoholu — Alkohol zesiluje účinek metforminu na metabolismus laktátu. Pacienti by měli být varováni před nadměrným příjmem alkoholu během užívání přípravku GLUCOPHAGE/GLUCOPHAGE XR.
- Porucha funkce jater — U pacientů s poruchou funkce jater se vyvinuly případy laktátové acidózy související s metforminem. To může být způsobeno poruchou clearance laktátu, která má za následek vyšší hladiny laktátu v krvi. Proto se vyhněte použití přípravku GLUCOPHAGE/GLUCOPHAGE XR u pacientů s klinickým nebo laboratorním průkazem onemocnění jater.
Nedostatek vitaminu B12
V klinických studiích GLUCOPHAGE 1000 mg trvajících 29 týdnů bylo u přibližně 7 % pacientů pozorováno snížení na podnormální hladiny dříve normálních sérových hladin vitaminu B12. Takový pokles, pravděpodobně v důsledku interference s absorpcí B12 z komplexu B12-vnitřní faktor, může být spojen s anémií, ale zdá se, že je rychle reverzibilní po přerušení podávání GLUCOPHAGE nebo vitaminu B12. Zdá se, že někteří jedinci (ti s nedostatečným příjmem nebo vstřebáváním vitaminu B12 nebo vápníku) jsou náchylní k rozvoji subnormálních hladin vitaminu B12. Měřte hematologické parametry na roční bázi a vitamin B12 ve 2 až 3letých intervalech u pacientů na GLUCOPHAGE/GLUCOPHAGE 500mg XR a zvládejte jakékoli abnormality [viz NEŽÁDOUCÍ REAKCE ].
Hypoglykémie při současném užívání s inzulínem a inzulínem
Sekretagogové
Je známo, že inzulín a sekretagogy inzulínu (např. sulfonylmočovina) způsobují hypoglykémii. GLUCOPHAGE/GLUCOPHAGE XR může zvýšit riziko hypoglykémie v kombinaci s inzulínem a/nebo sekretagogem inzulínu. Proto může být zapotřebí nižší dávka inzulínu nebo sekretagogu inzulínu, aby se minimalizovalo riziko hypoglykémie při použití v kombinaci s GLUCOPHAGE/GLUCOPHAGE XR [viz DROGOVÉ INTERAKCE ].
Makrovaskulární výsledky
Nebyly provedeny žádné klinické studie prokazující přesvědčivé důkazy o snížení makrovaskulárního rizika u přípravku GLUCOPHAGE/GLUCOPHAGE 850 mg XR.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( INFORMACE PRO PACIENTA ).
Laktátová acidóza
Vysvětlete rizika laktátové acidózy, její příznaky a stavy, které predisponují k jejímu rozvoji. Informujte pacienty, aby okamžitě přerušili léčbu přípravkem GLUCOPHAGE/GLUCOPHAGE XR a neprodleně informovali svého poskytovatele zdravotní péče, pokud se objeví nevysvětlitelná hyperventilace, myalgie, malátnost, neobvyklá somnolence nebo jiné nespecifické příznaky. Poraďte pacienty před nadměrným příjmem alkoholu a informujte pacienty o důležitosti pravidelného testování funkce ledvin při užívání GLUCOPHAGE/GLUCOPHAGE XR. Poučte pacienty, aby informovali svého lékaře, že užívají GLUCOPHAGE/GLUCOPHAGE 500 mg XR před jakýmkoli chirurgickým nebo radiologickým výkonem, protože může být nutné dočasné přerušení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Hypoglykémie
Informujte pacienty, že při současném podávání přípravku GLUCOPHAGE/GLUCOPHAGE XR s perorálními deriváty sulfonylmočoviny a inzulínem může dojít k hypoglykémii. Vysvětlete pacientům, kteří dostávají souběžnou léčbu, rizika hypoglykémie, její příznaky a léčbu a stavy, které predisponují k jejímu rozvoji [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Nedostatek vitaminu B12
Informujte pacienty o důležitosti pravidelných hematologických parametrů při užívání GLUCOPHAGE/GLUCOPHAGE XR [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Ženy v reprodukčním věku
Informujte ženy, že léčba přípravkem GLUCOPHAGE/GLUCOPHAGE XR může u některých premenopauzálních žen s anovulací vést k ovulaci, což může vést k nechtěnému těhotenství (viz Použití u konkrétních populací ].
Informace o podávání Glucophage XR
Informujte pacienty, že GLUCOPHAGE 500mg XR se musí polykat celý a nedrtit, krájet nebo žvýkat a že neaktivní složky mohou být příležitostně vyloučeny stolicí jako měkká hmota, která může připomínat původní tabletu.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Dlouhodobé studie karcinogenity byly provedeny na potkanech (doba podávání 104 týdnů) a myších (doba podávání 91 týdnů) v dávkách až 900 mg/kg/den včetně a 1500 mg/kg/den v uvedeném pořadí. Obě tyto dávky jsou přibližně trojnásobkem maximální doporučené denní dávky pro člověka 2550 mg na základě srovnání plochy povrchu těla. U samců ani samic myší nebyl nalezen žádný důkaz karcinogenity metforminu. Podobně nebyl u samců potkanů pozorován žádný tumorogenní potenciál u metforminu. U samic potkanů léčených dávkou 900 mg/kg/den však byl zvýšený výskyt benigních stromálních děložních polypů.
V následujících testech in vitro nebyl prokázán mutagenní potenciál metforminu: Amesův test (S. typhimurium), test genových mutací (buňky myšího lymfomu) nebo test chromozomálních aberací (lidské lymfocyty). Výsledky in vivo mikronukleárního testu na myších byly také negativní.
Fertilitu samců nebo samic potkanů neovlivnil metformin při podávání v dávkách až 600 mg/kg/den, což je přibližně dvojnásobek maximální doporučené denní dávky pro člověka 2550 mg na základě srovnání plochy povrchu těla.
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
Omezené údaje o GLUCOPHAGE/GLUCOPHAGE XR u těhotných žen nejsou dostatečné pro stanovení rizika závažných vrozených vad nebo potratu spojeného s užíváním léků. Publikované studie s užíváním metforminu během těhotenství neuvádějí jasnou souvislost s metforminem a závažnou vrozenou vadou nebo rizikem potratu (viz Data ]. Existují rizika pro matku a plod spojená se špatně kontrolovaným diabetes mellitus v těhotenství [viz Klinické úvahy ].
Nebyly pozorovány žádné nepříznivé vývojové účinky, když byl metformin podáván březím potkanům Sprague Dawley a králíkům během období organogeneze v dávkách až 2- a 5násobných, v daném pořadí, než je klinická dávka 2 550 mg, na základě tělesného povrchu [viz Data ].
Odhadované základní riziko závažných vrozených vad je 6–10 % u žen s pregestačním diabetes mellitus s HbA1C >7 a bylo hlášeno až 20–25 % u žen s HbA1C >10. Odhadované základní riziko potratu pro indikovanou populaci není známo. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2–4 % a 15–20 %.
Klinické úvahy
Mateřské a/nebo embryo/fetální riziko spojené s onemocněním
Špatně kontrolovaný diabetes mellitus v těhotenství zvyšuje u matky riziko diabetické ketoacidózy, preeklampsie, spontánních potratů, předčasného porodu, mrtvého porodu a porodních komplikací. Špatně kontrolovaný diabetes mellitus zvyšuje u plodu riziko závažných vrozených vad, mrtvě narozených dětí a morbidity související s makrosomií.
Data
Lidská data
Publikované údaje z postmarketingových studií neuvádějí jasnou souvislost s metforminem a závažnými vrozenými vadami, potratem nebo nepříznivými důsledky pro matku nebo plod, pokud byl metformin užíván během těhotenství. Tyto studie však nemohou jednoznačně prokázat absenci jakéhokoli rizika spojeného s metforminem kvůli metodickým omezením, včetně malé velikosti vzorku a nekonzistentních srovnávacích skupin.
Údaje o zvířatech
Metformin hydrochlorid neměl nepříznivý vliv na výsledky vývoje, když byl podáván březím potkanům a králíkům v dávkách až 600 mg/kg/den. To představuje expozici přibližně 2 a 5násobku klinické dávky 2550 mg na základě srovnání plochy povrchu těla u potkanů a králíků, v daném pořadí. Stanovení fetálních koncentrací prokázalo částečnou placentární bariéru vůči metforminu.
Laktace
Shrnutí rizik
Omezené publikované studie uvádějí, že metformin je přítomen v lidském mléce [viz Data ]. Neexistují však dostatečné informace ke stanovení účinků metforminu na kojené dítě a žádné dostupné informace o účincích metforminu na produkci mléka. Proto je třeba zvážit vývojové a zdravotní přínosy kojení spolu s klinickou potřebou matky GLUCOPHAGE/GLUCOPHAGE 500 mg XR a případnými nežádoucími účinky na kojené dítě z GLUCOPHAGE/GLUCOPHAGE 850 mg XR nebo ze základního onemocnění matky.
Data
Publikované klinické studie laktace uvádějí, že metformin je přítomen v lidském mléce, což vedlo k dávkám kojenců přibližně 0,11 % až 1 % dávky upravené podle hmotnosti matky a poměr mléko/plazma v rozmezí 0,13 až 1. Studie však nebyly navrženy tak, aby definitivně stanovit riziko užívání metforminu během kojení kvůli malé velikosti vzorku a omezeným údajům o nežádoucích účincích shromážděných u kojenců.
Ženy a muži reprodukčního potenciálu
Diskutujte o možnosti nechtěného těhotenství u premenopauzálních žen, protože léčba přípravkem GLUCOPHAGE/GLUCOPHAGE XR může u některých žen s anovulací vést k ovulaci.
Pediatrické použití
Glukofág
Bezpečnost a účinnost přípravku GLUCOPHAGE pro léčbu diabetes mellitus 2. typu byla stanovena u pediatrických pacientů ve věku 10 až 16 let. Bezpečnost a účinnost přípravku GLUCOPHAGE nebyla stanovena u pediatrických pacientů mladších 10 let.
Použití přípravku GLUCOPHAGE 850 mg u pediatrických pacientů ve věku 10 až 16 let k léčbě diabetes mellitus 2. typu je podpořeno důkazy z adekvátních a dobře kontrolovaných studií přípravku GLUCOPHAGE u dospělých s dalšími údaji z kontrolované klinické studie u pediatrických pacientů ve věku 10 až 16 let staří s diabetes mellitus 2. typu, který prokázal podobnou odpověď v glykemické kontrole jako u dospělých [viz Klinické studie ]. V této studii byly nežádoucí účinky podobné těm, které byly popsány u dospělých. Doporučuje se maximální denní dávka 2000 mg GLUCOPHAGE 1000 mg. [Vidět DÁVKOVÁNÍ A PODÁVÁNÍ .]
Glucophage 1000 mg XR
Bezpečnost a účinnost přípravku GLUCOPHAGE XR u pediatrických pacientů nebyla stanovena.
Geriatrické použití
Kontrolované klinické studie GLUCOPHAGE/GLUCOPHAGE XR nezahrnovaly dostatečný počet starších pacientů, aby bylo možné určit, zda reagují odlišně od mladších pacientů. Obecně platí, že výběr dávky pro staršího pacienta by měl být opatrný, obvykle začíná na spodní hranici dávkovacího rozmezí, což odráží vyšší frekvenci snížené funkce jater, ledvin nebo srdce a souběžné onemocnění nebo jinou medikamentózní terapii a vyšší riziko laktátové acidózy. Hodnotit renální funkce častěji u starších pacientů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Renální poškození
Metformin je v podstatě vylučován ledvinami a riziko akumulace metforminu a laktátové acidózy se zvyšuje se stupněm poruchy funkce ledvin. GLUCOPHAGE/GLUCOPHAGE 850 mg XR je kontraindikován u těžkého poškození ledvin, u pacientů s odhadovanou rychlostí glomerulární filtrace (eGFR) pod 30 ml/min/1,73 m2 [viz DÁVKOVÁNÍ A PODÁVÁNÍ , KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , a KLINICKÁ FARMAKOLOGIE ].
Poškození jater
Použití metforminu u pacientů s poruchou funkce jater bylo spojeno s některými případy laktátové acidózy. GLUCOPHAGE/GLUCOPHAGE 500 mg XR se nedoporučuje u pacientů s poruchou funkce jater. [vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
PŘEDÁVKOVAT
Došlo k předávkování metformin hydrochloridem, včetně požití množství většího než 50 gramů. Hypoglykémie byla hlášena přibližně v 10 % případů, ale nebyla prokázána žádná kauzální souvislost s metforminem. Laktátová acidóza byla hlášena u přibližně 32 % případů předávkování metforminem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Metformin je za dobrých hemodynamických podmínek dialyzovatelný s clearance až 170 ml/min. Proto může být hemodialýza užitečná pro odstranění nahromaděného léku od pacientů, u kterých existuje podezření na předávkování metforminem.
KONTRAINDIKACE
GLUCOPHAGE 1000 mg a GLUCOPHAGE 850 mg XR jsou kontraindikovány u pacientů s:
- Těžké poškození ledvin (eGFR pod 30 ml/min/1,73 m2) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
- Hypersenzitivita na metformin.
- Akutní nebo chronická metabolická acidóza, včetně diabetické ketoacidózy, s kómatem nebo bez něj.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Metformin je antihyperglykemikum, které zlepšuje glukózovou toleranci u pacientů s diabetes mellitus 2. typu, snižuje bazální i postprandiální plazmatickou glukózu. Metformin snižuje produkci glukózy v játrech, snižuje střevní absorpci glukózy a zlepšuje citlivost na inzulín zvýšením periferního vychytávání a využití glukózy. Při léčbě metforminem zůstává sekrece inzulínu nezměněna, zatímco hladiny inzulínu nalačno a celodenní inzulínová odpověď v plazmě se mohou snížit.
Farmakokinetika
Vstřebávání
Absolutní biologická dostupnost tablety GLUCOPHAGE 500 mg podané nalačno je přibližně 50 % až 60 %. Studie používající jednotlivé perorální dávky GLUCOPHAGE 500 až 1 500 mg a 850 až 2 550 mg ukazují, že se zvyšujícími se dávkami chybí úměrnost dávky, což je způsobeno spíše sníženou absorpcí než změnou eliminace. Při obvyklých klinických dávkách a dávkovacích schématech přípravku GLUCOPHAGE je ustálených plazmatických koncentrací metforminu dosaženo během 24 až 48 hodin a jsou obecně
Po jednorázové perorální dávce přípravku GLUCOPHAGE 500 mg XR je Cmax dosaženo se střední hodnotou 7 hodin a rozmezím 4 až 8 hodin. Maximální plazmatické hladiny jsou přibližně o 20 % nižší ve srovnání se stejnou dávkou GLUCOPHAGE 1000 mg, avšak rozsah absorpce (měřeno pomocí AUC) je srovnatelný s GLUCOPHAGE.
ustáleném stavu jsou AUC a Cmax menší než úměrné dávce pro GLUCOPHAGE XR v rozmezí 500 až 2000 mg podávaných jednou denně. Maximální plazmatické hladiny jsou přibližně 0,6, 1,1, 1,4 a 1,8 mcg/ml pro dávky 500, 1000, 1500 a 2000 mg jednou denně. Rozsah absorpce metforminu (měřeno pomocí AUC) z GLUCOPHAGE 500 mg XR v dávce 2000 mg jednou denně je podobný stejné celkové denní dávce podávané jako tablety GLUCOPHAGE 850 mg 1000 mg dvakrát denně. Po opakovaném podání GLUCOPHAGE XR se metformin neakumuloval v plazmě.
Účinek jídla:
Jídlo snižuje rozsah absorpce a mírně zpomaluje absorpci metforminu, jak ukazuje přibližně o 40 % nižší průměrná maximální plazmatická koncentrace (Cmax), o 25 % nižší plocha pod křivkou plazmatické koncentrace v závislosti na čase (AUC) a 35- minutové prodloužení doby do dosažení maximální plazmatické koncentrace (Tmax) po podání jedné 850mg tablety GLUCOPHAGE s jídlem ve srovnání se stejnou silou tablety podané nalačno.
Přestože se rozsah absorpce metforminu (měřeno pomocí AUC) z tablety GLUCOPHAGE XR zvýšil přibližně o 50 %, když byl podáván s jídlem, jídlo nemělo žádný vliv na Cmax a Tmax metforminu. Jídla s vysokým i nízkým obsahem tuku měla stejný účinek na farmakokinetiku GLUCOPHAGE XR.
Rozdělení
Zdánlivý distribuční objem (V/F) metforminu po jednotlivých perorálních dávkách GLUCOPHAGE 850 mg byl v průměru 654 ± 358 l. Metformin se jen zanedbatelně váže na plazmatické proteiny. Metformin se rozděluje do erytrocytů, s největší pravděpodobností jako funkce času.
Metabolismus
Studie s intravenózní jednorázovou dávkou u zdravých jedinců prokázaly, že metformin je vylučován v nezměněné podobě močí a nepodléhá jaternímu metabolismu (u lidí nebyly identifikovány žádné metabolity) ani žlučové exkreci.
Odstranění
Renální clearance (viz tabulka 4) je přibližně 3,5krát vyšší než clearance kreatininu, což ukazuje, že tubulární sekrece je hlavní cestou eliminace metforminu. Po perorálním podání je přibližně 90 % absorbovaného léčiva eliminováno ledvinami během prvních 24 hodin, s poločasem plazmatické eliminace přibližně 6,2 hodin. V krvi je eliminační poločas přibližně 17,6 hodin, což naznačuje, že erytrocytární hmota může být distribučním kompartmentem.
Specifické populace
Renální poškození
U pacientů se sníženou funkcí ledvin je plazmatický a krevní poločas metforminu prodloužen a renální clearance je snížena (viz tabulka 3) [viz DÁVKOVÁNÍ A PODÁVÁNÍ , KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Poškození jater
U pacientů s poruchou funkce jater nebyly provedeny žádné farmakokinetické studie metforminu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Geriatrie
Omezené údaje z kontrolovaných farmakokinetických studií přípravku GLUCOPHAGE 1000 mg u zdravých starších subjektů naznačují, že celková plazmatická clearance metforminu je snížena, poločas je prodloužen a Cmax je zvýšena ve srovnání se zdravými mladými subjekty. Zdá se, že změna farmakokinetiky metforminu s věkem je primárně způsobena změnou funkce ledvin (viz tabulka 4). [Vidět VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Pediatrie
Po podání jedné perorální tablety GLUCOPHAGE 500 mg s jídlem se geometrický průměr Cmax a AUC metforminu lišil o méně než 5 % mezi pediatrickými pacienty s diabetem 2. typu (12-16 let věku) a zdravými dospělými osobami stejného pohlaví a hmotnosti (20- 45 let), všichni s normální funkcí ledvin.
Rod
Farmakokinetické parametry metforminu se významně nelišily mezi normálními subjekty a pacienty s diabetes mellitus 2. typu při analýze podle pohlaví (muži = 19, ženy = 16).
Závod
Nebyly provedeny žádné studie farmakokinetických parametrů metforminu podle rasy.
Lékové interakce
In vivo hodnocení lékových interakcí
Klinické studie
Glukofág
Klinické studie pro dospělé
Byla provedena dvojitě zaslepená, placebem kontrolovaná, multicentrická klinická studie v USA zahrnující obézní pacienty s diabetes mellitus 2. typu, jejichž hyperglykémie nebyla adekvátně kontrolována samotnou dietou (základní plazmatická hladina glukózy nalačno [FPG] přibližně 240 mg/dl). Pacienti byli léčeni přípravkem GLUCOPHAGE (až 2550 mg/den) nebo placebem po dobu 29 týdnů. Výsledky jsou uvedeny v tabulce 7.
Průměrná výchozí tělesná hmotnost byla 201 lb a 206 lb ve větvi GLUCOPHAGE 850 mg a placebo. Průměrná změna tělesné hmotnosti od výchozího stavu do týdne 29 byla -1,4 lb a -2,4 lb ve skupině GLUCOPHAGE 1000 mg a ve skupině s placebem. 29týdenní, dvojitě zaslepená, placebem kontrolovaná studie GLUCOPHAGE a glyburidu, samostatně a v kombinaci byla provedena u obézních pacientů s diabetes mellitus 2. typu, u kterých se nepodařilo dosáhnout adekvátní glykemické kontroly při maximálních dávkách glyburidu (výchozí FPG přibližně 250 mg/dl). Pacienti randomizovaní do kombinované větve zahájili léčbu přípravkem GLUCOPHAGE 500 mg a glyburidem 20 mg. Na konci každého týdne prvních 4 týdnů studie byla u těchto pacientů dávka GLUCOPHAGE 500 mg zvýšena o 500 mg, pokud se jim nepodařilo dosáhnout cílové plazmatické glukózy nalačno. Po 4. týdnu byly takové úpravy dávkování prováděny měsíčně, i když žádnému pacientovi nebylo povoleno překročit GLUCOPHAGE 2500 mg. Pacienti v rameni pouze s GLUCOPHAGE (metformin plus placebo) vysadili glyburid a dodržovali stejný titrační plán. Pacienti v rameni s glyburidem pokračovali ve stejné dávce glyburidu. Na konci studie přibližně 70 % pacientů v kombinované skupině užívalo GLUCOPHAGE 2000 mg/glyburid 20 mg nebo GLUCOPHAGE 2500 mg/glyburid 20 mg. Výsledky jsou uvedeny v tabulce 8.
Průměrná výchozí tělesná hmotnost byla 202 lb, 203 lb a 204 lb ve skupině GLUCOPHAGE/glyburid, glyburid a GLUCOPHAGE 500 mg. Průměrná změna tělesné hmotnosti od výchozího stavu do týdne 29 byla 0,9 lb, -0,7 lb a -8,4 lb ve skupině GLUCOPHAGE/glyburid, glyburid a GLUCOPHAGE 850 mg, v daném pořadí.
Pediatrické klinické studie
Dvojitě zaslepená, placebem kontrolovaná studie u pediatrických pacientů ve věku 10 až 16 let s diabetes mellitus 2. typu (průměrná hodnota FPG 182,2 mg/dl), léčba přípravkem GLUCOPHAGE (až 2000 mg/den) po dobu až 16 týdnů (průměrná doba trvání léčby 11 týdnů). Výsledky jsou uvedeny v tabulce 9.
Průměrná výchozí tělesná hmotnost byla 205 lb a 189 lb ve větvi GLUCOPHAGE 850 mg a placebo. Průměrná změna tělesné hmotnosti od výchozího stavu do týdne 16 byla -3,3 lb a -2,0 lb ve větvi GLUCOPHAGE 500 mg a placebo.
Glucophage XR
24týdenní, dvojitě zaslepená, placebem kontrolovaná studie GLUCOPHAGE 1000 mg XR užívaná jednou denně s večerním jídlem byla provedena u pacientů s diabetes mellitus 2. typu, u kterých se nepodařilo dosáhnout glykemické kontroly dietou a cvičením. Pacienti vstupující do studie měli průměrnou výchozí hodnotu HbA1c 8,0 % a průměrnou výchozí hodnotu FPG 176 mg/dl. Léčebná dávka byla zvýšena na 1500 mg jednou denně, pokud ve 12. týdnu bylo HbA1c ≥7,0 %, ale
16týdenní, dvojitě zaslepená, placebem kontrolovaná studie závislosti odpovědi na dávce přípravku GLUCOPHAGE 500 mg XR, užívaného jednou denně s večerním jídlem nebo dvakrát denně s jídlem, byla provedena u pacientů s diabetes mellitus 2. typu, u kterých se nepodařilo dosáhnout glykemie. kontrola pomocí diety a cvičení. Výsledky jsou uvedeny v tabulce 10.
Průměrná výchozí tělesná hmotnost byla 193 lb, 192 lb, 188 lb, 196 lb, 193 lb a 194 lb ve skupině GLUCOPHAGE XR 500 mg, 1000 mg, 1500 mg a 2000 mg jednou denně a placebo, 1x denně, 1 . Průměrná změna tělesné hmotnosti od výchozího stavu do týdne 16 byla -1,3 lb, -1,3 lb, -0,7 lb, -1,5 lb, -2,2 lb a -1,8 lb, v tomto pořadí.
U pacientů s diabetes mellitus 2. léčených přípravkem GLUCOPHAGE 500 mg dvakrát denně po dobu alespoň 8 týdnů před vstupem do studie. Výsledky jsou uvedeny v tabulce 11.
Průměrná výchozí tělesná hmotnost byla 210 lb, 203 lb a 193 lb ve skupině GLUCOPHAGE 500 mg dvakrát denně a GLUCOPHAGE XR 1000 mg a 1500 mg jednou denně. Průměrná změna tělesné hmotnosti od výchozího stavu do týdne 24 byla 0,9 lb, 1,1 lb a 0,9 lb, v daném pořadí.
INFORMACE PRO PACIENTA
GLUCOPHAGE® [gloo-ko-fahzh] (metformin hydrochlorid) tablety
a
GLUCOPHAGE® XR [gloo-ko-fahzh XR] (metformin hydrochlorid) tablety s prodlouženým uvolňováním
Přečtěte si informace pro pacienty, které jsou dodávány s GLUCOPHAGE a GLUCOPHAGE 1000 mg XR, než je začnete užívat, a pokaždé, když dostanete náplň. Mohou se objevit nové informace. Tento leták nenahrazuje rozhovor s poskytovatelem zdravotní péče o vašem zdravotním stavu nebo léčbě.
Jaké jsou nejdůležitější informace, které bych měl vědět o GLUCOPHAGE 1000mg a GLUCOPHAGE 500mg XR?
U lidí užívajících GLUCOPHAGE nebo GLUCOPHAGE 1000 mg XR se mohou vyskytnout závažné nežádoucí účinky, včetně:
Laktátová acidóza. Metformin hydrochlorid, léčivý přípravek v GLUCOPHAGE 500 mg a GLUCOPHAGE XR, může způsobit vzácný, ale závažný nežádoucí účinek nazývaný laktátová acidóza (hromadění kyseliny mléčné v krvi), který může způsobit smrt. Laktátová acidóza je lékařská pohotovost a musí být léčena v nemocnici.
Přestaňte užívat GLUCOPHAGE nebo GLUCOPHAGE 500 mg XR a ihned kontaktujte svého poskytovatele zdravotní péče, pokud se u Vás objeví některý z následujících příznaků laktátové acidózy:
- cítit se velmi slabý a unavený
- máte neobvyklou (ne normální) bolest svalů
- mít potíže s dýcháním
- máte neobvyklou ospalost nebo spíte déle než obvykle
- máte nevysvětlitelné žaludeční nebo střevní potíže s nevolností a zvracením nebo průjmem
- cítit chlad, zejména v pažích a nohou
- cítit závrať nebo točení hlavy
- máte pomalý nebo nepravidelný srdeční tep
Máte vyšší šanci na získání laktátové acidózy, pokud:
- mít problémy s ledvinami. Lidé, jejichž ledviny nefungují správně, by neměli užívat GLUCOPHAGE 850 mg NEBO GLUCOPHAGE XR.
- mít problémy s játry.
- trpíte městnavým srdečním selháním, které vyžaduje léčbu léky.
- pijte hodně alkoholu (velmi často nebo krátkodobé „přejímečné“ pití).
- dehydratovat (ztratit velké množství tělesných tekutin). To se může stát, pokud jste nemocní s horečkou, zvracením nebo průjmem. K dehydrataci může dojít také tehdy, když se při aktivitě nebo cvičení hodně potíte a nepijete dostatek tekutin.
- podstoupit určité rentgenové testy s injekčními barvivy nebo kontrastními látkami.
- podstoupit operaci.
- máte srdeční infarkt, závažnou infekci nebo mrtvici.
- je vám 80 let nebo více a nebyla vám vyšetřena funkce ledvin.
Co je GLUCOPHAGE a GLUCOPHAGE 1000mg XR?
- GLUCOPHAGE a GLUCOPHAGE XR jsou léky na předpis, které obsahují metformin hydrochlorid. GLUCOPHAGE 500 mg a GLUCOPHAGE 1000 mg XR se používají s dietou a cvičením, aby pomohly kontrolovat vysokou hladinu cukru v krvi (hyperglykémii) u dospělých s diabetem 2. typu.
- GLUCOPHAGE 850 mg a GLUCOPHAGE 500 mg XR nejsou určeny pro osoby s diabetem 1. typu.
- GLUCOPHAGE 850 mg a GLUCOPHAGE 500 mg XR nejsou určeny pro osoby s diabetickou ketoacidózou (zvýšené ketony v krvi nebo moči).
GLUCOPHAGE 850 mg a GLUCOPHAGE 1000 mg XR mají stejnou účinnou látku. GLUCOPHAGE XR však působí ve vašem těle déle. Oba tyto léky pomáhají kontrolovat hladinu cukru v krvi mnoha způsoby. Patří mezi ně pomoc vašemu tělu lépe reagovat na inzulín, který přirozeně vytváří, snížení množství cukru, které vaše játra produkují, a snížení množství cukru, které vaše střeva absorbují. GLUCOPHAGE 1000 mg a GLUCOPHAGE 850 mg XR nezpůsobují, že vaše tělo vytváří více inzulínu.
Kdo by neměl užívat GLUCOPHAGE nebo GLUCOPHAGE 850 mg XR?
Některé stavy zvyšují vaši šanci na získání laktátové acidózy nebo způsobují jiné problémy, pokud užíváte některý z těchto léků. Většina stavů uvedených níže může zvýšit vaši šanci na získání laktátové acidózy.
Neužívejte GLUCOPHAGE 1000 mg nebo GLUCOPHAGE 500 mg XR, pokud:
- mít problémy s ledvinami
- jste alergický/á na metformin hydrochlorid v přípravku GLUCOPHAGE nebo GLUCOPHAGE 850 mg XR nebo na kteroukoli složku přípravku GLUCOPHAGE nebo GLUCOPHAGE XR. Úplný seznam složek v GLUCOPHAGE a GLUCOPHAGE XR naleznete na konci této příbalové informace.
- se chystáte dostat injekci barviva nebo kontrastní látky na rentgenový zákrok nebo pokud máte podstoupit operaci a nemůžete moc jíst ani pít. V těchto situacích bude nutné GLUCOPHAGE 1000 mg nebo GLUCOPHAGE XR na krátkou dobu přerušit. Poraďte se se svým poskytovatelem zdravotní péče o tom, kdy byste měli vysadit GLUCOPHAGE 850 mg nebo GLUCOPHAGE 850 mg XR a kdy byste měli znovu začít GLUCOPHAGE nebo GLUCOPHAGE XR. Vidět "Jaké jsou nejdůležitější informace, které bych měl vědět o GLUCOPHAGE nebo GLUCOPHAGE XR?"
Co mám sdělit svému poskytovateli zdravotní péče před užitím přípravku GLUCOPHAGE nebo GLUCOPHAGE 1000 mg XR?
Před užitím přípravku GLUCOPHAGE 500 mg nebo GLUCOPHAGE XR informujte svého poskytovatele zdravotní péče, pokud:
- mají diabetes 1. typu. GLUCOPHAGE 850 mg nebo GLUCOPHAGE 500 mg XR by se neměly používat k léčbě lidí s diabetem 1. typu.
- máte v anamnéze nebo máte riziko diabetické ketoacidózy (vysoké hladiny určitých kyselin, známých jako ketony, v krvi nebo moči). GLUCOPHAGE 1000 mg nebo GLUCOPHAGE XR by se neměly používat k léčbě diabetické ketoacidózy.
- mít problémy s ledvinami.
- mít problémy s játry.
- máte srdeční problémy, včetně městnavého srdečního selhání.
- jsou starší 80 let. Pokud je vám více než 80 let, neměli byste užívat GLUCOPHAGE 1000 mg nebo GLUCOPHAGE XR, pokud vaše ledviny nebyly vyšetřeny a nejsou v pořádku.
- pijte alkohol velmi často nebo pijte hodně alkoholu při krátkodobém „nárazovém“ pití.
- berou inzulín.
- mít jiné zdravotní potíže.
- jste těhotná nebo plánujete otěhotnět. Není známo, zda GLUCOPHAGE nebo GLUCOPHAGE 850 mg XR poškodí vaše nenarozené dítě. Pokud jste těhotná, promluvte si se svým poskytovatelem zdravotní péče o nejlepším způsobu, jak kontrolovat hladinu cukru v krvi, když jste těhotná.
- kojíte nebo plánujete kojit. Není známo, zda GLUCOPHAGE 850 mg nebo GLUCOPHAGE XR přechází do vašeho mateřského mléka. Promluvte si se svým poskytovatelem zdravotní péče o tom, jak nejlépe krmit své dítě, když užíváte GLUCOPHAGE 500 mg nebo GLUCOPHAGE 500 mg XR.
Informujte svého poskytovatele zdravotní péče o všech lécích, které užíváte, včetně léků na předpis i bez předpisu, vitamínů a bylinných doplňků. Znát léky, které užíváte. Uchovávejte si jejich seznam, abyste je mohli ukázat svému poskytovateli zdravotní péče a lékárníkovi, když dostanete nový lék.
- GLUCOPHAGE nebo GLUCOPHAGE XR mohou ovlivnit způsob účinku jiných léků a jiné léky mohou ovlivnit účinek GLUCOPHAGE nebo GLUCOPHAGE XR.
Lze GLUCOPHAGE nebo GLUCOPHAGE 500mg XR používat u dětí?
Bylo prokázáno, že GLUCOPHAGE 1000 mg účinně snižuje hladinu glukózy u dětí (ve věku 10-16 let) s diabetem 2. typu. GLUCOPHAGE 1000 mg nebyl studován u dětí mladších 10 let. GLUCOPHAGE 500 mg nebyl studován v kombinaci s jinými perorálními léky na kontrolu glukózy nebo inzulinem u dětí. Máte-li jakékoli dotazy týkající se užívání přípravku GLUCOPHAGE 1000 mg u dětí, zeptejte se svého lékaře nebo jiného poskytovatele zdravotní péče.
GLUCOPHAGE XR nebyl studován u dětí.
Jak mám užívat GLUCOPHAGE nebo GLUCOPHAGE XR?
- Užívejte GLUCOPHAGE 850 mg nebo GLUCOPHAGE 850 mg XR přesně tak, jak vám řekl váš poskytovatel zdravotní péče.
- GLUCOPHAGE nebo GLUCOPHAGE 850 mg XR by se měly užívat s jídlem, aby se zmírnily nežádoucí účinky žaludeční nevolnosti.
- GLUCOPHAGE nebo GLUCOPHAGE 500 mg XR spolkněte vcelku. GLUCOPHAGE 1000mg XR nedrťte, nekrájejte ani nežvýkejte.
- Někdy můžete ve stolici vylučovat měkkou hmotu (pohyb střev), která vypadá jako tablety GLUCOPHAGE 850 mg nebo GLUCOPHAGE XR. To není škodlivé a neovlivní to způsob, jakým GLUCOPHAGE 850 mg XR působí při kontrole vašeho diabetu.
- Když je vaše tělo pod určitými typy stresu, jako je horečka, trauma (například autonehoda), infekce nebo chirurgický zákrok, množství léků na cukrovku, které potřebujete, se může změnit. Okamžitě informujte svého poskytovatele zdravotní péče, pokud máte některý z těchto problémů.
- Váš poskytovatel zdravotní péče by měl před a během léčby přípravkem GLUCOPHAGE 1000 mg nebo GLUCOPHAGE 500 mg XR provést krevní testy, aby zkontroloval, jak dobře fungují vaše ledviny.
- Váš poskytovatel zdravotní péče bude kontrolovat vaši cukrovku pravidelnými krevními testy, včetně hladiny cukru v krvi a hemoglobinu A1C.
- Postupujte podle pokynů svého poskytovatele zdravotní péče pro léčbu příliš nízké hladiny cukru v krvi (hypoglykémie). Promluvte si se svým poskytovatelem zdravotní péče, pokud je pro vás nízká hladina cukru v krvi problémem. Vidět "Jaké jsou možné vedlejší účinky GLUCOPHAGE nebo GLUCOPHAGE XR?"
- Zkontrolujte si hladinu cukru v krvi, jak vám to řekl váš poskytovatel zdravotní péče.
- Při užívání přípravku GLUCOPHAGE 850 mg nebo GLUCOPHAGE 850 mg XR dodržujte předepsanou dietu a cvičební program.
- Pokud vynecháte dávku přípravku GLUCOPHAGE 1000 mg nebo GLUCOPHAGE 850 mg XR, vezměte si další dávku podle předpisu, pokud vám lékař neřekne jinak. Další den neužívejte další dávku.
- Pokud užijete příliš mnoho přípravku GLUCOPHAGE 500 mg nebo GLUCOPHAGE 500 mg XR, zavolejte svého poskytovatele zdravotní péče, místní Poison Control Center nebo jděte ihned na pohotovost v nejbližší nemocnici.
Čemu se mám vyhnout při užívání přípravku GLUCOPHAGE nebo GLUCOPHAGE 1000 mg XR?
Během užívání přípravku GLUCOPHAGE nebo GLUCOPHAGE XR nepijte mnoho alkoholických nápojů. To znamená, že byste neměli pít nárazově po krátkou dobu a neměli byste pravidelně pít velké množství alkoholu. Alkohol může zvýšit šanci na získání laktátové acidózy.
Jaké jsou vedlejší účinky GLUCOPHAGE a GLUCOPHAGE XR?
- Laktátová acidóza. Metformin, účinná látka v GLUCOPHAGE 1000 mg a GLUCOPHAGE 500 mg XR, může způsobit vzácný, ale závažný stav nazývaný laktátová acidóza (nahromadění kyseliny v krvi), který může způsobit smrt. Laktátová acidóza je lékařská pohotovost a musí být léčena v nemocnici.
Okamžitě zavolejte svého lékaře, pokud máte některý z následujících příznaků, které mohou být příznaky laktátové acidózy:
- cítíte chlad v rukou nebo nohou
- cítíte závratě nebo závratě
- máte pomalý nebo nepravidelný srdeční tep
- cítíte se velmi slabý nebo unavený
- máte potíže s dýcháním
- cítíte se ospalý nebo ospalý
- máte bolesti žaludku, nevolnost nebo zvracení
Většina lidí, kteří prodělali laktátovou acidózu s metforminem, mají další věci, které v kombinaci s metforminem vedly k laktátové acidóze. Informujte svého lékaře, pokud máte některý z následujících stavů, protože máte vyšší šanci na získání laktátové acidózy s přípravkem GLUCOPHAGE 850 mg nebo GLUCOPHAGE 500 mg XR, pokud:
- máte závažné problémy s ledvinami nebo jsou vaše ledviny postiženy určitými rentgenovými testy, které používají injekční barvivo
- mít problémy s játry
- pijte alkohol velmi často, nebo pijte hodně alkoholu při krátkodobém „přejímém“ pití
- dehydratovat (ztratit velké množství tělesných tekutin). To se může stát, pokud jste nemocní s horečkou, zvracením nebo průjmem. K dehydrataci může dojít také tehdy, když se při aktivitě nebo cvičení hodně potíte a nepijete dostatek tekutin
- podstoupit operaci
- máte srdeční infarkt, závažnou infekci nebo mrtvici
Mezi časté nežádoucí účinky GLUCOPHAGE 500 mg a GLUCOPHAGE 1000 mg XR patří průjem, nevolnost a žaludeční nevolnost. Tyto nežádoucí účinky obvykle vymizí poté, co lék nějakou dobu užíváte. Užívání léku s jídlem může pomoci snížit tyto nežádoucí účinky. Informujte svého lékaře, pokud vás nežádoucí účinky velmi obtěžují, trvají déle než několik týdnů, pokud se vrátí poté, co odezní, nebo začněte s léčbou později. Možná budete potřebovat nižší dávku nebo budete muset přestat užívat lék na krátkou dobu nebo nadobro.
Přibližně 3 z každých 100 lidí, kteří užívají GLUCOPHAGE nebo GLUCOPHAGE 1000 mg XR, mají na začátku užívání léku nepříjemnou kovovou chuť. Trvá to krátce.
GLUCOPHAGE 850 mg a GLUCOPHAGE 500 mg XR samy o sobě zřídka způsobují hypoglykémii (nízkou hladinu cukru v krvi). K hypoglykémii však může dojít, pokud dostatečně nejíte, pijete alkohol nebo užíváte jiné léky na snížení hladiny cukru v krvi.
Jak mám uchovávat GLUCOPHAGE 500 mg a GLUCOPHAGE XR?
GLUCOPHAGE a GLUCOPHAGE 850 mg XR skladujte při teplotě 20 °C až 25 °C.
Uchovávejte GLUCOPHAGE 850 mg a GLUCOPHAGE 500 mg XR a všechny léky mimo dosah dětí.
Obecné informace o použití GLUCOPHAGE 850 mg a GLUCOPHAGE 850 mg XR
Máte-li dotazy nebo problémy, promluvte si se svým lékařem nebo jiným poskytovatelem zdravotní péče. Můžete požádat svého lékaře nebo lékárníka o informace o přípravku GLUCOPHAGE 850 mg a GLUCOPHAGE 500 mg XR, které jsou určeny pro zdravotnické pracovníky. Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v příbalové informaci pro pacienty. Nepoužívejte GLUCOPHAGE 1000 mg nebo GLUCOPHAGE 1000 mg XR pro stav, pro který nebyl předepsán. Nesdílejte svůj lék s jinými lidmi.
Jaké jsou složky GLUCOPHAGE a GLUCOPHAGE 500mg XR?
Aktivní složky GLUCOPHAGE: metformin hydrochlorid.
Neaktivní složky v každé tabletě GLUCOPHAGE: povidon a magnesium-stearát. Kromě toho potah pro 500 mg a 850 mg tablety obsahuje hypromelózu a potah pro 1000 mg tablety obsahuje hypromelózu a polyethylenglykol.
Účinné látky GLUCOPHAGE 1000 mg XR: metformin hydrochlorid.
Neaktivní složky v každé tabletě GLUCOPHAGE 1000 mg XR 500 mg: sodná sůl karboxymethylcelulózy, hypromelóza, mikrokrystalická celulóza a stearát hořečnatý.
Neaktivní složky v každé tabletě GLUCOPHAGE XR 750 mg: sodná sůl karboxymethylcelulózy, hypromelóza a stearát hořečnatý.
Co je diabetes 2. typu?
Diabetes 2. typu je stav, kdy vaše tělo nevytváří dostatek inzulínu a inzulín, který vaše tělo produkuje, nefunguje tak dobře, jak by měl. Vaše tělo může také vytvářet příliš mnoho cukru. Když k tomu dojde, cukr (glukóza) se hromadí v krvi. To může vést k vážným zdravotním problémům.
Hlavním cílem léčby cukrovky je snížit hladinu cukru v krvi na normální úroveň.
Vysoká hladina cukru v krvi může být snížena dietou a cvičením a v případě potřeby některými léky.
Poraďte se se svým poskytovatelem zdravotní péče o tom, jak předcházet, rozpoznat a starat se o nízkou hladinu cukru v krvi (hypoglykémii), vysokou hladinu cukru v krvi (hyperglykémii) a problémy, které máte kvůli cukrovce.
