Proventil 100mcg Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
POUZE PRO ÚSTNÍ INHALACI
Co je Proventil a jak se používá?
Proventil je lék na předpis používaný k léčbě příznaků akutního astmatu nebo astmatu vyvolaného cvičením (bronchospasmus). Proventil 100mcg lze užívat samostatně nebo s jinými léky.
Proventil 100mcg patří do třídy léků nazývaných Beta2 Agonisté.
Není známo, zda je přípravek Proventil bezpečný a účinný u dětí mladších 4 let.
Jaké jsou možné vedlejší účinky přípravku Proventil?
Proventil může způsobit závažné nežádoucí účinky, včetně:
- kopřivka,
- potíže s dýcháním,
- otok obličeje, rtů, jazyka nebo hrdla,
- sípání,
- dušení
- ,
- jiné dýchací potíže,
- bolest na hrudi,
- rychlý srdeční tep,
- bušení srdce,
- chvění v tvé hrudi,
- těžká bolest hlavy,
- bušení do krku nebo uší,
- bolest nebo pálení při močení,
- zvýšená žízeň,
- zvýšené močení,
- suchá ústa,
- ovocný zápach dechu,
- křeče v nohou,
- zácpa,
- nepravidelný srdeční tep,
- zvýšená žízeň nebo močení,
- necitlivost nebo mravenčení a
- svalová slabost nebo pocit ochablosti
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Proventil patří:
- bolest na hrudi,
- rychlé nebo bušení srdce,
- závrať,
- pocit třesu nebo nervozity,
- bolest hlavy,
- bolesti zad,
- bolesti těla,
- žaludeční nevolnost,
- bolest krku,
- bolest dutin a
- rýma nebo ucpaný nos
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Proventil. Pro více informací se zeptejte svého lékaře nebo lékárníka.
POPIS
Aktivní složkou inhalačního aerosolu PROVENTIL® HFA (albuterol sulfát) je albuterol sulfát, USP racemický α1 [(terc-Butylamino)methyl]-4-hydroxy-w-xylen-α, α '-diol sulfát (2: l) (sůl), relativně selektivní beta2-adrenergní bronchodilatátor s následující chemickou strukturou:
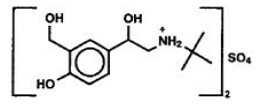
Albuterol sulfát je oficiální generický název ve Spojených státech. Světovou zdravotnickou organizací doporučený název léku je salbutamol sulfát. Molekulová hmotnost albuterolsulfátu je 576,7 a empirický vzorec je (C13H21NO3)2*H2SO4. Albuterol sulfát je bílá až téměř bílá krystalická pevná látka. Je rozpustný ve vodě a mírně rozpustný v ethanolu. PROVENTIL HFA Inhalační aerosol je tlaková aerosolová jednotka s odměřenou dávkou pro orální inhalaci. Obsahuje mikrokrystalickou suspenzi albuterolsulfátu v hnacím plynu HFA-134a (1,1,1,2-tetrafluorethan), ethanolu a kyselině olejové.
Každá aktivace dodá 120 mcg albuterol sulfátu, USP z ventilu a 108 mcg albuterol sulfátu, USP z náustku (ekvivalent 90 mcg báze albuterolu z náustku). Každý kanystr poskytuje 200 inhalací. Před prvním použitím a v případech, kdy nebyl inhalátor používán déle než 2 týdny, se doporučuje naplnit inhalátor vypuštěním čtyř „zkušebních střiků“ do vzduchu, mimo obličej.
Tento produkt neobsahuje chlorfluoruhlovodíky (CFC) jako pohonnou látku.
INDIKACE
PROVENTIL 100 mcg HFA inhalační aerosol je indikován u dospělých a dětí ve věku 4 let a starších k léčbě nebo prevenci bronchospasmu s reverzibilním obstrukčním onemocněním dýchacích cest a k prevenci bronchospasmu vyvolaného námahou.
DÁVKOVÁNÍ A PODÁVÁNÍ
Pro léčbu akutních epizod bronchospasmu nebo prevenci astmatických příznaků je obvyklá dávka pro dospělé a děti ve věku 4 let a starší dvě inhalace opakované každých 4 až 6 hodin. Nedoporučuje se častější podávání nebo větší počet inhalací. U některých pacientů může stačit jedna inhalace každé 4 hodiny. Každá aktivace inhalačního aerosolu PROVENTIL 100 mcg HFA dodá 108 mcg albuterol sulfátu (ekvivalent 90 mcg báze albuterolu) z náustku. Před prvním použitím a v případech, kdy nebyl inhalátor používán déle než 2 týdny, se doporučuje naplnit inhalátor vypuštěním čtyř „zkušebních střiků“ do vzduchu, mimo obličej.
PROVENTIL 100mcg HFA inhalační aerosol obsahuje 200 inhalací na kanystr. Kanystr má připojený indikátor dávky, který ukazuje, kolik inhalací zbývá. Displej ukazatele dávky se posouvá po každém desátém stisknutí. Když se blíží konec použitelných inhalací, pozadí za číslem v okénku displeje indikátoru dávky se změní na červené při 20 aktivacích nebo méně. PROVENTIL HFA inhalační aerosol by měl být zlikvidován, když okénko ukazatele dávky ukazuje nulu.
Prevence bronchospasmu vyvolaného cvičením
Obvyklá dávka pro dospělé a děti od 4 let jsou dvě inhalace 15 až 30 minut před výkonem.
Pro zachování správného používání tohoto produktu je důležité alespoň jednou týdně náustek důkladně umýt a vysušit. Inhalátor může přestat vydávat léky, pokud není řádně vyčištěn a důkladně vysušen (viz INFORMACE PRO PACIENTA ). Udržování plastového náustku v čistotě je velmi důležité, aby se zabránilo hromadění léků a ucpání. Inhalátor může přestat vydávat léky, pokud není řádně vyčištěn a důkladně vysušen na vzduchu. Pokud se náustek ucpe, omytím náustku se ucpání odstraní.
Pokud dříve účinný dávkový režim neposkytne obvyklou odpověď, může to být marker destabilizace astmatu a vyžaduje přehodnocení pacienta a léčebného režimu se zvláštním ohledem na možnou potřebu protizánětlivé léčby, např. kortikosteroidy.
JAK DODÁVÁNO
PROVENTIL 100 mcg HFA (albuterol sulfát) inhalační aerosol se dodává jako tlaková hliníková nádobka s připojeným indikátorem dávky, žlutým plastovým ovladačem a oranžovým protiprachovým uzávěrem, každý v krabicích po jedné. Každá aktivace dodá 120 mcg albuterol sulfátu z ventilu a 108 mcg albuterol sulfátu z náustku (ekvivalent 90 mcg albuterolové báze). Kanystry o čisté hmotnosti 6,7 g obsahují 200 inhalací ( NDC 0085-1132-04).
Uchovávejte při teplotě 15° - 25°C (59° - 77°F). Uchovávejte inhalátor náustkem dolů. Pro dosažení nejlepších výsledků by měla mít nádobka před použitím pokojovou teplotu.
PŘED POUŽITÍM DOBŘE PROTŘEPEJTE.
Žlutý aktuátor dodávaný s inhalačním aerosolem PROVENTIL 100 mcg HFA by se neměl používat s žádnými kanystry s jinými produkty a aktuátor z jiných produktů by se neměl používat s kanystrem s inhalačním aerosolem PROVENTIL HFA. Správné množství léku v každé nádobce nelze zaručit po 200 aktivacích a když okénko ukazatele dávky ukazuje nulu, i když nádobka není zcela prázdná. Po použití označeného počtu aktivací je třeba nádobku zlikvidovat.
VAROVÁNÍ: Zabraňte vstříknutí do očí. Obsah pod tlakem. Nepropichujte ani nespalujte. Vystavení teplotám nad 120 °F může způsobit prasknutí. Uchovávejte mimo dosah dětí.
PROVENTIL HFA inhalační aerosol neobsahuje chlorfluoruhlovodíky (CFC) jako hnací plyn.
Vyrobeno pro: Merck Sharp & Dohme Corp „dceřiná společnost MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Vyvinuto a vyrobeno: 3M Health Care Limited Loughborough UK nebo 3M Drug Delivery Systems Northridge, CA 91324, USA. Revize: září 2017
VEDLEJŠÍ EFEKTY
Informace o nežádoucích účincích týkající se inhalačního aerosolu PROVENTIL HFA jsou odvozeny z 12týdenní, dvojitě zaslepené, dvojitě falešné studie, která porovnávala inhalační aerosol PROVENTIL HFA, inhalátor albuterolu s pohonem CFC 11/12 a placebo inhalátor HFA-134a u 565 astmatiků. pacientů. Následující tabulka uvádí výskyt všech nežádoucích příhod (ať už zvažovaných zkoušejícím souvisejících s drogou nebo nesouvisejících s drogou) z této studie, které se vyskytly v míře 3 % nebo vyšší ve skupině léčené PROVENTIL 100 mcg HFA inhalačním aerosolem a častěji ve skupině léčené Skupina léčená PROVENTIL 100 mcg HFA inhalačním aerosolem než ve skupině s placebem. Celkově byla incidence a povaha nežádoucích účinků hlášených u inhalačního aerosolu PROVENTIL 100 mcg HFA a inhalátoru albuterolu s pohonem CFC 11/12 srovnatelná.
Incidence nežádoucích zkušeností (% pacientů) ve velké 12týdenní klinické studii*
Nežádoucí příhody hlášené u méně než 3 % pacientů užívajících inhalační aerosol PROVENTIL HFA au větší části pacientů s PROVENTIL 100 mcg HFA inhalační aerosol než u pacientů s placebem, které mohou souviset s PROVENTIL 100 mcg HFA inhalační aerosol, zahrnují: dysfonii, zvýšené pocení, sucho v ústech, bolest na hrudi, edém, ztuhlost, ataxie, křeče v nohou, hyperkineze, říhání, plynatost, tinitus, diabetes mellitus, úzkost, deprese, ospalost, vyrážka. U inhalačního aerosolu PROVENTIL HFA bylo také pozorováno bušení srdce a závratě.
Nežádoucí účinky hlášené ve 4týdenní pediatrické klinické studii srovnávající PROVENTIL 100 mcg HFA inhalační aerosol a inhalátor albuterolu s pohonem CFC 11/12 se vyskytovaly s nízkou četností výskytu a byly podobné těm, které byly pozorovány ve studiích u dospělých.
Ve studiích s malými kumulativními dávkami se zdálo, že třes, nervozita a bolest hlavy souvisí s dávkou.
Po použití inhalačního albuterolu byly hlášeny vzácné případy kopřivky, angioedému, vyrážky, bronchospasmu a orofaryngeálního edému. Kromě toho může albuterol, stejně jako ostatní sympatomimetika, způsobit nežádoucí reakce, jako je hypertenze, angina pectoris, vertigo, stimulace centrálního nervového systému, nespavost, bolest hlavy, metabolická acidóza a vysušení nebo podráždění orofaryngu.
DROGOVÉ INTERAKCE
Beta-blokátory
Látky blokující beta-adrenergní receptory nejen blokují plicní účinek beta-agonistů, jako je PROVENTIL 100 mcg HFA inhalační aerosol, ale mohou způsobit těžký bronchospasmus u astmatických pacientů. Pacienti s astmatem by proto za normálních okolností neměli být léčeni betablokátory. Avšak za určitých okolností, např. jako profylaxe po infarktu myokardu, nemusí existovat žádné přijatelné alternativy k použití beta-adrenergních blokátorů u pacientů s astmatem. V této situaci by měly být zváženy kardioselektivní beta-blokátory, i když by měly být podávány s opatrností.
Diuretika
Změny EKG a/nebo hypokalémie, které mohou být důsledkem podávání draslík nešetřících diuretik (jako jsou kličková nebo thiazidová diuretika), mohou být beta-agonisty akutně zhoršeny, zvláště když je překročena doporučená dávka beta-agonistů. Ačkoli klinický význam těchto účinků není znám, doporučuje se opatrnost při současném podávání beta-agonistů s diuretiky nešetřícími draslík.
albuterol-digoxin
Průměrné snížení sérových hladin digoxinu o 16 % a 22 % bylo prokázáno po jednorázovém intravenózním a perorálním podání albuterolu normálním dobrovolníkům, kteří dostávali digoxin po dobu 10 dnů. Klinický význam těchto nálezů pro pacienty s obstrukčním onemocněním dýchacích cest, kteří chronicky užívají albuterol a digoxin, není jasný; nicméně by bylo rozumné pečlivě vyhodnotit hladiny digoxinu v séru u pacientů, kteří v současné době užívají digoxin a albuterol.
Inhibitory monoaminoxidázy nebo tricyklická antidepresiva
Inhalační aerosol PROVENTIL HFA by měl být podáván s extrémní opatrností pacientům léčeným inhibitory monoaminooxidázy nebo tricyklickými antidepresivy nebo do 2 týdnů po vysazení těchto látek, protože účinek albuterolu na kardiovaskulární systém může být zesílen.
VAROVÁNÍ
Paradoxní bronchospasmus
Inhalační albuterol sulfát může způsobit paradoxní bronchospasmus, který může být život ohrožující. Pokud dojde k paradoxnímu bronchospasmu, je třeba okamžitě přerušit podávání PROVENTIL HFA inhalačního aerosolu a zahájit alternativní léčbu. Je třeba si uvědomit, že paradoxní bronchospasmus, pokud je spojen s inhalačními přípravky, se často vyskytuje při prvním použití nové nádobky.
Zhoršení astmatu
Astma se může zhoršit akutně po dobu několika hodin nebo chronicky po několik dní nebo déle. Pokud pacient potřebuje více dávek inhalačního aerosolu PROVENTIL HFA než obvykle, může to být marker destabilizace astmatu a vyžaduje přehodnocení pacienta a léčebného režimu se zvláštním ohledem na možnou potřebu protizánětlivé léčby, např. kortikosteroidy.
Použití protizánětlivých činidel
Použití samotných bronchodilatátorů beta-adrenergních agonistů nemusí být u mnoha pacientů dostatečné ke kontrole astmatu. Je třeba včas zvážit přidání protizánětlivých látek, např. kortikosteroidů, do terapeutického režimu.
Kardiovaskulární účinky
PROVENTIL 100 mcg HFA inhalační aerosol, stejně jako ostatní beta-adrenergní agonisté, může u některých pacientů vyvolat klinicky významné kardiovaskulární účinky měřené tepovou frekvencí, krevním tlakem a/nebo symptomy. I když jsou takové účinky po podání přípravku PROVENTIL 100 mcg HFA inhalační aerosol v doporučených dávkách neobvyklé, pokud se vyskytnou, může být nutné léčbu přerušit. Kromě toho bylo hlášeno, že beta-agonisté způsobují změny na EKG, jako je zploštění vlny T, prodloužení intervalu QTc a deprese segmentu ST. Klinický význam těchto nálezů není znám. Proto by měl být PROVENTIL HFA inhalační aerosol, stejně jako všechny sympatomimetické aminy, používán s opatrností u pacientů s kardiovaskulárními poruchami, zejména koronární insuficiencí, srdečními arytmiemi a hypertenzí.
Nepřekračujte doporučenou dávku
souvislosti s nadměrným užíváním inhalačních sympatomimetik u pacientů s astmatem byly hlášeny případy úmrtí. Přesná příčina smrti není známa, ale existuje podezření na zástavu srdce po neočekávaném rozvoji těžké akutní astmatické krize a následné hypoxii.
Okamžité hypersenzitivní reakce
Po podání albuterol sulfátu se mohou objevit okamžité reakce z přecitlivělosti, jak dokládají vzácné případy kopřivky, angioedému, vyrážky, bronchospasmu, anafylaxe a orofaryngeálního edému.
OPATŘENÍ
Všeobecné
Albuterol sulfát, stejně jako všechny sympatomimetické aminy, by měl být používán s opatrností u pacientů s kardiovaskulárními poruchami, zejména s koronární insuficiencí, srdečními arytmiemi a hypertenzí; u pacientů s křečovými poruchami, hypertyreózou nebo diabetes mellitus; a u pacientů, kteří neobvykle reagují na sympatomimetické aminy. U jednotlivých pacientů byly pozorovány klinicky významné změny systolického a diastolického krevního tlaku a lze očekávat, že se u některých pacientů vyskytnou po použití jakéhokoli beta-adrenergního bronchodilatátoru.
Bylo hlášeno, že velké dávky intravenózního albuterolu zhoršují již existující diabetes mellitus a ketoacidózu. Stejně jako u jiných beta-agonistů může albuterol u některých pacientů vyvolat významnou hypokalémii, pravděpodobně prostřednictvím intracelulárního zkratu, který má potenciál vyvolat nežádoucí kardiovaskulární účinky. Pokles je obvykle přechodný, nevyžaduje suplementaci.
Informace pro pacienty
Viz obrázek Návod k použití pro pacienta PŘED POUŽITÍM DOBŘE PROTŘEPEJTE. Pacientům by měly být poskytnuty následující informace:
Před prvním použitím a v případech, kdy nebyl inhalátor používán déle než 2 týdny, se doporučuje naplnit inhalátor vypuštěním čtyř „zkušebních střiků“ do vzduchu, mimo obličej.
UDRŽOVÁNÍ PLASTOVÉHO NÁSTRUKU V ČISTOTĚ JE VELMI DŮLEŽITÉ, ABY SE ZABRÁNILO NÁSOBENÍ A ZABLOKOVÁNÍ LÉKŮ. NÁSTŘIK BY MĚL UMÝT, TŘESIT, ABY SE Z NÍ ODSTRANILA PŘEBYTEČNÁ VODA, A DŮKLADNĚ SUŠIT NA VZDUCHU ALESPOŇ JEDNOU TÝDNĚ. INHALÁTOR MŮŽE PŘESTAT VYDÁVAT LÉKY, POKUD NEBUDE ŘÁDNĚ VYČIŠTĚN.
Náustek by měl být vyčištěn (s odstraněnou nádobkou) protékáním teplé vody přes horní a spodní část po dobu 30 sekund alespoň jednou týdně. Náustek je třeba protřepat, aby se odstranila přebytečná voda, a poté důkladně vysušit na vzduchu (např. přes noc). Zablokování hromaděním léků nebo nesprávná aplikace léku může být důsledkem toho, že náustek důkladně nevysušíte vzduchem.
Pokud se náustek ucpe (z náustku vytéká málo nebo žádný lék), lze ucpání odstranit umytím, jak je popsáno výše.
Pokud je nutné použít inhalátor před úplným vyschnutím, setřeste přebytečnou vodu, vyměňte nádobku, vyzkoušejte sprej dvakrát z obličeje a vezměte si předepsanou dávku. Po takovém použití je třeba náustek znovu umýt a nechat důkladně vyschnout na vzduchu.
Působení inhalačního aerosolu PROVENTIL HFA by mělo trvat až 4 až 6 hodin. PROVENTIL HFA inhalační aerosol by neměl být používán častěji, než je doporučeno. Bez porady s lékařem nezvyšujte dávku ani frekvenci dávek inhalačního aerosolu PROVENTIL HFA. Pokud zjistíte, že léčba přípravkem PROVENTIL 100 mcg HFA inhalační aerosol je méně účinná pro úlevu od symptomů, vaše příznaky se zhorší a/nebo potřebujete přípravek používat častěji než obvykle, je třeba okamžitě vyhledat lékařskou pomoc. Zatímco užíváte PROVENTIL 100 mcg HFA inhalační aerosol, ostatní inhalační léky a léky na astma byste měli užívat pouze podle pokynů svého lékaře.
Mezi běžné nežádoucí účinky léčby inhalačním albuterolem patří palpitace, bolest na hrudi, zrychlený srdeční tep, třes nebo nervozita. Pokud jste těhotná nebo kojíte, kontaktujte svého lékaře ohledně použití inhalačního aerosolu PROVENTIL 100 mcg HFA. Efektivní a bezpečné používání inhalačního aerosolu PROVENTIL 100 mcg HFA zahrnuje pochopení způsobu, jakým by měl být podáván. Inhalační aerosol PROVENTIL HFA používejte pouze s aktuátorem dodaným s produktem. Po použití 200 vstřiků nádobku zlikvidujte.
Obecně je technika podávání inhalačního aerosolu PROVENTIL HFA dětem podobná jako u dospělých. Děti by měly používat inhalační aerosol PROVENTIL HFA pod dohledem dospělé osoby podle pokynů lékaře pacienta. (Viz návod k použití pro pacienta.)
Karcinogeneze, mutageneze a zhoršování plodnosti
2leté studii na potkanech SPRAGUE-DAWLEY® způsobil albuterol sulfát v závislosti na dávce zvýšení výskytu benigních leiomyomů mezovaria při výše uvedených dietních dávkách 2 mg/kg (přibližně 15násobek maximální doporučené denní inhalační dávky pro dospělé na bázi mg/m² a přibližně 6násobek maximální doporučené denní inhalační dávky pro děti na bázi mg/m²). V jiné studii byl tento účinek blokován současným podáváním propranololu, neselektivního beta-adrenergního antagonisty. V 18měsíční studii na myších CD-1 neukázal albuterol sulfát žádný důkaz tumorigenicity při dietních dávkách až 500 mg/kg (přibližně 1700násobek maximální doporučené denní inhalační dávky pro dospělé na základě mg/m² a přibližně 800 násobek maximální doporučené denní inhalační dávky pro děti na základě mg/m²). Ve 22měsíční studii na Golden Hamsters nevykázal albuterol sulfát žádný důkaz tumorigenicity při dietních dávkách až 50 mg/kg (přibližně 225násobek maximální doporučené denní inhalační dávky pro dospělé na základě mg/m² a přibližně 110násobek vyšší než maximální doporučená denní inhalační dávka pro děti na základě mg/m²).
Albuterol sulfát nebyl mutagenní v Amesově testu ani v mutačním testu na kvasinkách. Albuterol sulfát nebyl klastogenní v testu na lidských periferních lymfocytech nebo v testu na mikronukleu myší kmene AH1.
Reprodukční studie na potkanech neprokázaly žádné známky poškození fertility při perorálních dávkách až do 50 mg/kg (přibližně 340násobek maximální doporučené denní inhalační dávky pro dospělé na základě mg/m²).
Těhotenství
Teratogenní účinky
Kategorie těhotenství C
Bylo prokázáno, že albuterol sulfát je u myší teratogenní. Studie na myších CD-1, kterým byl subkutánně podáván albuterol sulfát, prokázala tvorbu rozštěpu patra u 5 ze 111 (4,5 %) plodů při dávce 0,25 mg/kg (méně než maximální doporučená denní inhalační dávka pro dospělé na základě mg/m²) au 10 108 (9,3 %) plodů při dávce 2,5 mg/kg (přibližně 8násobek maximální doporučené denní inhalační dávky pro dospělé na základě mg/m²). Lék neindukoval tvorbu rozštěpu patra v dávce 0,025 mg/kg (méně než maximální doporučená denní inhalační dávka pro dospělé na bázi mg/m²). Rozštěp patra se také vyskytl u 22 ze 72 (30,5 %) plodů od samic léčených subkutánně 2,5 mg/kg isoproterenolu (pozitivní kontrola).
Reprodukční studie na králících Stride Dutch odhalila kranioschizu u 7 z 19 (37 %) plodů, když byl albuterol sulfát podáván perorálně v dávce 50 mg/kg (přibližně 680násobek maximální doporučené denní inhalační dávky pro dospělé na základě mg/m²).
inhalační reprodukční studii u potkanů SPRAGUE-DAWLEY přípravek albuterol sulfát/HFA-134a nevykazoval žádné teratogenní účinky při dávce 10,5 mg/kg (přibližně 70násobek maximální doporučené denní inhalační dávky pro dospělé na základě mg/m²).
Studie, ve které byl březím krysám podáván radioaktivně značený albuterol sulfát, prokázala, že materiál související s léčivem se přenáší z mateřského oběhu na plod.
Neexistují žádné adekvátní a dobře kontrolované studie přípravku PROVENTIL 100 mcg HFA inhalační aerosol nebo albuterol sulfát u těhotných žen. PROVENTIL 100 mcg HFA inhalační aerosol by měl být používán během těhotenství pouze v případě, že potenciální přínos ospravedlňuje potenciální riziko pro plod.
Během celosvětové marketingové zkušenosti byly u potomků pacientů léčených albuterolem hlášeny různé vrozené anomálie, včetně rozštěpu patra a defektů končetin. Některé z matek během těhotenství užívaly více léků. Protože nelze rozeznat žádný konzistentní vzor defektů, vztah mezi užíváním albuterolu a vrozenými anomáliemi nebyl stanoven.
Použití v práci a doručení
Vzhledem k možné interferenci beta-agonistů s kontraktilitou dělohy by mělo být použití inhalačního aerosolu PROVENTIL HFA k úlevě od bronchospasmu během porodu omezeno na pacientky, u kterých přínosy jasně převažují nad riziky.
Tokolýza
Albuterol nebyl schválen pro řízení předčasného porodu. Poměr přínosu a rizika při podávání albuterolu k tokolýze nebyl stanoven. Závažné nežádoucí účinky, včetně plicního edému, byly hlášeny během nebo po léčbě předčasného porodu beta2-agonisty, včetně albuterolu.
Kojící matky
Plazmatické hladiny albuterol sulfátu a HFA-134a po inhalačních terapeutických dávkách jsou u lidí velmi nízké, ale není známo, zda se složky přípravku PROVENTIL 100mcg HFA inhalační aerosol vylučují do mateřského mléka.
Vzhledem k možnosti tumorigenicity prokázané u albuterolu ve studiích na zvířatech a nedostatku zkušeností s používáním inhalačního aerosolu PROVENTIL HFA kojícími matkami by se mělo rozhodnout, zda přerušit kojení nebo přerušit podávání léku, přičemž je třeba vzít v úvahu důležitost drogu matce. Při podávání albuterol sulfátu kojící ženě je třeba postupovat opatrně.
Pediatrie
Bezpečnost a účinnost přípravku PROVENTIL HFA Inhalation Aerosol u pediatrických pacientů mladších 4 let nebyla stanovena.
Geriatrie
PROVENTIL HFA inhalační aerosol nebyl studován u geriatrické populace. Stejně jako u jiných beta2-agonistů je třeba dbát zvláštní opatrnosti při používání inhalačního aerosolu PROVENTIL HFA u starších pacientů, kteří mají souběžné kardiovaskulární onemocnění, které by mohlo být nepříznivě ovlivněno touto třídou léků.
PŘEDÁVKOVAT
Očekávané příznaky předávkování jsou příznaky nadměrné beta-adrenergní stimulace a/nebo výskyt nebo zvýraznění jakýchkoli příznaků uvedených v části NEŽÁDOUCÍ ÚČINKY, např. záchvaty, angina pectoris, hypertenze nebo hypotenze, tachykardie s frekvencí až 200 tepů za minutu, arytmie , nervozita, bolest hlavy, třes, sucho v ústech, bušení srdce, nevolnost, závratě, únava, malátnost a nespavost.
Může se také objevit hypokalémie. Stejně jako u všech sympatomimetických léků může být zástava srdce a dokonce smrt spojena se zneužíváním inhalačního aerosolu PROVENTIL 100 mcg HFA. Léčba spočívá ve vysazení přípravku PROVENTIL HFA Inhalation Aerosol spolu s vhodnou symptomatickou terapií. Je možné zvážit uvážlivé použití kardioselektivního blokátoru beta-receptorů, přičemž je třeba mít na paměti, že taková léčba může vyvolat bronchospasmus. Neexistují dostatečné důkazy ke stanovení, zda je dialýza prospěšná při předávkování inhalačním aerosolem PROVENTIL HFA.
Perorální střední letální dávka albuterol sulfátu u myší je vyšší než 2000 mg/kg (přibližně 6800násobek maximální doporučené denní inhalační dávky pro dospělé na základě mg/m² a přibližně 3200násobek maximální doporučené denní inhalační dávky pro děti na mg /m² základ). U dospělých potkanů je střední subkutánní letální dávka albuterol sulfátu přibližně 450 mg/kg (přibližně 3000násobek maximální doporučené denní inhalační dávky pro dospělé na základě mg/m² a přibližně 1400násobek maximální doporučené denní inhalační dávky pro děti na mg/m² základ). U mladých potkanů je subkutánní střední letální dávka přibližně 2000 mg/kg (přibližně 14 000násobek maximální doporučené denní inhalační dávky pro dospělé na základě mg/m² a přibližně 6400násobek maximální doporučené denní inhalační dávky pro děti v mg/m² základ). Střední letální dávka při inhalaci nebyla u zvířat stanovena.
KONTRAINDIKACE
PROVENTIL 100 mcg HFA inhalační aerosol je kontraindikován u pacientů s anamnézou přecitlivělosti na albuterol nebo jakoukoli jinou složku PROVENTIL HFA.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Studie in vitro a farmakologické studie in vivo prokázaly, že albuterol má ve srovnání s isoproterenolem přednostní účinek na beta2-adrenergní receptory. I když se uznává, že beta2-adrenergní receptory jsou převládajícími receptory na hladkém svalstvu průdušek, údaje ukazují, že v lidském srdci existuje populace beta2-receptorů v koncentraci mezi 10 % a 50 % srdečních beta-adrenergních receptorů. Přesná funkce těchto receptorů nebyla stanovena. (Vidět VAROVÁNÍ , Kardiovaskulární účinky sekce.)
Aktivace beta2-adrenergních receptorů na hladkém svalstvu dýchacích cest vede k aktivaci adenylcyklázy a ke zvýšení intracelulární koncentrace cyklického-3',5'-adenosinmonofosfátu (cyklický AMP). Toto zvýšení cyklického AMP vede k aktivaci proteinkinázy A, která inhibuje fosforylaci myosinu a snižuje intracelulární koncentrace iontového vápníku, což vede k relaxaci. Albuterol uvolňuje hladké svaly všech dýchacích cest, od průdušnice až po terminální bronchioly. Albuterol působí jako funkční antagonista k uvolnění dýchacích cest bez ohledu na obsažený spasmogen, čímž chrání před všemi bronchokonstrikčními výzvami. Zvýšené koncentrace cyklického AMP jsou také spojeny s inhibicí uvolňování mediátorů z žírných buněk v dýchacích cestách.
Ve většině klinických studií bylo prokázáno, že albuterol má větší účinek na dýchací cesty ve formě relaxace hladkého svalstva průdušek než isoproterenol ve srovnatelných dávkách, přičemž má méně kardiovaskulárních účinků. Kontrolované klinické studie a další klinické zkušenosti ukázaly, že inhalovaný albuterol, stejně jako jiné beta-adrenergní agonisty, může u některých pacientů vyvolat významný kardiovaskulární účinek, měřeno tepovou frekvencí, krevním tlakem, symptomy a/nebo elektrokardiografickými změnami.
Preklinický
Intravenózní studie na potkanech s albuterol sulfátem prokázaly, že albuterol prochází hematoencefalickou bariérou a dosahuje koncentrace v mozku dosahující přibližně 5 % plazmatických koncentrací. Ve strukturách mimo hematoencefalickou bariéru (šišinka a hypofýza) byly zjištěny koncentrace albuterolu 100krát vyšší než v celém mozku.
Studie na laboratorních zvířatech (miniprasata, hlodavci a psi) prokázaly výskyt srdečních arytmií a náhlé smrti (s histologickým důkazem nekrózy myokardu), když byly beta2-agonisty a methylxantiny podávány současně. Klinický význam těchto nálezů není znám.
Hnací látka HFA-134a nemá farmakologickou aktivitu, s výjimkou velmi vysokých dávek u zvířat (380-1300násobek maximální expozice u člověka na základě srovnání hodnot AUC), primárně vyvolávající ataxii, třes, dušnost nebo slinění. Tyto účinky jsou podobné účinkům, které vyvolávají strukturálně příbuzné chlorfluoruhlovodíky (CFC), které byly široce používány v inhalátorech s odměřenými dávkami.
zvířat a lidí bylo zjištěno, že hnací látka HFA-134a je rychle absorbována a rychle eliminována, s poločasem eliminace 3 až 27 minut u zvířat a 5 až 7 minut u lidí. Doba do dosažení maximální plazmatické koncentrace (Tmax) a střední doba zdržení jsou extrémně krátké, což vede k přechodnému výskytu HFA-134a v krvi bez známek akumulace.
Farmakokinetika
Ve studii biologické dostupnosti s jednorázovou dávkou, do které bylo zařazeno šest zdravých dobrovolníků mužského pohlaví, byly po podání dvou vstřiků z inhalačního aerosolu PROVENTIL HFA a inhalátoru albuterolu s pohonem CFC 11/12 pozorovány přechodně nízké hladiny albuterolu (blízké spodní hranici kvantifikace). . Formální farmakokinetické analýzy nebyly možné pro žádnou léčbu, ale systémové hladiny albuterolu se zdály podobné.
Klinické testy
Ve 12týdenní, randomizované, dvojitě zaslepené, dvojitě nefigurální, aktivní a placebem kontrolované studii, byla u 565 pacientů s astmatem hodnocena bronchodilatační účinnost přípravku PROVENTIL 100 mcg HFA inhalační aerosol (193 pacientů) ve srovnání s CFC 11 /12 inhalátor albuterol s pohonem (186 pacientů) a inhalátor placeba HFA-134a (186 pacientů).
Sériová měření FEV1 (zobrazená níže jako procentuální změna od výchozí hodnoty testovacího dne) prokázala, že dvě inhalace inhalačního aerosolu PROVENTIL HFA přinesly významně větší zlepšení funkce plic než placebo a přinesly výsledky, které byly klinicky srovnatelné s inhalátorem albuterolu s pohonem CFC 11/12.
Průměrná doba do nástupu 15% zvýšení FEV1 byla 6 minut a průměrná doba do dosažení maximálního účinku byla 50 až 55 minut. Průměrná doba trvání účinku měřená 15% zvýšením FEV1 byla 3 hodiny. U některých pacientů byla doba trvání účinku až 6 hodin.
jiné klinické studii u dospělých zabránily dvě inhalace inhalačního aerosolu PROVENTIL HFA podané 30 minut před cvičením bronchospasmu vyvolanému cvičením, jak bylo prokázáno udržením FEV1 v rozmezí 80 % výchozích hodnot u většiny pacientů.
Ve 4týdenní, randomizované, otevřené studii bylo hodnoceno 63 dětí ve věku 4 až 11 let s astmatem na bronchodilatační účinnost přípravku PROVENTIL HFA inhalační aerosol (33 pediatrických pacientů) ve srovnání s CFC 11/12. albuterolový inhalátor (30 dětských pacientů).
FEV1 jako procentuální změna oproti předdávce ve velké 12týdenní klinické studii
INFORMACE PRO PACIENTA
NÁVOD K POUŽITÍ
PROVENTIL® HFA (pro-vent-il) (albuterol sulfát) Inhalační aerosol s indikátorem dávky
Přečtěte si tento návod k použití, než začnete PROVENTIL 100 mcg HFA používat a pokaždé, když dostanete náplň. Mohou se objevit nové informace. Tyto informace nenahrazují rozhovor s lékařem o vašem zdravotním stavu nebo léčbě. Váš lékař by vám měl ukázat, jak má vaše dítě užívat PROVENTIL 100 mcg HFA.
Důležitá informace:
- PROVENTIL 100 mcg HFA je určen pouze k perorálnímu inhalačnímu použití.
- Užívejte PROVENTIL HFA přesně podle pokynů svého lékaře.
PROVENTIL® HFA inhalační aerosol se dodává jako kanystr s indikátorem dávky. Indikátor dávky je umístěn na horní straně nádobky, která se hodí do ovladače (viz obrázek A). Okénko displeje ukazatele dávky vám ukáže, kolik vstřiků léku vám zbývá. Při každém stisknutí středu indikátoru dávky se uvolní obláček léku.
- Ne použijte aktuátor PROVENTIL HFA s nádobkou s lékem z jakéhokoli jiného inhalátoru.
- Ne použijte nádobku PROVENTIL HFA s aktuátorem z jakéhokoli jiného inhalátoru.
Obrázek A 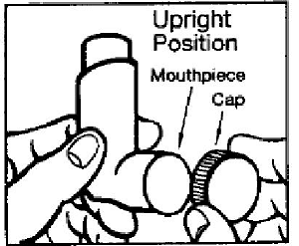
Před prvním použitím přípravku PROVENTIL HFA ujistěte se, že ukazatel na indikátoru dávky ukazuje napravo od inhalační značky „200“ v okénku zobrazení indikátoru dávky (viz obrázek A).
Každý kanystr PROVENTIL HFA obsahuje 200 vstřiků léku. To nezahrnuje spreje léků používané k naplnění vašeho inhalátoru.
- Okénko displeje ukazatele dávky se bude dále pohybovat po každých 10 vdechnutích.
- Číslo na displeji ukazatele dávky se bude měnit po každých 20 vdechnutích.
- Když ve vašem inhalátoru zbývá pouze 20 vstřiků léku, barva v okénku displeje ukazatele dávky se změní na červenou, jak je znázorněno ve stínované oblasti (viz obrázek B). To je, když potřebujete doplnit svůj předpis nebo se zeptat svého lékaře, zda potřebujete další předpis na PROVENTIL 100 mcg HFA.
Obrázek B 
Naplnění inhalátoru PROVENTIL HFA:
Před prvním použitím přípravku PROVENTIL HFA byste měli svůj inhalátor naplnit. Pokud přípravek PROVENTIL HFA nepoužíváte déle než 2 týdny, měli byste jej před použitím znovu naplnit.
- Odstraňte uzávěr z náustku (viz obrázek C). Před použitím zkontrolujte, zda uvnitř náustku nejsou předměty.
- Ujistěte se, že je nádobka zcela zasunuta do pohonu.
- Držte inhalátor ve vzpřímené poloze od obličeje a dobře s ním zatřeste.
- Úplně zatlačte na střed indikátoru dávky, aby se uvolnil sprej léku. Během odpočítávání můžete u indikátoru dávky slyšet jemné cvaknutí.
- Opakujte krok plnění ještě 3x, aby se uvolnily celkem 4 střiky léku. Před každým prostřikem inhalátor dobře protřepejte.
- Po 4 prostříknutích by měl ukazatel dávky ukazovat na 200. V nádobce nyní zbývají obláčky léku.
- Váš inhalátor je nyní připraven k použití.
Použití vašeho inhalátoru PROVENTIL 100 mcg HFA:
Krok 1: Před každým použitím inhalátor dobře protřepejte. Odstraňte uzávěr z náustku (viz obrázek C). Před použitím zkontrolujte, zda uvnitř náustku nejsou předměty. Ujistěte se, že je nádobka zcela zasunuta do pohonu.
Obrázek C 
Krok 2: Vydechněte tak úplně, jak pohodlně můžete ústy. Držte inhalátor ve vzpřímené poloze s náustkem směřujícím k vám a vložte náustek zcela do úst (viz obrázek D). Uzavřete rty kolem náustku.
Obrázek D 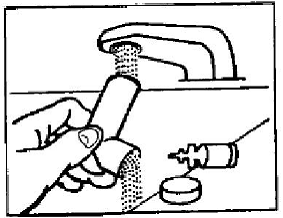
Krok 3: Zatímco se zhluboka a pomalu nadechujte, zatlačte ukazováčkem na střed indikátoru dávky, dokud se nádobka nepřestane pohybovat v aktuátoru a neuvolní se obláček léku (viz obrázek D). Poté přestaňte tisknout ukazatel dávky.
Krok 4: Zadržte dech tak dlouho, jak pohodlně můžete, až na 10 sekund. Vyjměte inhalátor z úst a poté vydechněte.
Krok 5: Pokud Vám lékař předepsal další dávky přípravku PROVENTIL 100 mcg HFA, počkejte 1 minutu a poté inhalátor dobře protřepejte. Opakujte kroky 3 až 5 v části „Použití inhalátoru PROVENTIL HFA“.
Krok 6: Ihned po použití víčko vyměňte.
Čištění vašeho inhalátoru PROVENTIL HFA:
Je velmi důležité, abyste udržovali náustek čistý, aby se lék nehromadil a neblokoval sprej přes náustek. Vyčistěte náustek 1krát týdně nebo pokud se náustek ucpe. (viz obrázek F)
Krok 1 : Vyjměte nádobku z ovladače a sejměte uzávěr z náustku. Kovovou nádobu nečistěte ani ji nenechte namočit.
Krok 2: Oplachujte náustek přes horní a spodní část teplou tekoucí vodou po dobu 30 sekund (viz obrázek E).
Obrázek E 
Krok 3: Setřeste z náustku tolik vody, kolik můžete.
Krok 4: Podívejte se do náustku, abyste se ujistili, že veškeré nahromaděné léky byly zcela smyty. Pokud je náustek ucpaný nánosem, z náustku vyteče málo nebo žádný lék (viz obrázek F). Pokud dojde k nahromadění, opakujte kroky 2 až 4 v části „Čištění inhalátoru PROVENTIL 100 mcg HFA“.
Obrázek F 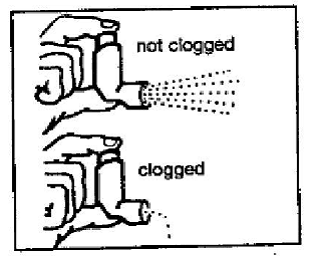
Krok 5: Nechte náustek vyschnout na vzduchu, např. přes noc (viz obrázek G). Nevkládejte nádobku zpět do aktuátoru, pokud je stále mokrá.
Obrázek G 
Krok 6: Když je náustek suchý, vložte nádobku zpět do aktuátoru a nasaďte na náustek uzávěr.
Poznámka: Pokud potřebujete inhalátor PROVENTIL 100 mcg HFA použít před úplným vyschnutím, vložte nádobku zpět do aktuátoru a dobře protřepejte inhalátor. Dvakrát zatlačte na střed indikátoru dávky, abyste uvolnili celkem 2 střiky do vzduchu směrem od obličeje. Užijte si předepsanou dávku, poté vyčistěte a osušte inhalátor na vzduchu, jak je popsáno v části „Čištění inhalátoru PROVENTIL HFA“.
Jak mám PROVENTIL HFA uchovávat?
- PROVENTIL HFA skladujte při pokojové teplotě mezi 59°F a 77°F (15°C a 25°C).
- Skladujte náustkem dolů.
- Nevystavujte PROVENTIL 100mcg HFA extrémnímu teplu a chladu.
- Kanystr nepropichujte ani nespalujte.
- Uchovávejte svůj inhalátor PROVENTIL 100 mcg HFA a všechny léky mimo dosah dětí.
Tento návod k použití byl schválen US Food and Drug Administration.
