Pulmicort 100mcg, 200mcg Budesonide Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Pulmicort 100 mcg Turbuhaler a jak se používá?
Pulmicort 100 mcg Turbuhaler je lék na předpis používaný k léčbě příznaků astmatu. Pulmicort 100 mcg Turbuhaler lze užívat samostatně nebo s jinými léky.
Pulmicort Turbuhaler patří do třídy léků nazývaných kortikosteroidy, inhalanty.
Není známo, zda je Pulmicort Turbuhaler bezpečný a účinný u dětí mladších 1 roku.
Jaké jsou možné vedlejší účinky přípravku Pulmicort 200 mcg Turbuhaler?
Pulmicort 100mcg Turbuhaler může způsobit závažné nežádoucí účinky včetně:
- kopřivka,
- potíže s dýcháním,
- otok obličeje, rtů, jazyka nebo hrdla,
- neobvyklá únava,
- problémy se zrakem,
- snadná tvorba modřin nebo krvácení,
- opuchlý obličej,
- neobvyklý růst vlasů,
- změny nálady,
- Deprese,
- změny nálady,
- míchání,
- svalová slabost nebo bolest,
- ztenčení kůže,
- pomalé hojení ran a
- zvýšená žízeň nebo močení
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Pulmicort 100 mcg Turbuhaler patří:
- sucho, podráždění nebo bolest v krku,
- chrapot,
- změny hlasu,
- špatná chuť v ústech,
- rýma nebo ucpaný nos a
- krvácení z nosu
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku Pulmicort Turbuhaler. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Pouze pro orální inhalaci.
POPIS
Budesonid, aktivní složka přípravku PULMICORT TURBUHALER (budesonid) 200 mcg, je kortikosteroid chemicky označený jako (RS)-11β, 16α, 17,21-Tetrahydroxypregna-1,4-dien-3,20-dion cyklický 16,17- acetal s butyraldehydem. Budesonid je poskytován jako směs dvou epimerů (22R a 22S). Empirický vzorec budesonidu je C25H34O6 a jeho molekulová hmotnost je 430,5. Jeho strukturní vzorec je:
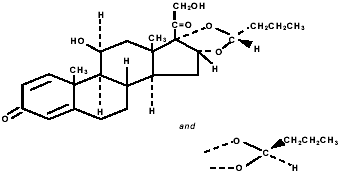
Budesonid je bílý až téměř bílý prášek bez chuti a zápachu, který je prakticky nerozpustný ve vodě a v heptanu, těžce rozpustný v ethanolu a snadno rozpustný v chloroformu. Jeho rozdělovací koeficient mezi oktanol a vodu při pH 7,4 je 1,6 x 103.
PULMICORT 100 mcg TURBUHALER (budesonid) je inhalační vícedávkový inhalátor suchého prášku, který obsahuje pouze mikronizovaný budesonid. Každá aktivace PULMICORT 100 mcg TURBUHALER poskytuje 200 mcg budesonidu na odměřenou dávku, která dodá přibližně 160 mcg budesonidu z náustku (na základě in vitro testování při 60 l/min po dobu 2 sekund).
Testování in vitro ukázalo, že podávání dávky pro PULMICORT 100 mcg TURBUHALER (budesonid) je podstatně závislé na průtoku vzduchu zařízením. Faktory pacienta, jako je inspirační průtok, také ovlivní dávku dodanou do plic pacientů při skutečném použití (viz Návod k použití pacienta ). U dospělých pacientů s astmatem (průměr FEV1 2,9 l [0,8 - 5,1 l]) byl průměrný vrcholový inspirační průtok (PIF) přes PULMICORT TURBUHALER (budesonid) 78 (40-111) l/min. Podobné výsledky (průměrný PIF 82 [43-125] l/min) byly získány u astmatických dětí (6 až 15 let, průměrná FEV1 2,1 l [0,9 - 5,4 l]). Pacienti by měli být pečlivě poučeni o použití tohoto léku, aby bylo zajištěno optimální podání dávky.
INDIKACE
PULMICORT TURBUHALER (budesonid) je indikován k udržovací léčbě astmatu jako profylaktická terapie u dospělých a dětských pacientů ve věku od šesti let. Je také indikován u pacientů vyžadujících léčbu astmatu perorálními kortikosteroidy. Mnoho z těchto pacientů může být časem schopno snížit nebo zcela eliminovat potřebu perorálních kortikosteroidů.
PULMICORT 100 mcg TURBUHALER (budesonid) NENÍ indikován k úlevě od akutního bronchospasmu.
DÁVKOVÁNÍ A PODÁVÁNÍ
PULMICORT 200 mcg TURBUHALER (budesonid) by měl být podáván orálně inhalační cestou u astmatických pacientů ve věku 6 let a starších. Jednotliví pacienti zaznamenají proměnlivý nástup a stupeň zmírnění symptomů. Obecně má PULMICORT TURBUHALER (budesonid) relativně rychlý nástup účinku na inhalační kortikosteroid. Zlepšení kontroly astmatu po inhalačním podání PULMICORT 200 mcg TURBUHALER (budesonid) může nastat do 24 hodin od zahájení léčby, i když maximálního přínosu nemusí být dosaženo po 1 až 2 týdnech nebo déle. Bezpečnost a účinnost přípravku PULMICORT TURBUHALER (budesonid) při podávání nad doporučené dávky nebyly stanoveny.
Doporučená počáteční dávka a nejvyšší doporučená dávka přípravku PULMICORT TURBUHALER (budesonid) na základě předchozí léčby astmatu jsou uvedeny v následující tabulce.
*U pacientů s mírným až středně těžkým astmatem, kteří jsou dobře kontrolováni inhalačními kortikosteroidy, lze zvážit dávkování přípravku PULMICORT 100 mcg TURBUHALER (budesonid) 200 mcg nebo 400 mcg jednou denně. PULMICORT 200 mcg TURBUHALER (budesonid) lze podávat jednou denně buď ráno nebo večer.
Pokud léčba jednou denně přípravkem PULMICORT 200 mcg TURBUHALER (budesonid) neposkytuje dostatečnou kontrolu příznaků astmatu, měla by být celková denní dávka zvýšena a/nebo podána jako rozdělená dávka.
Pacienti udržovaní na chronických perorálních kortikosteroidech
Zpočátku by měl být PULMICORT TURBUHALER (budesonid) používán současně s obvyklou udržovací dávkou systémového kortikosteroidu pacienta. Přibližně po jednom týdnu je zahájeno postupné vysazování systémového kortikosteroidu snižováním denní nebo alternativní denní dávky. Další snížení se provádí po intervalu jednoho nebo dvou týdnů, v závislosti na reakci pacienta. Obecně by tato snížení neměla překročit 2,5 mg prednisonu nebo jeho ekvivalentu. Důrazně se doporučuje pomalá rychlost stahování. Během snižování dávky perorálních kortikosteroidů by pacienti měli být pečlivě sledováni pro nestabilitu astmatu, včetně objektivních měření funkce dýchacích cest, a pro nedostatečnost nadledvin (viz VAROVÁNÍ ). Během vysazení mohou někteří pacienti pociťovat příznaky vysazení systémových kortikosteroidů, např. bolesti kloubů a/nebo svalů, malátnost a deprese, a to i přes udržení nebo dokonce zlepšení plicních funkcí. Takoví pacienti by měli být povzbuzováni, aby pokračovali v léčbě PULMICORT TURBUHALER (budesonid), ale měli by být sledováni kvůli objektivním známkám adrenální insuficience. Pokud se objeví známky adrenální insuficience, je třeba dočasně zvýšit dávky systémových kortikosteroidů a poté by vysazování mělo pokračovat pomaleji. Během období stresu nebo těžkého astmatického záchvatu mohou pacienti přeložení vyžadovat doplňkovou léčbu systémovými kortikosteroidy.
POZNÁMKA: U všech pacientů je žádoucí titrovat na nejnižší účinnou dávku, jakmile je dosaženo stability astmatu.
Návod k použití
Ilustrované pokyny pro pacienty pro použití doprovázejte každé balení PULMICORT 200mcg TURBUHALER (budesonid) .
Pacienti by měli být poučeni, aby před prvním použitím naplnili PULMICORT TURBUHALER (budesonid), a poučili je, aby se při každém použití jednotky zhluboka a silně nadechli. Po inhalaci se také doporučuje vypláchnout ústa.
JAK DODÁVÁNO
PULMICORT TURBUHALER (budesonid) se skládá z řady sestavených plastových detailů, hlavními částmi jsou dávkovací mechanismus, zásobník na léčivou látku a náustek. Inhalátor je chráněn bílým vnějším tubulárním krytem našroubovaným na inhalátor. Tělo inhalátoru je bílé a otočná rukojeť je hnědá. Na rukojeti je vytištěno následující znění „Pulmicort™ 200 mcg“. Inhalátor TURBUHALER nelze znovu naplnit a prázdný by měl být zlikvidován.
PULMICORT TURBUHALER (budesonid) je dostupný jako 200 mcg/dávka, 200 dávek (NDC 0186-0915-42) a má cílovou hmotnost náplně 104 mg.
Když v PULMICORT 200mcg TURBUHALER (budesonid) zbývá 20 dávek, v okénku indikátoru se objeví červená značka. Pokud je přístroj používán za bodem, ve kterém se ve spodní části okénka objeví červená značka, nemusí být získáno správné množství léku. Jednotka by měla být zlikvidována.
Skladujte s utaženým krytem na suchém místě při kontrolované pokojové teplotě 20-25°C (68-77°F) [viz USP]. Udržujte mimo dosah dětí.
Všechny ochranné známky jsou majetkem skupiny společností AstraZeneca. ©AstraZeneca 2001, 2006. Vyrobeno pro: AstraZeneca LP, Wilmington, DE 19850 Autor: AstraZeneca AB, Sodertalje, Švédsko 33020-00. Rev. 10/06. Datum revize FDA: 20. 8. 2007
VEDLEJŠÍ EFEKTY
Následující nežádoucí účinky byly hlášeny u pacientů léčených přípravkem PULMICORT 100 mcg TURBUHALER (budesonid).
Výskyt běžných nežádoucích účinků je založen na dvojitě zaslepených, placebem kontrolovaných klinických studiích v USA, ve kterých bylo 1 116 dospělých a dětských pacientů ve věku 6–70 let (472 žen a 644 mužů) léčeno přípravkem PULMICORT TURBUHALER (budesonid) (200 až 800 mcg dvakrát denně po dobu 12 až 20 týdnů) nebo placebo.
Následující tabulka ukazuje výskyt nežádoucích účinků u pacientů, kteří dříve dostávali bronchodilatátory a/nebo inhalační kortikosteroidy v kontrolovaných klinických studiích v USA. Tato populace zahrnovala 232 dětských pacientů mužského a 62 ženského pohlaví (ve věku 6 až 17 let) a 332 dospělých mužů a 331 žen (věk 18 let a více).
Nežádoucí příhody s ≥ 3% incidencí hlášenou pacienty na PULMICORT 100 mcg TURBUHALER (budesonid)
Výše uvedená tabulka zahrnuje všechny příhody (ať už jsou zkoušejícími považovány za související nebo nesouvisející s drogou), které se vyskytly v míře ≥ 3 % v kterékoli skupině PULMICORT TURBUHALER (budesonid) a byly častější než ve skupině s placebem. Při zvažování těchto údajů je třeba vzít v úvahu zvýšenou průměrnou dobu expozice u pacientů s PULMICORT 200 mcg TURBUHALER (budesonid).
Následující další nežádoucí účinky se vyskytly v těchto klinických studiích s PULMICORT 100 mcg TURBUHALER (budesonid) s incidencí 1 až 3 % a byly častější u PULMICORT 200 mcg TURBUHALER (budesonid) než u placeba.
Tělo jako celek: bolest krku
Kardiovaskulární: synkopa
Zažívací: bolest břicha, sucho v ústech, zvracení
Metabolické a nutriční: přibývání na váze
Muskuloskeletální: zlomenina, myalgie
Nervový: hypertonie, migréna
Krvácení a srážení krevních destiček: ekchymóza
psychiatrické: nespavost
Odolné mechanismy: infekce
Speciální smysly: chuťová perverze
Ve 20týdenní studii u dospělých astmatiků, kteří dříve vyžadovali perorální kortikosteroidy, byly účinky přípravku PULMICORT TURBUHALER (budesonid) 400 mcg dvakrát denně (N=53) a 800 mcg dvakrát denně (N=53) srovnány s placebem (N=53). ) na frekvenci hlášených nežádoucích účinků. Nežádoucí příhody, ať už jsou zkoušejícími považovány za související nebo nesouvisející s léky, hlášené u více než pěti pacientů ve skupině PULMICORT 200 mcg TURBUHALER (budesonid) a které se vyskytovaly častěji u PULMICORT TURBUHALER (budesonid) než u placeba, jsou uvedeny níže ( % PULMICORT TURBUHALER (budesonid) a % placeba). Při zvažování těchto údajů je třeba vzít v úvahu zvýšenou průměrnou dobu expozice u pacientů s PULMICORT 200 mcg TURBUHALER (budesonid) (78 dní u PULMICORT TURBUHALER (budesonid) vs. 41 dní u placeba).
Pacienti, kteří dostávají PULMICORT TURBUHALER (budesonid) jednou denně
Profil nežádoucích účinků podávání přípravku PULMICORT 100 mcg TURBUHALER (budesonid) 200 mcg a 400 mcg jednou denně a placeba byl hodnocen u 309 dospělých pacientů s astmatem v 18týdenní studii. Populace studie zahrnovala jak pacienty dříve léčené inhalačními kortikosteroidy, tak pacienty, kteří dříve kortikosteroidní léčbu nedostávali. Nebyl žádný klinicky významný rozdíl ve vzoru nežádoucích účinků po podávání přípravku PULMICORT 200 mcg TURBUHALER (budesonid) jednou denně ve srovnání s dávkováním dvakrát denně.
Pediatrické studie: Ve 12týdenní placebem kontrolované studii u 404 pediatrických pacientů ve věku 6 až 18 let, kteří byli předtím léčeni inhalačními kortikosteroidy, byla frekvence nežádoucích účinků pro každou věkovou kategorii (6 až 12 let, 13 až 18 let) srovnatelná pro PULMICORT TURBUHALER (budesonid) (při 100, 200 a 400 mcg dvakrát denně) a placebo. Neexistovaly žádné klinicky relevantní rozdíly ve vzoru nebo závažnosti nežádoucích účinků u dětí ve srovnání s těmi, které byly hlášeny u dospělých.
Hlášení nežádoucích událostí z jiných zdrojů: Vzácné nežádoucí účinky hlášené v publikované literatuře nebo z celosvětové marketingové zkušenosti s jakoukoli lékovou formou inhalačního budesonidu zahrnují: okamžité a opožděné hypersenzitivní reakce včetně vyrážky, kontaktní dermatitidy, kopřivky, angioedému a bronchospasmu; příznaky hypokorticismu a hyperkorticismu; glaukom, šedý zákal; psychiatrické symptomy včetně deprese, agresivních reakcí, podrážděnosti, úzkosti a psychózy.
DROGOVÉ INTERAKCE
klinických studiích nevedlo současné podávání budesonidu a jiných léků běžně používaných k léčbě astmatu ke zvýšené frekvenci nežádoucích účinků. Hlavní cestou metabolismu budesonidu, stejně jako ostatních kortikosteroidů, je izoenzym 3A4 (CYP3A4) cytochromu P450 (CYP). Po perorálním podání ketokonazolu, silného inhibitoru CYP3A4, se průměrná plazmatická koncentrace perorálně podaného budesonidu zvýšila. Současné podávání jiných známých inhibitorů CYP3A4 (např. itrakonazol, klarithromycin, erytromycin atd.) může inhibovat metabolismus budesonidu a zvýšit systémovou expozici budesonidu. Při současném podávání budesonidu s ketokonazolem a jinými známými inhibitory CYP3A4 je třeba opatrnosti.
VAROVÁNÍ
Zvláštní opatrnosti je zapotřebí u pacientů, kteří jsou převedeni ze systémově aktivních kortikosteroidů na PULMICORT 200 mcg TURBUHALER (budesonid), protože u astmatických pacientů došlo během a po přechodu ze systémových kortikosteroidů na méně systémově dostupné inhalační kortikosteroidy k úmrtím v důsledku insuficience nadledvin. Po vysazení systémových kortikosteroidů je k obnovení funkce hypotalamus-hypofýza-nadledviny (HPA) zapotřebí několik měsíců.
Pacienti, kteří byli dříve udržováni na 20 mg nebo více prednisonu (nebo jeho ekvivalentu) denně, mohou být nejcitlivější, zvláště když jim byly systémové kortikosteroidy téměř úplně vysazeny. Během tohoto období suprese HPA mohou pacienti vykazovat známky a příznaky adrenální insuficience, když jsou vystaveni traumatu, chirurgickému zákroku nebo infekci (zejména gastroenteritidě) nebo jiným stavům spojeným s těžkou ztrátou elektrolytů. Přestože PULMICORT TURBUHALER (budesonid) může zajistit kontrolu příznaků astmatu během těchto epizod, v doporučených dávkách dodává menší než normální fyziologické množství glukokortikoidů systémově a NEZAJIŠŤUJE mineralokortikoidní aktivitu, která je nezbytná pro zvládnutí těchto mimořádných událostí.
Během období stresu nebo těžkého astmatického záchvatu by pacienti, kterým byly vysazeny systémové kortikosteroidy, měli být poučeni, aby okamžitě obnovili perorální kortikosteroidy (ve velkých dávkách) a aby kontaktovali svého lékaře pro další instrukce. Tito pacienti by měli být také poučeni, aby nosili lékařskou identifikační kartu, která uvádí, že mohou potřebovat doplňkové systémové kortikosteroidy během období stresu nebo těžkého astmatického záchvatu.
Pacienti vyžadující perorální kortikosteroidy by měli být po převedení na PULMICORT 100 mcg TURBUHALER (budesonid) pomalu odstaveni ze systémového užívání kortikosteroidů. Během vysazování perorálních kortikosteroidů by měly být pečlivě sledovány funkce plic (FEV1 nebo AM PEF), užívání beta-agonistů a příznaky astmatu. Kromě sledování známek a příznaků astmatu je třeba u pacientů sledovat známky a příznaky nedostatečnosti nadledvin, jako je únava, malátnost, slabost, nauzea a zvracení a hypotenze.
Převedení pacientů z léčby systémovými kortikosteroidy na PULMICORT 200 mcg TURBUHALER (budesonid) může demaskovat alergické stavy dříve potlačené systémovou kortikosteroidní léčbou, např. rýmu, konjunktivitidu, artritidu, eozinofilní stavy a ekzémy (viz. DÁVKOVÁNÍ A PODÁVÁNÍ ).
Pacienti, kteří užívají léky, které potlačují imunitní systém, jsou náchylnější k infekci než zdraví jedinci. Například plané neštovice a spalničky mohou mít závažnější nebo dokonce smrtelný průběh u citlivých dětských pacientů nebo dospělých na imunosupresivních dávkách kortikosteroidů. U pediatrických nebo dospělých pacientů, kteří neměli tato onemocnění, je třeba věnovat zvláštní pozornost tomu, aby se zabránilo expozici. Není známo, jak dávka, cesta a délka podávání kortikosteroidů ovlivňuje riziko rozvoje diseminované infekce. Není také znám podíl základního onemocnění a/nebo předchozí léčby kortikosteroidy na riziku. Pokud dojde k expozici, může být indikována léčba imunoglobulinem proti varicella zoster (VZIG) nebo kombinovaným intravenózním imunoglobulinem (IVIG). Při expozici spalničkám může být indikována profylaxe sdruženým intramuskulárním imunoglobulinem (IG). (Viz příslušné příbalové informace pro kompletní informace o předepisování VZIG a IG.) Pokud se rozvinou plané neštovice, lze zvážit léčbu antivirotiky.
PULMICORT 200 mcg TURBUHALER (budesonid) není bronchodilatátor a není indikován k rychlé úlevě od bronchospasmu nebo jiných akutních epizod astmatu.
Stejně jako u jiných inhalačních léků na astma se po podání může objevit bronchospasmus s okamžitým zesílením sípání. Pokud se po podání přípravku PULMICORT TURBUHALER (budesonid) objeví bronchospasmus, měl by být okamžitě léčen rychle působícím inhalačním bronchodilatátorem. Léčba přípravkem PULMICORT TURBUHALER (budesonid) by měla být přerušena a měla by být zahájena alternativní léčba.
Pacienti by měli být poučeni, aby okamžitě kontaktovali svého lékaře, pokud se během léčby přípravkem PULMICORT TURBUHALER (budesonid) objeví epizody astmatu, které nereagují na jejich obvyklé dávky bronchodilatancií. Během těchto epizod mohou pacienti vyžadovat léčbu perorálními kortikosteroidy.
OPATŘENÍ
Všeobecné
Během vysazení perorálních kortikosteroidů mohou někteří pacienti pociťovat příznaky vysazení systémově aktivních kortikosteroidů, např. bolesti kloubů a/nebo svalů, malátnost a deprese, a to i přes udržení nebo dokonce zlepšení respiračních funkcí (viz DÁVKOVÁNÍ A PODÁVÁNÍ ).
U citlivých pacientů může PULMICORT TURBUHALER (budesonid) umožnit kontrolu příznaků astmatu s menší supresí funkce osy HPA než terapeuticky ekvivalentní perorální dávky prednisonu. Vzhledem k tomu, že budesonid je absorbován do krevního oběhu a může být systémově aktivní, lze příznivé účinky přípravku PULMICORT 100 mcg TURBUHALER (budesonid) při minimalizaci dysfunkce HPA očekávat pouze tehdy, pokud nejsou překročeny doporučené dávky a jednotliví pacienti jsou titrováni na nejnižší účinnou dávku. Vzhledem k tomu, že existuje individuální citlivost na účinky na produkci kortizolu, měli by lékaři vzít v úvahu tuto informaci při předepisování přípravku PULMICORT 100 mcg TURBUHALER (budesonid).
Vzhledem k možnosti systémové absorpce inhalačních kortikosteroidů by pacienti léčení přípravkem PULMICORT 200 mcg TURBUHALER (budesonid) měli být pečlivě sledováni s ohledem na jakékoli známky systémových účinků kortikosteroidů. Zvláštní pozornost by měla být věnována sledování pacientů po operaci nebo během období stresu, zda nedochází k průkazu nedostatečné odpovědi nadledvin.
Je možné, že se u malého počtu pacientů, zvláště při vyšších dávkách, mohou objevit systémové účinky kortikosteroidů, jako je hyperkorticismus, snížená hustota kostních minerálů a suprese nadledvin. Pokud k takovým změnám dojde, PULMICORT 100 mcg TURBUHALER (budesonid) by měl být snižován pomalu, v souladu s přijatými postupy pro zvládání příznaků astmatu a pro snižování systémových steroidů.
Perorálně inhalované kortikosteroidy, včetně budesonidu, mohou při podávání pediatrickým pacientům způsobit snížení rychlosti růstu. Ke snížení rychlosti růstu může dojít v důsledku nedostatečné kontroly astmatu nebo v důsledku použití kortikosteroidů k léčbě. Potenciální účinky dlouhodobé léčby na rychlost růstu by měly být zváženy oproti získaným klinickým přínosům a rizikům spojeným s alternativními terapiemi. Aby se minimalizovaly systémové účinky perorálně inhalovaných kortikosteroidů, včetně PULMICORT 200 mcg TURBUHALER (budesonid), měl by být každý pacient titrován na jeho nejnižší účinnou dávku (viz BEZPEČNOSTNÍ OPATŘENÍ, Pediatrické použití ).
Přestože pacienti v klinických studiích dostávali PULMICORT TURBUHALER (budesonid) nepřetržitě po dobu 1 až 2 let, dlouhodobé lokální a systémové účinky přípravku PULMICORT 200 mcg TURBUHALER (budesonid) u lidských subjektů nejsou zcela známy. Nejsou známy zejména účinky vyplývající z chronického užívání PULMICORT TURBUHALER (budesonid) na vývojové nebo imunologické procesy v ústech, hltanu, průdušnici a plicích.
V klinických studiích s PULMICORT TURBUHALER (budesonid) se u některých pacientů vyskytly lokalizované infekce Candida albicans v ústech a hltanu. Tyto infekce mohou vyžadovat léčbu vhodnou antifungální terapií a/nebo přerušení léčby přípravkem PULMICORT TURBUHALER (budesonid).
Inhalační kortikosteroidy by měly být používány s opatrností, pokud vůbec, u pacientů s aktivní nebo klidovou tuberkulózní infekcí dýchacích cest, neléčenými systémovými mykotickými, bakteriálními, virovými nebo parazitárními infekcemi nebo očním herpes simplex.
Po inhalačním podání kortikosteroidů byly hlášeny vzácné případy glaukomu, zvýšeného nitroočního tlaku a katarakty.
Informace pro pacienty
Pacienti léčení přípravkem PULMICORT TURBUHALER (budesonid) by měli obdržet následující informace a pokyny. Tyto informace mají pacientovi pomoci při bezpečném a účinném užívání léku. Nejedná se o odhalení všech možných nepříznivých nebo zamýšlených účinků. Pro správné použití PULMICORT 200 mcg TURBUHALER (budesonid) a pro dosažení maximálního zlepšení by si pacient měl přečíst a dodržovat přiložené Pokyny pro pacienty pro Používejte opatrně.
- Pacienti by měli používat PULMICORT 200 mcg TURBUHALER (budesonid) v pravidelných intervalech podle pokynů, protože jeho účinnost závisí na pravidelném užívání. Pacient by neměl měnit předepsané dávkování, pokud mu to nedoporučí lékař.
- Pacienti by měli být informováni, že PULMICORT 100 mcg TURBUHALER (budesonid) není bronchodilatátor a není určen k léčbě akutních nebo život ohrožujících epizod astmatu.
- Pacienti by měli být informováni, že účinnost přípravku PULMICORT 100 mcg TURBUHALER (budesonid) závisí na správném použití zařízení a technice inhalačního podání:
- 1. PULMICORT TURBUHALER (budesonid) musí být během plnění ve svislé poloze (náustek nahoře), aby byla podána správná dávka.
- 2. PULMICORT 100mcg TURBUHALER (budesonid) musí být napuštěn, když je jednotka použita úplně poprvé. Chcete-li jednotku naplnit, musíte ji držet ve vzpřímené poloze a hnědou rukojeť otočit zcela doprava a poté zcela otočit doleva, dokud nezaklapne. Opakovat.
- 3. Chcete-li natáhnout první dávku, musíte rukojeť otočit úplně doprava a úplně doleva, dokud nezaklapne.
- 4. Po první dávce není nutné jednotku plnit. Bezprostředně před použitím je však nutné jej zatížit ve svislé poloze, jak je popsáno výše.
- 5. Pacientům je třeba doporučit, aby inhalátorem netřásli.
- Pacienti by měli vložit náustek mezi rty a silně a zhluboka vdechovat. Prášek je poté dopraven do plic.
- Pacienti by neměli vydechovat přes PULMICORT TURBUHALER (budesonid).
- Vzhledem k malému objemu prášku nemusí pacient při inhalaci z inhalátoru TURBUHALER cítit chuť ani cítit přítomnost jakéhokoli léku vstupujícího do plic. Tento nedostatek pocitu neznamená, že pacient nemá prospěch z PULMICORT TURBUHALER (budesonid).
- Pacienty je třeba upozornit, že vyplachování úst vodou bez polknutí po každé dávce může snížit riziko rozvoje orální kandidózy.
- Pacienti by měli být poučeni, že dostanou novou jednotku PULMICORT TURBUHALER (budesonid) pokaždé, když doplní svůj předpis. Pacienti by měli být poučeni, aby po použití uvedeného počtu inhalací zlikvidovali celé zařízení. Když v PULMICORT TURBUHALER (budesonid) zbývá 20 dávek, v okénku indikátoru se objeví červená značka.
- PULMICORT TURBUHALER (budesonid) by se neměl používat s distanční vložkou.
- Náustek by se neměl kousat ani žvýkat.
- Kryt by měl být po každém otevření bezpečně nasazen.
- Pacienti by měli udržovat PULMICORT TURBUHALER (budesonid) vždy čistý a suchý.
- Pacienti by měli být informováni, že ke zlepšení kontroly astmatu po inhalaci PULMICORT TURBUHALER (budesonid) může dojít do 24 hodin od zahájení léčby, ačkoli maximálního přínosu nemusí být dosaženo po 1 až 2 týdnech nebo déle. Pokud se příznaky v tomto časovém období nezlepší nebo pokud se stav zhorší, pacient by měl být poučen, aby nezvyšoval dávkování, ale aby kontaktoval lékaře.
- Pacienti, jejichž systémové kortikosteroidy byly sníženy nebo vysazeny, by měli být poučeni, aby nosili varovnou kartu s upozorněním, že mohou potřebovat doplňkové systémové kortikosteroidy během období stresu nebo astmatického záchvatu, který nereaguje na bronchodilatanci.
- Pacientům je třeba doporučit, aby náhle neukončovali užívání přípravku PULMICORT TURBUHALER (budesonid).
- Pacienti by měli být varováni, aby se vyvarovali kontaktu s planými neštovicemi nebo spalničkami, a pokud jsou vystaveni, aby se neprodleně poradili se svým lékařem.
- Dlouhodobé užívání inhalačních kortikosteroidů, včetně budesonidu, může zvýšit riziko některých očních problémů (katarakta nebo glaukom). Je třeba zvážit pravidelné oční prohlídky.
- Ženy zvažující použití PULMICORT TURBUHALER (budesonid) by se měly poradit se svým lékařem, pokud jsou těhotné nebo plánují otěhotnět, nebo pokud kojí dítě.
- Pacienti zvažující použití PULMICORT TURBUHALER (budesonid) by se měli poradit se svým lékařem, pokud jsou alergičtí na budesonid nebo jakýkoli jiný perorálně inhalovaný kortikosteroid.
- Pacienti by měli informovat svého lékaře o dalších lécích, které užívají, protože PULMICORT 100 mcg TURBUHALER (budesonid) nemusí být za určitých okolností vhodný a lékař může chtít použít jiný lék.
Karcinogeneze, mutageneze, zhoršení plodnosti
Dlouhodobé studie byly provedeny na potkanech a myších s perorálním podáváním ke zhodnocení karcinogenního potenciálu budesonidu.
Ve 104týdenní perorální studii na potkanech Sprague-Dawley bylo pozorováno statisticky významné zvýšení výskytu gliomů u samců potkanů, kteří dostávali perorální dávku 50 mcg/kg/den (méně než maximální doporučená denní inhalační dávka u dospělých a děti na základě mcg/m2). U samců a samic potkanů nebyla pozorována žádná tumorigenicita při příslušných perorálních dávkách až do 25 a 50 mcg/kg (méně než maximální doporučená denní inhalační dávka u dospělých a dětí na základě mcg/m2). Ve dvou dalších dvouletých studiích u samců potkanů Fischer a Sprague-Dawley nezpůsobil budesonid žádné gliomy při perorální dávce 50 mcg/kg (méně než maximální doporučená denní inhalační dávka u dospělých a dětí na základě mcg/m2). U samců potkanů Sprague-Dawley však budesonid způsobil statisticky významný nárůst výskytu hepatocelulárních nádorů při perorální dávce 50 mcg/kg (méně než maximální doporučená denní inhalační dávka u dospělých a dětí na základě mcg/m2 ). Souběžné referenční kortikosteroidy (prednison a triamcinolon acetonid) v těchto dvou studiích vykazovaly podobná zjištění.
Při perorálním podávání budesonidu po dobu 91 týdnů myším v dávkách až 200 mcg/kg/den (méně než maximální doporučená denní inhalační dávka u dospělých a dětí na základě mcg/m2) nebyly prokázány žádné důkazy o karcinogenním účinku.
Budesonid nebyl mutagenní ani klastogenní v šesti různých testovacích systémech: Ames Salmonella/mikrozomový destičkový test, myší mikronukleový test, myší lymfomový test, test chromozomových aberací v lidských lymfocytech, pohlavně vázaný recesivní letální test u Drosophila melanogaster a analýza opravy DNA u potkana kultury hepatocytů.
U potkanů neměl budesonid při subkutánních dávkách až do 80 mcg/kg (méně než maximální doporučená denní inhalační dávka pro člověka na základě mcg/m2) žádný účinek na fertilitu.
Při dávce 20 mcg/kg/den (méně než maximální doporučená denní inhalační dávka pro člověka na základě mcg/m2) bylo pozorováno snížení přírůstku tělesné hmotnosti matky, prenatální životaschopnosti a životaschopnosti mláďat při narození a během laktace. Žádné takové účinky nebyly zaznamenány při dávce 5 mcg/kg (méně než maximální doporučená denní inhalační dávka pro člověka u dospělých na základě mcg/m2).
Těhotenství: Teratogenní účinky
Těhotenství kategorie B: Stejně jako ostatní glukokortikoidy způsoboval budesonid úbytek plodu, snížení hmotnosti mláďat a kosterní abnormality při subkutánních dávkách 25 mcg/kg/den u králíků (méně než maximální doporučená denní inhalační dávka pro člověka na základě mcg/m2) a 500 mcg/kg/den u potkanů (přibližně 3násobek maximální doporučené denní inhalační dávky pro člověka na základě mcg/m2).
potkanů nebyly pozorovány žádné teratogenní nebo embryocidní účinky, když byl budesonid podáván inhalačně v dávkách až 250 mcg/kg/den (ekvivalentní maximální doporučené denní inhalační dávce u člověka na základě mcg/m2).
Zkušenosti s perorálními kortikosteroidy od jejich zavedení do farmakologie na rozdíl od fyziologických dávek naznačují, že hlodavci jsou náchylnější k teratogenním účinkům kortikosteroidů než lidé.
Studie na těhotných ženách však neprokázaly, že PULMICORT TURBUHALER (budesonid) zvyšuje riziko abnormalit při podávání během těhotenství. Výsledky velké populační prospektivní kohortové epidemiologické studie zkoumající data ze tří švédských registrů pokrývajících přibližně 99 % těhotenství v letech 1995-1997 (tj. švédský lékařský registr narození; registr vrozených malformací; registr dětských kardiologických vad) nenaznačují žádné zvýšené riziko na vrozené vývojové vady z užívání inhalačního budesonidu během časného těhotenství. Vrozené malformace byly studovány u 2 014 kojenců narozených matkám, které uváděly užívání inhalačního budesonidu k léčbě astmatu v časném těhotenství (obvykle 10–12 týdnů po poslední menstruaci), tedy v období, kdy dochází k většině hlavních orgánových malformací. Míra zaznamenaných vrozených vad byla podobná jako v běžné populaci (3,8 % vs. 3,5 %). Kromě toho po expozici inhalačnímu budesonidu byl počet dětí narozených s orofaciálními rozštěpy podobný očekávanému počtu v normální populaci (4 děti vs. 3,3).
Stejná data byla použita ve druhé studii, která přinesla celkový počet 2 534 kojencům, jejichž matky byly vystaveny inhalačnímu budesonidu. V této studii se míra vrozených malformací u kojenců, jejichž matky byly vystaveny inhalačnímu budesonidu během časného těhotenství, nelišila od míry u všech novorozenců ve stejném období (3,6 %).
Navzdory nálezům na zvířatech by se zdálo, že možnost poškození plodu je malá, pokud je lék užíván během těhotenství. Nicméně, protože studie na lidech nemohou vyloučit možnost poškození, PULMICORT TURBUHALER (budesonid) by měl být během těhotenství používán pouze tehdy, je-li to nezbytně nutné.

Neteratogenní účinky
Hypoadrenalismus se může objevit u kojenců narozených matkám užívajícím kortikosteroidy během těhotenství. Takové děti by měly být pečlivě sledovány.
Kojící matky
Kortikosteroidy se vylučují do mateřského mléka. Vzhledem k potenciálu nežádoucích účinků u kojících dětí na jakýkoli kortikosteroid by mělo být rozhodnuto, zda přerušit kojení nebo přerušit léčbu, přičemž je třeba vzít v úvahu důležitost léku pro matku. Aktuální údaje o budesonidu chybí.
Pediatrické použití
Bezpečnost a účinnost přípravku PULMICORT 100 mcg TURBUHALER (budesonid) u pediatrických pacientů mladších 6 let nebyla stanovena.
U pediatrických pacientů s astmatem byla frekvence nežádoucích účinků pozorovaných u přípravku PULMICORT 100 mcg TURBUHALER (budesonid) podobná ve věkové skupině 6–12 let (N=172) ve srovnání s věkovou skupinou 13–17 let (N=124). .
Kontrolované klinické studie ukázaly, že perorálně inhalované kortikosteroidy mohou způsobit snížení rychlosti růstu u pediatrických pacientů. Tento účinek byl pozorován při absenci laboratorních důkazů suprese osy hypotalamus-hypofýza-nadledviny (HPA), což naznačuje, že rychlost růstu je citlivějším indikátorem systémové expozice kortikosteroidům u pediatrických pacientů než některé běžně používané testy funkce osy HPA. Dlouhodobé účinky tohoto snížení rychlosti růstu spojené s perorálně inhalovanými kortikosteroidy včetně dopadu na konečnou výšku v dospělosti nejsou známy. Potenciál „dohnat“ růst po přerušení léčby perorálně inhalovanými kortikosteroidy nebyl dostatečně studován.
Ve studii s astmatickými dětmi ve věku 5-12 let měli pacienti léčení přípravkem PULMICORT 200 mcg TURBUHALER (budesonid) 200 mcg dvakrát denně (n=311) snížení růstu o 1,1 centimetru ve srovnání s těmi, kteří dostávali placebo (n=418) v konec jednoho roku; rozdíl mezi těmito dvěma léčebnými skupinami se během tří let dodatečné léčby dále nezvětšil. Na konci čtyř let měly děti léčené přípravkem PULMICORT TURBUHALER (budesonid) a děti léčené placebem podobnou rychlost růstu. Závěry vyvozené z této studie mohou být zkresleny nerovnoměrným používáním kortikosteroidů v léčebných skupinách a zahrnutím údajů od pacientů, kteří v průběhu studie dosáhli puberty.
Růst pediatrických pacientů, kteří dostávají perorálně inhalační kortikosteroidy, včetně PULMICORT TURBUHALER (budesonid), by měl být rutinně sledován (např. prostřednictvím stadiometrie). Potenciální růstové účinky prodloužené léčby by měly být zváženy se získanými klinickými přínosy a riziky a přínosy spojenými s alternativními terapiemi. Aby se minimalizovaly systémové účinky inhalačních kortikosteroidů, včetně PULMICORT 100 mcg TURBUHALER (budesonid), měl by být každý pacient titrován na jeho nejnižší účinnou dávku.
Geriatrické použití
Do kontrolovaných klinických studií PULMICORT 100mcg TURBUHALER (budesonid) v USA a mimo USA bylo zahrnuto sto pacientů ve věku 65 let nebo starších. Nebyly žádné rozdíly v bezpečnosti a účinnosti léku ve srovnání s těmi, které byly pozorovány u mladších pacientů.
Obecně by měl být výběr dávky pro staršího pacienta opatrný, obvykle začínající na spodní hranici dávkovacího rozmezí, což odráží vyšší frekvenci snížené funkce jater, ledvin nebo srdce a souběžného onemocnění nebo jiné lékové terapie.
PŘEDÁVKOVAT
Potenciál akutních toxických účinků po předávkování PULMICORT 100mcg TURBUHALER (budesonid) je nízký. Pokud jsou užívány v nadměrných dávkách po delší dobu, mohou se objevit systémové účinky kortikosteroidů, jako je hyperkorticismus (viz OPATŘENÍ ). PULMICORT TURBUHALER ve dvojnásobku nejvyšší doporučené dávky (3200 mcg denně) podávaný po dobu 6 týdnů způsobil významné snížení (27 %) odpovědi plazmatického kortizolu na 6hodinovou infuzi ACTH ve srovnání s placebem (+1 %). Odpovídajícím účinkem 10 mg prednisonu denně bylo 35% snížení odpovědi plazmatického kortizolu na ACTH.
Minimální inhalační letální dávka u myší byla 100 mg/kg (přibližně 320násobek maximální doporučené denní inhalační dávky u dospělých a přibližně 380násobek maximální doporučené denní inhalační dávky u dětí na základě mcg/m2). Po podání inhalační dávky 68 mg/kg u potkanů nedošlo k žádnému úmrtí (přibližně 430násobek maximální doporučené denní inhalační dávky u dospělých a přibližně 510násobek maximální doporučené denní inhalační dávky u dětí na základě mcg/m2). Minimální orální letální dávka byla 200 mg/kg u myší (přibližně 630násobek maximální doporučené denní inhalační dávky u dospělých a přibližně 750násobek maximální doporučené denní inhalační dávky u dětí na základě mcg/m2) a méně než 100 mg/kg u potkanů (přibližně 630násobek maximální doporučené denní inhalační dávky u dospělých a přibližně 750násobek maximální doporučené denní inhalační dávky u dětí na základě mcg/m2).
Postmarketingové zkušenosti ukázaly, že pacienti, u kterých došlo k akutnímu předávkování inhalačním budesonidem, často zůstali asymptomatičtí. Užívání nadměrných dávek (až 6400 mcg denně) po delší dobu vykazovalo systémové kortikosteroidní účinky, jako je hyperkorticismus.
KONTRAINDIKACE
PULMICORT TURBUHALER (budesonid) je kontraindikován v primární léčbě status asthmaticus nebo jiných akutních epizod astmatu, kde jsou nutná intenzivní opatření.
Přecitlivělost na budesonid kontraindikuje použití PULMICORT TURBUHALER (budesonid).
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Budesonid je protizánětlivý kortikosteroid, který vykazuje silnou glukokortikoidní aktivitu a slabou mineralokortikoidní aktivitu. Ve standardních in vitro a zvířecích modelech má budesonid přibližně 200krát vyšší afinitu ke glukokortikoidnímu receptoru a 1000krát vyšší topickou protizánětlivou účinnost než kortizol (test ušního edému krysího krotonového oleje). Jako měřítko systémové aktivity je budesonid 40krát účinnější než kortizol při subkutánním podání a 25krát účinnější při perorálním podání v testu involuce brzlíku u potkana.
Aktivita PULMICORT 100mcg TURBUHALER je způsobena mateřským lékem budesonidem. Ve studiích afinity ke glukokortikoidnímu receptoru byla forma 22R dvakrát tak aktivní než epimer 22S. Studie in vitro ukázaly, že tyto dvě formy budesonidu se vzájemně nekonvertují.
Přesný mechanismus působení kortikosteroidů na zánět u astmatu není znám. Zánět je důležitou složkou v patogenezi astmatu. Bylo prokázáno, že kortikosteroidy mají širokou škálu inhibičních aktivit proti více typům buněk (např. žírné buňky, eozinofily, neutrofily, makrofágy a lymfocyty) a mediátorům (např. histamin, eikosanoidy, leukotrieny a cytokiny), které se účastní alergických a - alergicky zprostředkovaný zánět. Tyto protizánětlivé účinky kortikosteroidů mohou přispívat k jejich účinnosti u astmatu.
Studie u astmatických pacientů prokázaly příznivý poměr mezi lokální protizánětlivou aktivitou a systémovými kortikosteroidními účinky v širokém rozmezí dávek PULMICORT 200mcg TURBUHALER (budesonid). To se vysvětluje kombinací relativně vysokého lokálního protizánětlivého účinku, rozsáhlého odbourávání perorálně absorbovaného léčiva při prvním průchodu játry (85-95 %) a nízké účinnosti vytvořených metabolitů (viz níže).
Farmakokinetika
Vstřebávání:
Po perorálním podání budesonidu bylo maximální plazmatické koncentrace dosaženo přibližně za 1 až 2 hodiny a absolutní systémová dostupnost byla 6-13 %. Naproti tomu většina budesonidu dodaného do plic je systémově absorbována. U zdravých jedinců bylo 34 % odměřené dávky uloženo v plicích (jak bylo stanoveno metodou plazmatické koncentrace) s absolutní systémovou dostupností 39 % odměřené dávky. Farmakokinetika budesonidu se u zdravých dobrovolníků a astmatických pacientů významně neliší. Maximální plazmatické koncentrace budesonidu se objevily během 30 minut po inhalaci přípravku PULMICORT 200 mcg TURBUHALER.U astmatických pacientů vykazoval budesonid lineární zvýšení AUC a Cmax se zvyšující se dávkou jak po jedné dávce, tak po opakovaném podání PULMICORT 200 mcg TURBUHALER (budesonid).
Rozdělení:
Distribuční objem budesonidu byl přibližně 3 l/kg. Na plazmatické proteiny se vázal z 85–90 %. Vazba na proteiny byla konstantní v celém koncentračním rozsahu (1-100 nmol/l) dosaženém a překračujícím doporučené dávky PULMICORT TURBUHALER. Budesonid vykazoval malou nebo žádnou vazbu na globulin vázající kortikosteroidy. Budesonid se rychle ekvilibroval s červenými krvinkami způsobem nezávislým na koncentraci s poměrem krev/plazma asi 0,8.Metabolismus:
Studie in vitro s homogenáty lidských jater prokázaly, že budesonid je rychle a rozsáhle metabolizován. Byly izolovány dva hlavní metabolity tvořené izoenzymem 3A4 (CYP3A4) katalyzovanou biotransformací cytochromu P450 (CYP) a identifikovány jako 16α-hydroxyprednisolon a 6β-hydroxybudesonid. Kortikosteroidní aktivita každého z těchto dvou metabolitů je menší než 1 % aktivity mateřské sloučeniny. Nebyly zjištěny žádné kvalitativní rozdíly mezi metabolickými vzory in vitro a in vivo. V preparátech lidských plic a séra byla pozorována zanedbatelná metabolická inaktivace.Vylučování/eliminace:
Forma 22R budesonidu byla přednostně vylučována játry se systémovou clearance 1,4 l/min oproti 1,0 l/min u formy 22S. Terminální poločas, 2 až 3 hodiny, byl stejný pro oba epimery a byl nezávislý na dávce. Budesonid byl vylučován močí a stolicí ve formě metabolitů. Přibližně 60 % intravenózně radioaktivně značené dávky bylo nalezeno v moči. V moči nebyl detekován žádný nezměněný budesonid.Zvláštní populace:
Nebyly zjištěny žádné farmakokinetické rozdíly v důsledku rasy, pohlaví nebo pokročilého věku.Pediatrická:
Po intravenózním podání u pediatrických pacientů ve věku 10-14 let byl plazmatický poločas kratší než u dospělých (1,5 hodiny vs. 2,0 hodiny u dospělých). Ve stejné populaci po inhalaci budesonidu prostřednictvím tlakového inhalátoru s odměřenou dávkou byla absolutní systémová dostupnost podobná jako u dospělých.Jaterní nedostatečnost:
Snížená funkce jater může ovlivnit vylučování kortikosteroidů. Farmakokinetika budesonidu byla ovlivněna zhoršenou funkcí jater, o čemž svědčí dvojnásobná systémová dostupnost po perorálním požití. Farmakokinetika intravenózního budesonidu však byla u pacientů s cirhózou au zdravých subjektů podobná.Lékové interakce:
Ketokonazol, silný inhibitor izoenzymu 3A4 (CYP3A4) cytochromu P450 (CYP), hlavního metabolického enzymu pro kortikosteroidy, zvýšil plazmatické hladiny perorálně podaného budesonidu. V doporučených dávkách měl cimetidin mírný, ale klinicky nevýznamný účinek na farmakokinetiku perorálního budesonidu.Farmakodynamika
Aby se potvrdilo, že systémová absorpce není významným faktorem v klinické účinnosti inhalovaného budesonidu, byla provedena klinická studie u pacientů s astmatem, která porovnávala 400 mcg budesonidu podávaného pomocí tlakového inhalátoru s odměřenou dávkou s rozpěrkou trubice a 1400 mcg perorálního budesonidu a placebo. Studie prokázala účinnost inhalačního budesonidu, ale ne perorálně podaného budesonidu navzdory srovnatelným systémovým hladinám. Terapeutický účinek konvenčních dávek perorálně inhalovaného budesonidu se tedy z velké části vysvětluje jeho přímým působením na dýchací cesty.
Obecně má PULMICORT TURBUHALER (budesonid) relativně rychlý nástup účinku na inhalační kortikosteroid. Zlepšení kontroly astmatu po inhalaci PULMICORT TURBUHALER (budesonid) může nastat během 24 hodin od zahájení léčby, ačkoli maximálního přínosu nemusí být dosaženo po 1 až 2 týdnech nebo déle.
Bylo prokázáno, že PULMICORT TURBUHALER (budesonid) snižuje reaktivitu dýchacích cest v různých modelech expozice, včetně histaminu, metacholinu, disiřičitanu sodného a adenosinmonofosfátu u pacientů s hyperreaktivními dýchacími cestami. Klinický význam těchto modelů není jistý.
Předběžná léčba přípravkem PULMICORT 200 mcg TURBUHALER (budesonid) 1600 mcg denně (800 mcg dvakrát denně) po dobu 2 týdnů snížila akutní (reakce v rané fázi) a opožděná (reakce v pozdní fázi) pokles FEV1 po inhalačním alergenu.
Účinky přípravku PULMICORT 200 mcg TURBUHALER (budesonid) na osu hypotalamus-hypofýza-nadledviny (HPA) byly studovány u 905 dospělých a 404 dětských pacientů s astmatem. U většiny pacientů zůstala schopnost zvýšit produkci kortizolu v reakci na stres, hodnocená testem stimulace kosyntropinem (ACTH), nedotčena při léčbě PULMICORT TURBUHALER (budesonid) v doporučených dávkách. U dospělých pacientů léčených 100, 200, 400 nebo 800 mcg dvakrát denně po dobu 12 týdnů mělo abnormální stimulovanou odpověď kortizolu 4 %, 2 %, 6 % a 13 % (vrchol kortizolu
Podávání budesonidu přes PULMICORT 200 mcg TURBUHALER (budesonid) v dávkách až 800 mcg/den (průměrná denní dávka 445 mcg/den) nebo přes tlakový dávkovací inhalátor v dávkách až 1200 mcg/den (průměrná denní dávka 620 mcg /den) u 216 pediatrických pacientů (ve věku 3 až 11 let) po dobu 2 až 6 let nemělo žádný významný vliv na tělesný růst ve srovnání s nekortikosteroidní léčbou u 62 odpovídajících kontrolních pacientů. Dlouhodobý účinek přípravku PULMICORT TURBUHALER (budesonid) na růst však není zcela znám.
Klinické stopy
Terapeutická účinnost přípravku PULMICORT 100 mcg TURBUHALER (budesonid) byla hodnocena v kontrolovaných klinických studiích zahrnujících více než 1300 pacientů (6 let a starších) s astmatem s různou délkou trvání onemocnění (20 let) a závažností.
Dvojitě zaslepené, paralelní, placebem kontrolované klinické studie trvající 12 týdnů a déle ukázaly, že ve srovnání s placebem PULMICORT TURBUHALER (budesonid) významně zlepšil plicní funkce (měřeno pomocí PEF a FEV1), významně snížil ranní a večerní příznaky astmatu a významně snížila potřebu užívání inhalačních β2-agonistů podle potřeby v dávkách 400 mcg až 1600 mcg denně (200 mcg až 800 mcg dvakrát denně) u dospělých a 400 mcg až 800 mcg denně (2000 mcg až 400 mcg dvakrát denně) u dětských pacientů ve věku 6 let a starších.
Zlepšená funkce plic (ranní PEF) byla pozorována do 24 hodin od zahájení léčby u dospělých i dětských pacientů ve věku 6 let a starších, ačkoli maximálního přínosu nebylo dosaženo po 1 až 2 týdnech nebo déle po zahájení léčby. Zlepšená funkce plic byla zachována po celých 12 týdnů dvojitě zaslepené části studií.
Pacienti, kteří nedostávají léčbu kortikosteroidy
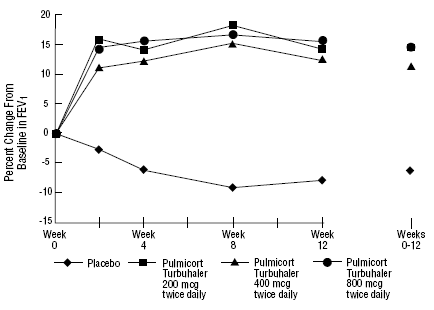
Ve 12týdenní klinické studii u 273 pacientů s mírným až středně těžkým astmatem (průměrná výchozí hodnota FEV1 2,27 l), kteří nebyli dobře kontrolováni samotnými bronchodilatátory, byl PULMICORT 200 mcg TURBUHALER (budesonid) hodnocen v dávkách 200 mcg dvakrát denně a 400 mcg dvakrát denně. denně versus placebo. Výsledky FEV1 z této studie jsou uvedeny na obrázku níže. Plicní funkce se významně zlepšila u obou dávek PULMICORT 100 mcg TURBUHALER (budesonid) ve srovnání s placebem.
12týdenní studie u pacientů, kteří nejsou léčeni kortikosteroidy před vstupem do studie

Ve 12měsíční kontrolované studii u 75 pacientů, kteří dříve neužívali kortikosteroidy, vedl PULMICORT TURBUHALER (budesonid) v dávce 200 mcg dvakrát denně ke zlepšení funkce plic (měřeno PEF) a snížení bronchiální hyperreaktivity ve srovnání s placebem.
Pacienti dříve užívající inhalační kortikosteroidy
Bezpečnost a účinnost přípravku PULMICORT 200 mcg TURBUHALER (budesonid) byla také hodnocena u dospělých a dětských pacientů (ve věku 6 až 18 let), kteří byli dříve léčeni inhalačními kortikosteroidy (dospělí: N=473, průměrná výchozí hodnota FEV1 2,04 l, výchozí dávky beklometadonu 126 % -1008 mcg/den; pediatrie: N=404, průměrná výchozí hodnota FEV1 2,09 l, výchozí dávky beklomethasondipropionátu 126-672 mcg/den nebo triamcinolonacetonidu 300-1800 mcg/den). Výsledky FEV1 těchto dvou studií, obě trvající 12 týdnů, jsou uvedeny na následujících obrázcích. Plicní funkce se významně zlepšila se všemi dávkami PULMICORT TURBUHALER (budesonid) ve srovnání s placebem v obou studiích.
Dospělí pacienti, kteří dříve užívali inhalační kortikosteroidy
Pediatričtí pacienti ve věku 6 až 18 let, kteří dříve užívali inhalační kortikosteroidy

Pacienti, kteří dostávají PULMICORT TURBUHALER (budesonid) jednou denně
Účinnost a bezpečnost podávání jednou denně PULMICORT 100 mcg TURBUHALER (budesonid) 200 mcg a 400 mcg a placeba byla také hodnocena u 309 dospělých pacientů s astmatem (průměrná výchozí hodnota FEV1 2,7 l) v 18týdenní studii. Ve srovnání s placebem vykazovali pacienti užívající Pulmicort 200 nebo 400 mcg jednou denně významně lepší stabilitu astmatu hodnocenou pomocí PEF a FEV1 během počátečního 6týdenního léčebného období, které bylo udržováno s denní dávkou 200 mcg během následujících 12 týdnů. Ačkoli studovaná populace zahrnovala jak pacienty dříve léčené inhalačními kortikosteroidy, tak pacienty, kteří dříve nedostávali léčbu kortikosteroidy, výsledky ukázaly, že podávání jednou denně bylo nejúčinnější u pacientů, kteří byli dříve léčeni perorálně inhalovanými kortikosteroidy (viz DÁVKOVÁNÍ A PODÁVÁNÍ ).
Pacienti dříve užívající perorální kortikosteroidy
klinické studii u 159 pacientů s těžkým astmatem vyžadujících chronickou perorální léčbu prednisonem (průměrná výchozí dávka prednisonu 19,3 mg/den) byl PULMICORT TURBUHALER (budesonid) v dávkách 400 mcg dvakrát denně a 800 mcg dvakrát denně porovnáván s placebem po dobu 20 týdnů doba. Přibližně dvě třetiny (68 % na 400 mcg dvakrát denně a 64 % na 800 mcg dvakrát denně) pacientů léčených PULMICORT TURBUHALER (budesonidem) byly schopny dosáhnout trvalé (nejméně 2 týdny) vysazení perorálních kortikosteroidů (ve srovnání s 8 % pacientů léčených placebem) a zlepšení kontroly astmatu. Průměrná dávka perorálního kortikosteroidu byla snížena o 83 % na 400 mcg dvakrát denně a o 79 % na 800 mcg dvakrát denně u pacientů léčených PULMICORT TURBUHALER (budesonidem) oproti 27 % u placeba. Navíc 58 z 64 pacientů (91 %), kteří během dvojitě zaslepené fáze studie zcela vyloučili perorální kortikosteroidy, zůstalo bez perorálních kortikosteroidů dalších 12 měsíců, zatímco dostávali PULMICORT 200 mcg TURBUHALER (budesonid).
INFORMACE PRO PACIENTA
Návod k použití pro pacienta
Přečtěte si prosím pozorně tuto příbalovou informaci dříve, než začnete svůj lék užívat. Poskytuje souhrn informací o vašem léku. Dodržování těchto pokynů pomáhá zajistit, že lék inhalujete správně.
PRO DALŠÍ INFORMACE SE ZEŽTE SVÉHO LÉKAŘE NEBO LÉKÁRNA.
CO BYSTE MĚLI VĚDĚT O PULMICORT TURBUHALER (budesonid)
Váš lékař Vám předepsal PULMICORT TURBUHALER 200 mcg. Obsahuje lék zvaný budesonid, což je syntetický kortikosteroid. Kortikosteroidy jsou přírodní látky nacházející se v těle, které pomáhají bojovat proti zánětu. Používají se k léčbě astmatu, protože snižují otoky a podráždění stěn malých dýchacích cest v plicích a zmírňují dýchací potíže. Při pravidelné inhalaci pomáhají kortikosteroidy také předcházet záchvatům astmatu.
PULMICORT TURBUHALER (budesonid) léčí zánět – „tichou část“ astmatu, kterou neslyšíte, nevidíte ani necítíte. Když se zánět neléčí, vaše astmatické příznaky a záchvaty se mohou zvýšit. PULMICORT 200 mcg TURBUHALER (budesonid) působí na prevenci a zmírnění příznaků a záchvatů astmatu.
DŮLEŽITÉ BODY, KTERÉ SI ZAPAMATUJTE O PULMICORT TURBUHALER (budesonid)
UJISTĚTE SE, že je tento lék pro Vás vhodný (viz „ČEŽ ZAČNETE PULMICORT TURBUHALER (budesonid) UŽÍVAT“).
Je důležité, abyste každou dávku inhaloval tak, jak vám doporučil lékař.
Turbuhaler používejte podle pokynů svého lékaře. NEPŘESTAVUJTE LÉČBU ANI NESNIŽUJTE SI DÁVKU, I KDYŽ SE CÍTÍTE LÉPE, pokud vám to lékař neřekne.
NE inhalujte více dávek nebo používejte Turbuhaler častěji, než Vám doporučil lékař.
Tento lék je NE určený k rychlé úlevě od dýchacích obtíží během astmatického záchvatu. Musí se užívat v pravidelných intervalech podle doporučení lékaře, nikoli jako nouzové opatření.
Váš lékař může předepsat další léky (jako jsou bronchodilatátory) pro naléhavou úlevu v případě akutního stavu
Pokud také užíváte jiný lék inhalačně, měli byste se poradit se svým lékařem o tom, kdy jej použít v souvislosti s užíváním PULMICORT 100 mcg TURBUHALER (budesonid).
PŘED POUŽITÍM VAŠEHO PULMICORT TURBUHALER (budesonid)
NEŽ ZAČNETE TENTO LÉK UŽÍVAT, ŘEKNĚTE SVÉMU LÉKAŘI, POKUD:
- jste těhotná (nebo plánujete otěhotnět),
- kojíte dítě,
- jste alergický(á) na budesonid nebo jakýkoli jiný perorálně inhalovaný kortikosteroid,
- mít nějaké infekce,
- máte nebo jste měli tuberkulózu,
- mají osteoporózu,
- byli v poslední době kolem někoho s planými neštovicemi nebo spalničkami,
- plánujete operaci,
- užíváte perorální kortikosteroidy, jako je prednison. Možná budete muset dodržovat konkrétní pokyny, abyste se vyhnuli zdravotním rizikům spojeným s ukončením užívání těchto typů léků.
Za určitých okolností nemusí být tento lék vhodný a váš lékař může chtít předepsat jiný lék. Ujistěte se, že váš lékař ví, jaké další léky užíváte, včetně léků na předpis a volně prodejných, stejně jako všechny vitamíny nebo dietní a bylinné doplňky.
JAKÉ JSOU MOŽNÉ NEŽÁDOUCÍ ÚČINKY PULMICORT TURBUHALER (budesonid)?
Stejně jako u všech inhalačních kortikosteroidů byste si měli být vědomi následujících nežádoucích účinků:
- Zvýšené sípání hned po užití PULMICORT 100 mcg TURBUHALER (budesonid). Vždy mějte s sebou krátkodobě působící bronchodilatační lék k léčbě náhlého sípání. Krátkodobě působící bronchodilatační léky pomáhají uvolnit svaly kolem dýchacích cest v plicích. Sípání nastává, když se svaly kolem dýchacích cest napínají. To ztěžuje dýchání. V závažných případech může sípání zastavit dýchání a způsobit smrt, pokud není okamžitě léčeno.
- Účinky na imunitní systém a vyšší pravděpodobnost infekcí.
- Oční problémy včetně glaukomu a šedého zákalu. Při používání PULMICORT TURBUHALER (budesonid) je třeba zvážit oční vyšetření.
- Během užívání přípravku PULMICOR TURBUHALER by měl být pravidelně kontrolován růst dítěte kvůli možnému zpomalení růstu.
Na základě klinických studií jsou nejčastějšími nežádoucími účinky hlášenými pacienty užívajícími PULMICORT 100 mcg TURBUHALER (budesonid):
- infekce dýchacích cest
- bolest hlavy
- příznaky chřipky
- bolest krku
- zánět vedlejších nosních dutin
Toto nejsou všechny možné vedlejší účinky přípravku PULMICORT TURBUHALER (budesonid). Další informace získáte od svého lékaře, zdravotníka nebo lékárníka.
POUŽÍVÁNÍ VAŠEHO PULMICORT TURBUHALER (budesonid)
- Postupujte podle pokynů v části „JAK POUŽÍVAT PULMICORT 200 mcg TURBUHALER“. Máte-li jakékoli problémy, sdělte to svému lékaři nebo lékárníkovi.
- Je důležité, abyste každou dávku inhalovali podle pokynů svého lékaře. Na etiketě lékárny je obvykle uvedeno, jakou dávku užívat a jak často. Pokud ne, nebo si nejste jistý(á), zeptejte se svého lékaře nebo lékárníka.
DÁVKOVÁNÍ
- Používejte podle pokynů svého lékaře.
- to je VELMI DŮLEŽITÉ že budete postupovat podle pokynů svého lékaře, kolik inhalací užívat a jak často používat PULMICORT TURBUHALER (budesonid).
- NE inhalujte více dávek nebo používejte svůj PULMICORT TURBUHALER (budesonid) častěji, než vám doporučil lékař.
- Může trvat 1 až 2 týdny nebo déle, než pocítíte maximální zlepšení JE VELMI DŮLEŽITÉ, ABYSTE PULMICORT 100 mcg TURBUHALER (budesonid) PRAVIDELNĚ UŽÍVALI. NEPŘESTAVUJTE LÉČBU ANI NESNIŽUJTE SI DÁVKU, I KDYŽ SE CÍTÍTE LÉPE, pokud vám to lékař neřekne.
- Pokud vynecháte dávku, vezměte si svou pravidelně naplánovanou další dávku, když je to nutné. NEZDVOJNÁSOBTE dávku.
JAK POUŽÍVAT PULMICORT TURBUHALER (budesonid)
Pečlivě si přečtěte celý návod a používejte pouze podle pokynů.
POKYNY K PLNĚNÍ:
Před prvním použitím nového PULMICORT 200 mcg TURBUHALER (budesonid) byste jej měli nastříkat. Chcete-li to provést, otočte kryt a zvedněte jej. Držte PULMICORT TURBUHALER (budesonid) vzpřímeně (s náustkem nahoru), poté otočte hnědou rukojeť úplně doprava a zase zpět doleva. Opakovat. Nyní jste připraveni vzít si svou první dávku (viz pokyny pro „UŽÍVÁNÍ DÁVKY“). Poté už ji nemusíte napouštět, i když ji odložíte na delší dobu.
UŽÍVÁNÍ DÁVKY:
NAKLÁDÁNÍ DÁVKY
- Otočte kryt a sejměte.
- Abyste zajistili správnou dávku, PULMICORT TURBUHALER (budesonid) musí být držen ve vzpřímené poloze (náustek nahoře), kdykoli se nakládá dávka léku.
- Otočte hnědou rukojeť úplně doprava, dokud to půjde. Otočte jej zpět úplně doleva.
- Uslyšíte cvaknutí.
VDECHNUTÍ DÁVKY
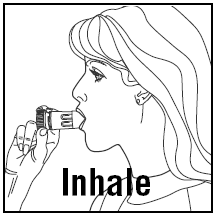
- Když inhalujete, PULMICORT 200 mcg TURBUHALER (budesonid) musí být držen ve svislé (náustek nahoře) nebo vodorovné poloze.
- Otočte hlavu od inhalátoru a vydechněte. Po naplnění inhalátorem netřeste.
- Umístěte náustek mezi rty a zhluboka a silně se nadechněte. Lék možná nebudete cítit ani cítit.
- Nekousejte ani nekousejte náustek.
- Vyjměte inhalátor z úst a vydechněte. Nefoukejte ani nevydechujte do náustku.
- Pokud je zapotřebí více než jedna dávka, opakujte výše uvedené kroky.
- Po dokončení nasaďte kryt zpět na inhalátor a otočte jej. Vypláchněte ústa vodou. Nepolykej.
- Udržujte svůj PULMICORT TURBUHALER (budesonid) vždy čistý a suchý.
- Nepoužívejte PULMICORT TURBUHALER (budesonid), pokud byl poškozen nebo pokud se náustek oddělil.
UCHOVÁVÁNÍ VAŠEHO PULMICORT TURBUHALER (budesonid)
- Po každém použití nasaďte zpět bílý kryt a pevně jej otočte na místo.
- Uchovávejte PULMICORT TURBUHALER (budesonid) na suchém místě při kontrolované pokojové teplotě, 68-77°F (20-25°C).
- Uchovávejte svůj PULMICORT TURBUHALER (budesonid) na bezpečném místě mimo dosah dosah malých dětí.
- NE použijte po datu uvedeném na těle vašeho Turbuhaleru.
JAK ZJISTIT, KDY JE VÁŠ PULMICORT TURBUHALER (budesonid) PRÁZDNÝ
Štítek na krabičce nebo obalu vám řekne, kolik dávek je ve vašem PULMICORT TURBUHALER. Váš PULMICORT TURBUHALER (budesonid) má pohodlné okénko indikátoru dávky přímo pod náustkem.
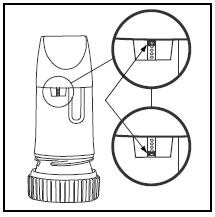
- Když se v horní části okénka objeví červená značka, zbývá 20 dávek léku. Nyní je čas pořídit si další PULMICORT 100 mcg TURBUHALER (budesonid).
- Když červená značka dosáhne spodní části okénka, váš inhalátor by měl být zlikvidován, protože již nemusí dodávat správné množství léku. (Stále můžete slyšet zvuk, když s ním zatřesete – tento zvuk není lékem. Tento zvuk vydává sušící činidlo uvnitř Turbuhaleru.)
- Pamatujte, že pokaždé, když doplníte svůj předpis, dostanete nový inhalátor.
- Neponořujte jej do vody, abyste zjistili, zda je prázdný. Jednoduše zkontrolujte okénko ukazatele dávky.
DALŠÍ INFORMACE O PULMICORT TURBUHALER (budesonid)
- PULMICORT 200 mcg TURBUHALER (budesonid) dodává váš lék jako velmi jemný prášek. Z tohoto důvodu možná ne chuť, vůně nebo pocit jakýkoli lék, který se dostane do vašich plic při inhalaci z PULMICORT TURBUHALER (budesonid) To neznamená, že nedostáváte léky.
- PULMICORT 100 mcg TURBUHALER (budesonid) by se neměl používat s distanční vložkou.
- PULMICORT 100mcg TURBUHALER obsahuje pouze budesonid a neobsahuje žádné neaktivní složky.
- PULMICORT TURBUHALER (budesonid) je speciálně navržen tak, aby podával pouze jednu dávku najednou, bez ohledu na to, jak často klikáte na hnědou rukojeť. Pokud po natažení dávky omylem fouknete do inhalátoru, jednoduše postupujte podle pokynů pro natažení nové dávky.
Tato příbalová informace neobsahuje úplné informace o vašem léku. Máte-li jakékoli otázky nebo si něčím nejste jisti, zeptejte se svého lékaře nebo lékárníka.
Možná si budete chtít znovu přečíst tuto příbalovou informaci. Prosím, NEVYHAZUJTE HO, dokud lék neukončíte.
PAMATUJTE: Tento přípravek Vám předepsal Váš lékař. NEDÁVEJTE tento lék nikomu jinému.
POUŽÍVEJTE TENTO PRODUKT PODLE NÁVODU, POKUD VÁŠ LÉKAŘ NEROZUMÍ JINAK.
Máte-li další otázky týkající se použití PULMICORT 100mcg TURBUHALER (budesonid) , volejte: 1-800-236-9933.
