Aciphex 10mg, 20mg Rabeprazole Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Aciphex 10 mg a jak se používá?
Aciphex 10 mg je lék na předpis používaný k léčbě příznaků refluxní choroby jícnu (GERD), Helicobacter Pylori a střevních vředů. Aciphex 10 mg lze užívat samostatně nebo s jinými léky.
Aciphex je inhibitor protonové pumpy.
Není známo, zda je přípravek Aciphex 20 mg tableta s opožděným uvolňováním bezpečný a účinný u dětí mladších 12 let. Není známo, zda je přípravek Aciphex 10 mg tableta s opožděným uvolňováním (sypání) bezpečný a účinný u dětí mladších 1 roku.
Jaké jsou možné vedlejší účinky přípravku Aciphex 10mg?
Aciphex může způsobit závažné nežádoucí účinky, včetně:
- silná bolest žaludku,
- krvavý průjem,
- náhlá bolest nebo potíže s pohybem kyčle, zápěstí nebo zad,
- záchvat (křeče),
- močí méně než obvykle,
- krev ve vaší moči,
- otok,
- rychlý nárůst hmotnosti,
- bolest kloubů,
- kožní vyrážka na tvářích nebo pažích zhoršená slunečním zářením,
- závrať,
- rychlý nebo nepravidelný srdeční tep,
- třes nebo trhavé pohyby svalů (třes),
- pocit nervozity,
- svalové křeče nebo křeče v rukou nebo nohou,
- kašel,
- potíže s polykáním nebo dušením,
- bolest hlavy,
- slabost,
- modřiny,
- neobvyklé krvácení (krvácení z nosu, dásní),
- červená nebo růžová moč,
- silný menstruační výtok,
- krvavá nebo dehtovitá stolice,
- vykašlávání krve nebo zvratků, které vypadají jako kávová sedlina,
- těžko kontrolovatelné krvácení,
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Aciphex patří:
- bolest hlavy,
- nevolnost,
- zvracení,
- průjem,
- zácpa,
- bolest břicha,
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Aciphex. Pro více informací se zeptejte svého lékaře nebo lékárníka.
POPIS
Aktivní složkou přípravku ACIPHEX 20 mg tablety s opožděným uvolňováním je rabeprazol sodný, což je inhibitor protonové pumpy. Jedná se o substituovaný benzimidazol chemicky známý jako sodná sůl 2-[[[4-(3methoxypropoxy)-3-methyl-2-pyridinyl]-methyl]sulfinyl]-1H-benzimidazolu. Má empirický vzorec C18H20N3NaO3S a molekulovou hmotnost 381,42. Rabeprazol sodný je bílá až slabě nažloutlá bílá pevná látka. Je velmi rozpustný ve vodě a methanolu, volně rozpustný v ethanolu, chloroformu a ethylacetátu a nerozpustný v etheru a n-hexanu. Stabilita sodné soli rabeprazolu je funkcí pH; rychle se rozkládá v kyselém prostředí a je stabilnější za alkalických podmínek. Strukturní obrázek je:
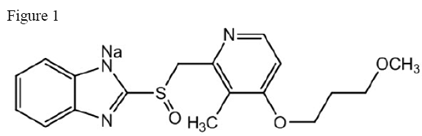
ACIPHEX je dostupný pro perorální podání jako enterosolventní tablety s opožděným uvolňováním obsahující 20 mg sodné soli rabeprazolu.
Neaktivními složkami 20mg tablety jsou karnaubský vosk, krospovidon, diacetylované monoglyceridy, ethylcelulóza, hydroxypropylcelulóza, ftalát hypromelózy, magnesium-stearát, mannitol, propylenglykol, hydroxid sodný, stearylfumarát sodný, mastek a oxid titaničitý. Žlutý oxid železitý je barvivem pro potah tablet. Červený oxid železitý je inkoustový pigment.
INDIKACE
Hojení Erozivních Nebo Ulcerózních GERD U dospělých
ACIPHEX 20 mg tablety s opožděným uvolňováním jsou indikovány pro krátkodobou (4 až 8 týdnů) léčbu při hojení a symptomatické úlevě od erozivní nebo ulcerózní gastroezofageální refluxní choroby (GERD). U pacientů, kteří se nezhojili po 8 týdnech léčby, lze zvážit další 8týdenní léčbu přípravkem ACIPHEX.
Udržování hojení erozivního nebo ulcerózního GERD u dospělých
Tablety ACIPHEX s opožděným uvolňováním jsou indikovány k udržení hojení a snížení míry recidivy příznaků pálení žáhy u pacientů s erozivní nebo ulcerózní gastroezofageální refluxní chorobou (GERD Maintenance). Kontrolované studie nepřesahují 12 měsíců.
Léčba symptomatické GERD u dospělých
ACIPHEX 20 mg tablety s opožděným uvolňováním jsou indikovány k léčbě denního a nočního pálení žáhy a dalších příznaků spojených s GERD u dospělých po dobu až 4 týdnů.
Hojení Duodenálních Vředů U Dospělých
ACIPHEX 20 mg tablety s opožděným uvolňováním jsou indikovány pro krátkodobou (do čtyř týdnů) léčbu při hojení a symptomatické úlevě od duodenálních vředů. Většina pacientů se uzdraví do čtyř týdnů.
Eradikace Helicobacter Pylori ke snížení rizika recidivy duodenálního vředu u dospělých
ACIPHEX 10 mg tablety s opožděným uvolňováním v kombinaci s amoxicilinem a klarithromycinem jako třílékový režim jsou indikovány k léčbě pacientů s infekcí H. pylori a duodenální vředovou chorobou (aktivní nebo v anamnéze během posledních 5 let) k eradikaci H. pylori . Bylo prokázáno, že eradikace H. pylori snižuje riziko recidivy duodenálního vředu.
U pacientů, u kterých léčba selže, by mělo být provedeno testování citlivosti. Pokud je prokázána rezistence na klarithromycin nebo testování citlivosti není možné, měla by být zahájena alternativní antimikrobiální léčba (viz KLINICKÁ FARMAKOLOGIE a úplné informace o předepisování klarithromycinu].
Léčba patologických hypersekrečních stavů, včetně Zollinger-Ellisonova syndromu u dospělých
ACIPHEX tablety s opožděným uvolňováním jsou indikovány k dlouhodobé léčbě patologických hypersekrečních stavů, včetně Zollinger-Ellisonova syndromu.
Léčba symptomatické GERD u dospívajících pacientů ve věku 12 let a starších
ACIPHEX 20 mg tablety s opožděným uvolňováním jsou indikovány k léčbě symptomatické GERD u dospívajících ve věku 12 let a starších po dobu až 8 týdnů.
DÁVKOVÁNÍ A PODÁVÁNÍ
Tabulka 1 ukazuje doporučené dávkování tablet ACIPHEX s opožděným uvolňováním u dospělých a dospívajících pacientů ve věku 12 let a starších. Použití tablet ACIPHEX s opožděným uvolňováním se nedoporučuje pro použití u pediatrických pacientů ve věku od 1 roku do méně než 12 let, protože nejnižší dostupná síla tablety (20 mg) překračuje doporučenou dávku pro tyto pacienty. U pediatrických pacientů ve věku od 1 roku do méně než 12 let použijte jinou formu rabeprazolu.
Pokyny pro administraci
- Tablety ACIPHEX 20 mg s opožděným uvolňováním spolkněte celé. Tablety nežvýkejte, nedrťte ani nerozdělujte.
- K léčbě duodenálních vředů užívejte ACIPHEX tablety s opožděným uvolňováním po jídle.
- Pro eradikaci Helicobacter pylori užívejte ACIPHEX 20 mg tablety s opožděným uvolňováním s jídlem.
- všech ostatních indikací lze tablety ACIPHEX s opožděným uvolňováním užívat s jídlem nebo bez jídla.
- Užijte vynechanou dávku co nejdříve. Pokud je téměř čas na další dávku, vynechejte vynechanou dávku a vraťte se k normálnímu schématu. Neužívejte dvě dávky současně.
JAK DODÁVÁNO
Dávkové formy A Síly
ACIPHEX 10 mg tablety s opožděným uvolňováním se dodávají v jedné síle, 20 mg. Tablety jsou kulaté, světle žluté, enterosolventní, bikonvexní tablety. „ACIPHEX 20“ je na jedné straně tabletu vytištěn červeně.
Skladování A Manipulace
ACIPHEX 20 mg je dodáván jako světle žluté enterosolventní tablety s opožděným uvolňováním. Na jedné straně je vytištěn název a síla v mg (ACIPHEX 20).
Láhve po 30 ( NDC 69784-243-30)
Skladujte při teplotě 25 °C (77 °F); povoleny výchylky do 15-30°C (59-86°F) [viz USP řízená pokojová teplota ]. Chraňte před vlhkostí.
Distribuováno společností Eisai Inc., Woodcliff Lake, NJ 07677. Revize: březen 2022
VEDLEJŠÍ EFEKTY
Následující závažné nežádoucí účinky jsou popsány níže a jinde v označení:
- Akutní tubulointersticiální nefritida [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Průjem spojený s Clostridium difficile [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Zlomenina kosti [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Závažné kožní nežádoucí účinky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Kožní a systémový lupus erythematodes [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Nedostatek kyanokobalaminu (vitamín B-12) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hypomagnezémie a metabolismus minerálů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Polypy fundických žláz [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za různých podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Dospělí
Údaje popsané níže odrážejí expozici tabletám ACIPHEX s opožděným uvolňováním u 1064 dospělých pacientů vystavených po dobu až 8 týdnů. Tyto studie byly primárně placebem a aktivní látkou kontrolované studie u dospělých pacientů s erozivním nebo ulcerózním gastroezofageálním refluxním onemocněním (GERD), duodenálními vředy a žaludečními vředy. Populace měla průměrný věk 53 let (rozmezí 18-89 let) a poměr přibližně 60 % mužů: 40 % žen. Rasová distribuce byla 86 % bělochů, 8 % Afroameričanů, 2 % Asijců a 5 % ostatních. Většina pacientů dostávala buď 10 mg, 20 mg nebo 40 mg denně ACIPHEX 20 mg tablety s opožděným uvolňováním.
Analýza nežádoucích účinků, které se objevily u ≥ 2 % pacientů léčených přípravkem ACIPHEX 10 mg tablety s opožděným uvolňováním (n=1064) a s vyšší frekvencí než placebo (n=89) v kontrolovaných severoamerických a evropských studiích akutní léčby, odhalila následující nežádoucí účinky: bolest (3 % vs. 1 %), faryngitida (3 % vs. 2 %), plynatost (3 % vs. 1 %), infekce (2 % vs. 1 %) a zácpa (2 % vs. 1 %).
Tři dlouhodobé udržovací studie zahrnovaly celkem 740 dospělých pacientů; alespoň 54 % dospělých pacientů bylo vystaveno ACIPHEX 20 mg tabletám s opožděným uvolňováním po dobu 6 měsíců a alespoň 33 % bylo vystaveno po dobu 12 měsíců. Ze 740 dospělých pacientů dostalo 247 (33 %) a 241 (33 %) pacientů 10 mg a 20 mg tablety ACIPHEX 20 mg s opožděným uvolňováním, zatímco 169 (23 %) pacientů dostalo placebo a 83 (11 %) omeprazol.
Bezpečnostní profil rabeprazolu v udržovacích studiích u dospělých byl v souladu s tím, co bylo pozorováno v akutních studiích.
Méně časté nežádoucí účinky pozorované v kontrolovaných klinických studiích (
Kombinovaná léčba s amoxicilinem a klarithromycinem
V klinických studiích používajících kombinovanou terapii s rabeprazolem plus amoxicilinem a klarithromycinem (RAC) nebyly pozorovány žádné nežádoucí účinky, které by byly jedinečné pro tuto kombinaci léků. V americké multicentrické studii byly nejčastěji hlášenými nežádoucími účinky souvisejícími s lékem u pacientů, kteří dostávali terapii RAC po dobu 7 nebo 10 dnů, průjem (8 % a 7 %) a perverze chuti (6 % a 10 %).
Nebyly pozorovány žádné klinicky významné laboratorní abnormality specifické pro kombinace léků.
Další informace o nežádoucích účincích nebo laboratorních změnách u amoxicilinu nebo klarithromycinu naleznete v příslušných informacích o předepisování v části Nežádoucí účinky.
Pediatrie
multicentrické, otevřené studii u dospívajících pacientů ve věku 12 až 16 let s klinickou diagnózou symptomatické GERD nebo endoskopicky prokázané GERD byl profil nežádoucích účinků podobný jako u dospělých. Nežádoucí účinky hlášené bez ohledu na vztah k ACIPHEX 20 mg tabletám s opožděným uvolňováním, které se vyskytly u ≥ 2 % ze 111 pacientů, byly bolest hlavy (9,9 %), průjem (4,5 %), nauzea (4,5 %), zvracení (3,6 %) a bolesti břicha (3,6 %). Související hlášené nežádoucí účinky, které se vyskytly u ≥ 2 % pacientů, byly bolest hlavy (5,4 %) a nauzea (1,8 %). V této studii nebyly hlášeny žádné nežádoucí účinky, které nebyly dříve pozorovány u dospělých.
Postmarketingové zkušenosti
Během postregistračního užívání rabeprazolu byly zjištěny následující nežádoucí účinky. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku:
Poruchy krve a lymfatického systému: agranulocytóza, hemolytická anémie, leukopenie, pancytopenie, trombocytopenie
Poruchy ucha a labyrintu: závrať
Oční poruchy: rozmazané vidění
Gastrointestinální poruchy: polypy fundické žlázy
Obecné poruchy a podmínky v místě podání: nenadálá smrt
Poruchy jater a žlučových cest: žloutenka
Poruchy imunitního systému: anafylaxe, angioedém, systémový lupus erythematodes, Stevens-Johnsonův syndrom, toxická epidermální nekrolýza (některé fatální), DRESS, AGEP
Infekce a nákazy: Průjem související s Clostridium difficile
Vyšetřování: Prodloužení protrombinového času/INR (u pacientů současně léčených warfarinem), zvýšení TSH
Poruchy metabolismu a výživy: hyperamonémie, hypomagnezémie, hypokalcémie, hypokalémie [Varování a opatření 5.8], hyponatrémie
Poruchy pohybového aparátu: zlomenina kosti, rabdomyolýza
Poruchy nervového systému: kóma
Psychiatrické poruchy: delirium, dezorientace
Poruchy ledvin a močových cest: intersticiální nefritida
Respirační, hrudní a mediastinální poruchy: intersticiální pneumonie
Poruchy kůže a podkožní tkáně: závažné dermatologické reakce včetně bulózních a jiných polékových erupcí na kůži, kožní lupus erythematodes, erythema multiforme
DROGOVÉ INTERAKCE
Tabulka 2 obsahuje léky s klinicky významnými lékovými interakcemi a interakcí s diagnostikou při současném podávání s ACIPHEX 10 mg tabletami s opožděným uvolňováním a pokyny pro jejich prevenci nebo léčbu.
Chcete-li získat další informace o interakcích s PPI, podívejte se na označení současně užívaných léků.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Přítomnost Malignity žaludku
U dospělých nevylučuje symptomatická odpověď na léčbu přípravkem ACIPHEX 10 mg přítomnost žaludeční malignity. Zvažte další sledování a diagnostické testování u dospělých pacientů, kteří mají suboptimální odpověď nebo časný symptomatický relaps po dokončení léčby PPI.
Interakce s warfarinem
Interakce rabeprazolu a warfarinu v ustáleném stavu nebyly u pacientů dostatečně hodnoceny. U pacientů užívajících současně inhibitor protonové pumpy a warfarin byly hlášeny případy zvýšeného INR a protrombinového času. Zvýšení INR a protrombinového času může vést k abnormálnímu krvácení a dokonce smrti. U pacientů léčených přípravkem ACIPHEX 10 mg tablety s opožděným uvolňováním a současně warfarinem může být nutné sledovat zvýšení INR a protrombinového času (viz DROGOVÉ INTERAKCE ].
Akutní tubulointersticiální nefritida
Akutní tubulointersticiální nefritida (TIN) byla pozorována u pacientů užívajících PPI a může se objevit kdykoli během léčby PPI. Pacienti mohou mít různé známky a příznaky od symptomatických reakcí přecitlivělosti až po nespecifické příznaky snížené funkce ledvin (např. malátnost, nauzea, anorexie). V hlášených sériích případů byli někteří pacienti diagnostikováni biopsií a bez extrarenálních projevů (např. horečka, vyrážka nebo artralgie).
Přerušte ACIPHEX a vyhodnoťte pacienty s podezřením na akutní TIN [viz KONTRAINDIKACE ].
Průjem spojený s Clostridium Difficile
Publikované pozorovací studie naznačují, že léčba PPI, jako je ACIPHEX, může být spojena se zvýšeným rizikem průjmu souvisejícího s Clostridium difficile, zejména u hospitalizovaných pacientů. Tuto diagnózu je třeba zvážit u průjmu, který se nezlepšuje [viz NEŽÁDOUCÍ REAKCE ].
Pacienti by měli používat nejnižší dávku a nejkratší dobu léčby PPI odpovídající léčenému stavu.
Průjem související s Clostridium difficile (CDAD) byl hlášen při použití téměř všech antibakteriálních látek. Další informace specifické pro antibakteriální látky (klaritromycin a amoxicilin) indikované k použití v kombinaci s ACIPHEX naleznete v oddílech Varování a bezpečnostní opatření v odpovídajících informacích o předepisování.
Zlomenina kosti
Několik publikovaných observačních studií u dospělých naznačuje, že léčba PPI může být spojena se zvýšeným rizikem zlomenin kyčle, zápěstí nebo páteře souvisejících s osteoporózou. Riziko zlomenin se zvýšilo u pacientů, kteří dostávali vysoké dávky, definované jako opakované denní dávky, a dlouhodobou terapii PPI (rok nebo déle). Pacienti by měli používat nejnižší dávku a nejkratší dobu léčby PPI odpovídající léčenému stavu. Pacienti s rizikem zlomenin souvisejících s osteoporózou by měli být léčeni podle zavedených pokynů pro léčbu [viz DÁVKOVÁNÍ A PODÁVÁNÍ , NEŽÁDOUCÍ REAKCE ].
Závažné kožní nežádoucí reakce
V souvislosti s užíváním PPI byly hlášeny závažné kožní nežádoucí reakce, včetně Stevens-Johnsonova syndromu (SJS) a toxické epidermální nekrolýzy (TEN), lékové reakce s eozinofilií a systémovými příznaky (DRESS) a akutní generalizované exantematózní pustulózy (AGEP). [vidět NEŽÁDOUCÍ REAKCE ]. Při prvních známkách nebo příznacích závažných kožních nežádoucích reakcí nebo jiných příznaků přecitlivělosti přerušte léčbu přípravkem ACIPHEX a zvažte další vyšetření.
Kožní a systémový lupus erythematodes
U pacientů užívajících PPI, včetně rabeprazolu, byly hlášeny kožní lupus erythematodes (CLE) a systémový lupus erythematodes (SLE). Tyto příhody se objevily jak jako nový nástup, tak jako exacerbace stávajícího autoimunitního onemocnění. Většina případů lupus erythematodes vyvolaných PPI byla CLE.
Nejběžnější formou CLE hlášenou u pacientů léčených PPI byl subakutní CLE (SCLE) a vyskytoval se během týdnů až let po kontinuální medikamentózní terapii u pacientů od kojenců až po seniory. Obecně byly histologické nálezy pozorovány bez orgánového postižení.
Systémový lupus erythematodes (SLE) je u pacientů užívajících PPI méně často hlášen než CLE. SLE spojený s PPI je obvykle mírnější než SLE neindukovaný léky. Nástup SLE se typicky objevil během dnů až let po zahájení léčby primárně u pacientů od mladých dospělých po starší osoby. U většiny pacientů se objevila vyrážka; byly však také hlášeny artralgie a cytopenie.
Vyhněte se podávání PPI déle, než je lékařsky indikováno. Pokud jsou u pacientů užívajících ACIPHEX zaznamenány známky nebo příznaky odpovídající CLE nebo SLE, přerušte podávání léku a odešlete pacienta k příslušnému specialistovi k vyšetření. Většina pacientů se zlepší po vysazení samotného PPI za 4 až 12 týdnů. Sérologické vyšetření (např. ANA) může být pozitivní a vyřešení zvýšených sérologických testů může trvat déle než klinické projevy.
Nedostatek kyanokobalaminu (vitamín B-12).
Každodenní léčba jakýmikoli léky potlačujícími kyselost po dlouhou dobu (např. déle než 3 roky) může vést k malabsorpci kyanokobalaminu (vitamín B-12) způsobené hypo- nebo achlorhydrií. V literatuře byly popsány vzácné zprávy o deficitu kyanokobalaminu vyskytujícího se při léčbě potlačující kyselost. Tuto diagnózu je třeba zvážit, pokud jsou u pacientů léčených přípravkem ACIPHEX pozorovány klinické příznaky odpovídající nedostatku kyanokobalaminu.
Hypomagnezémie a metabolismus minerálů
Hypomagnezémie, symptomatická a asymptomatická, byla vzácně hlášena u pacientů léčených PPI po dobu alespoň tří měsíců, ve většině případů po roce léčby. Mezi závažné nežádoucí účinky patří tetanie, arytmie a záchvaty. Hypomagnezémie může vést k hypokalcemii a/nebo hypokalémii a může u rizikových pacientů zhoršit základní hypokalcemii. U většiny pacientů vyžadovala léčba hypomagnezémie náhradu hořčíku a vysazení PPI.
pacientů, u kterých se očekává delší léčba nebo kteří užívají PPI s léky, jako je digoxin nebo léky, které mohou způsobit hypomagnezémii (např. diuretika), mohou zdravotníci zvážit sledování hladin hořčíku před zahájením léčby PPI a pravidelně [viz NEŽÁDOUCÍ REAKCE ].
Zvažte sledování hladin hořčíku a vápníku před zahájením léčby přípravkem ACIPHEX a pravidelně během léčby u pacientů s již existujícím rizikem hypokalcémie (např. hypoparatyreóza). Podle potřeby doplňte hořčík a/nebo vápník. Pokud je hypokalcémie refrakterní na léčbu, zvažte přerušení léčby PPI.
Interakce s methotrexátem
Literatura naznačuje, že současné užívání PPI s methotrexátem (primárně ve vysokých dávkách; viz informace o předepisování methotrexátu) může zvýšit a prodloužit sérové koncentrace methotrexátu a/nebo jeho metabolitu, což může vést k toxicitě metotrexátu. Při podávání vysokých dávek metotrexátu lze u některých pacientů zvážit dočasné vysazení PPI [viz DROGOVÉ INTERAKCE ].
Polypy fundických žláz
Užívání PPI je spojeno se zvýšeným rizikem polypů fundických žláz, které se zvyšuje s dlouhodobým užíváním, zejména po jednom roce. Většina uživatelů PPI, u kterých se vyvinuly polypy fundické žlázy, byla asymptomatická a polypy fundické žlázy byly identifikovány náhodně při endoskopii. Použijte nejkratší dobu trvání léčby PPI vhodnou pro léčený stav.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( Průvodce léky ).
Akutní tubulointersticiální nefritida
Poraďte pacientovi nebo pečovateli, aby okamžitě zavolal poskytovatele zdravotní péče pacienta, pokud zaznamená známky a/nebo příznaky spojené s akutní tubulointersticiální nefritidou [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Průjem spojený s Clostridium Difficile
Informujte pacienta nebo pečovatele, aby okamžitě zavolali pacientovi poskytovateli zdravotní péče, pokud se u nich objeví průjem, který se nezlepšuje [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Zlomenina kosti
Poraďte pacientovi nebo pečovateli, aby hlásil jakékoli zlomeniny, zejména kyčle, zápěstí nebo páteře, poskytovateli zdravotní péče pacienta [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Závažné kožní nežádoucí reakce
Poraďte pacientovi nebo pečovateli, aby přerušil ACIPHEX 20 mg a nahlásil poskytovateli zdravotní péče jakékoli známky a příznaky závažné kožní nežádoucí reakce nebo jiné známky přecitlivělosti [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Kožní a systémový lupus erythematodes
Poraďte pacientovi nebo pečovateli, aby okamžitě zavolal poskytovatele zdravotní péče pacienta v případě jakéhokoli nového nebo zhoršení příznaků spojených s kožním nebo systémovým lupus erythematodes [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Nedostatek kyanokobalaminu (vitamín B-12).
Informujte pacienta nebo pečovatele, aby hlásil jakékoli klinické příznaky, které mohou být spojeny s nedostatkem kyanokobalaminu, poskytovateli zdravotní péče pacienta, pokud užíval ACIPHEX 20 mg déle než 3 roky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Hypomagnezémie a metabolismus minerálů
Poraďte pacientovi nebo pečovateli, aby hlásil jakékoli klinické příznaky, které mohou být spojeny s hypomagnezémií, hypokalcémií, hypokalémií a hyponatrémií, poskytovateli zdravotní péče pacienta, pokud dostával přípravek ACIPHEX po dobu alespoň 3 měsíců [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Lékové interakce
Informujte pacienty, aby hlásili svému poskytovateli zdravotní péče, pokud užívají přípravky obsahující rilpivirin [viz KONTRAINDIKACE ], warfarin, digoxin nebo vysoké dávky methotrexátu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Správa
- Tablety ACIPHEX 10 mg s opožděným uvolňováním spolkněte celé. Tablety nežvýkejte, nedrťte ani nerozdělujte.
- K léčbě duodenálních vředů užívejte ACIPHEX tablety s opožděným uvolňováním po jídle.
- Pro eradikaci Helicobacter pylori užívejte ACIPHEX 20 mg tablety s opožděným uvolňováním s jídlem.
- U všech ostatních indikací lze ACIPHEX 10 mg tablety s opožděným uvolňováním užívat s jídlem nebo bez jídla.
- Užijte vynechanou dávku co nejdříve. Pokud je téměř čas na další dávku, vynechejte vynechanou dávku a vraťte se k normálnímu schématu. Neužívejte dvě dávky současně.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
88/104týdenní studii karcinogenity u myší CD-1 nevyvolal rabeprazol v perorálních dávkách až 100 mg/kg/den žádný zvýšený výskyt nádorů. Nejvyšší testovaná dávka vyvolala systémovou expozici rabeprazolu (AUC) 1,40 μg•hod/ml, což je 1,6násobek lidské expozice (plazmatická AUC0-∞ = 0,88 μg•hod/ml) při doporučené dávce pro GERD (20 mg/ml den). Ve 28týdenní studii karcinogenity u p53+/-transgenních myší nezpůsobil rabeprazol v perorálních dávkách 20, 60 a 200 mg/kg/den zvýšení incidence nádorů, ale ve všech dávkách vyvolal hyperplazii žaludeční sliznice. Systémová expozice rabeprazolu v dávce 200 mg/kg/den je asi 17 až 24krát vyšší než expozice u člověka při doporučené dávce pro GERD. Ve 104týdenní studii karcinogenity na potkanech Sprague-Dawley byli samci léčeni perorálními dávkami 5, 15, 30 a 60 mg/kg/den a samice 5, 15, 30, 60 a 120 mg/kg/den . Rabeprazol vyvolal hyperplazii žaludečních enterochromafínových buněk (ECL) u samců a samic potkanů a karcinoidní nádory buněk ECL u samic potkanů ve všech dávkách včetně nejnižší testované dávky. Nejnižší dávka (5 mg/kg/den) vyvolala systémovou expozici rabeprazolu (AUC) přibližně 0,1 μg•hod/ml, což je přibližně 0,1násobek lidské expozice při doporučené dávce pro GERD. U samců potkanů nebyly při dávkách do 60 mg/kg/den pozorovány žádné nádory související s léčbou, které by vedly k plazmatické expozici rabeprazolu (AUC) přibližně 0,2 μg•hod/ml (0,2násobek expozice u člověka při doporučené dávce pro GERD).
Rabeprazol byl pozitivní v Amesově testu, v testu přímé genové mutace buněk vaječníků čínského křečka (CHO/HGPRT) a v testu přímé genové mutace na buňce myšího lymfomu (L5178Y/TK+/–). Jeho demethylovaný metabolit byl také pozitivní v Amesově testu. Rabeprazol byl negativní v in vitro testu chromozomové aberace plicních buněk čínského křečka, in vivo testu mikrojader myší a in vivo a ex vivo testech neplánované syntézy DNA (UDS) potkaních hepatocytů (UDS).
Bylo zjištěno, že rabeprazol v intravenózních dávkách až do 30 mg/kg/den (plazmatická AUC 8,8 μg•h/ml, přibližně 10násobek expozice u člověka při doporučené dávce pro GERD) nemá žádný vliv na plodnost a reprodukční schopnost samců a krysích samic.
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
Neexistují žádné dostupné údaje o použití přípravku ACIPHEX 10 mg u těhotných žen, které by informovaly o rizicích spojených s užíváním léku. Základní riziko závažných vrozených vad a potratu pro uvedené populace není známo. Nicméně základní riziko v obecné populaci v USA u závažných vrozených vad je 2 až 4 % a potratu je 15 až 20 % klinicky uznaných těhotenství. V reprodukčních studiích na zvířatech s rabeprazolem podávaným během organogeneze 13násobku a 8násobku lidské plochy pod křivkou plazmatické koncentrace-čas (AUC) při doporučené dávce pro GERD nebyly pozorovány žádné známky nepříznivých vývojových účinků u potkanů a králíků [viz Data ].
Změny v morfologii kostí byly pozorovány u potomků potkanů léčených perorálními dávkami různých PPI po většinu březosti a laktace. Když bylo podávání matce omezeno pouze na gestaci, nebyly žádné účinky na morfologii kostní fýzy u potomků v jakémkoli věku [viz Data ].
Data
Údaje o zvířatech
Embryo-fetální vývojové studie byly provedeny u potkanů během organogeneze při intravenózních dávkách rabeprazolu až do 50 mg/kg/den (plazmatická AUC 11,8 μg•h/ml, přibližně 13násobek expozice u člověka při doporučené perorální dávce pro GERD) a králíků v intravenózních dávkách až 30 mg/kg/den (plazmatická AUC 7,3 μg•hod/ml, přibližně 8násobek expozice u člověka při doporučené perorální dávce pro GERD) a neodhalily žádné známky poškození plodu v důsledku rabeprazol.
Podávání rabeprazolu potkanům v pozdní březosti a během laktace v perorální dávce 400 mg/kg/den (přibližně 195násobek perorální dávky pro člověka vztaženo na mg/m2) vedlo ke snížení přírůstku tělesné hmotnosti mláďat.
Studie prenatální a postnatální vývojové toxicity u potkanů s dalšími cílovými body pro hodnocení vývoje kostí byla provedena s odlišným PPI při přibližně 3,4 až 57násobku perorální dávky pro člověka na základě plochy povrchu těla. Snížená délka stehenní kosti, šířka a tloušťka kortikální kosti, snížená tloušťka tibiální růstové ploténky a minimální až mírná hypocelularita kostní dřeně byly zaznamenány při dávkách tohoto PPI rovných nebo vyšších než 3,4násobek perorální dávky u člověka na základě plochy povrchu těla . Fyzální dysplazie ve femuru byla také pozorována u potomků po in utero a laktační expozici PPI v dávkách rovných nebo vyšších než 33,6násobek perorální dávky pro člověka na základě plochy povrchu těla. Účinky na mateřskou kost byly pozorovány u březích a kojících potkanů ve studii pre- a postnatální toxicity, kdy byl PPI podáván v perorálních dávkách 3,4 až 57násobku perorální dávky u člověka na základě tělesného povrchu. Když byly potkanům podávány dávky od 7. gestačního dne do odstavení 21. postnatálního dne, bylo pozorováno statisticky významné snížení hmotnosti stehenní kosti matky až o 14 % (ve srovnání s léčbou placebem) při dávkách rovných nebo vyšších než 33,6násobek perorální dávky u člověka na základě plochy povrchu těla.
Následná studie vývojové toxicity u potkanů s dalšími časovými body k vyhodnocení vývoje kostí mláďat od 2. postnatálního dne do dospělosti byla provedena s odlišným PPI při perorálních dávkách 280 mg/kg/den (asi 68násobek perorální dávky u člověka na základ plochy povrchu těla), kde podávání léčiva bylo buď od 7. dne gestace nebo od 16. dne gestace až do porodu. Když bylo podávání matce omezeno pouze na gestaci, neprojevily se žádné účinky na morfologii kostní fýzy u potomků v jakémkoli věku.
Laktace
Shrnutí rizik
Nebyly provedeny laktační studie k posouzení přítomnosti rabeprazolu v mateřském mléce, účinků rabeprazolu na kojené dítě nebo účinků rabeprazolu na produkci mléka. Rabeprazol je přítomen v mléce potkanů. Rozvoj a zdravotní přínosy kojení by měly být zváženy společně s klinickou potřebou matky ACIPHEX a veškerými potenciálními nežádoucími účinky ACIPHEX nebo základního stavu matky na kojené dítě.
Pediatrické použití
Bezpečnost a účinnost přípravku ACIPHEX 20 mg tablety s opožděným uvolňováním byla stanovena u pediatrických pacientů u dospívajících pacientů ve věku 12 let a starších pro léčbu symptomatické GERD. Použití přípravku ACIPHEX 20 mg tablety s opožděným uvolňováním v této věkové skupině je podpořeno adekvátními a dobře kontrolovanými studiemi u dospělých a multicentrickou, randomizovanou, otevřenou studií s paralelními skupinami u 111 dospívajících pacientů ve věku 12 až 16 let. Pacienti měli klinickou diagnózu symptomatické GERD nebo suspektní nebo endoskopicky prokázanou GERD a byli randomizováni buď k 10 mg nebo 20 mg jednou denně po dobu až 8 týdnů pro hodnocení bezpečnosti a účinnosti. Profil nežádoucích účinků u dospívajících pacientů byl podobný jako u dospělých. Související hlášené nežádoucí účinky, které se vyskytly u ≥ 2 % pacientů, byly bolest hlavy (5 %) a nauzea (2 %). V těchto studiích nebyly hlášeny žádné nežádoucí účinky, které nebyly dříve pozorovány u dospělých.
Bezpečnost a účinnost přípravku ACIPHEX 10 mg tablety s opožděným uvolňováním nebyla stanovena u pediatrických pacientů pro:
- Hojení erozivního nebo ulcerózního GERD
- Udržování hojení erozivního nebo ulcerózního GERD
- Léčba symptomatické GERD
- Hojení duodenálních vředů
- Eradikace Helicobacter pylori ke snížení rizika recidivy duodenálního vředu
- Léčba patologických hypersekrečních stavů, včetně Zollinger-Ellisonova syndromu
Tablety ACIPHEX s opožděným uvolňováním 20 mg se nedoporučují používat u pediatrických pacientů mladších 12 let, protože síla tablety překračuje doporučenou dávku pro tyto pacienty (viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. U pediatrických pacientů ve věku od 1 roku do méně než 12 let zvažte jinou lékovou formu rabeprazolu. Bezpečnost a účinnost jiné lékové formy a síly dávky rabeprazolu byla stanovena u pediatrických pacientů ve věku 1 až 11 let pro léčbu GERD.
Údaje o mladých zvířatech
Byly provedeny studie na juvenilních a mladých dospělých potkanech a psech. Ve studiích na juvenilních zvířatech byla sodná sůl rabeprazolu podávána perorálně potkanům po dobu až 5 týdnů a psům po dobu až 13 týdnů, vždy počínaje 7. dnem po porodu a poté následovalo 13týdenní období zotavení. Krysám byla podávána dávka 5, 25 nebo 150 mg/kg/den a psům byla podávána dávka 3, 10 nebo 30 mg/kg/den. Údaje z těchto studií byly srovnatelné s údaji u mladých dospělých zvířat. Farmakologicky zprostředkované změny, včetně zvýšených hladin gastrinu v séru a žaludečních změn, byly pozorovány u všech úrovní dávek jak u potkanů, tak u psů. Tato pozorování byla během 13týdenních období zotavení reverzibilní. I když se tělesná hmotnost a/nebo délka temeno-zadečku během dávkování snížily minimálně, nebyly u mladých potkanů ani psů zaznamenány žádné účinky na vývojové parametry.
Když byla nedospělá zvířata léčena po dobu 28 dnů různými PPI v dávkách rovných nebo vyšších než 34násobek denní perorální dávky pro člověka na základě tělesného povrchu, byl ovlivněn celkový růst a snížení tělesné hmotnosti související s léčbou (přibližně 14 %) a zvýšení tělesné hmotnosti a snížení hmotnosti stehenní kosti a délky stehenní kosti.
Geriatrické použití
Z celkového počtu subjektů (n=2009) v klinických studiích ACIPHEX 20 mg tablety s opožděným uvolňováním bylo 19 % ve věku 65 let a více, zatímco 4 % bylo ve věku 75 let a více. Mezi těmito subjekty a mladšími subjekty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti a další hlášené klinické zkušenosti neidentifikovaly rozdíly v odpovědích mezi staršími a mladšími pacienty, nelze však vyloučit větší citlivost některých starších osob.
Poškození jater
Podávání tablet ACIPHEX s opožděným uvolňováním pacientům s mírnou až středně těžkou poruchou funkce jater (Child-Pugh třída A a B) vedlo ke zvýšené expozici a snížené eliminaci (viz KLINICKÁ FARMAKOLOGIE ]. U pacientů s mírnou až středně těžkou poruchou funkce jater není nutná žádná úprava dávkování. U pacientů s těžkou poruchou funkce jater (Child-Pugh třída C) nejsou žádné informace. Vyhněte se užívání tablet ACIPHEX s opožděným uvolňováním u pacientů s těžkou poruchou funkce jater; pokud je však léčba nezbytná, sledujte pacienty kvůli nežádoucím reakcím [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , NEŽÁDOUCÍ REAKCE ].
PŘEDÁVKOVAT
Bylo obdrženo sedm zpráv o náhodném předávkování rabeprazolem. Maximální hlášené předávkování bylo 80 mg. Nebyly pozorovány žádné klinické známky nebo příznaky spojené s jakýmkoli hlášeným předávkováním. Pacienti se Zollinger-Ellisonovým syndromem byli léčeni až 120 mg rabeprazolu jednou denně. Není známo žádné specifické antidotum pro rabeprazol. Rabeprazol se ve velké míře váže na proteiny a není snadno dialyzovatelný.
případě předávkování by měla být léčba symptomatická a podpůrná.
Pokud dojde k nadměrné expozici, zavolejte do Poison Control Center na čísle 1-800-222-1222, kde získáte aktuální informace o léčbě otravy nebo předávkování.
KONTRAINDIKACE
- ACIPHEX 10 mg je kontraindikován u pacientů se známou přecitlivělostí na rabeprazol, substituované benzimidazoly nebo na kteroukoli složku přípravku. Hypersenzitivní reakce mohou zahrnovat anafylaxi, anafylaktický šok, angioedém, bronchospasmus, akutní tubulointersticiální nefritidu a kopřivku (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , NEŽÁDOUCÍ REAKCE ].
- PPI, včetně ACIPHEX, jsou kontraindikovány s přípravky obsahujícími rilpivirin [viz DROGOVÉ INTERAKCE ].
- Informace o kontraindikacích antibakteriálních látek (klaritromycin a amoxicilin) indikovaných v kombinaci s přípravkem ACIPHEX 20 mg tablety s opožděným uvolňováním naleznete v příbalové informaci v části Kontraindikace.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Rabeprazol patří do třídy antisekrečních sloučenin (substituované benzimidazolové inhibitory protonové pumpy), které nevykazují anticholinergní nebo antagonistické vlastnosti histaminového H2-receptoru, ale potlačují sekreci žaludeční kyseliny inhibicí žaludeční H+, K+ATPázy na sekrečním povrchu žaludku. parietální buňka. Protože je tento enzym považován za kyselou (protonovou) pumpu v parietální buňce, byl rabeprazol charakterizován jako inhibitor žaludeční protonové pumpy. Rabeprazol blokuje poslední krok sekrece žaludeční kyseliny.
V parietálních buňkách žaludku je rabeprazol protonován, hromadí se a přeměňuje se na aktivní sulfenamid. Při studiu in vitro je rabeprazol chemicky aktivován při pH 1,2 s poločasem rozpadu 78 sekund. Inhibuje transport kyseliny v prasečích žaludečních váčcích s poločasem 90 sekund.
Farmakodynamika
Antisekreční činnost
Antisekreční účinek nastupuje do jedné hodiny po perorálním podání 20 mg ACIPHEX 20 mg tablety s opožděným uvolňováním. Střední inhibiční účinek rabeprazolu na 24hodinovou aciditu žaludku je 88 % maxima po první dávce. Dávka 20 mg tablet ACIPHEX s opožděným uvolňováním inhibuje bazální a peptonovým jídlem stimulovanou sekreci kyseliny oproti placebu o 86 % a 95 %, v tomto pořadí a zvyšuje procento 24hodinového období, kdy pH žaludku >3 z 10 % na 65 % (viz tabulka níže). Tento relativně prodloužený farmakodynamický účinek ve srovnání s krátkým farmakokinetickým poločasem (1 až 2 hodiny) odráží trvalou inaktivaci H+, K+ATPázy.
Ve srovnání s placebem, 10 mg, 20 mg a 40 mg tablety ACIPHEX s opožděným uvolňováním podávané jednou denně po dobu 7 dnů významně snížily intragastrickou aciditu se všemi dávkami pro každý ze čtyř intervalů souvisejících s jídlem a celkově 24hodinové časové období. V této studii nebyly mezi dávkami žádné statisticky významné rozdíly; došlo však k významnému na dávce závislému snížení intragastrické acidity. Schopnost rabeprazolu způsobit na dávce závislé snížení průměrné intragastrické acidity je ilustrována níže.

Po podávání 20 mg ACIPHEX 20 mg tablet s opožděným uvolňováním jednou denně po dobu osmi dnů bylo průměrné procento času, kdy bylo pH žaludku vyšší než 3 nebo pH žaludku vyšší než 4 po jedné dávce (den 1) a více dávkách (den 8) významně vyšší než u placeba (viz tabulka níže). Snížení kyselosti žaludku a zvýšení pH žaludku pozorované u 20 mg ACIPHEX 10 mg tablet s opožděným uvolňováním podávaných jednou denně po dobu osmi dnů byly porovnány se stejnými parametry pro placebo, jak je znázorněno níže:
Účinky na expozici kyselině jícnu
pacientů s GERD a středně těžkou až těžkou expozicí jícnové kyselině snížila dávka 20 mg a 40 mg denně ACIPHEX 20 mg tablety s opožděným uvolňováním 24hodinovou expozici esofageální kyselině. Po sedmi dnech léčby se procento času, kdy bylo pH jícnu nižší než 4, snížilo z výchozích hodnot 24,7 % pro 20 mg a 23,7 % pro 40 mg na 5,1 % a 2,0 %, v daném pořadí. Normalizace 24hodinové intraezofageální expozice kyselině korelovala s pH žaludku vyšším než 4 po dobu alespoň 35 % 24hodinového období; této hladiny bylo dosaženo u 90 % subjektů užívajících ACIPHEX 20 mg a u 100 % subjektů užívajících ACIPHEX 40 mg. U přípravku ACIPHEX 20 mg a 40 mg denně byly významné účinky na pH žaludku a jícnu zaznamenány po jednom dni léčby a výraznější po sedmi dnech léčby.
Účinky na sérový gastrin
Střední hladina gastrinu nalačno se zvýšila v závislosti na dávce u pacientů léčených jednou denně přípravkem ACIPHEX 10 mg tablety s opožděným uvolňováním po dobu až osmi týdnů pro ulcerózní nebo erozivní ezofagitidu a u pacientů léčených po dobu až 52 týdnů k prevenci recidivy onemocnění. Hodnoty mediánu skupiny zůstaly v normálním rozmezí.
Ve skupině subjektů léčených 20 mg tabletami ACIPHEX s opožděným uvolňováním po dobu 4 týdnů bylo pozorováno zdvojnásobení středních koncentrací gastrinu v séru. Přibližně u 35 % těchto léčených subjektů došlo k rozvoji sérových koncentrací gastrinu nad horní hranicí normálu.
Účinky na buňky podobné enterochromafínu (ECL).
Zvýšený sérový gastrin sekundární k antisekrečním činidlům stimuluje proliferaci žaludečních ECL buněk, což může časem vést k hyperplazii ECL buněk u potkanů a myší a žaludeční karcinoidy u potkanů, zejména u samic [viz Neklinická toxikologie ].
více než 400 pacientů léčených tabletami ACIPHEX s opožděným uvolňováním (10 nebo 20 mg) jednou denně po dobu až jednoho roku se incidence hyperplazie buněk ECL zvyšovala s časem a dávkou, což je v souladu s farmakologickým účinkem inhibitoru protonové pumpy. U žádného pacienta se nevyvinuly adenomatoidní, dysplastické nebo neoplastické změny ECL buněk v žaludeční sliznici. U žádného pacienta se nevyvinuly karcinoidní nádory pozorované u potkanů.
Endokrinní účinky
Studie na lidech po dobu až jednoho roku neodhalily klinicky významné účinky na endokrinní systém. U zdravých subjektů mužského pohlaví léčených tabletami ACIPHEX s opožděným uvolňováním po dobu 13 dnů nebyly zjištěny žádné klinicky relevantní změny v následujících vyšetřovaných endokrinních parametrech: 17 β-estradiol, hormon stimulující štítnou žlázu, trijodtyronin, tyroxin, protein vázající tyroxin, příštítná tělíska hormon, inzulín, glukagon, renin, aldosteron, folikuly stimulující hormon, luteotropní hormon, prolaktin, somatotrofní hormon, dehydroepiandrosteron, globulin vázající kortizol a 6p-hydroxykortizol v moči, sérový testosteron a cirkadiánní kortizolový profil.
Další efekty
lidí léčených přípravkem ACIPHEX 10 mg tablety s opožděným uvolňováním po dobu až jednoho roku nebyly pozorovány žádné systémové účinky na centrální nervový, lymfoidní, hematopoetický, ledvinový, jaterní, kardiovaskulární nebo respirační systém. Nejsou k dispozici žádné údaje o dlouhodobé léčbě přípravkem ACIPHEX 10 mg tablety s opožděným uvolňováním a očních účincích.
Farmakokinetika
Po perorálním podání 20 mg ACIPHEX 10 mg tablety s opožděným uvolňováním se maximální plazmatické koncentrace (Cmax) rabeprazolu objevují v rozmezí 2 až 5 hodin (Tmax). Cmax a AUC rabeprazolu jsou lineární v rozmezí perorálních dávek 10 mg až 40 mg. Při podávání dávek 10 mg až 40 mg každých 24 hodin nedochází k žádné znatelné akumulaci; farmakokinetika rabeprazolu se opakovaným podáváním nemění.
Vstřebávání
Absolutní biologická dostupnost 20 mg perorální tablety rabeprazolu (ve srovnání s intravenózním podáním) je přibližně 52 %. Když se ACIPHEX 10 mg tablety s opožděným uvolňováním podávají s jídlem s vysokým obsahem tuku, Tmax je variabilní; který současný příjem potravy může zpozdit absorpci až o 4 hodiny nebo déle. Cmax a rozsah absorpce rabeprazolu (AUC) se však významně nemění. Tablety ACIPHEX s opožděným uvolňováním lze tedy užívat bez ohledu na načasování jídla.
Rozdělení
Rabeprazol se z 96,3 % váže na lidské plazmatické proteiny.
Odstranění
Metabolismus
Rabeprazol je rozsáhle metabolizován. Významná část rabeprazolu je metabolizována systémovou neenzymatickou redukcí na thioetherovou sloučeninu. Rabeprazol je také metabolizován na sulfonové a desmethylové sloučeniny prostřednictvím cytochromu P450 v játrech. Thioether a sulfon jsou primární metabolity měřené v lidské plazmě. U těchto metabolitů nebyla pozorována významná antisekreční aktivita. Studie in vitro prokázaly, že rabeprazol je metabolizován v játrech primárně cytochromy P450 3A (CYP3A) na sulfonový metabolit a cytochromem P450 2C19 (CYP2C19) na desmethyl rabeprazol. CYP2C19 vykazuje známý genetický polymorfismus v důsledku jeho nedostatku v některých subpopulacích (např. 3 až 5 % bělochů a 17 až 20 % Asiatů). Metabolismus rabeprazolu je u těchto subpopulací pomalý, proto se o nich hovoří jako o špatných metabolizátorech léku.
Vylučování
Po jednorázové 20mg perorální dávce 14C-značeného rabeprazolu bylo přibližně 90 % léčiva vyloučeno močí, primárně jako thioetherkarboxylová kyselina; jeho glukuronid a metabolity kyseliny merkapturové. Zbytek dávky byl získán ve stolici. Celkový výtěžek radioaktivity byl 99,8 %. V moči nebo stolici nebyl nalezen žádný nezměněný rabeprazol.
Specifické populace
Geriatričtí pacienti
U 20 zdravých starších subjektů, kterým byly podávány 20 mg tablety ACIPHEX s opožděným uvolňováním jednou denně po dobu sedmi dnů, se hodnoty AUC přibližně zdvojnásobily a Cmax se zvýšila o 60 % ve srovnání s hodnotami v paralelní mladší kontrolní skupině. Neexistoval žádný důkaz akumulace léku po podávání jednou denně [viz Použití ve specifické populaci ].
Pediatričtí pacienti
Farmakokinetika rabeprazolu byla studována u 12 dospívajících pacientů s GERD ve věku 12 až 16 let v multicentrické studii. Pacienti dostávali 20 mg tablety ACIPHEX s opožděným uvolňováním jednou denně po dobu pěti nebo sedmi dnů. Po 5 až 7 dnech podávání bylo zaznamenáno přibližně 40% zvýšení expozice rabeprazolu ve srovnání s expozicí po 1 dni podávání. Farmakokinetické parametry u dospívajících pacientů s GERD ve věku 12 až 16 let byly v rozmezí pozorovaném u zdravých dospělých subjektů.
Mužské a ženské pacienty a rasové nebo etnické skupiny
V analýzách upravených pro tělesnou hmotnost a výšku neukázala farmakokinetika rabeprazolu žádné klinicky významné rozdíly mezi muži a ženami. Ve studiích, které používaly různé formulace rabeprazolu, byly hodnoty AUC0-∞ pro zdravé japonské muže přibližně o 50 až 60 % vyšší než hodnoty odvozené ze shromážděných údajů od zdravých mužů ve Spojených státech.
Pacienti s poruchou ledvin
10 pacientů se stabilním terminálním onemocněním ledvin vyžadujícím udržovací hemodialýzu (clearance kreatininu ≤5 ml/min/1,73 m²) nebyly pozorovány žádné klinicky významné rozdíly ve farmakokinetice rabeprazolu po jednorázové 20mg dávce ACIPHEX 20mg tablety s opožděným uvolňováním ve srovnání s 10 zdravými subjekty.
Pacienti s poruchou funkce jater
Ve studii s jednorázovou dávkou u 10 pacientů s mírnou až středně těžkou poruchou funkce jater (Child-Pugh třída A a B, v tomto pořadí), kterým byla podána jedna 20mg dávka přípravku ACIPHEX 10 mg tablety s opožděným uvolňováním, se AUC0-24 přibližně zdvojnásobila, eliminace poločas byl 2 až 3krát vyšší a celková tělesná clearance byla snížena na méně než polovinu ve srovnání s hodnotami u zdravých mužů.
Ve studii s opakovanými dávkami u 12 pacientů s mírnou až středně těžkou poruchou funkce jater, kterým bylo podáváno 20 mg ACIPHEX 10 mg tablety s opožděným uvolňováním jednou denně po dobu osmi dnů, se hodnoty AUC0-∞ a Cmax zvýšily přibližně o 20 % ve srovnání s hodnotami u zdravých jedinců stejného věku a pohlaví. předměty. Tato zvýšení nebyla statisticky významná.
Neexistují žádné informace o dispozici rabeprazolu u pacientů s těžkou poruchou funkce jater (Child-Pugh třída C) (viz Použití u konkrétních populací ].
Studie lékových interakcí
Kombinované podávání s antimikrobiálními látkami
Šestnácti zdravým subjektům genotypovaným jako rychlí metabolizátoři s ohledem na CYP2C19 byly ve čtyřcestné zkřížené studii podávány 20 mg tablety ACIPHEX s opožděným uvolňováním, 1000 mg amoxicilinu, 500 mg klarithromycinu nebo všechny 3 léky. Každý ze čtyř režimů byl podáván dvakrát denně po dobu 6 dnů. AUC a Cmax klarithromycinu a amoxicilinu se po kombinovaném podání nelišily ve srovnání s hodnotami po jednorázovém podání. Po kombinovaném podání se však AUC a Cmax rabeprazolu zvýšily o 11 % a 34 %. AUC a Cmax pro 14-hydroxyklaritromycin (aktivní metabolit klarithromycinu) se také zvýšily o 42 % a Cmax o 46 %. Neočekává se, že by toto zvýšení expozice rabeprazolu a 14-hydroxyklaritromycinu vyvolalo bezpečnostní obavy.
Účinky jiných léků na rabeprazol
Antacida
Současné podávání ACIPHEX 20 mg tablet s opožděným uvolňováním a antacidů nevyvolalo žádné klinicky významné změny plazmatických koncentrací rabeprazolu.
Účinky Rabeprazolu Na Jiné Léky
Studie na zdravých dobrovolnících ukázaly, že rabeprazol nemá klinicky významné interakce s jinými léky metabolizovanými systémem CYP450, jako je teofylin (CYP1A2) podávaný v jedné perorální dávce, diazepam (CYP2C9 a CYP3A4) v jedné intravenózní dávce a fenytoin ( CYP2C9 a CYP2C19) podávané v jedné intravenózní dávce (s doplňkovým perorálním dávkováním). Interakce rabeprazolu a dalších léků metabolizovaných tímto enzymovým systémem v ustáleném stavu nebyly u pacientů studovány.
clopidogrel
Klopidogrel je metabolizován na svůj aktivní metabolit částečně prostřednictvím CYP2C19. Byla provedena studie na zdravých dobrovolnících včetně rychlých a středních metabolizátorů CYP2C19, kteří dostávali jednou denně 75 mg klopidogrelu současně s placebem nebo s 20 mg ACIPHEX 20 mg tablety s opožděným uvolňováním (n=36) po dobu 7 dnů. Průměrná AUC aktivního metabolitu klopidogrelu byla snížena přibližně o 12 % (průměrný poměr AUC byl 88 %, s 90% CI 81,7 až 95,5 %), když byly tablety ACIPHEX s opožděným uvolňováním podávány současně, ve srovnání s podáváním klopidogrelu s placebem (viz DROGOVÉ INTERAKCE ].
Digoxin
U zdravých dospělých jedinců (n=16) vedlo současné podávání 20 mg rabeprazolu ve formě tablet s opožděným uvolňováním s dávkami 2,5 mg digoxinu jednou denně v rovnovážném stavu k přibližně 29% a 19% zvýšení průměrné Cmax a AUC(0- 24) digoxinu [viz DROGOVÉ INTERAKCE ].
ketokonazol
zdravých dospělých jedinců (n=19) vedlo současné podávání 20 mg rabeprazolu ve formě tablet s opožděným uvolňováním v ustáleném stavu s jednou 400mg perorální dávkou ketokonazolu přibližně o 31 % snížení Cmax i AUC(0- inf) ketokonazolu [viz DROGOVÉ INTERAKCE ].
Cyklosporin
Inkubace in vitro využívající mikrozomy lidských jater ukázaly, že rabeprazol inhiboval metabolismus cyklosporinu s IC50 62 mikromolární, což je koncentrace, která je více než 50krát vyšší než Cmax u zdravých dobrovolníků po 14 dnech podávání 20 mg ACIPHEX 10 mg tablet s opožděným uvolňováním. Tento stupeň inhibice je podobný jako u omeprazolu při ekvivalentních koncentracích.
Mikrobiologie
K dispozici jsou následující údaje in vitro, ale klinický význam není znám.
Bylo prokázáno, že rabeprazol sodný, amoxicilin a klarithromycin jako režim tří léků jsou účinné proti většině kmenů Helicobacter pylori in vitro a při klinických infekcích (viz INDIKACE A POUŽITÍ , Klinické studie ].
Helicobacter pylori
Testování citlivosti izolátů H. pylori bylo provedeno na amoxicilin a klarithromycin pomocí metodologie ředění agaru1 a byly stanoveny minimální inhibiční koncentrace (MIC).
Standardizované postupy testování citlivosti vyžadují použití laboratorních kontrolních mikroorganismů ke kontrole technických aspektů laboratorních postupů.
Výskyt organismů odolných vůči antibiotikům mezi klinickými izoláty
Odolnost před úpravou
Míra rezistence klarithromycinu před léčbou (MIC ≥1 mcg/ml) vůči H. pylori byla na začátku ve všech léčebných skupinách dohromady 9 % (51/560). Více než 99 % (558/560) pacientů mělo izoláty H. pylori, které byly na počátku považovány za citlivé (MIC ≤ 0,25 mcg/ml) na amoxicilin. Dva pacienti měli výchozí izoláty H. pylori s MIC amoxicilinu 0,5 mcg/ml.
Informace o testování citlivosti na Helicobacter pylori naleznete v části Mikrobiologie v informacích o předepisování claritromycinu a amoxicilinu.
Pacienti s přetrvávající infekcí H. pylori po léčbě rabeprazolem, amoxicilinem a klarithromycinem budou mít pravděpodobně klinické izoláty rezistentní na klarithromycin. Pokud je to možné, mělo by se proto provést testování citlivosti na klarithromycin. Pokud je prokázána rezistence na klarithromycin nebo testování citlivosti není možné, měla by být zahájena alternativní antimikrobiální léčba.
Výsledky testu citlivosti na amoxicilin a klinické/bakteriologické výsledky
americké multicentrické studii mělo více než 99 % (558/560) pacientů izoláty H. pylori, které byly považovány za citlivé (MIC ≤ 0,25 mcg/ml) na amoxicilin na začátku studie. Další 2 pacienti měli výchozí izoláty H. pylori s MIC amoxicilinu 0,5 mcg/ml a oba izoláty byly na začátku rezistentní na klarithromycin; v jednom případě byl H. pylori vymýcen. V 7denní a 10denní léčebné skupině 75 % (107/145) a 79 % (112/142) pacientů, kteří měli před léčbou MIC citlivé na amoxicilin (≤ 0,25 mcg/ml), bylo eradikováno H. pylori . U žádného pacienta se během léčby nevyvinula H. pylori rezistentní na amoxicilin.
Farmakogenomika
klinické studii hodnotící tablety ACIPHEX s opožděným uvolňováním u dospělých japonských pacientů kategorizovaných podle genotypu CYP2C19 (n=6 na kategorii genotypů) byla suprese žaludeční kyseliny vyšší u pomalých metabolizátorů ve srovnání s extenzivními metabolizátory. To by mohlo být způsobeno vyššími plazmatickými hladinami rabeprazolu u pomalých metabolizátorů. Klinický význam tohoto není znám. Zda by se interakce sodné soli rabeprazolu s jinými léky metabolizovanými CYP2C19 mezi extenzivními a slabými metabolizátory lišily, či nikoli, nebylo studováno.
Klinické studie
Hojení Erozivních Nebo Ulcerózních GERD U dospělých
americké multicentrické, randomizované, dvojitě zaslepené, placebem kontrolované studii bylo 103 pacientů léčeno po dobu až osmi týdnů placebem, 10 mg, 20 mg nebo 40 mg tabletami ACIPHEX s opožděným uvolňováním jednou denně. Pro tuto a všechny studie hojení GERD byli způsobilí pro zařazení pouze pacienti se symptomy GERD a ezofagitidou alespoň 2. stupně (upravená škála Hetzel-Dent grading scale). Endoskopické hojení bylo definováno jako stupeň 0 nebo 1. Každá dávka rabeprazolu byla významně lepší než placebo při endoskopickém hojení po čtyřech a osmi týdnech léčby. Procento pacientů prokazujících endoskopické hojení bylo následující:
Kromě toho byl v týdnech 4 a 8 statisticky významný rozdíl ve prospěch dávek ACIPHEX 10 mg, 20 mg a 40 mg ve srovnání s placebem, pokud jde o úplné vymizení frekvence GERD pálení žáhy (p≤0,026). Všechny skupiny ACIPHEX hlásily signifikantně vyšší míru úplného vymizení závažnosti GERD denního pálení žáhy ve srovnání s placebem ve 4. a 8. týdnu (p≤0,036). Průměrné snížení denní dávky antacid oproti výchozí hodnotě bylo statisticky významné pro všechny skupiny ACIPHEX ve srovnání s placebem v týdnech 4 a 8 (p≤0,007).
V severoamerické multicentrické, randomizované, dvojitě zaslepené, aktivně kontrolované studii s 336 pacienty bylo procento pacientů zhojených při endoskopii po čtyřech a osmi týdnech léčby statisticky lepší u pacientů léčených tabletami ACIPHEX s opožděným uvolňováním ve srovnání s ranitidinem :
Dávka 20 mg tablet ACIPHEX s opožděným uvolňováním jednou denně byla významně účinnější než ranitidin 150 mg čtyřikrát denně u procenta pacientů s úplným vymizením pálení žáhy ve 4. a 8. týdnu (p
Doporučená dávka přípravku ACIPHEX 10 mg tablety s opožděným uvolňováním je 20 mg jednou denně po dobu 4 až 8 týdnů.
Dlouhodobé udržování hojení erozivního nebo ulcerózního GERD u dospělých
Dlouhodobé udržení hojení u pacientů s erozivní nebo ulcerózní GERD dříve vyléčených žaludeční antisekreční terapií bylo hodnoceno ve dvou amerických, multicentrických, randomizovaných, dvojitě zaslepených, placebem kontrolovaných studiích stejného designu v trvání 52 týdnů. Ve dvou studiích bylo randomizováno 209 a 285 pacientů, kteří dostávali buď 10 mg nebo 20 mg tablety ACIPHEX s opožděným uvolňováním jednou denně, nebo placebo. Jak je ukázáno v tabulkách 10 a 11 níže, pacienti léčení tabletami ACIPHEX s opožděným uvolňováním byli v obou studiích významně lepší než placebo, pokud jde o udržení hojení GERD a podíl pacientů, kteří zůstali bez příznaků pálení žáhy po 52. týdnu. Doporučená dávka přípravku ACIPHEX 20 mg tablety s opožděným uvolňováním je 20 mg jednou denně.
Léčba symptomatické GERD u dospělých
Dvě americké, multicentrické, dvojitě zaslepené, placebem kontrolované studie byly provedeny u 316 dospělých pacientů s denním a nočním pálením žáhy. Pacienti hlásili 5 nebo více období středně těžkého až velmi těžkého pálení žáhy během fáze léčby placebem týden před randomizací. Pacienti byli endoskopicky potvrzeni, že nemají žádné eroze jícnu.
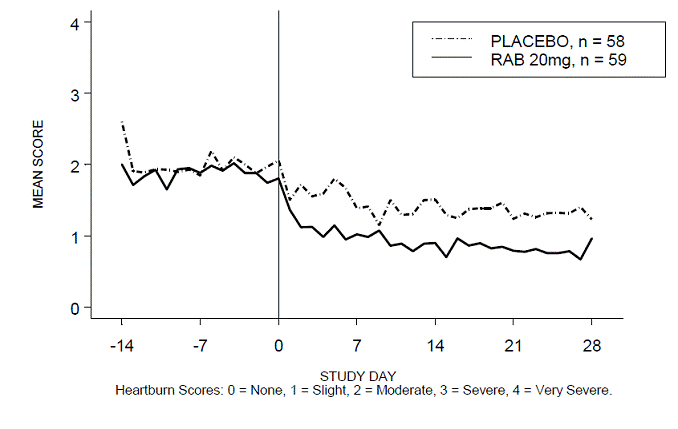
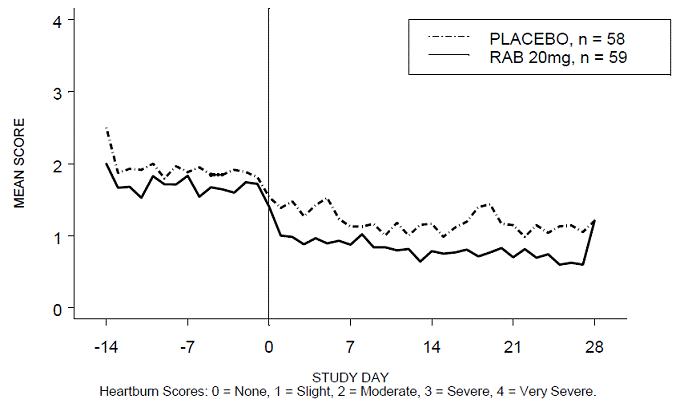
Procento období bez pálení žáhy během dne a/nebo noci bylo větší u 20 mg ACIPHEX 20 mg tablet s opožděným uvolňováním ve srovnání s placebem během 4 týdnů studie ve studii RABUSA-2 (47 % vs. 23 %) a studii RAB-USA- 3 (52 % vs. 28 %). Průměrné poklesy průměrného denního a nočního skóre pálení žáhy od výchozí hodnoty byly významně vyšší pro ACIPHEX 20 mg ve srovnání s placebem v týdnu 4. Grafické zobrazení zobrazující denní průměrné denní a noční skóre jsou uvedeny na obrázcích 2 až 5.
Obrázek 2: Průměrné denní skóre pálení žáhy RAB-USA-2
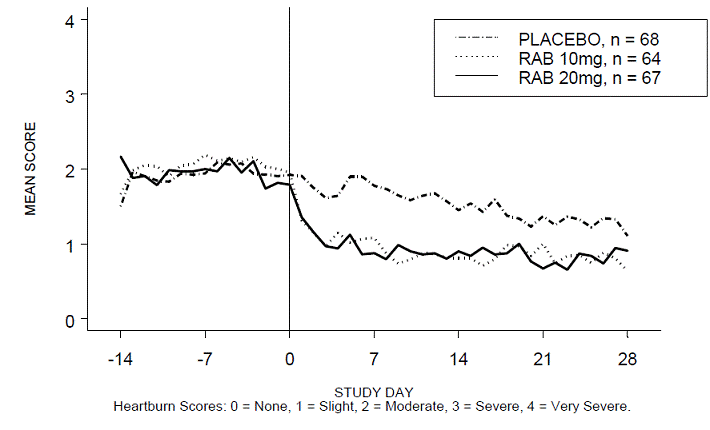
Obrázek 3: Průměrné skóre nočního pálení žáhy RAB-USA-2
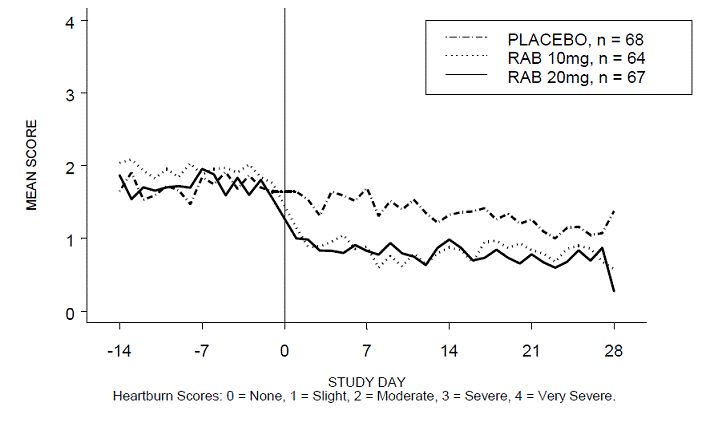
Obrázek 4: Průměrné skóre pálení žáhy během dne RAB-USA-3 Obrázek 3: Průměrné skóre pálení žáhy během dne RAB - USA – 3
Obrázek 5: Průměrné skóre nočního pálení žáhy RAB-USA-3
Navíc kombinovaná analýza těchto dvou studií ukázala, že 20 mg ACIPHEX 10 mg tablet s opožděným uvolňováním významně zlepšilo další symptomy související s GERD (regurgitace, říhání a časná sytost) do týdne 4 ve srovnání s placebem (všechny hodnoty p
Dávka 20 mg ACIPHEX 20 mg tablety s opožděným uvolňováním také významně snížila denní spotřebu antacid oproti placebu po dobu 4 týdnů (p
Doporučená dávka tablet ACIPHEX s opožděným uvolňováním je 20 mg jednou denně po dobu 4 týdnů.
Hojení Duodenálních Vředů U Dospělých
americké, randomizované, dvojitě zaslepené, multicentrické studii hodnotící účinnost 20 mg a 40 mg ACIPHEX 10 mg tablet s opožděným uvolňováním jednou denně oproti placebu pro hojení endoskopicky definovaných duodenálních vředů bylo 100 pacientů léčeno po dobu až čtyř týdnů. ACIPHEX byl významně lepší než placebo při hojení duodenálních vředů. Procento pacientů s endoskopickým zhojením je uvedeno níže:
týdnech 2 a 4 signifikantně více pacientů ve skupinách ACIPHEX 20 a 40 mg hlásilo úplné vymizení frekvence vředové bolesti (p≤0,018), závažnosti denní bolesti (p≤0,023) a závažnosti noční bolesti (p≤0,035) ve srovnání s placebo pacienti. Jedinou výjimkou byla skupina 40 mg versus placebo v týdnu 2 pro frekvenci bolesti duodenálního vředu (p=0,094). Na konci prvního týdne studie byly v obou skupinách ACIPHEX ve srovnání s placebem zaznamenány významné rozdíly v ústupu denní a noční bolesti. Významné snížení denního užívání antacid bylo také zaznamenáno v obou skupinách ACIPHEX ve srovnání s placebem v týdnech 2 a 4 (p
Mezinárodní randomizovaná, dvojitě zaslepená, aktivně kontrolovaná studie byla provedena u 205 pacientů srovnávajících 20 mg tablety ACIPHEX s opožděným uvolňováním jednou denně s 20 mg omeprazolu jednou denně. Studie byla navržena tak, aby poskytla alespoň 80% sílu k vyloučení rozdílu alespoň 10% mezi ACIPHEX 10mg a omeprazolem, za předpokladu čtyřtýdenní léčebné odpovědi 93% pro obě skupiny. U pacientů s endoskopicky definovanými duodenálními vředy léčenými po dobu až čtyř týdnů byl ACIPHEX srovnatelný s omeprazolem při hojení duodenálních vředů. Procento pacientů s endoskopickým zhojením po dvou a čtyřech týdnech je uvedeno níže:
ACIPHEX 20 mg a omeprazol byly srovnatelné v poskytování úplného ústupu symptomů.
Doporučená dávka přípravku ACIPHEX 20 mg tablety s opožděným uvolňováním je 20 mg jednou denně po dobu 4 týdnů.
Eradikace Helicobacter pylori u pacientů s peptickým vředovým onemocněním nebo symptomatickým nevředovým onemocněním u dospělých
Multicentrická studie v USA byla dvojitě zaslepené srovnání paralelních skupin ACIPHEX tablet s opožděným uvolňováním, amoxicilinu a klarithromycinu po dobu 3, 7 nebo 10 dnů vs. omeprazol, amoxicilin a klarithromycin po dobu 10 dnů. Terapie sestávala z rabeprazolu 20 mg dvakrát denně, amoxicilinu 1000 mg dvakrát denně a klarithromycinu 500 mg dvakrát denně (RAC) nebo omeprazolu 20 mg dvakrát denně, amoxicilinu 1000 mg dvakrát denně a klarithromycinu 500 mg dvakrát denně (OAC). Pacienti s infekcí H. pylori byli stratifikováni v poměru 1:1 pro pacienty s peptickým vředovým onemocněním (aktivní nebo s vředem v anamnéze v posledních pěti letech) [PUD] a ty, kteří byli symptomatickí, ale bez vředové choroby [NPUD], jak bylo stanoveno endoskopií horní části gastrointestinálního traktu. Celková míra eradikace H. pylori, definovaná jako negativní 13C-UBT pro H. pylori ≥6 týdnů od konce léčby, je uvedena v následující tabulce. Bylo zjištěno, že míra eradikace v 7denním a 10denním režimu RAC je podobná 10dennímu režimu OAC s použitím populací Intent-to-Treat (ITT) nebo Per-Protocol (PP). Míra eradikace v 3denním režimu RAC byla nižší než u ostatních režimů.
Doporučená dávka přípravku ACIPHEX 20 mg tablety s opožděným uvolňováním je 20 mg dvakrát denně s amoxicilinem a klarithromycinem po dobu 7 dnů.
Patologické hypersekreční stavy, včetně Zollinger-Ellisonova syndromu u dospělých
Dvanáct pacientů s idiopatickou hypersekrecí žaludku nebo Zollinger-Ellisonovým syndromem bylo úspěšně léčeno přípravkem ACIPHEX 10 mg tablety s opožděným uvolňováním v dávkách od 20 do 120 mg po dobu až 12 měsíců. ACIPHEX 10 mg způsobil uspokojivou inhibici sekrece žaludeční kyseliny u všech pacientů a úplné vymizení známek a příznaků acido-peptického onemocnění, pokud je přítomno. ACIPHEX 20 mg také zabránil recidivě žaludeční hypersekrece a projevům acido-peptického onemocnění u všech pacientů. Vysoké dávky přípravku ACIPHEX používané k léčbě této malé skupiny pacientů s hypersekrecí žaludku byly dobře tolerovány.
Doporučená počáteční dávka tablet ACIPHEX s opožděným uvolňováním je 60 mg jednou denně.
REFERENCE
1. Institut klinických a laboratorních standardů (CLSI). Metody ředění Testy antimikrobiální citlivosti na bakterie, které rostou aerobně; Schválený standard – desáté vydání. Dokument CLSI M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania, 19087, USA 2015.
INFORMACE PRO PACIENTA
ACIPHEX® (a-se-feks) (rabeprazol sodný) tablety s opožděným uvolňováním
Jaké jsou nejdůležitější informace, které bych měl vědět o přípravku ACIPHEX 10 mg?
ACIPHEX 20 mg byste měli užívat přesně podle předpisu, v nejnižší možné dávce a po co nejkratší potřebnou dobu.
ACIPHEX 20 mg může pomoci vašim příznakům souvisejícím s kyselinou, ale přesto můžete mít vážné žaludeční problémy. Promluvte si se svým lékařem.
ACIPHEX 20 mg může způsobit závažné nežádoucí účinky, včetně:
- Typ ledvinového problému (akutní tubulointersticiální nefritida). některých lidí, kteří užívají léky na bázi inhibitoru protonové pumpy (PPI), včetně přípravku ACIPHEX, se může rozvinout problém s ledvinami nazývaný akutní tubulointersticiální nefritida, ke kterému může dojít kdykoli během léčby přípravkem ACIPHEX. Okamžitě zavolejte svého lékaře, pokud se sníží množství moči nebo pokud máte krev v moči.
- Průjem způsobený infekcí (Clostridium difficile) ve střevech. Okamžitě zavolejte svého lékaře, pokud máte vodnatou stolici nebo bolesti žaludku, které neustupují. Můžete a nemusíte mít horečku.
- Zlomeniny kostí (kyčle, zápěstí nebo páteře). Zlomeniny kostí v kyčli, zápěstí nebo páteři se mohou objevit u lidí, kteří užívají více denních dávek léků PPI a po dlouhou dobu (rok nebo déle). Informujte svého lékaře, pokud máte zlomeninu kosti, zejména v kyčli, zápěstí nebo páteři.
- Některé typy lupus erythematodes. Lupus erythematodes je autoimunitní porucha (imunitní buňky těla napadají jiné buňky nebo orgány v těle). U některých lidí, kteří užívají léky na PPI, včetně přípravku ACIPHEX, se mohou vyvinout určité typy lupus erythematodes nebo se u nich může zhoršit lupus, který již mají. Okamžitě zavolejte svého lékaře, pokud máte novou nebo zhoršující se bolest kloubů nebo vyrážku na tvářích nebo pažích, která se zhoršuje na slunci.
Poraďte se se svým lékařem o riziku těchto závažných nežádoucích účinků.
ACIPHEX 10 mg může mít další závažné nežádoucí účinky. Viz "Jaké jsou možné vedlejší účinky přípravku ACIPHEX 10 mg?"
Co je ACIPHEX 20 mg?
ACIPHEX 10 mg je lék na předpis nazývaný inhibitor protonové pumpy (PPI).
ACIPHEX 20 mg snižuje množství kyseliny ve vašem žaludku.
U dospělých, ACIPHEX se používá pro:
- 8 týdnů až 16 týdnů k hojení poškození sliznice jícnu souvisejícího s kyselinou (nazývané erozivní ezofagitida nebo EE) a ke zmírnění příznaků, jako je bolest při pálení žáhy.
- udržení hojení jícnu a zmírnění symptomů souvisejících s EE. Není známo, zda je přípravek ACIPHEX 20 mg bezpečný a účinný, pokud je používán déle než 12 měsíců (1 rok).
- až 4 týdny k léčbě denního a nočního pálení žáhy a dalších příznaků, které se vyskytují u gastroezofageální refluxní choroby (GERD).
- až 4 týdny pro hojení a úlevu od příznaků duodenálních vředů.
- 7 dní s určitými antibiotiky k léčbě infekce a žaludečních (duodenálních) vředů způsobených bakterií zvanou H. pylori.
- dlouhodobá léčba stavů, kdy váš žaludek tvoří příliš mnoho kyseliny. To zahrnuje vzácný stav nazývaný Zollinger-Ellisonův syndrom.
U dospívajících ve věku 12 let a starších ACIPHEX 10 mg se používá po dobu až 8 týdnů k léčbě příznaků GERD.
Není známo, zda je ACIPHEX bezpečný a účinný u dětí mladších 12 let pro jiné použití.
Tablety ACIPHEX s opožděným uvolňováním by neměly užívat děti mladší 12 let.
Neužívejte ACIPHEX 10 mg, pokud:
- alergický na rabeprazol, jakýkoli jiný lék PPI nebo na kteroukoli složku přípravku ACIPHEX. Úplný seznam složek najdete na konci této Příručky pro léky.
- užívání léku, který obsahuje rilpivirin (EDURANT, COMPLERA, ODEFSEY) používaný k léčbě HIV-1 (virus lidské imunodeficience).
Než začnete přípravek ACIPHEX užívat, informujte svého lékaře o všech svých zdravotních potížích, včetně toho, zda:
- máte nízké hladiny hořčíku, nízké hladiny vápníku a nízké hladiny draslíku v krvi.
- mít problémy s játry.
- jste těhotná nebo plánujete otěhotnět. Není známo, zda ACIPHEX 20 mg může poškodit vaše nenarozené dítě.
- kojíte nebo plánujete kojit. Není známo, zda ACIPHEX 10 mg přechází do vašeho mateřského mléka. Poraďte se se svým lékařem o nejlepším způsobu krmení dítěte, pokud užíváte ACIPHEX.
Informujte svého lékaře o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků. Hlavně to řekněte svému lékaři jestliže užíváte antibiotikum, které obsahuje klarithromycin nebo amoxicilin nebo jestliže užíváte warfarin (COUMADIN, JANTOVEN), metotrexát (OTREXUP, RASUVO, TREXALL, XATMEP), digoxin (LANOXIN) nebo pilulku na odvodnění (diuretikum).
Jak mám užívat ACIPHEX?
- Užívejte ACIPHEX přesně podle předpisu.
- ACIPHEX se obvykle užívá 1krát denně. Váš lékař vám sdělí denní dobu, kdy máte ACIPHEX užívat, na základě vašeho zdravotního stavu.
- ACIPHEX 10 mg lze užívat s jídlem nebo bez jídla. Váš lékař Vám na základě Vašeho zdravotního stavu sdělí, zda tento lék užívat s jídlem nebo bez jídla.
- Každou tabletu ACIPHEX 20 mg spolkněte celou. Tablety ACIPHEX 10 mg nežvýkejte, nedrťte ani nerozdělujte. Pokud nemůžete tablety spolknout celé, informujte svého lékaře.
- Pokud vynecháte dávku přípravku ACIPHEX 10 mg, vezměte si ji co nejdříve. Pokud je téměř čas na další dávku, neměli byste zapomenutou dávku užít. Další dávku byste měl(a) užít v obvyklou dobu. Neužívejte 2 dávky současně.
- Pokud užijete příliš mnoho přípravku ACIPHEX 20 mg, ihned zavolejte svému lékaři nebo svému toxikologickému centru na číslo 1-800-222-1222 nebo jděte na nejbližší pohotovost.
- Pokud váš lékař předepisuje antibiotika s přípravkem ACIPHEX, přečtěte si informace pro pacienta, které jsou dodávány s antibiotiky, než je začnete užívat.
Jaké jsou možné vedlejší účinky přípravku ACIPHEX 20 mg?
ACIPHEX 10 mg může způsobit závažné nežádoucí účinky, včetně:
- Viz "Jaké jsou nejdůležitější informace, které bych měl vědět o přípravku ACIPHEX 20 mg?"
- Interakce s warfarinem. Užívání warfarinu s lékem PPI může vést ke zvýšenému riziku krvácení a smrti. Pokud užíváte warfarin, lékař vám může zkontrolovat krev, aby zjistil, zda nemáte zvýšené riziko krvácení. Pokud během léčby přípravkem ACIPHEX 20 mg užíváte warfarin, informujte ihned svého lékaře, pokud se u Vás objeví jakékoli známky nebo příznaky krvácení, včetně:
- bolest, otok nebo nepohodlí
- bolesti hlavy, závratě nebo slabost
- neobvyklé modřiny (modřiny, ke kterým dochází bez známé příčiny nebo které se zvětšují)
- krvácení z nosu
- krvácení z dásní
- zastavení krvácení z řezných ran trvá dlouho
- menstruační krvácení, které je silnější než obvykle
- růžová nebo hnědá moč
- červená nebo černá stolice
- vykašlávání krve
- zvracení krve nebo zvratky, které vypadají jako kávová sedlina
- Nízká hladina vitaminu B-12 těle se může objevit u lidí, kteří užívali ACIPHEX 10 mg po dlouhou dobu (více než 3 roky). Informujte svého lékaře, pokud máte příznaky nízké hladiny vitaminu B-12, včetně dušnosti, točení hlavy, nepravidelného srdečního tepu, svalové slabosti, bledé kůže, pocitu únavy, změn nálady a brnění nebo necitlivosti v pažích a nohou.
- Nízká hladina hořčíku v těle může nastat u lidí, kteří užívali ACIPHEX 20 mg po dobu alespoň 3 měsíců. Informujte svého lékaře, pokud máte příznaky nízké hladiny hořčíku, včetně záchvatů, závratí, nepravidelného srdečního tepu, nervozity, bolesti svalů nebo slabosti a křečí rukou, nohou nebo hlasu.
- Výrůstky žaludku (polypy fundické žlázy). Lidé, kteří dlouhodobě užívají léky PPI, mají zvýšené riziko vzniku určitého typu žaludečních výrůstků nazývaných polypy fundických žláz, zejména po užívání léků PPI déle než 1 rok.
- Závažné kožní reakce. ACIPHEX může způsobit vzácné, ale závažné kožní reakce, které mohou postihnout kteroukoli část vašeho těla. Tyto závažné kožní reakce mohou vyžadovat léčbu v nemocnici a mohou být život ohrožující:
- Kožní vyrážka, která může mít puchýře, olupování nebo krvácení na kterékoli části kůže (včetně rtů, očí, úst, nosu, genitálií, rukou nebo nohou).
- Můžete mít také horečku, zimnici, bolesti těla, dušnost nebo zvětšené lymfatické uzliny.
Přestaňte užívat přípravek ACIPHEX 20 mg a ihned kontaktujte svého lékaře. Tyto příznaky mohou být prvním příznakem závažné kožní reakce.
Mezi nejčastější nežádoucí účinky přípravku ACIPHEX 20 mg u dospělých patří: bolest, bolest v krku, plyn, infekce a zácpa.
Mezi nejčastější nežádoucí účinky přípravku ACIPHEX u dospívajících ve věku 12 let a starších patří: bolest hlavy, průjem, nevolnost, zvracení a bolest v oblasti žaludku (břicha).
Toto nejsou všechny možné vedlejší účinky přípravku ACIPHEX. Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám uchovávat ACIPHEX?
Tablety ACIPHEX skladujte na suchém místě při pokojové teplotě mezi 68 °F až 77 °F (20 °C až 25 °C).
ACIPHEX 20 mg a všechny léky uchovávejte mimo dosah dětí.
Obecné informace o bezpečném a efektivním používání přípravku ACIPHEX.
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Nepoužívejte ACIPHEX pro stav, pro který nebyl předepsán. Nedávejte ACIPHEX jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Můžete požádat svého lékaře nebo lékárníka o informace o přípravku ACIPHEX, který je určen pro zdravotníky.
Jaké jsou složky přípravku ACIPHEX 10 mg?
Aktivní složka: sodná sůl rabeprazolu
Neaktivní složky: karnaubský vosk, krospovidon, diacetylované monoglyceridy, ethylcelulóza, hydroxypropylcelulóza, ftalát hypromelózy, stearát hořečnatý, mannitol, hydroxid sodný, stearylfumarát sodný, mastek a oxid titaničitý. Žlutý oxid železitý je barvivem pro potah tablet. Červený oxid železitý je inkoustový pigment.
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv. Upraveno: 03/2022
