Pepcid 20mg, 40mg Famotidine Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Pepcid a jak se používá?
Pepcid (famotidin) se používá k léčbě pálení žáhy, GERD a Zollinger-Ellisonova syndromu. Je volně prodejný. Pepcid 20 mg je dostupný jako generikum.
Jaké jsou možné vedlejší účinky užívání přípravku Pepcid?
Nežádoucí účinky jsou méně časté, ale mohou zahrnovat:
- únava,
- zvracení,
- nevolnost,
- obtíže v oblasti břicha,
- anorexie,
- suchá ústa,
- vyrážka a
- svalové křeče
POPIS
Aktivní složka v PEPCID® (famotidin) je antagonista histaminového H2-receptoru. Famotidin je N'(aminosulfonyl)-3-[[[2-[(diaminomethylen)amino]-4-thiazolyl]methyl]thio]propanimidamid. Empirický vzorec famotidinu je C8H15N7O2S3 a jeho molekulová hmotnost je 337,43. Jeho strukturní vzorec je:
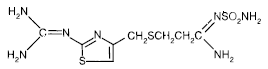
Famotidin je bílá až světle žlutá krystalická sloučenina, která je volně rozpustná v ledové kyselině octové, těžce rozpustná v methanolu, velmi těžce rozpustná ve vodě a prakticky nerozpustná v ethanolu.
Každá tableta pro perorální podání obsahuje buď 20 mg nebo 40 mg famotidinu a následující neaktivní složky: hydroxypropylcelulózu, hypromelózu, oxidy železa, stearát hořečnatý, mikrokrystalickou celulózu, kukuřičný škrob, mastek, oxid titaničitý a karnaubský vosk.
INDIKACE
PEPCID 40 mg je indikován v:
DÁVKOVÁNÍ A PODÁVÁNÍ
Duodenální vřed
Akutní terapie: Doporučená perorální dávka pro dospělé u aktivního duodenálního vředu je 40 mg jednou denně před spaním. Většina pacientů se uzdraví do 4 týdnů; zřídka je důvod používat PEPCID v plné dávce déle než 6 až 8 týdnů. Režim 20 mg dvakrát denně je také účinný.
Udržovací terapie: Doporučená perorální dávka pro dospělé je 20 mg jednou denně před spaním.
Benigní žaludeční vřed
Akutní terapie: Doporučená perorální dávka pro dospělé u aktivního benigního žaludečního vředu je 40 mg jednou denně před spaním.
Refluxní choroba jícnu (GERD)
Doporučená perorální dávka pro léčbu dospělých pacientů s příznaky GERD je 20 mg dvakrát denně po dobu až 6 týdnů. Doporučená perorální dávka pro léčbu dospělých pacientů s ezofagitidou včetně erozí a ulcerací a doprovodných symptomů způsobených GERD je 20 nebo 40 mg dvakrát denně po dobu až 12 týdnů (viz KLINICKÁ FARMAKOLOGIE u dospělých , Klinické studie ).
Dávkování pro pediatrické pacienty
Vidět OPATŘENÍ , Pediatričtí pacienti ve věku
Studie popsané v BEZPEČNOSTNÍ OPATŘENÍ, Pediatričtí pacienti ve věku
Dávkování pro pediatrické pacienty ve věku 1-16 let
Vidět OPATŘENÍ , Pediatričtí pacienti ve věku 1-16 let.
Studie popsané v BEZPEČNOSTNÍ OPATŘENÍ, Pediatričtí pacienti ve věku 1-16 let navrhují následující počáteční dávky u pediatrických pacientů ve věku 1-16 let:
Peptický vřed - 0,5 mg/kg/den po před spaním nebo rozděleně dvakrát denně až do 40 mg/den.
Gastroezofageální refluxní choroba s ezofagitidou nebo bez ní včetně erozí a ulcerací - 1,0 mg/kg/den po dělené bid až do 40 mg bid
Zatímco publikované nekontrolované studie naznačují účinnost famotidinu v léčbě gastroezofageálního refluxu a peptického vředu, údaje u pediatrických pacientů nejsou dostatečné pro stanovení procentuální odpovědi na dávku a délku léčby. Proto by měla být délka léčby (zpočátku na základě doporučení pro dospělé) a dávka individualizovány na základě klinické odpovědi a/nebo stanovení pH (žaludeční nebo jícnové) a endoskopie. Publikované nekontrolované klinické studie u pediatrických pacientů ve věku 1-16 let používaly dávky až 1 mg/kg/den pro peptický vřed a 2 mg/kg/den pro GERD s nebo bez ezofagitidy včetně erozí a ulcerací.
Patologické hypersekreční stavy (např. Zollinger-Ellisonův syndrom, mnohočetné endokrinní adenomy)
Dávkování PEPCID u pacientů s patologickými hypersekrečními stavy se u jednotlivých pacientů liší. Doporučená počáteční perorální dávka pro dospělé u patologických hypersekrečních stavů je 20 mg q 6 h. U některých pacientů může být zapotřebí vyšší počáteční dávka. Dávky by měly být upraveny podle individuálních potřeb pacienta a měly by pokračovat tak dlouho, jak je to klinicky indikováno. Některým dospělým pacientům s těžkým Zollinger-Ellisonovým syndromem byly podávány dávky až 160 mg q 6 h.
Současné užívání antacidů
V případě potřeby mohou být současně podávána antacida.
Úprava dávkování pro pacienty se středně těžkou nebo těžkou renální insuficiencí
dospělých pacientů se středně těžkou (clearance kreatininu
Na základě srovnání farmakokinetických parametrů pro PEPCID u dospělých a pediatrických pacientů je třeba zvážit úpravu dávkování u pediatrických pacientů se středně těžkou nebo těžkou renální insuficiencí.
JAK DODÁVÁNO
PEPCID 40 mg tablety 20 mg, jsou béžové, kulaté, čtvercové, potahované tablety s kódem MSD na jedné straně a hladké na druhé straně. Dodávají se následovně:
NDC 42998-639-09 jednotka použití láhve po 30 NDC 42998-639-98 jednotka použití láhve po 100.
PEPCID 40 mg tablety, 40 mg, jsou hnědé, kulaté, čtvercové, potahované tablety s kódem MSD na jedné straně a hladké na druhé straně. Dodávají se následovně:
NDC 42998-649-09 jednotka použití láhve po 30 NDC 42998-649-98 jednotka použití láhve po 100. Skladování
Skladujte při kontrolované pokojové teplotě.
PEPCID® (famotidin) tablety 20 mg a tablety 40 mg jsou vyráběny pro: Marathon Pharmaceuticals, LLC, Northbrook, IL 60062, USA. Vydáno v únoru 2014.
VEDLEJŠÍ EFEKTY
Nežádoucí účinky uvedené níže byly hlášeny během domácích a mezinárodních klinických studií u přibližně 2500 pacientů. V těchto kontrolovaných klinických studiích, ve kterých byly tablety PEPCID 40 mg srovnávány s placebem, byla incidence nežádoucích účinků ve skupině, která dostávala tablety PEPCID, 40 mg před spaním, podobná jako ve skupině s placebem.
Následující nežádoucí účinky byly hlášeny u více než 1 % pacientů léčených PEPCID v kontrolovaných klinických studiích a mohou být v příčinné souvislosti s lékem: bolest hlavy (4,7 %), závratě (1,3 %), zácpa (1,2 %) ) a průjem (1,7 %).
Následující další nežádoucí účinky byly v klinických studiích nebo od uvedení léku na trh hlášeny zřídka. Vztah k léčbě PEPCID 20 mg byl v mnoha případech nejasný. V každé kategorii jsou nežádoucí účinky uvedeny v pořadí klesající závažnosti:
Tělo jako celek: horečka, astenie, únava
Kardiovaskulární: arytmie, AV blokáda, palpitace. Prodloužený QT interval byl u pacientů s poruchou funkce ledvin hlášen velmi vzácně.
Gastrointestinální: cholestatická žloutenka, hepatitida, abnormality jaterních enzymů, zvracení, nauzea, břišní diskomfort, anorexie, sucho v ústech
Hematologické: vzácné případy agranulocytózy, pancytopenie, leukopenie, trombocytopenie
Přecitlivělost: anafylaxe, angioedém, orbitální nebo obličejový edém, kopřivka, vyrážka, konjunktivální injekce
Muskuloskeletální: rabdomyolýza, muskuloskeletální bolest včetně svalových křečí, artralgie
Nervový systém/psychiatrický: záchvat grand mal; psychické poruchy, které byly reverzibilní v případech, pro které bylo získáno sledování, včetně halucinací, zmatenosti, agitovanosti, deprese, úzkosti, sníženého libida; parestézie; nespavost; spavost. U pacientů s poruchou funkce ledvin byly velmi vzácně hlášeny křeče.
Respirační: bronchospasmus, intersticiální pneumonie
Kůže: toxická epidermální nekrolýza/Stevens-Johnsonův syndrom (velmi vzácné), alopecie, akné, pruritus, suchá kůže, zrudnutí
Speciální smysly: tinnitus, porucha chuti
Jiný: byly hlášeny vzácné případy impotence a vzácné případy gynekomastie; v kontrolovaných klinických studiích však incidence nebyla vyšší než u placeba.
Nežádoucí účinky hlášené u tablet PEPCID se mohou vyskytnout také u PEPCID 20 mg pro perorální suspenzi.
Pediatričtí pacienti
V klinické studii u 35 pediatrických pacientů ve věku
DROGOVÉ INTERAKCE
Nebyly zjištěny žádné lékové interakce. Studie s famotidinem u člověka, na zvířecích modelech a in vitro neprokázaly žádnou významnou interferenci s likvidací sloučenin metabolizovaných jaterními mikrozomálními enzymy, např. systémem cytochromu P450. Mezi sloučeniny testované u člověka patří warfarin, theofylin, fenytoin, diazepam, aminopyrin a antipyrin. Indocyaninová zeleň jako index jaterní extrakce léku byla testována a nebyly zjištěny žádné významné účinky.
VAROVÁNÍ
Nebyly poskytnuty žádné informace
OPATŘENÍ
Všeobecné
Symptomatická odpověď na léčbu PEPCID nevylučuje přítomnost žaludeční malignity.
Pacienti se středně těžkou nebo těžkou renální insuficiencí
Protože nežádoucí účinky na CNS byly hlášeny u pacientů se středně těžkou a těžkou renální insuficiencí, může být nutné použít delší intervaly mezi dávkami nebo nižší dávky u pacientů se středně těžkou (clearance kreatininu KLINICKÁ FARMAKOLOGIE u dospělých a DÁVKOVÁNÍ A PODÁVÁNÍ ). Prodloužení QT intervalu bylo hlášeno velmi vzácně u pacientů s poruchou funkce ledvin, jejichž dávka/dávkovací interval famotidinu nemusel být vhodně upraven.
Karcinogeneze, mutageneze, zhoršení plodnosti
Ve 106týdenní studii na potkanech a 92týdenní studii na myších, kterým byly perorálně podávány dávky až 2 000 mg/kg/den (přibližně 2 500násobek doporučené dávky u lidí při aktivním duodenálním vředu), nebyl prokázán žádný karcinogenní potenciál pro PEPCID.
Famotidin byl negativní v mikrobiálním mutagenním testu (Amesův test) za použití Salmonella typhimurium a Escherichia coli s nebo bez aktivace jaterních enzymů potkana v koncentracích až 10 000 mcg/misku. Ve studiích in vivo na myších s mikronukleárním testem a testem chromozomálních aberací nebyly pozorovány žádné známky mutagenního účinku.
Ve studiích s potkany, kterým byly podávány perorální dávky až 2000 mg/kg/den nebo intravenózní dávky až 200 mg/kg/den, nebyly fertilita a reprodukční schopnosti ovlivněny.

Těhotenství
Těhotenství kategorie B
Reprodukční studie byly provedeny na potkanech a králících při perorálních dávkách až 2000 a 500 mg/kg/den, v daném pořadí, a u obou druhů při intravenózních dávkách až 200 mg/kg/den, a neodhalily žádné významné důkazy zhoršená plodnost nebo poškození plodu v důsledku PEPCID. I když nebyly pozorovány žádné přímé fetotoxické účinky, u některých králíků byly pozorovány sporadické potraty, ke kterým došlo pouze u matek s výrazným sníženým příjmem potravy při perorálních dávkách 200 mg/kg/den (250násobek obvyklé dávky pro člověka) nebo vyšších. Neexistují však žádné adekvátní nebo dobře kontrolované studie u těhotných žen. Vzhledem k tomu, že reprodukční studie na zvířatech nejsou vždy prediktivní pro lidskou odpověď, měl by být tento lék používán během těhotenství pouze tehdy, je-li to nezbytně nutné.
Kojící matky
Studie provedené na kojících potkanech ukázaly, že famotidin se vylučuje do mateřského mléka. Přechodná růstová deprese byla pozorována u mladých potkanů sajících od matek léčených maternotoxickými dávkami alespoň 600násobku obvyklé dávky pro člověka. Famotidin je detekovatelný v lidském mléce. Vzhledem k potenciálu závažných nežádoucích účinků PEPCID u kojených dětí by se mělo rozhodnout, zda přerušit kojení nebo přerušit podávání léku, přičemž je třeba vzít v úvahu důležitost léku pro matku.
Pediatričtí pacienti
Použití PEPCID 20 mg u pediatrických pacientů ve věku
Dvě farmakokinetické studie u pediatrických pacientů ve věku 3 měsíce až 1 rok je podobná jako u starších pediatrických pacientů (1-15 let věku) a dospělých . Naopak u pediatrických pacientů ve věku 0-3 měsíců byly hodnoty clearance famotidinu 2- až 4krát nižší než u starších pediatrických pacientů a dospělých. Tyto studie také ukazují, že průměrná biologická dostupnost u pediatrických pacientů KLINICKÁ FARMAKOLOGIE u dětských pacientů , Farmakokinetika a farmakodynamika .)
Ve dvojitě zaslepené, randomizované studii s vysazením léčby bylo 35 pediatrických pacientů ve věku NEŽÁDOUCÍ REAKCE , Pediatričtí pacienti ).
Tyto studie naznačují, že počáteční dávka 0,5 mg/kg/dávku famotidinu perorální suspenze může být přínosem pro léčbu GERD po dobu až 4 týdnů jednou denně u pacientů ve věku
Pediatričtí pacienti ve věku 1-16 let
Použití PEPCID 40 mg u pediatrických pacientů ve věku 1-16 let je podpořeno důkazy z adekvátních a dobře kontrolovaných studií PEPCID u dospělých a následujícími studiemi u pediatrických pacientů: V publikovaných studiích u malého počtu pediatrických pacientů 1-15 let věku byla clearance famotidinu podobná jako u dospělých. U pediatrických pacientů ve věku 11-15 let byly perorální dávky 0,5 mg/kg spojeny s průměrnou plochou pod křivkou (AUC) podobnou té, která byla pozorována u dospělých léčených perorálně dávkou 40 mg. Podobně u pediatrických pacientů ve věku 1-15 let byly intravenózní dávky 0,5 mg/kg spojeny s průměrnou AUC podobnou té, která byla pozorována u dospělých léčených intravenózně dávkou 40 mg. Omezené publikované studie také naznačují, že vztah mezi sérovou koncentrací a supresí kyseliny je podobný u pediatrických pacientů ve věku 1-15 let ve srovnání s dospělými. Tyto studie navrhují počáteční dávku pro pediatrické pacienty ve věku 1-16 let takto:
Peptický vřed - 0,5 mg/kg/den po před spaním nebo dělená nabídka až 40 mg/den.
Gastroezofageální refluxní choroba s ezofagitidou nebo bez ní včetně erozí a ulcerací - 1,0 mg/kg/den po dělené bid až do 40 mg bid
Zatímco publikované nekontrolované studie naznačují účinnost famotidinu v léčbě gastroezofageálního refluxu a peptického vředu, údaje u pediatrických pacientů nejsou dostatečné pro stanovení procentuální odpovědi na dávku a délku léčby. Proto by měla být délka léčby (zpočátku na základě doporučení pro dospělé) a dávka individualizovány na základě klinické odpovědi a/nebo stanovení pH (žaludeční nebo jícnové) a endoskopie. Publikované nekontrolované klinické studie u pediatrických pacientů používaly dávky až 1 mg/kg/den pro peptický vřed a 2 mg/kg/den pro GERD s nebo bez ezofagitidy včetně erozí a ulcerací.
Geriatrické použití
Ze 4 966 subjektů v klinických studiích, kteří byli léčeni famotidinem, bylo 488 subjektů (9,8 %) ve věku 65 let a starších a 88 subjektů (1,7 %) bylo starších 75 let. Mezi těmito subjekty a mladšími subjekty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti. Nelze však vyloučit větší citlivost některých starších jedinců.
Není nutná žádná úprava dávkování na základě věku (viz KLINICKÁ FARMAKOLOGIE u dospělých , Farmakokinetika ). Je známo, že tento lék je v podstatě vylučován ledvinami a riziko toxických reakcí na tento lék může být větší u pacientů s poruchou funkce ledvin. Vzhledem k tomu, že u starších pacientů je pravděpodobnější snížená funkce ledvin, je třeba věnovat pozornost výběru dávky a může být užitečné sledovat funkci ledvin. Úprava dávkování je nezbytná v případě středně těžké nebo těžké poruchy funkce ledvin (viz OPATŘENÍ , Pacienti se středně těžkou nebo těžkou renální insuficiencí a DÁVKOVÁNÍ A PODÁVÁNÍ , Úprava dávkování u pacientů se středně těžkou nebo těžkou renální insuficiencí ).
PŘEDÁVKOVAT
Nežádoucí účinky v případech předávkování jsou podobné nežádoucím účinkům, které se vyskytují v běžné klinické praxi (viz NEŽÁDOUCÍ REAKCE ). Dospělým pacientům s patologickými hypersekrečními stavy byly podávány perorální dávky až 640 mg/den bez závažných nežádoucích účinků. V případě předávkování by měla být léčba symptomatická a podpůrná. Neabsorbovaný materiál by měl být odstraněn z gastrointestinálního traktu, pacient by měl být monitorován a měla by být použita podpůrná léčba.
Perorální LD50 famotidinu u samců a samic potkanů a myší byla vyšší než 3000 mg/kg a minimální letální akutní perorální dávka u psů přesáhla 2000 mg/kg. Famotidin nevyvolával zjevné účinky při vysokých perorálních dávkách u myší, potkanů, koček a psů, ale vyvolal významnou anorexii a růstovou depresi u králíků počínaje dávkou 200 mg/kg/den perorálně. Intravenózní LD50 famotidinu u myší a potkanů se pohybovala v rozmezí 254-563 mg/kg a minimální letální jednotlivá IV dávka u psů byla přibližně 300 mg/kg. Příznaky akutní intoxikace u psů léčených IV byly zvracení, neklid, bledost sliznic nebo zarudnutí úst a uší, hypotenze, tachykardie a kolaps.
KONTRAINDIKACE
Přecitlivělost na kteroukoli složku těchto produktů. U této třídy sloučenin byla pozorována zkřížená citlivost. PEPCID 40 mg by se proto neměl podávat pacientům s anamnézou přecitlivělosti na jiné antagonisty H2-receptorů.
KLINICKÁ FARMAKOLOGIE
Klinická farmakologie u dospělých
GI efekty
PEPCID je kompetitivní inhibitor histaminových H2-receptorů. Primární klinicky významnou farmakologickou aktivitou PEPCID 40 mg je inhibice žaludeční sekrece. Jak koncentrace kyseliny, tak objem žaludeční sekrece jsou potlačeny PEPCID, zatímco změny v sekreci pepsinu jsou úměrné objemovému výstupu.
U normálních dobrovolníků a hypersekretorů inhiboval PEPCID 20 mg bazální a noční žaludeční sekreci a také sekreci stimulovanou jídlem a pentagastrinem. Po perorálním podání došlo k nástupu antisekrečního účinku do jedné hodiny; maximální účinek byl závislý na dávce a dostavil se během jedné až tří hodin. Doba trvání inhibice sekrece dávkami 20 a 40 mg byla 10 až 12 hodin.
Jednorázové večerní perorální dávky 20 a 40 mg inhibovaly bazální a noční sekreci kyseliny u všech subjektů; průměrná noční sekrece žaludeční kyseliny byla inhibována o 86 % a 94 %, v daném pořadí, po dobu alespoň 10 hodin. Stejné dávky podané ráno u všech subjektů potlačily potravou stimulovanou sekreci kyseliny. Průměrná suprese byla 76 % a 84 % 3 až 5 hodin po podání a 25 % a 30 % 8 až 10 hodin po podání. U některých subjektů, které dostaly dávku 20 mg, však antisekreční účinek zmizel během 6-8 hodin. Při opakovaných dávkách nedošlo ke kumulativnímu účinku. Noční intragastrické pH bylo zvýšeno večerními dávkami 20 a 40 mg PEPCID na průměrné hodnoty 5,0 a 6,4, v daném pořadí. Když byl PEPCID 40 mg podán po snídani, bazální denní interdigestivní pH ve 3 a 8 hodinách po 20 nebo 40 mg PEPCID 40 mg se zvýšilo na přibližně 5.
PEPCID 40 mg měl malý nebo žádný účinek na hladiny gastrinu v séru nalačno nebo po jídle. Vyprazdňování žaludku a exokrinní funkce pankreatu nebyly PEPCID ovlivněny.
Další efekty
Systémové účinky PEPCID na CNS, kardiovaskulární, respirační nebo endokrinní systém nebyly v klinických farmakologických studiích zaznamenány. Rovněž nebyly zaznamenány žádné antiandrogenní účinky. (Vidět NEŽÁDOUCÍ REAKCE .) Hladiny hormonů v séru, včetně prolaktinu, kortizolu, tyroxinu (T4) a testosteronu, se po léčbě PEPCID nezměnily.
Farmakokinetika
PEPCID 20 mg je neúplně absorbován. Biologická dostupnost perorálních dávek je 40–45 %. Biologická dostupnost může být mírně zvýšena jídlem nebo mírně snížena antacidy; tyto účinky však nemají žádný klinický význam. PEPCID podléhá minimálnímu metabolismu prvního průchodu játry. Po perorálním podání se maximální plazmatické hladiny objeví za 1-3 hodiny. Plazmatické hladiny po opakovaných dávkách jsou podobné jako po jednotlivých dávkách. 15 až 20 % PEPCID 20 mg v plazmě se váže na proteiny. PEPCID má eliminační poločas 2,5-3,5 hodiny. PEPCID je eliminován ledvinami (65-70 %) a metabolickými (30-35 %) cestami. Renální clearance je 250-450 ml/min, což ukazuje na určitou tubulární exkreci. 25 až 30 % perorální dávky a 65-70 % intravenózní dávky se objeví v moči jako nezměněná sloučenina. Jediným metabolitem identifikovaným u člověka je S-oxid.
Mezi hodnotami clearance kreatininu a eliminačním poločasem PEPCID existuje úzký vztah. U pacientů s těžkou renální insuficiencí, tj. clearance kreatininu nižší než 10 ml/min, může eliminační poločas PEPCID překročit 20 hodin a může být nutná úprava dávky nebo dávkovacích intervalů u středně těžké a těžké renální insuficience (viz OPATŘENÍ , DÁVKOVÁNÍ A PODÁVÁNÍ ).
U starších pacientů nejsou žádné klinicky významné změny ve farmakokinetice PEPCID související s věkem. U starších pacientů se sníženou funkcí ledvin však může být clearance léčiva snížena (viz OPATŘENÍ , Geriatrické použití ).
Klinické studie
Duodenální vřed
V americké multicentrické, dvojitě zaslepené studii u ambulantních pacientů s endoskopicky potvrzeným duodenálním vředem byl perorálně podávaný PEPCID srovnáván s placebem. Jak je uvedeno v tabulce 1, 70 % pacientů léčených PEPCID 40 mg hs bylo vyléčeno do 4. týdne.
Pacienti, kteří se nezhojili do 4. týdne, pokračovali ve studii. Do 8. týdne se vyléčilo 83 % pacientů léčených PEPCID oproti 45 % pacientů léčených placebem. Výskyt hojení vředů u PEPCID byl významně vyšší než u placeba v každém časovém bodě na základě podílu endoskopicky potvrzených zhojených vředů.
V této studii byla doba do úlevy od denní a noční bolesti významně kratší u pacientů užívajících PEPCID než u pacientů užívajících placebo; pacienti užívající PEPCID také užívali méně antacid než pacienti užívající placebo.
Dlouhodobá udržovací léčba duodenálních vředů
PEPCID 40 mg, 20 mg pohs byl srovnáván s placebem hs jako udržovací terapie ve dvou dvojitě zaslepených, multicentrických studiích pacientů s endoskopicky potvrzeným zhojeným duodenálním vředem. V americké studii byla pozorovaná incidence vředů během 12 měsíců u pacientů léčených placebem 2,4krát vyšší než u pacientů léčených PEPCID. 89 pacientů léčených PEPCID mělo kumulativní pozorovaný výskyt vředů 23,4 % ve srovnání s pozorovaným výskytem vředů 56,6 % u 89 pacientů užívajících placebo (p
Žaludeční vřed
americké i mezinárodní multicentrické, dvojitě zaslepené studii u pacientů s endoskopicky potvrzeným aktivním benigním žaludečním vředem byl perorálně podávaný PEPCID 20 mg, 40 mg hs srovnáván s placebem hs Během studií byla povolena antacida, ale spotřeba se významně nelišila mezi skupinami s PEPCID a placebem. Jak je uvedeno v tabulce 2, výskyt hojení vředů (výpadky počítané jako nezhojené) s PEPCID 20 mg byl statisticky významně lepší než u placeba v týdnech 6 a 8 v americké studii a v týdnech 4, 6 a 8 v mezinárodní studii na základě na počtu vředů, které se zhojily, potvrzené endoskopií.
Doba do úplné úlevy od denní a noční bolesti byla statisticky významně kratší u pacientů užívajících PEPCID 20 mg než u pacientů užívajících placebo; v žádné studii však nebyl statisticky významný rozdíl v podílu pacientů, jejichž bolest byla zmírněna do konce studie (8. týden).
Refluxní choroba jícnu (GERD)
Perorálně podávaný PEPCID byl srovnáván s placebem v americké studii, která zahrnovala pacienty se symptomy GERD a bez endoskopických důkazů eroze nebo ulcerace jícnu. PEPCID 20 mg dvakrát denně byl statisticky významně lepší než 40 mg hs a placebo v poskytování úspěšného symptomatického výsledku, definovaného jako střední nebo vynikající zlepšení symptomů (tabulka 3).
Po dvou týdnech léčby byl symptomatický úspěch pozorován u většího procenta pacientů užívajících PEPCID 20 mg dvakrát denně ve srovnání s placebem (p ≤ 0,01).
Symptomatické zlepšení a hojení endoskopicky ověřené eroze a ulcerace byly studovány ve dvou dalších studiích. Zhojení bylo definováno jako úplné vymizení všech erozí nebo ulcerací viditelných při endoskopii. Americká studie porovnávající PEPCID 40 mg pobid s placebem a PEPCID 20 mg pobid prokázala významně vyšší procento hojení u PEPCID 40 mg dvakrát denně v 6. a 12. týdnu (tabulka 4).
Ve srovnání s placebem měli pacienti, kteří dostávali PEPCID, rychlejší úlevu od denního a nočního pálení žáhy a větší procento pacientů zaznamenalo úplnou úlevu od nočního pálení žáhy. Tyto rozdíly byly statisticky významné.
V mezinárodní studii, kdy byl PEPCID 40 mg pobid srovnáván s ranitidinem 150 mg pobid, bylo pozorováno statisticky významně vyšší procento hojení s PEPCID 40 mg dvakrát denně ve 12. týdnu (tabulka 5). Nebyl však žádný významný rozdíl mezi léčbou v úlevě od symptomů.
Patologické hypersekreční stavy (např. Zollinger-Ellisonův syndrom, mnohočetné endokrinní adenomy)
Ve studiích pacientů s patologickými stavy hypersekrece, jako je Zollingerův-Ellisonův syndrom s mnohočetnými endokrinními adenomy nebo bez nich, PEPCID významně inhiboval sekreci žaludeční kyseliny a kontroloval související příznaky. Orálně podávané dávky od 20 do 160 mg q 6 h udržovaly bazální sekreci kyseliny pod 10 mEq/h; počáteční dávky byly titrovány podle individuální potřeby pacienta a u některých pacientů bylo nutné postupem času upravit. PEPCID 40 mg byl dobře snášen při těchto vysokých dávkách po dlouhou dobu (déle než 12 měsíců) u osmi pacientů a nebyly hlášeny žádné případy gynekomastie, zvýšených hladin prolaktinu nebo impotence, které by byly považovány za důsledek léku.
Klinická farmakologie u dětských pacientů
Farmakokinetika
Tabulka 6 uvádí farmakokinetické údaje z klinických studií a publikované studie u pediatrických pacientů (ve věku
Plazmatická clearance je snížena a poločas eliminace je prodloužen u pediatrických pacientů ve věku 0-3 měsíců ve srovnání se staršími pediatrickými pacienty. Farmakokinetické parametry u pediatrických pacientů ve věku > 3 měsíce až 15 let jsou srovnatelné s parametry získanými u dospělých.
Studie biologické dostupnosti u 8 dětských pacientů (11-15 let) ukázaly průměrnou perorální biologickou dostupnost 0,5 ve srovnání s hodnotami pro dospělé 0,42 až 0,49. Perorálními dávkami 0,5 mg/kg bylo dosaženo AUC 645 ± 249 ng-h/ml a 580 ± 60 ng-h/ml u pediatrických pacientů ve věku
Farmakodynamika
Farmakodynamika famotidinu byla hodnocena u 5 dětských pacientů ve věku 2-13 let pomocí sigmoidálního modelu Emax. Tato data naznačují, že vztah mezi sérovou koncentrací famotidinu a supresí žaludeční kyseliny je podobný tomu, který byl pozorován v jedné studii u dospělých (tabulka 7).
Pět publikovaných studií (tabulka 8) zkoumalo účinek famotidinu na žaludeční pH a trvání suprese kyseliny u dětských pacientů. Zatímco každá studie měla jiný design, údaje o potlačení kyseliny v průběhu času jsou shrnuty takto:
jedné studii bylo prokázáno, že trvání účinku famotidinu IV 0,5 mg/kg na žaludeční pH a supresi kyselosti je delší u pediatrických pacientů ve věku
INFORMACE PRO PACIENTA
Nebyly poskytnuty žádné informace. Podívejte se prosím na OPATŘENÍ sekce.
