Imodium 2mg Loperamide Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Imodium 2 mg a jak se používá?
Imodium 2 mg je lék na předpis používaný k léčbě příznaků akutního průjmu, chronického průjmu a cestovatelského průjmu. Imodium lze užívat samostatně nebo s jinými léky.
Imodium patří do třídy léků nazývaných Antidiarrheals.
Jaké jsou možné vedlejší účinky přípravku Imodium?
Imodium může způsobit závažné nežádoucí účinky, včetně:
- průjem, který je vodnatý nebo krvavý,
- bolest žaludku nebo nadýmání,
- přetrvávající nebo zhoršující se průjem,
- rychlé nebo bušení srdce,
- chvění v tvé hrudi,
- dušnost a
- točení hlavy
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Imodium patří:
- zácpa,
- závrať,
- ospalost,
- nevolnost a
- žaludeční křeče
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Imodium. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
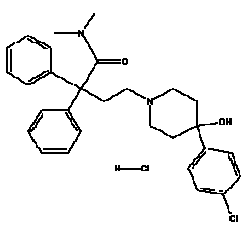
IMODIUM® (loperamid hydrochlorid), 4-(p-chlorfenyl)-4-hydroxy-N,N-dimethyl-a,a-difenyl-1-piperidinbutyramid monohydrochlorid, je syntetické antidiaroikum pro perorální použití.
IMODIUM® (loperamid hcl) je dostupný ve 2mg tobolkách.
Neaktivní složky jsou: laktóza, kukuřičný škrob, mastek a stearát hořečnatý. Kapsle IMODIUM® (loperamid hcl) obsahují FD&C Yellow č. 6.
INDIKACE
IMODIUM® (loperamid hydrochlorid) je indikován ke kontrole a symptomatické úlevě od akutního nespecifického průjmu a chronického průjmu spojeného se zánětlivým onemocněním střev. IMODIUM® (loperamid hcl) je také indikován ke snížení objemu výtoku z ileostomií.
DÁVKOVÁNÍ A PODÁVÁNÍ
(1 kapsle = 2 mg)
Pacienti by měli dostat vhodnou náhradu tekutin a elektrolytů podle potřeby.
Akutní průjem
Dospělí: Doporučená počáteční dávka je 4 mg (dvě tobolky) následovaná 2 mg (jedna tobolka) po každé nezformované stolici. Denní dávka by neměla překročit 16 mg (8 tobolek). Klinické zlepšení je obvykle pozorováno do 48 hodin.
Děti: U dětí ve věku 2 až 5 let (20 kg nebo méně) by se měla používat tekutá formulace bez předpisu (IMODIUM® (loperamid hcl) AD 1 mg/5 ml); pro věk 6 až 12 let lze použít buď IMODIUM® (loperamid hcl) kapsle nebo IMODIUM® (loperamid hcl) AD Liquid. Pro děti ve věku 2 až 12 let obvykle splní požadavky na počáteční dávkování následující schéma pro tobolky nebo tekutinu:
Doporučené dávkovací schéma prvního dne
Dva až pět let: 1 mg třikrát denně (3 mg denní dávka) (13 až 20 kg) Šest až osm let: 2 mg dvakrát denně (4 mg denní dávka) (20 až 30 kg) Osm až dvanáct let: 2 mg třikrát denně (6 mg denní dávka) (více než 30 kg )
Doporučené následné denní dávkování
Po prvním dnu léčby se doporučuje podávat následné dávky IMODIUM® (loperamid hcl) (1 mg/10 kg tělesné hmotnosti) až po řídké stolici. Celková denní dávka by neměla překročit doporučené dávky pro první den.
Chronický průjem
Děti: Ačkoli IMODIUM® (loperamid hcl) byl studován u omezeného počtu dětí s chronickým průjmem; terapeutická dávka pro léčbu chronického průjmu u pediatrické populace nebyla stanovena.
Dospělí: Doporučená počáteční dávka je 4 mg (dvě tobolky) následovaná 2 mg (jedna tobolka) po každé nezformované stolici, dokud není průjem pod kontrolou, poté by měla být dávka přípravku IMODIUM® (loperamid hcl) snížena, aby vyhovovala individuálním požadavkům. Když byla stanovena optimální denní dávka, může být toto množství podáváno jako jediná dávka nebo v rozdělených dávkách.
Průměrná denní udržovací dávka v klinických studiích byla 4 až 8 mg (dvě až čtyři tobolky). Dávka 16 mg (osm tobolek) byla překročena jen zřídka. Pokud není po léčbě dávkou 16 mg denně po dobu alespoň 10 dnů pozorováno klinické zlepšení, je nepravděpodobné, že by symptomy byly dalším podáváním kontrolovány. Podávání přípravku IMODIUM® (loperamid hcl) může pokračovat, pokud nelze průjem adekvátně kontrolovat dietou nebo specifickou léčbou.
Děti do 2 let
Užívání přípravku IMODIUM (loperamid hcl) u dětí do 2 let se nedoporučuje. Vzácně byly hlášeny případy paralytického ileu spojeného s abdominální distenzí. Většina těchto hlášení se vyskytla při akutní úplavici, předávkování au velmi malých dětí mladších dvou let.
Starší
starších subjektů nebyly provedeny žádné formální farmakokinetické studie. U starších pacientů s průjmem však nebyly ve srovnání s mladými pacienty hlášeny žádné velké rozdíly v dispozici léku. U starších osob není nutná úprava dávkování.
Renální poškození
U pacientů s poruchou funkce ledvin nejsou k dispozici žádné farmakokinetické údaje. Vzhledem k tomu, že metabolity a nezměněné léčivo se vylučují převážně stolicí, není u pacientů s poruchou funkce ledvin nutná žádná úprava dávkování (viz sekce BEZPEČNOSTNÍ OPATŘENÍ ).
Poškození jater
Přestože nejsou k dispozici žádné farmakokinetické údaje u pacientů s poruchou funkce jater, IMODIUM (loperamid hcl) by se měl u těchto pacientů používat s opatrností z důvodu sníženého metabolismu prvního průchodu játry. (vidět OPATŘENÍ ).
JAK DODÁVÁNO
Kapsle – každá tobolka obsahuje 2 mg loperamid hydrochloridu. Tobolky mají světle zelené tělo a tmavě zelený uzávěr s potiskem „JANSSEN“ na jednom segmentu a „IMODIUM“ na druhém segmentu. Kapsle IMODIUM® (loperamid hcl) jsou dodávány v lahvičkách po 100.
NDC 50458-400-10.........(100 KAPSLÍ)
Uchovávejte při teplotě 15°-25°C (59°-77°F).
Janssen Pharmaceutica Inc. Revidováno září 1996, červenec 1998. Datum revize FDA: 21. 10. 2005
VEDLEJŠÍ EFEKTY
Údaje z klinických studií
Nežádoucí účinky hlášené během klinických studií IMODIUM® (loperamid hydrochlorid) je obtížné odlišit od příznaků spojených s průjmovým syndromem. Nežádoucí zkušenosti zaznamenané během klinických studií s IMODIUM® (loperamid hcl) byly obecně nezávažné a samoomezující. Častěji byly pozorovány při léčbě chronického průjmu.
Hlášené nežádoucí účinky jsou shrnuty bez ohledu na posouzení kauzality zkoušejícími.
1) Nežádoucí účinky ze 4 placebem kontrolovaných studií u pacientů s akutním průjmem Nežádoucí účinky s incidencí 1,0 % nebo vyšší, které byly hlášeny nejméně tak často u pacientů užívajících loperamid-hydrochlorid jako u pacientů užívajících placebo, jsou uvedeny v tabulce níže.
Nežádoucí účinky s incidencí 1,0 % nebo vyšší, které byly častěji hlášeny u pacientů užívajících placebo než loperamid-hydrochlorid, byly: sucho v ústech, plynatost, břišní křeče a kolika.
2) Nežádoucí účinky z 20 placebem kontrolovaných studií u pacientů s chronickým průjmem
Nežádoucí účinky s incidencí 1,0 % nebo vyšší, které byly hlášeny nejméně stejně často u pacientů užívajících loperamid-hydrochlorid jako u pacientů užívajících placebo, jsou uvedeny níže v tabulce níže.
Nežádoucí účinky s incidencí 1,0 % nebo vyšší, které byly častěji hlášeny u pacientů užívajících placebo než loperamid-hydrochlorid, byly: nauzea, zvracení, bolest hlavy, meteorismus, bolest břicha, křeče v břiše a kolika.
3) Nežádoucí účinky ze sedmdesáti šesti kontrolovaných a nekontrolovaných studií u pacientů s akutním nebo chronickým průjmem
Nežádoucí účinky s incidencí 1,0 % nebo vyšší u pacientů ze všech studií jsou uvedeny v tabulce níže.
Postmarketingové zkušenosti
Byly hlášeny následující nežádoucí účinky:
Poruchy kůže a podkoží
Při užívání přípravku IMODIUM (loperamid hcl) byly hlášeny vyrážky, svědění, kopřivka, angioedém a extrémně vzácné případy bulózní erupce včetně erythema multiforme, Stevens-Johnsonova syndromu a toxické epidermální nekrolýzy.
Poruchy imunitního systému
Při použití přípravku IMODIUM (loperamid hcl) byly hlášeny ojedinělé výskyty alergických reakcí a v některých případech závažné reakce z přecitlivělosti včetně anafylaktického šoku a anafylaktoidních reakcí.

Gastrointestinální poruchy
Sucho v ústech, bolest břicha, distenze nebo diskomfort, nevolnost, zvracení, plynatost, dyspepsie, zácpa, paralytický ileus, megakolon, včetně toxického megakolonu (viz KONTRAINDIKACE a VAROVÁNÍ ).
Poruchy ledvin a močových cest
Zadržování moči
Poruchy nervového systému
Ospalost, závratě
Celkové poruchy a administrativní podmínky v místě
Únava
Řada nežádoucích účinků hlášených během klinických studií a postmarketingových zkušeností s loperamidem jsou častými příznaky základního průjmového syndromu (bolesti břicha/nepohodlí, nauzea, zvracení, sucho v ústech, únava, ospalost, závratě, zácpa a plynatost). . Tyto příznaky je často obtížné odlišit od nežádoucích účinků léků.
Zneužívání drog a závislost
Zneužívání
Specifická klinická studie navržená k posouzení potenciálu zneužití loperamidu ve vysokých dávkách vedla ke zjištění extrémně nízkého potenciálu zneužití.
Závislost
Studie na opicích závislých na morfinu prokázaly, že loperamid-hydrochlorid v dávkách vyšších, než jsou dávky doporučené pro člověka, zabránil známkám abstinenčního syndromu morfinu. U lidí však byl test na naloxonovou provokační zornici, který v případě pozitivního výsledku indikuje účinky podobné opiátům, provedený po jedné vysoké dávce nebo po více než dvou letech terapeutického užívání IMODIUM® (loperamid hydrochlorid), negativní. Orálně podávaný IMODIUM® (loperamid hcl) (loperamid formulovaný se stearátem hořečnatým) je vysoce nerozpustný a špatně proniká do CNS.
DROGOVÉ INTERAKCE
Neklinické údaje ukázaly, že loperamid je substrátem P-glykoproteinu. Současné podávání loperamidu (jednorázová dávka 16 mg) s jednorázovou dávkou 600 mg buď chinidinu nebo ritonaviru, což jsou oba inhibitory glykoproteinu P, vedlo k 2- až 3násobnému zvýšení plazmatických hladin loperamidu. Vzhledem k možnosti zesílených centrálních účinků při současném podávání loperamidu s chinidinem a ritonavirem je třeba opatrnosti při podávání loperamidu v doporučených dávkách (2 mg až do 16 mg maximální denní dávky) s inhibitory P-glykoproteinu.
Pokud je jednorázová dávka 16 mg loperamidu podávána současně s jednorázovou dávkou 600 mg saquinaviru, loperamid snížil expozici saquinaviru o 54 %, což může být klinicky významné z důvodu snížení terapeutické účinnosti saquinaviru. Účinek saquinaviru na loperamid má menší klinický význam. Proto, když je loperamid podáván se saquinavirem, terapeutická účinnost saquinaviru by měla být pečlivě sledována.
VAROVÁNÍ
pacientů, kteří mají průjem, často dochází k vyčerpání tekutin a elektrolytů. V takových případech je velmi důležité podávání vhodných tekutin a elektrolytů. Použití přípravku IMODIUM® (loperamid hcl) nevylučuje potřebu vhodné tekutinové a elektrolytové terapie.
Obecně platí, že IMODIUM (loperamid hcl) by se neměl používat, pokud je třeba se vyhnout inhibici peristaltiky kvůli možnému riziku významných následků včetně ileu, megakolonu a toxického megakolonu. IMODIUM (loperamid hcl) musí být okamžitě vysazen, když se objeví zácpa, abdominální distenze nebo ileus.
Léčba průjmu přípravkem IMODIUM (loperamid hcl) je pouze symptomatická. Kdykoli lze určit základní etiologii, měla by být podána specifická léčba, je-li to vhodné (nebo je-li indikováno).
pacientů s AIDS léčených přípravkem IMODIUM (loperamid hcl) na průjem by měla být léčba ukončena při prvních známkách abdominální distenze. Byly ojedinělé zprávy o toxickém megakolonu u pacientů s AIDS s infekční kolitidou virových i bakteriálních patogenů léčených loperamid-hydrochloridem. {ref EDMS-PSDB-2564186, str. 12}
IMODIUM® (loperamid hcl) by měl být používán se zvláštní opatrností u malých dětí kvůli větší variabilitě odpovědi v této věkové skupině. Dehydratace, zejména u mladších dětí, může dále ovlivnit variabilitu odpovědi na IMODIUM® (loperamid hcl).
OPATŘENÍ
Všeobecné
Byly hlášeny extrémně vzácné alergické reakce včetně anafylaxe a anafylaktického šoku. Pokud při akutním průjmu není pozorováno klinické zlepšení do 48 hodin, podávání přípravku IMODIUM® (loperamid hydrochlorid) by mělo být přerušeno a pacientům by mělo být doporučeno, aby se poradili se svým lékařem. Přestože nejsou k dispozici žádné farmakokinetické údaje u pacientů s poruchou funkce jater, IMODIUM (loperamid hcl) by se měl u těchto pacientů používat s opatrností z důvodu sníženého metabolismu prvního průchodu játry. Pacienti s jaterní dysfunkcí by měli být pečlivě sledováni kvůli známkám toxicity CNS. U pacientů s poruchou funkce ledvin nejsou k dispozici žádné farmakokinetické údaje. Vzhledem k tomu, že bylo hlášeno, že většina léčiva je metabolizována a metabolity nebo nezměněné léčivo se vylučují převážně stolicí, není u pacientů s poruchou funkce ledvin nutná úprava dávkování. Nebyly provedeny žádné formální studie k hodnocení farmakokinetiky loperamidu u starších subjektů. Ve dvou studiích, které zahrnovaly starší pacienty, však nebyly u starších pacientů s průjmem ve srovnání s mladými pacienty žádné velké rozdíly v dispozici léku.
Karcinogeneze, mutageneze, poškození plodnosti
V 18měsíční studii na potkanech s perorálními dávkami až 40 mg/kg/den (21násobek maximální dávky pro člověka 16 mg/den na základě srovnání plochy povrchu těla) nebyly žádné důkazy o karcinogenezi.
Loperamid nebyl genotoxický v Amesově testu, SOS chromotestu u E. coli, dominantním letálním testu u myších samic ani v testu transformace myších embryonálních buněk.
Fertilita a reprodukční výkon byly hodnoceny u potkanů pomocí perorálních dávek 2,5, 10 a 40 mg/kg/den v jedné studii a 1, 5, 10, 20 a 40 mg/kg/den (pouze samice) ve druhé studie. Perorální podávání 20 mg/kg/den (přibližně 11násobek dávky pro člověka na základě srovnání plochy povrchu těla) a vyšší vyvolalo silné poškození ženské plodnosti. Léčba potkaních samic až 10 mg/kg/den po (přibližně 5násobek dávky pro člověka na základě srovnání plochy povrchu těla) neměla žádný vliv na fertilitu. Léčba samců potkanů dávkou 40 mg/kg/den po (přibližně 21násobek dávky pro člověka na základě srovnání plochy povrchu těla) způsobila zhoršení samčí plodnosti, zatímco podávání až 10 mg/kg/den (přibližně 5násobek lidské dávka založená na srovnání plochy povrchu těla) neměl žádný účinek.
Těhotenství
Teratogenní účinky Kategorie těhotenství C
Teratologické studie byly provedeny u potkanů s použitím perorálních dávek 2,5, 10 a 40 mg/kg/den au králíků s použitím perorálních dávek 5, 20 a 40 mg/kg/den. Tyto studie neodhalily žádné známky poškození plodnosti nebo poškození plodu při dávkách až 10 mg/kg/den u potkanů (5násobek dávky pro člověka na základě srovnání plochy povrchu těla) a 40 mg/kg/den u králíků (43 násobek lidské dávky na základě srovnání plochy povrchu těla). Léčba krys 40 mg/kg/den po (21násobek dávky pro člověka na základě srovnání plochy povrchu těla) způsobila výrazné zhoršení plodnosti. Studie neprokázaly teratogenní aktivitu. Neexistují žádné adekvátní a dobře kontrolované studie u těhotných žen. Loperamid by měl být během těhotenství podáván pouze tehdy, pokud potenciální přínos ospravedlňuje potenciální riziko pro plod.
Neteratogenní účinky
V peri- a postnatální reprodukční studii u potkanů způsobilo perorální podávání 40 mg/kg/den zhoršení růstu a přežití potomků.
Kojící matky
Malá množství loperamidu se mohou objevit v lidském mateřském mléce. Proto se IMODIUM (loperamid hcl) během kojení nedoporučuje.
Pediatrické použití
Viz " VAROVÁNÍ Sekce pro informace o větší variabilitě odezvy v této věkové skupině.
V případě náhodného předávkování přípravkem IMODIUM® dětmi, viz " PŘEDÁVKOVÁNÍ Sekce pro doporučenou léčbu.
PŘEDÁVKOVAT
V případech předávkování (včetně relativního předávkování v důsledku jaterní dysfunkce) se může objevit retence moči, paralytický ileus a deprese CNS. Děti mohou být citlivější na účinky na CNS než dospělí. Klinické studie prokázaly, že kaše aktivního uhlí podaná okamžitě po požití loperamid hydrochloridu může snížit množství léčiva, které se absorbuje do systémového oběhu, až devítinásobně. Pokud dojde po požití spontánně ke zvracení, měla by být podána orálně kaše 100 g aktivního uhlí, jakmile je možné zadržet tekutiny.
Pokud nedošlo ke zvracení, měl by být proveden výplach žaludku následovaný podáním 100 g suspenze aktivního uhlí žaludeční sondou. V případě předávkování by pacienti měli být sledováni na známky deprese CNS po dobu nejméně 24 hodin.
Pokud se objeví příznaky předávkování, lze jako protijed podat naloxon. Pokud reaguje na naloxon, musí být pečlivě sledovány vitální funkce, zda se znovu neobjeví příznaky předávkování lékem po dobu nejméně 24 hodin po poslední dávce naloxonu.
Vzhledem k prodlouženému účinku loperamidu a krátkému trvání (jedna až tři hodiny) naloxonu musí být pacient pečlivě sledován a opakovaně léčen naloxonem, jak je indikováno. Vzhledem k tomu, že se močí vylučuje relativně málo léku, neočekává se, že by nucená diuréza byla účinná při předávkování IMODIUM® (loperamid hydrochlorid).
klinických studiích dospělý, který užil tři 20mg dávky během 24 hodin, měl po druhé dávce nevolnost a po třetí dávce zvracel. Ve studiích určených ke zkoumání potenciálních vedlejších účinků nevedlo úmyslné požití až 60 mg loperamid hydrochloridu v jedné dávce zdravým subjektům k žádným významným nežádoucím účinkům.
KONTRAINDIKACE
IMODIUM (loperamid hcl) je kontraindikován u pacientů se známou přecitlivělostí na loperamid-hydrochlorid nebo na kteroukoli pomocnou látku.
IMODIUM (loperamid hcl) je kontraindikován u pacientů s bolestí břicha bez průjmu.
IMODIUM (loperamid hcl) se nedoporučuje u kojenců mladších 24 měsíců.
IMODIUM (loperamid hcl) by se neměl používat jako primární léčba:
- u pacientů s akutní úplavicí, která je charakterizována krví ve stolici a vysokou horečkou,
- u pacientů s akutní ulcerózní kolitidou,
u pacientů s bakteriální enterokolitidou způsobenou invazivními organismy včetně Salmonella, Shigella a Campylobacter,
- u pacientů s pseudomembranózní kolitidou spojenou s užíváním širokospektrých antibiotik.
KLINICKÁ FARMAKOLOGIE
In vitro studie a studie na zvířatech ukazují, že IMODIUM® (loperamid hydrochlorid) působí zpomalením střevní motility a ovlivněním pohybu vody a elektrolytů střevem. Loperamid se váže na opiátový receptor ve střevní stěně. V důsledku toho inhibuje uvolňování acetylcholinu a prostaglandinů, čímž snižuje peristaltiku a prodlužuje dobu průchodu střevem. Loperamid zvyšuje tonus análního svěrače, čímž snižuje inkontinenci a urgenci.
člověka IMODIUM® (loperamid hcl) prodlužuje dobu průchodu střevním obsahem. Snižuje denní objem stolice, zvyšuje viskozitu a objemovou hustotu a snižuje ztráty tekutin a elektrolytů. Tolerance k protiprůjmovému účinku nebyla pozorována. Klinické studie ukázaly, že zdánlivý poločas eliminace loperamidu u člověka je 10,8 hodin s rozmezím 9,1 - 14,4 hodin. Plazmatické hladiny nezměněného léku zůstávají pod 2 nanogramy na ml po požití 2mg tobolky IMODIUM® (loperamid hcl). Plazmatické hladiny jsou nejvyšší přibližně pět hodin po podání tobolky a 2,5 hodiny po podání tekutiny. Maximální plazmatické hladiny loperamidu byly podobné pro obě formulace. K eliminaci loperamidu dochází především oxidativní N-demethylací. Předpokládá se, že izoenzymy cytochromu P450 (CYP450), CYP2C8 a CYP3A4, hrají důležitou roli v procesu N-demethylace loperamidu, protože kvercetin (inhibitor CYP2C8) a ketokonazol (inhibitor CYP3A4) významně inhibovaly proces N-demetylace in vitro o 40 % a 90 %. %, resp. Kromě toho se zdá, že CYP2B6 a CYP2D6 hrají menší roli při N-demethylaci loperamidu. Vylučování nezměněného loperamidu a jeho metabolitů probíhá převážně stolicí. U těch pacientů, u kterých byly během klinických studií sledovány biochemické a hematologické parametry, nebyly během léčby IMODIUM® (loperamid hcl) zaznamenány žádné tendence k abnormalitám. Podobně ani rozbory moči, EKG a klinická oftalmologická vyšetření neprokázaly tendence k abnormalitám.
INFORMACE PRO PACIENTA
Pacientům je třeba doporučit, aby se poradili se svým lékařem, pokud se jejich průjem do 48 hodin nezlepší nebo pokud zaznamenají krev ve stolici, horečku nebo roztažení břicha.
Na pozadí průjmových syndromů léčených přípravkem IMODIUM (loperamid hcl) se může objevit únava, závratě nebo ospalost. Proto je vhodné dbát opatrnosti při řízení auta nebo obsluze strojů. (vidět NEŽÁDOUCÍ REAKCE ).
