Pentasa 400mg Mesalamine Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Pentasa a jak se používá?
Pentasa je lék na předpis používaný k léčbě příznaků ulcerózní kolitidy. Pentasa 400 mg se může užívat samostatně nebo s jinými léky.
Pentasa patří do třídy léků nazývaných deriváty kyseliny 5-aminosalicylové.
Není známo, zda je přípravek Pentasa bezpečný a účinný u dětí starších 5 let.
Jaké jsou možné vedlejší účinky přípravku Pentasa?
Pentasa může způsobit závažné nežádoucí účinky včetně:
- silná bolest žaludku,
- žaludeční křeče,
- krvavý průjem,
- horečka,
- bolest hlavy,
- vyrážka,
- krvavá nebo dehtovitá stolice,
- vykašlávání krve,
- zvratky, které vypadají jako kávová sedlina,
- malé nebo žádné močení,
- bolestivé nebo obtížné močení,
- otoky nohou nebo kotníků,
- pocit únavy nebo dušnosti,
- ztráta chuti k jídlu,
- bolest v horní části žaludku,
- únava,
- snadná tvorba modřin nebo krvácení,
- tmavá moč,
- stolice hliněné barvy, a
- zežloutnutí kůže nebo očí
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Pentasa 400 mg patří:
- nevolnost,
- zvracení,
- bolest břicha,
- průjem,
- špatné trávení,
- plyn,
- bolest hlavy,
- vyrážka a
- abnormální jaterní testy
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky Pentasy. Pro více informací se zeptejte svého lékaře nebo lékárníka.
POPIS
PENTASA (mesalamin) pro perorální podání je přípravek s řízeným uvolňováním mesalaminu, aminosalicylátové protizánětlivé látky pro gastrointestinální použití.
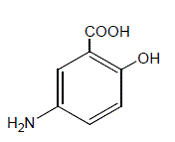
Chemicky je mesalamin 5-amino-2-hydroxybenzoová kyselina. Má molekulovou hmotnost 153,14.
Strukturní vzorec je:
Každá 250mg tobolka obsahuje 250 mg mesalaminu. Obsahuje také následující neaktivní složky: acetylovaný monoglycerid, ricinový olej, koloidní oxid křemičitý, ethylcelulózu, hydroxypropylmethylcelulózu, škrob, kyselinu stearovou, cukr, mastek a bílý vosk. Obal kapsle obsahuje D&C Yellow #10, FD&C Blue #1, FD&C Green #3, želatinu, oxid titaničitý a další složky.
Každá 500 mg tobolka obsahuje 500 mg mesalaminu. Obsahuje také následující neaktivní složky: acetylovaný monoglycerid, ricinový olej, koloidní oxid křemičitý, ethylcelulózu, hydroxypropylmethylcelulózu, škrob, kyselinu stearovou, cukr, mastek a bílý vosk. Obal kapsle obsahuje FD&C Blue #1, želatinu, oxid titaničitý a další složky.
INDIKACE
PENTASA 400 mg je indikována k navození remise ak léčbě dospělých pacientů s mírnou až středně aktivní ulcerózní kolitidou.
DÁVKOVÁNÍ A PODÁVÁNÍ
Doporučená dávka pro navození remise a symptomatickou léčbu mírné až středně aktivní ulcerózní kolitidy u dospělých je 1 g (4 tobolky PENTASA 250 mg nebo 2 tobolky PENTASA 500 mg) 4krát denně v celkové denní dávce 4 G. Délka léčby v kontrolovaných studiích byla až 8 týdnů.
Kapsle PENTASA lze spolknout celé nebo alternativně lze kapsli otevřít a celý obsah nasypat do jablečného pyré nebo jogurtu. Celý obsah by měl být okamžitě spotřebován. Tobolky a obsah tobolek se nesmí drtit ani žvýkat.
Pijte dostatečné množství tekutin.
Bezpečnost a účinnost přípravku PENTASA 400 mg u pediatrických pacientů nebyla stanovena.
JAK DODÁVÁNO
PENTASA 250 mg s prodlouženým uvolňováním tobolky jsou dodávány v lahvičkách po 240 tobolkách ( NDC 54092-189-81). Každá zelená a modrá tobolka obsahuje 250 mg mesalaminu v kuličkách s prodlouženým uvolňováním. Tobolky PENTASA s prodlouženým uvolňováním jsou označeny pětiúhelníkovým logem starburst a číslem 2010 na zelené části a S429 250 mg na modré části tobolky.
PENTASA 500 mg s prodlouženým uvolňováním tobolky jsou dodávány v lahvičkách po 120 tobolkách ( NDC 54092-191-12). Každá modrá tobolka obsahuje 500 mg mesalaminu v kuličkách s prodlouženým uvolňováním. PENTASA 400 mg tobolky s prodlouženým uvolňováním jsou označeny pětiúhelníkovým logem starburst a S429 500 mg na tobolkách.
Skladujte při teplotě 25 °C (77 °F); povolené výchylky do 15 °C až 30 °C (59 °F až 86 °F) [viz USP Controlled Room Temperature].
Chcete-li nahlásit PODEZŘELNÉ NEŽÁDOUCÍ REAKCE, kontaktujte společnost Takeda Pharmaceuticals na čísle 1800-828-2088 nebo FDA na čísle 1-800-FDA-1088 nebo www.fda.gov/medwatch.
Distribuce: Takeda Pharmaceuticals America, Inc. Lexington, MA 02421, USA. Upraveno: listopad 2021
VEDLEJŠÍ EFEKTY
V kombinovaných domácích a zahraničních klinických studiích dostalo terapii PENTASA více než 2100 pacientů s ulcerózní kolitidou nebo Crohnovou chorobou. Obecně byla terapie PENTASOU dobře tolerována. Nejčastějšími příhodami (tj. větší nebo rovné 1 %) byly průjem (3,4 %), bolest hlavy (2,0 %), nauzea (1,8 %), bolest břicha (1,7 %), dyspepsie (1,6 %), zvracení (1,5 %) %) a vyrážka (1,0 %).
Ve dvou domácích placebem kontrolovaných studiích zahrnujících více než 600 pacientů s ulcerózní kolitidou bylo nežádoucích účinků méně u pacientů léčených PENTASOU (mesalamin) než ve skupině s placebem (PENTASA 14 % vs. placebo 18 %) a nebyly závislé na dávce. Události vyskytující se ve více než 1 % jsou uvedeny v tabulce níže. Z toho pouze nauzea a zvracení byly častější ve skupině PENTASA. Ukončení léčby z důvodu nežádoucích účinků bylo častější u placeba než u PENTASY (7 % vs. 4 %).
Klinická laboratorní měření neukázala žádné významné abnormální trendy u žádného testu, včetně měření hematologické, jaterní a ledvinové funkce.
Následující nežádoucí účinky, prezentované tělesným systémem, byly hlášeny zřídka (tj. méně než 1 %) během domácích studií ulcerózní kolitidy a Crohnovy choroby. V mnoha případech nebyl vztah s PENTASOU prokázán.
Gastrointestinální: abdominální distenze, anorexie, zácpa, duodenální vřed, dysfagie, říhání, jícnový vřed, fekální inkontinence, zvýšení GGTP, GI krvácení, zvýšení alkalické fosfatázy, zvýšení LDH, vřed v ústech, orální moniliáza, pankreatitida, krvácení z konečníku, zvýšení SGOT, zvýšení SGPT, abnormality stolice (změna barvy nebo struktury), žízeň
Dermatologické: akné, alopecie, suchá kůže, ekzém, erythema nodosum, porucha nehtů, fotosenzitivita, pruritus, pocení, kopřivka
Nervový systém: deprese, závratě, nespavost, somnolence, parestézie
Kardiovaskulární: palpitace, perikarditida, vazodilatace
Jiný: albuminurie, amenorea, zvýšení amylázy, artralgie, astenie, bolest prsů, konjunktivitida, ekchymóza, edém, horečka, hematurie, hypomenorea, Kawasakiho syndrom, křeče v nohách, lichen planus, zvýšení lipázy, malátnost, menoragie, metroragie, mykokardie , trombocytémie, trombocytopenie, frekvence močení
Týden po dokončení 8týdenní studie ulcerózní kolitidy se u 72letého muže bez předchozí anamnézy plicních problémů rozvinula dušnost. U pacienta byla následně jedním lékařem diagnostikována intersticiální plicní fibróza bez eozinofilie a druhým lékařem bronchiolitis obliterans s organizující se pneumonitidou. Příčinný vztah mezi touto příhodou a léčbou mesalaminem nebyl stanoven.
Publikované kazuistiky a/nebo spontánní postmarketingové sledování popsaly vzácné případy perikarditidy, fatální myokarditidy, bolesti na hrudi a abnormalit T-vlny, hypersenzitivní pneumonitidy, pankreatitidy, nefrotického syndromu, intersticiální nefritidy, hepatitidy, aplastické anémie, pancytopenie, leukopenie, agranulocytózy, popř. anémie při léčbě mesalaminem. Anémie může být součástí klinického obrazu zánětlivého onemocnění střev. Alergické reakce, které by mohly zahrnovat eozinofilii, lze pozorovat v souvislosti s léčbou PENTASOU 400 mg.
Postmarketingové zprávy
Během poregistračního používání mesalaminu značky PENTASA v klinické praxi byly zjištěny následující události. Protože jsou hlášeny dobrovolně z populace neznámé velikosti, nelze provést odhad frekvence. Tyto příhody byly vybrány pro zahrnutí kvůli kombinaci závažnosti, četnosti hlášení nebo potenciální kauzální souvislosti s mesalaminem:
Gastrointestinální: Hlášení hepatotoxicity, včetně zvýšených jaterních enzymů (SGOT/AST, SGPT/ALT, GGT, LDH, alkalická fosfatáza, bilirubin), hepatitidy, žloutenky, cholestatické žloutenky, cirhózy a možného hepatocelulárního poškození včetně nekrózy jater a selhání jater. Některé z těchto případů byly smrtelné. Byl také hlášen jeden případ Kawasakiho syndromu, který zahrnoval změny jaterních funkcí.
Jiný: anafylaktická reakce, SJS/TEN, DRESS, AGEP, zánět pohrudnice/pleuritida, pneumonitida, granulocytopenie, systémový lupus erythematodes, lupus-like syndrom, akutní selhání ledvin, intersticiální plicní choroba, hypersenzitivní pneumonitida (včetně intersticiální pneumonitidy, alergické alveolitidy, eozinofilní pneumonie), chronické selhání ledvin, nefrogenní diabetes insipidus, nefrolitiáza, intrakraniální hypertenze, angioedém a oligospermie (reverzibilní).
DROGOVÉ INTERAKCE
Nebyly provedeny žádné studie interakcí mezi PENTASOU 400 mg a jinými léky; u produktů obsahujících mesalamin však byly hlášeny následující lékové interakce:
Nefrotoxické látky, včetně nesteroidních protizánětlivých léků
Současné užívání mesalaminu se známými nefrotoxickými látkami, včetně nesteroidních protizánětlivých léků (NSAID), může zvýšit riziko nefrotoxicity. U pacientů užívajících nefrotoxické léky sledujte změny renálních funkcí a nežádoucí účinky související s mesalaminem.

Azathioprin nebo 6-merkaptopurin
Současné užívání mesalaminu s azathioprinem nebo 6-merkaptopurinem a/nebo jinými léky, o kterých je známo, že způsobují myelotoxicitu, může zvýšit riziko krevních poruch, selhání kostní dřeně a souvisejících komplikací. Pokud se nelze vyhnout současnému užívání přípravku PENTASA a azathioprinu nebo 6-merkaptopurinu, sledujte krevní testy, včetně kompletního krevního obrazu a počtu krevních destiček.
VAROVÁNÍ
Nebyly poskytnuty žádné informace
OPATŘENÍ
Renální poškození
Poškození ledvin, včetně onemocnění s minimálními změnami, akutní a chronické intersticiální nefritidy a selhání ledvin byly hlášeny u pacientů, kterým byla podávána PENTASA nebo jiné produkty, které obsahují mesalamin nebo jsou na mesalamin převedeny.
Je známo, že mesalamin je v podstatě vylučován ledvinami a riziko nežádoucích účinků může být vyšší u pacientů s poruchou funkce ledvin. U všech pacientů před zahájením a pravidelně během léčby přípravkem PENTASA vyhodnoťte renální funkce. Zhodnoťte rizika a přínosy používání přípravku PENTASA u pacientů se známou poruchou funkce ledvin nebo s anamnézou onemocnění ledvin nebo užívajících současně nefrotoxické léky.
Syndrom akutní intolerance vyvolaný mesalaminem
Mesalamin je spojován se syndromem akutní intolerance, který může být obtížné odlišit od vzplanutí zánětlivého onemocnění střev. Příznaky zahrnují křeče, akutní bolest břicha, krvavý průjem a někdy horečku, bolest hlavy a vyrážku. Sledujte pacienty, zda se tyto příznaky během léčby nezhorší. Při podezření na syndrom akutní intolerance okamžitě přerušte léčbu přípravkem PENTASA.
Hypersenzitivní reakce
pacientů užívajících sulfasalazin byly hlášeny hypersenzitivní reakce. Někteří pacienti mohou mít podobnou reakci na PENTASU nebo na jiné sloučeniny, které obsahují mesalamin nebo jsou na něj přeměněny.
Stejně jako u sulfasalazinu se hypersenzitivní reakce vyvolané mesalaminem mohou projevit jako postižení vnitřních orgánů, včetně myokarditidy, perikarditidy, nefritidy, hepatitidy, pneumonitidy a hematologických abnormalit. Okamžitě vyhodnoťte pacienty, pokud jsou přítomny známky nebo příznaky reakce přecitlivělosti. Pokud nelze zjistit alternativní etiologii známek a symptomů, přerušte léčbu přípravkem PENTASA.
Jaterní selhání
U pacientů s již existujícím onemocněním jater, kterým byly podávány jiné přípravky obsahující mesalamin, byly hlášeny případy selhání jater. Zhodnoťte rizika a přínosy užívání přípravku PENTASA 400 mg u pacientů se známou poruchou funkce jater.
Závažné kožní nežádoucí reakce
Při užívání mesalaminu byly hlášeny závažné kožní nežádoucí reakce, jako je Stevens-Johnsonův syndrom (SJS) a toxická epidermální nekrolýza (TEN), léková reakce s eozinofilií a systémovými příznaky (DRESS) a akutní generalizovaná exantematózní pustulóza (AGEP). (vidět NEŽÁDOUCÍ REAKCE ). Při prvních známkách nebo příznacích závažných kožních nežádoucích reakcí nebo jiných příznaků přecitlivělosti přerušte léčbu přípravkem PENTASA a zvažte další vyšetření.
Fotosenzitivita
Pacienti s již existujícími kožními onemocněními, jako je atopická dermatitida a atopický ekzém, hlásili závažnější fotosenzitivní reakce. Doporučte pacientům, aby se vyhýbali slunci, nosili ochranný oděv a při pobytu venku používali širokospektrální opalovací krém.
Nefrolitiáza
Při užívání mesalaminu byly hlášeny případy nefrolitiázy, včetně kamenů se 100% obsahem mesalaminu. Kameny obsahující mesalamin jsou radiotransparentní a nedetekovatelné standardní radiografií nebo počítačovou tomografií (CT). Během léčby zajistěte dostatečnou hydrataci.
Interference S Laboratorními Testy
Použití mesalaminu může vést k falešně zvýšeným výsledkům testů při měření normetanefrinu v moči kapalinovou chromatografií s elektrochemickou detekcí kvůli podobnosti chromatogramů normetanefrinu a hlavního metabolitu mesalaminu, kyseliny N-acetyl-5-aminosalicylové (N-Ac-5-ASA ). Zvažte alternativní, selektivní test na normetanefrin.
Karcinogeneze, mutageneze, zhoršení plodnosti
Ve 104týdenní dietní studii karcinogenity mesalaminu byly myši CD-1 léčeny dávkami až 2500 mg/kg/den a nebyl tumorigenní. Pro osobu s průměrnou výškou 50 kg (1,46 m2 tělesného povrchu) to představuje 2,5násobek doporučené dávky pro člověka na základě tělesného povrchu (2960 mg/m2/den). Ve 104týdenní studii karcinogenity v dietě u potkanů Wistar nebyl mesalamin až do dávky 800 mg/kg/den tumorigenní. Tato dávka představuje 1,5násobek doporučené dávky pro člověka na základě tělesného povrchu.
Amesově testu in vitro a v mikronukleárním testu in vivo u myší nebyly pozorovány žádné známky mutagenity.
Při perorálních dávkách mesalaminu až do 400 mg/kg/den (0,8násobek doporučené dávky pro člověka na základě tělesného povrchu) nebyly u samců nebo samic potkanů pozorovány žádné účinky na fertilitu nebo reprodukční schopnost.
Abnormality spermatu a neplodnost u mužů, které byly hlášeny v souvislosti se sulfasalazinem, nebyly u přípravku PENTASA 400 mg tobolky během kontrolovaných klinických studií pozorovány.
Těhotenství
Teratogenní účinky
Publikované údaje z metaanalýz, kohortových studií a kazuistik o užívání mesalaminu během těhotenství spolehlivě neinformovaly o souvislosti s mesalaminem a závažnými vrozenými vadami, potratem nebo nepříznivými výsledky u matky nebo plodu. Neexistují žádné jasné důkazy, že expozice mesalaminu v časném těhotenství je spojena se zvýšeným rizikem závažných vrozených malformací, včetně srdečních malformací. Publikované epidemiologické studie mají důležitá metodologická omezení, která brání interpretaci údajů, včetně neschopnosti kontrolovat zmatky, jako je základní onemocnění matek, užívání souběžných léků matkami a chybějící informace o dávce a délce užívání mesalaminových produktů. PENTASA by se měla během těhotenství používat pouze v případě, že přínosy převažují nad riziky.
reprodukčních studiích na zvířatech neodhalilo perorální podávání mesalaminu během organogeneze březím potkanům v dávkách až 1000 mg/kg/den (5900 mg/m²) a králíkům v dávkách 800 mg/kg/den (6856 mg/m²) žádné důkazy teratogenních účinků nebo poškození plodu v důsledku mesalaminu.
Odhadované základní riziko závažných vrozených vad a potratu pro uvedené populace není známo. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratů u klinicky uznaných těhotenství 2 % až 4 % a 15 % až 20 %.
Neteratogenní účinky
Publikované údaje naznačují, že zvýšená aktivita onemocnění je spojena s rizikem rozvoje nepříznivých výsledků těhotenství u žen s ulcerózní kolitidou. Mezi nepříznivé důsledky těhotenství patří předčasný porod (před 37. týdnem těhotenství), kojenci s nízkou porodní hmotností (méně než 2 500 g) a malé vzhledem ke gestačnímu věku při narození.
Kojící matky
Údaje z publikované literatury uvádějí přítomnost mesalaminu a jeho metabolitu, kyseliny N-acetyl-5-aminosalicylové, v mateřském mléce v malých množstvích s relativními kojeneckými dávkami (RID) 0,1 % nebo méně pro mesalamin. Klinický význam toho nebyl stanoven a existují omezené zkušenosti s kojícími ženami užívajícími mesalamin.
Existují zprávy o průjmu pozorovaném u kojených dětí vystavených mesalaminu. Vliv PENTASY 400 mg na tvorbu mléka není znám. Buďte opatrní, pokud je PENTASA 400 mg podávána kojící ženě a sledujte kojené děti, zda nemají průjem.
publikovaných laktačních studiích se dávky mesalaminu pro matku z různých perorálních a rektálních formulací a produktů pohybovaly od 500 mg do 4,8 g denně. Průměrná koncentrace mesalaminu v mléce se pohybovala od nedetekovatelné do 0,5 mg/l. Průměrná koncentrace kyseliny N-acetyl-5-aminosalicylové v mléce se pohybovala od 0,2 do 9,3 mg/l. Na základě těchto koncentrací jsou odhadované kojenecké denní dávky pro výlučně kojené dítě 0 až 0,075 mg/kg/den mesalaminu (RID 0 % až 0,1 %) a 0,03 až 1,4 mg/kg/den N-acetyl-5-aminosalicylové kyseliny kyselina.
Pediatrické použití
Bezpečnost a účinnost přípravku PENTASA u pediatrických pacientů nebyla stanovena.
Geriatrické použití
Klinické studie přípravku PENTASA 400 mg nezahrnovaly dostatečný počet pacientů ve věku 65 let a více, aby bylo možné určit, zda reagují odlišně od mladších pacientů. Zprávy z nekontrolovaných klinických studií a postmarketingové systémy hlášení naznačovaly vyšší výskyt krevních dyskrazií (tj. agranulocytózy, neutropenie a pancytopenie) u pacientů užívajících přípravky obsahující mesalamin, jako je PENTASA 400 mg, kteří byli ve věku 65 let nebo starší, ve srovnání s mladšími pacienty. Během léčby přípravkem PENTASA sledujte u starších pacientů kompletní počet krvinek a krevních destiček.
Při předepisování přípravku PENTASA obecně berte v úvahu vyšší frekvenci snížené funkce jater, ledvin nebo srdce a souběžného onemocnění nebo jiné farmakoterapie u starších pacientů.
PŘEDÁVKOVAT
PENTASA 400 mg je aminosalicylát a mohou se objevit příznaky toxicity salicylátu, jako jsou: nevolnost, zvracení, bolest břicha, tachypnoe, hyperpnoe, tinitus a neurologické příznaky (bolesti hlavy, závratě, zmatenost, křeče). Těžká intoxikace salicyláty může vést k nerovnováze pH elektrolytů a krve a potenciálně k poškození dalších orgánů (např. ledvin a jater).
Léčba Předávkování
Neexistuje žádné specifické antidotum pro předávkování mesalaminem; nicméně konvenční terapie toxicity salicylátů může být prospěšná v případě akutního předávkování a může zahrnovat dekontaminaci gastrointestinálního traktu, aby se zabránilo další absorpci. Upravte nerovnováhu tekutin a elektrolytů podáním vhodné intravenózní terapie a udržujte adekvátní renální funkce.
KONTRAINDIKACE
PENTASA je kontraindikována u pacientů se známou nebo suspektní přecitlivělostí na salicyláty, aminosalicyláty nebo jakoukoli složku tohoto léku.
KLINICKÁ FARMAKOLOGIE
Sulfasalazin se štěpí působením bakterií v tlustém střevě na sulfapyridin (SP) a mesalamin (5-ASA). Obvyklá perorální dávka sulfasalazinu pro aktivní ulcerózní kolitidu u dospělých je 2 až 4 g denně v rozdělených dávkách. Čtyři gramy sulfasalazinu poskytují 1,6 g volného mesalaminu do tlustého střeva.
Mechanismus účinku mesalaminu (a sulfasalazinu) není zcela objasněn, ale zdá se, že jde o lokální protizánětlivý účinek na epiteliální buňky tlustého střeva. Slizniční produkce metabolitů kyseliny arachidonové (AA), a to jak cestou cyklooxygenázy (tj. prostanoidy), tak cestou lipoxygenázy (tj. leukotrieny (LT) a kyseliny hydroxyeikosatetraenové (HETE), je u pacientů s ulcerózní kolitidou zvýšena a je Je možné, že mesalamin zmírňuje zánět blokováním cyklooxygenázy a inhibicí produkce prostaglandinu (PG) v tlustém střevě.
Lidská farmakokinetika a metabolismus
Vstřebávání
PENTASA je ethylcelulózou potažená formulace mesalaminu s prodlouženým uvolňováním navržená tak, aby uvolňovala terapeutické množství mesalaminu v celém gastrointestinálním traktu. Na základě údajů o vylučování močí je absorbováno 20 % až 30 % mesalaminu v přípravku PENTASA. Na rozdíl od toho, když je mesalamin podáván orálně jako neformulovaná 1 g vodná suspenze, mesalamin je absorbován přibližně z 80 %.
Plazmatická koncentrace mesalaminu dosáhla vrcholu přibližně 1 mcg/ml 3 hodiny po dávce 1 g PENTASY a klesala dvoufázovým způsobem. Literatura popisuje průměrný terminální poločas mesalaminu po intravenózním podání 42 minut. Vzhledem k kontinuálnímu uvolňování a absorpci mesalaminu z PENTASY v gastrointestinálním traktu nelze po perorálním podání stanovit skutečný poločas eliminace. Kyselina N-acetyl-5-aminosalicylová, hlavní metabolit mesalaminu (kyselina 5-aminosalicylová), dosáhla vrcholu přibližně za 3 hodiny při 1,8 mcg/ml a její koncentrace následovala po dvoufázovém poklesu. Farmakologické aktivity kyseliny N-acetyl-5-aminosalicylové nejsou známy a další metabolity nebyly identifikovány.
Farmakokinetika perorálního mesalaminu byla nelineární, když byly tobolky PENTASA dávkovány od 250 mg do 1 g čtyřikrát denně, přičemž plazmatické koncentrace mesalaminu v ustáleném stavu se zvýšily asi devětkrát, z 0,14 mcg/ml na 1,21 mcg/ml, což naznačuje saturovatelný metabolismus prvního průchodu játry. Farmakokinetika N-acetyl-5-aminosalicylové kyseliny byla lineární.
Odstranění
Asi 130 mg volného mesalaminu bylo získáno ve stolici po jedné dávce 1 g PENTASA 400 mg, což bylo srovnatelné se 140 mg mesalaminu získaného z molární ekvivalentní dávky 2,5 g tablety sulfasalazinu. Eliminace volného mesalaminu a salicylátů ve stolici se úměrně zvýšila s dávkou PENTASY. Kyselina N-acetyl-5-aminosalicylová byla primární sloučeninou vylučovanou močí (19 % až 30 %) po dávce PENTASY 400 mg.
Klinické testy
Ve dvou randomizovaných, dvojitě zaslepených, placebem kontrolovaných studiích závislosti odpovědi na dávce (UC-1 a UC-2) u 625 pacientů s aktivní mírnou až středně těžkou ulcerózní kolitidou, PENTASA 400 mg v perorální dávce 4 g/den podávaná 1 g čtyřikrát denně vedlo ke konzistentnímu zlepšení v prospektivně identifikovaných parametrech primární účinnosti, PGA, Tx F a SI, jak je uvedeno v tabulce níže.
Dávka 4 g PENTASY také poskytla konzistentní zlepšení sekundárních parametrů účinnosti, jmenovitě frekvence návštěv na toaletu, konzistence stolice, rektální krvácení, bolesti břicha/rekta a urgence. Dávka 4 g PENTASY vyvolala remisi hodnocenou endoskopickými a symptomatickými koncovými body.
U některých pacientů bylo pozorováno, že dávka 2 g PENTASY 400 mg zlepšila měřené parametry účinnosti. Nicméně dávka 2 g poskytla nekonzistentní výsledky v parametrech primární účinnosti ve dvou adekvátních a dobře kontrolovaných studiích.
INFORMACE PRO PACIENTA
Nebyly poskytnuty žádné informace. Podívejte se prosím na OPATŘENÍ sekce.
