Protonix 20mg, 40mg Pantoprazole Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Protonix 40 mg a jak se používá?
Protonix 40 mg je lék na předpis používaný k léčbě příznaků ezofagitidy způsobené žaludeční kyselinou v důsledku gastroezofageálního refluxu nebo GERD a Zollinger-Ellisonova syndromu nebo jiných stavů způsobujících nadměrnou žaludeční kyselinu. Protonix 40 mg lze užívat samostatně nebo s jinými léky.
Protonix patří do třídy léků nazývaných inhibitory protonové pumpy (PPI).
Není známo, zda je Protonix bezpečný a účinný u dětí mladších 5 let.
Jaké jsou možné vedlejší účinky Protonixu?
Protonix může způsobit závažné nežádoucí účinky, včetně:
- silná bolest žaludku,
- průjem, který je vodnatý nebo obsahuje krev,
- náhlá bolest nebo potíže s pohybem kyčle, zápěstí nebo zad,
- modřiny nebo otoky v místě vpichu,
- malé nebo žádné močení,
- krev v moči,
- otok,
- rychlý nárůst hmotnosti,
- závrať,
- rychlý nebo nepravidelný srdeční tep,
- třes (třes) nebo trhavé pohyby,
- pocit nervozity,
- svalové křeče nebo křeče v rukou nebo nohou,
- kašel,
- pocit dušení,
- bolesti kloubů a
- kožní vyrážka na tvářích nebo pažích, která se zhoršuje v noci
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky Protonixu patří:
- bolest hlavy,
- závrať,
- bolest břicha,
- plyn,
- nevolnost,
- zvracení,
- průjem,
- bolest kloubů,
- horečka,
- vyrážka a
- příznaky nachlazení (nejčastější u dětí)
Informujte svého lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Prometrium. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
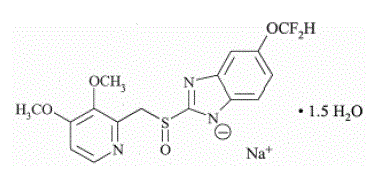
Aktivní složka přípravku PROTONIX (pantoprazol sodný) pro perorální suspenzi s opožděným uvolňováním a PROTONIX (pantoprazol sodný) tablety s opožděným uvolňováním, PPI, je substituovaný benzimidazol, sodná sůl 5-(difluormethoxy)-2-[[(3,4- dimethoxy-2-pyridinyl)methyl]sulfinyl]-lH-benzimidazol seskvihydrát, sloučenina, která inhibuje sekreci žaludeční kyseliny. Jeho empirický vzorec je C16H14F2N3NaO4S x 1,5 H2O, s molekulovou hmotností 432,4. Strukturní vzorec je:
Seskvihydrát sodné soli pantoprazolu je bílý až téměř bílý krystalický prášek a je racemický. Pantoprazol má slabě zásadité a kyselé vlastnosti. Seskvihydrát sodné soli pantoprazolu je volně rozpustný ve vodě, velmi málo rozpustný ve fosfátovém pufru při pH 7,4 a prakticky nerozpustný v n-hexanu.
Stabilita sloučeniny ve vodném roztoku je závislá na pH. Rychlost degradace se zvyšuje s klesajícím pH. Při teplotě okolí je poločas rozkladu přibližně 2,8 hodiny při pH 5 a přibližně 220 hodin při pH 7,8.
PROTONIX 40 mg se dodává jako perorální suspenze s opožděným uvolňováním v jednodávkových baleních, k dispozici v jedné síle (40 mg) pantoprazolu (odpovídá 45,1 mg sodné soli pantoprazolu) a jako tableta s opožděným uvolňováním, k dispozici ve dvou silách 20 mg pantoprazolu (odpovídá 22,56 mg sodné soli pantoprazolu) a 40 mg pantoprazolu (odpovídá 45,1 mg sodné soli pantoprazolu).
Tablety PROTONIX s opožděným uvolňováním obsahují následující neúčinné složky: stearát vápenatý, krospovidon, hypromelóza, oxid železitý, mannitol, kopolymer kyseliny methakrylové, polysorbát 80, povidon, propylenglykol, uhličitan sodný, laurylsulfát sodný, oxid titaničitý a triethylcitrát. Tablety s opožděným uvolňováním PROTONIX (40 mg a 20 mg) vyhovují testu rozpouštění podle USP 2.
PROTONIX 40 mg perorální suspenze s opožděným uvolňováním obsahuje následující neúčinné složky: krospovidon, hypromelózu, kopolymer kyseliny methakrylové, mikrokrystalickou celulózu, polysorbát 80, povidon, uhličitan sodný, laurylsulfát sodný, mastek, oxid titaničitý, triethyloxid železitý a žlutý oxid železitý.
INDIKACE
PROTONIX pro perorální suspenzi s opožděným uvolňováním a tablety PROTONIX 40 mg s opožděným uvolňováním jsou určeny pro:
Krátkodobá léčba erozivní ezofagitidy spojené s gastroezofageální refluxní chorobou (GERD)
PROTONIX 20 mg je indikován u dospělých a dětských pacientů ve věku pěti let a starších ke krátkodobé léčbě (do 8 týdnů) při hojení a symptomatické úlevě od erozivní ezofagitidy (EE). U těch dospělých pacientů, kteří se nezhojili po 8 týdnech léčby, lze zvážit další 8týdenní léčbu přípravkem PROTONIX. Bezpečnost léčby delší než 8 týdnů u pediatrických pacientů nebyla stanovena.
Udržování hojení Erozivní Ezofagitidy
PROTONIX je indikován k udržení hojení EE a snížení četnosti relapsů denních a nočních symptomů pálení žáhy u dospělých pacientů s GERD. Kontrolované studie nepřesáhly 12 měsíců.
Patologické hypersekreční stavy včetně Zollinger-Ellisonova syndromu
PROTONIX 20 mg je indikován k dlouhodobé léčbě patologických hypersekrečních stavů, včetně Zollinger-Ellisonova (ZE) syndromu.
DÁVKOVÁNÍ A PODÁVÁNÍ
Doporučené dávkovací schéma
PROTONIX se dodává jako granule s opožděným uvolňováním v balíčcích pro přípravu perorálních suspenzí nebo jako tablety s opožděným uvolňováním. Doporučené dávkování je uvedeno v tabulce 1.
Pokyny pro administraci
Pokyny pro způsob podávání pro každou dávkovou formu jsou uvedeny v tabulce 2.
Užijte vynechanou dávku co nejdříve. Pokud je téměř čas na další dávku, vynechejte vynechanou dávku a vezměte si další dávku v pravidelném plánovaném čase. Neužívejte 2 dávky současně.
Tablety se zpožděným uvolňováním PROTONIX
Tablety PROTONIX s opožděným uvolňováním spolkněte celé, s jídlem nebo bez jídla v žaludku. U pacientů, kteří nejsou schopni spolknout 40mg tabletu, lze užít dvě 20mg tablety. Současné podávání antacidů neovlivňuje absorpci přípravku PROTONIX Tablety s opožděným uvolňováním.
PROTONIX pro perorální suspenzi s opožděným uvolňováním
Podávejte PROTONIX pro perorální suspenzi s opožděným uvolňováním přibližně 30 minut před jídlem perorálním podáním v jablečném džusu nebo jablečném pyré nebo pouze nasogastrickou sondou v jablečném džusu. Protože je pro stabilitu nezbytné správné pH, nepodávejte PROTONIX 20 mg pro perorální suspenzi s opožděným uvolňováním v tekutinách jiných než jablečný džus nebo potravinách jiných než jablečný pyré.
Nerozdělujte balíček 40 mg PROTONIX 20 mg pro perorální suspenzi s opožděným uvolňováním, abyste vytvořili dávku 20 mg pro pediatrické pacienty, kteří nejsou schopni užívat tabletovou formu.
PROTONIX pro perorální suspenzi s opožděným uvolňováním – perorální podání v jablečném pyré
- Otevřete balíček.
- Nasypte granule na jednu čajovou lžičku jablečného pyré. NEPOUŽÍVEJTE JINÉ POTRAVINY, NERUŠTE ANI NEŽÝVEJTE GRANULE.
- Užívejte do 10 minut od přípravy.
- Pijte doušky vody, abyste se ujistili, že se granule vyplaví do žaludku. Podle potřeby opakujte doušky vody.
PROTONIX pro perorální suspenzi s opožděným uvolňováním - orální podání v jablečném džusu
- Otevřete balíček.
- Vysypte granule do malého šálku nebo čajové lžičky obsahující jednu čajovou lžičku jablečné šťávy.
- Míchejte 5 sekund (granule se nerozpustí) a ihned spolkněte.
- Abyste se ujistili, že byla podána celá dávka, vypláchněte nádobu jednou nebo dvakrát jablečnou šťávou, abyste odstranili zbývající granule. Okamžitě spolkněte.
PROTONIX 40 mg pro perorální suspenzi s opožděným uvolňováním – podání nazogastrické (NG) nebo gastrostomické sondy
Pacientům, kteří mají zavedenou nazogastrickou sondu nebo gastrostomickou sondu, lze PROTONIX 40 mg pro perorální suspenzi s opožděným uvolňováním podat následovně:
- Vyjměte píst z válce 2 uncové (60 ml) injekční stříkačky s hrotem katetru. Zlikvidujte píst.
- Připojte hrot katétru stříkačky k 16 francouzské (nebo větší) hadičce.
- Držte stříkačku připojenou k hadičce tak vysoko, jak je to možné, při podávání přípravku PROTONIX pro perorální suspenzi s opožděným uvolňováním, abyste zabránili jakémukoli ohnutí hadičky.
- Vyprázdněte obsah sáčku do válce stříkačky.
- Přidejte 10 ml (2 čajové lžičky) jablečného džusu a jemně poklepejte a/nebo protřepejte válec stříkačky, abyste stříkačku a hadičku propláchli. Opakujte alespoň dvakrát, pokaždé se stejným množstvím jablečné šťávy (10 ml nebo 2 čajové lžičky). Ve stříkačce by neměly zůstat žádné granule.
JAK DODÁVÁNO
Dávkové formy A Síly
Tablety se zpožděným uvolňováním:
- 40 mg pantoprazolu, žluté oválné bikonvexní tablety s potiskem PROTONIX (hnědý inkoust) na jedné straně
- 20 mg pantoprazolu, žluté oválné bikonvexní tablety s potiskem P20 (hnědý inkoust) na jedné straně
Pro perorální suspenzi s opožděným uvolňováním:
- 40 mg pantoprazolu, světle nažloutlé až tmavě nahnědlé, enterosolventní granule v jednodávkovém balení
Skladování A Manipulace
PROTONIX (sodná sůl pantoprazolu) tablety s opožděným uvolňováním jsou dodávány jako žluté oválné bikonvexní tablety s opožděným uvolňováním s potiskem PROTONIX (hnědý inkoust) na jedné straně obsahující 40 mg pantoprazolu a jsou dostupné následovně:
NDC 0008-0841-81, lahve 90
PROTONIX (sodná sůl pantoprazolu) tablety s opožděným uvolňováním jsou dodávány jako žluté oválné bikonvexní tablety s opožděným uvolňováním s potiskem P20 (hnědý inkoust) na jedné straně obsahující 20 mg pantoprazolu a jsou dostupné následovně:
NDC 0008-0843-81, lahve 90
PROTONIX (pantoprazol sodný) pro perorální suspenzi s opožděným uvolňováním se dodává jako světle nažloutlé až tmavě nahnědlé enterosolventní granule obsahující 40 mg pantoprazolu v jednodávkovém balení a jsou dostupné takto:
NDC 0008-0844-02, karton s jednotkovou dávkou po 30
Úložný prostor
Uchovávejte PROTONIX 40 mg pro perorální suspenzi s opožděným uvolňováním a PROTONIX 20 mg tablety s opožděným uvolňováním při teplotě 20° až 25°C (68° až 77°F); povoleny výchylky do 15° až 30°C (59° až 86°F) [viz USP řízená pokojová teplota ].
Distribuuje: Wyeth Pharmaceuticals LLC, dceřiná společnost Pfizer Inc., Philadelphia, PA 19101. Revize: listopad 2020
VEDLEJŠÍ EFEKTY
Následující závažné nežádoucí účinky jsou popsány níže a jinde v označení:
- Akutní tubulointersticiální nefritida [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Průjem spojený s Clostridium difficile [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Zlomenina kosti [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Kožní a systémový lupus erythematodes [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Nedostatek kyanokobalaminu (vitamín B-12) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hypomagnezémie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Polypy fundických žláz [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Profily nežádoucích účinků pro PROTONIX (pantoprazol sodný) pro perorální suspenzi s opožděným uvolňováním a PROTONIX (pantoprazol sodný) tablety s opožděným uvolňováním jsou podobné.
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v klinické praxi.
Dospělí
Bezpečnost v devíti randomizovaných srovnávacích klinických studiích v USA u pacientů s GERD zahrnovala 1 473 pacientů na perorálním přípravku PROTONIX (20 mg nebo 40 mg), 299 pacientů na antagonistu H2-receptoru, 46 pacientů na jiném PPI a 82 pacientů na placebu. Nejčastěji se vyskytující nežádoucí účinky jsou uvedeny v tabulce 3.
Další nežádoucí účinky, které byly hlášeny pro PROTONIX 20 mg v klinických studiích s frekvencí ≤ 2 %, jsou uvedeny níže podle tělesného systému:
Tělo jako celek: alergická reakce, pyrexie, fotosenzitivní reakce, edém obličeje
Gastrointestinální: zácpa, sucho v ústech, hepatitida
Hematologické: leukopenie, trombocytopenie
Metabolické/nutriční: zvýšená CK (kreatinkináza), generalizovaný edém, zvýšené triglyceridy, zvýšené jaterní enzymy
Muskuloskeletální: myalgie
Nervový: deprese, vertigo
Kůže a přílohy: kopřivka, vyrážka, pruritus
Speciální smysly: rozmazané vidění
Pediatričtí pacienti
Bezpečnost přípravku PROTONIX při léčbě EE související s GERD byla hodnocena u pediatrických pacientů ve věku od 1 roku do 16 let ve třech klinických studiích. Bezpečnostní studie zahrnovaly pediatrické pacienty s EE; jelikož však EE není v pediatrické populaci častá, bylo hodnoceno také 249 dětských pacientů s endoskopicky prokázanou nebo symptomatickou GERD. Všechny nežádoucí reakce dospělých na PROTONIX 20 mg jsou považovány za relevantní pro pediatrické pacienty. U pacientů ve věku od 1 roku do 16 let patří mezi nejčastěji hlášené (>4 %) nežádoucí účinky: URI, bolest hlavy, horečka, průjem, zvracení, vyrážka a bolest břicha.
Informace o bezpečnosti u pacientů mladších 1 roku viz Použití u konkrétních populací .
Další nežádoucí účinky, které byly hlášeny u přípravku PROTONIX 20 mg u pediatrických pacientů v klinických studiích s frekvencí ≤ 4 %, jsou uvedeny níže podle tělesného systému:
Tělo jako celek: alergická reakce, otok obličeje
Gastrointestinální: zácpa, plynatost, nevolnost
Metabolické/nutriční: zvýšené triglyceridy, zvýšené jaterní enzymy, zvýšená CK (kreatinkináza)
Muskuloskeletální: artralgie, myalgie
Nervový: závratě, vertigo
Kůže a přílohy: kopřivka
Následující nežádoucí účinky pozorované u dospělých v klinických studiích nebyly hlášeny u pediatrických pacientů v klinických studiích, ale jsou považovány za relevantní pro dětské pacienty: fotosenzitivní reakce, sucho v ústech, hepatitida, trombocytopenie, generalizovaný edém, deprese, pruritus, leukopenie a rozmazané vidění .
Zollinger-Ellisonův (ZE) syndrom
V klinických studiích ZE syndromu byly nežádoucí účinky hlášené u 35 pacientů užívajících PROTONIX 80 mg/den až 240 mg/den po dobu až 2 let podobné těm, které byly hlášeny u dospělých pacientů s GERD.
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během postregistračního užívání přípravku PROTONIX. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Tyto nežádoucí účinky jsou uvedeny níže podle tělesného systému:
Gastrointestinální poruchy: polypy fundické žlázy
Obecné poruchy a podmínky podávání: astenie, únava, malátnost
Hematologické: pancytopenie, agranulocytóza
Poruchy jater a žlučových cest: hepatocelulární poškození vedoucí ke žloutence a selhání jater
Poruchy imunitního systému: anafylaxe (včetně anafylaktického šoku), systémový lupus erythematodes
Infekce a nákazy: Průjem související s Clostridium difficile
Vyšetřování: změny hmotnosti
Poruchy metabolismu a výživy: hyponatremie, hypomagnezémie
Muskuloskeletální poruchy: rabdomyolýza, zlomenina kosti
Nervový: ageuzie, dysgeuzie
Psychiatrické poruchy: halucinace, zmatenost, nespavost, somnolence
Poruchy ledvin a močových cest: akutní tubulointersticiální nefritida
Poruchy kůže a podkožní tkáně: závažné dermatologické reakce (některé fatální), včetně erythema multiforme, Stevens-Johnsonova syndromu, toxické epidermální nekrolýzy (TEN, některé fatální), angioedému (Quinckeho edém) a kožního lupus erythematodes
DROGOVÉ INTERAKCE
Tabulka 4 zahrnuje léky s klinicky významnými lékovými interakcemi a interakcí s diagnostikou při současném podávání s PROTONIXem a pokyny pro jejich prevenci nebo léčbu.
Chcete-li získat další informace o interakcích s PPI, podívejte se na označení současně užívaných léků.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Přítomnost Malignity žaludku
dospělých nevylučuje symptomatická odpověď na léčbu přípravkem PROTONIX přítomnost žaludeční malignity. Zvažte další sledování a diagnostické testování u dospělých pacientů, kteří mají suboptimální odpověď nebo časný symptomatický relaps po dokončení léčby PPI. U starších pacientů zvažte i endoskopii.
Akutní tubulointersticiální nefritida
Akutní tubulointersticiální nefritida (TIN) byla pozorována u pacientů užívajících PPI a může se objevit kdykoli během léčby PPI. Pacienti mohou mít různé známky a příznaky od symptomatických reakcí přecitlivělosti až po nespecifické příznaky snížené funkce ledvin (např. malátnost, nauzea, anorexie). V hlášených sériích případů byli někteří pacienti diagnostikováni biopsií a bez extrarenálních projevů (např. horečka, vyrážka nebo artralgie). Vysaďte PROTONIX 20 mg a vyhodnoťte pacienty s podezřením na akutní TIN [viz KONTRAINDIKACE ].
Průjem spojený s Clostridium difficile
Publikované pozorovací studie naznačují, že léčba PPI, jako je PROTONIX 20 mg, může být spojena se zvýšeným rizikem průjmu souvisejícího s Clostridium difficile, zejména u hospitalizovaných pacientů. Tuto diagnózu je třeba zvážit u průjmu, který se nezlepšuje [viz NEŽÁDOUCÍ REAKCE ].
Pacienti by měli používat nejnižší dávku a nejkratší dobu léčby PPI odpovídající léčenému stavu.
Zlomenina kosti
Několik publikovaných observačních studií naznačuje, že léčba PPI může být spojena se zvýšeným rizikem zlomenin kyčle, zápěstí nebo páteře souvisejících s osteoporózou. Riziko zlomenin se zvýšilo u pacientů, kteří dostávali vysoké dávky, definované jako opakované denní dávky, a dlouhodobou terapii PPI (rok nebo déle). Pacienti by měli používat nejnižší dávku a nejkratší dobu léčby PPI odpovídající léčenému stavu. Pacienti s rizikem zlomenin souvisejících s osteoporózou by měli být léčeni podle zavedených pokynů pro léčbu [viz DÁVKOVÁNÍ A PODÁVÁNÍ , NEŽÁDOUCÍ REAKCE ].
Kožní a systémový lupus erythematodes
pacientů užívajících PPI, včetně sodné soli pantoprazolu, byly hlášeny kožní lupus erythematodes (CLE) a systémový lupus erythematodes (SLE). Tyto příhody se objevily jak jako nový nástup, tak jako exacerbace stávajícího autoimunitního onemocnění. Většina případů lupus erytematózních vyvolaných PPI byla CLE.
Nejběžnější formou CLE hlášenou u pacientů léčených PPI byl subakutní CLE (SCLE) a vyskytoval se během týdnů až let po kontinuální medikamentózní terapii u pacientů od kojenců až po seniory. Obecně byly histologické nálezy pozorovány bez orgánového postižení.
Systémový lupus erythematodes (SLE) je u pacientů užívajících PPI méně často hlášen než CLE. SLE spojený s PPI je obvykle mírnější než SLE neindukovaný léky. Nástup SLE se typicky objevil během dnů až let po zahájení léčby primárně u pacientů od mladých dospělých po starší osoby. U většiny pacientů se objevila vyrážka; byly však také hlášeny artralgie a cytopenie.
Vyhněte se podávání PPI déle, než je lékařsky indikováno. Pokud jsou u pacientů užívajících PROTONIX 40 mg zaznamenány známky nebo příznaky odpovídající CLE nebo SLE, přerušte léčbu a odešlete pacienta k příslušnému specialistovi k vyšetření. Většina pacientů se zlepší po vysazení samotného PPI za 4 až 12 týdnů. Sérologické vyšetření (např. ANA) může být pozitivní a vyřešení zvýšených sérologických testů může trvat déle než klinické projevy.
Nedostatek kyanokobalaminu (vitamín B-12).
Obecně může každodenní léčba jakýmikoli léky potlačujícími kyselost po dlouhou dobu (např. déle než 3 roky) vést k malabsorpci kyanokobalaminu (vitamín B-12) způsobené hypo- nebo achlorhydrií. V literatuře byly popsány vzácné zprávy o deficitu kyanokobalaminu vyskytujícího se při léčbě potlačující kyselost. Tuto diagnózu je třeba zvážit, pokud jsou pozorovány klinické příznaky odpovídající nedostatku kyanokobalaminu.
Hypomagnezémie
Hypomagnezémie, symptomatická a asymptomatická, byla vzácně hlášena u pacientů léčených PPI po dobu alespoň tří měsíců a ve většině případů po roce léčby. Mezi závažné nežádoucí účinky patří tetanie, arytmie a záchvaty. U většiny pacientů vyžadovala léčba hypomagnezémie náhradu hořčíku a vysazení PPI.
U pacientů, u kterých se očekává delší léčba nebo kteří užívají PPI s léky, jako je digoxin nebo léky, které mohou způsobit hypomagnezémii (např. diuretika), mohou zdravotníci zvážit sledování hladin hořčíku před zahájením léčby PPI a pravidelně [viz NEŽÁDOUCÍ REAKCE ].
Tumorogenita
Vzhledem k chronické povaze GERD může existovat potenciál pro prodloužené podávání PROTONIXu. V dlouhodobých studiích na hlodavcích byl pantoprazol karcinogenní a způsoboval vzácné typy gastrointestinálních nádorů. Význam těchto zjištění pro vývoj nádoru u lidí není znám [viz Neklinická toxikologie ].
Polypy fundických žláz
Užívání PPI je spojeno se zvýšeným rizikem polypů fundických žláz, které se zvyšuje s dlouhodobým užíváním, zejména po jednom roce. Většina uživatelů PPI, u kterých se vyvinuly polypy fundické žlázy, byla asymptomatická a polypy fundické žlázy byly identifikovány náhodně při endoskopii. Použijte nejkratší dobu trvání léčby PPI vhodnou pro léčený stav.
Interference s vyšetřováním Neuroendokrinních nádorů
Hladiny sérového chromograninu A (CgA) se zvyšují sekundárně po lékem vyvolaném poklesu kyselosti žaludku. Zvýšená hladina CgA může způsobit falešně pozitivní výsledky při diagnostických vyšetřeních neuroendokrinních nádorů. Poskytovatelé zdravotní péče by měli dočasně přerušit léčbu přípravkem PROTONIX 20 mg alespoň 14 dní před stanovením hladin CgA a zvážit opakování testu, pokud jsou počáteční hladiny CgA vysoké. Pokud se provádějí sériové testy (např. pro monitorování), měla by být pro testování použita stejná komerční laboratoř, protože referenční rozmezí mezi testy se mohou lišit [viz. KLINICKÁ FARMAKOLOGIE ].
Interference s močovou clonou pro THC
Existují zprávy o falešně pozitivních screeningových testech moči na tetrahydrokanabinol (THC) u pacientů užívajících PPI, včetně PROTONIXu [viz DROGOVÉ INTERAKCE ].
Současné užívání přípravku PROTONIX s methotrexátem
Literatura naznačuje, že současné užívání PPI s methotrexátem (primárně ve vysokých dávkách; viz informace o předepisování methotrexátu) může zvýšit a prodloužit sérové hladiny methotrexátu a/nebo jeho metabolitu, což může vést k toxicitě methotrexátu. Při podávání vysokých dávek metotrexátu lze u některých pacientů zvážit dočasné vysazení PPI [viz DROGOVÉ INTERAKCE ].
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( Návod k použití a návod k použití ).
Malignita žaludku
Poraďte pacientům, aby se vrátili ke svému poskytovateli zdravotní péče, pokud mají suboptimální odpověď nebo časný symptomatický relaps [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Akutní tubulointersticiální nefritida
Informujte pacienty, aby okamžitě zavolali svého poskytovatele zdravotní péče, pokud zaznamenají známky a / nebo příznaky spojené s akutní tubulointersticiální nefritidou [viz KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Průjem spojený s Clostridium Difficile
Informujte pacienty, aby okamžitě zavolali svého poskytovatele zdravotní péče, pokud se u nich objeví průjem, který se nezlepší [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Zlomenina kosti
Doporučte pacientům, aby hlásili jakékoli zlomeniny, zejména kyčle, zápěstí nebo páteře, svému poskytovateli zdravotní péče [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Kožní a systémový lupus erythematodes
Informujte pacienty, aby okamžitě zavolali svého poskytovatele zdravotní péče v případě jakýchkoli nových nebo zhoršených příznaků spojených s kožním nebo systémovým lupus erythematodes [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Nedostatek kyanokobalaminu (vitamín B-12).
Informujte pacienty, aby hlásili jakékoli klinické příznaky, které mohou být spojeny s nedostatkem kyankobalaminu svému poskytovateli zdravotní péče, pokud užívají PROTONIX 40 mg déle než 3 roky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Hypomagnezémie
Informujte pacienty, aby hlásili jakékoli klinické příznaky, které mohou být spojeny s hypomagnezémií, svému poskytovateli zdravotní péče, pokud užívali PROTONIX 40 mg po dobu alespoň 3 měsíců [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Lékové interakce
Poučte pacienty, aby informovali svého poskytovatele zdravotní péče o všech dalších lécích, které v současné době užívají, včetně přípravků obsahujících rilpivirin [viz KONTRAINDIKACE ] digoxin [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ] a vysokou dávkou methotrexátu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Těhotenství
Informujte těhotnou ženu o možném riziku pro plod. Informujte ženy o reprodukčním potenciálu, aby informovaly svého poskytovatele zdravotní péče o známém nebo předpokládaném těhotenství [viz Použití u konkrétních populací ].
Správa
- Nedělte, nedrťte ani nežvýkejte PROTONIX pro perorální suspenzi s opožděným uvolňováním a PROTONIX 20 mg tablety s opožděným uvolňováním.
- Balíček perorální suspenze PROTONIX je fixní dávka a nelze ji rozdělit na menší dávku.
- Tablety PROTONIX 20 mg s opožděným uvolňováním spolkněte celé, s jídlem nebo bez jídla v žaludku.
- Současné podávání antacidů neovlivňuje absorpci přípravku PROTONIX Tablety s opožděným uvolňováním.
- Užívejte PROTONIX 20 mg pro perorální suspenzi s opožděným uvolňováním přibližně 30 minut před jídlem.
- Podávejte PROTONIX pro perorální suspenzi s opožděným uvolňováním v jablečném džusu nebo jablečném pyré, jak je popsáno v návodu k použití. Nepodávejte do vody, jiných tekutin nebo potravin.
- U pacientů s nazogastrickou (NG) nebo gastrostomickou sondou lze PROTONIX pro perorální suspenzi s opožděným uvolňováním podávat s jablečným džusem, jak je popsáno v návodu k použití.
- Užijte vynechanou dávku co nejdříve. Pokud je téměř čas na další dávku, vynechejte vynechanou dávku a vezměte si další dávku v pravidelném plánovaném čase. Neužívejte 2 dávky současně.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Ve 24měsíční studii karcinogenity byly potkanům Sprague-Dawley perorálně podávány pantoprazol v dávkách 0,5 až 200 mg/kg/den, což je přibližně 0,1 až 40násobek expozice na základě tělesného povrchu u osoby s hmotností 50 kg při dávce 40 mg /den. Léčba 0,5 až 200 mg/kg/den ve fundu žaludku vyvolala hyperplazii buněk podobných enterochromafinu (ECL) a benigní a maligní neuroendokrinní buněčné nádory v závislosti na dávce. V předžaludku vyvolala léčba 50 a 200 mg/kg/den (přibližně 10 až 40násobek doporučené dávky pro člověka na základě tělesného povrchu) benigní spinocelulární papilomy a maligní spinocelulární karcinomy. Vzácné gastrointestinální nádory spojené s léčbou pantoprazolem zahrnovaly adenokarcinom duodena s dávkou 50 mg/kg/den a benigní polypy a adenokarcinomy fundu žaludku s dávkou 200 mg/kg/den. V játrech vyvolala léčba 0,5 až 200 mg/kg/den na dávce závislé zvýšení výskytu hepatocelulárních adenomů a karcinomů. Ve štítné žláze vyvolala léčba dávkou 200 mg/kg/den zvýšený výskyt adenomů z folikulárních buněk a karcinomů u samců i samic potkanů.
Ve 24měsíční studii karcinogenity byly potkanům Fischer 344 perorálně podávány dávky pantoprazolu 5 až 50 mg/kg/den, což je přibližně 1 až 10násobek doporučené dávky pro člověka na základě tělesného povrchu. V žaludečním fundu vyvolala léčba 5 až 50 mg/kg/den hyperplazii buněk podobných enterochromafinu (ECL) a benigní a maligní neuroendokrinní buněčné nádory. Výběr dávky pro tuto studii nemusel být adekvátní ke komplexnímu hodnocení karcinogenního potenciálu pantoprazolu.
Ve 24měsíční studii karcinogenity byly myši B6C3F1 léčeny perorálně dávkami 5 až 150 mg/kg/den pantoprazolu, což je 0,5 až 15násobek doporučené dávky pro člověka na základě tělesného povrchu. V játrech vyvolala léčba dávkou 150 mg/kg/den zvýšený výskyt hepatocelulárních adenomů a karcinomů u samic myší. Léčba 5 až 150 mg/kg/den také vyvolala hyperplazii ECL buněk žaludku a fundu.
26týdenní studie karcinogenity p53 +/-transgenních myší nebyla pozitivní.
Pantoprazol byl pozitivní v in vitro testech chromozomálních aberací lidských lymfocytů, v jednom ze dvou myších mikronukleárních testů na klastogenní účinky a v in vitro testu na mutagenní účinky na ovariálních buňkách čínského křečka/HGPRT. Nejednoznačné výsledky byly pozorovány v in vivo testu kovalentní vazby DNA potkaních jater. Pantoprazol byl negativní v in vitro testu Ames mutace, in vitro testu neplánované syntézy DNA (UDS) s potkaními hepatocyty, in vitro testu AS52/GPT savčích buněk dopředných genových mutací, in vitro testu mutace thymidinkinázy s myším lymfomem L5178Y a in vivo test chromozomální aberace buněk kostní dřeně potkana.
Při perorálním podávání pantoprazolu v dávkách až 500 mg/kg/den potkaním samcům (98násobek doporučené dávky pro člověka na základě tělesného povrchu) a 450 mg/kg/den potkaním samicím nebyly pozorovány žádné účinky na fertilitu nebo reprodukční schopnost (88násobek doporučené dávky pro člověka na základě plochy povrchu těla).
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
Dostupné údaje z publikovaných observačních studií neprokázaly souvislost závažných malformací nebo jiných nepříznivých výsledků těhotenství s pantoprazolem.
V reprodukčních studiích na zvířatech nebyly u pantoprazolu pozorovány žádné známky nepříznivých vývojových výsledků. Reprodukční studie byly provedeny na potkanech při perorálních dávkách až 450 mg/kg/den (asi 88násobek doporučené dávky pro člověka) a králících při perorálních dávkách až 40 mg/kg/den (přibližně 16násobek doporučené dávky pro člověka) s podávání pantoprazolu během organogeneze březím zvířatům a v této studii neodhalily žádné známky poškození plodu pantoprazolem (viz Data ).
Studie pre- a postnatální vývojové toxicity u potkanů s dalšími cílovými body pro hodnocení účinku na vývoj kostí byla provedena s pantoprazolem sodným. Orální dávky pantoprazolu 5, 15 a 30 mg/kg/den (přibližně 1, 3 a 6násobek lidské dávky 40 mg/den) byly podávány těhotným ženám od 6. dne gestace (GD) do dne laktace (LD ) 21. Změny kostní morfologie byly pozorovány u mláďat exponovaných pantoprazolu in utero a prostřednictvím mléka během období laktace a také při perorálním podávání od 4. postnatálního dne (PND) do 21. PND [viz Použití u konkrétních populací ]. U mateřských zvířat nebyly zjištěny žádné nálezy související s drogou. Informujte těhotné ženy o možném riziku poškození plodu.
Odhadované základní riziko závažných vrozených vad a potratu pro indikovanou populaci není známo. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 až 4 % a 15 až 20 %.
Data
Lidská data
Dostupné údaje z publikovaných observačních studií neprokázaly souvislost nežádoucích výsledků souvisejících s těhotenstvím a užíváním pantoprazolu. Metodologická omezení těchto observačních studií nemohou s jistotou stanovit nebo vyloučit jakékoli riziko spojené s užíváním léků během těhotenství. V prospektivní studii Evropské sítě teratologických informačních služeb byly výsledky skupiny 53 těhotných žen, kterým byla podávána střední denní dávka 40 mg pantoprazolu, porovnány s kontrolní skupinou 868 těhotných žen, které neužívaly žádné inhibitory protonové pumpy (PPI). . Mezi ženami vystavenými PPI a kontrolní skupinou nebyl žádný rozdíl v míře závažných malformací, což odpovídalo relativnímu riziku (RR) = 0,55, [95% interval spolehlivosti (CI) 0,08-3,95]. V populační retrospektivní kohortové studii zahrnující všechny živě narozené děti v Dánsku od roku 1996 do roku 2008 nedošlo během analýzy expozice pantoprazolu v prvním trimestru u 549 živě narozených dětí k žádnému významnému nárůstu závažných vrozených vad. Metaanalýza, která porovnávala 1 530 těhotných žen vystavených PPI alespoň v prvním trimestru se 133 410 neexponovanými těhotnými ženami, neprokázala žádné významné zvýšení rizika vrozených malformací nebo spontánního potratu při expozici PPI (pro velké malformace OR = 1,12 ([95 % CI 0,86-1,45] a pro spontánní potraty OR=1,29 [95% CI 0,84-1,97]).
Údaje o zvířatech
Reprodukční studie byly provedeny u potkanů při perorálních dávkách pantoprazolu až 450 mg/kg/den (asi 88násobek doporučené dávky pro člověka na základě tělesného povrchu) au králíků při perorálních dávkách až 40 mg/kg/den (přibližně 16 násobek doporučené dávky pro člověka na základě tělesného povrchu) s podáváním sodné soli pantoprazolu během organogeneze u březích zvířat. Studie neodhalily žádné známky poškození plodnosti nebo poškození plodu v důsledku pantoprazolu.
Studie pre- a postnatální vývojové toxicity u potkanů s dalšími cílovými body pro hodnocení účinku na vývoj kostí byla provedena s pantoprazolem sodným. Orální dávky pantoprazolu 5, 15 a 30 mg/kg/den (přibližně 1, 3 a 6násobek lidské dávky 40 mg/den na základě tělesného povrchu) byly podávány těhotným ženám ode dne gestace (GD) 6 až den laktace (LD) 21. V postnatální den (PND 4) až PND 21 byly mláďatům podávány perorální dávky 5, 15 a 30 mg/kg/den (přibližně 1, 2,3 a 3,2násobek expozice ( AUC) u lidí v dávce 40 mg). U mateřských zvířat nebyly zjištěny žádné nálezy související s drogou. Během dávkovací fáze před odstavením (PND 4 až 21) mláďat došlo ke zvýšené úmrtnosti a/nebo úhynu a ke snížení tělesné hmotnosti a přírůstku tělesné hmotnosti při dávce 5 mg/kg/den (přibližně stejné expozice (AUC) u lidí dostávajících 40 mg dávka) a vyšší dávky. V PND 21 byla u potomků pozorována snížená střední délka a hmotnost stehenní kosti a změny v kostní hmotě a geometrii stehenní kosti při dávkách 5 mg/kg/den (přibližně stejné expozice (AUC) u lidí při dávce 40 mg) a vyšších dávkách. Nálezy femuru zahrnovaly nižší celkovou plochu, minerální obsah a hustotu kosti, obvod periostu a endostu a moment setrvačnosti v příčném řezu. Na distálním femuru, proximální tibii nebo v kolenních kloubech nebyly žádné mikroskopické změny. Změny kostních parametrů byly po období zotavení částečně reverzibilní, přičemž nálezy PND 70 se omezily na minerální kostní denzitu kortikální/subkortikální metafýzy dolní femuru u mláďat samic při dávce 5 mg/kg/den (přibližně stejné expozice (AUC) u lidí ve 40. mg dávka) a vyšší dávky.
Laktace
Shrnutí rizik
Pantoprazol byl zjištěn v mateřském mléce kojící matky po jednorázové perorální dávce 40 mg pantoprazolu. Nebyly pozorovány žádné účinky na kojené dítě (viz Data ). Neexistují žádné údaje o účincích pantoprazolu na produkci mléka.

Vývojové a zdravotní přínosy kojení by měly být zváženy spolu s klinickou potřebou matky PROTONIX 40 mg a veškerými potenciálními nežádoucími účinky pantoprazolu nebo základního stavu matky na kojené dítě.
Data
Mateřské mléko 42leté ženy, která dostávala 40 mg perorálně pantoprazolu 10 měsíců po porodu, bylo studováno po dobu 24 hodin, aby se prokázaly nízké hladiny pantoprazolu přítomného v mateřském mléce. Pantoprazol byl detekovatelný v mléce pouze 2 a 4 hodiny po dávce s hladinami mléka přibližně 36 mcg/la 24 mcg/l, v daném pořadí. Poměr mléko/plazma 0,022 byl pozorován 2 hodiny po podání léku. Pantoprazol nebyl detekovatelný (
Pediatrické použití
Bezpečnost a účinnost přípravku PROTONIX pro krátkodobou léčbu (až osm týdnů) EE související s GERD byla stanovena u pediatrických pacientů ve věku od 1 roku do 16 let. Účinnost pro EE nebyla prokázána u pacientů mladších 1 roku. Kromě toho pro pacienty mladší 5 let není k dispozici žádná vhodná síla dávkování ve formulaci vhodné pro věk. Proto je PROTONIX indikován ke krátkodobé léčbě EE spojené s GERD u pacientů ve věku 5 let a starších. Bezpečnost a účinnost přípravku PROTONIX pro pediatrické použití jiné než EE nebyly stanoveny.
1 rok až 16 let věku
Použití PROTONIXu u pediatrických pacientů ve věku od 1 roku do 16 let pro krátkodobou léčbu (až osm týdnů) EE spojené s GERD je podporováno: a) extrapolací výsledků z adekvátních a dobře kontrolovaných studií, které podpořily schválení PROTONIX pro léčbu EE spojené s GERD u dospělých a b) studie bezpečnosti, účinnosti a farmakokinetiky provedené u dětských pacientů [viz Klinické studie , KLINICKÁ FARMAKOLOGIE ].
Bezpečnost přípravku PROTONIX 40 mg při léčbě EE spojené s GERD u pediatrických pacientů ve věku 1 až 16 let byla hodnocena ve třech multicentrických, randomizovaných, dvojitě zaslepených studiích s paralelní léčbou, do kterých bylo zařazeno 249 pediatrických pacientů, včetně 8 s EE (4 pacienti věk 1 rok až 5 let a 4 pacienti 5 let až 11 let). Děti ve věku od 1 roku do 5 let s endoskopicky diagnostikovanou EE (definovanou jako endoskopické Hetzel-Dentovo skóre ≥2) byly léčeny jednou denně po dobu 8 týdnů jednou ze dvou úrovní dávek PROTONIXu (přibližně 0,6 mg/kg nebo 1,2 mg/kg ). Všichni 4 tito pacienti s EE byli vyléčeni (Hetzel-Dentovo skóre 0 nebo 1) po 8 týdnech. Protože EE není v pediatrické populaci častá, byli do těchto studií zahrnuti také převážně dětští pacienti s endoskopicky prokázanou nebo symptomatickou GERD. Pacienti byli léčeni řadou dávek PROTONIXu 20 mg jednou denně po dobu 8 týdnů. Bezpečnostní zjištění viz NEŽÁDOUCÍ REAKCE Protože tyto pediatrické studie neměly žádné placebo, aktivní komparátor ani důkazy o odpovědi na dávku, studie nebyly jednoznačné, pokud jde o klinický přínos přípravku PROTONIX 20 mg pro symptomatickou GERD u pediatrické populace. Účinnost přípravku PROTONIX 40 mg pro léčbu symptomatické GERD u pediatrických pacientů nebyla stanovena.
Ačkoli údaje z klinických studií podporují použití přípravku PROTONIX pro krátkodobou léčbu EE spojené s GERD u pediatrických pacientů 1 rok až 5 let, neexistuje žádná komerčně dostupná léková forma vhodná pro pacienty mladší 5 let [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
populační farmakokinetické analýze měly hodnoty clearance u dětí ve věku 1 až 5 let s endoskopicky prokázanou GERD střední hodnotu 2,4 l/h. Po ekvivalentní dávce 1,2 mg/kg (15 mg pro ≤12,5 kg a 20 mg pro >12,5 až
Novorozenci do méně než jednoho roku věku
multicentrické, randomizované, dvojitě zaslepené, placebem kontrolované studii s vysazením léčby u 129 dětských pacientů ve věku 1 až 11 měsíců nebyl přípravek PROTONIX 20 mg shledán jako účinný. Pacienti byli zařazeni, pokud měli symptomatickou GERD na základě anamnézy a nereagovali na nefarmakologické intervence pro GERD po dobu dvou týdnů. Pacienti dostávali PROTONIX denně po dobu čtyř týdnů v otevřené fázi, poté byli pacienti randomizováni ve stejném poměru, aby dostávali léčbu PROTONIXem 40 mg nebo placebo po následující čtyři týdny dvojitě zaslepeným způsobem. Účinnost byla hodnocena sledováním doby od randomizace do ukončení studie v důsledku zhoršení symptomů během čtyřtýdenní fáze léčby a vysazení. Mezi přípravkem PROTONIX 20 mg a placebem nebyl statisticky významný rozdíl v míře vysazení.
této studii byly nežádoucími účinky, které byly hlášeny častěji (rozdíl ≥4 %) u léčené populace ve srovnání s populací s placebem, zvýšená CK, zánět středního ucha, rinitida a laryngitida.
V populační farmakokinetické analýze byla systémová expozice vyšší u pacientů mladších než 1 rok s GERD ve srovnání s dospělými, kteří dostali jednorázovou dávku 40 mg (geometrický průměr AUC byl o 103 % vyšší u předčasně narozených kojenců a novorozenců, kteří dostali jednorázovou dávku 2,5 mg PROTONIX a o 23 % vyšší u kojenců ve věku 1 až 11 měsíců, kterým byla podávána jedna dávka přibližně 1,2 mg/kg). U těchto pacientů se zdánlivá clearance (CL/F) zvyšovala s věkem (medián clearance: 0,6 l/hod, rozmezí: 0,03 až 3,2 l/hod).
Tyto dávky vedly k farmakodynamickým účinkům na pH žaludku, nikoli však jícnu. Po dávkování 2,5 mg PROTONIX 20 mg jednou denně u předčasně narozených dětí a novorozenců došlo ke zvýšení průměrného pH žaludku (z výchozí hodnoty 4,3 na 5,2 v ustáleném stavu) a průměrné % času, kdy bylo pH žaludku > 4 ( od 60 % ve výchozím stavu do 80 % v ustáleném stavu). Po podávání jednou denně přibližně 1,2 mg/kg přípravku PROTONIX 20 mg u kojenců ve věku 1 až 11 měsíců došlo ke zvýšení průměrného pH žaludku (z 3,1 na začátku na 4,2 v rovnovážném stavu) a ke zvýšení průměrného % času, pH žaludku bylo > 4 (od 32 % na začátku do 60 % v ustáleném stavu). Nebyly však pozorovány žádné významné změny v průměrném intraezofageálním pH nebo % času, kdy bylo pH v jícnu
Protože se v randomizované, placebem kontrolované studii v této věkové skupině neprokázala účinnost přípravku PROTONIX 20 mg, není použití přípravku PROTONIX k léčbě symptomatické GERD u kojenců mladších 1 roku indikováno.
Údaje o toxicitě zvířat
Ve studii prenatálního a postnatálního vývoje u potkanů byly mláďatům podávány perorální dávky pantoprazolu v dávce 5, 15 a 30 mg/kg/den (přibližně 1, 2,3 a 3,2násobek expozice (AUC) u dětí ve věku 6 až 11 let v dávce 40 mg) v den po narození (PND 4) až do PND 21, navíc k laktační expozici prostřednictvím mléka. V PND 21 byla u potomků pozorována snížená střední délka a hmotnost stehenní kosti a změny v kostní hmotě a geometrii stehenní kosti při dávce 5 mg/kg/den (přibližně stejné expozice (AUC) u dětí ve věku 6 až 11 let při dávce 40 mg) a vyšší dávky. Změny kostních parametrů byly po období zotavení částečně reverzibilní.
neonatálních/juvenilních zvířat (potkani a psi) byla toxicita podobná jako u dospělých zvířat, včetně žaludečních změn, snížení hmoty červených krvinek, zvýšení lipidů, indukce enzymů a hepatocelulární hypertrofie. Ve studiích s opakovanými dávkami byl pozorován zvýšený výskyt eozinofilních hlavních buněk u dospělých a neonatálních/juvenilních potkanů a atrofie hlavních buněk u dospělých potkanů a neonatálních/juvenilních psů ve fundické sliznici žaludku. Úplné až částečné zotavení těchto účinků bylo zaznamenáno u zvířat obou věkových skupin po období zotavení.
Geriatrické použití
V krátkodobých klinických studiích v USA byla míra hojení EE u 107 starších pacientů (≥65 let) léčených PROTONIXem podobná jako u pacientů mladších 65 let. Míra výskytu nežádoucích účinků a laboratorních abnormalit u pacientů ve věku 65 let a starší byly podobné jako u pacientů mladších 65 let.
PŘEDÁVKOVAT
Zkušenosti u pacientů užívajících velmi vysoké dávky přípravku PROTONIX (vyšší než 240 mg) jsou omezené. Spontánní postmarketingové zprávy o předávkování obecně spadají do známého bezpečnostního profilu přípravku PROTONIX.
Pantoprazol nelze odstranit hemodialýzou. V případě předávkování by měla být léčba symptomatická a podpůrná.
Jednotlivé perorální dávky pantoprazolu 709 mg/kg, 798 mg/kg a 887 mg/kg byly smrtelné pro myši, potkany a psy. Příznaky akutní toxicity byly hypoaktivita, ataxie, shrbené sezení, roztažení končetin, poloha na boku, segregace, absence ušního reflexu a třes.
Pokud dojde k nadměrné expozici přípravku PROTONIX 20 mg, zavolejte do Poison Control Center na čísle 1-800-222-1222, kde získáte aktuální informace o léčbě otravy nebo předávkování.
KONTRAINDIKACE
- PROTONIX je kontraindikován u pacientů se známou přecitlivělostí na kteroukoli složku přípravku nebo na jakýkoli substituovaný benzimidazol. Hypersenzitivní reakce mohou zahrnovat anafylaxi, anafylaktický šok, angioedém, bronchospasmus, akutní tubulointersticiální nefritidu a kopřivku (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , NEŽÁDOUCÍ REAKCE ].
- Inhibitory protonové pumpy (PPI), včetně PROTONIXu, jsou kontraindikovány u pacientů užívajících přípravky obsahující rilpivirin (viz DROGOVÉ INTERAKCE ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Pantoprazol je PPI, který potlačuje poslední krok v produkci žaludeční kyseliny kovalentní vazbou na enzymový systém (H+, K+)-ATPázy na sekrečním povrchu žaludeční parietální buňky. Tento účinek vede k inhibici jak bazální, tak stimulované sekrece žaludeční kyseliny, bez ohledu na stimul. Vazba na (H+, K+)-ATPázu má za následek trvání antisekrečního účinku, který přetrvává déle než 24 hodin pro všechny testované dávky (20 mg až 120 mg).
Farmakodynamika
PROTONIX 20 mg Pro perorální suspenzi s opožděným uvolňováním bylo prokázáno, že 40 mg je srovnatelné s přípravkem PROTONIX Tablety s opožděným uvolňováním v potlačení pentagastrinem stimulovaného MAO u pacientů (n = 49) s GERD a EE v anamnéze. V této multicentrické farmakodynamické zkřížené studii byla perorální dávka 40 mg přípravku PROTONIX pro perorální suspenzi s opožděným uvolňováním podávaná v čajové lžičce jablečného pyré srovnávána s perorální dávkou 40 mg přípravku PROTONIX tablety s opožděným uvolňováním po podání každé formulace jednou denně po dobu 7 dní. Oba léky byly podávány třicet minut před snídaní. Pentagastrinem stimulovaný (MAO) byl hodnocen od 23. do 24. hodiny v ustáleném stavu.
Antisekreční činnost
Za podmínek maximální stimulace kyseliny pomocí pentagastrinu dochází u zdravých subjektů k poklesu produkce žaludeční kyseliny závislému na dávce po jedné dávce perorálního (20-80 mg) nebo jednotlivé dávky intravenózního (20-120 mg) pantoprazolu. Pantoprazol podávaný jednou denně vede ke zvýšení inhibice sekrece žaludeční kyseliny. Po úvodní perorální dávce 40 mg pantoprazolu bylo dosaženo 51% průměrné inhibice za 2,5 hodiny. Při podávání jednou denně po dobu 7 dnů se průměrná inhibice zvýšila na 85 %. Pantoprazol potlačil sekreci kyseliny o více než 95 % u poloviny subjektů. Sekrece kyseliny se vrátila k normálu do týdne po poslední dávce pantoprazolu; nebyl žádný důkaz rebound hypersekrece.
sérii studií závislosti odpovědi na dávce způsobil pantoprazol v perorálních dávkách v rozmezí od 20 do 120 mg na dávce závislé zvýšení středního bazálního pH žaludku a procenta času, kdy bylo pH žaludku >3 a >4. Léčba 40 mg pantoprazolu vyvolala významně větší zvýšení pH žaludku než dávka 20 mg. Dávky vyšší než 40 mg (60, 80, 120 mg) nevedly k dalšímu významnému zvýšení mediánu pH žaludku. Účinky pantoprazolu na střední hodnotu pH z jedné dvojitě zaslepené zkřížené studie jsou uvedeny v tabulce 5.
Sérum Gastrin Effects
Hladiny gastrinu v séru nalačno byly hodnoceny ve dvou dvojitě zaslepených studiích akutního hojení EE, ve kterých 682 pacientů s gastroezofageální refluxní chorobou (GERD) dostávalo 10, 20 nebo 40 mg PROTONIX 20 mg po dobu až 8 týdnů. Po 4 týdnech léčby došlo ke zvýšení středních hladin gastrinu o 7 %, 35 % a 72 % oproti hodnotám před léčbou ve skupinách s 10, 20 a 40 mg, v daném pořadí. Podobné zvýšení hladin gastrinu v séru bylo zaznamenáno při 8týdenní návštěvě s průměrným zvýšením o 3 %, 26 % a 84 % u tří dávkových skupin pantoprazolu. Střední hladiny gastrinu v séru zůstaly během udržovací léčby tabletami s opožděným uvolňováním PROTONIX v normálních mezích.
dlouhodobých mezinárodních studiích zahrnujících více než 800 pacientů bylo v prvních měsících léčby pantoprazolem v dávkách 40 mg denně během udržovacích studií GERD pozorováno 2- až 3násobné průměrné zvýšení sérové hladiny gastrinu nalačno před léčbou mg nebo vyšší denně u pacientů s refrakterní GERD. Hladiny gastrinu v séru nalačno obecně zůstávaly na přibližně 2 až 3násobku výchozích hodnot po dobu až 4 let pravidelného sledování v klinických studiích.
Po krátkodobé léčbě přípravkem PROTONIX 20 mg se zvýšené hladiny gastrinu vrátí k normálu nejméně o 3 měsíce.
Enterochromaffin-like (ECL) Cell Effects
U 39 pacientů léčených perorálním pantoprazolem v dávce 40 mg až 240 mg denně (většina dostávala 40 mg až 80 mg) po dobu až 5 let došlo k mírnému zvýšení hustoty buněk ECL po prvním roce užívání, které se zdálo být plató po 4 letech.
neklinické studii na potkanech Sprague-Dawley vedla celoživotní expozice (24 měsíců) pantoprazolu v dávkách 0,5 až 200 mg/kg/den ke zvýšení proliferace žaludečních ECL buněk a žaludečních neuroendokrinních (NE) buněčných nádorů v závislosti na dávce . Žaludeční nádory NE-buněk u potkanů mohou být výsledkem chronického zvýšení sérových koncentrací gastrinu. Vysoká hustota buněk ECL v žaludku potkana činí tento druh vysoce citlivým na proliferační účinky zvýšených koncentrací gastrinu produkovaných PPI. Nebylo však pozorováno žádné zvýšení sérového gastrinu po podání pantoprazolu v dávce 0,5 mg/kg/den. V samostatné studii byl u 1 samice potkana po 12 měsících podávání pantoprazolu v dávce 5 mg/kg/den a po 9měsíční obnově po 9měsíčním zotavení po 1 krysí samici pozorován nádor z NE-buněk žaludku bez souběžných proliferativních změn ECL-buněk (viz Neklinická toxikologie ].
Endokrinní účinky
klinické farmakologické studii neměl PROTONIX 40 mg podávaný jednou denně po dobu 2 týdnů žádný vliv na hladiny následujících hormonů: kortizol, testosteron, trijodtyronin (T3), tyroxin (T4), hormon stimulující štítnou žlázu (TSH), thyronin- vazebný protein, parathormon, inzulín, glukagon, renin, aldosteron, folikuly stimulující hormon, luteinizační hormon, prolaktin a růstový hormon.
V jednoleté studii u pacientů s GERD léčených PROTONIXEM 40 mg nebo 20 mg nedošlo k žádným změnám oproti výchozí hodnotě v celkových hladinách T3, T4 a TSH.
Farmakokinetika
PROTONIX 40 mg tablety s opožděným uvolňováním se připravují jako enterosolventní tablety, takže absorpce pantoprazolu začíná až poté, co tableta opustí žaludek. Maximální sérová koncentrace (Cmax) a plocha pod křivkou sérové koncentrace v čase (AUC) se zvyšují úměrně perorálním a intravenózním dávkám od 10 mg do 80 mg. Pantoprazol se nekumuluje a jeho farmakokinetika se při opakovaném denním dávkování nemění. Po perorálním nebo intravenózním podání klesá sérová koncentrace pantoprazolu biexponenciálně s konečným poločasem eliminace přibližně jedna hodina.
extenzivních metabolizátorů s normální funkcí jater, kteří dostávají perorální dávku enterosolventní 40mg tablety pantoprazolu, je maximální koncentrace (Cmax) 2,5 μg/ml; čas k dosažení maximální koncentrace (tmax) je 2,5 h a průměrná celková plocha pod křivkou plazmatické koncentrace v závislosti na čase (AUC) je 4,8 μg•h/ml (rozsah 1,4 až 13,3 μg•h/ml). Po intravenózním podání pantoprazolu rychlým metabolizátorům je jeho celková clearance 7,6-14,0 l/h a jeho zdánlivý distribuční objem je 11,0-23,6 l.
Jedna perorální dávka přípravku PROTONIX pro perorální suspenzi s opožděným uvolňováním, 40 mg, se ukázala jako bioekvivalentní, když byla podávána zdravým subjektům (N = 22) jako granule posypané čajovou lžičkou jablečného pyré, jako granule smíchané s jablečným džusem nebo smíchané s jablečný džus s následným podáním nazogastrickou sondou. Farmakokinetické parametry plazmy ze zkřížené studie u zdravých subjektů jsou shrnuty v tabulce 6.
Vstřebávání
Po podání jedné nebo více perorálních dávek 40 mg přípravku PROTONIX 20 mg tablety s opožděným uvolňováním bylo maximální plazmatické koncentrace pantoprazolu dosaženo přibližně za 2,5 hodiny a Cmax byla 2,5 μg/ml. Pantoprazol podléhá malému metabolismu při prvním průchodu játry, což má za následek absolutní biologickou dostupnost přibližně 77 %. Absorpce pantoprazolu není ovlivněna současným podáváním antacidů.
Podávání tablet PROTONIX s odloženým uvolňováním s jídlem může zpozdit jeho absorpci až o 2 hodiny nebo déle; nicméně Cmax a rozsah absorpce pantoprazolu (AUC) se nemění. Proto lze užívat PROTONIX 40 mg tablety s opožděným uvolňováním bez ohledu na načasování jídla.
Podání granulí pantoprazolu, 40 mg, s jídlem s vysokým obsahem tuku prodloužilo střední dobu dosažení maximální plazmatické koncentrace o 2 hodiny. Při souběžném jídle s vysokým obsahem tuků se Cmax a AUC granulí pantoprazolu, 40 mg, posypaných jablečným pyré, snížily o 51 % a 29 %. Proto by se měl PROTONIX 20 mg pro perorální suspenzi s opožděným uvolňováním užívat přibližně 30 minut před jídlem.
Rozdělení
Zdánlivý distribuční objem pantoprazolu je přibližně 11 až 23,6 l, distribuuje se hlavně v extracelulární tekutině. Vazba pantoprazolu na sérové proteiny je asi 98 %, primárně na albumin.
Odstranění
Metabolismus
Pantoprazol je rozsáhle metabolizován v játrech prostřednictvím systému cytochromu P450 (CYP). Metabolismus pantoprazolu je nezávislý na způsobu podání (intravenózní nebo perorální). Hlavní metabolickou cestou je demethylace prostřednictvím CYP2C19 s následnou sulfatací; další metabolické cesty zahrnují oxidaci CYP3A4. Neexistují žádné důkazy o tom, že by některý z metabolitů pantoprazolu měl významnou farmakologickou aktivitu.
Vylučování
Po jednorázové perorální nebo intravenózní dávce pantoprazolu značeného 14C zdravým subjektům s normálním metabolizmem bylo přibližně 71 % dávky vyloučeno močí a 18 % vyloučeno stolicí prostřednictvím žlučové exkrece. Nezměněný pantoprazol se ledvinami nevylučoval.
Specifické populace
Geriatričtí pacienti
Pouze mírné až střední zvýšení AUC (43 %) a Cmax (26 %) pantoprazolu bylo zjištěno u starších subjektů (ve věku 64 až 76 let) po opakovaném perorálním podání ve srovnání s mladšími subjekty (viz Použití u konkrétních populací ].
Pediatričtí pacienti
Farmakokinetika pantoprazolu byla studována u dětí mladších 16 let ve čtyřech randomizovaných, otevřených klinických studiích u pediatrických pacientů s předpokládanou/prokázanou GERD. Formulace granulí pro děti byla studována u dětí ve věku do 5 let a PROTONIX 40 mg tablety s opožděným uvolňováním byly studovány u dětí starších 5 let.
V populační PK analýze se celková clearance zvyšovala s rostoucí tělesnou hmotností nelineárním způsobem. Celková clearance se také zvyšovala s rostoucím věkem pouze u dětí do 3 let.
Novorozenec do 5 let věku
[vidět Použití u konkrétních populací ]
Děti a dospívající od 6 do 16 let
Farmakokinetika přípravku PROTONIX Tablety s opožděným uvolňováním byla hodnocena u dětí ve věku 6 až 16 let s klinickou diagnózou GERD. Farmakokinetické parametry po jednorázové perorální dávce 20 mg nebo 40 mg tablet PROTONIX 40 mg u dětí ve věku 6 až 16 let byly vysoce variabilní (% CV se pohybuje v rozmezí 40 až 80 %). Geometrický průměr AUC odhadnutý z populační farmakokinetické analýzy po 40 mg tabletě PROTONIX 40 mg u pediatrických pacientů byl asi o 39 % a 10 % vyšší u dětí ve věku 6 až 11 a 12 až 16 let ve srovnání s dospělými (tabulka 7). .
Mužské A ženské pacienty
U žen ve srovnání s muži dochází k mírnému zvýšení AUC a Cmax pantoprazolu. Hodnoty clearance normalizované na hmotnost jsou však u žen a mužů podobné.
U pediatrických pacientů ve věku 1 až 16 let nebyly pozorovány žádné klinicky relevantní účinky pohlaví na clearance pantoprazolu, jak ukázala populační farmakokinetická analýza.
Pacienti s poruchou ledvin
pacientů s těžkou poruchou funkce ledvin byly farmakokinetické parametry pantoprazolu podobné jako u zdravých subjektů.
Pacienti s poruchou funkce jater
U pacientů s mírnou až těžkou poruchou funkce jater (Child-Pugh A až C cirhóza) se maximální koncentrace pantoprazolu zvýšily pouze mírně (1,5krát) ve srovnání se zdravými subjekty. Přestože se hodnoty sérového poločasu zvýšily na 7-9 hodin a hodnoty AUC se zvýšily 5 až 7krát u pacientů s poruchou funkce jater, tato zvýšení nebyla větší než ta, která byla pozorována u pomalých metabolizátorů CYP2C19, kde není nutná úprava dávkování. Tyto farmakokinetické změny u pacientů s poruchou funkce jater vedou k minimální akumulaci léku po podání více dávek jednou denně. Dávky vyšší než 40 mg/den nebyly studovány u pacientů s poruchou funkce jater.
Studie lékových interakcí
Vliv jiných léků na pantoprazol
Pantoprazol je metabolizován hlavně CYP2C19 a v menší míře CYP 3A4, 2D6 a 2C9. Ve studiích lékových interakcí in vivo se substráty CYP2C19 (diazepam [také substrát CYP3A4] a fenytoin [také induktor CYP3A4] a klopidogrel), nifedipin, midazolam a klarithromycin (substráty CYP3A4), metoprolol (substrát CYP2D6), dic naproxenu a piroxikamu (substráty CYP2C9) a theofylinu (substrát CYP1A2) u zdravých subjektů nebyla farmakokinetika pantoprazolu významně změněna.
Vliv Pantoprazolu Na Jiné Léky
clopidogrel
Klopidogrel je metabolizován na svůj aktivní metabolit částečně prostřednictvím CYP2C19. Ve zkřížené klinické studii byl 66 zdravým subjektům podáván klopidogrel (300 mg nasycovací dávka následovaná 75 mg denně) samotný a s pantoprazolem (80 mg ve stejnou dobu jako klopidogrel) po dobu 5 dnů. V den 5 byla průměrná AUC aktivního metabolitu klopidogrelu snížena přibližně o 14 % (geometrický průměrný poměr byl 86 %, s 90% CI 79 až 93 %), když byl pantoprazol podáván současně s klopidogrelem ve srovnání s klopidogrelem podávaným samostatně. Farmakodynamické parametry byly také měřeny a prokázaly, že změna v inhibici agregace krevních destiček (indukovaná 5 μM ADP) korelovala se změnou expozice aktivnímu metabolitu klopidogrelu. Klinický význam tohoto nálezu není jasný.
Mykofenolát mofetil (MMF)
Podávání pantoprazolu 40 mg dvakrát denně po dobu 4 dnů a jednorázová dávka 1000 mg MMF přibližně jednu hodinu po poslední dávce pantoprazolu 12 zdravým subjektům ve zkřížené studii vedlo ke snížení Cmax o 57 % a snížení o 27 %. v AUC MPA. Pacienti po transplantaci, kteří dostávali přibližně 2000 mg MMF denně (n=12), byli srovnáváni s pacienty po transplantaci, kteří dostávali přibližně stejnou dávku MMF a pantoprazolu 40 mg denně (n=21). U pacientů užívajících pantoprazol i MMF došlo k 78% snížení Cmax a 45% snížení AUC MPA (viz DROGOVÉ INTERAKCE ].
Jiné drogy
Studie in vivo také naznačují, že pantoprazol významně neovlivňuje kinetiku následujících léků (cisaprid, theofylin, diazepam [a jeho aktivní metabolit, desmethyldiazepam], fenytoin, metoprolol, nifedipin, karbamazepin, midazolam, klarithromycin, diklofenak, naproxen a perorální antikoncepce [levonorgestrel/ethinylestradiol]). V jiných studiích in vivo neměly digoxin, ethanol, glyburid, antipyrin, kofein, metronidazol a amoxicilin žádné klinicky významné interakce s pantoprazolem.
Přestože v klinických studiích nebyly pozorovány žádné významné lékové interakce, potenciál pro významné lékové interakce při podávání vysokých dávek pantoprazolu více než jednou denně nebyl studován u pomalých metabolizátorů nebo jedinců s poruchou funkce jater.
Antacida
Rovněž nedošlo k žádné interakci se současně podávanými antacidy.
Farmakogenomika
CYP2C19 vykazuje známý genetický polymorfismus v důsledku jeho nedostatku v některých subpopulacích (např. přibližně 3 % bělochů a Afroameričanů a 17 % až 23 % Asiatů jsou pomalí metabolizátoři). Ačkoli tyto subpopulace pomalých metabolizátorů pantoprazolu mají hodnoty poločasu eliminace 3,5 až 10 hodin u dospělých, stále dochází k minimální akumulaci (23 % nebo méně) při dávkování jednou denně. U dospělých pacientů, kteří jsou pomalými metabolizátory CYP2C19, není nutná úprava dávkování.
Podobně jako u dospělých vykazovali dětští pacienti, kteří mají genotyp pomalého metabolizátoru CYP2C19 (CYP2C19 *2/*2), více než 6násobné zvýšení AUC ve srovnání s pediatrickými pacienty s extenzivním (CYP2C19 *1/*1) a středním (CYP2C19 *1 /*x) metabolizátoři. Slabí metabolizátoři vykazovali přibližně 10krát nižší zdánlivou perorální clearance ve srovnání s extenzivními metabolizátory.
U známých pediatrických pomalých metabolizátorů je třeba zvážit snížení dávky.
Klinické studie
PROTONIX 20 mg tablety s opožděným uvolňováním byly použity v následujících klinických studiích.
Erozivní ezofagitida (EE) spojená s gastroezofageální refluxní chorobou (GERD)
Dospělí pacienti
Multicentrická, dvojitě zaslepená, placebem kontrolovaná studie v USA s přípravkem PROTONIX 10 mg, 20 mg nebo 40 mg jednou denně byla provedena u 603 pacientů s příznaky refluxu a endoskopicky diagnostikovanou EE stupně 2 nebo vyšším (Hetzel-Dentova škála). V této studii mělo přibližně 25 % zařazených pacientů závažnou EE stupně 3 a 10 % mělo stupeň 4. Procenta pacientů vyléčených (podle protokolu, n = 541) v této studii jsou uvedena v tabulce 8.
V této studii měly všechny léčebné skupiny PROTONIX významně vyšší rychlost hojení než skupina s placebem. To platilo bez ohledu na stav H. pylori pro léčebné skupiny 40 mg a 20 mg PROTONIX 40 mg. Dávka 40 mg přípravku PROTONIX 20 mg vedla k výrazně vyšším rychlostem hojení než u dávky 20 mg nebo 10 mg.
Významně větší část pacientů užívajících PROTONIX 40 mg zaznamenala úplnou úlevu od denního a nočního pálení žáhy a absenci regurgitace, počínaje prvním dnem léčby, ve srovnání s placebem. Pacienti užívající PROTONIX konzumovali významně méně antacidových tablet denně než pacienti užívající placebo.
PROTONIX 40 mg a 20 mg jednou denně byl také srovnáván s nizatidinem 150 mg dvakrát denně v americké multicentrické, dvojitě zaslepené studii s 243 pacienty s příznaky refluxu a endoskopicky diagnostikovanou EE stupně 2 nebo vyšším. Procenta vyléčených pacientů (podle protokolu, n = 212) jsou uvedena v tabulce 9.
Léčba jednou denně přípravkem PROTONIX 40 mg nebo 20 mg vedla k významně lepší rychlosti hojení po 4 i 8 týdnech ve srovnání s léčbou dvakrát denně se 150 mg nizatidinu. U skupiny léčené 40 mg bylo dosaženo významně vyšší rychlosti hojení ve srovnání s nizatidinem bez ohledu na stav H. pylori.
Významně větší část pacientů ve skupinách léčených PROTONIXem zaznamenala úplnou úlevu od nočního pálení žáhy a regurgitace, počínaje prvním dnem a denního pálení žáhy druhý den, ve srovnání s těmi, kteří užívali nizatidin 150 mg dvakrát denně. Pacienti užívající PROTONIX konzumovali významně méně antacidových tablet denně než pacienti užívající nizatidin.
Pediatričtí pacienti ve věku od 5 do 16 let
Účinnost přípravku PROTONIX v léčbě EE související s GERD u dětských pacientů ve věku 5 až 16 let je extrapolována z adekvátních a dobře provedených studií u dospělých, protože se předpokládá, že patofyziologie je stejná. Čtyři dětští pacienti s endoskopicky diagnostikovanou EE byli studováni v multicentrických, randomizovaných, dvojitě zaslepených studiích s paralelní léčbou. Děti s endoskopicky diagnostikovanou EE (definovanou jako endoskopické Hetzel-Dentovo skóre ≥2) byly léčeny jednou denně po dobu 8 týdnů jednou ze dvou úrovní dávek PROTONIXu (20 mg nebo 40 mg). Všichni 4 pacienti s EE byli vyléčeni (Hetzel-Dentovo skóre 0 nebo 1) po 8 týdnech.
Dlouhodobá údržba hojení erozivní ezofagitidy
Dvě nezávislé, multicentrické, randomizované, dvojitě zaslepené, komparátorem kontrolované studie stejného designu byly provedeny u dospělých pacientů s GERD s endoskopicky potvrzenou zhojenou EE, aby se prokázala účinnost přípravku PROTONIX při dlouhodobém udržení hojení. Dvě studie v USA zahrnovaly 386 a 404 pacientů, kteří dostávali buď 10 mg, 20 mg nebo 40 mg PROTONIX 40 mg tablety s opožděným uvolňováním jednou denně nebo 150 mg ranitidinu dvakrát denně. Jak je ukázáno v tabulce 10, PROTONIX 40 mg a 20 mg byly významně lepší než ranitidin v každém časovém bodě s ohledem na udržení hojení. Navíc PROTONIX 40 mg byl lepší než všechny ostatní studované léčby.
PROTONIX 40 mg byl lepší než ranitidin ve snížení počtu denních a nočních epizod pálení žáhy od prvního do dvanáctého měsíce léčby. PROTONIX 20 mg podávaný jednou denně byl také účinný při snižování epizod denního a nočního pálení žáhy v jedné studii, jak je uvedeno v tabulce 11.
Patologické hypersekreční stavy včetně Zollinger-Ellisonova syndromu
multicentrické, otevřené studii s 35 pacienty s patologickými stavy hypersekrece, jako je Zollingerův-Ellisonův syndrom, s mnohočetnou endokrinní neoplazií typu I nebo bez ní, PROTONIX úspěšně kontroloval sekreci žaludeční kyseliny. Dávky v rozmezí od 80 mg denně do 240 mg denně udržovaly produkci žaludeční kyseliny pod 10 mEq/h u pacientů bez předchozího chirurgického zákroku na snížení kyselosti a pod 5 mEq/h u pacientů s předchozím chirurgickým zákrokem na snížení kyselosti.
Dávky byly zpočátku titrovány podle individuálních potřeb pacienta a u některých pacientů upraveny na základě klinické odpovědi s časem [viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. PROTONIX 40 mg byl v těchto dávkách dobře snášen po dlouhou dobu (u některých pacientů déle než 2 roky).
INFORMACE PRO PACIENTA
PROTONIX (pro-TAH-nix) (pantoprazol sodný) tablety s opožděným uvolňováním a PROTONIX (pro-TAH-nix) (pantoprazol sodný) pro perorální suspenzi s opožděným uvolňováním
Jaké jsou nejdůležitější informace, které bych měl vědět o PROTONIXu?
Měl(a) byste užívat PROTONIX 20 mg přesně podle předpisu, v nejnižší možné dávce a po co nejkratší potřebnou dobu.
PROTONIX může pomoci vašim příznakům souvisejícím s kyselinou, ale přesto můžete mít vážné žaludeční problémy. Promluvte si se svým lékařem.
PROTONIX může způsobit závažné nežádoucí účinky, včetně:
- Typ ledvinového problému (akutní tubulointersticiální nefritida). U některých lidí, kteří užívají léky na bázi inhibitoru protonové pumpy (PPI), včetně přípravku PROTONIX 40 mg, se může rozvinout problém s ledvinami nazývaný akutní tubulointersticiální nefritida, který se může objevit kdykoli během léčby přípravkem PROTONIX. Okamžitě zavolejte svého lékaře, pokud se sníží množství moči nebo pokud máte krev v moči.
- Průjem způsobený infekcí (Clostridium difficile) ve střevech. Okamžitě zavolejte svého lékaře, pokud máte vodnatou stolici nebo bolesti žaludku, které neustupují. Můžete a nemusíte mít horečku.
- Zlomeniny kostí (kyčle, zápěstí nebo páteře). Zlomeniny kostí v kyčli, zápěstí nebo páteři se mohou objevit u lidí, kteří užívají více denních dávek léků PPI a po dlouhou dobu (rok nebo déle). Informujte svého lékaře, pokud máte zlomeninu kosti, zejména v kyčli, zápěstí nebo páteři.
- Některé typy lupus erythematodes. Lupus erythematodes je autoimunitní porucha (imunitní buňky těla napadají jiné buňky nebo orgány v těle). U některých lidí, kteří užívají léky na PPI, včetně přípravku PROTONIX 40 mg, se mohou vyvinout určité typy lupus erythematodes nebo se u nich již lupus zhorší. Okamžitě zavolejte svého lékaře, pokud máte novou nebo zhoršující se bolest kloubů nebo vyrážku na tvářích nebo pažích, která se zhoršuje na slunci.
Poraďte se se svým lékařem o riziku těchto závažných nežádoucích účinků.
PROTONIX může mít další závažné nežádoucí účinky. Vidět "Jaké jsou možné vedlejší účinky PROTONIXu?"
Co je PROTONIX 20 mg?
Lék na předpis nazývaný inhibitor protonové pumpy (PPI), který se používá ke snížení množství kyseliny ve vašem žaludku.
U dospělých, PROTONIX se používá pro:
- až 8 týdnů pro hojení a zmírnění symptomů poškození sliznice jícnu souvisejícího s kyselinou (nazývané erozivní ezofagitida nebo EE). Váš lékař může pacientům, jejichž EE se nehojí, předepsat dalších 8 týdnů přípravku PROTONIX 20 mg.
- udržení hojení EE a pomoci zabránit návratu příznaků pálení žáhy způsobených GERD. Není známo, zda je PROTONIX 40 mg bezpečný a účinný, pokud je pro tento účel používán déle než 12 měsíců.
- dlouhodobá léčba stavů, kdy váš žaludek tvoří příliš mnoho kyseliny. To zahrnuje vzácný stav nazývaný Zollinger-Ellisonův syndrom.
U dětí ve věku 5 let a starších, PROTONIX se používá pro:
- až 8 týdnů pro vyléčení a zmírnění symptomů EE. Není známo, zda je PROTONIX 20 mg bezpečný, pokud je u dětí používán déle než 8 týdnů.
PROTONIX 20 mg není určen k použití u dětí do 5 let. Není známo, zda je PROTONIX 40 mg bezpečný a účinný u dětí pro jinou léčbu než EE.
Neužívejte PROTONIX 20 mg, pokud:
- alergický na sodnou sůl pantoprazolu, jakýkoli jiný lék PPI nebo na kteroukoli složku přípravku PROTONIX. Úplný seznam složek najdete na konci této Příručky pro léky.
- užívání léku, který obsahuje rilpivirin (EDURANT, COMPLERA, ODEFSEY, JULUCA) používaný k léčbě HIV-1 (virus lidské imunodeficience).
Před užitím přípravku PROTONIX informujte svého lékaře o všech svých zdravotních potížích, včetně toho, zda:
- máte nízké hladiny hořčíku v krvi.
- jste těhotná nebo plánujete otěhotnět. PROTONIX 40 mg může poškodit vaše nenarozené dítě. Informujte svého lékaře, pokud během léčby přípravkem PROTONIX otěhotníte nebo si myslíte, že byste mohla být těhotná.
- kojíte nebo plánujete kojit. PROTONIX může přecházet do vašeho mateřského mléka. Promluvte si se svým lékařem o nejlepším způsobu krmení dítěte, pokud užíváte PROTONIX.
Informujte svého lékaře o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků. Zvláště informujte svého lékaře, pokud užíváte metotrexát (Otrexup, Rasuvo, Trexall, XATMEP), digoxin (LANOXIN) nebo vodní pilulka (diuretikum).
Jak mám užívat PROTONIX 20 mg?
- Užívejte PROTONIX 40 mg přesně podle pokynů svého lékaře.
PROTONIX tablety s opožděným uvolňováním (PROTONIX 20 mg tablety):
-
- Tablety PROTONIX 40 mg nerozdělujte, nežvýkejte ani nedrťte.
- Tablety PROTONIX 20 mg polykejte celé, s jídlem nebo bez jídla.
- Informujte svého lékaře, pokud nejste schopen spolknout tabletu PROTONIX 20 mg.
- Během užívání tablet PROTONIX 40 mg můžete užívat antacida.
PROTONIX 40 mg pro perorální suspenzi s opožděným uvolňováním (PROTONIX pro perorální suspenzi):
-
- PROTONIX 20 mg pro perorální suspenzi nerozdělujte, nežvýkejte ani nedrťte.
- Užívejte PROTONIX 40 mg pro perorální suspenzi asi 30 minut před jídlem.
- PROTONIX pro perorální suspenzi se má podávat pouze ústy smíchaným s jablečným džusem nebo jablečným pyré nebo nasogastrickou (NG) sondou nebo gastrostomickou sondou smíchanou s jablečným džusem. Nemíchejte PROTONIX pro perorální suspenzi s jinými tekutinami než s jablečným džusem nebo jinými potravinami než s jablečným pyré.
- Nerozdělujte balíček PROTONIX 20 mg pro perorální suspenzi, abyste vytvořili menší dávku.
- Viz "Návod k použití" na konci této Příručky k lékům najdete pokyny, jak smíchat a užívat PROTONIX 40 mg pro perorální suspenzi ústy v jablečném nebo jablečném džusu nebo jak smíchat a podat suspenzi NG sondou nebo gastrostomickou sondou smíchanou s jablečnou šťávou.
- Pokud vynecháte dávku přípravku PROTONIX, vezměte si ji co nejdříve. Pokud je téměř čas na další dávku, neužívejte vynechanou dávku. Užijte další dávku v obvyklou dobu. Neužívejte 2 dávky současně.
- Pokud užijete příliš mnoho přípravku PROTONIX, okamžitě zavolejte svého lékaře nebo své toxikologické centrum na číslo 1-800-222-1222 nebo jděte na nejbližší pohotovost.
Jaké jsou možné vedlejší účinky přípravku PROTONIX 40 mg?
PROTONIX 20 mg může způsobit závažné nežádoucí účinky, včetně:
- Vidět "Jaké jsou nejdůležitější informace, které bych měl vědět o PROTONIX?"
- Nízká hladina vitaminu B-12 ve vašem těle může nastat u lidí, kteří užívali PROTONIX 40 mg po dlouhou dobu (více než 3 roky). Informujte svého lékaře, pokud máte příznaky nízké hladiny vitaminu B-12, včetně dušnosti, točení hlavy, nepravidelného srdečního tepu, svalové slabosti, bledé kůže, pocitu únavy, změn nálady a brnění nebo necitlivosti v pažích a nohou.
- Nízká hladina hořčíku ve vašem těle může nastat u lidí, kteří užívali PROTONIX po dobu alespoň 3 měsíců. Informujte svého lékaře, pokud máte příznaky nízké hladiny hořčíku, včetně záchvatů, závratí, nepravidelného srdečního tepu, nervozity, bolesti svalů nebo slabosti a křečí rukou, nohou nebo hlasu.
- Výrůstky žaludku (polypy fundické žlázy). Lidé, kteří dlouhodobě užívají léky PPI, mají zvýšené riziko vzniku určitého typu žaludečních výrůstků nazývaných polypy fundických žláz, zejména po užívání léků PPI déle než 1 rok.
Mezi nejčastější nežádoucí účinky přípravku PROTONIX 40 mg u dospělých patří: bolest hlavy, průjem, nevolnost, bolest v oblasti žaludku (břicha), zvracení, plynatost, závratě a bolesti kloubů.
Mezi nejčastější nežádoucí účinky přípravku PROTONIX 40 mg u dětí patří: infekce horních cest dýchacích, bolest hlavy, horečka, průjem, zvracení, vyrážka a bolest v oblasti žaludku (břicha). To nejsou všechny možné vedlejší účinky přípravku PROTONIX. Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám PROTONIX 40 mg uchovávat?
Uchovávejte PROTONIX 20 mg při pokojové teplotě mezi 68 °F až 77 °F (20 °C až 25 °C).
Uchovávejte PROTONIX a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a efektivním používání přípravku PROTONIX.
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Nepoužívejte PROTONIX na stav, pro který nebyl předepsán. Nedávejte PROTONIX 20 mg jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit. Můžete požádat svého lékaře nebo lékárníka o informace o přípravku PROTONIX 20 mg, které jsou určeny pro zdravotníky.
Jaké složky obsahuje PROTONIX?
Aktivní složka: seskvihydrát pantoprazolu sodného
Neaktivní složky v tabletách s opožděným uvolňováním PROTONIX: stearát vápenatý, krospovidon, hypromelóza, oxid železitý, mannitol, kopolymer kyseliny methakrylové, polysorbát 80, povidon, propylenglykol, uhličitan sodný, laurylsulfát sodný, oxid titaničitý a triethylcitrát.
Neaktivní složky v PROTONIX 40 mg pro perorální suspenzi s opožděným uvolňováním: krospovidon, hypromelóza, kopolymer kyseliny methakrylové, mikrokrystalická celulóza, polysorbát 80, povidon, uhličitan sodný, laurylsulfát sodný, mastek, oxid titaničitý, triethylcitrát a žlutý oxid železitý.
Návod k použití
PROTONIX (pro-TAH-nix) (pantoprazol sodný) pro perorální suspenzi s opožděným uvolňováním
PROTONIX 40 mg s opožděným uvolňováním perorální suspenze (PROTONIX 40 mg pro perorální suspenzi):
Důležitá informace:
- PROTONIX pro perorální suspenzi neštípejte, nežvýkejte ani nedrťte.
- Užívejte PROTONIX pro perorální suspenzi asi 30 minut před jídlem.
- PROTONIX pro perorální suspenzi:
- by měl užívat pouze s jablečným pyré nebo jablečnou šťávou.
- by měl nemíchat ve vodě nebo jiných tekutinách nebo jiných potravinách.
- balení by se nemělo dělit, aby se vytvořila menší dávka.
Užívání PROTONIX 20 mg pro perorální suspenzi s jablečným pyré:
Užívání PROTONIX 40 mg pro perorální suspenzi s jablečnou šťávou:
Podávání přípravku PROTONIX 40 mg pro perorální suspenzi nazogastrickou (NG) sondou nebo gastrostomickou sondou:
- PROTONIX pro perorální suspenzi lze podávat pomocí NG sondy nebo gastrostomické sondy velikost 16 French nebo větší. Nepodávejte PROTONIX 20 mg pro perorální suspenzi NG sondou nebo gastrostomickou sondou menší než velikost 16 French.
- Směs PROTONIX 20 mg pro perorální suspenzi pouze v jablečné šťávě při podávání NG sondou nebo gastrostomickou sondou.
Jak mám PROTONIX 20 mg uchovávat?
Uchovávejte PROTONIX 20 mg při pokojové teplotě mezi 68 °F až 77 °F (20 °C až 25 °C).
Uchovávejte PROTONIX 40 mg a všechny léky mimo dosah dětí.
Tento návod k použití a návod k použití byl schválen Úřadem pro kontrolu potravin a léčiv USA.
