Prilosec 40mg, 10mg, 20mg Omeprazole Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Prilosec 40 mg a jak se používá?
Prilosec 40 mg je lék na předpis a volně prodejný lék používaný k léčbě příznaků gastroezofageální refluxní choroby (GERD), žaludečních vředů a dalších stavů způsobených nadbytkem žaludeční kyseliny. Prilosec 10 mg lze užívat samostatně nebo s jinými léky.
Prilosec patří do třídy léků nazývaných inhibitory protonové pumpy.
Není známo, zda je přípravek Prilosec 40 mg bezpečný a účinný u dětí mladších 1 měsíce.
Jaké jsou možné nežádoucí účinky přípravku Prilosec 10 mg?
Prilosec může způsobit závažné nežádoucí účinky včetně:
- silná bolest žaludku,
- průjem, který je vodnatý nebo krvavý,
- nová nebo neobvyklá bolest zápěstí, stehna, kyčle nebo zad,
- záchvat (křeče),
- malé nebo žádné močení,
- krev ve vaší moči,
- otok,
- rychlý nárůst hmotnosti,
- závrať,
- nepravidelný srdeční tep,
- pocit nervozity,
- svalové křeče,
- svalové křeče,
- kašel,
- pocit dušení,
- bolesti kloubů a
- kožní vyrážka na tvářích nebo pažích, která se zhoršuje slunečním zářením
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Prilosec patří:
- bolest břicha,
- plyn,
- nevolnost,
- zvracení,
- průjem a
- bolest hlavy
POPIS
Účinná látka v kapslích PRILOSEC (omeprazol) s opožděným uvolňováním je substituovaný benzimidazol, 5-methoxy-2-[[(4-methoxy-3,5-dimethyl-2-pyridinyl)methyl]sulfinyl]-1H-benzimidazol, sloučenina, která inhibuje sekreci žaludeční kyseliny. Jeho empirický vzorec je C17H19N3O3S s molekulovou hmotností 345,42. Strukturní vzorec je:
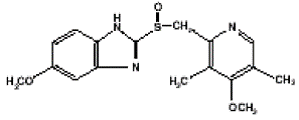
Omeprazol je bílý až téměř bílý krystalický prášek, který taje za rozkladu při přibližně 155 °C. Je to slabá báze, volně rozpustná v ethanolu a methanolu a mírně rozpustná v acetonu a isopropanolu a velmi málo rozpustná ve vodě. Stabilita omeprazolu je funkcí pH; rychle se odbourává v kyselém prostředí, ale má přijatelnou stabilitu za alkalických podmínek.
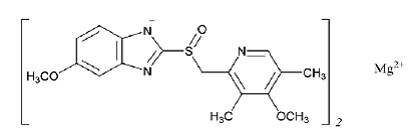
Aktivní složkou přípravku PRILOSEC (omeprazol magnesium) pro perorální suspenzi s opožděným uvolňováním je 5-methoxy-2-[[(4-methoxy-3,5-dimethyl-2-pyridinyl)methyl]sulfinyl]-1H-benzimidazol, magnesium sůl (2:1)
Omeprazol magnesium je bílý až téměř bílý prášek s bodem tání s degradací při 200 °C. Sůl je mírně rozpustná (0,25 mg/ml) ve vodě při 25 °C a je rozpustná v methanolu. Poločas rozpadu je vysoce závislý na pH.
Empirický vzorec pro omeprazol magnesium je (C17H18N3O3S)2 Mg, molekulová hmotnost je 713,12 a strukturní vzorec je:
PRILOSEC se dodává jako tobolky s opožděným uvolňováním pro perorální podání. Každá tobolka s opožděným uvolňováním obsahuje buď 10 mg, 20 mg nebo 40 mg omeprazolu ve formě enterosolventních granulí s následujícími neaktivními složkami: celulóza, hydrogenfosforečnan sodný, hydroxypropylcelulóza, hypromelóza, laktóza, mannitol, laurylsulfát sodný a další ingredience. Obaly tobolek obsahují následující neaktivní složky: želatina-NF, FD&C Blue #1, FD&C Red #40, D&C Red #28, oxid titaničitý, syntetický černý oxid železitý, isopropanol, butylalkohol, FD&C Blue #2, D&C Red #7 Calcium Lake a navíc 10 mg a 40 mg obaly tobolek také obsahují D&C Yellow #10.
Každé balení PRILOSEC pro perorální suspenzi s opožděným uvolňováním obsahuje buď 2,8 mg nebo 11,2 mg omeprazolu magnesium (odpovídá 2,5 mg nebo 10 mg omeprazolu), ve formě enterosolventních granulí s následujícími neúčinnými složkami: glycerylmonostearát, hydroxypropyl celulóza, hypromelóza, stearát hořečnatý, kopolymer C kyseliny methakrylové, polysorbát, kuličky cukru, mastek a triethylcitrát a také neaktivní granule. Neaktivní granule se skládají z následujících složek: kyselina citrónová, krospovidon, dextróza, hydroxypropylcelulóza, oxid železitý a xanthamová guma. Granule omeprazolu a neaktivní granule se konstituují s vodou za vzniku suspenze a podávají se orálně, nasogastricky nebo přímo do žaludku.
INDIKACE
Léčba aktivního duodenálního vředu
PRILOSEC 20 mg je indikován ke krátkodobé léčbě aktivního duodenálního vředu u dospělých. Většina pacientů se uzdraví do čtyř týdnů. Někteří pacienti mohou vyžadovat další čtyři týdny terapie.
Eradikace Helicobacter pylori ke snížení rizika recidivy duodenálního vředu
Bylo prokázáno, že eradikace H. pylori snižuje riziko recidivy duodenálního vředu.
Trojitá terapie
PRILOSEC 40 mg v kombinaci s klarithromycinem a amoxicilinem je indikován k léčbě pacientů s infekcí H. pylori a duodenální vředovou chorobou (aktivní nebo až 1 rok v anamnéze) k eradikaci H. pylori u dospělých.
Duální terapie
PRILOSEC v kombinaci s klarithromycinem je indikován k léčbě pacientů s infekcí H. pylori a duodenální vředovou chorobou k eradikaci H. pylori u dospělých.
U pacientů, u kterých selhala terapie, je PRILOSEC s klarithromycinem pravděpodobněji spojen s rozvojem rezistence na klarithromycin ve srovnání s trojkombinací. U pacientů, u kterých léčba selže, by mělo být provedeno testování citlivosti. Pokud je prokázána rezistence na klarithromycin nebo testování citlivosti není možné, měla by být zahájena alternativní antimikrobiální léčba (viz KLINICKÁ FARMAKOLOGIE informace o předepisování claritromycinu, sekce Mikrobiologie].
Léčba aktivního benigního žaludečního vředu
PRILOSEC je indikován ke krátkodobé léčbě (4 až 8 týdnů) aktivního benigního žaludečního vředu u dospělých.
Léčba symptomatické gastroezofageální refluxní choroby (GERD)
PRILOSEC je indikován k léčbě pálení žáhy a dalších příznaků spojených s GERD po dobu až 4 týdnů u pacientů ve věku 1 rok a starších.
Léčba erozivní ezofagitidy (EE) způsobené kyselinou zprostředkovanou GERD
Pediatričtí pacienti od 1 roku věku až po dospělé
PRILOSEC 20 mg je indikován ke krátkodobé léčbě (4 až 8 týdnů) EE způsobené kyselinou zprostředkovanou GERD, která byla diagnostikována endoskopií u pacientů ve věku 1 rok a starších.
Účinnost přípravku PRILOSEC 10 mg užívaného déle než 8 týdnů u pacientů s EE nebyla stanovena. Pokud pacient nereaguje na 8týdenní léčbu, lze mu podat další 4 týdny léčby. Pokud dojde k recidivě příznaků EE nebo GERD (např. pálení žáhy), lze zvážit další 4 až 8 týdenní kúry přípravku PRILOSEC.
Pediatričtí pacienti ve věku 1 měsíc až méně než 1 rok
PRILOSEC je indikován ke krátkodobé léčbě (až 6 týdnů) EE způsobené kyselinou zprostředkovanou GERD u pediatrických pacientů ve věku od 1 měsíce do méně než 1 roku.
Udržování hojení EE v důsledku kyselinou zprostředkovaného GERD
PRILOSEC 40 mg je indikován k udržovacímu hojení EE způsobené kyselinou zprostředkovanou GERD u pacientů ve věku 1 rok a starších.
Kontrolované studie nepřesahují 12 měsíců.
Patologické hypersekreční stavy
PRILOSEC 40 mg je indikován k dlouhodobé léčbě patologických stavů s hypersekrecí (např. Zollinger-Ellisonův syndrom, mnohočetné endokrinní adenomy a systémová mastocytóza) u dospělých.
DÁVKOVÁNÍ A PODÁVÁNÍ
Doporučený dávkovací režim pro dospělé podle indikace
Tabulka 1 ukazuje doporučené dávkování přípravku PRILOSEC 40 mg u dospělých pacientů podle indikace.
Doporučený pediatrický dávkovací režim podle indikace
Tabulka 2 ukazuje doporučené dávkování přípravku PRILOSEC u dětských pacientů podle indikace.
Pokyny pro administraci
- PRILOSEC 40 mg je určen k přípravě ve vodě a podávání perorálně nebo nasogastrickou (NG) nebo žaludeční sondou.
- Užívejte PRILOSEC 40 mg před jídlem.
- Antacida lze užívat současně s přípravkem PRILOSEC.
- Vynechané dávky: Pokud dojde k vynechání dávky, podejte ji co nejdříve. Pokud však má být použita další plánovaná dávka, neužívejte vynechanou dávku a vezměte si další dávku včas. Neužívejte dvě dávky najednou, abyste nahradili vynechanou dávku.
Orální podání ve vodě
Podání vodou pomocí NG nebo žaludeční sondy (velikost 6 nebo větší)
JAK DODÁVÁNO
Dávkové formy A Síly
PRILOSEC Pro perorální suspenzi s opožděným uvolňováním: 2,5 mg a 10 mg omeprazolu v jednodávkových baleních obsahujících jemný žlutý prášek, sestávající z bílých až nahnědlých granulí omeprazolu a bledě žlutých neaktivních granulí.
Skladování A Manipulace
PRILOSEC (omeprazol magnesium) pro perorální suspenzi s opožděným uvolňováním, 2,5 mg nebo 10 mg omeprazolu, se dodává jako jednodávkové balení obsahující jemný žlutý prášek, který se skládá z bílých až nahnědlých granulí omeprazolu a světle žlutých neaktivních granulí. Jednodávkové balíčky PRILOSEC se dodávají následovně:
NDC 70515-625–01 balení jednotkové dávky po 30: 2,5 mg balení NDC 70515-610 – 01 balení jednotkové dávky po 30: 10 mg balení
Úložný prostor
PRILOSEC pro perorální suspenzi s opožděným uvolňováním uchovávejte při teplotě 25 °C (77 °F); výlety povoleny do 15 – 30 °C (59 – 86 °F). [Vidět USP řízená pokojová teplota .]
Vyrobeno pro: Covis Pharma, Zug, 6300 Švýcarsko. Revize: březen 2022
VEDLEJŠÍ EFEKTY
Následující závažné nežádoucí účinky jsou popsány níže a jinde v označení:
- Akutní tubulointersticiální nefritida [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Průjem spojený s Clostridium difficile [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Zlomenina kosti [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Závažné kožní nežádoucí účinky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Kožní a systémový lupus erythematodes [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Nedostatek kyanokobalaminu (vitamín B-12) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hypomagnezémie a metabolismus minerálů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Polypy fundických žláz [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických zkoušek s PRILOSEC
Monoterapie
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Údaje o bezpečnosti popsané níže odrážejí expozici omeprazolu ve formě tobolek s hořčíkem s opožděným uvolňováním u 3096 pacientů z celosvětových klinických studií (465 pacientů ze studií v USA a 2631 pacientů z mezinárodních studií). Indikace klinicky studované v amerických studiích zahrnovaly duodenální vřed, rezistentní vřed a Zollinger-Ellisonův syndrom. Mezinárodní klinické studie byly dvojitě zaslepené a otevřené. Nejčastější nežádoucí účinky hlášené (tj. s incidencí ≥ 2 %) u pacientů léčených PRILOSECem zařazeným do těchto studií zahrnovaly bolest hlavy (7 %), bolest břicha (5 %), nauzeu (4 %), průjem (4 % ), zvracení (3 %) a plynatost (3 %).
Další nežádoucí účinky, které byly hlášeny s incidencí ≥ 1 %, zahrnovaly regurgitaci kyseliny (2 %), infekci horních cest dýchacích (2 %), zácpu (2 %), závratě (2 %), vyrážku (2 %), astenii (1 %) ), bolesti zad (1 %) a kašel (1 %).
Bezpečnostní profil klinické studie u pacientů starších 65 let byl podobný jako u pacientů ve věku 65 let nebo méně.
Bezpečnostní profil klinické studie u pediatrických pacientů, kteří dostávali omeprazol magnesium ve formě tobolek s opožděným uvolňováním, byl podobný jako u dospělých pacientů. Nežádoucí účinky respiračního systému byly však jedinečné u pediatrické populace často hlášeny ve věkové skupině 1 měsíc až Použití u konkrétních populací ].
Zkušenosti z klinických studií s PRILOSEC 20 mg v kombinované léčbě pro eradikaci H. pylori
klinických studiích využívajících buď duální léčbu omeprazolem v tobolkách s hořčíkem s opožděným uvolňováním a klarithromycinem, nebo trojitou léčbu omeprazolem v tobolkách hořčíku se zpožděným uvolňováním, klaritromycinem a amoxicilinem, nebyly pozorovány žádné nežádoucí účinky, které by byly jedinečné pro tyto kombinace léků. Pozorované nežádoucí účinky byly omezeny na ty, které byly dříve hlášeny u samotného omeprazolu, klarithromycinu nebo amoxicilinu.
Duální terapie (omeprazol hořčík tobolky s opožděným uvolňováním/klaritromycin)
Nežádoucí účinky pozorované v kontrolovaných klinických studiích využívajících kombinovanou terapii s omeprazolem ve formě tobolek s hořčíkem s opožděným uvolňováním a klarithromycinem (n = 346), které se lišily od těch dříve popsaných pro samotné tobolky s hořčíkem s omeprazolem s opožděným uvolňováním, byly poruchy chuti (15 %), změna barvy jazyka (2 %), rýma (2 %), faryngitida (1 %) a chřipkový syndrom (1 %). (Další informace o klarithromycinu naleznete v informacích o předepisování klarithromycinu, část Nežádoucí účinky.)
Trojitá terapie (omeprazol hořčík tobolky s opožděným uvolňováním/klaritromycin/amoxicilin)
Nejčastějšími nežádoucími účinky pozorovanými v klinických studiích s kombinovanou terapií s omeprazolem, tobolkami s hořčíkem s opožděným uvolňováním, klarithromycinem a amoxicilinem (n = 274) byly průjem (14 %), poruchy chuti (10 %) a bolest hlavy (7 %). Žádný z nich se nevyskytoval s vyšší frekvencí než u pacientů užívajících samotná antimikrobiální látky. (Další informace o klarithromycinu nebo amoxicilinu naleznete v příslušných informacích o předepisování v části Nežádoucí účinky.)
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během užívání omeprazolu po schválení. Protože tyto reakce jsou dobrovolně hlášeny z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich skutečnou frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Tělo jako celek: Hypersenzitivní reakce včetně anafylaxe, anafylaktického šoku, angioedému, bronchospasmu, intersticiální nefritidy, kopřivky (viz také Kůže níže); horečka; bolest; únava; nevolnost; systémový lupus erythematodes
Kardiovaskulární: Bolest na hrudi nebo angina pectoris, tachykardie, bradykardie, palpitace, zvýšený krevní tlak, periferní edém
Endokrinní: Gynekomastie
Gastrointestinální: Pankreatitida (některá smrtelná), anorexie, dráždivé tlusté střevo, změna barvy stolice, kandidóza jícnu, slizniční atrofie jazyka, stomatitida, otok břicha, sucho v ústech, mikroskopická kolitida, polypy fundických žláz.
Gastroduodenální karcinoidy byly hlášeny u pacientů se syndromem ZE při dlouhodobé léčbě omeprazolem. Předpokládá se, že toto zjištění je projevem základního stavu, o kterém je známo, že je spojen s takovými nádory.
Jaterní: Onemocnění jater včetně selhání jater (některé fatální), nekrózy jater (některé fatální), jaterní encefalopatie, hepatocelulární onemocnění, cholestatické onemocnění, smíšená hepatitida, žloutenka a zvýšení jaterních testů [ALT, AST, GGT, alkalická fosfatáza a bilirubin]
Infekce a nákazy: Průjem související s Clostridium difficile
Poruchy metabolismu a výživy: Hypomagnezémie, hypokalcémie, hypokalémie [Varování a opatření 5.9], hyponatremie, hypoglykémie, přírůstek hmotnosti
Muskuloskeletální: Svalová slabost, myalgie, svalové křeče, bolesti kloubů, bolesti nohou, zlomeniny kostí
Nervový systém/psychiatrický: Psychiatrické poruchy a poruchy spánku včetně deprese, agitovanosti, agrese, halucinací, zmatenosti, nespavosti, nervozity, apatie, somnolence, úzkosti a snů; třes, parestézie; závrať
Respirační: Epistaxe, bolest hltanu
Kůže: Závažné generalizované kožní reakce včetně toxického SJS/TEN (některé fatální), DRESS, AGEP, kožní lupus erythematodes a erythema multiforme; fotosenzitivita; kopřivka; vyrážka; zánět kůže; pruritus; petechie; purpura; alopecie; suchá kůže; hyperhidróza
Speciální smysly: Tinnitus, chuťová perverze
Oční: Optická atrofie, přední ischemická neuropatie zrakového nervu, optická neuritida, syndrom suchého oka, podráždění oka, rozmazané vidění, dvojité vidění
Urogenitální: Intersticiální nefritida, hematurie, proteinurie, zvýšený sérový kreatinin, mikroskopická pyurie, infekce močových cest, glykosurie, frekvence močení, bolest varlat
Hematologické: Agranulocytóza (některé fatální), hemolytická anémie, pancytopenie, neutropenie, anémie, trombocytopenie, leukopenie, leukocytóza
DROGOVÉ INTERAKCE
Tabulky 3 a 4 zahrnují léky s klinicky významnými lékovými interakcemi a interakcí s diagnostikou při současném podávání s omeprazolem a pokyny pro jejich prevenci nebo léčbu.
Chcete-li získat další informace o interakcích s PPI, podívejte se na označení současně užívaných léků.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Přítomnost Malignity žaludku
dospělých nevylučuje symptomatická odpověď na léčbu přípravkem PRILOSEC přítomnost žaludeční malignity. Zvažte další sledování a diagnostické testování u dospělých pacientů, kteří mají suboptimální odpověď nebo časný symptomatický relaps po dokončení léčby PPI. U starších pacientů zvažte i endoskopii.
Akutní tubulointersticiální nefritida
Akutní tubulointersticiální nefritida (TIN) byla pozorována u pacientů užívajících PPI a může se objevit kdykoli během léčby PPI. Pacienti mohou mít různé známky a příznaky od symptomatických reakcí přecitlivělosti až po nespecifické příznaky snížené funkce ledvin (např. malátnost, nauzea, anorexie). V hlášených sériích případů byli někteří pacienti diagnostikováni biopsií a bez extrarenálních projevů (např. horečka, vyrážka nebo artralgie). Přerušte léčbu přípravkem PRILOSEC 40 mg a vyhodnoťte pacienty s podezřením na akutní TIN [viz KONTRAINDIKACE ].
Průjem spojený s Clostridium Difficile
Publikované observační studie naznačují, že léčba PPI, jako je PRILOSEC, může být spojena se zvýšeným rizikem průjmu souvisejícího s Clostridium difficile, zejména u hospitalizovaných pacientů. Tuto diagnózu je třeba zvážit u průjmu, který se nezlepšuje [viz NEŽÁDOUCÍ REAKCE ].
Pacienti by měli používat nejnižší dávku a nejkratší dobu léčby PPI odpovídající léčenému stavu.
Průjem související s Clostridium difficile (CDAD) byl hlášen při použití téměř všech antibakteriálních látek. Více informací specifických pro antibakteriální látky (klaritromycin a amoxicilin) indikované k použití v kombinaci s PRILOSECem naleznete v oddílech Upozornění a opatření v příslušných informacích pro předepisování.
Zlomenina kosti
Několik publikovaných observačních studií naznačuje, že léčba inhibitorem protonové pumpy (PPI) může být spojena se zvýšeným rizikem zlomenin kyčle, zápěstí nebo páteře souvisejících s osteoporózou. Riziko zlomenin se zvýšilo u pacientů, kteří dostávali vysoké dávky, definované jako opakované denní dávky, a dlouhodobou terapii PPI (rok nebo déle). Pacienti by měli používat nejnižší dávku a nejkratší dobu léčby PPI odpovídající léčenému stavu. Pacienti s rizikem zlomenin souvisejících s osteoporózou by měli být léčeni podle zavedených pokynů pro léčbu [viz DÁVKOVÁNÍ A PODÁVÁNÍ , NEŽÁDOUCÍ REAKCE ].
Závažné kožní nežádoucí reakce
V souvislosti s užíváním PPI byly hlášeny závažné kožní nežádoucí reakce, včetně Stevens-Johnsonova syndromu (SJS) a toxické epidermální nekrolýzy (TEN), lékové reakce s eozinofilií a systémovými příznaky (DRESS) a akutní generalizované exantematózní pustulózy (AGEP). [vidět NEŽÁDOUCÍ REAKCE ]. Při prvních známkách nebo příznacích závažných kožních nežádoucích reakcí nebo jiných příznaků přecitlivělosti přerušte léčbu přípravkem PRILOSEC a zvažte další hodnocení.
Kožní a systémový lupus erythematodes
pacientů užívajících PPI, včetně omeprazolu, byly hlášeny kožní lupus erythematodes (CLE) a systémový lupus erythematodes (SLE). Tyto příhody se objevily jak jako nový nástup, tak jako exacerbace stávajícího autoimunitního onemocnění. Většina případů lupus erythematodes vyvolaných PPI byla CLE.
Nejběžnější formou CLE hlášenou u pacientů léčených PPI byl subakutní CLE (SCLE) a vyskytoval se během týdnů až let po kontinuální medikamentózní terapii u pacientů od kojenců až po seniory. Obecně byly histologické nálezy pozorovány bez orgánového postižení.
Systémový lupus erythematodes (SLE) je u pacientů užívajících PPI méně často hlášen než CLE. SLE spojený s PPI je obvykle mírnější než SLE neindukovaný léky. Nástup SLE se typicky objevil během dnů až let po zahájení léčby primárně u pacientů od mladých dospělých po starší osoby. U většiny pacientů se objevila vyrážka; byly však také hlášeny artralgie a cytopenie.
Vyhněte se podávání PPI déle, než je lékařsky indikováno. Pokud jsou u pacientů užívajících PRILOSEC 10 mg zaznamenány známky nebo příznaky odpovídající CLE nebo SLE, přerušte léčbu a odešlete pacienta k příslušnému specialistovi k vyšetření. Většina pacientů se zlepší po vysazení samotného PPI za 4 až 12 týdnů. Sérologické vyšetření (např. ANA) může být pozitivní a vyřešení zvýšených sérologických testů může trvat déle než klinické projevy.
Interakce s klopidogrelem
Vyhněte se současnému užívání přípravku PRILOSEC 10 mg s klopidogrelem. Clopidogrel je proléčivo. Inhibice agregace krevních destiček klopidogrelem je zcela způsobena aktivním metabolitem. Metabolismus klopidogrelu na jeho aktivní metabolit může být narušen současným užíváním léků, jako je omeprazol, které inhibují aktivitu CYP2C19. Současné užívání klopidogrelu s 80 mg omeprazolu snižuje farmakologickou aktivitu klopidogrelu, i když je podáván s odstupem 12 hodin.
Při použití PRILOSECu zvažte alternativní protidestičkovou léčbu [viz DROGOVÉ INTERAKCE a KLINICKÁ FARMAKOLOGIE ].
Nedostatek kyanokobalaminu (vitamín B-12).
Každodenní léčba jakýmikoli léky potlačujícími kyselost po dlouhou dobu (např. déle než 3 roky) může vést k malabsorpci kyanokobalaminu (vitamín B-12) způsobené hypo- nebo achlorhydrií. V literatuře byly popsány vzácné zprávy o deficitu kyanokobalaminu vyskytujícího se při léčbě potlačující kyselost. Tuto diagnózu je třeba zvážit, pokud jsou u pacientů léčených přípravkem PRILOSEC pozorovány klinické příznaky odpovídající nedostatku kyanokobalaminu.
Hypomagnezémie a metabolismus minerálů
Hypomagnezémie, symptomatická a asymptomatická, byla vzácně hlášena u pacientů léčených PPI po dobu alespoň tří měsíců, ve většině případů po roce léčby. Mezi závažné nežádoucí účinky patří tetanie, arytmie a záchvaty. Hypomagnezémie může vést k hypokalcemii a/nebo hypokalémii a může u rizikových pacientů zhoršit základní hypokalcemii. U většiny pacientů vyžadovala léčba hypomagnezémie náhradu hořčíku a vysazení PPI.
U pacientů, u kterých se očekává delší léčba nebo kteří užívají PPI s léky, jako je digoxin nebo léky, které mohou způsobit hypomagnezémii (např. diuretika), mohou zdravotníci zvážit sledování hladin hořčíku před zahájením léčby PPI a pravidelně [viz NEŽÁDOUCÍ REAKCE ].
Zvažte sledování hladin hořčíku a vápníku před zahájením léčby PRILOSECem a pravidelně během léčby u pacientů s již existujícím rizikem hypokalcémie (např. hypoparatyreóza). Podle potřeby doplňte hořčík a/nebo vápník. Pokud je hypokalcémie refrakterní na léčbu, zvažte přerušení léčby PPI.
Interakce s třezalkou tečkovanou nebo rifampinem
Léky, které indukují CYP2C19 nebo CYP3A4 (jako je třezalka tečkovaná nebo rifampin), mohou podstatně snížit koncentrace omeprazolu (viz DROGOVÉ INTERAKCE ]. Vyhněte se současnému užívání přípravku PRILOSEC s třezalkou tečkovanou nebo rifampinem.
Interakce s diagnostickými vyšetřeními pro neuroendokrinní nádory
Hladiny sérového chromograninu A (CgA) se zvyšují sekundárně po lékem vyvolaném poklesu kyselosti žaludku. Zvýšená hladina CgA může způsobit falešně pozitivní výsledky při diagnostických vyšetřeních neuroendokrinních nádorů. Poskytovatelé zdravotní péče by měli dočasně přerušit léčbu přípravkem PRILOSEC 20 mg alespoň 14 dní před stanovením hladin CgA a zvážit opakování testu, pokud jsou počáteční hladiny CgA vysoké. Pokud se provádějí sériové testy (např. pro monitorování), měla by být pro testování použita stejná komerční laboratoř, protože referenční rozsahy mezi testy se mohou lišit [viz DROGOVÉ INTERAKCE ].
Interakce s methotrexátem
Literatura naznačuje, že současné užívání PPI s methotrexátem (primárně ve vysokých dávkách) může zvýšit a prodloužit sérové hladiny methotrexátu a/nebo jeho metabolitu, což může vést k toxicitě methotrexátu. Při podávání vysokých dávek metotrexátu lze u některých pacientů zvážit dočasné vysazení PPI [viz DROGOVÉ INTERAKCE ].
Polypy fundických žláz
Užívání PPI je spojeno se zvýšeným rizikem polypů fundických žláz, které se zvyšuje s dlouhodobým užíváním, zejména po jednom roce. Většina uživatelů PPI, u kterých se vyvinuly polypy fundické žlázy, byla asymptomatická a polypy fundické žlázy byly identifikovány náhodně při endoskopii. Použijte nejkratší dobu trvání léčby PPI vhodnou pro léčený stav.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( Návod k použití a návod k použití ).
Akutní tubulointersticiální nefritida
Poraďte pacientovi nebo pečovateli, aby okamžitě zavolal poskytovatele zdravotní péče pacienta, pokud zaznamená známky a/nebo příznaky spojené s akutní tubulointersticiální nefritidou [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Průjem spojený s Clostridium Difficile
Informujte pacienta nebo pečovatele, aby okamžitě zavolali pacientovi poskytovateli zdravotní péče, pokud se u nich objeví průjem, který se nezlepšuje [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Zlomenina kosti
Poraďte pacientovi nebo pečovateli, aby hlásil jakékoli zlomeniny, zejména kyčle, zápěstí nebo páteře, poskytovateli zdravotní péče pacienta [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Závažné kožní nežádoucí reakce
Poraďte pacientovi nebo pečovateli, aby přestal užívat PRILOSEC 40 mg a hlásil svému poskytovateli zdravotní péče při prvním výskytu závažné kožní nežádoucí reakce nebo jiného příznaku hypersenzitivity [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Kožní a systémový lupus erythematodes
Poraďte pacientovi nebo pečovateli, aby okamžitě zavolal poskytovatele zdravotní péče pacienta v případě jakéhokoli nového nebo zhoršení příznaků spojených s kožním nebo systémovým lupus erythematodes [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Nedostatek kyanokobalaminu (vitamín B-12).
Poraďte pacientovi nebo pečovateli, aby hlásil jakékoli klinické příznaky, které mohou být spojeny s nedostatkem kyanokobalaminu, poskytovateli zdravotní péče pacienta, pokud dostává PRILOSEC déle než 3 roky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Hypomagnezémie a metabolismus minerálů
Poraďte pacientovi nebo pečovateli, aby hlásil jakékoli klinické příznaky, které mohou být spojeny s hypomagnezémií, hypokalcémií a/nebo hypokalémií, poskytovateli zdravotní péče pacienta, pokud dostával PRILOSEC alespoň 3 měsíce [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Lékové interakce
Poraďte pacientům, aby hlásili svému poskytovateli zdravotní péče, pokud zahájí léčbu přípravky obsahujícími rilpivirin, klopidogrelem, třezalkou tečkovanou nebo rifampinem; nebo pokud užívají vysoké dávky methotrexátu [viz KONTRAINDIKACE , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Správa
- PRILOSEC je určen k přípravě ve vodě a podávání perorálně nebo pomocí nazogastrické (NG) nebo žaludeční sondy, jak je popsáno v Průvodci léčivy.
- Užívejte PRILOSEC před jídlem.
- Antacida lze užívat současně s přípravkem PRILOSEC.
- Vynechané dávky: Pokud dojde k vynechání dávky, podejte ji co nejdříve. Pokud však má být použita další plánovaná dávka, neužívejte vynechanou dávku a vezměte si další dávku včas. Neužívejte dvě dávky najednou, abyste nahradili vynechanou dávku.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Ve dvou 24měsíčních studiích karcinogenity u potkanů byl omeprazol v denních dávkách 1,7, 3,4, 13,8, 44,0 a 140,8 mg/kg/den (přibližně 0,4 až 34násobek lidské dávky 40 mg/den, vyjádřeno na povrchu těla plošný základ) produkoval žaludeční ECL buněčné karcinoidy způsobem závislým na dávce u samců i samic potkanů; výskyt tohoto účinku byl výrazně vyšší u samic potkanů, které měly vyšší hladiny omeprazolu v krvi. Karcinoidy žaludku se u neléčených potkanů vyskytují jen zřídka. Kromě toho byla u všech léčených skupin obou pohlaví přítomna hyperplazie buněk ECL. V jedné z těchto studií byly samice potkanů léčeny 13,8 mg omeprazolu/kg/den (asi 3,4násobek dávky pro člověka 40 mg/den, na základě plochy povrchu těla) po dobu jednoho roku a poté byly sledovány další rok bez lék. U těchto potkanů nebyly pozorovány žádné karcinoidy. Zvýšený výskyt hyperplazie ECL buněk související s léčbou byl pozorován na konci jednoho roku (94 % léčených vs. 10 % kontrol). Do druhého roku byl rozdíl mezi léčenými a kontrolními potkany mnohem menší (46 % vs. 26 %), ale stále vykazoval větší hyperplazii v léčené skupině. Adenokarcinom žaludku byl pozorován u jednoho potkana (2 %). Žádný podobný nádor nebyl pozorován u samců nebo samic potkanů léčených po dobu dvou let. U tohoto kmene potkanů nebyl historicky zaznamenán žádný podobný nádor, ale nález zahrnující pouze jeden nádor je obtížné interpretovat. V 52týdenní studii toxicity na potkanech Sprague-Dawley byly mozkové astrocytomy nalezeny u malého počtu samců, kteří dostávali omeprazol v dávkách 0,4, 2 a 16 mg/kg/den (přibližně 0,1 až 3,9 násobek lidské dávky 40 mg/den na základě tělesného povrchu). V této studii nebyly u samic potkanů pozorovány žádné astrocytomy. Ve dvouleté studii karcinogenity u potkanů Sprague-Dawley nebyly nalezeny žádné astrocytomy u samců ani samic při vysoké dávce 140,8 mg/kg/den (asi 34násobek dávky pro člověka 40 mg/den na základě tělesného povrchu) . 78týdenní studie karcinogenity omeprazolu na myších neprokázala zvýšený výskyt nádorů, ale studie nebyla přesvědčivá. 26týdenní studie karcinogenity transgenních myší p53 (+/-) nebyla pozitivní.
Omeprazol byl pozitivní na klastogenní účinky v in vitro testu na chromozomální aberaci lidských lymfocytů, v jednom ze dvou in vivo myších mikronukleárních testů a v in vivo testu na chromozomální aberace buněk kostní dřeně. Omeprazol byl negativní v in vitro Amesově testu, in vitro testu přímé mutace buněk myšího lymfomu a in vivo testu poškození DNA potkaních jater.
Bylo zjištěno, že omeprazol v perorálních dávkách až 138 mg/kg/den u potkanů (asi 34násobek perorální dávky pro člověka 40 mg na základě tělesného povrchu) nemá žádný vliv na fertilitu a reprodukční schopnost.
Ve 24měsíčních studiích karcinogenity u potkanů bylo pozorováno na dávce závislé významné zvýšení žaludečních karcinoidních nádorů a hyperplazie buněk ECL u samců i samic (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Karcinoidní nádory byly také pozorovány u potkanů podrobených fundektomii nebo dlouhodobé léčbě jinými inhibitory protonové pumpy nebo vysokými dávkami antagonistů H2-receptorů.
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
Neexistují žádné adekvátní a dobře kontrolované studie s omeprazolem u těhotných žen. Dostupné epidemiologické údaje neprokázaly zvýšené riziko závažných vrozených malformací nebo jiných nepříznivých následků těhotenství při užívání omeprazolu v prvním trimestru. Reprodukční studie na potkanech a králících vedly k embryonální letalitě závislé na dávce při dávkách omeprazolu, které byly přibližně 3,4 až 34násobkem perorální dávky 40 mg pro člověka (na základě plochy povrchu těla pro osobu o hmotnosti 60 kg).
Teratogenita nebyla pozorována v reprodukčních studiích na zvířatech s perorálním podáváním hořčíku esomeprazolu (enantiomer omeprazolu) u potkanů a králíků během organogeneze v dávkách přibližně 68krát a 42krát, v daném pořadí, perorální dávky 40 mg esomeprazolu nebo 40 mg omeprazolu ( na základě tělesného povrchu pro osobu vážící 60 kg).
Změny v morfologii kostí byly pozorovány u potomků potkanů, kterým byly po většinu březosti a laktace podávány dávky rovné nebo vyšší než přibližně 34násobek perorální dávky 40 mg esomeprazolu nebo 40 mg omeprazolu pro člověka. Když bylo podávání matce omezeno pouze na gestaci, nebyly žádné účinky na morfologii kostní fýzy u potomků v jakémkoli věku [viz Data ].
Odhadovaná základní rizika závažných vrozených vad a potratu pro indikovanou populaci nejsou známa. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 % až 4 % a 15 % až 20 %.
Data
Lidská data
Čtyři publikované epidemiologické studie porovnávaly frekvenci vrozených abnormalit mezi kojenci narozenými ženám, které užívaly omeprazol během těhotenství, s frekvencí abnormalit u kojenců žen vystavených antagonistům H2-receptorů nebo jiným kontrolám.
Populační retrospektivní kohortová epidemiologická studie ze Švédského lékařského registru narození, pokrývající přibližně 99 % těhotenství v letech 1995 až 99, uváděla 955 kojenců (824 exponovaných během prvního trimestru, 39 z nich exponovaných po prvním trimestru a 131 exponovaných po prvním trimestru), jejichž matky užívaly omeprazol během těhotenství. Počet kojenců vystavených in utero omeprazolu s jakoukoli malformací, nízkou porodní hmotností, nízkým Apgar skóre nebo hospitalizací byl podobný počtu pozorovanému v této populaci. Počet dětí narozených s defekty komorového septa a počet mrtvě narozených dětí byl mírně vyšší u kojenců vystavených působení omeprazolu než očekávaný počet v této populaci.
Populační retrospektivní kohortová studie zahrnující všechny živě narozené děti v Dánsku od roku 1996 do roku 2009 uvádí 1 800 živě narozených dětí, jejichž matky užívaly omeprazol během prvního trimestru těhotenství, a 837 317 živě narozených dětí, jejichž matky neužívaly žádný inhibitor protonové pumpy. Celková míra vrozených vad u kojenců narozených matkám s expozicí omeprazolu v prvním trimestru byla 2,9 % a 2,6 % u kojenců narozených matkám, které nebyly vystaveny žádnému inhibitoru protonové pumpy během prvního trimestru.
Retrospektivní kohortová studie referovala o 689 těhotných ženách vystavených buď H2-blokátorům nebo omeprazolu v prvním trimestru (134 vystavených omeprazolu) a 1 572 těhotných ženách neexponovaných žádnému z nich během prvního trimestru. Celková míra malformací u potomků narozených matkám s expozicí omeprazolu, H2-blokátoru v prvním trimestru nebo neexponovaných, byla 3,6 %, 5,5 % a 4,1 %.
Malá prospektivní observační kohortová studie sledovala 113 žen vystavených omeprazolu během těhotenství (89 % s expozicemi v prvním trimestru). Hlášená četnost velkých vrozených malformací byla 4 % ve skupině s omeprazolem, 2 % u kontrol vystavených neteratogenům a 2,8 % u kontrol s párem onemocnění. Míra spontánních a elektivních potratů, předčasných porodů, gestační věk při porodu a průměrná porodní hmotnost byla mezi skupinami podobná.
Několik studií neukázalo žádné zjevné nepříznivé krátkodobé účinky na kojence, když byla jednorázová perorální nebo intravenózní dávka omeprazolu podána více než 200 těhotným ženám jako premedikace k císařskému řezu v celkové anestezii.
Údaje o zvířatech
omeprazol
Reprodukční studie provedené s omeprazolem u potkanů v perorálních dávkách až 138 mg/kg/den (asi 34násobek perorální dávky pro člověka 40 mg na základě tělesného povrchu) au králíků v dávkách až 69,1 mg/kg/den ( přibližně 34násobek perorální dávky pro člověka 40 mg na bázi tělesného povrchu) během organogeneze neodhalil žádný důkaz teratogenního potenciálu omeprazolu. U králíků vyvolal omeprazol v rozmezí dávek 6,9 až 69,1 mg/kg/den (přibližně 3,4 až 34násobek perorální dávky 40 mg pro člověka na základě tělesného povrchu) podávaný během organogeneze zvýšení embryonální letality související s dávkou, fetální resorpce a narušení těhotenství. U potkanů byla pozorována na dávce závislá embryonální/fetální toxicita a postnatální vývojová toxicita u potomků po rodičích léčených omeprazolem v dávce 13,8 až 138,0 mg/kg/den (asi 3,4 až 34násobek perorálních dávek 40 mg pro člověka na povrch těla plošný základ), podávaný před pářením během období laktace.
esomeprazol
Níže popsaná data byla získána ze studií s použitím esomeprazolu, enantiomeru omeprazolu. Násobky dávek mezi zvířaty a lidmi jsou založeny na předpokladu stejné systémové expozice esomeprazolu u lidí po perorálním podání buď 40 mg esomeprazolu nebo 40 mg omeprazolu.
V reprodukčních studiích s esomeprazolem magnesium u potkanů v perorálních dávkách až 280 mg/kg/den (asi 68násobek perorální dávky pro člověka 40 mg na základě tělesného povrchu) nebo u králíků nebyly pozorovány žádné účinky na embryo-fetální vývoj. perorální dávky až do 86 mg/kg/den (přibližně 42násobek perorální dávky 40 mg esomeprazolu nebo 40 mg omeprazolu pro člověka na bázi tělesného povrchu) podávané během organogeneze.
Studie prenatální a postnatální vývojové toxicity u potkanů s dalšími cílovými body pro hodnocení vývoje kostí byla provedena s esomeprazolem magnesium v perorálních dávkách 14 až 280 mg/kg/den (asi 3,4 až 68násobek perorální dávky 40 mg esomeprazolu nebo 40 mg omeprazolu na základě tělesného povrchu). Neonatální/časně postnatální (od narození do odstavení) přežití bylo sníženo při dávkách rovných nebo vyšších než 138 mg/kg/den (přibližně 34násobek perorální dávky 40 mg esomeprazolu nebo 40 mg omeprazolu pro člověka na základě tělesného povrchu). Tělesná hmotnost a přírůstek tělesné hmotnosti byly sníženy a neurobehaviorální nebo obecné vývojové zpoždění v časovém rámci bezprostředně po odstavení bylo evidentní při dávkách rovných nebo vyšších než 69 mg/kg/den (asi 17násobek perorální dávky 40 mg esomeprazolu nebo 40 mg omeprazolu na základě tělesného povrchu). Kromě toho byla při dávkách rovných nebo vyšších než 14 mg/kg/den (asi 3,4krát vyšší než u lidí po perorálním podání) zaznamenána snížená délka stehenní kosti, šířka a tloušťka kortikální kosti, snížená tloušťka tibiální růstové ploténky a minimální až mírná hypocelularita kostní dřeně. dávka 40 mg esomeprazolu nebo 40 mg omeprazolu na základě tělesného povrchu). Fyzální dysplazie stehenní kosti byla pozorována u potomků potkanů léčených perorálními dávkami hořečnatého esomeprazolu v dávkách rovných nebo vyšších než 138 mg/kg/den (přibližně 34násobek perorální dávky pro člověka 40 mg esomeprazolu nebo 40 mg omeprazolu na tělo základ plochy).
Účinky na kost matky byly pozorovány u březích a kojících potkanů ve studii pre- a postnatální toxicity, kdy byl esomeprazol magnesium podáván v perorálních dávkách 14 až 280 mg/kg/den (asi 3,4 až 68násobek perorální dávky 40 mg esomeprazolu u člověka nebo 40 mg omeprazolu na základě tělesného povrchu). Když byly potkanům podávány dávky od 7. gestačního dne do odstavení 21. postnatálního dne, bylo pozorováno statisticky významné snížení hmotnosti stehenní kosti matky až o 14 % (ve srovnání s léčbou placebem) při dávkách rovných nebo vyšších než 138 mg/kg/den (asi 34násobek perorální dávky pro člověka 40 mg esomeprazolu nebo 40 mg omeprazolu na základě tělesného povrchu).
Studie prenatálního a postnatálního vývoje u potkanů s esomeprazolem stronciem (za použití ekvimolárních dávek ve srovnání se studií esomeprazol magnesium) přinesla podobné výsledky u samic a mláďat, jak je popsáno výše.
Následná studie vývojové toxicity u potkanů s dalšími časovými body k vyhodnocení vývoje kostí mláďat od 2. postnatálního dne do dospělosti byla provedena s esomeprazolem magnesium v perorálních dávkách 280 mg/kg/den (asi 68násobek perorální dávky 40 mg pro člověka na základě tělesného povrchu), kdy esomeprazol byl podáván buď od 7. dne gestace nebo od 16. dne gestace až do porodu. Když bylo podávání matce omezeno pouze na gestaci, neprojevily se žádné účinky na morfologii kostní fýzy u potomků v jakémkoli věku.
Laktace
Shrnutí rizik
Omezené údaje naznačují, že omeprazol může být přítomen v lidském mléce. Neexistují žádné klinické údaje o účincích omeprazolu na kojené dítě nebo na produkci mléka. Vývojové a zdravotní přínosy kojení by měly být zváženy společně s klinickou potřebou matky pro PRILOSEC 40 mg a případnými nežádoucími účinky na kojené dítě z PRILOSEC 20 mg nebo ze základního stavu matky.
Pediatrické použití
Bezpečnost a účinnost přípravku PRILOSEC 40 mg byla stanovena u dětských pacientů ve věku 1 až 16 let pro léčbu symptomatické GERD, léčbu EE způsobenou kyselinou zprostředkovanou GERD a udržení hojení EE v důsledku GERD zprostředkované kyselinou. Použití přípravku PRILOSEC 10 mg v této věkové skupině je podpořeno adekvátními a dobře kontrolovanými studiemi u dospělých a nekontrolovanými studiemi bezpečnosti, účinnosti a farmakokinetiky provedenými u dětských a dospívajících pacientů [viz KLINICKÁ FARMAKOLOGIE , Klinické studie ].
Bezpečnost a účinnost přípravku PRILOSEC 10 mg byla stanovena u pediatrických pacientů ve věku 1 měsíc až méně než 1 rok pro léčbu EE způsobené kyselinou zprostředkovanou GERD a je podpořena adekvátními a dobře kontrolovanými studiemi u dospělých a bezpečnosti, farmakokinetiky, a farmakodynamické studie provedené u dětských pacientů [viz KLINICKÁ FARMAKOLOGIE ].
U pediatrické populace byly nežádoucí účinky dýchacího systému často hlášeny v celé věkové skupině (1 měsíc až 16 let). Zánět středního ucha byl často hlášen ve věkové skupině 1 měsíc až NEŽÁDOUCÍ REAKCE ].
Bezpečnost a účinnost přípravku PRILOSEC nebyla stanovena v:
- pacienti mladší než 1 rok pro:
- Léčba symptomatické GERD
- Udržování hojení EE v důsledku kyselinou zprostředkované GERD
- dětští pacienti pro:
- Léčba aktivního duodenálního vředu
- Eradikace H. pylori ke snížení rizika recidivy duodenálního vředu
- Léčba aktivního benigního žaludečního vředu
- Patologické hypersekreční stavy
- pacientům mladším než 1 měsíc pro jakoukoli indikaci.
Údaje o mladých zvířatech
Bylo prokázáno, že esomeprazol, enantiomer omeprazolu, snižuje tělesnou hmotnost, přírůstek tělesné hmotnosti, hmotnost stehenní kosti, délku stehenní kosti a celkový růst při perorálních dávkách přibližně 34 až 68násobku denní dávky pro člověka 40 mg esomeprazolu nebo 40 mg omeprazolu na základě tělesné hmotnosti povrchová plocha ve studii toxicity u juvenilních potkanů. Násobky dávek mezi zvířaty a lidmi jsou založeny na předpokladu stejné systémové expozice esomeprazolu u lidí po perorálním podání buď 40 mg esomeprazolu nebo 40 mg omeprazolu.
28denní studie toxicity se 14denní fází zotavení byla provedena u mladých potkanů s esomeprazolem magnesium v dávkách 70 až 280 mg/kg/den (přibližně 17 až 68násobek denní perorální dávky 40 mg esomeprazolu nebo 40 mg omeprazol na bázi tělesného povrchu). Zvýšení počtu úmrtí při vysoké dávce 280 mg/kg/den bylo pozorováno, když byl juvenilním potkanům podáván esomeprazol magnesium od 7. postnatálního dne do 35. postnatálního dne. Navíc dávky rovné nebo vyšší než 140 mg/kg/den den (přibližně 34krát denní perorální dávka 40 mg esomeprazolu nebo 40 mg omeprazolu na základě tělesného povrchu) způsobily s léčbou související snížení tělesné hmotnosti (přibližně 14 %) a zvýšení tělesné hmotnosti, snížení hmotnosti stehenní kosti a femuru délka a ovlivnila celkový růst. Výše popsaná srovnatelná zjištění byla také pozorována v této studii s jinou solí esomeprazolu, esomeprazol-stronciem, v ekvimolárních dávkách esomeprazolu.
Geriatrické použití
Omeprazol byl podáván více než 2000 starším jedincům (ve věku ≥ 65 let) v klinických studiích v USA a Evropě. Nebyly žádné rozdíly v bezpečnosti a účinnosti mezi staršími a mladšími subjekty. Jiné hlášené klinické zkušenosti neidentifikovaly rozdíly v odpovědi mezi staršími a mladšími subjekty, ale nelze vyloučit větší citlivost některých starších jedinců.
Farmakokinetické studie ukázaly, že rychlost eliminace byla u starších osob poněkud snížena a biologická dostupnost byla zvýšena. Plazmatická clearance omeprazolu byla 250 ml/min (přibližně poloviční než u mladých dobrovolníků) a jeho plazmatický poločas byl v průměru jednu hodinu, což je asi dvojnásobek u mladých zdravých dobrovolníků. U starších pacientů však není nutná žádná úprava dávkování [viz KLINICKÁ FARMAKOLOGIE ].
Poškození jater
pacientů s poruchou funkce jater (Child-Pugh třída A, B nebo C) se expozice omeprazolu podstatně zvýšila ve srovnání se zdravými jedinci. Snížení dávky přípravku PRILOSEC 10 mg až 10 mg jednou denně se doporučuje u pacientů s poruchou funkce jater pro udržení hojení EE [viz DÁVKOVÁNÍ A PODÁVÁNÍ , KLINICKÁ FARMAKOLOGIE ].
Asijská populace
Ve studiích na zdravých dobrovolnících měli Asiaté přibližně čtyřikrát vyšší expozici než bělochy. Asijským pacientům se doporučuje snížení dávky přípravku PRILOSEC 20 mg až 10 mg jednou denně pro udržení hojení EE [viz DÁVKOVÁNÍ A PODÁVÁNÍ , KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
Byly obdrženy zprávy o předávkování omeprazolem u lidí. Dávky se pohybovaly až do 2400 mg (120násobek obvyklé doporučené klinické dávky). Projevy byly různé, ale zahrnovaly zmatenost, ospalost, rozmazané vidění, tachykardii, nevolnost, zvracení, pocení, návaly horka, bolest hlavy, sucho v ústech a další nežádoucí reakce podobné těm, které byly pozorovány při běžné klinické zkušenosti (viz NEŽÁDOUCÍ REAKCE ]. Příznaky byly přechodné a nebyl hlášen žádný závažný klinický výsledek, pokud byl PRILOSEC 20 mg užíván samostatně. Není známo žádné specifické antidotum při předávkování omeprazolem.
Omeprazol se ve velké míře váže na proteiny, a proto není snadno dialyzovatelný. V případě předávkování by měla být léčba symptomatická a podpůrná.
Pokud dojde k nadměrné expozici, zavolejte do Poison Control Center na čísle 1-800-222-1222, kde získáte aktuální informace o léčbě otravy nebo předávkování.
KONTRAINDIKACE
- PRILOSEC je kontraindikován u pacientů se známou přecitlivělostí na substituované benzimidazoly nebo na kteroukoli složku přípravku. Hypersenzitivní reakce mohou zahrnovat anafylaxi, anafylaktický šok, angioedém, bronchospasmus, akutní tubulointersticiální nefritidu a kopřivku (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , NEŽÁDOUCÍ REAKCE ].
- Inhibitory protonové pumpy (PPI), včetně přípravku PRILOSEC 10 mg, jsou kontraindikovány u pacientů užívajících přípravky obsahující rilpivirin (viz DROGOVÉ INTERAKCE ].
- Informace o kontraindikacích antibakteriálních látek (klaritromycin a amoxicilin) indikovaných v kombinaci s přípravkem PRILOSEC 40 mg naleznete v části KONTRAINDIKACE jejich příbalových informací.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Omeprazol patří do třídy antisekrečních sloučenin, substituovaných benzimidazolů, které potlačují sekreci žaludeční kyseliny specifickou inhibicí enzymového systému H+/K+ ATPázy na sekrečním povrchu parietálních buněk žaludku. Protože je tento enzymový systém považován za kyselou (protonovou) pumpu v žaludeční sliznici, byl omeprazol charakterizován jako inhibitor pumpy žaludeční kyseliny v tom, že blokuje poslední krok produkce kyseliny. Tento účinek je závislý na dávce a vede k inhibici jak bazální, tak stimulované sekrece kyseliny bez ohledu na stimul.

Farmakodynamika
Antisekreční činnost
Po perorálním podání dochází k nástupu antisekrečního účinku omeprazolu do jedné hodiny, s maximálním účinkem do dvou hodin. Inhibice sekrece je asi 50 % maxima za 24 hodin a trvání inhibice trvá až 72 hodin. Antisekreční účinek tak trvá mnohem déle, než by se dalo očekávat z velmi krátkého (méně než jedna hodina) plazmatického poločasu, zjevně v důsledku prodloužené vazby na parietální enzym H+/K+ ATPázu. Po vysazení léku se sekreční aktivita vrací postupně, během 3 až 5 dnů. Inhibiční účinek sekrece onacidu omeprazolu se zvyšuje s opakovaným dávkováním jednou denně a dosahuje plató po čtyřech dnech.
Výsledky četných studií antisekrečního účinku opakovaných dávek 20 mg a 40 mg omeprazolu u zdravých subjektů a pacientů jsou uvedeny níže. Hodnota „max“ představuje stanovení v době maximálního účinku (2 až 6 hodin po podání), zatímco hodnoty „min“ jsou hodnoty 24 hodin po poslední dávce omeprazolu.
Jednorázové denní perorální dávky omeprazolu v rozmezí od 10 mg do 40 mg způsobily u některých pacientů 100% inhibici 24hodinové intragastrické acidity.
Sérum Gastrin Effects
Ve studiích zahrnujících více než 200 pacientů se hladiny gastrinu v séru zvýšily během prvních 1 až 2 týdnů podávání terapeutických dávek omeprazolu jednou denně souběžně s inhibicí sekrece kyseliny. Při pokračující léčbě nedošlo k žádnému dalšímu zvýšení sérového gastrinu. Ve srovnání s antagonisty histaminového H2-receptoru byl střední nárůst způsobený 20mg dávkami omeprazolu vyšší (1,3 až 3,6násobný vs. 1,1 až 1,8násobný nárůst). Hodnoty gastrinu se vrátily na úroveň před léčbou, obvykle během 1 až 2 týdnů po ukončení léčby.
Zvýšený gastrin způsobuje hyperplazii buněk podobnou enterochromafinu a zvýšené hladiny sérového chromograninu A (CgA). Zvýšené hladiny CgA mohou způsobit falešně pozitivní výsledky při diagnostických vyšetřeních neuroendokrinních nádorů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Enterochromaffin-like (ECL) Cell Effects
Vzorky biopsie lidského žaludku byly získány od více než 3000 pacientů (dětí i dospělých) léčených omeprazolem v dlouhodobých klinických studiích. Výskyt hyperplazie buněk ECL se v těchto studiích s časem zvyšoval; u těchto pacientů však nebyl nalezen žádný případ karcinoidů, dysplazie nebo neoplazie buněk ECL. Tyto studie však nemají dostatečné trvání a rozsah, aby vyloučil možný vliv dlouhodobého podávání omeprazolu na vznik jakýchkoli premaligních nebo maligních stavů.
Další efekty
Systémové účinky omeprazolu na CNS, kardiovaskulární a respirační systém nebyly dosud zjištěny. Omeprazol podávaný v perorálních dávkách 30 nebo 40 mg po dobu 2 až 4 týdnů neměl žádný vliv na funkci štítné žlázy, metabolismus sacharidů nebo cirkulující hladiny parathormonu, kortizolu, estradiolu, testosteronu, prolaktinu, cholecystokininu nebo sekretinu.
Po jednorázové dávce 90 mg omeprazolu nebyl prokázán žádný účinek na vyprazdňování žaludku pevné a tekuté složky testovaného jídla. U zdravých subjektů neměla jednorázová intravenózní dávka omeprazolu (0,35 mg/kg) žádný účinek na sekreci vnitřního faktoru. U lidí nebyl pozorován žádný systematický účinek závislý na dávce na bazální nebo stimulovaný výdej pepsinu.
Nicméně, když je intragastrické pH udržováno na 4,0 nebo vyšší, bazální výdej pepsinu je nízký a aktivita pepsinu je snížena.
Stejně jako jiná činidla, která zvyšují intragastrické pH, omeprazol podávaný po dobu 14 dnů zdravým subjektům způsobil významné zvýšení intragastrických koncentrací životaschopných bakterií. Vzorec bakteriálního druhu se nezměnil od toho, který se běžně vyskytuje ve slinách. Všechny změny vymizely do tří dnů po ukončení léčby.
Průběh Barrettova jícnu u 106 pacientů byl hodnocen v dvojitě zaslepené kontrolované studii v USA s PRILOSEC 40 mg dvakrát denně po dobu 12 měsíců a následně 20 mg dvakrát denně po dobu 12 měsíců nebo ranitidinem 300 mg dvakrát denně po dobu 24 měsíců. Nebyl pozorován žádný klinicky významný dopad antisekreční terapie na Barrettovu sliznici. Přestože se během antisekreční terapie vyvinul neoskvamózní epitel, nebylo dosaženo úplné eliminace Barrettovy sliznice. Mezi léčebnými skupinami nebyl pozorován žádný významný rozdíl ve vývoji dysplazie na Barrettově sliznici a u žádného pacienta se během léčby nevyvinul karcinom jícnu. Mezi léčebnými skupinami nebyly pozorovány žádné významné rozdíly ve vývoji hyperplazie ECL buněk, korpusové atrofické gastritidy, korpusové střevní metaplazie nebo polypů tlustého střeva přesahujících 3 mm v průměru.
Farmakokinetika
Vstřebávání
PRILOSEC 20 mg pro perorální suspenzi s opožděným uvolňováním obsahuje hořečnaté granule omeprazolu a neaktivní granule k podání ve vodě. Absorpce omeprazolu začíná až poté, co gastrorezistentní granule opustí žaludek. Farmakokinetika omeprazolu je závislá na čase, s vyššími plazmatickými koncentracemi v ustáleném stavu ve srovnání s jednorázovou dávkou. Systémová expozice (AUC a Cmax) omeprazolu po podávání 20 mg perorální suspenze s opožděným uvolňováním jednou denně po dobu 5 dnů je o 51 % a 58 % vyšší než po první dávce. Maximální plazmatické koncentrace omeprazolu po opakovaných dávkách perorální suspenze s opožděným uvolňováním nastávají během 1,5 až 2 hodin. U zdravých jedinců je plazmatický poločas 0,5 až 1 hodina.
Rozdělení
Vazba na bílkoviny je přibližně 95 %.
Odstranění
Metabolismus
Omeprazol je rozsáhle metabolizován enzymovým systémem cytochromu P450 (CYP). Hlavní část jeho metabolismu je závislá na polymorfně exprimovaném CYP2C19, odpovědném za tvorbu hydroxyomeprazolu, hlavního metabolitu v plazmě. Zbývající část je závislá na jiné specifické izoformě, CYP3A4, zodpovědné za tvorbu omeprazolsulfonu.
Vylučování
Po jednorázovém perorálním podání pufrovaného roztoku omeprazolu se močí vyloučilo jen málo, pokud vůbec nějaké, nezměněné léčivo. Většina dávky (asi 77 %) byla vyloučena močí jako nejméně šest metabolitů. Dva byly identifikovány jako hydroxyomeprazol a odpovídající karboxylová kyselina. Zbytek dávky byl získatelný ve stolici. To znamená významné vylučování metabolitů omeprazolu žlučí. V plazmě byly identifikovány tři metabolity: sulfidové a sulfonové deriváty omeprazolu a hydroxyomeprazol. Tyto metabolity mají velmi malou nebo žádnou antisekreční aktivitu.
Kombinovaná terapie s antimikrobiálními látkami
Omeprazol 40 mg denně byl podáván v kombinaci s klarithromycinem 500 mg každých 8 hodin zdravým dospělým mužům. Plazmatické koncentrace omeprazolu v ustáleném stavu byly zvýšeny (Cmax, AUC0-24 a T½ zvýšení o 30 %, 89 % a 34 %) při současném podávání klarithromycinu. Pozorované zvýšení plazmatické koncentrace omeprazolu bylo spojeno s následujícími farmakologickými účinky. Průměrná hodnota pH žaludku za 24 hodin byla při podávání samotného omeprazolu a 5,7 při současném podávání s klarithromycinem.
Plazmatické koncentrace klarithromycinu a 14-hydroxyklaritromycinu byly zvýšeny při současném podávání omeprazolu. U klarithromycinu byla průměrná Cmax o 10 % vyšší, průměrná Cmin o 27 % vyšší a průměrná AUC0-8 byla o 15 % vyšší, když byl klarithromycin podáván s omeprazolem, než když byl klarithromycin podáván samotný. Podobné výsledky byly pozorovány pro 14-hydroxyklaritromycin, průměrná Cmax byla o 45 % vyšší, průměrná Cmin byla o 57 % vyšší a průměrná AUC0-8 byla o 45 % vyšší. Koncentrace klarithromycinu v žaludeční tkáni a hlenu byly také zvýšeny při současném podávání omeprazolu.
Specifické populace
Geriatričtí pacienti
Rychlost eliminace omeprazolu byla u starších pacientů poněkud snížena a biologická dostupnost byla zvýšena. Biologická dostupnost omeprazolu byla 76 %, když byla jednorázová perorální dávka 40 mg omeprazolu (pufrovaný roztok) podána zdravým starším dobrovolníkům, oproti 58 % u mladých dobrovolníků, kterým byla podána stejná dávka. Téměř 70 % dávky se objevilo v moči jako metabolity omeprazolu a nebylo detekováno žádné nezměněné léčivo. Plazmatická clearance omeprazolu byla 250 ml/min (přibližně poloviční než u mladých dobrovolníků) a jeho plazmatický poločas byl v průměru jednu hodinu, což je asi dvojnásobek u mladých zdravých dobrovolníků.
Pediatričtí pacienti
2 až 16 let věku
Farmakokinetika omeprazolu byla zkoumána u pediatrických pacientů ve věku 2 až 16 let:
Po srovnatelných dávkách omeprazolu v mg/kg mají mladší děti (ve věku 2 až 5 let) nižší AUC než děti ve věku 6 až 16 let nebo dospělí; AUC posledních dvou skupin se nelišily [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
1 až 11 měsíců věku
Ke stanovení vhodných dávek přípravku PRILOSEC 40 mg u pediatrických pacientů byl použit populační farmakokinetický model
1 měsíc až méně než 1 rok věku pro léčbu (až 6 týdnů) erozivní ezofagitidy způsobené kyselinou zprostředkovanou GERD. Model byl založen na datech od 64 dětí ve věku 0,5 měsíce až 16 let. U dětí mladších než 1 rok byly k dispozici pouze omezené údaje. Omeprazol byl v těchto studiích pediatrickým pacientům podáván jako perorální suspenze připravená z tobolek s opožděným uvolňováním. Pediatrické dávky byly simulovány ve věkové skupině 1 až 11 měsíců, aby se dosáhlo srovnatelných expozic omeprazolu s dospělými po léčbě 20 mg jednou denně [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Rasové nebo etnické skupiny
[Vidět KLINICKÁ FARMAKOLOGIE ].
Pacienti s poruchou ledvin
pacientů s chronickým poškozením ledvin (clearance kreatininu mezi 10 a 62 ml/min/1,73 m²) byla likvidace omeprazolu velmi podobná jako u zdravých subjektů, i když došlo k mírnému zvýšení biologické dostupnosti. Protože vylučování močí je primární cestou vylučování metabolitů omeprazolu, jejich vylučování se zpomalovalo úměrně se sníženou clearance kreatininu. Toto zvýšení biologické dostupnosti se nepovažuje za klinicky významné.
Pacienti s poruchou funkce jater
U pacientů s chronickým onemocněním jater klasifikovaným jako Child-Pugh třída A (n=3), B (n=4) a C (n=1) se biologická dostupnost zvýšila přibližně na 100 % ve srovnání se zdravými jedinci, což odráží snížený první průchod plazmatický poločas léčiva se zvýšil na téměř 3 hodiny ve srovnání s poločasem u zdravých subjektů 0,5 až 1 hodina. Plazmatická clearance byla v průměru 70 ml/min, ve srovnání s hodnotou 500 až 600 ml/min u zdravých jedinců (viz DÁVKOVÁNÍ A PODÁVÁNÍ , Použití u konkrétních populací ].
Studie lékových interakcí
Vliv Omeprazolu Na Jiné Léky
Omeprazol je časově závislý inhibitor CYP2C19 a může zvýšit systémovou expozici současně podávaným lékům, které jsou substráty CYP2C19. Kromě toho podávání omeprazolu zvyšuje intragastrické pH a může změnit systémovou expozici určitých léků, které vykazují rozpustnost závislou na pH.
Antiretrovirotika
U některých antiretrovirových léků, jako je rilpivirin, atazanavir a nelfinavir, byly hlášeny snížené sérové koncentrace při podávání spolu s omeprazolem (viz DROGOVÉ INTERAKCE ].
Rilpivirin: Po opakovaných dávkách rilpivirinu (150 mg, denně) a omeprazolu (20 mg, denně) se AUC snížila o 40 %, Cmax o 40 % a Cmin o 33 % pro rilpivirin.
Nelfinavir: Po opakovaných dávkách nelfinaviru (1250 mg, dvakrát denně) a omeprazolu (40 mg denně) se AUC snížila o 36 % a 92 %, Cmax o 37 % a 89 % a Cmin o 39 % a 75 % pro nelfinavir a M8 .
Atazanavir: Po opakovaných dávkách atazanaviru (400 mg, denně) a omeprazolu (40 mg, denně, 2 hodiny před atazanavirem) se AUC snížila o 94 %, Cmax o 96 % a Cmin o 95 %.
saquinavir: Po opakovaném podávání sachinaviru/ritonaviru (1000/100 mg) dvakrát denně po dobu 15 dnů s omeprazolem 40 mg denně souběžně podávané 11. až 15. den.
AUC se zvýšila o 82 %, Cmax o 75 % a Cmin o 106 %. Mechanismus této interakce není zcela objasněn.
clopidogrel
Ve zkřížené klinické studii byl 72 zdravým subjektům podáván klopidogrel (300 mg nasycovací dávka a následně 75 mg denně) samotný a s omeprazolem (80 mg ve stejnou dobu jako klopidogrel) po dobu 5 dnů. Expozice aktivnímu metabolitu klopidogrelu se snížila o 46 % (1. den) a 42 % (5. den), když byly klopidogrel a omeprazol podávány společně.
Výsledky z jiné zkřížené studie u zdravých subjektů ukázaly podobnou farmakokinetickou interakci mezi klopidogrelem (300 mg nasycovací dávka/75 mg denní udržovací dávka) a omeprazolem 80 mg denně při současném podávání po dobu 30 dnů. Expozice aktivnímu metabolitu klopidogrelu byla během tohoto časového období snížena o 41 % až 46 %.
V jiné studii byly 72 zdravým subjektům podávány stejné dávky klopidogrelu a 80 mg omeprazolu, ale léky byly podávány s odstupem 12 hodin; výsledky byly podobné, což naznačuje, že podávání klopidogrelu a omeprazolu v různých časech nebrání jejich interakci [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , DROGOVÉ INTERAKCE ].
Mykofenolát mofetil
Podávání omeprazolu 20 mg dvakrát denně po dobu 4 dnů a jednorázová dávka 1000 mg MMF přibližně jednu hodinu po poslední dávce omeprazolu 12 zdravým subjektům ve zkřížené studii vedlo ke snížení Cmax o 52 % a snížení o 23 %. v AUC MPA [viz DROGOVÉ INTERAKCE ].
Cilostazol
Omeprazol působí jako inhibitor CYP2C19. Omeprazol podávaný v dávkách 40 mg denně po dobu jednoho týdne 20 zdravým subjektům ve zkřížené studii zvýšil Cmax cilostazolu o 18 % a AUC o 26 %. Cmax a AUC jednoho z aktivních metabolitů, 3,4-dihydro-cilostazolu, který má 4-7krát vyšší aktivitu než cilostazol, byly zvýšeny o 29 % a 69 %. Očekává se, že současné podávání cilostazolu s omeprazolem zvýší koncentrace cilostazolu a výše uvedeného aktivního metabolitu [viz DROGOVÉ INTERAKCE ].
Diazepam
Současné podávání omeprazolu 20 mg jednou denně a diazepamu 0,1 mg/kg podaných intravenózně vedlo k 27% snížení clearance a 36% prodloužení poločasu diazepamu (viz DROGOVÉ INTERAKCE ].
Digoxin
Současné podávání omeprazolu 20 mg jednou denně a digoxinu u zdravých subjektů zvýšilo biologickou dostupnost digoxinu o 10 % (30 % u dvou subjektů) [viz DROGOVÉ INTERAKCE ].
Vliv Jiných Léků Na Omeprazol
vorikonazol
Současné podávání omeprazolu a vorikonazolu (kombinovaný inhibitor CYP2C19 a CYP3A4) vedlo k více než zdvojnásobení expozice omeprazolu. Když byl vorikonazol (400 mg každých 12 hodin po dobu jednoho dne a následně 200 mg jednou denně po dobu 6 dnů) podáván s omeprazolem (40 mg jednou denně po dobu 7 dnů) zdravým subjektům, Cmax a AUC0-24 omeprazolu v ustáleném stavu významně zvýšené: v průměru 2krát (90% CI: 1,8, 2,6) a 4krát (90% CI: 3,3, 4,4), v tomto pořadí, ve srovnání s tím, kdy byl omeprazol podáván bez vorikonazolu [viz DROGOVÉ INTERAKCE ].
Mikrobiologie
Duální terapie omeprazolem a klarithromycinem a trojitá terapie omeprazolem, klarithromycinem a amoxicilinem se ukázala být účinná proti většině kmenů Helicobacter pylori in vitro a při klinických infekcích (viz INDIKACE A POUŽITÍ , Klinické studie ].
Helicobacter pylori
Testování citlivosti izolátů H. pylori bylo provedeno na amoxicilin a klarithromycin pomocí metodologie ředění agaru1 a byly stanoveny minimální inhibiční koncentrace (MIC).
Standardizované postupy testování citlivosti vyžadují použití laboratorních kontrolních mikroorganismů ke kontrole technických aspektů laboratorních postupů.
Odolnost před úpravou
Míra rezistence před léčbou klarithromycinem byla 3,5 % (4/113) ve studiích duální terapie omeprazolem/klaritromycinem (4 a 5) a 9,3 % (41/439) ve studiích trojité terapie omeprazol/klaritromycin/amoxicilin (1, 2 a 3).
Izoláty citlivé na amoxicilin (≤ 0,25 μg/ml) byly nalezeny u 99,3 % (436/439) pacientů ve studiích trojité terapie omeprazol/klaritromycin/amoxicilin (1, 2 a 3). Minimální inhibiční koncentrace (MIC) amoxicilinu před léčbou > 0,25 μg/ml se vyskytly u 0,7 % (3/439) pacientů, z nichž všichni byli ve studii s klarithromycinem a amoxicilinem. Jeden pacient měl před léčbou nepotvrzenou minimální inhibiční koncentraci amoxicilinu (MIC) > 256 μg/ml pomocí Etest®.
Pacienti, u kterých nebyla eradikována H. pylori po trojkombinaci omeprazol/klaritromycin/amoxicilin nebo duální terapii omeprazol/klaritromycin, budou pravděpodobně mít izoláty H. pylori rezistentní na klarithromycin. Pokud je to možné, mělo by být proto provedeno testování citlivosti na klarithromycin. Pacienti s H. pylori rezistentními na klarithromycin by neměli být léčeni žádným z následujících přípravků: duální terapie omeprazol/klaritromycin, trojkombinace omeprazol/klaritromycin/amoxicilin nebo jiné režimy, které zahrnují klarithromycin jako jediné antimikrobiální činidlo.
Výsledky testu citlivosti na amoxicilin a klinické/bakteriologické výsledky
klinických studiích trojité terapie bylo 84,9 % (157/185) pacientů ve skupině léčené omeprazolem/klaritromycinem/amoxicilinem, kteří měli před léčbou MIC citlivé na amoxicilin (≤ 0,25 μg/ml), eradikováno H. pylori (18 % /185) selhala terapie. Z 28 pacientů, u kterých selhala trojitá terapie, 11 nemělo žádné výsledky testu citlivosti po léčbě a 17 mělo po léčbě izoláty H. pylori s MIC citlivými na amoxicilin. Jedenáct z pacientů, u kterých selhala trojitá terapie, mělo také po léčbě izoláty H. pylori s MIC rezistentními na klarithromycin.
Test citlivosti na Helicobacter pylori
Informace o testování citlivosti na Helicobacter pylori naleznete v části Mikrobiologie v informacích o předepisování claritromycinu a amoxicilinu.
Účinky na mikrobiální ekologii gastrointestinálního traktu
Snížená žaludeční acidita způsobená jakýmikoli prostředky, včetně inhibitorů protonové pumpy, zvyšuje počet bakterií v žaludku normálně přítomných v gastrointestinálním traktu. Léčba inhibitory protonové pumpy může vést k mírně zvýšenému riziku gastrointestinálních infekcí, jako jsou Salmonella a Campylobacter a u hospitalizovaných pacientů možná také Clostridium difficile.
Farmakogenomika
CYP2C19, polymorfní enzym, se účastní metabolismu omeprazolu. Alela CYP2C19*1 je plně funkční, zatímco alely CYP2C19*2 a *3 jsou nefunkční. Existují další alely spojené s žádnou nebo sníženou enzymatickou funkcí. Pacienti nesoucí dvě plně funkční alely jsou rychlí metabolizátoři a pacienti nesoucí dvě alely se ztrátou funkce jsou pomalí metabolizátoři. U extenzivních metabolizátorů je omeprazol primárně metabolizován CYP2C19.
Systémová expozice omeprazolu se liší podle stavu metabolismu pacienta: pomalí metabolizátoři > střední metabolizátoři > rychlí metabolizátoři. Přibližně 3 % bělochů a 15 až 20 % Asiatů jsou pomalí metabolizátoři CYP2C19.
Ve farmakokinetické studii s jednorázovou dávkou 20 mg omeprazolu byla AUC omeprazolu u asijských subjektů přibližně čtyřnásobná než u bělochů (viz DÁVKOVÁNÍ A PODÁVÁNÍ , Použití u konkrétních populací ].
Klinické studie
Aktivní duodenální vřed
multicentrické, dvojitě zaslepené, placebem kontrolované studii se 147 pacienty s endoskopicky dokumentovaným duodenálním vředem bylo procento pacientů vyléčených (podle protokolu) po 2 a 4 týdnech významně vyšší u omeprazolových tobolek s opožděným uvolňováním 20 mg jednou denně než s placebem (p ≤ 0,01).
Léčba aktivního duodenálního vředu % vyléčených pacientů
Úplná denní a noční úleva od bolesti se objevila významně rychleji (p ≤ 0,01) u pacientů léčených tobolkami omeprazol magnesium s opožděným uvolňováním 20 mg než u pacientů léčených placebem. Na konci studie významně více pacientů, kteří dostávali omeprazol magnesium tobolky s opožděným uvolňováním, mělo úplnou úlevu od denní bolesti (p ≤ 0,05) a noční bolesti (p ≤ 0,01).
multicentrické, dvojitě zaslepené studii s 293 pacienty s endoskopicky dokumentovaným duodenálním vředem bylo procento pacientů vyléčených (podle protokolu) po 4 týdnech významně vyšší s omeprazolem v tobolkách s opožděným uvolňováním 20 mg jednou denně než s ranitidinem 150 mg dvakrát denně ( p
Léčba aktivního duodenálního vředu % vyléčených pacientů
U pacientů léčených omeprazolem ve formě tobolek s hořčíkem s opožděným uvolňováním došlo k hojení významně rychleji než u pacientů léčených ranitidinem 150 mg dvakrát denně (p
V zahraniční nadnárodní randomizované, dvojitě zaslepené studii se 105 pacienty s endoskopicky dokumentovaným duodenálním vředem byly po 2, 4 a 8 týdnech porovnány 20 mg a 40 mg tobolky omeprazol magnesium s opožděným uvolňováním se 150 mg ranitidinu dvakrát denně. Po 2 a 4 týdnech byly obě dávky PRILOSEC 10 mg statisticky lepší (podle protokolu) než ranitidin, ale 40 mg nebylo lepší než 20 mg tobolek s omeprazolovým hořčíkem s opožděným uvolňováním a po 8 týdnech nebyl žádný významný rozdíl mezi aktivní léky.
Léčba aktivního duodenálního vředu % vyléčených pacientů
Eradikace H. pylori u pacientů s duodenálním vředem
Trojitá terapie (omeprazol hořčík tobolky s opožděným uvolňováním/klaritromycin/amoxicilin)
Tři randomizované, dvojitě zaslepené klinické studie v USA u pacientů s infekcí H. pylori a duodenální vředovou chorobou (n = 558) porovnávaly omeprazol magnesium tobolky s opožděným uvolňováním plus klarithromycin plus amoxicilin s clarithromycinem plus amoxicilinem. Dvě studie (1 a 2) byly provedeny u pacientů s aktivním duodenálním vředem a druhá studie (3) byla provedena u pacientů s anamnézou duodenálního vředu v posledních 5 letech, ale bez vředu přítomného v době zařazení do studie . Dávkovací režim ve studiích byl omeprazol magnesium tobolky s opožděným uvolňováním 20 mg dvakrát denně plus klarithromycin 500 mg dvakrát denně plus amoxicilin 1 g dvakrát denně po dobu 10 dnů; nebo klarithromycin 500 mg dvakrát denně plus amoxicilin 1 g dvakrát denně po dobu 10 dnů. Ve studiích 1 a 2 dostávali pacienti, kteří užívali režim s omeprazolem, také dalších 18 dní tobolky omeprazolu s hořčíkem s opožděným uvolňováním v dávce 20 mg jednou denně. Studovanými cílovými body byla eradikace H. pylori a hojení duodenálních vředů (pouze studie 1 a 2). Stav H. pylori byl stanoven pomocí CLOtest®, histologie a kultivace ve všech třech studiích. U daného pacienta byl H. pylori považován za eradikovaný, pokud byly alespoň dva z těchto testů negativní a žádný nebyl pozitivní.
Kombinace omeprazolu plus klarithromycinu plus amoxicilinu byla účinná při eradikaci H. pylori.
Duální terapie (omeprazol hořčík tobolky s opožděným uvolňováním/klaritromycin)
Čtyři randomizované, dvojitě zaslepené, multicentrické studie (4, 5, 6 a 7) hodnotily tobolky hořčíku omeprazolu s opožděným uvolňováním 40 mg jednou denně plus klarithromycin 500 mg třikrát denně po dobu 14 dnů, po nichž následoval omeprazol hořčík s opožděným uvolňováním tobolky 20 mg jednou denně (studie 4, 5 a 7) nebo omeprazol magnesium tobolky s opožděným uvolňováním 40 mg jednou denně (studie 6) po dobu dalších 14 dnů u pacientů s aktivním duodenálním vředem spojeným s H. pylori. Studie 4 a 5 byly provedeny v USA a Kanadě a zahrnovaly 242 a 256 pacientů. Infekce H. pylori a duodenální vřed byly potvrzeny u 219 pacientů ve studii 4 a 228 pacientů ve studii 5. Tyto studie porovnávaly kombinovaný režim s tobolkami omeprazolu s hořčíkem s opožděným uvolňováním a monoterapií klarithromycinem. Studie 6 a 7 byly provedeny v Evropě a zahrnovaly 154 a 215 pacientů. Infekce H. pylori a duodenální vřed byly potvrzeny u 148 pacientů ve studii 6 a 208 pacientů ve studii 7. Tyto studie porovnávaly kombinovaný režim s monoterapií omeprazolem. Výsledky analýz účinnosti pro tyto studie jsou popsány níže. Eradikace H. pylori byla definována jako žádný pozitivní test (kultura nebo histologie) 4 týdny po ukončení léčby a dva negativní testy byly požadovány, aby bylo možné považovat H. pylori za eradikované. V analýze podle protokolu byli vyloučeni následující pacienti: pacienti, kteří nedokončili léčbu, pacienti s chybějícími testy H. pylori po léčbě a pacienti, u kterých nebyla hodnocena eradikace H. pylori, protože se u nich na konci léčby objevil vřed .
Kombinace omeprazolu a klarithromycinu byla účinná při eradikaci H. pylori.
Hojení vředů se významně nelišilo, když byl k léčbě omeprazolem přidán klarithromycin ve srovnání s léčbou samotným omeprazolem.
Kombinace omeprazolu a klarithromycinu byla účinná při eradikaci H. pylori a snížení recidivy duodenálního vředu.
Aktivní benigní žaludeční vřed
V americké multicentrické, dvojitě zaslepené studii omeprazolu 40 mg jednou denně, 20 mg jednou denně a placeba u 520 pacientů s endoskopicky diagnostikovaným žaludečním vředem byly získány následující výsledky.
Léčba žaludečního vředu % pacientů vyléčených (všichni pacienti léčeni)
U stratifikovaných skupin pacientů s velikostí vředu menší nebo rovnou 1 cm nebyl zjištěn žádný rozdíl v rychlosti hojení mezi 40 mg a 20 mg ani po 4, ani po 8 týdnech. U pacientů s velikostí vředu větší než 1 cm byla dávka 40 mg po 8 týdnech významně účinnější než 20 mg.
zahraniční, nadnárodní, dvojitě zaslepené studii 602 pacientů s endoskopicky diagnostikovaným žaludečním vředem byl hodnocen omeprazol 40 mg 1x denně, 20 mg 1x denně a ranitidin 150 mg 2x denně.
Léčba žaludečního vředu % pacientů vyléčených (všichni pacienti léčeni)
Symptomatická GERD
Ve Skandinávii byla provedena placebem kontrolovaná studie s cílem porovnat účinnost omeprazolu 20 mg nebo 10 mg jednou denně po dobu až 4 týdnů při léčbě pálení žáhy a dalších příznaků u pacientů s GERD bez EE. Výsledky jsou uvedeny níže.
% úspěšného symptomatického výsledku1
EE v důsledku kyselinou zprostředkovaného GERD
V americké multicentrické dvojitě zaslepené placebem kontrolované studii s 20 mg nebo 40 mg omeprazolových hořčíkových tobolek s opožděným uvolňováním u pacientů se symptomy GERD a endoskopicky diagnostikovanou EE stupně 2 nebo vyšším byly procentuální míry hojení (podle protokolu) následující :
této studii nebyla dávka 40 mg lepší než 20 mg dávka tobolek omeprazolu s hořčíkem s opožděným uvolňováním v procentuální rychlosti hojení. Jiné kontrolované klinické studie také ukázaly, že tobolky omeprazolu s hořčíkem se zpožděným uvolňováním jsou účinné u těžké GERD. Ve srovnání s antagonisty histaminových H2-receptorů u pacientů s EE, stupně 2 nebo vyšším, byly tobolky omeprazol magnesium s opožděným uvolňováním v dávce 20 mg významně účinnější než aktivní kontroly. Úplná denní a noční úleva od pálení žáhy se objevila významně rychleji (p
V této a pěti dalších kontrolovaných studiích GERD uvádělo významně více pacientů užívajících 20 mg omeprazolu (84 %) úplnou úlevu od příznaků GERD než pacientů užívajících placebo (12 %).
Udržování hojení EE v důsledku kyselinou zprostředkovaného GERD
americké dvojitě zaslepené, randomizované, multicentrické, placebem kontrolované studii byly u pacientů s endoskopicky potvrzenou zhojenou ezofagitidou studovány dva dávkové režimy tobolek omeprazol magnézia s opožděným uvolňováním. Výsledky pro stanovení udržení hojení EE jsou uvedeny níže.
Analýza tabulky životaschopnosti
V mezinárodní multicentrické dvojitě zaslepené studii byly u pacientů s endoskopicky potvrzenou zhojenou ezofagitidou srovnávány tobolky hořčíku omeprazolu s opožděným uvolňováním 20 mg denně a 10 mg denně s ranitidinem 150 mg dvakrát denně. Níže uvedená tabulka poskytuje výsledky této studie pro udržení hojení EE.
Analýza tabulky životaschopnosti
U pacientů, kteří měli zpočátku erozivní ezofagitidu stupně 3 nebo 4, bylo pro udržení po zhojení účinné 20 mg tobolek omeprazol magnézia s opožděným uvolňováním denně, zatímco 10 mg neprokázalo účinnost.
Patologické hypersekreční stavy
otevřených studiích se 136 pacienty s patologickými stavy hypersekrece, jako je Zollingerův-Ellisonův (ZE) syndrom s mnohočetnými endokrinními adenomy nebo bez nich, tobolky omeprazolu s opožděným uvolňováním významně inhibovaly sekreci žaludeční kyseliny a kontrolovaly související příznaky průjmu, anorexie a bolesti. Dávky v rozmezí od 20 mg každý druhý den do 360 mg denně udržovaly bazální sekreci kyseliny pod 10 mEq/hod u pacientů bez předchozí operace žaludku a pod 5 mEq/hod u pacientů s předchozí operací žaludku.
Počáteční dávky byly titrovány podle individuální potřeby pacienta a u některých pacientů byly nutné úpravy s časem [viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Omeprazol magnesium tobolky s opožděným uvolňováním byly dobře snášeny při těchto vysokých dávkách po dlouhou dobu (> 5 let u některých pacientů). U většiny pacientů se ZE nebyly sérové hladiny gastrinu ovlivněny tobolkami omeprazolu s hořčíkem s opožděným uvolňováním. U některých pacientů se však sérový gastrin zvýšil na hladiny vyšší, než byly hladiny přítomné před zahájením léčby omeprazolem. Nejméně u 11 pacientů se syndromem ZE na dlouhodobé léčbě omeprazolem ve formě tobolek s opožděným uvolňováním hořčíku se vyvinuly žaludeční karcinoidy. Předpokládá se, že tyto nálezy jsou spíše projevem základního stavu, o kterém je známo, že je s takovými nádory spojen, než výsledkem podávání omeprazolových hořčíkových tobolek s opožděným uvolňováním [viz NEŽÁDOUCÍ REAKCE ].
Pediatrické studie pro léčbu symptomatické GERD, léčbu EE způsobené kyselinou zprostředkovanou GERD a udržení hojení EE v důsledku kyselinou zprostředkovanou GERD
Léčba symptomatické GERD
Účinnost tobolek hořčíku omeprazolu s opožděným uvolňováním pro léčbu symptomatické GERD u pediatrických pacientů ve věku 1 až 16 let je částečně založena na údajích získaných od 125 pediatrických pacientů ve dvou nekontrolovaných klinických studiích.
Do první studie bylo zařazeno 12 dětských pacientů ve věku 1 až 2 roky s anamnézou klinicky diagnostikované GERD. Pacientům byla podávána jedna dávka omeprazolu (0,5 mg/kg, 1 mg/kg nebo 1,5 mg/kg) po dobu 8 týdnů jako otevřená kapsle v 8,4% roztoku hydrogenuhličitanu sodného. U 75 procent (9/12) pacientů se epizody zvracení/regurgitace snížily oproti výchozí hodnotě alespoň o 50 %.
Do druhé studie bylo zařazeno 113 dětských pacientů ve věku 2 až 16 let s anamnézou symptomů naznačujících symptomatickou GERD. Pacientům byla podávána jedna dávka omeprazolu (10 mg nebo 20 mg, na základě tělesné hmotnosti) po dobu 4 týdnů buď jako neporušená tobolka, nebo jako otevřená tobolka v jablečném pyré. Úspěšná odpověď byla definována jako žádné středně závažné nebo závažné epizody symptomů souvisejících s bolestí nebo zvracení/regurgitace během posledních 4 dnů léčby. Výsledky ukázaly míru úspěšnosti 60 % (9/15; 10 mg omeprazolu) a 59 % (58/98; 20 mg omeprazolu).
Léčba EE způsobená kyselinou zprostředkovanou GERD
nekontrolované, otevřené studii s titrací dávky pro léčbu EE u pediatrických pacientů ve věku 1 až 16 let byly vyžadovány dávky v rozmezí 0,7 až 3,5 mg/kg/den (80 mg/den). Dávky byly zahájeny na 0,7 mg/kg/den. Dávky byly zvyšovány po 0,7 mg/kg/den (pokud intraezofageální pH vykazovalo pH
Udržování hojení EE v důsledku kyselinou zprostředkovaného GERD
nekontrolované, otevřené studii udržení hojení EE u 46 dětských pacientů ve věku 1 až 16 let potřebovalo 54 % pacientů poloviční léčebnou dávku. Zbývající pacienti zvýšili léčebnou dávku (0,7 až maximálně 2,8 mg/kg/den) buď po celé udržovací období, nebo se vrátili k poloviční dávce před dokončením. Ze 46 pacientů, kteří vstoupili do udržovací fáze, 19 (41 %) nemělo žádný relaps během sledování (rozmezí 4 až 25 měsíců). Navíc udržovací terapie u pacientů s EE vedla k tomu, že 63 % pacientů nemělo žádné celkové příznaky.
REFERENCE
1. Institut klinických a laboratorních standardů (CLSI). Metody ředění Testy antimikrobiální citlivosti na bakterie, které rostou aerobně; Schválený standard – desáté vydání. Dokument CLSI M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania, 19087, USA 2015.
INFORMACE PRO PACIENTA
PRILOSEC® (pry-lo-sec) (omeprazol magnesium) pro perorální suspenzi s opožděným uvolňováním
Jaké jsou nejdůležitější informace, které bych měl o PRILOSEC vědět?
PRILOSEC 10 mg může pomoci vašim příznakům souvisejícím s kyselinou, ale přesto můžete mít vážné žaludeční potíže. Promluvte si se svým lékařem.
PRILOSEC může způsobit závažné nežádoucí účinky, včetně:
- Typ ledvinového problému (akutní tubulointersticiální nefritida). U některých lidí, kteří užívají léky na bázi inhibitoru protonové pumpy (PPI), včetně přípravku PRILOSEC, se může rozvinout problém s ledvinami nazývaný akutní tubulointersticiální nefritida, ke kterému může dojít kdykoli během léčby přípravkem PRILOSEC. Okamžitě zavolejte svého lékaře, pokud se sníží množství moči nebo pokud máte krev v moči.
- Průjem způsobený infekcí (Clostridium difficile) ve střevech. Okamžitě zavolejte svého lékaře, pokud máte vodnatou stolici nebo bolesti žaludku, které neustupují. Můžete a nemusíte mít horečku.
- Zlomeniny kostí (kyčle, zápěstí nebo páteře). Zlomeniny kostí v kyčli, zápěstí nebo páteři se mohou objevit u lidí, kteří užívají více denních dávek léků PPI a po dlouhou dobu (rok nebo déle). Informujte svého lékaře, pokud máte zlomeninu kosti, zejména v kyčli, zápěstí nebo páteři.
- Některé typy lupus erythematodes. Lupus erythematodes je autoimunitní porucha (imunitní buňky těla napadají jiné buňky nebo orgány v těle). U některých lidí, kteří užívají léky na PPI, včetně přípravku PRILOSEC 10 mg, se mohou vyvinout určité typy lupus erythematodes nebo se u nich může zhoršit lupus, který již mají. Okamžitě zavolejte svého lékaře, pokud máte novou nebo zhoršující se bolest kloubů nebo vyrážku na tvářích nebo pažích, která se zhoršuje na slunci.
Poraďte se se svým lékařem o riziku těchto závažných nežádoucích účinků. PRILOSEC 10 mg může mít další závažné nežádoucí účinky. Viz "Jaké jsou možné vedlejší účinky přípravku PRILOSEC 20 mg?"
Co je PRILOSEC 20 mg?
Lék na předpis nazývaný inhibitor protonové pumpy (PPI), který se používá ke snížení množství kyseliny ve vašem žaludku.
U dospělých, PRILOSEC 20 mg se používá pro:
- až 8 týdnů na hojení duodenálních vředů.
- 10 až 14 dní s určitými antibiotiky k léčbě infekce způsobené bakterií zvanou H. pylori. V případě potřeby může lékař předepsat dalších 14 až 18 dní přípravku PRILOSEC po léčbě antibiotiky.
- až 8 týdnů na hojení žaludečních vředů.
- až 4 týdny k léčbě pálení žáhy a dalších příznaků, které se vyskytují při gastroezofageální refluxní chorobě (GERD).
- až 8 týdnů pro hojení a zmírnění symptomů poškození sliznice jícnu souvisejícího s kyselinou (nazývané erozivní ezofagitida nebo EE). Pacientům, jejichž EE se nehojí, může lékař předepsat další 4 týdny přípravku PRILOSEC 20 mg.
- udržení hojení EE a pomoci zabránit návratu příznaků pálení žáhy způsobených GERD. Není známo, zda je PRILOSEC bezpečný a účinný, pokud je pro tento účel používán déle než 12 měsíců.
- dlouhodobá léčba stavů, kdy váš žaludek tvoří příliš mnoho kyseliny. To zahrnuje vzácný stav nazývaný Zollinger-Ellisonův syndrom.
U dětí ve věku od 1 do 16 let PRILOSEC 20 mg se používá pro:
- až 4 týdny k léčbě pálení žáhy a dalších příznaků, které se vyskytují u GERD.
- až 8 týdnů k léčbě GERD pomocí EE.
- udržení hojení EE a pomoci zabránit návratu příznaků pálení žáhy způsobených GERD. Není známo, zda je PRILOSEC bezpečný a účinný, pokud je pro tento účel používán déle než 12 měsíců.
U dětí ve věku od 1 měsíce do méně než 12 měsíců, PRILOSEC 10 mg se používá pro:
- až 6 týdnů k léčbě GERD pomocí EE. Není známo, zda je PRILOSEC bezpečný a účinný pro jiná použití u dětí ve věku od 1 měsíce do méně než 12 měsíců nebo u dětí mladších 1 měsíce.
Neužívejte PRILOSEC, pokud:
- alergický na omeprazol, jakýkoli jiný lék PPI nebo na kteroukoli složku přípravku PRILOSEC. Úplný seznam složek najdete na konci této Příručky pro léky.
- užívání léku, který obsahuje rilpivirin (EDURANT, COMPLERA, ODEFSEY) používaný k léčbě HIV-1 (virus lidské imunodeficience).
Před užitím přípravku PRILOSEC 20 mg informujte svého lékaře o všech svých zdravotních potížích, včetně toho, zda:
- máte nízké hladiny hořčíku, nízké hladiny vápníku a nízké hladiny draslíku v krvi.
- jste těhotná nebo plánujete otěhotnět. Není známo, zda PRILOSEC 10 mg poškodí vaše nenarozené dítě.
- kojíte nebo plánujete kojit. PRILOSEC 40 mg může přecházet do vašeho mateřského mléka. Pokud užíváte PRILOSEC, poraďte se se svým lékařem o nejlepším způsobu výživy svého dítěte.
- Informujte svého lékaře o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků. Zvláště informujte svého lékaře, pokud užíváte lék, který obsahuje klarithromycin nebo amoxicilin, klopidogrel (Plavix), metotrexát (Otrxup, Rasuvo, Trexall, XATMEP), digoxin (LANOXIN), vodní pilulku (diuretikum), třezalku tečkovanou (Hypericum perforatum) nebo rifampin (Rimactane, Rifater, Rifamate).
Jak mám užívat PRILOSEC 20 mg?
- Užívejte PRILOSEC 20 mg přesně podle pokynů svého lékaře.
- Bez porady se svým lékařem neměňte dávku ani nepřestávejte přípravek PRILOSEC 40 mg.
- PRILOSEC se obvykle užívá 1krát denně.
- Užívejte PRILOSEC 20 mg před jídlem.
- PRILOSECEM lze užívat antacida.
- PRILOSEC se smíchá s vodou a lze jej užívat ústy nebo podávat nazogastrickou (NG) sondou nebo žaludeční sondou.
- Viz "Návod k použití" na konci tohoto Návodu k medikaci najdete pokyny, jak smíchat a užívat PRILOSEC 10 mg ústy ve vodě nebo jak smíchat a podat PRILOSEC NG sondou nebo žaludeční sondou rozmíchanou ve vodě.
- Pokud vynecháte dávku přípravku PRILOSEC, vezměte si ji, jakmile si vzpomenete. Pokud je téměř čas na další dávku, neužívejte vynechanou dávku. Užijte další dávku v obvyklou dobu. Neužívejte 2 dávky současně.
- Pokud užijete příliš mnoho přípravku PRILOSEC, ihned zavolejte svému lékaři nebo svému toxikologickému centru na číslo 1-800-222-1222 nebo jděte na nejbližší pohotovost.
Jaké jsou možné vedlejší účinky přípravku PRILOSEC 40 mg?
PRILOSEC může způsobit závažné nežádoucí účinky, včetně:
- Vidět Jaké jsou nejdůležitější informace, které bych měl vědět o přípravku PRILOSEC 40 mg?
- Nízká hladina vitamínu B-12 ve vašem těle se může objevit u lidí, kteří užívali PRILOSEC 40 mg po dlouhou dobu (více než 3 roky). Informujte svého lékaře, pokud máte příznaky nízké hladiny vitaminu B-12, včetně dušnosti, točení hlavy, nepravidelného srdečního tepu, svalové slabosti, bledé kůže, pocitu únavy, změn nálady a brnění nebo necitlivosti v pažích a nohou.
- Nízká hladina hořčíku a metabolismus minerálů ve vašem těle se může stát u lidí, kteří užívali PRILOSEC alespoň 3 měsíce. Informujte svého lékaře, pokud máte příznaky nízké hladiny hořčíku, včetně záchvatů, závratí, nepravidelného srdečního tepu, nervozity, bolesti svalů nebo slabosti a křečí rukou, nohou nebo hlasu.
- Výrůstky žaludku (polypy fundické žlázy). Lidé, kteří užívají léky PPI po dlouhou dobu, mají zvýšené riziko vzniku určitého typu žaludečních výrůstků nazývaných polypy fundických žláz, zejména po užívání léků PPI déle než 1 rok.
- Závažné kožní reakce. PRILOSEC může způsobit vzácné, ale závažné kožní reakce, které mohou postihnout kteroukoli část vašeho těla. Tyto závažné kožní reakce mohou vyžadovat léčbu v nemocnici a mohou být život ohrožující:
- Kožní vyrážka, která může mít puchýře, olupování nebo krvácení na kterékoli části kůže (včetně rtů, očí, úst, nosu, genitálií, rukou nebo nohou).
- Můžete mít také horečku, zimnici, bolesti těla, dušnost nebo zvětšené lymfatické uzliny.
Přestaňte užívat PRILOSEC 20 mg a ihned kontaktujte svého lékaře. Tyto příznaky mohou být prvním příznakem závažné kožní reakce.
Mezi nejčastější nežádoucí účinky přípravku PRILOSEC 40 mg u dospělých patří: bolest hlavy, bolest v oblasti žaludku (břicha), nevolnost, průjem, zvracení a plynatost.
Mezi nejčastější nežádoucí účinky přípravku PRILOSEC u dětí ve věku 1 až 16 let patří: infekce horních cest dýchacích, horečka, bolest hlavy, bolest v oblasti žaludku (břicha), nevolnost, průjem, zvracení a plynatost. Toto nejsou všechny možné vedlejší účinky přípravku PRILOSEC. Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám uchovávat PRILOSEC 40 mg?
Skladujte PRILOSEC při pokojové teplotě mezi 68°F až 77°F (20°C až 25°C).
Uchovávejte PRILOSEC 20 mg a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a efektivním používání přípravku PRILOSEC.
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Nepoužívejte PRILOSEC pro stav, pro který nebyl předepsán. Nedávejte PRILOSEC 40 mg jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit. Můžete požádat svého lékaře nebo lékárníka o informace o přípravku PRILOSEC 20 mg, který je určen pro zdravotnické pracovníky.
Jaké jsou složky přípravku PRILOSEC?
Aktivní složka: omeprazol magnesium
Neaktivní složky: glycerylmonostearát, hydroxypropylcelulóza, hypromelóza, stearát hořečnatý, kopolymer C kyseliny methakrylové, polysorbát, kuličky cukru, mastek a triethylcitrát a také neaktivní granule. Neaktivní granule se skládají z kyseliny citrónové, krospovidonu, dextrózy, hydroxypropylcelulózy, oxidu železitého a xanthanové gumy.
NÁVOD K POUŽITÍ
PRILOSEC® (pry-lo-sec) (omeprazol magnesium) pro perorální suspenzi s opožděným uvolňováním
Užívání PRILOSEC 40 mg ve vodě:
Podání PRILOSECU s vodou nazogastrickou (NG) sondou nebo žaludeční sondou:
Lidem, kteří mají NG sondu nebo žaludeční sondu velikosti 6 nebo větší, může být PRILOSEC podáván následovně:
Tato příručka pro léky byla schválena americkým Úřadem pro kontrolu potravin a léčiv
