Prevacid 15mg, 30mg Lansoprazole Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Prevacid a jak se používá?
Prevacid 15 mg je lék na předpis používaný k léčbě příznaků žaludečních a střevních vředů a ke snížení množství kyseliny produkované v žaludku. Prevacid 15 mg lze užívat samostatně nebo s jinými léky.
- Prevacid 15 mg je inhibitor protonové pumpy.
Jaké jsou možné nežádoucí účinky přípravku Prevacid 30 mg?
Prevacid 30 mg může způsobit závažné nežádoucí účinky, včetně:
- silná bolest žaludku,
- průjem obsahující krev,
- záchvat (křeče,
- potíže s močením,
- krev ve vaší moči,
- otok,
- rychlý nárůst hmotnosti,
- závrať,
- rychlý nebo nepravidelný srdeční tep,
- třes,
- trhavé pohyby svalů,
- pocit nervozity,
- svalové křeče nebo křeče v rukou nebo nohou,
- kašel,
- pocit, že se dusíš,
- bolesti kloubů a
- kožní vyrážka na tvářích nebo pažích, která se zhoršuje slunečním zářením
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Prevacid 15 mg patří:
- nevolnost,
- bolest břicha,
- průjem,
- zácpa a
- bolest hlavy
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
Toto nejsou všechny možné vedlejší účinky přípravku Prevacid. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
PŘEDCHÁZET (lansoprazol) orálně se rozpadající tablety s opožděným uvolňováním
POPIS
Účinnou složkou přípravku PREVACID 30 mg tobolky s opožděným uvolňováním a PREVACID 15 mg SoluTab perorálně se rozpadající tablety s opožděným uvolňováním je lansoprazol, substituovaný benzimidazol, 2-[[[3-methyl-4-(2,2,2trifluorethoxy)-2-pyridyl] methyl] sulfinyl] benzimidazol, sloučenina inhibující sekreci žaludeční kyseliny. Jeho empirický vzorec je C16H14F3N3O2S s molekulovou hmotností 369,37. Lansoprazol má následující strukturu:
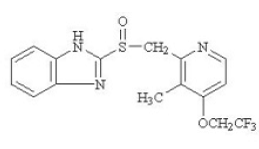
Lansoprazol je bílý až hnědobílý krystalický prášek bez zápachu, který taje za rozkladu při přibližně 166 °C. Lansoprazol je volně rozpustný v dimethylformamidu; rozpustný v methanolu; těžce rozpustný v ethanolu; mírně rozpustný v ethylacetátu, dichlormethanu a acetonitrilu; velmi málo rozpustný v etheru a prakticky nerozpustný v hexanu a vodě.
Lansoprazol je stabilní při vystavení světlu po dobu až dvou měsíců. Rychlost degradace sloučeniny ve vodném roztoku se zvyšuje s klesajícím pH. Poločas rozpadu léčivé látky ve vodném roztoku při 25 °C je přibližně 0,5 hodiny při pH 5,0 a přibližně 18 hodin při pH 7,0.
PREVACID se dodává v tobolkách s opožděným uvolňováním a PREVACID 15 mg SoluTab se dodává v perorálně se rozpadajících tabletách s opožděným uvolňováním (SoluTab) pro perorální podání.
PREVACID je dostupný ve dvou dávkovacích silách: 15 a 30 mg lansoprazolu v jedné tobolce. Každá tobolka s opožděným uvolňováním obsahuje enterosolventní granule skládající se z 15 nebo 30 mg lansoprazolu (aktivní složka) a následujících neaktivních složek: cukrové kuličky, sacharóza, kopolymer kyseliny methakrylové, nízko substituovaná hydroxypropylcelulóza, škrob, uhličitan hořečnatý, mastek, polyethylen glykol, oxid titaničitý, polysorbát 80, hydroxypropylcelulóza, koloidní oxid křemičitý, D&C Red č. 28, FD&C Blue č. 1, FD&C Green č. 31 a FD&C Red č. 40.
PREVACID 30 mg SoluTab je dostupný ve dvou dávkovacích silách: 15 a 30 mg lansoprazolu v jedné tabletě. Každá tableta s opožděným uvolňováním obsahuje enterosolventní mikrogranule skládající se z 15 nebo 30 mg lansoprazolu (účinná látka) a následujících neúčinných složek: mannitol, kyselina methakrylová, hydroxypropylcelulóza, monohydrát laktosy, kuličky mikrokrystalické celulózy, triethylcitrát, krospovidon, polyakrylát, uhličitan hořečnatý, aspartam2, glycerylmonostearát, hypromelóza, stearát hořečnatý, kyselina citrónová, oxid titaničitý, mastek, umělé jahodové aroma, polyethylenglykol, polysorbát 80 a oxid železitý.
Pouze 1PREVACID 15 mg tobolky. 2Fenylketonurika: PREVACID SoluTab obsahuje 2,5 mg fenylalaninu v 15 mg tabletě a 5,1 mg v 30 mg tabletě.
INDIKACE
Léčba aktivního duodenálního vředu
PREVACID a PREVACID SoluTab jsou indikovány u dospělých ke krátkodobé léčbě (po dobu čtyř týdnů) k hojení a zmírnění příznaků aktivního duodenálního vředu (viz Klinické studie ].
Eradikace H. pylori ke snížení rizika recidivy duodenálního vředu
Trojitá terapie: PREVACID nebo PREVACID SoluTab/amoxicilin/klaritromycin
PREVACID nebo PREVACID 30 mg SoluTab v kombinaci s amoxicilinem plus klarithromycinem jako trojkombinace je indikován u dospělých k léčbě pacientů s infekcí H. pylori a duodenální vředovou chorobou (aktivní nebo roční anamnéza duodenálního vředu) k eradikaci H. pylori. Bylo prokázáno, že eradikace H. pylori snižuje riziko recidivy duodenálního vředu [viz Klinické studie ].
Přečtěte si prosím úplné informace o předepisování amoxicilinu a klarithromycinu.
Duální terapie: PREVACID nebo PREVACID SoluTab/amoxicilin
PREVACID nebo PREVACID 15 mg SoluTab v kombinaci s amoxicilinem jako duální terapie je indikován u dospělých k léčbě pacientů s infekcí H. pylori a duodenální vředovou chorobou (aktivní duodenální vřed nebo dvanáctníkový vřed v anamnéze jeden rok), kteří jsou buď alergičtí nebo nesnášejí klarithromycin nebo u kterých je známa nebo existuje podezření na rezistenci na klarithromycin (viz informace o předepisování klarithromycinu, část Mikrobiologie). Bylo prokázáno, že eradikace H. pylori snižuje riziko recidivy duodenálního vředu [viz Klinické studie ].
Přečtěte si prosím úplné informace o předepisování amoxicilinu.
Údržba zahojených duodenálních vředů
PREVACID a PREVACID SoluTab jsou indikovány u dospělých k udržení hojení duodenálních vředů. Kontrolované studie nepřesahují 12 měsíců [viz Klinické studie ].
Léčba aktivního benigního žaludečního vředu
PREVACID a PREVACID 30 mg SoluTab jsou indikovány u dospělých ke krátkodobé léčbě (až osm týdnů) k hojení a zmírnění příznaků aktivního benigního žaludečního vředu (viz Klinické studie ].
Hojení žaludečního vředu spojeného s NSAID
PREVACID 30 mg a PREVACID SoluTab jsou indikovány u dospělých k léčbě žaludečních vředů souvisejících s NSAID u pacientů, kteří pokračují v užívání NSAID. Kontrolované studie nepřesáhly osm týdnů [viz Klinické studie ].
Snížení rizika žaludečního vředu spojeného s NSAID
PREVACID 15 mg a PREVACID SoluTab jsou indikovány u dospělých ke snížení rizika žaludečních vředů souvisejících s NSAID u pacientů s prokázaným žaludečním vředem v anamnéze, kteří vyžadují použití NSAID. Kontrolované studie nepřesáhly 12 týdnů [viz Klinické studie ].
Léčba symptomatické gastroezofageální refluxní choroby (GERD)
PREVACID 15 mg a PREVACID 30 mg SoluTab jsou indikovány ke krátkodobé léčbě dospělých a pediatrických pacientů ve věku 12 až 17 let (až osm týdnů) a dětských pacientů ve věku od jednoho do 11 let (až 12 týdnů) k léčbě pálení žáhy. a další příznaky spojené s GERD [viz Klinické studie ].
Léčba erozivní ezofagitidy (EE)
PREVACID 15 mg a PREVACID 30 mg SoluTab jsou indikovány pro krátkodobou léčbu u dospělých a pediatrických pacientů ve věku 12 až 17 let (až 8 týdnů) a dětských pacientů ve věku od jednoho do 11 let (až 12 týdnů) za účelem hojení a zmírnění příznaků všech stupňů EE.
U dospělých, kteří se nezhojí přípravkem PREVACID 30 mg nebo PREVACID 15 mg SoluTab po dobu osmi týdnů (5 až 10 %), může být užitečné podat dalších osm týdnů léčby. Pokud dojde k recidivě erozivní ezofagitidy, lze zvážit další osmitýdenní kúru přípravku PREVACID 30 mg nebo PREVACID SoluTab [viz Klinické studie ].
Údržba hojení EE
PREVACID a PREVACID SoluTab jsou indikovány u dospělých k udržení hojení EE. Kontrolované studie nepřesáhly 12 měsíců [viz Klinické studie ].
Patologické hypersekreční stavy včetně Zollinger-Ellisonova syndromu (ZES)
PREVACID 15 mg a PREVACID SoluTab jsou indikovány u dospělých k dlouhodobé léčbě patologických hypersekrečních stavů, včetně Zollinger-Ellisonova syndromu (viz Klinické studie ].
DÁVKOVÁNÍ A PODÁVÁNÍ
Doporučené dávkování pro dospělé podle indikace
Doporučené dávkování u dětí podle indikace
Pediatričtí pacienti ve věku 1 až 11 let
V klinických studiích nebyl přípravek PREVACID podáván dětem ve věku 1 až 11 let déle než 12 týdnů. Není známo, zda je přípravek PREVACID bezpečný a účinný, pokud je užíván déle, než je doporučená doba. Nepřekračujte doporučenou dávku a dobu užívání u pediatrických pacientů, jak je uvedeno níže [viz Použití u konkrétních populací ].
Poškození jater
Doporučená dávka je 15 mg perorálně denně u pacientů s těžkou poruchou jater (Child-Pugh C) (viz Použití u konkrétních populací ].
Důležité informace o administraci
- Užívejte PREVACID nebo PREVACID 30 mg SoluTab před jídlem.
- Nedrťte ani nežvýkejte PREVACID 15 mg tobolku nebo PREVACID 30 mg SoluTab.
- Užívejte PREVACID nebo PREVACID 30 mg SoluTab alespoň 30 minut před sukralfátem (viz DROGOVÉ INTERAKCE ].
- Antacida lze užívat současně s přípravkem PREVACID nebo PREVACID SoluTab.
- Vynechané dávky: Pokud dojde k vynechání dávky, podejte ji co nejdříve. Pokud však má být použita další plánovaná dávka, neužívejte vynechanou dávku a vezměte si další dávku včas. Neužívejte dvě dávky najednou, abyste nahradili vynechanou dávku.
PREVACID kapsle
- spolknout celé; nežvýkat.
- U pacientů, kteří mají potíže s polykáním tobolek, lze tobolky PREVACID otevřít a podat perorálně nebo nazogastrickou sondou v měkkých potravinách nebo tekutinách specifikovaných níže.
- Podávání přípravku PREVACID v potravinách nebo tekutinách jiných než níže uvedených nebylo klinicky studováno, a proto se nedoporučuje.
Podání v měkkých potravinách (jablečné pyré, ENSURE pudink, tvaroh, jogurt nebo pasírované hrušky):
Podání v tekutinách (jablečný džus, pomerančový džus nebo rajčatový džus):
Podání jablečným džusem přes nasogastrickou sondu (≥16 francouzsky)
PREVACID 15 mg SoluTab
- Nelámejte ani neřežte.
- Umístěte tabletu na jazyk, nechte ji rozpadnout, s vodou nebo bez vody, dokud nelze mikrogranule spolknout. Mikrogranule nežvýkejte.
- Tableta se typicky rozpadne za méně než jednu minutu.
- Alternativně lze dětem nebo jiným pacientům, kteří mají potíže s polykáním tablet, přípravek PREVACID SoluTab podávat s vodou pomocí perorální stříkačky nebo NG trubice následovně:
Podání S Vodou V Orální Stříkačce
Podání vodou pomocí NG trubice (≥8 francouzsky)
JAK DODÁVÁNO
Dávkové formy A Síly
PREVACID 15 mg tobolky s opožděným uvolňováním
- 15 mg síla je neprůhledná, růžovozelená tobolka s potiskem „TAP“ a „PREVACID 15“.
- 30 mg síla je neprůhledná, růžovo-černá tobolka s potiskem „TAP“ a „PREVACID 30“.
PREVACID 30 mg SoluTab orálně rozpadavé tablety s opožděným uvolňováním
- 15 mg síla je bílá až nažloutle bílá, nepotahovaná kulatá tableta obsahující oranžové až tmavě hnědé skvrny s vyraženým „15“ na jedné straně.
- 30 mg síla je bílá až nažloutle bílá, nepotahovaná kulatá tableta obsahující oranžové až tmavě hnědé skvrny s vyraženým „30“ na jedné straně.
Skladování A Manipulace
PREVACID tobolky s opožděným uvolňováním , 15 mg, jsou neprůhledné, růžové a zelené s potiskem „TAP“ a „PREVACID 15“ na tobolkách. 30 mg tobolky s opožděným uvolňováním jsou neprůhledné, růžové a černé s potiskem „TAP“ a „PREVACID 30“ na tobolce. Jsou k dispozici následovně:
PREVACID 30 mg SoluTab perorálně se rozpadající tablety s opožděným uvolňováním , 15 mg, jsou bílé až nažloutle bílé, kulaté nepotahované tablety obsahující oranžové až tmavě hnědé skvrny, s vyraženým „15“ na jedné straně tablety. 30 mg jsou bílé až nažloutle bílé, kulaté nepotahované tablety obsahující oranžové až tmavě hnědé skvrny s vyraženým „30“ na jedné straně tablety. Tablety jsou dostupné následovně:
Skladujte při teplotě 25 °C (77 °F); povoleny výchylky do 15-30°C (59-86°F)[viz USP řízená pokojová teplota ].
Distribuce: Takeda Pharmaceuticals America, Inc., Deerfield, IL 60015. Revize: červen 2018
VEDLEJŠÍ EFEKTY
Následující závažné nežádoucí účinky jsou popsány níže a jinde v označení:
- Akutní tubulointersticiální nefritida [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Průjem spojený s Clostridium difficile [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Zlomenina kosti [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Závažné kožní nežádoucí účinky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Kožní a systémový lupus erythematodes [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Nedostatek kyanokobalaminu (vitamín B12) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Hypomagnezémie a metabolismus minerálů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Polypy fundických žláz [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v klinické praxi.
Celosvětově bylo přípravkem PREVACID 30 mg léčeno více než 10 000 pacientů ve fázi 2 nebo fáze 3 klinických studií zahrnujících různé dávky a trvání léčby. Obecně byla léčba přípravkem PREVACID 30 mg dobře tolerována v krátkodobých i dlouhodobých studiích.
Následující nežádoucí účinky byly hlášeny ošetřujícím lékařem, že mají možný nebo pravděpodobný vztah k léku u 1 % nebo více pacientů léčených přípravkem PREVACID a vyskytovaly se ve vyšší míře u pacientů léčených přípravkem PREVACID než u pacientů léčených placebem v tabulce 1.
Bolest hlavy byla také pozorována ve více než 1% incidenci, ale byla častější u placeba. Výskyt průjmu byl podobný u pacientů, kteří dostávali placebo, a pacientů, kteří dostávali 15 a 30 mg přípravku PREVACID, ale vyšší u pacientů, kteří dostávali 60 mg přípravku PREVACID (2,9, 1,4, 4,2 a 7,4 %).
Nejčastěji hlášeným možná nebo pravděpodobně s léčbou souvisejícím nežádoucím účinkem během udržovací léčby byl průjem.
Ve studii snížení rizika přípravku PREVACID pro žaludeční vředy související s NSAID byla incidence průjmu u pacientů léčených přípravkem PREVACID 30 mg, misoprostolem a placebem 5, 22 a 3 %.
Jiná studie pro stejnou indikaci, kde pacienti užívali buď inhibitor COX-2, nebo lansoprazol a naproxen, prokázala, že bezpečnostní profil byl podobný předchozí studii. Další reakce z této studie, které nebyly dříve pozorovány v jiných klinických studiích s přípravkem PREVACID 30 mg, zahrnovaly kontuzi, duodenitidu, epigastrický diskomfort, poruchu jícnu, únavu, hlad, hiátovou kýlu, chrapot, zhoršené vyprazdňování žaludku, metaplazii a poškození ledvin.
Další nežádoucí účinky vyskytující se u méně než 1 % pacientů nebo subjektů, kteří dostávali PREVACID 15 mg v domácích studiích, jsou uvedeny níže:
Tělo jako celek - zvětšené břicho, alergická reakce, astenie, bolest zad, kandidóza, karcinom, bolest na hrudi (jinak nespecifikovaná), zimnice, otoky, horečka, chřipkový syndrom, halitóza, infekce (jinak nespecifikovaná), malátnost, bolest šíje, ztuhlost šíje, bolest , bolest pánve
Kardiovaskulární systém - angina, arytmie, bradykardie, cerebrovaskulární příhoda/mozkový infarkt, hypertenze/hypotenze, migréna, infarkt myokardu, palpitace, šok (oběhové selhání), synkopa, tachykardie, vazodilatace
Zažívací ústrojí - abnormální stolice, anorexie, bezoár, kardiospasmus, cholelitiáza, kolitida, sucho v ústech, dyspepsie, dysfagie, enteritida, říhání, stenóza jícnu, ezofageální vřed, ezofagitida, změna barvy stolice, flatulence, žaludeční uzliny/zánět žaludku, gastroenteritida, gastritida, gastritida, gastritida , gastrointestinální porucha, gastrointestinální krvácení, glositida, krvácení z dásní, hematemeze, zvýšená chuť k jídlu, zvýšené slinění, meléna, ulcerace v ústech, nevolnost a zvracení, nevolnost a zvracení a průjem, gastrointestinální moniliáza, rektální porucha, rektální krvácení, stomatitida, tenesmus, žízeň, porucha jazyka, ulcerózní kolitida, ulcerózní stomatitida
Endokrinní systém - diabetes mellitus, struma, hypotyreóza Hemický a lymfatický systém - anémie, hemolýza, lymfadenopatie
Poruchy metabolismu a výživy - avitaminóza, dna, dehydratace, hyperglykémie/hypoglykémie, periferní edém, přírůstek/úbytek hmotnosti
Muskuloskeletální systém - artralgie, artritida, onemocnění kostí, onemocnění kloubů, křeče v nohách, muskuloskeletální bolest, myalgie, myastenie, ptóza, synovitida
Nervový systém - abnormální sny, agitovanost, amnézie, úzkost, apatie, zmatenost, křeče, demence, depersonalizace, deprese, diplopie, závratě, emoční labilita, halucinace, hemiplegie, zhoršení nepřátelství, hyperkineze, hypertonie, hypestezie, nespavost, snížení/zvýšení libida, neuróza, parestézie, poruchy spánku, ospalost, poruchy myšlení, třes, vertigo
Dýchací systém - astma, bronchitida, zvýšený kašel, dušnost, epistaxe, hemoptýza, škytavka, laryngeální neoplazie, plicní fibróza, faryngitida, pleurální porucha, pneumonie, respirační porucha, zánět/infekce horních cest dýchacích, rýma, sinusitida, stridor
Kůže a přílohy - akné, alopecie, kontaktní dermatitida, suchá kůže, fixovaná erupce, porucha vlasů, makulopapulózní vyrážka, porucha nehtů, pruritus, vyrážka, karcinom kůže, kožní porucha, pocení, kopřivka
Speciální smysly - abnormální vidění, amblyopie, blefaritida, rozmazané vidění, katarakta, konjunktivitida, hluchota, suché oči, porucha ucha/očí, bolest oka, glaukom, zánět středního ucha, parosmie, fotofobie, degenerace/porucha sítnice, ztráta chuti, perverze chuti, tinnitus, zrak polní defekt
Urogenitální systém - abnormální menstruace, zvětšení prsou, bolest prsů, citlivost prsou, dysmenorea, dysurie, gynekomastie, impotence, ledvinový kámen, bolest ledvin, leukorea, menoragie, menstruační porucha, porucha penisu, polyurie, porucha varlat, bolest močové trubice, frekvence močení, retence moči, infekce močových cest, nutkání na močení, poruchy močení, vaginitida
Postmarketingové zkušenosti
Od uvedení přípravku PREVACID a PREVACID 30 mg SoluTab na trh byly hlášeny další nežádoucí účinky. Většina těchto případů pochází ze zahraničí a vztah k přípravku PREVACID 15 mg nebo PREVACID SoluTab nebyl stanoven. Protože tyto reakce byly hlášeny dobrovolně z populace neznámé velikosti, nelze odhadnout frekvenci. Tyto události jsou uvedeny níže podle tělesného systému COSTART.
Tělo jako celek - anafylaktické/anafylaktoidní reakce, systémový lupus erythematodes;
Zažívací ústrojí - hepatotoxicita, pankreatitida, zvracení;
Hemický a lymfatický systém - agranulocytóza, aplastická anémie, hemolytická anémie, leukopenie, neutropenie, pancytopenie, trombocytopenie a trombotická trombocytopenická purpura;
Infekce a nákazy - průjem související s Clostridium difficile;
Poruchy metabolismu a výživy - hypomagnezémie, hypokalcémie, hypokalémie, hyponatremie;
Muskuloskeletální systém - zlomenina kostí, myositida;
Kůže a přílohy - závažné dermatologické reakce včetně erythema multiforme, SJS/TEN (některé fatální), DRESS, AGEP, kožní lupus erythematodes;
Speciální smysly - porucha řeči;
Urogenitální systém - intersticiální nefritida, retence moči.
Kombinovaná terapie s amoxicilinem a klarithromycinem
V klinických studiích používajících kombinovanou léčbu přípravkem PREVACID plus amoxicilin a klarithromycin a přípravkem PREVACID 30 mg plus amoxicilin nebyly pozorovány žádné nežádoucí účinky typické pro tyto kombinace léků. Nežádoucí účinky, které se vyskytly, byly omezeny na ty, které byly dříve hlášeny u přípravku PREVACID 15 mg, amoxicilinu nebo klarithromycinu.
Trojitá terapie: PREVACID/amoxicilin/klaritromycin
Nejčastěji hlášenými nežádoucími účinky u pacientů, kteří dostávali trojkombinaci po dobu 14 dnů, byly průjem (7 %), bolest hlavy (6 %) a zkreslení chuti (5 %). Nebyly zjištěny žádné statisticky významné rozdíly ve frekvenci hlášených nežádoucích účinků mezi 10 a 14denními režimy trojité terapie. Žádné nežádoucí účinky související s léčbou nebyly pozorovány ve významně vyšší míře u trojkombinace než u jakéhokoli režimu duální terapie.
Duální terapie: PREVACID/amoxicilin
Nejčastěji hlášenými nežádoucími účinky u pacientů, kteří dostávali PREVACID 30 mg třikrát denně plus amoxicilin třikrát denně duální terapii, byly průjem (8 %) a bolest hlavy (7 %). Při duální léčbě přípravkem PREVACID 30 mg třikrát denně plus amoxicilin třikrát denně nebyly pozorovány žádné nežádoucí účinky související s léčbou ve významně vyšších četnostech než při podávání samotného přípravku PREVACID 15 mg.
Informace o nežádoucích účincích antibakteriálních látek (amoxicilin a klarithromycin) indikovaných v kombinaci s přípravkem PREVACID nebo PREVACID SoluTab naleznete v části Nežádoucí účinky v jejich informacích o předepisování.
Laboratorní hodnoty
Následující změny laboratorních parametrů u pacientů, kteří dostávali PREVACID 30 mg, byly hlášeny jako nežádoucí účinky:
Abnormální jaterní testy, zvýšený SGOT (AST), zvýšený SGPT (ALT), zvýšený kreatinin, zvýšená alkalická fosfatáza, zvýšené globuliny, zvýšení GGTP, zvýšení/snížení/abnormální WBC, abnormální AG poměr, abnormální RBC, bilirubinémie, zvýšení draslíku v krvi, zvýšená močovina v krvi, přítomnost krystalů v moči, eozinofilie, snížený hemoglobin, hyperlipémie, zvýšené/snížené elektrolyty, zvýšený/snížený cholesterol, zvýšené glukokortikoidy, zvýšené LDH, zvýšené/snížené/abnormální krevní destičky, zvýšené hladiny gastrinu a pozitivní skrytá krev ve stolici. Rovněž byly hlášeny abnormality moči, jako je albuminurie, glykosurie a hematurie. Byly hlášeny další izolované laboratorní abnormality.
placebem kontrolovaných studiích, kdy byly hodnoceny SGOT (AST) a SGPT (ALT), mělo 0,4 % (4/978) a 0,4 % (11/2 677) pacientů, kteří dostávali placebo a PREVACID, v daném pořadí zvýšení enzymů vyšší než trojnásobek horní hranice normálního rozmezí při poslední návštěvě ošetření. Žádný z těchto pacientů, kteří dostávali PREVACID 30 mg, nehlásil žloutenku kdykoli během studie.
V klinických studiích používajících kombinovanou léčbu přípravkem PREVACID 15 mg plus amoxicilin a klarithromycin a přípravkem PREVACID plus amoxicilin nebyly pozorovány žádné zvýšené laboratorní abnormality týkající se těchto kombinací léků.
Informace o změnách laboratorních hodnot u antibakteriálních látek (amoxicilin a klarithromycin) indikovaných v kombinaci s přípravkem PREVACID nebo PREVACID 30 mg SoluTab naleznete v části Nežádoucí účinky v informacích o jejich předepisování.
DROGOVÉ INTERAKCE
Tabulky 2 a 3 zahrnují léky s klinicky významnými lékovými interakcemi a interakcí s diagnostikou při současném podávání s přípravkem PREVACID 15 mg nebo PREVACID SoluTab a pokyny pro jejich prevenci nebo léčbu.
Chcete-li získat další informace o interakcích s PPI, podívejte se na označení současně užívaných léků.
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Přítomnost Malignity žaludku
U dospělých symptomatická odpověď na léčbu přípravkem PREVACID 15 mg nebo PREVACID SoluTab nevylučuje přítomnost žaludeční malignity. Zvažte další sledování a diagnostické testování u dospělých pacientů, kteří mají suboptimální odpověď nebo časný symptomatický relaps po dokončení léčby PPI. U starších pacientů zvažte i endoskopii.
Akutní tubulointersticiální nefritida
Akutní tubulointerstiální nefritida (TIN) byla pozorována u pacientů užívajících PPI a může se objevit kdykoli během léčby PPI. Pacienti mohou mít různé známky a příznaky od symptomatických reakcí přecitlivělosti až po nespecifické příznaky snížené funkce ledvin (např. malátnost, nauzea, anorexie). V hlášených sériích případů byli někteří pacienti diagnostikováni biopsií a bez extrarenálních projevů (např. horečka, vyrážka nebo artralgie). Přerušte léčbu přípravkem PREVACID nebo PREVACID 15 mg SoluTab a vyhodnoťte pacienty s podezřením na akutní TIN [viz KONTRAINDIKACE ].
Průjem spojený s Clostridium Difficile
Publikované observační studie naznačují, že léčba PPI, jako je PREVACID 30 mg a PREVACID 30 mg SoluTab, může být spojena se zvýšeným rizikem průjmu souvisejícího s Clostridium difficile (CDAD), zejména u hospitalizovaných pacientů. Tuto diagnózu je třeba zvážit u průjmu, který se nezlepšuje [viz NEŽÁDOUCÍ REAKCE ].
Pacienti by měli používat nejnižší dávku a nejkratší dobu léčby PPI odpovídající léčenému stavu.
CDAD byla hlášena při použití téměř všech antibakteriálních látek. Další informace specifické pro antibakteriální látky (klaritromycin a amoxicilin) indikované k použití v kombinaci s přípravkem PREVACID 15 mg nebo PREVACID 15 mg SoluTab naleznete v části Upozornění a bezpečnostní opatření v jejich informacích o předepisování.
Zlomenina kosti
Několik publikovaných observačních studií naznačuje, že léčba PPI může být spojena se zvýšeným rizikem zlomenin kyčle, zápěstí nebo páteře souvisejících s osteoporózou. Riziko zlomenin se zvýšilo u pacientů, kteří dostávali vysoké dávky, definované jako opakované denní dávky, a dlouhodobou terapii PPI (rok nebo déle). Pacienti by měli používat nejnižší dávku a nejkratší dobu léčby PPI odpovídající léčenému stavu. Pacienti s rizikem zlomenin souvisejících s osteoporózou by měli být léčeni podle zavedených pokynů pro léčbu [viz DÁVKOVÁNÍ A PODÁVÁNÍ , NEŽÁDOUCÍ REAKCE ].
Závažné kožní nežádoucí reakce
souvislosti s užíváním PPI byly hlášeny závažné kožní nežádoucí reakce, včetně Stevens-Johnsonova syndromu (SJS) a toxické epidermální nekrolýzy (TEN), lékové reakce s eozinofilií a systémovými příznaky (DRESS) a akutní generalizované exantematózní pustulózy (AGEP). [vidět NEŽÁDOUCÍ REAKCE ]. Přerušte léčbu přípravkem PREVACID 30 mg nebo PREVACID SoluTab při prvních známkách nebo příznacích závažných kožních nežádoucích reakcí nebo jiných příznaků přecitlivělosti a zvažte další hodnocení.
Kožní a systémový lupus erythematodes
U pacientů užívajících PPI, včetně lansoprazolu, byly hlášeny kožní lupus erythematodes (CLE) a systémový lupus erythematodes (SLE). Tyto příhody se objevily jak jako nový nástup, tak jako exacerbace stávajícího autoimunitního onemocnění. Většina případů lupus erythematodes vyvolaných PPI byla CLE.
Nejběžnější formou CLE hlášenou u pacientů léčených PPI byl subakutní CLE (SCLE) a vyskytoval se během týdnů až let po kontinuální medikamentózní terapii u pacientů od kojenců až po seniory. Obecně byly histologické nálezy pozorovány bez orgánového postižení.
Systémový lupus erythematodes (SLE) je u pacientů užívajících PPI méně často hlášen než CLE. SLE spojený s PPI je obvykle mírnější než SLE neindukovaný léky. Nástup SLE se typicky objevil během dnů až let po zahájení léčby primárně u pacientů od mladých dospělých po starší osoby. U většiny pacientů se objevila vyrážka; byly však také hlášeny artralgie a cytopenie.
Vyhněte se podávání PPI déle, než je lékařsky indikováno. Pokud jsou u pacientů užívajících přípravek PREVACID 15 mg nebo PREVACID SoluTab zaznamenány známky nebo příznaky odpovídající CLE nebo SLE, přerušte léčbu a odešlete pacienta k příslušnému specialistovi k vyšetření. Většina pacientů se zlepší po vysazení samotného PPI za čtyři až 12 týdnů. Sérologické vyšetření (např. ANA) může být pozitivní a vyřešení zvýšených sérologických testů může trvat déle než klinické projevy.
Nedostatek kyanokobalaminu (vitamín B12).
Každodenní léčba jakýmikoli léky potlačujícími kyselost po dlouhou dobu (např. déle než tři roky) může vést k malabsorpci kyanokobalaminu (vitamín B12) způsobené hypo- nebo achlorhydrií. V literatuře byly popsány vzácné zprávy o deficitu kyanokobalaminu vyskytujícího se při léčbě potlačující kyselost. Tuto diagnózu je třeba zvážit, pokud jsou u pacientů léčených přípravkem PREVACID nebo PREVACID SoluTab pozorovány klinické příznaky odpovídající nedostatku kyanokobalaminu.
Hypomagnezémie a metabolismus minerálů
Hypomagnezémie, symptomatická a asymptomatická, byla vzácně hlášena u pacientů léčených PPI po dobu alespoň tří měsíců, ve většině případů po roce léčby. Mezi závažné nežádoucí účinky patří tetanie, arytmie a záchvaty. Hypomagnezémie může vést k hypokalcemii a/nebo hypokalémii a může u rizikových pacientů zhoršit základní hypokalcemii. U většiny pacientů vyžadovala léčba hypomagnezémie náhradu hořčíku a vysazení PPI.
U pacientů, u kterých se očekává delší léčba nebo kteří užívají PPI s léky, jako je digoxin nebo léky, které mohou způsobit hypomagnezémii (např. diuretika), mohou zdravotníci zvážit sledování hladin hořčíku před zahájením léčby PPI a pravidelně [viz NEŽÁDOUCÍ REAKCE ].
Zvažte sledování hladin hořčíku a vápníku před zahájením léčby přípravkem PREVACID 30 mg nebo PREVACID SoluTab a pravidelně během léčby u pacientů s již existujícím rizikem hypokalcémie (např. hypoparatyreóza). Podle potřeby doplňte hořčík a/nebo vápník. Pokud je hypokalcémie refrakterní na léčbu, zvažte přerušení léčby PPI.
Interakce s vyšetřeními pro neuroendokrinní nádory
Hladiny sérového chromograninu A (CgA) se zvyšují sekundárně po lékem vyvolaném poklesu kyselosti žaludku. Zvýšená hladina CgA může způsobit falešně pozitivní výsledky při diagnostických vyšetřeních neuroendokrinních nádorů. Poskytovatelé zdravotní péče by měli dočasně přerušit léčbu lansoprazolem alespoň 14 dní před stanovením hladin CgA a zvážit opakování testu, pokud jsou počáteční hladiny CgA vysoké. Pokud se provádějí sériové testy (např. pro monitorování), měla by být pro testování použita stejná komerční laboratoř, protože referenční rozsahy mezi testy se mohou lišit [viz DROGOVÉ INTERAKCE , KLINICKÁ FARMAKOLOGIE ].
Interakce s methotrexátem
Literatura naznačuje, že současné užívání PPI s methotrexátem (primárně ve vysokých dávkách) může zvýšit a prodloužit sérové hladiny methotrexátu a/nebo jeho metabolitu, což může vést k toxicitě methotrexátu. Při podávání vysokých dávek metotrexátu lze u některých pacientů zvážit dočasné vysazení PPI [viz DROGOVÉ INTERAKCE , KLINICKÁ FARMAKOLOGIE ].
Pacienti s fenylketonurií
Fenylalanin může být škodlivý pro pacienty s fenylketonurií (PKU). PREVACID 30 mg SoluTab obsahuje fenylalanin, složku aspartamu. Jedna 15mg tableta obsahuje 2,5 mg a jedna 30mg tableta obsahuje 5,1 mg fenylalaninu. Před předepsáním přípravku PREVACID SoluTab pacientovi s PKU zvažte kombinované denní množství fenylalaninu ze všech zdrojů, včetně přípravku PREVACID 30 mg SoluTab.
Polypy fundických žláz
Užívání PPI je spojeno se zvýšeným rizikem polypů fundických žláz, které se zvyšuje s dlouhodobým užíváním, zejména po jednom roce. Většina uživatelů PPI, u kterých se vyvinuly polypy fundické žlázy, byla asymptomatická a polypy fundické žlázy byly identifikovány náhodně při endoskopii. Použijte nejkratší dobu trvání léčby PPI vhodnou pro léčený stav.
Riziko ztluštění srdeční chlopně u pediatrických pacientů mladších než jeden rok
PREVACID 30 mg a PREVACID SoluTab nejsou schváleny u pediatrických pacientů mladších jednoho roku. Neklinické studie na juvenilních potkanech s lansoprazolem prokázaly nežádoucí účinek ztluštění srdeční chlopně. Riziko poranění srdeční chlopně se nezdá být relevantní pro pacienty ve věku jednoho roku a starší [viz Použití u konkrétních populací ].
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( Průvodce léky a Návod k použití ).
Doporučte pacientům, aby:
Akutní tubulointersticiální nefritida
Zavolat svému poskytovateli zdravotní péče, pokud zaznamenají známky a / nebo příznaky spojené s akutní tubulointersticiální nefritidou [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Průjem spojený s Clostridium Difficile
Okamžitě zavolat svému poskytovateli zdravotní péče, pokud se u nich objeví průjem, který se nezlepší [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Zlomenina kosti
Nahlásit jakékoli zlomeniny, zejména kyčle, zápěstí nebo páteře, svému poskytovateli zdravotní péče [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Závažné kožní nežádoucí reakce
Chcete-li ukončit užívání přípravku PREVACID nebo PREVACID 30 mg SoluTab a okamžitě zavolat svému poskytovateli zdravotní péče k dalšímu posouzení [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Kožní a systémový lupus erythematodes
Okamžitě zavolat svého poskytovatele zdravotní péče o jakékoli nové nebo zhoršení příznaků spojených s kožním nebo systémovým lupus erythematodes [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Nedostatek kyanokobalaminu (vitamín B12).
Hlásit jakékoli klinické příznaky, které mohou být spojeny s nedostatkem kyanokobalaminu svému poskytovateli zdravotní péče, pokud užívají PREVACID nebo PREVACID SoluTab déle než tři roky [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Hypomagnezémie a minerály
Metabolismus Hlásit jakékoli klinické příznaky, které mohou být spojeny s hypomagnezémií, hypokalcemií a/nebo hypokalémií svému poskytovateli zdravotní péče, pokud užívají PREVACID nebo PREVACID 15 mg SoluTab po dobu alespoň tří měsíců [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Lékové interakce
Informujte pacienty, aby hlásili svému poskytovateli zdravotní péče, pokud užívají přípravky obsahující rilpivirin [viz KONTRAINDIKACE ] nebo vysoké dávky methotrexátu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Těhotenství
Informujte těhotnou ženu o možném riziku pro plod. Informujte ženy o reprodukčním potenciálu, aby informovaly svého poskytovatele zdravotní péče o známém nebo předpokládaném těhotenství [viz Použití u konkrétních populací ].
Správa
- Vynechané dávky: Pokud dojde k vynechání dávky, podejte ji co nejdříve. Pokud však má být použita další plánovaná dávka, neužívejte vynechanou dávku a vezměte si další dávku včas. Neužívejte dvě dávky najednou, abyste nahradili vynechanou dávku.
- PREVACID nebo PREVACID 30 mg SoluTab by se měl užívat před jídlem.
- Nedrťte ani nežvýkejte PREVACID 15mg tobolku nebo PREVACID SoluTab.
- Užijte PREVACID nebo PREVACID 30 mg SoluTab alespoň 30 minut před sukralfátem.
- Fenylketonurika: Obsahuje 2,5 mg fenylalaninu na 15 mg tablety PREVACID 30 mg SoluTab a 5,1 mg na tabletu PREVACID SoluTab 30 mg.
Kapsle PREVACID
- spolknout celé; nežvýkat.
- Pro pacienty, kteří mají potíže s polykáním tobolek:
- PREVACID 15mg kapsle lze otevřít a nasypat na jablečný protlak, pudink ENSURE, tvaroh, jogurt nebo pasírované hrušky
- PREVACID 15mg tobolky lze také vyprázdnit do malého objemu buď jablečné šťávy, pomerančové šťávy nebo rajčatové šťávy
- Alternativně mohou být tobolky PREVACID podávány s jablečným džusem pomocí nazogastrické sondy
- Popis všech pokynů k přípravě a podání naleznete v Návodu k použití
PREVACID SoluTab
- Nelámejte ani neřežte.
- Umístěte tabletu na jazyk; nechte ji rozpadnout, s vodou nebo bez ní, dokud částice nelze spolknout. Částice nežvýkejte.
- Tableta se typicky rozpadne za méně než jednu minutu.
- Alternativně lze dětem nebo jiným pacientům, kteří mají potíže s polykáním tablet, přípravek PREVACID 30 mg SoluTab podávat s vodou pomocí perorální stříkačky nebo NG trubice, jak je popsáno v návodu k použití.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Ve dvou, 24měsíčních studiích karcinogenity byly potkani Sprague-Dawley léčeni perorálními dávkami lansoprazolu 5 až 150 mg/kg/den, což je asi 1 až 40násobek expozice na povrchu těla (mg/m²) u osoby o hmotnosti 50 kg. průměrné výšky [1,46 m² tělesného povrchu (BSA)] při doporučené dávce pro člověka 30 mg/den. Lansoprazol vyvolal na dávce závislou žaludeční enterochromafínovou buněčnou hyperplazii (ECL) a karcinoidy ECL buněk u samců i samic potkanů. Také zvýšil výskyt střevní metaplazie žaludečního epitelu u obou pohlaví. U samců potkanů vyvolal lansoprazol na dávce závislý nárůst adenomů testikulárních intersticiálních buněk. Incidence těchto adenomů u potkanů dostávajících dávky 15 až 150 mg/kg/den (čtyřnásobek až 40násobek doporučené dávky pro člověka na základě BSA) překročila nízkou základní incidenci (rozmezí = 1,4 až 10 %) pro tento kmen potkanů.
Ve 24měsíční studii karcinogenity byly myši CD-1 léčeny perorálními dávkami lansoprazolu 15 až 600 mg/kg/den, což je dvojnásobek až 80násobek doporučené dávky pro člověka na základě BSA. Lansoprazol vyvolal na dávce závislý zvýšený výskyt hyperplazie ECL buněk žaludku. Způsobil také zvýšený výskyt jaterních nádorů (hepatocelulární adenom plus karcinom). Incidence nádorů u samců myší léčených 300 a 600 mg/kg/den (40 až 80násobek doporučené dávky pro člověka na základě BSA) a u samic myší léčených 150 až 600 mg/kg/den (20 až 80násobek doporučené dávky pro člověka dávka založená na BSA) překročila rozsahy výskytu pozadí v historických kontrolách pro tento kmen myší. Léčba lansoprazolem vyvolala adenom rete testis u samců myší, kteří dostávali 75 až 600 mg/kg/den (10 až 80násobek doporučené dávky pro člověka na základě BSA).
26týdenní studie karcinogenity transgenních myší p53 (+/-) nebyla pozitivní.
Lansoprazol byl pozitivní v Amesově testu a in vitro testu chromozomálních aberací lidských lymfocytů. Lansoprazol nebyl genotoxický v ex vivo testu neplánované syntézy DNA v potkaních hepatocytech (UDS), in vivo testu mikrojader u myší nebo testu chromozomálních aberací buněk kostní dřeně potkana.
Bylo zjištěno, že lansoprazol v perorálních dávkách až 150 mg/kg/den (40násobek doporučené dávky pro člověka na základě BSA) nemá žádný vliv na fertilitu a reprodukční schopnost samců a samic potkanů.
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
Dostupné údaje z publikovaných observačních studií celkově nenaznačují souvislost nežádoucích výsledků těhotenství s léčbou lansoprazolem (viz Data ).
V reprodukčních studiích na zvířatech vyvolalo perorální podávání lansoprazolu potkanům během organogeneze během laktace v 6,4násobku maximální doporučené dávky pro člověka snížení hmotnosti stehenní kosti, délky stehenní kosti, délky temeno-zašlé kosti a tloušťky růstové ploténky (pouze muži) v den po narození 21 (viz Data ). Tyto účinky byly spojeny se snížením tělesné hmotnosti. Informujte těhotné ženy o potenciálním riziku pro plod.
Odhadované základní riziko závažných vrozených vad a potratu pro uvedené populace není známo. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 až 4 % a 15 až 20 %.
Pokud je PREVACID 15 mg nebo PREVACID 15 mg SoluTab podáván s klarithromycinem, platí informace o těhotenství pro klarithromycin také pro kombinovaný režim. Další informace o použití v těhotenství naleznete v informacích o předepisování klarithromycinu.
Data
Lidská data
Dostupné údaje z publikovaných observačních studií neprokázaly souvislost nežádoucích výsledků souvisejících s těhotenstvím a užíváním lansoprazolu. Metodologická omezení těchto observačních studií nemohou s jistotou stanovit nebo vyloučit jakékoli riziko spojené s užíváním léků během těhotenství. V prospektivní studii Evropské sítě teratologických informačních služeb byly porovnány výsledky skupiny 62 těhotných žen, kterým byla podávána střední denní dávka 30 mg lansoprazolu, s kontrolní skupinou 868 těhotných žen, které neužívaly žádné PPI. Mezi ženami vystavenými PPI a kontrolní skupinou nebyl žádný rozdíl v míře závažných malformací, což odpovídalo relativnímu riziku (RR) = 1,04, [95% interval spolehlivosti (CI) 0,25-4,21]. V populační retrospektivní kohortové studii zahrnující všechny živě narozené děti v Dánsku od roku 1996 do roku 2008 nedošlo během analýzy expozice lansoprazolu v prvním trimestru u 794 živě narozených dětí k žádnému významnému nárůstu závažných vrozených vad. Metaanalýza, která porovnávala 1 530 těhotných žen vystavených PPI alespoň v prvním trimestru se 133 410 neexponovanými těhotnými ženami, neprokázala žádné významné zvýšení rizika vrozených malformací nebo spontánního potratu při expozici PPI (pro velké malformace Odds Ratio (OR) = 1,12 [95% CI 0,86-1,45] a pro spontánní potraty OR=1,29, [95% CI 0,841,97]).
Údaje o zvířatech
Ve studiích provedených na březích potkaních potkanech při perorálních dávkách lansoprazolu až do 150 mg/kg/den (40násobek doporučené dávky pro člověka [30 mg/den] na základě tělesného povrchu) podávaných během organogeneze a březích králíků při perorálních dávkách lansoprazolu až do 30 mg/kg/den (16násobek doporučené dávky pro člověka na základě tělesného povrchu) podávaných během organogeneze.
Studie prenatální a postnatální vývojové toxicity u potkanů s dalšími cílovými body pro hodnocení vývoje kostí byla provedena s lansoprazolem v perorálních dávkách 10 až 100 mg/kg/den (0,7 až 6,4násobek maximální doporučené dávky lansoprazolu u člověka 30 mg na základě AUC [plocha pod křivkou plazmatické koncentrace-čas]) podávané během organogeneze během laktace. Účinky na matku pozorované při dávce 100 mg/kg/den (6,4násobek maximální doporučené dávky 30 mg lansoprazolu pro člověka na základě AUC) zahrnovaly prodloužení období těhotenství, snížení přírůstku tělesné hmotnosti během těhotenství a snížení spotřeby potravy. Při této dávce se zvýšil počet mrtvě narozených dětí, což mohlo být sekundární k mateřské toxicitě. Tělesná hmotnost mláďat byla redukována na 100 mg/kg/den počínaje 11. postnatálním dnem. Hmotnost stehenní kosti, délka stehenní kosti a délka temeno-kosterní kosti byly sníženy na 100 mg/kg/den 21. den po narození. Hmotnost stehenní kosti byla stále snížena skupina 100 mg/kg/den ve věku 17 až 18 týdnů. Tloušťka růstové ploténky byla snížena u mužů s dávkou 100 mg/kg/den 21. den po narození a byla zvýšena u mužů s dávkami 30 a 100 mg/kg/den ve věku 17 až 18 týdnů. Účinky na parametry kostí byly spojeny se snížením přírůstku tělesné hmotnosti.
Laktace
Shrnutí rizik
Neexistují žádné informace týkající se přítomnosti lansoprazolu v mateřském mléce, účinků na kojené dítě nebo účinků na produkci mléka. Lansoprazol a jeho metabolity jsou však přítomny v mléce potkanů. Vývojové a zdravotní přínosy kojení by měly být zváženy spolu s klinickou potřebou matky užívat přípravek PREVACID 30 mg nebo PREVACID 30 mg SoluTab a jakékoli potenciální nežádoucí účinky přípravku PREVACID 30 mg nebo PREVACID SoluTab na kojené dítě nebo ze základního onemocnění matky.
Pediatrické použití
Bezpečnost a účinnost přípravku PREVACID 15 mg a PREVACID 30 mg SoluTab byla stanovena u pediatrických pacientů ve věku od jednoho roku do 17 let pro krátkodobou léčbu symptomatické GERD a erozivní ezofagitidy.
klinických studiích symptomatické GERD a erozivní ezofagitidy nebyl přípravek PREVACID 30 mg podáván déle než 12 týdnů u pacientů ve věku od jednoho roku do 11 let. Není známo, zda jsou PREVACID 30 mg a PREVACID SoluTab bezpečné a účinné, pokud jsou používány déle, než je doporučená doba. Nepřekračujte doporučenou dávku a délku užívání u pediatrických pacientů (viz Údaje o toxicitě pro mláďata zvířat ).
PREVACID nebyl účinný u pediatrických pacientů se symptomatickou GERD ve věku jeden měsíc až méně než jeden rok v multicentrické, dvojitě zaslepené, placebem kontrolované studii. Bezpečnost a účinnost proto nebyla stanovena u pacientů mladších jednoho roku. Neklinické studie na juvenilních potkanech prokázaly nežádoucí účinek ztluštění srdeční chlopně a kostních změn při dávkách lansoprazolu vyšších, než je maximální doporučená ekvivalentní dávka pro člověka.
Novorozenci do méně než jednoho roku věku
Farmakokinetika lansoprazolu byla studována u pediatrických pacientů s GERD ve věku méně než 28 dnů a od jednoho do 11 měsíců. Ve srovnání se zdravými dospělými, kteří dostávali 30 mg, měli novorozenci vyšší expozici (průměrné normalizované hodnoty AUC založené na hmotnosti 2,04 a 1,88krát vyšší při dávkách 0,5 a 1 mg/kg/den, v daném pořadí). Kojenci ve věku ≤ 10 týdnů měli hodnoty clearance a expozice podobné novorozencům. Kojenci starší 10 týdnů, kteří dostávali 1 mg/kg/den, měli průměrné hodnoty AUC podobné jako u dospělých, kteří dostávali dávku 30 mg.
Lansoprazol nebyl shledán jako účinný ve čtyřtýdenní multicentrické, dvojitě zaslepené, placebem kontrolované studii s paralelními skupinami v USA a Polsku u 162 pacientů ve věku od jednoho měsíce do méně než 12 měsíců se symptomatickou GERD na základě anamnézy pláče/rozčilení/podrážděnosti spojené s krmením, kteří nereagovali na konzervativní léčbu GERD (tj. nefarmakologickou intervenci) po dobu sedmi až 14 dnů. Pacienti obdrželi
lansoprazol ve formě suspenze denně (0,2 až 0,3 mg/kg/den u kojenců ve věku ≤ 10 týdnů nebo 1,0 až 1,5 mg/kg/den u kojenců starších 10 týdnů nebo placebo) po dobu až čtyř týdnů dvojitě zaslepené léčby.
Primární cílový bod účinnosti byl hodnocen na základě více než 50% snížení od výchozí hodnoty buď v procentu krmení s epizodou pláče/zmatku/podrážděnosti, nebo trváním (minuty) epizody pláče/rozčilení/podrážděnosti během jedné hodiny po krmení.
Mezi skupinou s pediatrickou suspenzí lansoprazolu a skupinou s placebem nebyl žádný rozdíl v procentu respondentů (54 % v obou skupinách).
V pediatrických klinických studiích nebyly hlášeny žádné nežádoucí účinky (ve věku od jednoho měsíce do méně než 12 měsíců), které nebyly dříve pozorovány u dospělých.
Na základě výsledků studie účinnosti fáze 3 se lansoprazol neprokázal jako účinný. Tyto výsledky proto nepodporují použití lansoprazolu při léčbě symptomatické GERD u kojenců.
Od jednoho roku do 11 let věku
V nekontrolované, otevřené, multicentrické studii v USA bylo 66 dětským pacientům (ve věku od jednoho roku do 11 let) s GERD přiděleno na základě tělesné hmotnosti, aby dostávali úvodní dávku buď PREVACID 15 mg denně, pokud ≤ 30 kg nebo PREVACID 30 mg denně, pokud je větší než 30 kg podáván po dobu 8 až 12 týdnů. Dávka přípravku PREVACID byla zvýšena (až na 30 mg dvakrát denně) u 24 z 66 pediatrických pacientů po dvou nebo více týdnech léčby, pokud zůstali symptomatickí. Na začátku mělo 85 % pacientů mírné až středně závažné celkové symptomy GERD (hodnoceno rozhovorem s vyšetřovatelem), 58 % mělo neerozivní GERD a 42 % mělo erozivní ezofagitidu (hodnoceno endoskopicky).
Po 8 až 12 týdnech léčby přípravkem PREVACID 15 mg prokázala analýza záměru k léčbě přibližně 50% snížení frekvence a závažnosti příznaků GERD.
21 z 27 pacientů s erozivní ezofagitidou bylo vyléčeno po osmi týdnech a 100 % pacientů bylo vyléčeno po 12 týdnech endoskopií (tabulka 4).
Ve studii 66 pediatrických pacientů ve věkové skupině jeden rok až 11 let po léčbě přípravkem PREVACID 15 mg podávaným perorálně v dávkách 15 mg denně až 30 mg dvakrát denně bylo zvýšení sérových hladin gastrinu podobné jako ve studiích u dospělých. Střední hladiny gastrinu v séru nalačno se zvýšily o 89 % z 51 pg/ml na začátku na 97 pg/ml [interkvartilní rozmezí (25. až 75. percentil) 71 až 130 pg/ml] při poslední návštěvě.
Pediatrická bezpečnost přípravku PREVACID 30 mg tobolky byla hodnocena u 66 dětských pacientů ve věku od 1 roku do 11 let. Z 66 pacientů s GERD 85 % (56/66) užívalo PREVACID 30 mg po dobu osmi týdnů a 15 % (10/66) jej užívalo po dobu 12 týdnů.
Nejčastěji hlášené (dva nebo více pacientů) nežádoucí účinky související s léčbou u pacientů ve věku 1 až 11 let (N=66) byly zácpa (5 %) a bolest hlavy (3 %).
Dvanáct let do 17 let věku
nekontrolované, otevřené, multicentrické studii v USA bylo 87 dospívajících pacientů (ve věku 12 až 17 let) se symptomatickou GERD léčeno přípravkem PREVACID po dobu 8 až 12 týdnů. Základní horní endoskopie klasifikovaly tyto pacienty do dvou skupin: 64 (74 %) neerozivní GERD a 23 (26 %) erozivní ezofagitida (EE). Pacienti s neerozivní GERD dostávali PREVACID 15 mg denně po dobu osmi týdnů a pacienti s EE dostávali PREVACID 30 mg denně po dobu osmi až 12 týdnů. Na začátku mělo 89 % těchto pacientů mírné až středně závažné celkové symptomy GERD (hodnoceno rozhovory s vyšetřovatelem). Během osmi týdnů léčby přípravkem PREVACID 15 mg došlo u dospívajících pacientů k 63% snížení frekvence a 69% snížení závažnosti příznaků GERD na základě výsledků z deníku.
Dvacet jedna z 22 (95,5 %) dospívajících pacientů s erozivní ezofagitidou bylo vyléčeno po osmi týdnech léčby přípravkem PREVACID 15 mg. Jeden pacient zůstal nezhojený po 12 týdnech léčby (tabulka 5).
těchto 87 dospívajících pacientů bylo zvýšení sérových hladin gastrinu podobné těm pozorovaným ve studiích u dospělých, medián sérových hladin gastrinu nalačno se zvýšil o 42 % z výchozích 45 pg/ml na 64 pg/ml [interkvartilní rozmezí (25. až 75. percentil) 44 až 88 pg/ml] při poslední návštěvě. (Normální hladiny gastrinu v séru jsou 25 až 111 pg/ml.)
Bezpečnost tobolek přípravku PREVACID byla hodnocena u těchto 87 dospívajících pacientů. Z 87 dospívajících pacientů s GERD užívalo 6 % (5/87) PREVACID 15 mg méně než šest týdnů, 93 % (81/87) šest až 10 týdnů a 1 % (1/87) déle než 10 týdnů .
Nejčastěji hlášenými (alespoň 3 %) nežádoucími účinky souvisejícími s léčbou u těchto pacientů byly bolest hlavy (7 %), bolest břicha (5 %), nauzea (3 %) a závratě (3 %). Závrať související s léčbou, která se v této informaci o předepisování přípravku vyskytuje u méně než 1 % dospělých pacientů, byla v této studii hlášena třemi dospívajícími pacienty s neerozivní GERD, kteří měli závratě souběžně s jinými reakcemi (jako je migréna, dušnost, a zvracení).
Údaje o toxicitě pro mláďata zvířat
Zesílení srdeční chlopně
Ve dvou studiích perorální toxicity došlo u mladých potkanů léčených lansoprazolem ke ztluštění mitrální srdeční chlopně. Ztluštění srdeční chlopně bylo pozorováno především při perorálním podávání zahájeném 7. den po narození (věkový ekvivalent u novorozenců) a 14. den (ekvivalent lidského věku přibližně jeden rok) při dávkách 250 mg/kg/den a vyšších (7. den po narození a postnatální den 14, respektive 6,2násobek a 4,2násobek denní pediatrické dávky 15 mg u pediatrických pacientů ve věku od 1 roku do 11 let s hmotností 30 kg nebo méně, na základě AUC). Délka léčby spojená se ztluštěním srdeční chlopně se pohybovala od 5 dnů do 8 týdnů. Zjištění se obrátila nebo směřovala k reverzibilitě po 4týdenním období zotavení bez léků. Výskyt ztluštění srdeční chlopně po zahájení dávkování 21. den po narození (ekvivalent lidského věku přibližně dva roky) byl omezen na jednoho potkana (1/24) ve skupinách, kterým byla podávána dávka 500 mg/kg/den po dobu 4 nebo 8 týdnů (přibližně 5,2násobek denní pediatrické dávky 15 mg u pediatrických pacientů ve věku 1 až 11 let s hmotností 30 kg nebo méně, na základě AUC). Na základě expozičních rozpětí se riziko poranění srdeční chlopně nezdá být relevantní pro pacienty ve věku jednoho roku a starší.
Změny kostí
V osmitýdenní studii orální toxicity u mladých potkanů s dávkováním zahájeným v postnatální den 7 byly dávky rovné nebo vyšší než 100 mg/kg/den (2,5násobek denní pediatrické dávky 15 mg u dětí ve věku od 1 do 11 let o hmotnosti 30 let kg nebo méně, na základě AUC) způsobil opožděný růst, přičemž zhoršení přírůstku hmotnosti bylo pozorováno již v postnatálním 10. dni (věk ekvivalentní novorozeneckým lidem). Na konci léčby příznaky zhoršeného růstu při dávce 100 mg/kg/den a vyšší zahrnovaly snížení tělesné hmotnosti (14 až 44 % ve srovnání s kontrolami), absolutní hmotnosti více orgánů, hmotnosti stehenní kosti, délky stehenní kosti a korunky. délka zadku. Tloušťka femorální růstové ploténky byla snížena pouze u mužů a pouze při dávce 500 mg/kg/den. Účinky související se zpožděným růstem přetrvávaly až do konce čtyřtýdenního období zotavení. Dlouhodobější údaje nebyly shromažďovány.
Geriatrické použití
celkového počtu pacientů (n=21 486) v klinických studiích přípravku PREVACID bylo 16 % pacientů ve věku 65 let a více, zatímco 4 % byla ve věku 75 let a více. Mezi těmito pacienty a mladšími pacienty nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti a další hlášené klinické zkušenosti nezjistily významné rozdíly v odpovědích mezi geriatrickými a mladšími pacienty, nelze však vyloučit větší citlivost některých starších jedinců [viz KLINICKÁ FARMAKOLOGIE ].

Poškození jater
U pacientů s různým stupněm chronického poškození jater byla expozice lansoprazolu zvýšena ve srovnání se zdravými jedinci s normální funkcí jater (viz KLINICKÁ FARMAKOLOGIE ]. U pacientů s mírnou (Child-Pugh třída A) nebo středně těžkou (Child-Pugh třída B) poruchou jater není nutná žádná úprava dávkování přípravku PREVACID nebo PREVACID SoluTab. Doporučená dávka je 15 mg perorálně denně u pacientů s těžkou poruchou funkce jater (Child-Pugh třída C) (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
PŘEDÁVKOVAT
Lansoprazol není odstraňován z oběhu hemodialýzou. Při jednom hlášeném předávkování pacient zkonzumoval 600 mg přípravku PREVACID 15 mg bez nežádoucích účinků. Perorální dávky lansoprazolu až do 5000 mg/kg u potkanů [přibližně 1300násobek 30mg dávky pro člověka na základě tělesného povrchu (BSA)] a u myší (přibližně 675,7násobek 30mg dávky pro člověka na základě BSA) nevedly k úmrtí nebo jakékoli klinické příznaky.
V případě nadměrné expozice by měla být léčba symptomatická a podpůrná.
Pokud dojde k nadměrné expozici, zavolejte do toxikologického centra na číslo 1-800-222-1222, kde získáte aktuální informace o zvládání otravy nebo nadměrné expozice.
KONTRAINDIKACE
- PREVACID 15 mg a PREVACID 15 mg SoluTab jsou kontraindikovány u pacientů se známou přecitlivělostí na kteroukoli složku přípravku. Hypersenzitivní reakce mohou zahrnovat anafylaxi, anafylaktický šok, angioedém, bronchospasmus, akutní tubulointersticiální nefritidu a kopřivku (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , NEŽÁDOUCÍ REAKCE ].
- Inhibitory protonové pumpy (PPI), včetně PREVACID a PREVACID SoluTab, jsou kontraindikovány s přípravky obsahujícími rilpivirin (viz DROGOVÉ INTERAKCE ].
- Informace o kontraindikacích antibakteriálních látek (klaritromycin a amoxicilin) indikovaných v kombinaci s přípravkem PREVACID nebo PREVACID 30 mg SoluTab naleznete v části Kontraindikace v informacích o jejich předepisování.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Lansoprazol patří do třídy antisekrečních sloučenin, substituovaných benzimidazolů, které potlačují sekreci žaludeční kyseliny specifickou inhibicí enzymového systému (H+, K+)-ATPázy na sekrečním povrchu parietálních buněk žaludku. Protože tento enzymový systém je považován za kyselou (protonovou) pumpu v parietální buňce, lansoprazol byl charakterizován jako inhibitor pumpy žaludeční kyseliny, protože blokuje poslední krok produkce kyseliny. Tento účinek je závislý na dávce a vede k inhibici jak bazální, tak stimulované sekrece žaludeční kyseliny bez ohledu na stimul. Lansoprazol nevykazuje anticholinergní nebo antagonistickou aktivitu histaminu typu 2.
Farmakodynamika
Antisekreční činnost
Po perorálním podání bylo prokázáno, že lansoprazol významně snižuje výdej bazální kyseliny a významně zvyšuje průměrné pH žaludku a procento času, kdy bylo pH žaludku vyšší než tři a vyšší než čtyři. Lansoprazol také významně snížil výdej žaludeční kyseliny stimulovaný jídlem a objem sekrece, stejně jako výdej kyseliny stimulovaný pentagastrinem. U pacientů s hypersekrecí kyseliny lansoprazol významně snižoval bazální a pentagastrinem stimulovanou sekreci žaludeční kyseliny. Lansoprazol inhiboval normální zvýšení objemu sekrece, kyselosti a výdeje kyseliny vyvolané inzulínem.
Výsledky intragastrického pH pětidenní farmakodynamické zkřížené studie s 15 a 30 mg lansoprazolu jednou denně jsou uvedeny v tabulce 6:
Po úvodní dávce v této studii bylo pozorováno zvýšené pH žaludku během jedné až dvou hodin u 30 mg lansoprazolu a dvou až tří hodin u 15 mg lansoprazolu. Po opakovaném denním podávání bylo pozorováno zvýšené pH žaludku během první hodiny po podání 30 mg lansoprazolu a během jedné až dvou hodin po podání 15 mg lansoprazolu.
Potlačení kyselosti může zvýšit účinek antimikrobiálních látek při eradikaci Helicobacter pylori (H. pylori). Procento času, kdy bylo pH žaludku zvýšeno nad pět a šest, bylo hodnoceno ve zkřížené studii s přípravkem PREVACID podávaným denně, dvakrát denně a třikrát denně (tabulka 7).
Inhibice sekrece žaludeční kyseliny měřená intragastrickým pH se postupně vrátila k normálu během dvou až čtyř dnů po více dávkách. Nebyly zjištěny žádné známky zpětné kyselosti žaludku.
Enterochromaffin-like (ECL) Cell Effects
Během celoživotní expozice lansoprazolu u potkanů v dávce až 150 mg/kg/den sedm dní v týdnu byla pozorována výrazná hypergastrinemie následovaná proliferací buněk ECL a tvorbou karcinoidních nádorů, zejména u samic potkanů. Vzorky žaludeční biopsie z těla žaludku od přibližně 150 pacientů léčených nepřetržitě lansoprazolem po dobu alespoň jednoho roku nevykazovaly známky ECL buněčných účinků podobných těm, které byly pozorovány ve studiích na potkanech. K vyloučení možnosti zvýšeného rizika rozvoje žaludečních nádorů u pacientů dlouhodobě léčených lansoprazolem jsou zapotřebí dlouhodobější údaje (viz Neklinická toxikologie ].
Jiné žaludeční účinky u lidí
Lansoprazol významně neovlivnil průtok krve sliznicí ve fundu žaludku. V důsledku normálního fyziologického účinku způsobeného inhibicí sekrece žaludeční kyseliny bylo pozorováno snížení průtoku krve v antru, pyloru a bulbu duodena asi o 17 %. Lansoprazol významně zpomalil žaludeční vyprazdňování stravitelných pevných látek. Lansoprazol zvyšoval hladiny pepsinogenu v séru a snižoval aktivitu pepsinu za bazálních podmínek a v reakci na stimulaci jídlem nebo injekci inzulínu. Stejně jako u jiných látek, které zvyšují intragastrické pH, bylo zvýšení pH žaludku spojeno se zvýšením bakterií redukujících dusičnany a zvýšením koncentrace dusitanů v žaludeční šťávě u pacientů se žaludečním vředem. Nebylo pozorováno žádné významné zvýšení koncentrací nitrosaminu.
Sérum Gastrin Effects
více než 2 100 pacientů se střední sérové hladiny gastrinu nalačno zvýšily o 50 až 100 % oproti výchozí hodnotě, ale po léčbě 15 až 60 mg perorálního lansoprazolu zůstaly v normálním rozmezí. Tato zvýšení dosáhla plató během dvou měsíců léčby a vrátila se na úroveň před léčbou do čtyř týdnů po ukončení léčby.
Zvýšený gastrin způsobuje hyperplazii buněk podobnou enterochromafínu a zvýšené hladiny CgA v séru. Zvýšené hladiny CgA mohou způsobit falešně pozitivní výsledky při diagnostických vyšetřeních neuroendokrinních nádorů [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Endokrinní účinky
Studie na lidech po dobu až jednoho roku nezjistily žádné klinicky významné účinky na endokrinní systém. Studované hormony zahrnují testosteron, luteinizační hormon (LH), folikuly stimulující hormon (FSH), globulin vázající pohlavní hormony (SHBG), dehydroepiandrosteron sulfát (DHEA-S), prolaktin, kortizol, estradiol, inzulín, aldosteron, parathormon, glukagon, stimulaci štítné žlázy hormon (TSH), trijodtyronin (T3), tyroxin (T4) a somatotropní hormon (STH). Lansoprazol v perorálních dávkách 15 až 60 mg po dobu až jednoho roku neměl žádný klinicky významný účinek na sexuální funkce. Navíc lansoprazol v perorálních dávkách 15 až 60 mg po dobu dvou až osmi týdnů neměl žádný klinicky významný účinek na funkci štítné žlázy. Ve 24měsíčních studiích karcinogenity u potkanů Sprague-Dawley s denními dávkami lansoprazolu až 150 mg/kg byly proliferativní změny v Leydigových buňkách varlat, včetně benigních novotvarů, ve srovnání s kontrolními potkany zvýšené.
Další efekty
lidí nebyly zjištěny žádné systémové účinky lansoprazolu na centrální nervový systém, lymfoidní, hematopoetický, renální, jaterní, kardiovaskulární nebo respirační systém. U 56 pacientů, kteří podstoupili rozsáhlá vstupní vyšetření očí, nebyla po léčbě lansoprazolem (až do 180 mg/den) po dobu až 58 měsíců pozorována žádná zraková toxicita. Po celoživotní expozici lansoprazolu u potkanů byla pozorována fokální atrofie slinivky břišní, difuzní lymfoidní hyperplazie v brzlíku a spontánní atrofie sítnice.
Farmakokinetika
Vstřebávání
PREVACID 15 mg a PREVACID SoluTab obsahují formu enterosolventních granulí lansoprazolu (protože lansoprazol je labilní v kyselém prostředí), takže absorpce lansoprazolu začíná až poté, co granule opustí žaludek. Průměrné maximální plazmatické hladiny lansoprazolu se objevují přibližně za 1,7 hodiny. Po jednorázovém podání 15 až 60 mg perorálního lansoprazolu byly maximální plazmatické koncentrace (Cmax) lansoprazolu a plocha pod křivkami plazmatické koncentrace (AUC) lansoprazolu přibližně úměrné podané dávce. Lansoprazol se nekumuluje a jeho farmakokinetika se při opakovaném podávání nemění. Absolutní biologická dostupnost je více než 80 %. U zdravých jedinců byl průměrný (±SD) plazmatický poločas 1,5 (±1,0) hodiny. Cmax i AUC se sníží o přibližně 50 až 70 %, pokud je lansoprazol podán 30 minut po jídle, ve srovnání se stavem nalačno. Pokud je lansoprazol podáván před jídlem, nedochází k žádnému významnému účinku jídla.
Rozdělení
Lansoprazol se z 97 % váže na plazmatické proteiny. Vazba na plazmatické proteiny je konstantní v rozmezí koncentrací 0,05 až 5 mcg/ml.
Odstranění
Metabolismus
Lansoprazol je rozsáhle metabolizován v játrech. V plazmě byly identifikovány dva metabolity v měřitelných množstvích (hydroxylované sulfinylové a sulfonové deriváty lansoprazolu). Tyto metabolity mají velmi malou nebo žádnou antisekreční aktivitu. Předpokládá se, že lansoprazol je transformován na dva aktivní druhy, které inhibují sekreci kyseliny blokováním protonové pumpy [(H+, K+)-ATPázový enzymový systém] na sekrečním povrchu parietálních buněk žaludku. Tyto dva aktivní druhy nejsou přítomny v systémovém oběhu. Plazmatický eliminační poločas lansoprazolu je méně než dvě hodiny, zatímco inhibiční účinek na kyselinu trvá déle než 24 hodin. Proto plazmatický eliminační poločas lansoprazolu neodráží dobu trvání potlačení sekrece žaludeční kyseliny.
Vylučování
Po jednorázovém perorálním podání přípravku PREVACID nebyl prakticky žádný nezměněný lansoprazol vylučován močí. V jedné studii byla po jednorázové perorální dávce 14Clansoprazolu přibližně jedna třetina podaného záření vyloučena močí a dvě třetiny byly nalezeny ve stolici. To znamená významné vylučování metabolitů lansoprazolu žlučí.
Specifické populace
Pediatričtí pacienti
Od jednoho do 17 let
Farmakokinetika lansoprazolu byla studována u pediatrických pacientů s GERD ve věku 1 až 11 let a 12 až 17 let ve dvou samostatných klinických studiích. U dětí ve věku od 1 roku do 11 let byl lansoprazol podáván v dávce 15 mg denně pro subjekty s hmotností ≤ 30 kg a 30 mg denně pro subjekty s hmotností vyšší než 30 kg. Průměrné hodnoty Cmax a AUC pozorované v den 5 dávkování byly podobné mezi dvěma dávkovými skupinami a nebyly ovlivněny hmotností nebo věkem v každé dávkové skupině s upravenou hmotností použité ve studii. U dospívajících jedinců ve věku 12 až 17 let byli jedinci randomizováni k podávání lansoprazolu v dávce 15 nebo 30 mg denně. Průměrné hodnoty Cmax a AUC lansoprazolu nebyly ovlivněny tělesnou hmotností nebo věkem; a téměř úměrné dávce zvýšení středních hodnot Cmax a AUC bylo pozorováno mezi dvěma dávkovými skupinami ve studii. Celkově byla farmakokinetika lansoprazolu u pediatrických pacientů ve věku od 1 roku do 17 let podobná jako u zdravých dospělých subjektů.
Geriatričtí pacienti
Clearance lansoprazolu je u starších pacientů snížena, s poločasem eliminace prodlouženým přibližně o 50 až 100 %. Protože průměrný poločas u starších pacientů zůstává mezi 1,9 až 2,9 hodinami, opakované podávání jednou denně nevede ke kumulaci lansoprazolu. Vrcholové plazmatické hladiny nebyly u starších osob zvýšeny [viz Použití u konkrétních populací ].
Mužské A ženské pacienty
Ve studii porovnávající 12 mužských a šesti ženských lidských subjektů, kteří dostávali lansoprazol, nebyly zjištěny žádné rozdíly ve farmakokinetice a výsledcích intragastrického pH v závislosti na pohlaví.
Rasové nebo etnické skupiny
Souhrnné průměrné farmakokinetické parametry přípravku PREVACID z dvanácti studií v USA (N=513) byly porovnány s průměrnými farmakokinetickými parametry ze dvou asijských studií (N=20). Průměrné hodnoty AUC přípravku PREVACID 30 mg u asijských subjektů byly přibližně dvojnásobné oproti hodnotám zjištěným v souhrnných údajích z USA; interindividuální variabilita však byla vysoká. Hodnoty Cmax byly srovnatelné.
Pacienti s poruchou ledvin
pacientů s těžkou poruchou funkce ledvin se vazba na plazmatické proteiny po podání 60 mg lansoprazolu snížila o 1 až 1,5 %. Pacienti s poruchou funkce ledvin měli zkrácený poločas eliminace a sníženou celkovou AUC (volná a vázaná). AUC volného lansoprazolu v plazmě však nesouvisela se stupněm poruchy funkce ledvin; a Cmax a Tmax (čas do dosažení maximální koncentrace) se nelišily od Cmax a Tmax u subjektů s normální funkcí ledvin. Farmakokinetika lansoprazolu se proto u pacientů s mírnou, středně těžkou nebo těžkou poruchou funkce ledvin klinicky nelišila ve srovnání se zdravými jedinci s normální funkcí ledvin.
Pacienti s poruchou funkce jater
pacientů s mírnou (Child-Pugh třída A) nebo středně těžkou (Child-Pugh třída B) poruchou funkce jater došlo po opakovaných perorálních dávkách 30 mg přípravku PREVACID 30 mg k přibližně 3násobnému zvýšení průměrné AUC ve srovnání se zdravými jedinci s normální funkcí jater na sedm dní. Odpovídající průměrný plazmatický poločas lansoprazolu byl prodloužen z 1,5 na čtyři hodiny (Child-Pugh A) nebo pět hodin (Child-Pugh B).
U pacientů s kompenzovanou a dekompenzovanou cirhózou došlo po jednorázové perorální dávce 30 mg PREVACIDu k přibližně 6násobnému a 5násobnému zvýšení AUC ve srovnání se zdravými jedinci s normální funkcí jater (viz DÁVKOVÁNÍ A PODÁVÁNÍ , Použití u konkrétních populací ].
Studie lékových interakcí
Vliv Lansoprazolu Na Jiné Léky
Interakce cytochromu P450
Lansoprazol je metabolizován prostřednictvím systému cytochromu P450, konkrétně prostřednictvím izoenzymů CYP3A a CYP2C19. Studie ukázaly, že PREVACID 15 mg nemá u zdravých jedinců klinicky významné interakce s jinými léky metabolizovanými systémem cytochromu P450, jako je warfarin, antipyrin, indometacin, ibuprofen, fenytoin, propranolol, prednison, diazepam nebo klarithromycin. Tyto sloučeniny jsou metabolizovány prostřednictvím různých izoenzymů cytochromu P450 včetně CYP1A2, CYP2C9, CYP2C19, CYP2D6 a CYP3A.
Theofylin
Když byl PREVACID 30 mg podáván současně s theofylinem (CYP1A2, CYP3A), bylo pozorováno mírné zvýšení (10 %) clearance theofylinu. Vzhledem k malé velikosti a směru účinku na clearance theofylinu je nepravděpodobné, že by tato interakce vyvolávala klinické obavy (viz DROGOVÉ INTERAKCE ].
Methotrexát a 7-hydroxymethotrexát
otevřené, jednoramenné, osmidenní, farmakokinetické studii s 28 dospělými pacienty s revmatoidní artritidou (kteří vyžadovali chronické užívání 7,5 až 15 mg methotrexátu podávaného týdně), sedmidenní podávání naproxenu 500 mg dvakrát denně a PREVACID 30 mg denně nemělo žádný vliv na farmakokinetiku methotrexátu a 7-hydroxymethotrexátu. I když tato studie nebyla navržena tak, aby hodnotila bezpečnost této kombinace léků, nebyly zaznamenány žádné závažné nežádoucí účinky. Tato studie však byla provedena s nízkými dávkami methotrexátu. Studie lékových interakcí s vysokými dávkami methotrexátu nebyla provedena [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Amoxicilin
Bylo také prokázáno, že PREVACID 30 mg nemá žádnou klinicky významnou interakci s amoxicilinem.
Sukralfát
Ve zkřížené studii s jednorázovou dávkou, která zkoumala PREVACID 30 mg podávaný samostatně a současně se sukralfátem 1 gram, byla absorpce lansoprazolu zpožděna a biologická dostupnost byla snížena o 17 %, pokud byl podáván současně se sukralfátem (viz DÁVKOVÁNÍ A PODÁVÁNÍ , DROGOVÉ INTERAKCE ].
Antacida
klinických studiích byla antacida podávána současně s přípravkem PREVACID 15 mg a nebyly prokázány žádné změny v účinnosti přípravku PREVACID.
clopidogrel
Klopidogrel je metabolizován na svůj aktivní metabolit částečně prostřednictvím CYP2C19. Byla provedena studie u zdravých jedinců, kteří byli extenzivními metabolizátory CYP2C19 a dostávali klopidogrel 75 mg jednou denně samostatně nebo současně s přípravkem PREVACID 30 mg (n=40) po dobu devíti dnů. Průměrná AUC aktivního metabolitu klopidogrelu byla snížena přibližně o 14 % (průměrný poměr AUC byl 86 %, s 90% CI 80 až 92 %), když byl přípravek PREVACID podáván současně, ve srovnání s podáváním samotného klopidogrelu.
Farmakodynamické parametry byly také měřeny a prokázaly, že změna v inhibici agregace krevních destiček (indukovaná 5 mcM ADP) souvisela se změnou expozice aktivnímu metabolitu klopidogrelu. Účinek na expozici aktivnímu metabolitu klopidogrelu a na klopidogrelem indukovanou inhibici krevních destiček se nepovažuje za klinicky významný.
Vliv jiných léků na Lansoprazol
Protože je lansoprazol metabolizován CYP2C19 a CYP3A4, induktory a inhibitory těchto enzymů mohou potenciálně změnit expozici lansoprazolu.
Mikrobiologie
Mikrobiologie
Lansoprazol, klarithromycin a/nebo amoxicilin se ukázaly jako účinné proti většině kmenů Helicobacter pylori in vitro a při klinických infekcích (viz INDIKACE A POUŽITÍ ].
Odolnost proti Helicobacter Pylori před ošetřením
Rezistence klarithromycinu před léčbou (≥2,0 mcg/ml) byla 9,5 % (91/960) podle E-testu a 11,3 % (12/106) při ředění agarem v klinických studiích s duální a trojitou terapií (M93-125, M93-130, M93131, M95-392 a M95-399).
Izoláty citlivé na amoxicilin (≤0,25 mcg/ml) se vyskytly u 97,8 % (936/957) a 98,0 % (98/100) pacientů v klinických studiích s duální a trojitou terapií pomocí E-testu a ředěním agaru, v daném pořadí. 21 z 957 pacientů (2,2 %) podle E-testu a dva ze 100 pacientů (2,0 %) podle ředění agaru mělo MIC před léčbou amoxicilinem vyšší než 0,25 mcg/ml. Jeden pacient ve 14denním režimu trojité terapie měl před léčbou nepotvrzenou minimální inhibiční koncentraci amoxicilinu (MIC) vyšší než 256 mcg/ml podle E-testu a pacient byl eradikován H. pylori (tabulka 8).
Pacienti, u kterých nedošlo k eradikaci H. pylori po trojité léčbě lansoprazolem/amoxicilinem/klaritromycinem, budou mít pravděpodobně H. pylori rezistentní na klarithromycin. Proto by u pacientů, u kterých selhala léčba, mělo být, pokud je to možné, provedeno testování citlivosti na klarithromycin. Pacienti s H. pylori rezistentními na klarithromycin by neměli být léčeni trojkombinací lansoprazol/amoxicilin/klaritromycin nebo režimy, které zahrnují klarithromycin jako jediné antimikrobiální činidlo.
Výsledky testu citlivosti na amoxicilin a klinické/bakteriologické výsledky
klinických studiích s duální a trojitou terapií bylo 82,6 % (195/236) pacientů, kteří měli před léčbou MIC citlivé na amoxicilin (≤0,25 mcg/ml), eradikováno H. pylori. Z těch, kteří měli před léčbou MIC amoxicilinu vyšší než 0,25 mcg/ml, u tří ze šesti byl H. pylori eradikován. Celkem u 30 % (21/70) pacientů selhala duální terapie lansoprazol 30 mg třikrát denně/amoxicilin 1 g třikrát denně a celkem 12,8 % (22/172) pacientů selhalo při 10 a 14denním triple terapeutické režimy. Výsledky citlivosti po léčbě nebyly získány u 11 pacientů, u kterých selhala terapie. Devět z 11 pacientů s MIC po léčbě amoxicilinem, u kterých selhal režim trojité terapie, mělo také izoláty H. pylori rezistentní na klarithromycin.
Test citlivosti na Helicobacter pylori
Informace o testování citlivosti na Helicobacter pylori viz Mikrobiologická sekce v informacích o předepisování claritromycinu a amoxicilinu .
Klinické studie
Duodenální vřed
americké multicentrické, dvojitě zaslepené, placebem kontrolované studii závislosti odpovědi na dávce (15, 30 a 60 mg přípravku PREVACID jednou denně) u 284 pacientů s endoskopicky dokumentovaným duodenálním vředem bylo procento pacientů vyléčených po dvou a čtyřech týdnech významně vyšší u všech dávek přípravku PREVACID než u placeba. U dvou vyšších dávek ve srovnání s přípravkem PREVACID 15 mg nebyl prokázán větší nebo dřívější účinek. Na základě této studie a druhé studie popsané níže je doporučená dávka přípravku PREVACID 15 mg u duodenálního vředu 15 mg denně (tabulka 9).
PREVACID 15 mg byl významně účinnější než placebo v úlevě od bolesti břicha během dne a v noci a ve snížení množství antacid užívaných za den.
Ve druhé multicentrické studii v USA, rovněž dvojitě zaslepené, placebem kontrolované, srovnání dávek (15 a 30 mg přípravku PREVACID 15 mg jednou denně) a včetně srovnání s ranitidinem u 280 pacientů s endoskopicky dokumentovaným duodenálním vředem, procento vyléčení pacientů po čtyřech týdnech bylo významně vyšší u obou dávek přípravku PREVACID 15 mg než u placeba. Nebyla prokázána větší nebo dřívější odpověď na vyšší dávku přípravku PREVACID. Ačkoli dávka 15 mg přípravku PREVACID byla po čtyřech týdnech lepší než ranitidin, nepřítomnost významného rozdílu po dvou týdnech a absence rozdílu mezi 30 mg přípravku PREVACID a ranitidin ponechává srovnávací účinnost těchto dvou látek neurčenou (tabulka 10) [ vidět INDIKACE A POUŽITÍ ].
Eradikace H. pylori ke snížení rizika recidivy duodenálního vředu
Randomizované, dvojitě zaslepené klinické studie provedené v USA u pacientů s H. pylori a duodenální vředovou chorobou (definovanou jako aktivní vřed nebo anamnéza vředu do jednoho roku) vyhodnotily účinnost přípravku PREVACID v kombinaci s amoxicilinem a klarithromycinem jako trojnásobek 14 denní terapie nebo v kombinaci s amoxicilinem jako duální 14denní terapie pro eradikaci H. pylori. Na základě výsledků těchto studií byla stanovena bezpečnost a účinnost dvou různých eradikačních režimů:
Trojitá terapie : PREVACID 30 mg dvakrát denně/amoxicilin 1 g dvakrát denně/klaritromycin 500 mg dvakrát denně
Duální terapie : PREVACID 30 mg třikrát denně/amoxicilin 1 g třikrát denně
Všechna ošetření trvala 14 dní. Eradikace H. pylori byla definována jako dva negativní testy (kultivace a histologie) po čtyřech až šesti týdnech po ukončení léčby.
Ukázalo se, že trojitá terapie je účinnější než všechny možné kombinace duální terapie. Ukázalo se, že duální terapie je účinnější než obě monoterapie. Bylo prokázáno, že eradikace H. pylori snižuje riziko recidivy duodenálního vředu.
Randomizovaná, dvojitě zaslepená klinická studie provedená v USA u pacientů s H. pylori a duodenální vředovou chorobou (definovanou jako aktivní vřed nebo anamnéza vředu do jednoho roku) porovnávala účinnost trojkombinace PREVACID po dobu 10 a 14 dnů. Tato studie prokázala, že 10denní trojitá terapie byla ekvivalentní 14denní trojité terapii při eradikaci H. pylori (tabulky 11 a 12) [viz INDIKACE A POUŽITÍ ].
Údržba zahojených duodenálních vředů
Bylo prokázáno, že PREVACID zabraňuje opětovnému výskytu dvanáctníkových vředů. U pacientů s endoskopicky potvrzeným zhojeným duodenálním vředem byly provedeny dvě nezávislé, dvojitě zaslepené, multicentrické kontrolované studie. Pacienti zůstali zhojeni významně déle a počet recidiv duodenálních vředů byl významně nižší u pacientů léčených přípravkem PREVACID 15 mg než u pacientů léčených placebem po dobu 12 měsíců (tabulka 13) [viz INDIKACE A POUŽITÍ ].
Ve studii č. 2 nebyl zaznamenán žádný významný rozdíl mezi přípravkem PREVACID 15 a 30 mg v udržení remise.
Žaludeční vřed
V americké multicentrické, dvojitě zaslepené, placebem kontrolované studii s 253 pacienty s endoskopicky dokumentovaným žaludečním vředem bylo procento pacientů vyléčených po čtyřech a osmi týdnech významně vyšší u přípravku PREVACID 15 a 30 mg jednou denně než u placeba (tabulka 14 ) [viz INDIKACE A POUŽITÍ ].
Pacienti léčení jakoukoli dávkou přípravku PREVACID hlásili významně menší denní a noční bolesti břicha spolu s méně dny užívání antacid a méně antacidních tablet užívaných denně než skupina s placebem.
Nezávislé zdůvodnění účinnosti přípravku PREVACID 30 mg poskytla metaanalýza publikovaných a nepublikovaných údajů.
Hojení žaludečního vředu spojeného s NSAID
Ve dvou amerických a kanadských multicentrických, dvojitě zaslepených, aktivně kontrolovaných studiích u pacientů s endoskopicky potvrzeným žaludečním vředem spojeným s NSAID, kteří pokračovali v užívání NSAID, bylo procento pacientů vyléčených po osmi týdnech statisticky významně vyšší při 30 mg přípravku PREVACID než při aktivní ovládání. Do studie bylo zařazeno celkem 711 pacientů a léčeno bylo 701 pacientů. Pacienti byli ve věku od 18 do 88 let (medián věku 59 let), přičemž 67 % pacientů bylo žen a 33 % pacientů mužů. Rasa byla rozdělena následovně: 87 % běloch, 8 % černoch, 5 % jiný. Nebyl žádný statisticky významný rozdíl mezi přípravkem PREVACID 30 mg denně a aktivní kontrolou při zmírnění symptomů (tj. bolesti břicha) (tabulka 15) [viz INDIKACE A POUŽITÍ ].
Snížení rizika žaludečního vředu spojeného s NSAID
jedné velké americké, multicentrické, dvojitě zaslepené, placebem a misoprostolem kontrolované studii (misoprostol zaslepený pouze endoskopistovi) u pacientů, kteří vyžadovali chronické užívání NSAID a kteří měli v anamnéze endoskopicky dokumentovaný žaludeční vřed, byl podíl pacientů, kteří zůstali bez žaludečních vředů po čtyřech, osmi a 12 týdnech, byla významně vyšší při 15 nebo 30 mg přípravku PREVACID 15 mg než u placeba. Do studie bylo zařazeno celkem 537 pacientů a léčeno bylo 535 pacientů. Pacienti byli ve věku od 23 do 89 let (medián věku 60 let), přičemž 65 % pacientů bylo žen a 35 % pacientů mužů. Rasa byla rozdělena následovně: 90 % kavkazská, 6 % černá, 4 % jiná. Dávka 30 mg přípravku PREVACID neprokázala žádný další přínos ve snížení rizika žaludečního vředu spojeného s NSAID než dávka 15 mg (viz tabulka 16) INDIKACE A POUŽITÍ ].
Symptomatická gastroezofageální refluxní choroba (GERD)
Symptomatická GERD
americké multicentrické, dvojitě zaslepené, placebem kontrolované studii s 214 pacienty s častými příznaky GERD, ale bez erozí jícnu při endoskopii, bylo pozorováno významně větší zmírnění pálení žáhy spojené s GERD při podávání lansoprazolu 15 mg jednou denně až do osmi týdne než u placeba. Nebyl pozorován žádný významný dodatečný přínos lansoprazolu 30 mg jednou denně.
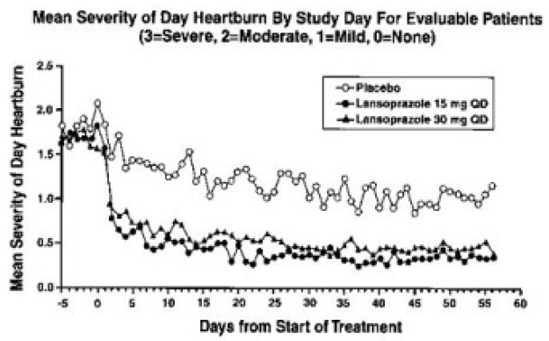
Analýzy zaměřené na léčbu prokázaly významné snížení frekvence a závažnosti denního a nočního pálení žáhy. Údaje o frekvenci a závažnosti pro období osmitýdenní léčby jsou uvedeny v tabulce 17 a na obrázcích 1 a 2:
Obrázek 1: Průměrná závažnost dne Pálení žáhy podle dne studie pro hodnotitelné pacienty (3=závažné, 2=střední, 1=mírné, 0=žádné)
Obrázek 2: Průměrná závažnost nočního pálení žáhy podle dne studie pro hodnotitelné pacienty (3=závažné, 2=střední, 1=mírné, 0=žádné)
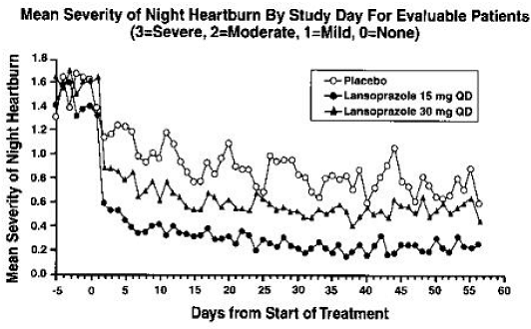
Ve dvou amerických, multicentrických dvojitě zaslepených, ranitidinem kontrolovaných studiích s celkem 925 pacienty s častými příznaky GERD, ale bez erozí jícnu při endoskopii, byl lansoprazol 15 mg lepší než ranitidin 150 mg (dvakrát denně) ve snížení frekvence a závažnosti dne a noční pálení žáhy spojené s GERD po dobu osmitýdenní léčby. Nebyl pozorován žádný významný další přínos lansoprazolu 30 mg jednou denně [viz INDIKACE A POUŽITÍ ].
Erozivní ezofagitida
V americké, multicentrické, dvojitě zaslepené, placebem kontrolované studii s 269 pacienty vstupujícími s endoskopickou diagnózou ezofagitidy se slizničním stupněm dva nebo více a stupněm tři a čtyři znamenající erozivní onemocnění jsou procenta pacientů se zhojením uvedena v tabulce 18:
této studii všechny skupiny s přípravkem PREVACID uváděly významně větší úlevu od pálení žáhy a menší denní a noční bolesti břicha spolu s méně dny užívání antacid a méně tablet antacid užívaných denně než skupina s placebem. Ačkoli všechny dávky byly účinné, dřívější vyléčení ve vyšších dvou dávkách naznačuje 30 mg denně jako doporučenou dávku.
PREVACID byl také srovnáván v americké multicentrické dvojitě zaslepené studii s nízkou dávkou ranitidinu u 242 pacientů s erozivní refluxní ezofagitidou. PREVACID v dávce 30 mg byl významně účinnější než ranitidin 150 mg dvakrát denně, jak je uvedeno níže (tabulka 19).
Navíc pacienti léčení přípravkem PREVACID 30 mg hlásili menší denní a noční pálení žáhy a užívali méně antacidových tablet po méně dní než pacienti užívající ranitidin 150 mg dvakrát denně.
Ačkoli tato studie prokazuje účinnost přípravku PREVACID 15 mg při hojení erozivní ezofagitidy, nepředstavuje adekvátní srovnání s ranitidinem, protože doporučená dávka ranitidinu pro ezofagitidu je 150 mg čtyřikrát denně, což je dvojnásobek dávky použité v této studii.
Ve dvou popsaných studiích a v několika menších studiích zahrnujících pacienty se středně těžkou až těžkou erozivní ezofagitidou přípravek PREVACID produkoval rychlosti hojení podobné těm, které jsou uvedeny výše.
americké multicentrické, dvojitě zaslepené, aktivně kontrolované studii bylo 30 mg přípravku PREVACID 30 mg srovnáváno s ranitidinem 150 mg dvakrát denně u 151 pacientů s erozivní refluxní ezofagitidou, která špatně reagovala na minimálně 12týdenní léčbu s min. jeden antagonista H2-receptoru podávaný v dávce indikované pro zmírnění symptomů nebo vyšší, jmenovitě cimetidin 800 mg/den, ranitidin 300 mg/den, famotidin 40 mg/den nebo nizatidin 300 mg/den. PREVACID 30 mg byl při hojení refluxní ezofagitidy účinnější než ranitidin 150 mg dvakrát denně a procento pacientů se zhojením bylo následující. Tato studie nepředstavuje srovnání účinnosti antagonistů histaminových H2-receptorů s přípravkem PREVACID 30 mg, protože všichni pacienti prokázali necitlivost na způsob léčby antagonistou histaminového H2-receptoru. Ukazuje to však, že PREVACID 30 mg může být užitečný u pacientů, u kterých selhává antagonista histaminového H2-receptoru (tabulka 20) [viz INDIKACE A POUŽITÍ ].
Udržování hojení Erozivní Ezofagitidy
pacientů s endoskopicky potvrzenou zhojenou ezofagitidou byly provedeny dvě nezávislé, dvojitě zaslepené, multicentrické kontrolované studie. Pacienti zůstali v remisi významně déle a počet recidiv erozivní ezofagitidy byl významně nižší u pacientů léčených přípravkem PREVACID 30 mg než u pacientů léčených placebem po dobu 12 měsíců (tabulka 21).
Bez ohledu na počáteční stupeň erozivní ezofagitidy byly PREVACID 15 a 30 mg podobné v udržení remise.
randomizované, dvojitě zaslepené studii v USA byl přípravek PREVACID 15 mg denně (n=100) srovnáván s ranitidinem 150 mg dvakrát denně (n=106) v doporučeném dávkování u pacientů s endoskopicky prokázanou zhojenou erozivní ezofagitidou během období 12 měsíců. Léčba přípravkem PREVACID 15 mg vedla k tomu, že pacienti zůstali zhojeni (léze 0. stupně) erozivní ezofagitidy po významně delší dobu než u pacientů léčených ranitidinem (p INDIKACE A POUŽITÍ ].
Patologické hypersekreční stavy včetně Zollinger-Ellisonova syndromu
otevřených studiích s 57 pacienty s patologickými stavy hypersekrece, jako je Zollingerův-Ellisonův syndrom (ZES) s mnohočetnými endokrinními adenomy nebo bez nich, přípravek PREVACID 15 mg významně inhiboval sekreci žaludeční kyseliny a kontroloval související příznaky průjmu, anorexie a bolesti. Dávky v rozmezí od 15 mg každý druhý den do 180 mg denně udržovaly bazální sekreci kyseliny pod 10 mEq/hod u pacientů bez předchozí operace žaludku a pod 5 mEq/hod u pacientů s předchozí operací žaludku.
Počáteční dávky byly titrovány podle individuální potřeby pacienta a u některých pacientů byly nutné úpravy s časem [viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Přípravek PREVACID byl při těchto vysokých dávkách po dlouhou dobu (u některých pacientů déle než čtyři roky) dobře snášen. U většiny pacientů se ZES nebyly sérové hladiny gastrinu přípravkem PREVACID modifikovány. U některých pacientů se však sérový gastrin zvýšil na hladiny vyšší, než byly hladiny přítomné před zahájením léčby lansoprazolem (viz INDIKACE A POUŽITÍ ].
INFORMACE PRO PACIENTA
PŘEDCHÁZET (prev-a-sid) (lansoprazol) tobolky s opožděným uvolňováním, pro perorální podání a
PREVACID SoluTab (prev-a-sid sol-u-tab) (lansoprazol) orálně se rozpadající tablety s opožděným uvolňováním
Jaké jsou nejdůležitější informace, které bych měl vědět o přípravku PREVACID a PREVACID 15 mg SoluTab?
Měli byste užívat PREVACID a PREVACID 15 mg SoluTab přesně podle předpisu, v nejnižší možné dávce a po co nejkratší potřebnou dobu.
PREVACID a PREVACID SoluTab mohou pomoci s příznaky souvisejícími s kyselinou, ale přesto můžete mít vážné žaludeční potíže.
Promluvte si se svým lékařem. PREVACID 30 mg a PREVACID 30 mg SoluTab mohou způsobit závažné nežádoucí účinky, včetně:
- Typ ledvinového problému (akutní tubulointersticiální nefritida). některých lidí, kteří užívají léky na bázi inhibitoru protonové pumpy (PPI), včetně PREVACID 30 mg a PREVACID 15 mg SoluTab, se může rozvinout problém s ledvinami nazývaný akutní tubulointersticiální nefritida, ke kterému může dojít kdykoli během léčby léky na PPI včetně PREVACID a PREVACID SoluTab. Okamžitě zavolejte svého lékaře, pokud se sníží množství moči nebo pokud máte krev v moči.
- Průjem způsobený infekcí (Clostridium difficile) ve střevech. Okamžitě zavolejte svého lékaře, pokud máte vodnatou stolici nebo bolesti žaludku, které neustupují. Můžete a nemusíte mít horečku.
- Zlomeniny kostí (kyčle, zápěstí nebo páteře). Zlomeniny kostí v kyčli, zápěstí nebo páteři se mohou objevit u lidí, kteří užívají více denních dávek léků PPI a po dlouhou dobu (rok nebo déle). Informujte svého lékaře, pokud máte zlomeninu kosti, zejména v kyčli, zápěstí nebo páteři.
- Některé typy lupus erythematodes. Lupus erythematodes je autoimunitní porucha (imunitní buňky těla napadají jiné buňky nebo orgány v těle). U některých lidí, kteří užívají léky na PPI, včetně přípravku PREVACID 15 mg a PREVACID 30 mg SoluTab, se mohou vyvinout určité typy lupus erythematodes nebo se u nich již lupus zhorší. Okamžitě zavolejte svého lékaře, pokud máte novou nebo zhoršující se bolest kloubů nebo vyrážku na tvářích nebo pažích, která se zhoršuje na slunci.
Poraďte se se svým lékařem o riziku těchto závažných nežádoucích účinků.
PREVACID 15 mg a PREVACID SoluTab mohou mít další závažné nežádoucí účinky. Vidět "Jaké jsou možné vedlejší účinky přípravku PREVACID a PREVACID SoluTab?".
Co jsou PREVACID a PREVACID 30 mg SoluTab?
Lék na předpis nazývaný inhibitor protonové pumpy (PPI), který se používá ke snížení množství kyseliny ve vašem žaludku.
U dospělých, PREVACID 15 mg a PREVACID SoluTab se používají k:
- 4 týdny pro hojení a zmírnění symptomů dvanáctníkových vředů.
- 10 až 14 dní s určitými antibiotiky k léčbě infekce způsobené bakterií zvanou H. pylori.
- udržení hojení duodenálních vředů. PREVACID 30 mg nebyl pro tento účel studován déle než 12 měsíců.
- až 8 týdnů pro hojení a zmírnění symptomů žaludečních vředů.
- až 8 týdnů pro hojení žaludečních vředů u lidí užívajících léky proti bolesti nazývané nesteroidní protizánětlivé léky (NSAID). PREVACID 30 mg nebyl pro tento účel studován déle než 8 týdnů.
- snížení rizika žaludečních vředů u lidí, u kterých existuje riziko vzniku žaludečních vředů při užívání NSAID. Přípravek PREVACID nebyl pro tento účel studován déle než 12 týdnů.
- až 8 týdnů k léčbě pálení žáhy a dalších příznaků, které se vyskytují při gastroezofageální refluxní chorobě (GERD). GERD nastává, když se kyselina ve vašem žaludku vrací zpět do trubice (jícnu), která spojuje ústa se žaludkem. To může způsobit pocit pálení na hrudi nebo v krku, kyselou chuť nebo říhání.
- až 8 týdnů pro hojení a zmírnění symptomů poškození sliznice jícnu souvisejícího s kyselinou (nazývané erozivní ezofagitida nebo EE). Váš lékař může předepsat dalších 8 až 16 týdnů přípravku PREVACID nebo PREVACID 15 mg SoluTab pacientům, u kterých se EE nezlepší nebo jejichž příznaky se vrátí.
- udržení hojení EE. Přípravek PREVACID nebyl pro tento účel studován déle než 12 měsíců.
- dlouhodobá léčba stavů, kdy váš žaludek tvoří příliš mnoho kyseliny. To zahrnuje vzácný stav nazývaný Zollinger-Ellisonův syndrom.
Děti: Podávejte PREVACID 30 mg a PREVACID 30 mg SoluTab přesně tak, jak Vám předepsal lékař Vašeho dítěte. Nezvyšujte dávku přípravku PREVACID a PREVACID SoluTab ani nepodávejte svému dítěti PREVACID 15 mg a PREVACID 15 mg SoluTab déle, než po dobu, kterou Vám předepsal lékař.
U dětí ve věku od 1 do 11 let PREVACID 15 mg a PREVACID 15 mg SoluTab se používají k:
- až 12 týdnů k léčbě pálení žáhy a dalších příznaků, které se mohou vyskytnout u GERD.
- až 12 týdnů pro vyléčení a zmírnění symptomů EE.
U dětí ve věku 12 až 17 let PREVACID a PREVACID SoluTab se používají pro:
- až 8 týdnů k léčbě pálení žáhy a dalších příznaků, které se mohou vyskytnout u GERD.
- až 8 týdnů pro vyléčení a zmírnění symptomů EE.
PREVACID 30 mg a PREVACID SoluTab se nedoporučují k léčbě příznaků GERD u dětí mladších 1 roku a mohou jim ublížit.
Neužívejte PREVACID nebo PREVACID 15 mg SoluTab, pokud:
- alergický na lansoprazol, jakýkoli jiný lék PPI nebo na kteroukoli složku přípravku PREVACID 15 mg nebo PREVACID 30 mg SoluTab. Úplný seznam složek v přípravcích PREVACID a PREVACID 30 mg SoluTab naleznete na konci tohoto Průvodce léčivými přípravky.
- užívání léku, který obsahuje rilpivirin (EDURANT, COMPLERA, ODEFSEY, JULUCA) používaný k léčbě HIV-1 (virus lidské imunodeficience).
Před užitím přípravku PREVACID 15 mg nebo PREVACID SoluTab informujte svého lékaře o všech svých zdravotních potížích, včetně toho, zda:
- máte nízké hladiny hořčíku, vápníku, draslíku nebo sodíku v krvi nebo užíváte diuretika.
- mít problémy s játry.
- mají fenylketonurii. PREVACID SoluTab obsahuje aspartam.
- jste těhotná, domníváte se, že byste mohla být těhotná, nebo těhotenství plánujete. PREVACID nebo PREVACID SoluTab může poškodit vaše nenarozené dítě. Poraďte se se svým lékařem o možných rizicích pro nenarozené dítě, pokud se PREVACID 30 mg nebo PREVACID 15 mg SoluTab užívá během těhotenství.
- kojíte nebo plánujete kojit. Není známo, zda PREVACID nebo PREVACID 30 mg SoluTab přechází do vašeho mateřského mléka. Pokud užíváte PREVACID nebo PREVACID SoluTab, poraďte se se svým lékařem o nejlepším způsobu krmení dítěte.
Informujte svého lékaře o všech lécích, které užíváte, včetně léků na předpis a volně prodejných léků, vitamínů a bylinných doplňků. Zvláště informujte svého lékaře, pokud užíváte methotrexát (OTREXUP, RASUVO, TREXALL, REDITREX, XATMEP).
Jak mám užívat PREVACID 15 mg a PREVACID 30 mg SoluTab?
- Užívejte PREVACID 30 mg nebo PREVACID SoluTab přesně podle pokynů svého lékaře.
- Bez porady se svým lékařem neměňte dávku ani nepřestávejte užívat PREVACID 30 mg nebo PREVACID SoluTab.
- Užívejte PREVACID 30 mg nebo PREVACID 15 mg SoluTab před jídlem.
PREVACID 15 mg tobolky:
-
- Tobolky PREVACID 30 mg polykejte celé.
- Tobolky PREVACID nedrťte ani nežvýkejte.
- Pokud máte potíže s polykáním celé tobolky, můžete tobolku otevřít a vzít obsah s určitými potravinami nebo šťávami. Pokyny, jak užívat tobolky PREVACID 30 mg s určitými jídly nebo šťávami, naleznete v části „Návod k použití“ na konci této Příručky k léčbě.
- Pokyny, jak míchat a podávat tobolky PREVACID 30 mg nazogastrickou sondou (NG sondou), naleznete v části „Návod k použití“ na konci této Příručky k léčbě.
PREVACID SoluTab:
-
- PREVACID 30 mg SoluTab je tableta, která se rozpouští v ústech s vodou nebo bez vody.
- Tablety nelámejte, neřežte, nedrťte ani nežvýkejte.
- Pokyny, jak míchat a podávat PREVACID SoluTab pomocí injekční stříkačky a NG zkumavky, naleznete v části „Návod k použití“ na konci této Příručky k léčbě.
- Pokud vynecháte dávku přípravku PREVACID nebo PREVACID 30 mg SoluTab, užijte ji, jakmile si vzpomenete. Pokud je téměř čas na další dávku, neužívejte vynechanou dávku. Užijte si další dávku v obvyklou dobu. Neužívejte 2 dávky současně.
- Pokud užijete příliš mnoho přípravku PREVACID nebo PREVACID 30 mg SoluTab, ihned zavolejte svého lékaře nebo své toxikologické centrum na číslo 1-800-222-1222 nebo jděte na pohotovost v nejbližší nemocnici.
Jaké jsou možné vedlejší účinky přípravku PREVACID a PREVACID SoluTab?
PREVACID a PREVACID SoluTab mohou způsobit závažné nežádoucí účinky, včetně:
- Vidět "Jaké jsou nejdůležitější informace, které bych měl vědět o přípravku PREVACID 30 mg a PREVACID SoluTab?".
- Nízká hladina vitaminu B12 těle se může objevit u lidí, kteří užívali PREVACID 30 mg nebo PREVACID SoluTab po dlouhou dobu (více než 3 roky). Informujte svého lékaře, pokud máte příznaky nízké hladiny vitaminu B12, včetně dušnosti, točení hlavy, nepravidelného srdečního tepu, svalové slabosti, bledé kůže, pocitu únavy, změn nálady a brnění nebo necitlivosti v pažích a nohou.
- Výrůstky žaludku (polypy fundické žlázy). Lidé, kteří užívají léky PPI po dlouhou dobu, mají zvýšené riziko vzniku určitého typu růstu žaludku nazývaného polypy fundických žláz, zejména po užívání léků PPI déle než 1 rok.
- Nízká hladina hořčíku v těle může nastat u lidí, kteří užívali PREVACID po dobu alespoň 3 měsíců. Okamžitě informujte svého lékaře, pokud máte příznaky nízké hladiny hořčíku, včetně záchvatů, závratí, nepravidelného srdečního tepu, nervozity, bolesti svalů nebo slabosti a křeče rukou, nohou nebo hlasu.
- Závažné kožní reakce. PREVACID 15 mg může způsobit vzácné, ale závažné kožní reakce, které mohou postihnout kteroukoli část vašeho těla. Tyto závažné kožní reakce mohou vyžadovat léčbu v nemocnici a mohou být život ohrožující:
- Kožní vyrážka, která může mít puchýře, olupování nebo krvácení na kterékoli části kůže (včetně rtů, očí, úst, nosu, genitálií, rukou nebo nohou).
- Můžete mít také horečku, zimnici, bolesti těla, dušnost nebo zvětšené lymfatické uzliny.
Přestaňte užívat přípravek PREVACID a ihned kontaktujte svého lékaře. Tyto příznaky mohou být prvním příznakem závažné kožní reakce.
Mezi nejčastější vedlejší účinky přípravku PREVACID a PREVACID SoluTab patří: průjem, bolest v oblasti žaludku (břicha), nevolnost a zácpa.
Toto nejsou všechny možné vedlejší účinky přípravku PREVACID 30 mg a PREVACID 30 mg SoluTab.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků.
Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
Jak mám uchovávat PREVACID a PREVACID 30 mg SoluTab?
Uchovávejte PREVACID při pokojové teplotě mezi 68 °F až 77 °F (20 °C až 25 °C).
Uchovávejte PREVACID 15 mg a PREVACID SoluTab a všechny léky mimo dosah dětí.
Obecné informace o bezpečném a účinném užívání přípravku PREVACID 15 mg a PREVACID SoluTab.
Léky jsou někdy předepisovány pro jiné účely, než které jsou uvedeny v Průvodci léky. Nepoužívejte PREVACID nebo PREVACID 30 mg SoluTab u stavů, pro které nebyl předepsán. Nedávejte PREVACID 30 mg nebo PREVACID SoluTab jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit. Můžete požádat svého lékaře nebo lékárníka o informace o přípravku PREVACID 30 mg a PREVACID 15 mg SoluTab, který je určen pro zdravotníky.
Jaké jsou složky přípravku PREVACID a PREVACID SoluTab?
Aktivní složka: lansoprazol.
Neaktivní složky v tobolkách PREVACID 30 mg: cukrové kuličky, sacharóza, kopolymer kyseliny methakrylové, nízko substituovaná hydroxypropylcelulóza, škrob, uhličitan hořečnatý, mastek, polyethylenglykol, oxid titaničitý, polysorbát 80, hydroxypropylcelulóza, koloidní oxid křemičitý, D&C Red No. 28, FD&C Blue No. 1 a FD&C Red č. 40.
Pouze PREVACID 15 mg tobolky: FD&C Green č. 3.
Neaktivní složky přípravku PREVACID 15 mg SoluTab: mannitol, kyselina methakrylová, hydroxypropylcelulóza, monohydrát laktózy-mikrokrystalická celulosa, triethylcitrát, krospovidon, polyakrylát, uhličitan hořečnatý, aspartam, glycerylmonostearát, hypromelóza, magnesium-stearát, kyselina citronová, oxid titaničitý, mastek, etylenglykol jahodové aroma polysorbát 80 a oxid železitý.
PREVACID SoluTab obsahuje 2,5 mg fenylalaninu v každé 15mg tabletě a 5,1 mg fenylalaninu v každé 30mg tabletě.
NÁVOD K POUŽITÍ
PŘEDCHÁZET (prev-a-sid) (lansoprazol) tobolky s opožděným uvolňováním, pro perorální podání a
PREVACID SoluTab (prev-a-sid sol-u-tab) (lansoprazol) orálně se rozpadající tablety s opožděným uvolňováním
Důležité:
- Užívejte PREVACID 15 mg nebo PREVACID 15 mg SoluTab před jídlem.
- Nedrťte ani nežvýkejte PREVACID 15 mg tobolky nebo PREVACID 30 mg SoluTab.
- PREVACID nebo PREVACID 15 mg SoluTab by se měl používat pouze s níže uvedenými potravinami a šťávami.
PREVACID tobolky s opožděným uvolňováním (PREVACID 30 mg tobolky)
Užívání PREVACID 15 mg tobolky s určitými potravinami:
Můžete použít pouze jablečný protlak, pudink ENSURE, tvaroh, jogurt nebo pasírované hrušky.
Užívání tobolek PREVACID s určitými šťávami:
Můžete použít pouze jablečný džus, pomerančový džus nebo rajčatový džus.
Podání tobolek PREVACID nazogastrickou sondou (NG sonda) velikosti 16 French nebo větší:
Můžete použít pouze jablečný džus.
PREVACID 15 mg SoluTab tablety se zpožděným uvolňováním v ústech (PREVACID SoluTab)
Pacientům, kteří mají potíže s polykáním tablet, lze PREVACID SoluTab podávat následovně:
Podání přípravku PREVACID SoluTab s vodou pomocí perorální stříkačky:
Podání přípravku PREVACID 15 mg SoluTab s vodou pomocí nazogastrické sondy (NG sonda) velikosti 8 French nebo větší:
Jak mám uchovávat PREVACID a PREVACID 30 mg SoluTab?
- Uchovávejte tobolky PREVACID a PREVACID 15 mg SoluTab při pokojové teplotě mezi 68 °F až 77 °F (20 °C až 25 °C).
Uchovávejte PREVACID a PREVACID 30 mg SoluTab a všechny léky mimo dosah dětí.
Tento návod k použití byl schválen US Food and Drug Administration.
